Микробиология, 2020, T. 89, № 1, стр. 34-41
Выделение продуктов фотосинтеза аноксигенными фототрофными бактериями
Р. Н. Ивановский a, *, Н. В. Лебедева a, О. И. Кеппен a, А. В. Чудновская a
a Кафедра микробиологии биологического факультета МГУ им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: mguru@mail.ru
Поступила в редакцию 15.04.2019
После доработки 03.07.2019
Принята к публикации 29.09.2019
Аннотация
В процессе фотосинтеза аноксигенные фототрофные бактерии, относящиеся к разным таксономическим группам и различающиеся по физиологии и механизму автотрофной фиксации СО2, выделяют в среду растворимые органические соединения (РОС) в количестве от 5 до 20% от включенного в состав клеток неорганического углерода. Зеленая серная бактерия Chlorobaculum limnaeum выделяет в среду около 10% углерода, ассимилированного в процессе автотрофной фиксации СО2. Выделение РОС у Cba. limnaeum является прижизненным процессом, поскольку оно прекращается в темноте и блокируется фторацетатом – ингибитором фиксации СО2 в восстановительном цикле трикарбоновых кислот, через который эта бактерия осуществляет ассимиляцию углекислоты. Выделение РОС увеличивается до 30 и 60% при наличии в среде ацетата или пирувата соответственно. Отсутствие азота в среде стимулирует выделение РОС Cba. limnaeum до 60% от ассимилированного СО2. При добавлении в этих условиях ацетата выделение РОС возрастает до 120%. Полученные данные свидетельствуют о том, что при наличии света в анаэробных водных экосистемах аноксигенные фототрофы могут функционировать в качестве генераторов первичной продукции.
Фотосинтезирующие микроорганизмы – водоросли, цианобактерии и фототрофные бактерии – являются продуцентами первичной продукции водных экосистем. Основным продуцентом первичной продукции в морских экосистемах является фитопланктон, состоящий из оксигенных фототрофов – водорослей и цианобактерий, обитающих в аэробной фотической зоне. Часть ассимилированного ими в процессе фотоавтотрофной ассимиляции СО2 выделяется среду в виде растворимых органических субстратов (РОС), используемых далее хемоорганотрофными членами экосистемы. В состав РОС, выделяемых фитопланктоном, может входить широкий круг органических соединений: углеводы (моносахариды, олигосахариды, полисахариды), липиды (жирные кислоты), азотсодержащие соединения (аминокислоты, полипептиды, белки), органические кислоты (гликолат, субстраты цикла трикарбоновых кислот, витамины) и ряд других соединений, в частности, цианотоксины (Thornton, 2014; Repeta, 2015). Чистые культуры морских водорослей и цианобактерий выделяют в среду в виде РОС примерно 10% от ассимилированного ими СО2 (Carlson, 2002; Urbani et al., 2005). Исследованию биогеохимических циклов синтеза и минерализации углерода в морских экосистемах посвящено значительное количество работ, суммированных в ряде обзорных статей (Carlson, 2002; Nelson, Siegel, 2013; Thornton, 2014; Carlson, Hansell, 2015; Livanou et al., 2017). Аноксигенные фототрофы бактериопланктона в фотической зоне морских экосистем представлены аэробными аноксигенными бактериями семейства Erythrobacteraceae. Однако они являются фотоорганотрофами и не участвуют в создании первичной продукции (Ferrera et al., 2011; Thiel et al., 2018). Аноксигенные фототрофные бактерии не участвуют в создании первичной продукции в аэробной фотической зоне морских местообитаний, поскольку пурпурные серные бактерии и зеленые серные бактерии являются анаэробами, а у пурпурных несерных бактерий синтез фотохимического аппарата (Madigan, Jung, 2008; Bauer et al., 2009) и ферментов цикла Кальвина (Romagnoli, Tabita, 2009) репрессируется кислородом.
Типичными местообитаниями для зеленых серных бактерий (ЗСБ) и пурпурных серных и несерных бактерий являются цианобактериальные маты, толща воды на границе или ниже хемоклина, разделяющего аэробную и анаэробную зоны стратифицированных водоемов, а также в донных осадках, для которых показана положительная корреляция между численностью пурпурных серных бактерий, выделяемых ими РОС и численностью гетеротрофного бактериопланктона (Overmann et al., 1996; Overmann, Garcia-Pichel, 2013). В этих местах обитания они являются основными продуцентами первичной продукции.
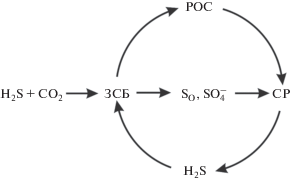
Chlorobaculum limnaeum, как типичный представитель зеленых серных бактерий, является облигатным фототрофом и анаэробом. Фиксация СО2, как и у других представителей ЗСБ, осуществляется им через восстановительный цикл трикарбоновых кислот (вЦТК) (Evans et al., 1966; Ivanovsky et al., 1980). Будучи водными организмами, ЗСБ часто обнаруживаются на границе анаэробной зоны стратифицированных водоемов, донных осадков и в составе цианобактериальных матов. Известно также, что ЗСБ образуют ассоциации с серо- и сульфатредукторами (СР) (Biebl, Pfennig, 1978). Продукты, образуемые ЗСБ в результате автотрофной фиксации СО2 и выделяемые в среду, используются СР для синтеза биомассы, восстановления молекулярной серы или сульфатов до сульфида (рис. 1). Таким образом, они включаются в замкнутую трофическую цепь фототроф-продуцент → хемотроф-потребитель.
Рис. 1.
Взаимоотношения зеленых серных бактерий (ЗСБ) и сульфатредукторов (СР) в природных экосистемах.
Целью данной работы было исследование способности выделять РОС аноксигенными фототрофными бактериями, относящимися к различным таксономическим группам, и регуляции этого процесса у зеленой серной бактерии Cba. limnaeum.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Бактерии и условия культивирования. Объектами исследования были аноксигенные фототрофные бактерии из коллекции культур кафедры микробиологии МГУ им. М.В. Ломоносова, относящиеся к разным таксономическим группам и различающиеся по физиологии и механизму автотрофной фиксации СО2: Rhodospirillum rubrum МГУ 301, Rhodobacter sphaeroides МГУ 323, Rhodopseudomonas palustris МГУ 286, Ectothiorhodospira shaposhnikovii МГУ 313, Thiocapsa roseopersicina МГУ 317, Clorobaculum limnaeum МГУ 319, Chloroflexus aurantiacus OK-70-fl, Ocscillochloris trichoides DG-6 (табл. 1). Бактерии культивировали в герметически закрытых стеклянных флаконах на 500 мл с в люминостате (2000 лк) при 28°С в фотоавтотрофных условиях с добавлением Na2S · 9H2O (1 г/л) или Н2 в качестве донора электронов и NaHCO3 (2 г/л) в качестве источника углерода. Cba. limnaeum выращивали на среде Ларсена (Larsen, 1952), пурпурные несерные бактерии выращивали на среде Ормерода (Ormerod et al., 1961). Tca. roseopersicina BBS выращивали на среде Пфеннига (Pfennig, Biebl, 1976), Ect. shaposhnikovii на среде Ларсена (Larsen, 1952), Cfl. aurantiacus OK-70-fl на среде (Castenbolz, Pierson, 1981), Osc. trichoides DG-6 на модифицированной среде DGN (Keppen et al., 1994).
Таблица 1.
Исследуемые аноксигенные фототрофные бактерии
| Бактерии | Филогенетическая группа | Основные характеристики |
|---|---|---|
| Rhodospirillum rubrum МГУ 301 | Alphaproteobacteria Несерные пурпурные бактерии |
Рост преимущественно фотогетеротрофный с использованием органических соединений в качестве источника углерода и электронов. Способны расти фотоавтотрофно, используя Н2 как донор электронов. Фиксация СО2 осуществляется через цикл Кальвина |
| Rhodobacter sphaeroides МГУ 323 | Alphaproteobacteria Несерные пурпурные бактерии |
Рост преимущественно фотогетеротрофный с использованием органических соединений в качестве источника углерода и электронов. Способны расти фотоавтотрофно, используя Н2 как донор электронов. Фиксация СО2 осуществляется через цикл Кальвина |
| Rhodopseudomonas palustris МГУ 286 | Alphaproteobacteria Несерные пурпурные бактерии |
Рост преимущественно фотогетеротрофный с использованием органических соединений в качестве источника углерода и электронов. Способны расти фотоавтотрофно, используя Н2 как донор электронов. Фиксация СО2 осуществляется через цикл Кальвина |
| Ectothiorhodospira shaposhnikovii МГУ 313 | Gammaproteobacteria Пурпурные серные бактерии |
Рост преимущественно фотогетеротрофный с использованием органических соединений в качестве источника углерода и электронов. Способны расти фотоавтотрофно, используя сульфид, тиосульфат и Н2 как донор электронов. Фиксация СО2 осуществляется через цикл Кальвина |
| Thiocapsa roseopersicina МГУ 317 | Gammaproteobacteria Пурпурные серные бактерии |
Фотоавтотроф. Растет, используя сульфид, тиосульфат, молекулярную серу и Н2 в качестве донора электронов. В темноте способен расти как хемолитоавтотроф, используя сульфид, тиосульфат, молекулярную серу как донор электронов. Фиксация СО2 осуществляется через цикл Кальвина |
| Clorobacullum limnaeum МГУ 319 | Chlorobi Зеленые серные бактерии |
Фотоавтотроф. Растет, используя сульфид, тиосульфат, молекулярную серу и Н2 в качестве донора электронов. Фиксация СО2 осуществляется через вЦТК |
| Chloroflexus aurantiacus OK‑70‑fl | Chloroflexi Аноксигенные нитчатые фототрофные бактерии |
Рост преимущественно фотогетеротрофный с использованием органических соединений в качестве источника углерода и электронов. Способны расти фотоавтотрофно, используя Н2 как донор электронов. Фиксация СО2 осуществляется через 3-гидроксипропионатный цикл |
| Ocscillochloris trichoides DG-6 МГУ 327 | Chloroflexi Аноксигенные нитчатые фототрофные бактерии (АНФБ) |
Фотоавтотроф. Растет, используя сульфид и Н2 в качестве донора электронов. Фиксация СО2 осуществляется через цикл Кальвина |
Ассимиляция бикарбоната и выделение продуктов его ассимиляции в среду. Для постановки опытов по фиксации меченого бикарбоната и выделению продуктов фотосинтеза в среду использовали культуры бактерий, находящиеся в экспоненциальной фазе роста (1‒2 сут). Клетки отделяли центрифугированием (8000 g, 30 мин), промывали фосфатным буфером 0.01 М (рH 7), ресуспендировали в среде культивирования до плотности 1‒2 мг белка/мл с добавлением Na2S · 9H2O (5 мM) или Н2 в качестве донора электронов. Эксперименты по ассимиляции NaH14-CO3 суспензиями клеток проводили в стеклянных медицинских шприцах (10 мл) на свету (2000 лк). Органические субстраты добавляли в концентрации 1 г/л. Реакцию начинали добавлением NaH14CO3 (1 мМ, 0.04 Мбк), а затем, через определенные промежутки времени, отбирали пробы клеточной суспензии (1.0 мл). Клеточную суспензию фильтровали через нитроцеллюлозные фильтры (0.45 мкм). 1 мл фильтрата, содержащего выделяемые в среду нелетучие продукты ассимиляции меченого бикарбоната, разливали в ячейки плашки (Falcon 24-Well Flat-Bottom Plate), куда для удаления не ассимилировавшегося NaH14CO3 добавляли 50 мкл 1 н НСl до конечного рН 3.0. Количество меченого углерода на фильтре рассматривали как ассимилированный клетками, а в составе фильтрата ‒ как выделенные в среду продукты фиксации СО2 (РОС). Соотношение выделившегося РОС к количеству СО2, включенному в состав клеток, обозначали как коэффициент К $\left( {К = \frac{{{\text{РОС}}}}{{{\text{ассимилированный}}\,\,{\text{C}}{{{\text{O}}}_{{\text{2}}}}}} \times 100} \right)\% .$ Содержание метки в фильтрах и фильтрате определяли на сцинтилляционном счетчике LKB RacBeta модель 1127.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выделение продуктов фотосинтеза аноксигенными фототрофными бактериями. Все исследованные бактерии, независимо от их таксономического положения (Alphaproteobacteria, Gammaproteobacteria, Chlorobi, Chloroflexi), механизма автотрофной фиксации СО2 (цикл Кальвина, вЦТК, 3-гидроксипропионатный цикл) и физиологических особенностей бактерий (фотогетеротрофы и строгие фотоавтотрофы), в процессе фотосинтеза выделяли в среду 5‒20% от фиксированного СО2 в виде растворимого органического вещества (табл. 1 и 2).
Таблица 2.
Фиксация СО2 и выделение РОС суспензией клеток фототрофных бактерий (нмоль мг белка–1 мин–1)
| Бактерии | Фиксация СО2 | Выделение РОС | К, % |
|---|---|---|---|
| Rba. sphaeroides | 22.3 | 1.4 | 6.4 |
| Rps. palustris | 34.8 | 5.5 | 15.8 |
| Rsp. rubrum | 50.5 | 5.4 | 10.7 |
| Ect. shaposhnikovii | 83.0 | 16.6 | 20.0 |
| Tca. roseopersicina | 23.4 | 1.5 | 6.4 |
| Cba. limnaeum | 61.8 | 6.0 | 9.7 |
| Cfl. aurantiacus | 14.2 | 3.8 | 27.0 |
| Osc. trichoides | 7.0 | 1.6 | 23.1 |
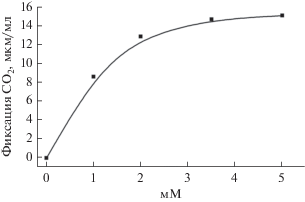
Выделение продуктов фотосинтеза Cba. limnaeum. В процессе автотрофной ассимиляции СО2 в среду выделялись РОС в количестве 8‒10% от ассимилированного СО2 (табл. 2). РОС являются продуктами автотрофной фиксации СО2, поскольку в темноте их выделение в среду останавливается (рис. 2) и полностью блокируется (рис. 3) при добавлении фторацетата – эффективного ингибитора аконитазной реакции в восстановительном цикле трикарбоновых кислот, через который осуществляется автотрофная ассимиляция у ЗСБ (Evans et al., 1966; Buchanan, Arnon, 1990; Tang, Blankenship, 2010). Скорость фиксации СО2Cba. limnaeum зависит от его концентрации в среде. Эта зависимость определяется константами Михаэлиса для карбоксилаз, участвующих в фотоавтотрофной ассимиляции СО2. В свою очередь, количество доступного неорганического углерода (СО2/NaHCO3) в среде, возможно, оказывает влияние на уровень выделения продуктов. Можно предположить, что при лимитирующих (ниже величины Км) концентрациях неорганического углерода в среде, весь ассимилированный СО2 в основном будет расходоваться на биосинтетические потребности клеток. Вследствие этого может происходить торможение или полное прекращение выделения клетками продуктов фотосинтеза. Скорость фиксации СО2 клетками Cba. limnaeum увеличивается с увеличением начальной концентрации бикарбоната в среде с Км ≈ 1 мМ (рис. 4). Однако при увеличении концентрации бикарбоната в среде до величины, обеспечивающей максимальную скорость фотоассимиляции СО2, уровень выделения в среду продуктов фотосинтеза оставался постоянным и составлял около 10%. Это свидетельствует о том, что при росте Cba. limnaeum в фотоавтотрофных условиях всегда присутствует постоянный уровень выделения РОС, не зависящий от концентрации СО2/NaHCO3 в среде.
Рис. 2.
Фиксация СО2 (а) и выделение РОС (б) клетками Cba. limnaeum на свету и в темноте. Контроль (1); свет выключен (стрелка вниз) после 2-часовой инкубации (2).
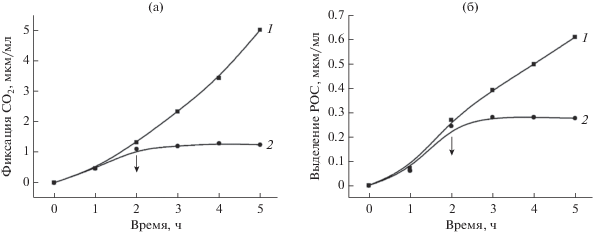
Рис. 3.
Ингибирование фторацетатом выделения РОС в процессе фотоавтотрофной ассимиляции СО2 клетками Cba. limnaeum. Контроль (1); +фторацетат 1 × 10–3 (2).
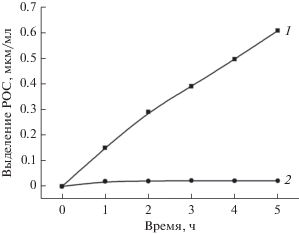
Рис. 4.
Зависимость скорости ассимиляции СО2 клетками Cba. limnaeum от концентрации бикарбоната в среде.
Зависимость скорости ассимиляции СО2 и выделения в среду РОС от наличия в среде дополнительных органических субстратов. Ацетат, являясь промежуточным продуктом автотрофной ассимиляции СО2 через вЦТК, в тоже время является конечным продуктом деградации сложных органических субстратов в цианобактериальных матах, и в тех или иных концентрациях, по-видимому, может присутствовать в экосистемах обитания ЗСБ. Наличие ацетата в среде культивирования примерно в два раза увеличивает выход биомассы, но заметно (на 20‒40%) снижает скорость фотоассимиляции СО2 (табл. 3). Однако, при этом наблюдается значительное (до 30%) увеличение выделения продуктов фотоассимиляции СО2 (табл. 4).
Таблица 3.
Рост и фиксация [14C]бикарбоната Cba. limnaeum на минеральной и среде с ацетатом
| Рост (оптическая плотность при 650 нм) | |
|---|---|
| Состав среды культивирования | Рост |
| СО2 + Na2S | 0.9 |
| СО2 + ацетат + Na2S | 1.3 |
| Ассимиляция [14C]бикарбоната (нмоль мг белка–1 мин–1) | |
| Состав среды в опыте | Фиксация СО2 |
| Na2S + СО2 | 58.6 |
| СО2 + Na2S + ацетат | 39.7 |
Таблица 4.
Ассимиляция СО2 и выделение продуктов фотосинтеза клетками культуры Cba. limnaeum на среде с различными органическими субстратами
| Состав среды в опыте | Потребление СО2, нмоль мг белка–1 мин–1 |
К, % |
|---|---|---|
| СО2 + сульфид | 65.6 | 8.1 |
| СО2 + сульфид + ацетат | 44.9 | 31.7 |
| СО2 + сульфид + пируват | 44.5 | 60.4 |
| СО2 + сульфид + аланин | 85.8 | 8.5 |
| СО2 + сульфид + 2-оксоглутарат | 128.6 | 5.5 |
| СО2 + сульфид + аспартат | 74.4 | 6.6 |
По-видимому, ацетат, включающийся в конструктивный метаболизм Cba. limnaeum в качестве готового строительного блока, позволяет снизить энергетические затраты на фотоассимиляцию СО2, что делает возможным увеличение выделения в среду продуктов фотосинтеза без потери темпов роста и выхода биомассы Cba. limnaeum. Пируват, также как и ацетат, является промежуточным продуктом автотрофной ассимиляции СО2 в вЦТК, и его присутствие в среде при автотрофной ассимиляции меченого бикарбоната также приводит к увеличению количества выделяемых органических соединений до 40‒60%. В то же время, наличие в среде аланина, аспартата или глутамата – продуктов аминирования пирувата, оксалоацетата и 2-оксоглутарата, несмотря на увеличение скорости ассимиляции СО2, не влияло на уровень выделения органических соединений (табл. 4).
Зависимость скорости ассимиляции СО2 и выделения в среду продуктов фотосинтеза от наличия в среде источника азота. Все ЗБС обладают способностью к азотфиксации, однако предпочтительным источником азота для них является аммоний (Heda, Madigan, 1986). Можно предположить, что в условиях отсутствия в среде соединений азота, синтезируемые органические кетокислоты не могут быть использованы для биосинтеза азотсодержащих соединений клетки и, таким образом, они могут выделяться в среду в виде РОС. Для проверки этого предположения мы сравнивали скорость автотрофной фиксации СО2 и выделения продуктов фотосинтеза на средах, содержащих и не содержащих аммоний в качестве источника азота. В опыте использовали клетки Cba. limnaeum, выросшие на среде с аммонием. Установлено, что на среде, содержащей 1 мМ аммония, величина К не превышает 10% (табл. 5). В отсутствие источника азота в среде уменьшается ассимиляция углекислоты, но выделение продуктов фотосинтеза увеличивается (К = 98%). При добавлении в этих условиях ацетата выделение РОС возрастает до величины К = 120%. Это означает, что, когда ЗСБ растут в условия лимита по азоту, они начинают выделять в среду значительное количество продуктов автотрофной ассимиляции СО2, количество которых еще больше увеличивается при наличии в среде ацетата. В последнем случае более половины от ассимилированного в процессе автотрофной ассимиляции СО2 продуктов фотосинтеза выделяется в окружающую среду в виде РОС и, следовательно, может быть использовано для поддержания роста хемотрофных бактерий, обитающих в данной экосистеме.
Таблица 5.
Ассимиляция СО2 и выделение РОС клетками культуры Cba. limnaeum в зависимости от наличия источника азота в среде
| Состав среды в опыте | Ассимиляция СО2, нмоль мг белка–1 мин–1 |
Выделение РОС К, % |
|---|---|---|
| СО2 + сульфид + аммоний | 51.4 | 11.1 |
| СО2 + сульфид ‒ аммоний | 35.5 | 56.6 |
| СО2 + сульфид – аммоний + ацетат | 25.4 | 118.2 |
Таким образом, в процессе фотосинтеза аноксигенные фототрофные бактерии, относящиеся к разным таксономическим группам и различающиеся по физиологии и механизму автотрофной фиксации СО2, выделяют в среду растворимые органические соединения в количестве от 5 до 20% от включенного в состав клеток неорганического углерода. Для Cba. limnaeum в процессе фотоавтотрофного роста в среду выделяется в виде РОС около 10% углерода, ассимилированного в процессе автотрофной фиксации СО2. Выделение РОС увеличивается до 30 и 60% при наличии в среде ацетата или пирувата соответственно. Отсутствиe азота в среде стимулирует выделение РОС до 60% от ассимилированного СО2. При добавлении в этих условиях ацетата выделение РОС возрастает до 120%. Полученные данные свидетельствуют о том, что при наличии света в анаэробных водных экосистемах аноксигенные фототрофы могут функционировать в качестве основных генераторов первичной продукции. Природа РОС, выделяемых в среду в процессе фотосинтеза, будет предметом дальнейших исследований.
Список литературы
Bauer C., Setterdahl A., Wu J., Robinson B.R. Regulation of gene expression in response to oxygen tension // Advances in Photosynthesis and Respiration / Ed. Hunter C.N.. Berlin: Springer, 2009. V. 28. P. 707‒722.
Biebl H., Pfennig N. Growth yields of green sulfur bacteria in mixed cultures with sulfur and sulfate reducing bacteria // Arch. Microbiol. 1978. V. 117. P. 9–16.
Buchanan B.B., Arnon D.I. A reverse KREBS cycle in photosynthesis: consensus at last // Photosynth. Res. 1990. V. 24. P. 47‒53.
Carlson C.A. Production and removal processes // Biogeochemistry of marine dissolved organic matter / Eds. Hansell D.A., Carlson C.A. San Diego: Academic Press, 2002. P. 91‒151.
Carlson C.A., Hansell D.A. DOM sources, sinks, reactivity, and budgets // Biogeochemistry of marine dissolved organic matter (2nd edn) / Eds. Hansell D.A., Carlson C.A. Boston: Academic Press, 2015. P. 65‒126.
Castenbolz R.W., Pierson B.K. Isolation of members of the family Chloroflexaceae // The Prokaryotes / Eds. Starr P., Stolp H., Truper Y.G., Balows A., Schlegel H.G. Berlin‒Heidelberg‒New York: Springer-Verlag, 1981 V. 1. P. 291‒298.
Evans M.C., Buchanan B.B., Arnon D.I. A new ferredoxin-dependent carbon reduction cycle in a photosynthetic bacterium // Proc. Natl. Acad. Sci. USA. 1966. V. 55. P. 928‒934.
Ferrera I., Gasol J.M., Sebastián M., Hojerová E., Koblížek M. Comparison of growth rates of aerobic anoxygenic phototrophic bacteria and other bacterioplankton groups in coastal Mediterranean waters // Appl. Environ. Microbiol. 2011. V. 77. P. 7451‒7458.
Heda G.D., Madigan M.T. Aspects of nitrogen fixation in Chlorobium // Arch. Microbiol. 1986. V. 143. P. 330–336.
Ivanovsky R.N., Sintsov N.V., Kondratieva E.N. ATP-linked citrate lyase activity in the green sulfur bacterium Chlorobium limicola forma thiosulfatophilum // Arch. Microbiol. 1980. V. 128. P. 239–241.
Keppen O.I., Baulina O.I., Kondratieva E.N. Oscillochloris trichoides neotype strain DG-6 // Photosynth. Res. 1994. V. 41. P. 29‒33.
Larsen H. On the culture and general physiology of the green sulfur bacteria // J. Bacteriol. 1952. V. 64. P. 187‒196.
Livanou E., Lagaria A., Psarra S., Lika K. Dissolved organic matter release by phytoplankton in the context of the Dynamic Energy Budget theory // Biogeosci. Discuss. 2017. P. 1‒33. https://doi.org/10.5194/bg-2017-426
Madigan M.T., Jung D.O. An overview of purple bacteria: systematics, physiology, and habitats // Advances in Photosynthesis and Respiration / Eds. Hunter N., Daldal F., Thurnauer M.C., Beatty J.T. Dordrecht: Springer, 2008. V. 28. P. 1‒15.
Nelson N.B., Siegel D.A. The global distribution and dynamics of chromophoric dissolved organic matter // Ann. Rev. Mar. Sci. 2013. V. 5. P. 447‒476.
Ormerod J.G., Ormerod K.S., Gest H. Light-dependent utilization of organic compounds and photoproduction of molecular hydrogen by photosynthetic bacteria; relationships with nitrogen metabolism // Arch. Biochem. Biophys. 1961. V. 94. P. 449‒463.
Overmann J., Beatty J.T., Hall K.J. Purple sulfur bacteria control the growth of aerobic heterotrophic bacterioplankton in a meromictic salt lake // Appl. Environ. Microbiol. 1996. V. 62. P. 3251‒3258.
Overmann J., Garcia-Pichel F. The phototrophic way of life // The Prokaryotes / Eds. Rosenberg E., DeLong E.F., Lory S., Stackebrandt E., Thompson F. Berlin, Heidelberg: Springer, 2013. P. 203‒257.
Pfennig N., Biebl H. Desulfuromonas acetoxidans gen. nov. and sp. nov., a new anaerobic, sulfur-reducing, acetate-oxidizing bacterium // Arch. Microbiol. 1976. V. 110. P. 3‒12.
Repeta D.J. Chemical characterization and cycling of dissolved organic matter // Biogeochemistry of Marine Dissolved Organic Matter, 2nd edn / Eds. Hansell D.A., Carlson C.A. Boston: Academic Press, 2015. P. 21‒63.
Romagnoli S., Tabita F.R. Carbon dioxide metabolism and its regulation in nonsulfur purple photosynthetic bacteria // Advances in Photosynthesis and Respiration / Ed. Hunter C.N. Berlin: Springer, 2009. V. 28. P. 563‒576.
Tang K.H., Blankenship R.E. Both forward and reverse TCA cycles operate in green sulfur bacteria // J. Biol. Chem. 2010. V. 285. P. 35848‒35854.
Thiel V., Tank M., Bryant D.A. Diversity of chlorophototrophic bacteria revealed in the omics era // Annu. Rev. Plant Biol. 2018. V. 69. P. 21‒49.
Thornton D.C.O. Dissolved organic matter (DOM) release by phytoplankton in the contemporary and future ocean // Eur. J. Phycol. 2014. V. 49. P. 20‒46.
Urbani R., Magaletti E., Sist P., Cicero A.M. Extracellular carbohydrates released by the marine diatoms Cylindrotheca closterium, Thalassiosira pseudonana and Skeletonema costatum: effect of P-depletion and growth status // Sci. Total Environ. 2005. V. 353. P. 300‒306.
Дополнительные материалы отсутствуют.


