Микробиология, 2020, T. 89, № 1, стр. 52-58
Экспресс-метод определения взаимосвязи биокоррозии полиэтилена биопленками Chromobacterium violaceum c их способностью формировать внеклеточный полимерный матрикс
М. В. Журина a, А. В. Ганнесен a, С. В. Мартьянов a, В. К. Плакунов a, *
a Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: plakunov@inmi.ru
Поступила в редакцию 19.06.2019
После доработки 09.07.2019
Принята к публикации 29.09.2019
Аннотация
Метод основан на массированном засеве образцов полиэтилена чистыми культурами микроорганизмов или их смесями с последующим формированием биопленок в течение 5‒7 сут. Степень повреждения поверхности полиэтилена определяли двумя альтернативными способами: разработанным нами оптическим методом, основанным на измерении интенсивности рассеянного света, а также стандартным методом с использованием профилометра. Оба способа обнаружили прямую корреляцию результатов и могут быть рекомендованы для практического измерения начальных этапов биокоррозии поверхности полиэтилена. Показано, что степень биокоррозии определяется, в первую очередь, не общим накоплением внеклеточного полимерного матрикса, а количеством жизнеспособных клеток микроорганизма в биопленке
В многочисленных исследованиях функций внеклеточного полимерного матрикса (ВПМ) микробных биопленок убедительно продемонстрирована его важная роль в защите биопленочного “населения” от воздействия экстремальных физико-химических факторов окружающей среды, а также от биоцидов (Стрелкова и соавт,, 2013; Flemming, 2016). В состав ВПМ входит большое количество низкомолекулярных компонентов, а также биополимеров, в том числе внеклеточные ферменты, роль которых пока мало изучена (Saxena et al., 2019). Есть основания полагать, что в структуре ВПМ ферменты находятся в (квази)иммобилизованном состоянии в результате взаимодействия с полисахаридами и другими компонентами ВПМ, что способствует их устойчивости к внешним воздействиям и влияет на величину и специфичность ферментативной активности (Tielen et al., 2013; Romero et al., 2018).
В процессе биокоррозии полиэтилена (ПЭ) возникают структурные нарушения полимерной цепи с появлением химически реакционных групп, включающих кислород (Kowalczyk et al., 2016). Эти результаты указывают на возможное включение в биодеградацию ПЭ, в частности, оксидаз и пероксидаз, участвующих в расщеплении лигнина (Sangale et al., 2012). Можно также предполагать (Arkatkar et al., 2009), что в процессах биодеструкции ПЭ участвуют содержащиеся у нефтеокисляющих микроорганизмов оксигеназы, способные внедрять кислород в углеводородную цепь длинноцепочечных парафинов. Одними из таких активно окисляющих нефтепродукты бактерий являются представители рода Chromobacterium. Их деградирующая способность в отношении дизельного топлива, керосина и сырой нефти обнаружена в скоплениях водорослей по берегам рек (Bassey et al., 2018), a также в образцах отвержденной сырой нефти в морской воде и на берегах морей (Itah, Essien, 2005).
Учитывая важную роль ВПМ в формировании и функционировании микробных биопленок, целью данной работы являлось сравнение активности процессов биодеградации ПЭ, осуществляемых биопленками штамма дикого типа Chromobacterium violaceum ATCC 31532 (штамм WT), способного к формированию полноценного ВПМ, и его мутанта CV026 с дефектом синтеза ВПМ (Журина и соавт., 2013; Kamaeva et al., 2014).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Подготовка микробных культур. Культуры Chromobacterium violaceum сохраняли на столбиках полужидкой (0.3% агара) среды LB (“Difco”) под вазелиновым маслом при комнатной температуре. Перед экспериментом культуры рассевали методом “истощающего штриха” на поверхности плотной среды LA (среда LB с добавлением 2.5% агара) и инкубировали 48 ч при 30°С. Чашки с выросшими культурами хранили 2‒3 недели при комнатной температуре в герметичных сосудах. Для эксперимента выбирали характерные колонии, которые засевали на жидкую среду LB и выращивали 24 ч при 30°С на качалке (150 об./мин). Полученные культуры использовали в качестве тест-объектов для измерения биокоррозии ПЭ.
Подготовка тестируемых образцов пластмасс. Из листов полиэтиленовой нестабилизированной пленки ПВД толщиной 150 мкм (ГОСТ 10354-82) нарезали полоски 1 × 2 см, помещали на бумажные фильтры в чашки Петри и стерилизовали УФ в течение 60 мин (лампа ДБ 30-01 мощностью 30 Вт, бактерицидная мощность 6 Вт). Стерильные образцы хранили при комнатной температуре в герметизированных парафильмом чашках Петри.
Измерение биокоррозии ПЭ оптическим методом. Использовали чашки Петри с плотной средой LA, а также с этой же средой, разбавленной средой М9 в 10 и 50 раз (в присутствии 2.5% агара) без источника углерода. Тестируемые пластинки ПЭ погружали в застывшую среду примерно на 2/3 высоты. Непогруженная часть образца служила для микроскопического контроля его однородности: при наличии дефектов в исходном образце результаты для него не учитывались. Непосредственно вокруг основания образца и вглубь плотной среды вносили 5 мкл 24-часовой культуры изучаемого микроорганизма. При такой постановке опыта на одну чашку Петри диаметром 10 см можно поместить 4‒6 образцов (один из них служил холостым вариантом и не подвергался воздействию микроорганизма (рис. S1 ).
Чашки инкубировали при 30°С в течение 4‒7 сут. Затем образцы (не менее трех каждого типа) извлекали стерильным пинцетом, ополаскивали стерильной дистиллированной водой для удаления непрочно связанных бактерий, подсушивали на воздухе. Часть образцов фотографировали с помощью портативного цифрового микроскопа DNX 30 (“Levenhuk Inc.”, США) при боковом освещении светодиодным источником (под углом 5° относительно горизонтальной поверхности) на черном не рассеивающем свет фоне для визуального качественного выявления сформированных на поверхности ПЭ биопленок. Использовали такое увеличение микроскопа (примерно ×200), чтобы пластинка полностью помещалась в поле зрения микроскопа, и большая часть рассеянного света попадала в его объектив. Схема установки для оптического анализа отображена на рис. 1.
Рис. 1.
Схема установки для проведения оптического анализа пластин: 1 – анализируемая пластина; 2 – подложка; 3 – фонарик; 4 – портативный USB-микроскоп “Levenhuk Inc.”; 5 – лапка штатива; 6 – компьютер.
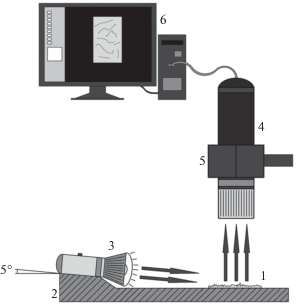
Поскольку пластинки ПЭ прозрачны, на фотографиях на темном фоне выявляется светорассеяние от дефектов поверхности, локализованных на обеих сторонах пластинки.
На погруженной в среду части пластинок с помощью инструмента Emboss (рельеф) графической программы Photoshop CS6 Extended визуализировали шероховатости, сформированные микробными биопленками. Примеры таких пластинок представлены на рис. 2.
Рис. 2.
Полоски полиэтилена после инкубации в плотной среде LA в присутствии изучаемых штаммов Chromobacterium violaceum, контрастированные с помощью инструмента Photoshop CS6 Extended Emboss (рельеф).

На рис. 2 можно видеть, что штамм C. violaceum WT, по сравнению с мутантом CV026, в условиях наших экспериментов образует более плотную биопленку со сложной архитектурой.
Эти образцы (включая холостые, инкубированные в отсутствие микроорганизма) помещали в 5% раствор дихромата калия в концентрированной серной кислоте и выдерживали 24 ч при комнатной температуре для полного растворения биопленок и последующего измерения шероховатости поверхности полиэтилена.
Два других варианта пластинок (каждый не менее чем в трех повторностях), инкубированных в среде LА, разбавленной в 10 (LA/10) и в 50 раз (LA/50), окрашивали с помощью метаболизируемого красителя, 3-(4,5-диметилтиазол-2-ил)-2,5-ди-фенилтетразолий бромида (МТТ), для выявления метаболически активных бактерий, а также кристаллическим фиолетовым (КФ) для определения общей массы биопленок (Плакунов и соавт., 2016). По сравнению с ранее описанными методами были внесены некоторые изменения.
При окрашивании МТТ пластинки с биопленками споласкивали дистиллированной водой и инкубировали 1 сут в 3 мл 0.1% раствора МТТ в среде LB при комнатной температуре (в планшетах с крышками) в присутствии 50 мкг/мл азитромицина (этот антибиотик подавляет рост микроорганизмов, но не препятствует восстановлению МТТ).
Примеры окрашенных пластинок представлены на рис. 2S.
Окрашенные пластинки (в том числе холостой вариант) ополаскивали дистиллированной водой и подсушивали на воздухе. Затем каждую пластинку экстрагировали 3 мл 96% этанола (до практически полного обесцвечивания). Оптическую плотность экстрактов измеряли при 540 нм на спектрофотометре 722 Grating (Китай) против экстракта холостого варианта.
В случае окрашивания КФ пластинки ополаскивали дистиллированной водой и помещали в 3 мл 0.1% водного раствора КФ на 60 мин, после чего избыток несвязанного красителя удаляли промыванием дистиллированной водой. Пластинки подсушивали на воздухе. Примеры окрашенных пластинок представлены на рис. 3S.
Рис. 3.
Количественная оценка формирования био-пленок на поверхности пластинок полиэтилена по окрашиванию КФ: А – на неразбавленной среде LA; Б – на среде LA/10; B – на среде LA/50. Варианты опытов: 1 – контроль; 2 – Chromobacterium violaceum CV026; 3 – Chromobacterium violaceum WT.
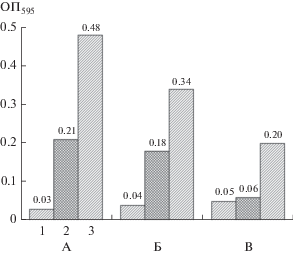
Связанный с биопленками краситель экстрагировали 3 мл 96% этанола (до практически полного обесцвечивания). Оптическую плотность экстрактов измеряли при 595 нм против холостого образца.
Денситометрический анализ степени повреждения пластин. После экстракции красителей все образцы (в том числе из первой, неокрашенной порции), включая холостой вариант, помещали в хромовую смесь (5% раствор дихромата калия в концентрированной серной кислоте) на 1 сут при комнатной температуре для растворения биопленок, отмывали в большом объеме дистиллированной воды, подсушивали на воздухе и фотографировали с помощью микроскопа DNX 30 (“Levenhuk Inc.”, США).
Полученные фотографии обрабатывали с помощью инструментов Photoshop CS6 Extended. Для этого из каждой фотографии вырезали основную часть 400 × 400 пкс (исключая края фотографии), переводили в формат bmp и использовали как образцы для количественного анализа с помощью денситометрической программы (Sorbfil TLC View) для денситометра Сорбфил (ТУ 4436-003-16943778-99, ЗАО НПО “Техноком”, Россия).
Измерение биокоррозии ПЭ с помощью профилометра. После проведения денситометрического анализа производили измерение шероховатости профиля поверхности пластин при помощи прибора-профилометра TR110new (“Time Group Inc.”, Китай). Для этого пластину ПЭ закрепляли на прозрачной плексигласовой подложке, укрепленной на штативе выше уровня глаз. Сверху пластины устанавливали профилометр, игла которого во время измерения проходила путь длиной 6 мм. Производили 6‒9 измерений профиля поверхности пластины в одной проекции, после чего прибор поворачивали на 90° и измеряли 6‒9 раз в перпендикулярной проекции. Затем пластину переворачивали и повторяли измерения в двух проекциях. Прозрачность плексигласовой подложки обеспечивала визуальный контроль траектории иглы профилометра, необходимый для избегания прохождения иглы по одному и тому же месту. Дополнительное визуальное контрастирование царапин, оставляемых иглой, проводили при помощи светодиодного фонаря, направленного на пластину снизу под углом 60°.
Измеряли усредненный параметр шероховатости поверхности Ra (мкм), высчитываемый прибором автоматически на основе обработки сигналов от иглы на впадинах и возвышениях профиля.
Статистическую обработку результатов проводили, как и в предыдущих работах, с использованием программного пакета OriginLab 8.6. Поскольку тест на нормальность закона варьирования данных в наших экспериментах дал отрицательный результат, для оценки достоверности различий применяли непараметрический U-критерий Манна–Уитни–Вилкоксона при р < 0.05. Для графического отображения полученных закономерностей использовали алгоритм выбора типичного эксперимента (Paulson, 2008). Построение и сглаживание графиков проводили с использованием программы OriginLab 8.6 при помощи функции В-spline.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Взаимосвязь процесса формирования биопленок с величиной биокоррозии ПЭ определяли с помощью разработанного нами экспресс-метода, который позволяет получить результаты в течение 5‒7 дней, в отличие от классических подходов, требующих более длительной инкубации: от нескольких недель до нескольких месяцев (Sangale et al., 2012). Характерной особенностью нашего метода является использование массированного воздействия микроорганизмов непосредственно на испытуемый образец. Кроме стандартной среды LА использовали два ее разведения в 10 и 50 раз с целью снижения возможного репрессирующего действия содержащихся в ней питательных веществ на синтез ферментов, участвующих в биодеградации ПЭ. С другой стороны, можно было ожидать, что, поскольку в биодеградации ПЭ участвуют не специфические для этого субстрата ферменты, а ферменты общего метаболизма (Arkatkar et al., 2009), массированный засев микроорганизмов на богатой среде может способствовать увеличению общего количества ферментов, участвующих в биодеградации ПЭ.
Как показали проведенные эксперименты, общее накопление биопленок по окрашиванию КФ у исследуемых штаммов заметно отличалось (рис. 3), поскольку у мутанта Chromobacterium violaceum CV026 синтез ВПМ значительно снижен (Журина и соавт., 2013). Наибольшие различия наблюдались на неразбавленной среде LA и на среде, разбавленной в 50 раз (LA/50).
Методом, позволяющим количественно оценить содержание в биопленках метаболически активных бактерий, является окрашивание красителем МТТ (Плакунов и соавт., 2016) (рис. 4).
Рис. 4.
Количественная оценка метаболически активных бактерий на поверхности пластинок полиэтилена по окрашиванию МТТ. Обозначения как на рис. 3.
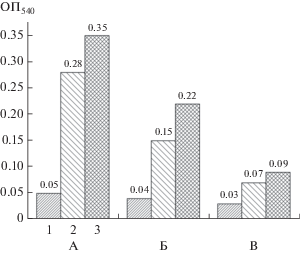
Как следует из данных, представленных на рис. 4, различия между штаммами в количестве метаболически активных бактерий на пластинках ПЭ значительно меньше, чем различия в общем количестве биопленочного материала, поскольку КФ окрашивает как ВПМ, так и клетки бактерий. Таким образом, в условиях наших экспериментов способность бактерий переходить к “прикрепленному” способу существования, по-видимому, реализуется до того, как начинается активный синтез ВПМ. Поэтому особый интерес представляло выявление связи между общим количеством биопленок на поверхности пластинок ПЭ, количеством метаболически активных бактерий в этих биопленках и степенью биокоррозии поверхности обрастаемого ими ПЭ. Степень биокоррозии определяли двумя способами: разработанным нами оптическим методом, а также стандартным методом измерения шероховатости поверхности с помощью профилометра. В случае оптического метода величину биокоррозии поверхности ПЭ оценивали денситометрически по величине интенсивности (площади пиков) рассеянного света, оцениваемой как “яркость” (рис. 5).
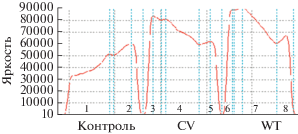
Рис. 5.
Денситометрическое измерение степени биокоррозии изучаемыми штаммами поверхности полиэтилена в результате инкубации на неразбавленной среде LB. Величина светорассеяния представлена как “яркость” на оси ординат.
Аналогичным образом измеряли светорассеяние при инкубации пластинок ПЭ в разбавленных средах LA. Величины площадей полученных пиков светорассеяния использовали для построения диаграмм относительно контрольных образцов, инкубированных при тех же условиях в стерильной среде LA. Данные суммированы на рис. 6.
Рис. 6.
Определение степени биокоррозии поверхности полиэтилена оптическим методом на среде LA с разной степенью разбавления: А – на неразбавленной среде LA; Б – на среде LA/10; В – на среде LA/50. Варианты опытов: 1 – Chromobacterium violaceum CV026; 2 – Chromobacterium violaceum WT.
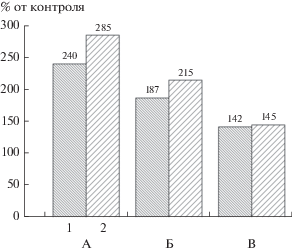
Для сравнения с предложенным нами оптическим методом был использован стандартный метод определения шероховатости поверхности ПЭ, подвергнутого биокоррозии, с помощью профилометра. Результаты представлены на рис. 7.
Рис. 7.
Определение степени биокоррозии поверхности полиэтилена с помощью профилометра на среде LA с разной степенью разбавления. Обозначения как на рис. 6.
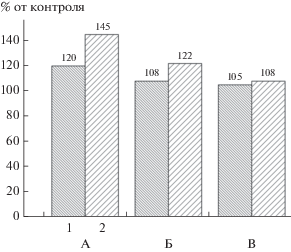
В целом между данными, полученными сравниваемыми методами, наблюдается положительная корреляция. Точного количественного совпадения результатов ожидать трудно, поскольку принципы определения шероховатости поверхности у этих методов принципиально различаются. В оптическом методе шероховатость характеризуется степенью светорассеяния от дефектов поверхности ПЭ, а в случае профилометрического метода она измеряется непосредственно по перемещению зонда по неровностям поверхности ПЭ. Однако предлагаемый нами метод дает более надежные усредненные результаты, поскольку для измерения шероховатости используется практически вся изучаемая поверхность пластинки, тогда как данные, получаемые с помощью профилометрического метода, сильно зависят от характера распределения повреждений по поверхности пластинки, и для получения усредненных результатов требуют многократных измерений при движении зонда в разных направлениях. Поэтому для практического применения сравнительного определения степени биокоррозии поверхности ПЭ под воздействием разных микробных ассоциаций, разработанный нами оптический метод представляется более простым и корректным.
Предлагаемый экспресс-метод одновременно решает две задачи. Во-первых, он позволяет быстро проверить с помощью высокоактивных микробных ассоциаций большое количество защитных добавок, предупреждающих биокоррозию технологических покрытий или упаковок, изготавливаемых из ПЭ. Во-вторых, позволяет сформулировать рекомендации для создания эффективных микробных ассоциаций, позволяющих утилизировать отходы ПЭ, что является в настоящее время весьма актуальной проблемой.
Из полученных нами результатов следует, что биокоррозия определяется не столько общей величиной обрастания биопленкой корродируемого материала, измеряемого по окрашиванию биопленок КФ, сколько наличием в этой биопленке жизнеспособных метаболически активных клеток. Накопление ВПМ, стимулирующего прикрепление микроорганизмов к поверхности материалов, несомненно, играет важную, но не всегда решающую роль, как можно судить при сравнении данных, представленных на рис. 3‒4 и 6‒7. Поэтому для корректной оценки корродирующей активности микробного сообщества необходимо определять не только общую степень обрастания материала, но и количество содержащихся в нем метаболически активных микроорганизмов.
Список литературы
Журина М.В., Кострикина Н.А., Паршина Е.А., Стрелкова Е.А., Юсипович А.И., Максимов Г.В., Плакунов В.К. Визуализация внеклеточного полимерного матрикcа биопленок Chromobacterium violaceum с помощью микроскопических методов // Микробиология. 2013. Т. 82. С. 502–509.
Zhurina M.V., Kostrikina N.A., Parshina E.Yu., Strelkova E.A.,Yusipovich A.I., Maksimov G.V., Plakunov V.K. Visualization of the extracellular polymeric matrix of Chromobacterium violaceum biofilms by microscopic methods // Microbiology (Moscow). 2013. V. 82. P. 517–524.
Стрелкова Е.А., Позднякова Н.В., Журина М.В., Плакунов В.К., Беляев С.С. Роль внеклеточного полимерного матрикса в устойчивости бактериальных биопленок к экстремальным факторам среды // Микробиология. 2013. Т. 82. С. 131–138.
Strelkova E.A., Pozdnyakova N.V., Zhurina M.V., Plakunov V.K., Belyaev S.S. Role of the extracellular polymer matrix in resistance of bacterial biofilms to extreme environmental factors // Microbiology (Moscow). 2013. V. 82. P. 119–125.
Arkatkar A., Arutchelvi J., Sudhakar M., Bhaduri S., Uppara P.V., Doble M. Approaches to enhance the biodegradation of polyolefins // Open Environ. Engineer. J. 2009. V. 2. P. 68–80.
Bassey I.U., Andy I.E., Unimke A.A., Akpanke J. Hydrocarbon degrading potentials of Chromobacterium violaceum, Bacillus subtilis and Micrococcus luteus isolated from lemna waste dumpsite, Cross River State, Nigeria // Int. J. Sci. Res. Public. 2018. V. 8. P. 122–129.
Flemming H.C. EPS ‒ Then and Now // Microorganisms. 2016. V. 4. pii: E41. https://doi.org/10.3390/microorganisms4040041
Itah A.Y., Essien J.P. Growth profile and hydrocarbonoclastic potential of microorganisms isolated from tarballs in the Bight of Bonny, Nigeria // World J. Microbiol. Biotechnol. 2005. V. 21. P. 1317–1322.
Kamaeva A.A., Vasilchenko A.S., Deryabin D.G. Atomic force microscopy reveals a morphological differentiation of Chromobacterium violaceum cells associated with biofilm development and directed by N-hexanoyl-L-homoserine lactone // PLoS One. 2014. V. 9. e103741. https://doi.org/10.1371/journal.pone.0103741
Kowalczyk A., Chyc M., Ryszka P.ł., Latowski D. Achromobacter xylosoxidans as a new microorganism strain colonizing high-density polyethylene as a key step to its biodegradation // Environ Sci. Pollut. Res. 2016. V. 23. P. 11349–11356.
Paulson D.S. Biostatistics and Microbiology // Springer Science + Business Media, 2008.
Romero C.M., Martorell P.V., López A.G., Peñalver C.G.N., Chaves S., Mechetti M. Architecture and physicochemical characterization of Bacillus biofilm as a potential enzyme immobilization factory // Colloids Surf. B: Biointerfaces. 2018. V. 162. P. 246‒255. https://doi.org/10.1016/j.colsurfb.2017.11.057
Sangale M.K., Shahnawaz M., Ade A.B. A Review on biodegradation of polythene: the microbial approach // J. Bioremed. Biodeg. 2012. V. 3(10). https://doi.org/10.4172/2155-6199.1000164
Saxena P., Joshi Y., Rawat K., Bisht R. Biofilms: architecture, resistance, quorum sensing and control mechanisms // Indian J. Microbiol. 2019. V. 59. P. 3–12.
Tielen P., Kuhn H., Rosenau F., Jaeger K.E., Flemming H.C., Wingender J. Interaction between extracellular lipase LipA and the polysaccharide alginate of Pseudomonas aeruginosa // BMC Microbiol. 2013. V. 13. Article 159. https://doi.org/10.1186/1471-2180-13-159
Дополнительные материалы
- скачать Zhurina_1.tiff
- Рис. S1. Образцы полиэтилена на чашке Петри с плотной средой LA
- скачать Zhurina_2.tiff
- Рис. 2S Образцы полиэтилена, окрашенные МТТ, после инкубирования в плотной среде LA в присутствии изучаемых штаммов Chromobacterium violaceum
- скачать Zhurina_3.tiff
- Рис.3S. Образцы полиэтилена, окрашенные КФ, после инкубирования в плотной среде LA в присутствии изучаемых штаммов Chromobacterium violaceum


