Микробиология, 2020, T. 89, № 1, стр. 88-98
Выделение и характеристика штаммов – продуцентов бактериальной целлюлозы
В. В. Ревин a, Е. В. Лияськина a, *, Н. Б. Сапунова a, А. О. Богатырева a
a ФГБОУ ВО “Национальный исследовательский Мордовский государственный университет
им. Н.П. Огарёва”
430005 Саранск, Россия
* E-mail: liyaskina@yandex.ru
Поступила в редакцию 07.03.2019
После доработки 22.07.2019
Принята к публикации 29.09.2019
Аннотация
Выделено два новых штамма-продуцента бактериальной целлюлозы из симбиотических сообществ “Чайный гриб” и “Индийский рис”. Штаммы идентифицированы на основании анализа 16S РНК, морфологических, биохимических и физиологических характеристик как Komagataeibacter sucrofermentans Н 110 и Komagataeibacter hansenii С 110 и депонированы во Всероссийской коллекции промышленных микроорганизмов под номерами ВКПМ B-11267 и ВКПМ В-12950 соответственно. Выделенные бактерии обладают высокой продуктивностью и способны образовывать на средах с отходами пищевой промышленности до 8.2–9.5 г/л бактериальной целлюлозы.
В настоящее время бактериальная целлюлоза (БЦ) привлекает особое внимание исследователей. По сравнению с растительной целлюлозой она обладает целым рядом преимуществ. Прежде всего, она является химически чистым веществом и не требует очистки от примесей. Кроме того, микрофибриллы бактериальной целлюлозы значительно тоньше микрофибрилл растительной целлюлозы. При этом степень кристалличности бактериальной целлюлозы достигает 70–89%, что превышает аналогичный показатель для растительной целлюлозы.
Благодаря своим уникальным свойствам БЦ является перспективным материалом для промышленности и техники, открывая новые горизонты для нанотехнологии (Ревин и соавт., 2014). Она имеет большой потенциал для использования в медицине в качестве биоматериала для тканевой инженерии, создания раневых покрытий и трансдермальных терапевтических систем, а также может использоваться в диетологии в качестве носителя добавок для сбалансированного питания, в промышленной электронике для получения оптически прозрачных соединений с ультранизким коэффициентом теплового расширения, для изготовления акустических диафрагм, способна служить заменой растительной целлюлозы в производстве бумаги. БЦ является перспективным источником получения нанокристаллической целлюлозы и биокомпозиционных материалов (Ревин и соавт., 2014; Liyaskina et al., 2017).
Несмотря на все преимущества бактериальной целлюлозы перед полимером растительного происхождения, процесс ее производства является довольно дорогостоящим. Это связано, прежде всего, с невысокой продуктивностью известных штаммов, которая, как правило, не превышает 5 г/л БЦ. Поэтому остается актуальным выделение новых культур продуцентов и получение высокопродуктивных штаммов методами селекции и генетической инженерии.
Бактериальную целлюлозу образуют грамотрицательные бактерии родов Komagataeibacter (Gluconacetobacter), Agrobacterium, Achromobacter, Enterobacter, Rhizobium, Pseudomonas, Salmonella, Azotobacter, Alcaligenes и грамположительные бактерии Sarcina ventriculi, Rhodococcus (Ревин и соавт., 2014). Наиболее известным продуцентом бактериальной целлюлозы является уксуснокислая бактерия Komagataeibacter xylinus (Gluconacetobacter xylinus, Acetobacter xylinum, A. aceti ssp. xylinum, A. xylinus).
Род Gluconacetobacter принадлежит семейству Acetobacteraceae и относится к филуму Proteobacteria, класс Alfaproteobacteria. На основании анализа 16S рРНК виды этого рода были разделены на 2 группы: группа Gluconacetobacter xylinus (G. xylinus, G. sucrofermentans, G. hansenii, G. europaeus, G. entanii, G. saccharivorans, G. swingsii, G. rhaeticus, G. nataicola, G. oboediens, G. intermedius) и группа Gluconacetobacter liquefaciens (G. liquefaciens, G. sacchari, G. diazotrophicus, G. johannae, G. azotocaptans) (Yamada, Yukphan, 2008; Cleenwerck et al., 2010; Y-amada et al., 2012).
Бактерии группы Gluconacetobacter liquefaciens образуют 2,5-дикето-D-глюконат и водорастворимый коричневый пигмент. Бактерии группы Gluconacetobacter xylinus не синтезируют данный пигмент и образуют 2-кето-D-глюконат и/или 5‑кето-D-глюконат (Yamada et al., 2012).
В настоящее время бактерии группы Gluconacetobacter xylinus перенесены в новый род Komagataeibacter, первоначально названный Komagatabacter (K. xylinus, K. hansenii, K. europaeus, K. oboediens, K. intermedius, K. swingsii, K. rhaeticus, K. saccharivorans, K. nataicola, K. kombuchae, K. sucrofermentans, K. kakiaceti, K. medellinensis, K. maltaceti) (Yamada et al., 2012; Yamada, 2014).
На сегодняшний день выделено и описано большое количество штаммов рода Komagataeibacter (Gluconacetobacter). Полностью секвенированы геномы K. medellinensis NBRC 3288 (Ogino et al., 2011), K. nataicola RZS0111 (Zhang et al., 2017), K. hansenii ATCC 53582 (Florea et al., 2016), K. xylinus E25 (Kubiak et al., 2014), K. xylinus E259, K. xylinus CGMCC 2955 (Liu et al., 2018), K. xylinus E26, K. xylinus BCRC 12334 (Ryngajllo et al., 2018). В целом у представителей рода Komagataeibacter содержание Г + Ц в ДНК составляет от 55.8 до 63.4 мол. % (Yamada, 2012).
К роду Komagataeibacter относятся многочисленные недавно выделенные продуценты БЦ. Большое количество штаммов выделено из симбиотического сообщества “Чайный гриб”: K. hansenii GH-1/2008 (ВКПМ В-10547) (Патент РФ № 2464307, 2012), K. xylinus B-12068 (Патент РФ № 2568605, 2015; Volova et al., 2018), K. rhaeticus CALU-1629 (Патент ЕАПВ № 201700517, 2017), K. rhaeticus P 1463 (Semjonovs et al., 2017); K. intermedius AF2 (dos Santos et al., 2014).
Из уксуса выделены продуценты Komagatabacter (Gluconacetobacter) sp. RKY5 (Kim et al., 2006), K. medellinensis (Castro et al., 2012); Komagatabacter (Gluconacetobacter) kakiaceti sp. nov. (Iino et al., 2012). Из фруктовых соков выделены бактерии K. intermedius (Lin et al., 2016), G. swingsii, G. rhaeticus (Dellaglio et al., 2005); Komagatabacter (Gluconacetobacter) sp. gel_SEA623-2 (Kim et al., 2017); из фруктов – Komagatabacter (Gluconacetobacter) sp. F6 (Jahan et al., 2012).
Штаммы рода Komagataeibacter различаются количеством образуемой БЦ, зависимостью этого процесса от используемого субстрата, структурой и свойствами синтезируемой целлюлозы (Ryngajllo et al., 2018).
Целью настоящей работы была характеристика новых штаммов – эффективных продуцентов бактериальной целлюлозы, выделенных из симбиотических сообществ “Чайный гриб” и “Индийский рис”.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования и источник выделения. Источниками выделения штаммов – продуцентов БЦ были симбиотические сообщества “Чайный гриб” (De Filippis et al., 2018) и “Индийский рис” (Fels et al., 2018).
Состав сред и условия культивирования. Штаммы, образующие БЦ, выделяли на среде HS (Hestrin, Schramm, 1954) следующего состава (г/л): глюкоза – 20.0, пептон – 5.0, дрожжевой экстракт – 5.0, гидрофосфат натрия – 2.7, лимонная кислота – 1.15; рH среды – 6.0.
Чистые культуры поддерживали на среде следующего состава (г/л): глюкоза – 10.0, дрожжевой экстракт – 10.0, пептон – 7.0, лимонная кислота – 0.2, уксусная кислота – 0.1, этанол – 10.0, агар – 15.0; рН 5.0‒6.0.
Для изучения культурально-морфологических свойств микроорганизмов использовали агаризованную среду с глюкозой следующего состава (г/л): глюкоза – 10.0, дрожжевой экстракт – 10.0, пептон – 7.0, лимонная кислота – 0.2, уксусная кислота – 1.5, этанол – 10.0, агар – 20.0; рH 6.0; среду YE следующего состава (г/л): дрожжевой экстракт – 30.0, этанол – 20.0, агар – 20.0; рH 6.0; среду с мелом следующего состава (г/л): пептон – 5.0, дрожжевой экстракт – 3.0, этанол – 30.0, мел – 20.0, агар – 15.0; рH 6.0; среду с мелассой следующего состава (г/л): меласса – 55, агар – 15.0; рН 4.5.
Для получения БЦ использовали среды: HS (рН 6.0), среду с мелассой в концентрации 55 г/л (рН 4.5), фильтрат нативной послеспиртовой барды (рН 4.0).
Культивирование продуцента осуществляли в конических колбах на 250 мл, содержащих 100 мл среды. Инокулят выращивали на шейкере-инкубаторе ES-20/60 (“Biosan”, Латвия) при скорости перемешивания 250 об./мин и температуре 28°С в течение 1 сут. Полученным инокулятом в количестве 10% от объема среды засевали колбы опытного варианта, которые затем помещали на шейкер-инкубатор ES-20/60 и проводили культивирование при скорости перемешивания 250 об./мин в течение 3 сут. Также культивирование осуществляли в статических условиях при температуре 28°С в течение 5 и 14 сут.
Определение количества образовавшейся БЦ. Полученную БЦ трехкратно обрабатывали 0.1 н раствором NaOH при 80°С в течение 30 мин для удаления клеток и компонентов среды. От раствора щелочи целлюлозу отмывали 0.5% раствором уксусной кислоты и дистиллированной водой до нейтральной реакции. Количество полисахарида определяли весовым методом после высушивания до постоянной массы при температуре 60°С.
Микроскопические исследования. Морфологию клеток изучали в световом микроскопе DM2500 M (“Leica”, Швейцария), а морфологию колоний ‒ с помощью стереомикроскопа Stemi DV4 (“Carl Zeiss”, Германия).
Определение физиологических свойств штаммов проводили в соответствии с общепринятыми методами (Нетрусов и соавт., 2005). Спектр субстратов, используемых штаммами в качестве источника углерода, определяли на жидкой среде HS. В качестве источников углерода и энергии исследовали: сахара – глюкозу, фруктозу, сахарозу, лактозу, мальтозу, ксилозу, галактозу, арабинозу; спирты – глицерин, маннит; соли органических кислот – ацетат, лактат, цитрат; первичные спирты – этанол. Рост штаммов при значениях рН 3.0–7.0 определяли, доводя основную среду HS 0.1 н раствором HCl или NaOH до нужного значения рН, который оценивали потенциометрически на pH-метре S220 SevenCompact (“Mettler Toledo”, Швейцария). Температурные пределы роста изучали в интервале 6–37°С. Температурный и рН оптимумы роста штаммов определяли с использованием глюкозы в качестве субстрата.
Состав жирных кислот (ЖК) в липидах обоих штаммов определяли на газовом хроматографе GC-2010 Plus (“Shimadzu”, Япония) с капиллярной колонкой HP-FFAP 50 м × 0.32 мм × 0.5 мкм (“Agilent Technologies”, США). Использовался программный комплекс Shimadzu GCsolution.
Молекулярно-генетические исследования. Выделение, очистку ДНК, определение Г + Ц в составе ДНК проводили по стандартным методикам (Heath et al., 1986). Определение нуклеотидной последовательности гена 16S рРНК у штаммов проводили по стандартным методикам в ФГБУ “ГосНИИгенетика”.
РЕЗУЛЬТАТЫ
Методом многоступенчатого скрининга по способности синтезировать наибольшее количество БЦ в результате исследований были выделены 2 штамма бактерий-продуцентов. Штамм Н 110 был выделен из симбиотического сообщества “Чайный гриб” (Комбуча, Medusomyces gisevii J. Lindau), а штамм С 110 ‒ из симбиотического сообщества “Индийский рис” (морской рис, тибикос, тиби, тибетский гриб, японский рис, водяной кефир).
Морфология. Клетки штаммов Н 110 и С 110 при оптимальных условиях культивирования на среде с глюкозой (10.0 г/л) в качестве субстрата представляют собой палочки с закругленными концами, некоторые слегка изогнуты; эндоспор не образуют; окраска по Граму – отрицательная; расположение одиночное, парное, в коротких цепочках; размеры 0.6–1.2 × 1.0–3.0 мкм (рис. 1).
Культуральные свойства. Штаммы Н 110 и С 110 хорошо растут плотных питательных средах с содержанием агара 2%.
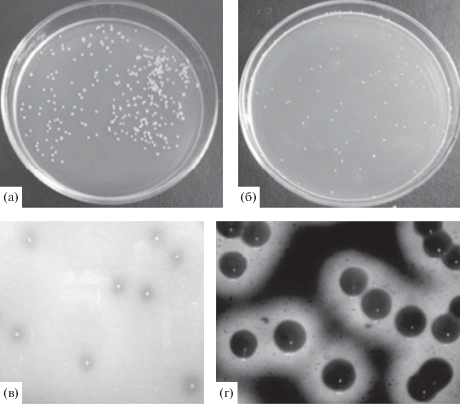
На агаризованной среде с глюкозой и среде YE при 28°С на 3 сут роста штаммы Н 110 и С 110 образовывали мелкие круглые колонии диаметром 1–2 мм светло-бежевого цвета (рис. 2а, 2б). На 5 сут культивирования диаметр колоний увеличивался до 2–4 мм. На агаризованной среде с мелом и мелассой колонии окружены прозрачным ореолом, образующимся, вероятно, под действием уксусной кислоты (рис. 2в, 2г).
Рис. 2.
Колонии K. sucrofermentans Н 110 на средах с глюкозой (а), этанолом (среда YE) (б), мелом (в) и мелассой (г) на 3 сут роста.
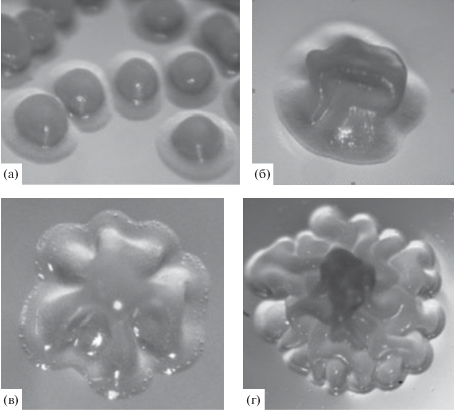
Колонии имели форму шара на плоской подошве, блестящие, желеобразные, целиком снимающиеся с агара (рис. 3а). В процессе роста поверхность колонии становилась морщинистой, а край волнистым (рис. 3б–3г, 4).
Рис. 3.
Колонии K. sucrofermentans Н 110 на среде с глюкозой. 3 сут роста: диаметр 1 мм (а), диаметр 2 мм (б); 4 сут роста: диаметр 2‒3 мм (в); 5 сут роста: диаметр 4 мм (г).
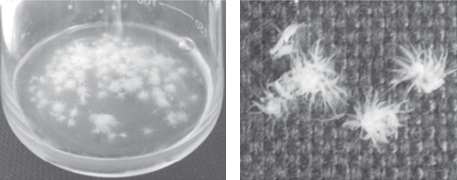
При росте в жидкой среде исследуемые штаммы в статических условиях образовывали гель-пленку бактериальной целлюлозы (рис. 5), в динамических условиях – агломераты бактериальной целлюлозы различной формы и размеров в зависимости от состава среды и режимов перемешивания (рис. 6). Так при культивировании штаммов в конических колбах на 250 мл, содержащих 100 мл среды HS, в шейкере-инкубаторе при скорости перемешивания 100 об./мин образовывались крупные агломераты БЦ от 25 до 30 мм в диаметре. При повышении скорости перемешивания до 150 об./мин и выше БЦ приобретала вид хлопьев размерами 1–7 мм.
Физиологические свойства. Штаммы Н 110 и С 110 являются аэробными мезофильными ацидотолерантными органогетеротрофами. Штаммы росли в пределах температур 6–37°С с оптимумом роста при 28–30°С и в диапазоне рН 3–7 с оптимумом при значениях 4–6 (табл. 1).
Таблица 1.
Фенотипические характеристики штаммов K. sucrofermentans Н 110 (ВКПМ B-11267) (1), K. hansenii С 110 (ВКПМ В-12950) (2) в сравнении с типовыми штаммами G. sucrofermentans LMG 18788T (=JCM 9730T = DSM 15973T) (3) (Cleenwerck et al., 2010), K. hansenii LMG 1527T (=NBRC 14820T = = NCIB 8745T = DSM 5602T = ATCC 35959) (4) (Cleenwerck et al., 2009) и K. hansenii GH-1/2008 (ВКПМ В-10547) (5) (Патент РФ № 2464307, 2012), K. xylinus В-12068 (6) (Патент РФ № 2568605, 2015; Volova et al., 2018)
| Фенотипические характеристики |
1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|
| Размер клеток, мкм | 0.6–1.2 × 1.0–3.0 | 0.5–1.2 × 1.0–3.0 | 0.6–0.8 × 1.0–1.2 | 0.5–0.8 × 1.0–1.5 | 0.6–1.2 × 1.0–3.0 | 0.4–0.6 × 1.0–1.5 |
| Диапазон рН для роста | 3–7 | 3–7 | 3–7 | 3–7 | 2.5–6.5 | 2.5–6.5 |
| рНопт | 4–6 | 4–6 | 4–6 | 4–6 | 4–6 | 3.5–4.5 |
| Диапазон температуры роста, °С | 6–37 | 6–37 | 28–37 | 25–35 | 20–37 | |
| Топт, °С | 28–30 | 28–30 | 28–30 | 28–30 | 28–30 | 28–30 |
| Источники углерода: | ||||||
| D-глюкоза | + | + | + | + | + | + |
| фруктоза | + | + | + | + | ||
| сахароза | + | + | + | – | + | + |
| лактоза | + | + | ± | + | ||
| мальтоза | + | + | + | + | + | |
| D-ксилоза | + | + | ± | + | ||
| D-галактоза | + | + | + | – | ||
| арабиноза | + | + | ||||
| лактат | + | + | ||||
| ацетат | + | + | ||||
| цитрат | + | + | + | |||
| маннит | + | + | + | – | ||
| глицерин | + | + | + | ± | ||
| этанол | + | + | + | |||
| Рост в присутствии 30% глюкозы | + | + | ± | – | ||
| Рост в отсутствии уксусной кислоты | + | + | + | + | ||
| Рост в присутствии 0.35% уксусной кислоты | + | + | + | + | ||
| Рост в присутствии 5% уксусной кислоты | – | – | – | – | – | – |
| Рост в присутствии 3% этанола | + | + | – | + | ||
| Г + Ц в ДНК, мол. % | 60.5 | 59.3 | 62.7 | 62 |
Максимальное количество БЦ образовывалось при температуре 30°С и составляло для штаммов Н 110 и С 110, соответственно, 2.19 ± 0.08 и 1.76 ± ± 0.07 г/л на 3-и сут культивирования в динамических условиях на стандартной среде HS с глюкозой.
В качестве источников углерода и энергии штаммы Н 110 и С 110 использовали глюкозу, фруктозу, сахарозу, лактозу, мальтозу, ксилозу, галактозу, арабинозу, лактат, ацетат, цитрат, маннит, глицерин, этанол. Наилучшими источниками углерода в составе среды HS для роста штаммов Н 110 и С 110 и образования БЦ служили глюкоза, фруктоза, глицерин и маннит (табл. 2). Максимальное количество БЦ образовывалось штаммами Н 110 и С 110 на среде с фруктозой (2.62 ± 0.03 и 2.55 ± 0.03 г/л соответственно) и глицерином (2.5 ± 0.1 и 2.22 ± 0.02 г/л соответственно) за 3 сут культивирования в динамических условиях. На средах с сахарозой и лактозой образование БЦ было наименьшим.
Таблица 2.
Образование БЦ штаммами K. sucrofermentans Н 110 и K. hansenii С 110
| Среда культивирования | Способ и время культивирования | Выход БЦ, г/л | |
|---|---|---|---|
| K. sucrofermentans Н 110 | K. hansenii С 110 | ||
| HS с глюкозой (2%) | Динамический, 3 сут | 2.19 ± 0.08 | 1.76 ± 0.07 |
| Статический, 5 сут | 1.8 ± 0.1 | 1.46 ± 0.05 | |
| HS с фруктозой (2%) | Динамический, 3 сут | 2.62 ± 0.03 | 2.55 ± 0.03 |
| HS с глицерином (2%) | Динамический, 3 сут | 2.5 ± 0.1 | 2.22 ± 0.02 |
| HS с маннитом (2%) | Динамический, 3 сут | 2.2 ± 0.1 | 1.8 ± 0.1 |
| HS с этанолом (2%) | Динамический, 3 сут | 1.34 ± 0.03 | 1.45 ± 0.03 |
| HS с сахарозой (2%) | Динамический, 3 сут | 0.93 ± 0.02 | 0.78 ± 0.02 |
| HS с лактозой (2%) | Динамический, 3 сут | 0.75 ± 0.04 | 0.77 ± 0.04 |
| Меласса | Динамический, 3 сут | 2.96 ± 0.06 | 2.37 ± 0.02 |
| Статический, 5 сут | 2.2 ± 0.1 | 1.96 ± 0.06 | |
| Статический, 14 сут | 8.2 ± 0.2 | 8.1 ± 0.2 | |
| Барда | Динамический, 3 сут | 6.2 ± 0.2 | 6.0 ± 0.1 |
| Статический, 5 сут | 3.3 ± 0.02 | 2.87 ± 0.06 | |
| Статический, 14 сут | 9.5 ± 0.1 | 9.2 ± 0.1 | |
Бактерии окисляют этанол до уксусной кислоты, ацетат и лактат – до СО2 и H2О. Оба организма каталазоположительные, оксидазоотрицательные. Желатину не разжижают, крахмал не гидролизуют, нитраты не восстанавливают; индол и сероводород не образуют. Бактерии растут в присутствии повышенных концентраций глюкозы (30%), в присутствии 5% этанола, не нуждаются в уксусной кислоте для роста, но растут в ее присутствии. Образуют кислоты на различных сахарах и спиртах (маннит, глицерин, этанол), но не на сахарозе. Наибольшее снижение значений pH происходит на среде с глюкозой – с 6.0 до 3.1 ± 0.1 за 3 сут культивирования в динамических условиях. Так же значительное снижение pH наблюдается на среде с этанолом – с 6.0 до 3.4 ± 0.1 за 3 сут культивирования в динамических условиях. При использовании в качестве источников углерода фруктозы и глицерина происходит меньшее закисление среды – значение рН снижается с 6.0 до 5.3 ± 0.1 за 3 сут культивирования в динамических условиях.
Штаммы способны образовывать значительное количество БЦ на средах с дешевыми отходами пищевой промышленности, такими как меласса и барда. Максимальное количество БЦ образуется штаммами Н 110 и С 110 на послеспиртовой барде – 9.5 ± 0.1 и 9.2 ± 0.1 г/л соответственно за 14 сут культивирования в статических условиях (табл. 2). Также значительное образование БЦ отмечено на среде с мелассой – 8.2 ± 0.2 и 8.1 ± 0.2 г/л за 14 сут культивирования в статических условиях штаммами Н 110 и С 110 соответственно.
Содержание жирных кислот (ЖК). Состав жирных кислот липидов мембран клеток штаммов Н 110 и С 110 (в % от суммы) представлен в табл. 3. Основными жирными кислотами у выделенных штаммов были С16:0 и С18:1ω7с. Полученные результаты согласуются с литературными данными, согласно которым эти жирные кислоты преобладали у типовых штаммов G. sucrofermentans LMG 18788T (12.2 и 66.7%) и G. xylinus JCM 7644 T (23.1 и 67.4%) (Iino, 2012).
Таблица 3.
Состав жирных кислот штаммов K. sucrofermentans Н 110 (ВКПМ B-11267) (1), K. hansenii С 110 (ВКПМ В-12950) (2) в сравнении с типовыми штаммами G. sucrofermentans LMG 18788T (=JCM 9730T = DSM 15973T) (3) (Iino et al., 2012), G. xylinus JCM 7644T (4) (Iino et al., 2012) (% от суммы ЖК)
| Жирная кислота | Символ | 1 | 2 | 3 | 4 |
|---|---|---|---|---|---|
| Декановая | С10:0 | 5.06 | 9.79 | 1.7 | ‒ |
| Додекановая | С12:0 | 1.45 | 6.62 | ‒ | ‒ |
| Тетрадекановая | С14:0 | 1.25 | 2.27 | 7.8 | 3.8 |
| Гексадекановая | C16:0 | 21.47 | 27.2 | 12.2 | 23.1 |
| 9-Гексадеценовая | С16:1ω7с | 4.85 | 2.26 | ||
| Октадекановая | С18:0 | 1.67 | 1.43 | 1.2 | 4.1 |
| 11-Октадеценовая | С18:1ω7с | 64.28 | 50.43 | 66.7 | 67.4 |
Молекулярно-генетические исследования. Содержание Г + Ц в ДНК штаммов Н 110 и С 110 составляло 60.5 и 59.3 мол. % соответственно. У типовых штаммов G. sucrofermentans LMG 18788T (=JCM 9730T = DSM 15973T) и K. hansenii LMG 1527T (=NBRC 14820T = NCIB 8745T = DSM 5602T = = ATCC 35959) содержание Г + Ц в ДНК составляло 62.7 и 62 мол. % соответственно(Cleenwerck et al., 2009, 2010).
Штаммы продуценты идентифицированы до вида с помощью анализа 16S РНК. При секвенировании вариабельных участков генов, кодирующих 16S рРНК, получена собранная нуклеотидная последовательность для каждого штамма. Последовательности были выровнены с соответствующими последовательностями ближайших видов бактерий, доступными из базы данных GenBank. Наиболее близкий уровень сходства по гену 16S рРНК штамм Н 110 продемонстрировал с типовым штаммом вида Gluconacetobacter (Komagataeibacter) sucrofermentans – 98.3%. По данным анализа генов, кодирующих 16S рРНК, штамм С 110 наиболее близок к виду Komagataeibacter hansenii – 99%.
ОБСУЖДЕНИЕ
Выделено два новых штамма-продуцента бактериальной целлюлозы из симбиотических сообществ “Чайный гриб” и “Индийский рис”.
По литературным данным известно, что общее количество видов в составе микрофлоры “Чайного гриба” может превышать 22, в число которых входят уксуснокислые бактерии семейства Acetobacteraceae, молочнокислые бактерии рода Lactobacillus, а также дрожжевые грибы Zygosaccharomyces spp., Saccharomyces spp., Dekkera spp., Pichia spp. (De Filippis et al., 2018). Выше уже отмечалось, что из симбиотического сообщества “Чайный гриб” ранее были выделены такие виды продуцентов БЦ как G. hansenii (Патент РФ № 2464307, 2012), K. xylinus (Патент РФ № 2568605, 2015; Volova, 2018), K. rhaeticus (Патент ЕАПВ № 201700517, 2017; Semjonovs et al., 2017), K. intermedius (dos Santos et al., 2014). Нами впервые из данного сообщества выделен вид K. sucrofermentans. Типовой штамм G. sucrofermentans LMG 18788T (=JCM 9730T = DSM 15973T) был выделен из ягод черешни (Cleenwerck et al., 2010). Этот штамм образует значительное количество целлюлозы на среде с сахарозой в динамических условиях.
Согласно литературным данным микрофлора “Индийского риса” представлена, в основном, молочнокислыми бактериями Lactobacillaceae, Leuconostocaceae, а также представителями семейств Bifidobacteriaceae, Clostridiaceae, Acetobacteriaceae и дрожжевыми грибами (Fels et al., 2018). Типовой штамм K. hansenii LMG 1527T (=NBRC 14820T = NCIB 8745T = DSM 5602T = ATCC 35959) выделен из уксуса (Cleenwerck et al., 2009).
Выделенные нами штаммы идентифицированы на основании анализа 16S РНК, морфологических, биохимических и физиологических характеристик как Komagataeibacter sucrofermentans Н 110 и Komagataeibacter hansenii С 110 и депонированы в ВКПМ под номерами K. sucrofermentans ВКПМ B-11267 и K. hansenii ВКПМ В-12950.
Штаммы K. sucrofermentans Н 110 и K. hansenii С 110 проявили сходство по большинству признаков с типовыми штаммами G. sucrofermentans LMG 18788T (=JCM 9730T = DSM 15973T) (Cleenwerck et al., 2010) и K. hansenii LMG 1527T (=NBRC 14820T = NCIB 8745T = DSM 5602T = ATCC 35959) (Cleenwerck et al., 2009), а так же штаммами, выделенными из симбиотического сообщества “Чайный гриб”, K. hansenii GH-1/2008 (ВКПМ В‑10547) (Патент РФ № 2464307, 2012) и K. xylinus В-12068 (Патент РФ № 2568605, 2015; Volova, 2018). Однако в отличие от наших штаммов, G. hansenii GH-1/2008 не растет на среде с 3% этанола (Патент РФ № 2464307, 2012). Этанол в концентрации 0.3‒1.5% для данного штамма является стимулятором синтеза целлюлозы, но при концентрации спирта выше 2% процесс образования БЦ прекращается. Кроме того, штамм G. hansenii GH-1/2008 плохо растет на плотных питательных средах, образует колонии только на полужидких питательных средах с содержанием агара в плотной среде не выше 1.5% (Патент РФ № 2464307, 2012). Штамм K. xylinus В-12068, в отличие от наших штаммов, не растет в присутствии 30% D-глюкозы, но образует максимальное количество БЦ при добавлении в среду 3% этанола (Патент РФ № 2568605, 2015; Volova et al., 2018).
Температура является важным фактором, влияющим на рост штаммов-продуцентов и на синтез БЦ. Согласно литературным данным, максимальный выход целлюлозы достигался при 28–30°C; температурный минимум для бактерий составлял 6–10°C, температурный максимум – 35–45°C (Coban, Biyik, 2011). Штаммы K. sucrofermentans Н 110 и K. hansenii С 110 также росли в пределах температур 6–37°С с оптимумом роста при 28–30°С и в диапазоне рН 3–7 с оптимумом при значениях 4–6.
По литературным данным, БЦ образуется в широком диапазоне рН – от 4.0 до 7.0 (Coban, Biyik, 2011). Оптимальное значение рН для роста продуцентов и образования БЦ зависит в первую очередь от используемого штамма и среды культивирования. Уксуснокислые бактерии устойчивы к низким значениям рН. Оптимальное значение рН для биосинтеза целлюлозы бактерией K. xylinus B-12068 находится в диапазоне 3.6–4.0 (Volova et al., 2018). Максимальный выход БЦ на стандартной среде HS составляет 2.73 г/л при pH 3.6. Для продуцента K. medellinensis, выделенного из уксуса, максимальный выход БЦ (4.5 г/л) наблюдается при рН среды 3.5 (Castro et al., 2012).
Ранее нами было показано, что при культивировании штамма K. sucrofermentans B-11267 на среде HS с глюкозой в течение первых суток происходит резкое понижение значений рН с 6 до 4 в результате образования из глюкозы глюконовой кислоты под действием фермента дегидрогеназы (Revin et al., 2018). При культивировании бактерии K. sucrofermentans B-11267 на фильтрате послеспиртовой барды и молочной сыворотке наблюдается обратный процесс: происходит понижение кислотности среды, что вероятно связано с потреблением органических кислот (Revin et al., 2018). При этом максимальное количество БЦ на среде с бардой образуется при начальном значении рН 3.95 (6.19 г/л), а на среде HS с глюкозой – при начальном значении рН 6.0 (2.19 г/л) за 3 сут культивирования в динамических условиях.
Наилучшими источниками углерода в составе среды HS для роста штаммов K. sucrofermentans Н 110 и K. hansenii С 110 и образования целлюлозы служат глюкоза, фруктоза, глицерин и маннит. На средах с сахарозой и лактозой образуется наименьшее количество БЦ. Согласно литературным данным, типовой штамм K. sucrofermentans LMG 18788T (=JCM 9730T = DSM 15973T) образует за 15 сут культивирования в статических условиях на среде HS с глюкозой, фруктозой, сахарозой, лактозой, ксилозой и глицерином 1.2, 2.06, 4.9, 1.6, 1.7, и 3.2 г/л БЦ соответственно (Tsouko et al., 2015). Типовой штамм K. hansenii LMG 1527T (=NBRC 14820T = NCIB 8745T = DSM 5602T =ATCC 35959) не растет в среде с сахарозой (Cleenwerck et al., 2009). По данным российских ученых (Volova et al., 2018) выход БЦ, образуемой бактерией K. xylinus B-12068 на 7 сут культивирования в статических условиях в колбах при начальном значении рН 6.0, составляет в среде с глюкозой, сахарозой и галактозой 2.2, 1.6 и 1.4 г/л соответственно. Штамм K. hansenii GH-1/2008 ВКПМ В-10547 лучше образует БЦ на среде, содержащей сахарозу, чем на среде, содержащей глюкозу (Патент РФ № 2464307, 2012). При культивировании в течение 7 сут на среде HS с глюкозой биомасса сухой пленки БЦ составляет 2.17 г/л, а на среде с сахарозой (30 г/л) – 5.57 г/л.
Важной проблемой в получении БЦ является использование дорогих питательных сред. Известно, что около 30% от общей стоимости процесса составляет стоимость питательной среды. Для культивирования продуцентов БЦ используют среды, в состав которых входят источники углерода (глюкоза, сахароза, фруктоза, глицерин), азота (дрожжевой экстракт, пептон), фосфора, микроэлементы и биологически активные вещества. С целью удешевления процесса биосинтеза БЦ выгоднее использовать среды, состоящие из отходов промышленности и сельского хозяйства, например мелассы, барды, молочной сыворотки, фруктовых соков и т.д. Одновременно решается вопрос, связанный с утилизацией этих отходов.
Штаммы K. sucrofermentans Н 110 и K. hansenii С 110 характеризуются способностью образовывать значительное количество БЦ на средах с дешевыми отходами пищевой промышленности, такими как меласса (8.2 ± 0.2 и 8.1 ± 0.2 г/л) и барда (9.5 ± 0.1 и 9.2 ± 0.1 г/л).
Барда образуется в значительном количестве как отход спиртового производства. Она содержит практически все питательные вещества, присущие исходному сырью: протеины, жиры, клетчатку, безазотистые экстрактивные вещества, включая несброженные сахара и крахмал. В настоящее время исследователями изучается возможность использования барды для увеличения выхода БЦ (Wu, Liu, 2013; Revin et al., 2018). Органические кислоты положительно влияют на образование БЦ, вследствие чего богатая ими барда используется для увеличения выхода целлюлозы. Например, Wu и Liu при статическом культивировании G. xylinus в течение 7 сут на среде с рисовой бардой получили выход БЦ 6.26 г/л (Wu, Liu, 2013).
Меласса представляет собой побочный продукт конечной стадии кристаллизации в процессе производства сахара и является одним из наиболее экономичных источников углерода в микробиологической промышленности. Меласса содержит до 80% сухих веществ, из которых около 48% представлено сахарозой. Также в мелассе содержатся аминокислоты, органические кислоты и их соли, бетаин, минеральные вещества и витамины. Известно о получении БЦ в количестве 5.3 г/л на среде с мелассой штаммом A. xylinum BPR2001 в биореакторе после ее термокислотной обработки (Bae, Shoda, 2004).
Таким образом, в ходе исследований получены новые высокопродуктивные штаммы, способные образовывать на средах с отходами пищевой промышленности до 8.0–9.5 г/л бактериальной целлюлозы. Одновременно решается вопрос, связанный с утилизацией этих отходов. Впервые вид K. sucrofermentans выделен из симбиотического сообщества “Чайный гриб”. Также впервые штамм-продуцент бактериальной целлюлозы выделен из симбиотического сообщества “Индийский рис”. Несмотря на то, что бактерии K. sucrofermentans Н 110 и K. hansenii С 110 выделены из различных источников и являются представителями различных видов, они имеют ряд схожих фенотипических характеристик, свойственных представителям рода Komagataeibacter, и отличаются по ряду признаков от типовых штаммов и других представителей рода.
Список литературы
Нетрусов А.И., Егорова М.А., Захарчук Л.М. и др. Практикум по микробиологии: Учеб. пособие для студ. высш. учеб. заведений. М.: Издательский центр “Академия”, 2005. 608 с.
Пaтeнт PФ. 2012. № 2464307.
Пaтeнт PФ. 2015. № 2568605.
Патент ЕАПВ. 2017. № 201700517.
Ревин В.В., Лияськина Е.В., Пестов Н.А. Получение бактериальной целлюлозы и нанокомпозиционных материалов. Саранск: Изд-во Мордовcкого ун-та, 2014. 128 с.
Bae S., Shoda M. Bacterial cellulose production by fed-batch fermentation in molasses medium // Biotechnol. Prog. 2004. V. 20. P. 1366–1371.
Castro C., Zuluaga R., Álvarez C., Putaux J.-L., Caro G., Rojas O.J., Mondragon I., Gañán P. Bacterial cellulose produced by a new acid-resistant strain of Gluconacetobacter genus // Carbohydr. Polym. 2012. V. 89. P. 1033–1037.
Cleenwerck I., De Wachter M., González A., De Vuyst L., De Vos P. Differentiation of species of the family Acetobacteraceae by AFLP DNA fingerprinting: Gluconacetobacter kombuchae is a later heterotypic synonym of Gluconacetobacter hansenii // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 1771–1786.
Cleenwerck I., De Vos P., De Vuyst L. Phylogeny and differentiation of species of the genus Gluconacetobacter and related taxa based on multilocus sequence analyses of housekeeping genes and reclassification of Acetobacter xylinus subsp. sucrofermentans as Gluconacetobacter sucrofermentans (Toyosaki et al. 1996) sp. nov., comb. nov. // Int. J. Syst. Evol. Microbiol. 2010. V. 60. P. 2277–2283.
Coban E.P., Biyik H. Evaluation of different pH and temperatures for bacterial cellulose production in HS medium and beet molasses medium // African J. Microbial. Res. 2011. V. 5. P. 1037–1045.
Dellaglio F., Cleenwerck I., Felis G.E. Description of Gluconacetobacter swingsii sp. nov. and Gluconacetobacter rhaeticus sp. nov., isolated from Italian apple fruit // Int. J. Syst. Evol. Microbiol. 2005. V. 55. P. 2365–2370.
De Filippis F., Troise A.D., Vitaglione P., Ercolini D. Different temperatures select distinctive acetic acid bacteria species and promotes organic acids production during Kombucha tea fermentation // Food Microbiol. 2018. V. 73. P. 11–16.
Dos Santos R.A., Berretta A.A., Barud Hda S., González-García L.N., Zucchi T.D., Goldman G.H., Riaño-Pachón D.M. Draft genome sequence of Komagataeibacter intermedius strain AF2, a producer of cellulose, isolated from Kombucha tea // Genome Announc. 2015. V. 3. P. e01404–e01415.
Iino T., Suzuki R., Tanaka N., Kosako Y., Ohkuma M., Komagata K., Uchimura T. Gluconacetobacter kakiaceti sp. nov., an acetic acid bacterium isolated from a traditional Japanese fruit vinegar // Int. J. Syst. Evol. Microbiol. 2011. V. 62. P. 1465–1469.
Iyer P.R., Geib S.M., Catchmark J., Kao T.H., Tien M. Genome sequence of a cellulose-producing bacterium, Gluconacetobacter hansenii ATCC 23769 // J. Bacteriol. 2010. V. 192. P. 4256–4257.
Jahan F., Kumar V., Rawat G., Saxena R.K. Production of microbial cellulose by a bacterium isolated from fruit // Ap-pl. Biochem. Biotechnol. 2012. V. 167. P. 1157–1171.
Fels L., Jakob F., Vogel R.F., Wefers D. Structural characterization of the exopolysaccharides from water kefir // Carbohydr. Polym. 2018. V. 189. P. 296–303.
Florea M., Reeve B., Abbott M., Freemont P.S., Ellis T. Genome sequence and plasmid transformation of the model high-yield bacterial cellulose producer Gluconacetobacter hansenii ATCC 53582 // Sci. Rep. 2016. V. 6. P. 1–9.
Heath L.S., Sloan G.L., Heath H.E. A simple and generally applicable procedure for releasing DNA from bacterial cells // Appl. Environ. Microbiol. 1986. V. 51. P. 1138‒1140.
Hestrin S., Schramm M. Synthesis of cellulose by Acetobacter xylinum. II. Preparation of freeze-dried cells capable of polymerizing glucose to cellulose // Biochem. J. 1954. V. 58. P. 345–352.
Kim S.Y., Kim J.N., Wee Y.J., Park D.H., Ryu H.W. Production of bacterial cellulose by Gluconacetobacter sp. RKY5 isolated from persimmon vinegar // Appl. Biochem. Biotechnol. 2006. V. 131. P. 705–715.
Kim S.S., Lee S.Y., Park K.J., Park S.M., An H.J., Hyun J.M., Choi Y.H. Gluconacetobacter sp. gel_SEA623-2, bacterial cellulose producing bacterium isolated from citrus fruit juice // Saudi J. Biol. Sci. 2017. V. 24. P. 314–319.
Kubiak K., Kurzawa M., Jędrzejczak-Krzepkowska M., Ludwicka K., Krawczyk M., Migdalski A., Kacprzak M.M., Loska D., Krystynowicz A., Bielecki S. Complete genome sequence of Gluconacetobacter xylinus E25 strain ‒ valuable and effective producer of bacterial nanocellulose // J. Biotechnol. 2014. V. 176. P. 18–19.
Liu M., Liu L., Jia S., Li S., Zou Y., Zhong C. Complete genome analysis of Gluconacetobacter xylinus CGMCC 2955 for elucidating bacterial cellulose biosynthesis and metabolic regulation // Sci. Rep. 2018. V. 8. P. 6266.
Liyaskina E., Revin V., Paramonova E, Nazarkina M., Pestov N., Revina N., Kolesnikova S. Nanomaterials from bacterial cellulose for antimicrobial wound dressing // J. Phys.: Conf. Ser. 2017. V. 784. P. 012034.
Ogino H., Azuma Y., Hosoyama A., Nakazawa H., Matsutani M., Hasegawa A., Otsuyama K., Matsushita K., Fujita N., Shirai M. Complete genome sequence of NBRC 3288, a unique cellulose-nonproducing strain of Gluconacetobacter xylinus isolated from vinegar // J. Bacteriol. 2011. V. 193. P. 6997–6998.
Revin V., Liyaskina E., Nazarkina M., Bogatyreva A., Shchankin M. Cost-effective production of bacterial cellulose using acidic food industry by-products // Braz. J. Microbiol. 2018. V. 49. P. 151–159.
Ryngajłło M., Kubiak K., Jędrzejczak-Krzepkowska M., J-acek P., Bielecki S. Comparative genomics of the Komagataeibacter strains ‒ Efficient bionanocellulose producers // Microbiol. Open. 2018. P. e00731.
Semjonovs P., Ruklisha M., Paegle L., Saka M., Treimane R., Skute M., Rozenberga L., Vikele L., Sabovics M., Cleenwerck I. Cellulose synthesis by Komagataeibacter rhaeticus strain P 1463 isolated from Kombucha // Appl. Microbiol. Biotechnol. 2017. V. 101. P. 1003–1012.
Volova T.G., Prudnikova S.V., Sukovatyi A.G., Shishatskaya E.I. Production and properties of bacterial cellulose by the strain Komagataeibacter xylinus B-12068 // Appl. Microbiol. Biotechnol. 2018. V. 102. P. 7417–7428.
Wu J.M., Liu R.H. Cost-effective production of bacterial cellulose in static cultures using distillery wastewater // J. Biosci. Bioeng. 2013. V. 115. P. 284–290.
Yamada Y., Yukphan P. Genera and species in acetic acid bacteria // Int. J. Food Microbiol. 2008. V. 125. P. 15–24.
Yamada Y., Yukphan P., Vu H.T.L., Muramatsu Y., Ochaikul D., Nakagawa Y. Subdivision of the genus Gluconacetobacter Yamada, Hoshino and Ishikawa 1998: the proposal of Komagatabacter gen. nov., for strains accommodated to the Gluconacetobacter xylinus group in the α-Proteobacteria // Ann. Microbiol. 2012. V. 62. P. 849–859.
Yamada Y. Transfer of Gluconacetobacter kakiaceti, Gluconacetobacter medellinensis and Gluconacetobacter maltacetito the genus Komagataeibacter as Komagataeibacter kakiaceti comb. nov., Komagataeibacter medellinensis comb. nov. and Komagataeibacter maltaceti comb. nov. // Int. J. Syst. Evol. Microbiol. 2014. V. 64. P. 1670–1672.
Zhang H., Xu X., Chen X., Yuan F., Sun B., Xu Y., Sun D. Complete genome sequence of the cellulose-producing strain Komagataeibacter nataicola RZS01 // Sci. Rep. 2017. V. 7. P. 4431.
Дополнительные материалы отсутствуют.