Микробиология, 2020, T. 89, № 1, стр. 74-87
Функциональная активность гуминовых веществ в пролонгировании выживания популяции углеводородокисляющей бактерии Acinetobacter junii
Ю. А. Николаев a, *, Н. Г. Лойко a, Е. В. Демкина a, Е. А. Атрощик c, А. И. Константинов b, И. В. Перминова b, Г. И. Эль-Регистан a
a Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
119071 Москва, Россия
b Московский государственный университет им. М.В. Ломоносова, химический факультет
119991 Москва, Россия
c Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Россия
* E-mail: nikolaevya@mail.ru
Поступила в редакцию 05.06.2019
После доработки 23.07.2019
Принята к публикации 29.09.2019
Аннотация
Предложен новый подход к повышению количества жизнеспособных клеток в длительно хранящихся популяциях (культурах) углеводородокисляющей бактерии Acinetobacter junii, основанный на применении препаратов гуминовых веществ (ГВ). ГВ образуются как продукты конденсации и окисления фенольных соединений, в том числе алкилрезорцинов, обладающих активностью факторов межклеточной коммуникации микроорганизмов, проявляющих стресс-потенцирующую и антиоксидантную активность. Показано, что внесение ГВ в бактериальную культуру стационарной фазы роста приводит к увеличению численности жизнеспособности клеток (в 10‒15 раз) при хранении бакпрепаратов от 1 до 4 мес. в провокационных условиях (при доступе кислорода воздуха, в среде роста, при температуре 20‒25°С). Анализ кривых отмирания культур A. junii, как контрольных, так и опытных вариантов, выявил их бифазность с начальной фазой быстрого отмирания (0.167 lg КОЕ/мл сут), характерного для автолиза регулярных стационарных клеток, и медленного отмирания (lg 0.015 КОЕ/мл сут), свойственного клеткам-персистерам, что ранее было показано для условно-патогенных бактерий как признак, детерминирующий этот тип фенотипической гетерогенности бактериальных популяций. Определена концентрационная зависимость влияния ГВ на образование персистеров. В сравнительных экспериментах показано, что обработка стационарных культур A. junii пероксидом водорода (0.03‒0.3%) как стрессорным фактором, также стимулировала повышение численности клеток-персистеров (в 4 раза), но выживающих не более, чем 1.5‒2 мес. в отличие от вариантов с ГВ. При рассеве длительно хранящихся (2–4 мес.) культур как контрольных, так и опытных вариантов (с ГВ или Н2О2) на плотные среды отмечено изменение их диссоциативного спектра за счет замещения доминантного колониально-морфологического фенотипа минорными (40% и более), что является одним из свойств покоящихся цистоподобных форм бактерий. При этом в вариантах с ГВ и контрольных соотношение диссоциантов различалось. Сравнение химического состава препаратов ГВ позволило заключить, что на образование клеток-персистеров влияют наиболее окисленные гидрофильные ГВ, а пролонгация жизнеспособности определяется вкладом менее окисленных гуматов с более высокой антиоксидантной активностью. Таким образом, механизм действия ГВ на бактериальную популяцию заключается в: 1) индукции (повышении численности) образования клеток-персистеров; 2) пролонгации сохранения выживающими клетками колониеобразующей способности в провокационных условиях хранения; 3) влиянии на изменение диссоциативного спектра хранящихся популяций. Сформулировано положение об образовании в популяциях сапротрофных бактерий (на примере A. junii) стресс-индуцированных клеток-персистеров (П), созревающих в анабиотические покоящиеся формы, предназначенные для выживания популяции (вида). В практическом аспекте прием образования клеток-персистеров под воздействием ГВ может быть рекомендован для разработки бакпрепаратов различного назначения.
Микроорганизмы являются основой большинства биотехнологий, базирующихся на использовании как ферментов, так и собственно биомассы в процессах биодеградации ксенобиотиков, очистки почв и стоков от антропогенных загрязнений, синтеза и трансформации целевых продуктов и др. Эффективность биопрепаратов − деструкторов ксенобиотиков находится в прямой зависимости от количества жизнеспособных клеток и их каталитической (технологической) активности.
К наиболее эффективным способам сохранения жизнеспособности клеток относятся их криоконсервация, лиофилизация или L-высушивание, имеющие высокий коэффициент протекторной защиты, поскольку лишенные воды клетки при субнулевых температурах находятся в анабиотическом состоянии (Donev, 2001; Morgan et al., 2006). Другое направление стабилизации клеток включает использование способов их иммобилизации с применением биосовместимых гидрогелей (Chen, 2003; Polyak et al., 2004), инкапсулирование, например, в золи (гели) кремнезема (Meunier et al., 2010; Aukema et al., 2014). Однако эти методы мало применимы для получения биопрепаратов экологического назначения, используемых для биоремедиации загрязненных природных объектов. Основная причина – высокая себестоимость препаратов.
Наиболее часто используемой формой препаратов, применяемых для очистки почв и стоков от загрязнений (в частности, нефтяных), является концентрированная микробная биомасса, поскольку в ней изначально высока доля длительно выживающих жизнеспособных клеток. Предлагались способы хранения препаратов нефтедеструкторов при пониженных температурах (Куюкина, Ившина, 2002; Петриков, 2008), что повышает стоимость их хранения. Также обсуждалась возможность генно-инженерного создания штаммов, высокострессоустойчивых и способных к реализации процессов “самоконсервации” под воздействием определенных индуцирующих агентов (Штерншис и соавт., 2000). Работы в этом направлении – индукции процессов “самоконсервации”, представляются актуальными.
В наших предыдущих исследованиях было показано, что реализация процессов “самоконсервации” клеток микроорганизмов осуществляется путем образования цистоподобных покоящихся клеток (ЦПК) в циклах развития культур как неспорообразующих, так и спорообразующих микроорганизмов, в условиях, когда спорообразование репрессировано условиями окружения. ЦПК – это специализированные покоящиеся клетки микроорганизмов, предназначенные для выживания и сохранения вида в неблагоприятных для роста и неростовых условиях. Они характеризуются особенностями ультраструктурной организации, анабиотическим уровнем метаболизма, высокой термоустойчивостью (устойчивостью к повреждающим воздействиям), длительным сохранением жизнеспособности (КОЕ-способности). ЦПК прорастают целым спектром фенотипических диссоциантов, из которых доминантным станет наиболее приспособленный к новой среде, что позволяет популяции адаптироваться к новым условиям (Бухарин и соавт., 2005; Николаев и соавт., 2006; Эль-Регистан и соавт., 2006).
Обычно количество ЦПК в популяции не превышает долей процента. Поэтому важной фундаментальной и практической задачей является выяснение механизмов и практическое использование способов получения популяций с высокой долей ЦПК. В этом направлении исследований было показано, что факторы внеклеточной коммуникации микроорганизмов – фенольные липиды класса алкилрезорцинов (АР), обладающие функциями регуляторов клеточной плотности популяций, индуцируют развитие анабиотического состояния у клеток микроорганизмов (Эль-Регистан и соавт., 2006; Мулюкин и соавт., 2008). Механизм действия АР основан на их физико-химических взаимодействиях (водородных связях, электростатических, гидрофобных взаимодействиях) с макромолекулами клеточных биополимеров (белками, нуклеиновыми кислотами) и липидами мембран, что обусловливает изменения их структурной организации и функциональной активности (Дерябин и соавт., 2005; Николаев и соавт., 2006; Крупянский и соавт., 2012). С другой стороны, АР (в частности, гексилрезорцин) индуцируют экспрессию стрессовых регулонов (RpoS, SOS ответа) (Голод и соавт., 2009) и, следовательно, теоретически могут повышать численность субпопуляции клеток-персистеров, выживающих при повреждающих воздействиях, образование которых индуцируется стрессом (Balaban et al., 2004, 2013; Levin-Reisman et al., 2019). Важным свойством фенольных липидов является их антиоксидантная активность как ловушек активных форм кислорода (АФК) (Меньщикова и соавт., 2012; Кондратенко и соавт., 2016). Кроме того, у окисленных продуктов сохраняется высокая биологическая активность (Степаненко и соавт., 2005; El-Registan et al., 2005). Продуктами окисления фенольных липидов являются полимерные конденсированные полифенолы, к которым относятся гуминовые вещества (ГВ). С биотехнологических позиций гуматы являются перспективными реагентами ‒ дешевыми, доступными и экологически безопасными.
Целью работы было исследовать влияние ГВ 4-х коммерческих препаратов на пролонгирование выживания популяций углеводородокисляющей бактерии Acinetobacter junii и определить роль ГВ в увеличении численности выживающих клеток.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования была грамотрицательная бактерия Acinetobacter junii из коллекции культур лаборатории выживаемости микроорганизмов ФИЦ Биотехнологии РАН, способная к активному окислению углеводородов нефти и их утилизации в качестве единственного источника углерода и энергии.
Культивирование. Бактерии выращивали при 28 ± 2°С на орбитальной качалке (100 об./мин) в конических колбах объемом 250 мл, содержащих 50 мл жидкой минеральной среды К1 (Зайцев, Карасевич, 1981) состава (г/л): К2НРО4 · 3Н2О ‒ 4.0; NaH2PО4 · 2H2О ‒ 0.4; (NH4)2SО4 ‒ 0.5; MgSО4 · 7H2О ‒ 0.1; Са(NO3)2 · 4Н2О ‒ 0.01; рН 7.3; раствор микроэлементов ‒ 1 мл/л. Состав раствора микроэлементов (г/л): ЭДТА ‒ 2.50; ZnSО4 · 7Н2О ‒ 10.95; NaMoО4 · 2Н2О ‒ 0.18; FeSО4 · 7Н2О ‒ 5.0; MnSО4 · 2Н2О ‒ 1.54; CuSО4 · · Н2О ‒ 0.39; Co(NО3)2 · 6Н2О ‒ 0.24; Na2B4O7 · · 10H2O ‒ 0.17. В качестве единственного источника углерода использовали пентадекан, который добавляли после стерилизации в питательную среду (10 мл/л). Инокулят – культуру стационарной фазы роста, вносили в количестве 2% (об.).
О росте культуры судили по изменению оптической плотности при λ = 540 нм (спектрофотометр Jenway 7315, Великобритания).
Число жизнеспособных клеток (КОЕ/мл) и диссоциативный спектр популяции по колониально-морфологическим признакам определяли путем высева аликвот десятичных разведений культур на агаризованную (1.8% агара фирмы “Нelicon”) питательную среду LB (“AMRESCO”).
Схема эксперимента. Бактериальную культуру выращивали до начала стационарной фазы роста (3 сут), после чего добавляли гуматы (0.03‒3.0 г/л) или Н2О2 (0.03‒0.3%) в определенной концентрации. Затем культуры инкубировали в статическом режиме при температуре 20‒25°С в течение 4 мес. Для предотвращения высыхания культур колбы помещали в полиэтиленовые пакеты.
Элементный состав ГВ (CHN) определяли на автоматическом CHN анализаторе (Vario EL, “Elementar”).
Структурно-групповой состав ГВ определяли методом спектроскопии ЯМР 13С в растворе на спектрометре ЯМР Avance 400 (“Bruker”) с несущей частотой для ядер 13С 100 МГц. Навеску 40‒45 мг гумата растворяли в 0.6 мл 0.3 М NaOD/D2O. Раствор переносили в 5-мл ампулу для ЯМР и регистрировали спектр с использованием импульсной последовательности CPMG. Для исключения ядерного эффекта Оверхаузера, искажающего количественную информацию о распределении углерода между основными структурными группами ГВ, широкополосную развязку от протонов отключали на время регистрации сигнала спада свободной индукции. Длительность релаксационной задержки между импульсами в эксперименте ЯМР составляла 7.8 с, длительность эксперимента достигала 10 ч. Условия получения количественных спектров 13С ЯМР описаны в работе Ковалевского и соавт. (2000). Преобразование Фурье полученного спектра, умножение на спадающую экспоненту с параметром уширения lb = 100 Гц и фазирование преобразованного спектра выполняли с использованием программного обеспечения MestReC одноименной компании. Интегрирование спектров для получения количественной информации о структурно-групповом составе гуматов выполняли с помощью программного обеспечения GelTreat, разработанного А.В. Кудрявцевым (химический факультет МГУ). Пределы интегрирования составили (м.д.): 0–50 – углерод алкильных звеньев, CHn; 50–58 – углерод метокси-групп, CH3O; 58–65 – углерод алкокси-групп, CH2O; 65–90 – углерод алкокси-групп, CHO; 90–110 – углерод ацетальных групп, OCO; 110–145 – ароматический углерод, не замещенный гетероатомами, Car; 145–165 – ароматический углерод, замещенный гетероатомами, CarO; 165–185 – углерод карбоксильных групп, COO; 185–220 – углерод карбонильных групп, C=O.
Молекулярно-массовый состав ГВ определяли методом эксклюзионной хроматографии как описано ранее (Perminova et al., 1998, 2003). В качестве подвижной фазы использовали 0.03 М фосфатный буфер со значением рН 6.8. Для исследования готовили растворы гуматов концентрации ~80 мг/л в фосфатном буфере. Проба объемом 1 мл автоматически отбиралась и поступала в хроматографическую колонку (D = 0.15 см, l = 25 см), заполненную гелем Toyopearl HS-55s. Для калибровки колонки применяли полистиролсульфонаты натрия молекулярных масс 80 840, 45 100, 33 500, 15 800, 10 200 Да. Аналитический сигнал регистрировали спектрофотометрически при λ = 254 нм. Обработку хроматограмм осуществляли с применением программного обеспечения GelTreat.
Статистическая и графическая обработка результатов проведена с использованием пакета прикладных программ Excell 2010.
РЕЗУЛЬТАТЫ
Влияние ГВ на пролонгирование выживания клеток A. junii. На первом этапе исследовали влияние препарата Гумиком на численность выживающих клеток A. junii, определяя динамику отмирания культур при их хранении в провокационных условиях (доступ кислорода воздуха, при 20‒25°С, среда роста) в течение 4 мес. (рис. 1а, табл. 1S). Превышение численности выживших клеток в опытных культурах по сравнению с контрольными начинало выявляться уже через 7 сут и сохранялось на протяжении всего срока хранения культур 4 мес. (рис. 1а).
Рис. 1.
Изменение численности жизнеспособных клеток A. junii (КОЕ/мл) при длительном хранении в течение 120 сут (а) в контрольном (без ГВ) и опытных вариантах с внесением препарата Гумиком (г/л): 1 – контроль; 2 – 0.03; 3 – 0.15; 4 – 0.6; 5 – 1.5; 6 – 3.0. (б) – часть графика в укрупненном масштабе – до 30 сут; обозначения те же.
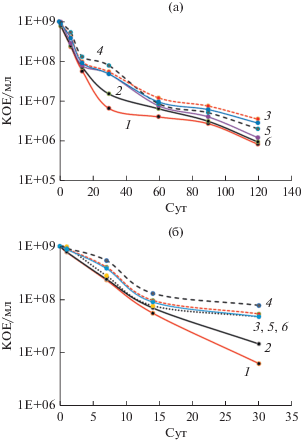
Таблица 1.
Количество жизнеспособных клеток Acinetobacter junii (КОЕ/мл) через 30 и 120 сут хранения культур в присутствии оптимальных концентраций ГВ. Данные представлены в % относительно контрольного варианта без ГВ, а также в пересчете на 1 г/л ГВ − в скобках
| Время инкубации | Гумиком, 0.6 г/л | Гумат + 7, 1.0 г/л | Гуми-20, 0.2 г/л | Сахалинский, 0.1 г/л |
|---|---|---|---|---|
| 30 сут | 1200 (2000) | 434 (434) | 1594 (7970) | 869 (8690) |
| 120 сут | 244 (407) | 561 (561) | 671 (3355) | 707 (7070) |
Отмирание контрольной культуры имело две фазы и описывалось двумя последовательными экспоненциальными кривыми с коэффициентом корреляции R2 = 0.99, что свидетельствует о гетерогенности стационарных микробных популяций, включающих субпопуляцию стационарных клеток и малочисленную субпопуляцию клеток-персистеров, что описано для популяций патогенных бактерий (Balaban et al., 2004). В период до 30 сут инкубации скорость отмирания популяции составляла 0.167 lg КОЕ/мл сут, в период от 30 до 90 сут снизилась до 0.015 lg КОЕ/мл сут, включая плато от 60 до 90 сут, после чего несколько повысилась. Субпопуляция быстро отмирающих клеток составляла около 99%, а численность выживших – около 1%, что соответствует численности персистеров в популяциях патогенных бактерий. Через 4 мес. хранения численность выживших клеток снизилась до 0.1%.
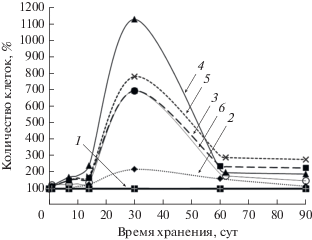
Кривые отмирания опытных культур с внесением ГВ имели аналогичный характер, но скорость отмирания в периоды до 7 сут и от 15 до 30 сут была существенно ниже, чем в контрольных вариантах (рис. 1б), что объясняется образованием значительно большего числа клеток-персистеров. Влияние ГВ на титр устойчивых к автолизу бактерий зависело от концентрации ГВ и сроков хранения культур (рис. 2). Наиболее выраженный эффект ГВ наблюдался через 1 мес. хранения, когда разница между контрольным и опытными вариантами составляла от 200% (0.03 г ГВ/л) до 1400% (0.6 г ГВ/л). На более поздних сроках инкубации (2 мес.) эта разница снижалась и затем сохранялась до конца эксперимента, составляя до 400% от контроля в вариантах с 1.5 и 3.0 г ГВ/л.
Рис. 2.
Динамика изменения численности жизнеспособных клеток A. junii (% от контроля) в вариантах с внесением препарата Гумиком (г/л): 1 – контроль; 2 – 0.03; 3 – 0.15; 4 – 0.6; 5 – 1.5; 6 – 3.0.
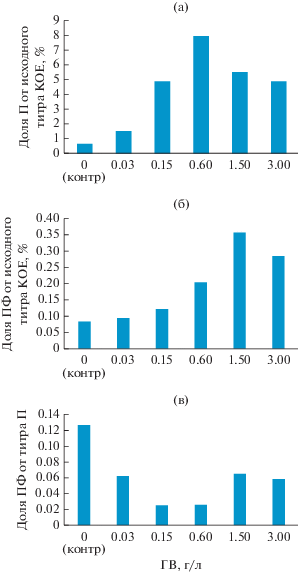
Отметим изменения в концентрационной зависимости влияния ГВ на численность выживающих клеток, наблюдаемые в процессе хранения контрольных и опытных культур (рис. 3). Если в 1-мес. культурах наиболее эффективной была концентрация 0.6 г/л (рис. 3а), то в 3-мес. культурах – 1.5 г/л (рис. 3б). Не все образовавшиеся в 1-мес. культурах формы выживания, индуцированные действием ГВ, сохраняли колониеобразующую активность при хранении: их доля в 4-мес. культурах от количества в 1-мес. культурах оказалась обратно пропорциональна величине индукции их образования под влиянием ГВ с коэффициентом корреляции – 0.78 (рис. 3в). Наиболее хорошо выживают формы, образовавшиеся в контрольных вариантах, хуже всего – в варианте с 0.6 г ГВ/л, по-видимому, вследствие приобретения состояния некультивируемости в незащищенных от внешних воздействий условиях (доступ воздуха, температура 20‒25°С). Однако абсолютное количество выживших клеток в опытных вариантах было существенно (на 400%) больше, чем в контрольных.
Рис. 3.
Удельное количество жизнеспособных клеток в опытных культурах A. junii с добавлением препарата Гумиком: a – доля персистеров (30 сут) от исходного титра КОЕ; б – доля покоящихся форм (120 сут) от исходного титра КОЕ; в – доля покоящихся форм (120 сут) от числа персистеров (30 сут).
Необходимо отметить, что по данным микроскопического анализа клетки A. junii в культурах, развивающихся в среде с пентадеканом, начиная с 14 сут и далее, были собраны в плотные агрегаты размерами 8‒12 мкм. Это обусловливает занижение результатов при определении КОЕ. Однако это свойство клеток агрегировать в стареющих культурах может иметь положительное экологическое значение, так как увеличивает шансы бактерий к выживанию и вырастанию в свежей среде за счет реализации эффектов межклеточной коммуникации (Бухарин и соавт., 2005; Олескин и соавт., 2016).
Сравнительная биологическая активность препаратов ГВ. В следующей серии экспериментов сравнивали влияние разных препаратов ГВ на численность выживающих клеток A. junii при длительном хранении в провокационных условиях. Кривые отмирания опытных культур во всех вариантах (рис. 1Sа, 1Sб, 1Sв) были идентичны кривым для препарата Гумиком: быстрое отмирание стационарных клеток на первом этапе инкубации и медленное снижение числа КОЕ-способных клеток-персистеров в процессе хранения до 120 сут. При этом во всех опытных вариантах при внесении препаратов ГВ во всех испытанных концентрациях численность жизнеспособных клеток была выше, чем в контрольных вариантах, с максимумом превышения на 30 сут инкубации (рис. 4).
Рис. 4.
Изменение численности (lg КОЕ/мл) жизнеспособных клеток A. junii и % от контроля в контрольном (1) и опытных вариантах с внесением препаратов: 2 ‒ Гумиком 0.06 г/л; 3 ‒ Гумат + 7 1 г/л; 4 ‒ Сахалинский 0.4 г/л; 5 ‒ Гуми-20 0.8% (об.) при хранении в течение: (а) – 1 мес.; (б) – 2 мес.; (в) – 3 мес.; (г) – 4 мес.
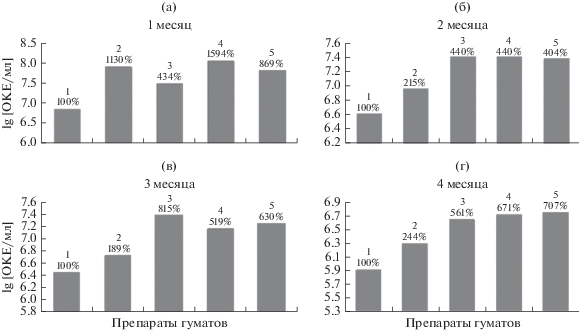
Отметим, что скорость быстрого отмирания стационарных клеток в вариантах использования трех препаратов ГВ ‒ Гумиком, Сахалинский и Гуми-20, замедлилась через 1.5 мес. инкубации, а при использовании препарата Гумат + 7 – через 1 мес. инкубации (рис. 1а; 1Sа, 1Sб, 1Sв), что коррелирует с численностью образовавшихся клеток-персистеров (рис. 4а), однако при дальнейшем хранении препарат Гумиком показал сравнительно плохие результаты (рис. 4б‒4г). В пересчете на 1 г активного вещества большей активностью обладали препараты Гуми-20 и Сахалинский (табл. 1). Таким образом, целевая активность препаратов ГВ варьирует: для краткосрочного хранения при высоком титре образующихся клеток-персистеров (30 сут инкубации) наиболее эффективны были препараты Гумиком и Гуми-20, а для пролонгирования выживания – препараты Гумат + 7, Гуми-20 и Сахалинский.
Использованные в работе препараты ГВ различались по химическому составу. В табл. 2 и 3 представлены данные структурно-группового (по данным спектроскопии ЯМР 13С) и молекулярно-массового (по данным эксклюзионной хроматографии) состава препаратов ГВ. Распределение углерода по основным структурным фрагментам ГВ отражает удельную долю групп, различающихся функциональной активностью.
Таблица 2.
Структурно-групповой состав исследованных гуматов, по данным спектроскопии 13С ЯМР
| Гумат | Распределение углерода по основным структурным фрагментам ГВ, % | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| CHn | CH3O | CH2O | CHO | OCO | Car | CarO | COO | C=O | |
| Гумат + 7 | 12.7 | 2.5 | 1.7 | 2.2 | 4.0 | 44.5 | 13.0 | 13.5 | 5.9 |
| Гумиком | 18.4 | 2.4 | 2.3 | 4.4 | 5.5 | 30.7 | 8.6 | 19.0 | 8.9 |
| Сахалинский | 11.4 | 1.5 | 1.3 | 3.6 | 4.5 | 41.8 | 10.5 | 19.4 | 6.0 |
Таблица 3.
Молекулярно-массовый состав исследованных гуматов по данным эксклюзионно-хроматографического исследования
| Гумат | Молекулярные массы, кДа | Полидисперсность Mw/Mn |
Выход с колонки, % | ||
|---|---|---|---|---|---|
| Mp | Mw | Mn | |||
| Гумат + 7 | 11.8 | 10.2 | 2.0 | 5.1 | 41 |
| Гуми20 | 17.1 | 19.9 | 4.2 | 4.7 | 41 |
| Сахалинский | 8.0 | 12.0 | 3.2 | 3.8 | 69 |
Препарат Гумиком отличался большим количеством алкильных, алкокси-, карбоксильных и карбонильных групп; низким содержанием ароматического углерода, как замещенного, так и не замещенного гетероатомами. Такие характеристики характерны для более окисленных ГВ. Препараты Гумат + 7 и Сахалинский, напротив, имели существенно меньшее число алкильных групп, высокое содержание ароматического углерода и низкое содержание карбонильных групп, что характеризует их как более восстановленные, обладающие антиоксидантными свойствами. Анализ полученных результатов позволяет сделать заключение: стресс-индуцирующая активность, ответственная за образование в стационарных культурах клеток-персистеров, ассоциирована с окисленными гуматами, а протекторная длительность хранения выживающих клеток определяется вкладом менее окисленных компонентов, обладающих более высокой антиоксидантной активностью.
Роль гуминовых веществ в выживании бактериальных культур. Как было показано ранее в работах с условно-патогенными бактериями (Lewis, 2010; Balaban et al., 2004, 2019) и сапротрофными бактериями (Эль-Регистан и соавт., 2006; Мулюкин и соавт., 2012, 2014, 2015; Лойко и соавт., 2015), образование специализированных клеток, предназначенных для выживания популяции в неблагоприятных для роста условиях, индуцируется стрессорными воздействиями – голоданием, критическим повышением клеточной плотности культур, что всегда имеет место и не зависит от состава среды, а также вызывается воздействием неблагоприятных факторов среды, приводящих к развитию стресса, например окислителей. Мы считаем, что ГВ выполняют роль сигналов стресса.
Для сравнительного анализа действия ГВ как стрессоров, индуцирующих образование выживающих форм, был использован окислительный стресс, вызываемый внесением в культуру пероксида водорода, который быстро разлагается и не влияет на бактериальные клетки при пролонгированной инкубации. Пероксид водорода вносили в предстационарную культуру A. junii (1.2 × 109 КОЕ/мл) в концентрациях 0.03, 0.15 и 0.3%. В ходе эксперимента наблюдали достоверное повышение титра жизнеспособных клеток в опытных вариантах с 0.03 и 0.15% Н2О2 при хранении культур в течение 2 мес. (соответственно, 400 и 340% от контроля) (табл. 2S). При этом Н2О2 в концентрации 0.3% вызывал сравнительное с контролем и вариантами Н2О2 в концентрациях 0.15 и 0.3% снижение численности КОЕ в течение 3 нед. после внесения. В период 1‒2 мес. хранения численность КОЕ во всех опытных вариантах была выше контрольных и затем снижалась. Наибольшая доля сохранивших жизнеспособность клеток от числа форм, образование которых было индуцировано окислительным стрессом (1 сут – 100%), отмечена в вариантах с 0.15 и 0.3% Н2О2 (табл. 3S), где наблюдался частичный автолиз клеток в 1‒7 сут после внесения Н2О2. Влияние автолиза как стадии, необходимой для созревания выживающих клеток, предназначенных для сохранения популяции, было отмечено нами ранее (Эль-Регистан и соавт., 2006) и подтверждено в настоящем исследовании.
Кривые падения жизнеспособности клеток в культурах с развитием окислительного стресса, индуцированного внесением Н2О2 (рис. 5), принципиально не отличались от кривых отмирания культур с внесением ГВ: отмечалась такая же двухфазность отмирания клеток в контрольных и опытных вариантах и достоверное превышение численности выживающих клеток в 1‒2 мес. опытных культурах (до 400%). Отличие в экспериментах с Н2О2 и ГВ заключалось в быстрой потере колониеобразующей способности формами, образование которых было индуцировано окислительным стрессом: их численность не превышала контрольного уровня уже к 3 мес. хранения (рис. 6).
Рис. 5.
Количество жизнеспособных клеток A. junii (КОЕ/мл) в вариантах с добавлением в культуру стационарной фазы роста H2O2 (%): 1 – контроль; 2 – 0.03; 3 – 0.015; 4 – 0.3.
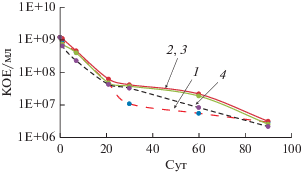
Рис. 6.
Динамика изменения количества жизнеспособных клеток A. junii (в % от контроля) в вариантах с внесением H2O2: 1 – контроль; 2 – 0.03%; 3 – 0.15%, 4 – 0.3%.

Полученные результаты позволяют заключить, что стрессорные воздействия, вызываемые внесением ГВ или Н2О2 в культуру начала стационарной фазы роста, в которой уже развивается стресс “критического повышения клеточной плотности”, стимулируют образование клеточных форм, предназначенных для выживания популяции, в количествах больших, чем в контрольных культурах (без ГВ или Н2О2). Однако, помимо стресс-индуцирующего действия, в отличие от Н2О2, ГВ обладают протекторной активностью, что обусловливает длительное сохранение КОЕ-способности выживающих форм (до 4 мес. и далее) в количествах бóльших (на 300‒400%), чем в контроле.
Диссоциативный спектр выживающих популяций A. junii. Одним из признаков длительно выживающих (мес.–млн лет) в неростовых условиях покоящихся форм бактерий является их прорастание и дальнейшее развитие популяций в виде спектра фенотипических вариантов (диссоциантов), различающихся колониально-морфологическими и физиологическими признаками, что было показано ранее для бактерий различных таксономических групп (Николаев и соавт., 2006; Solyanikova et al., 2011; Мулюкин и соавт., 2014). Этот признак − расширение диссоциативного спектра при прорастании выживающих покоящихся форм, определяли для культур A. junii в вариантах их обработки ГВ и Н2О2.
При высеве аликвот длительно (2, 3 мес.) хранящихся культур на плотную среду клетки диссоциантов формировали колонии, различающиеся колониально-морфологическими признаками: S – доминантный тип, округлые гладкие выпуклые среднего размера; Sпр – бледные прозрачные, по форме и размерам близкие к S типу; Sm – мелкие, в 3 и более раз меньше доминантного S типа.
В длительно хранящихся культурах A. junii как контрольных, так и опытных вариантов существенно менялся диссоциативный спектр выживающих популяций (табл. 4). Общей закономерностью было замещение доминантного S-фенотипа, численность которого составляла в культурах стационарной фазы до 97‒99%, минорными фенотипами Sпр и Sm, их доля в 2‒3-мес. культурах повышалась до 40% и более. Изменения диссоциативного спектра зависели от концентрации действующего фактора (ГВ или Н2О2) и времени хранения культур.
Таблица 4.
Диссоциативный спектр популяций A. junii с внесением ГВ или Н2О2 при длительном хранении
| Концентрация индуктора | Количество диссоциантов, % | |||||
|---|---|---|---|---|---|---|
| 2 мес. хранения | 3 мес. хранения | |||||
| S | Sпр | Sm | S | Sпр | Sm | |
| Контроль* | 39.2 | 58.8 | 2.0 | 52.5 | 45 | 2.5 |
| ГВ Сахалинский | ||||||
| 0.025 г/л | 45.1 | 51.7 | 3.2 | 41.3 | 54.3 | 4.4 |
| 0.05 г/л | 45.8 | 47.6 | 6.6 | 22.8 | 69.6 | 7.6 |
| 0.1 г/л | 49.0 | 39.5 | 9.5 | 20.9 | 63.4 | 15.8 |
| Н2О2 | ||||||
| 0.03% | 44.2 | 51.9 | 3.9 | 18.3 | 78.1 | 3.6 |
| 0.15% | 39.7 | 53.2 | 10 | 15.4 | 80.0 | 4.6 |
| 0.3% | 20.6 | 67.6 | 11.8 | 17.7 | 69.8 | 12.5 |
В опытах с Н2О2, индуцирующим окислительный стресс, который стимулировал образование выживающих клеток-персистеров, в 2-мес. культурах наблюдали зависимое от увеличения концентрации Н2О2 замещение доминантного S варианта (численность которого снижалась от 44 до 20%) вариантами Sпр, число которых возрастало, соответственно, от 50 до 70% и Sm ‒ от 4 до 12%. Отметим определенную корреляцию между концентрационной зависимостью изменений в диссоциативном спектре (табл. 4) и численностью выживающих клеток (рис. 6) в 2-мес. культурах. В 3-мес. культурах зависимости от концентрации Н2О2 не наблюдали ни в диссоциативных спектрах (табл. 4), ни в численности выживающих клеток (рис. 6), которая не отличалась от численности клеток в контрольных вариантах.
В серии опытов с ГВ зависимость диссоциативного спектра от концентрации ГВ, напротив, была выражена в 3-мес. культурах (табл. 4). В 2-мес. культурах различия наблюдались, в основном, в удельной доле минорных Sпр и Sm вариантов, а в 3-месячных культурах ‒ в достоверном снижении доли доминантного S фенотипа по мере возрастания концентрации ГВ. При этом отметим концентрационную зависимость численности выживающих популяций как в 2-мес., так и 3-мес. культурах A. junii, а также достоверно большую численность выживающих клеток в опытных вариантах по сравнению с контрольными (на 400‒600%) (рис. 4).
ОБСУЖДЕНИЕ
Методологически работа была основана на анализе условий и механизмов (длительного) выживания микроорганизмов в природных системах. Гуминовые вещества (ГВ) в качестве действующего фактора пролонгирования сохранения КОЕ-способности клеток были выбраны как естественные компоненты почвенных систем – наиболее обширной экологической ниши существования микроорганизмов. На долю ГВ приходится до 80‒90% от суммарной органической составляющей почв, а в торфах – до 50%. Гуминовые вещества – это темно-коричневые или темно-бурые органические соединения природного происхождения, широко распространенные в почвах, торфах, сланцах, углях. ГВ классифицируются по растворимости в кислотах и щелочах на фракции гуминовых и фульвокислот. Высказано предположение о способности ГВ интенсифицировать процессы биоремедиации почв, загрязненных углеводородами нефти, благодаря их способности диспергировать и солюбилизировать гидрофобные вещества (Левинский, 2000; Дагуров и соавт., 2005). Имеется информация о способности ГВ к физико-химическим взаимодействиям с ферментными белками, что может повышать скорость каталитических реакций и, таким образом, стимулировать рост бактерий (Тихонов и соавт., 2010). Авторами настоящей работы было показано, что ГВ в зависимости от концентрации способны как активировать, так и ингибировать скорость каталитических реакций, влияя на ферментативную активность почв вплоть до консервации почвенных ферментов, что было продемонстрировано для амилолитической компоненты погребенных почв (тыс. лет) (Demkina et al., 2015). В данном исследовании ГВ были впервые применены для увеличения численности покоящихся клеток и длительности выживания клеток углеводородокисляющих бактерий. Выбор объекта исследований был обусловлен следующими соображениями.
Нефть является одним из наиболее распространенных загрязнителей окружающей среды, ежегодный объем поступления которой составляет около 2‒3 × 107 т (около 3% от общего объема добываемой нефти). Самовосстановление экосистем в регионах, подвергшихся нефтяному загрязнению, является сложным и длительным (10‒25 лет) процессом (Тимергазина, Переходова, 2012). Наиболее распространены биологические методы очистки, реализующие два подхода: 1) активизацию аборигенной микрофлоры, разлагающей и/или утилизирующей углеводороды нефти, и 2) внесение в загрязненный биотоп активных штаммов микроорганизмов-деструкторов в форме биопрепарата. Основным требованием к выпускаемым биопрепаратам является длительность сохранения достаточно высокого титра жизнеспособных и технологически активных клеток (Петриков и соавт., 2008; Саламатова и соавт., 2010).
В настоящем исследовании предложен новый оригинальный подход к разработке способов получения длительно хранящихся бакпрепаратов на основе применения препаратов гуминовых веществ на примере пролонгирования жизнеспособности клеток углеводородокисляющей бактерии A. junii. Было показано, что внесение препаратов ГВ различного состава в культуры A. junii начала стационарной фазы роста во всех вариантах опытов, но с разной результативностью увеличивает численность длительно (1–4 мес.) выживающих клеток.
Анализ кривых отмирания контрольных культур выявил закономерности в изменении численности жизнеспособных (КОЕ) клеток; динамика отмирания была бифазной (рис. 1): фазу быстрого отмирания – до 30 сут хранения, фазу медленного отмирания – от 30 до 80‒90 сут, после чего от 90 до 120 сут скорость потери КОЕ-способности несколько возрастала. Наличие на кривых отмирания микробных популяций участков с разными скоростями отмирания отражает их гетерогенность по свойству сохранения жизнеспособности клеток в стрессовой ситуации, в данном случае − при критическом повышении численности популяции и недостатке источников питания. Наиболее хорошо бифазность отмирания стационарных культур была изучена для ситуаций выживания клеток при действии биоцидных доз антибиотиков (Balaban et al., 2013). Как правило, первыми отмирают стационарные (неспециализированные, вегетативные, регулярные – в разной терминологии) клетки, составляющие в стандартных условиях до 99% от численности популяции, формирующие первый участок быстрого падения численности КОЕ. Пологое плато (от 30 до 80‒90 сут) отражает наличие в популяции клеток-персистеров, составляющих малочисленную (до 1%) субпопуляцию клеток, образующихся в результате цитодифференцировки, фенотип которых характеризуется отсутствием или крайне медленным делением, устойчивостью к автолизу и высокой стрессоустойчивостью, в цитируемых работах − к биоцидным дозам антибиотиков (стрессоров) (Lewis, 2010; Balaban et al., 2013; Helaine, Kugelberg, 2014), в наших исследованиях – к неростовым условиям.
Проблема образования клеток-персистеров и выживания популяции при летальных воздействиях токсикантов является в настоящее время центральной в медицинской микробиологии и исследуется на моделях патогенных бактерий. Получена большая информация об условиях и механизмах образования персистеров, но нигде не обсуждается их дальнейшая судьба (Helaine, Kugelberg, 2014; Van den Bergh et al., 2017). В наших предыдущих работах с непатогенными штаммами патогенных бактерий (Esherichia coli К12, Pseudomonas aeruginosa РАО-1 и Staphilococcus aureus 209P) была сформулирована гипотеза, рассматривающая клетки-персистеры как предшественники анабиотических цистоподобных клеток (ЦПК), предназначенных для выживания микробных популяций в неблагоприятных для роста условиях, обнаруживаемых в 2‒3-мес. культурах бактерий (Лойко и соавт., 2015). Согласно гипотезе, персистеры представляют собой субпопуляцию клеток, в которых завершены молекулярно-генетические процессы перехода в состояние не-деления и перехода в фенотип персистенции (цитодифференцировка), но не прошли физико-химические процессы приобретения персистерами анабиотического состояния, такие как биокристаллизация нуклеоида (Лойко и соавт., 2017) и витрификация цитоплазмы (Fonseca et al., 2017), которые мы считаем характерными для покоящихся форм. Ранее образование и свойства покоящихся форм типа ЦПК были показано для неспорообразующих бактерий разных таксонов (Эль-Регистан и соавт., 2006; Мулюкин и соавт., 2008, 2014).
Применительно к полученным результатам (рис. 1), клетки, выжившие в 30-сут культурах, следует рассматривать как персистеры, а в 60‒90-сут культурах как покоящиеся формы. Более подробная градация скорости отмирания контрольных и опытных культур в период до 30 сут хранения (рис. 1б) выявила отличия опытных культур от контрольных: практически одинаковую скорость отмирания стационарных клеток в период 7–15 сут и существенно более низкую − в опытных культурах. Эта разница объясняется, соответственно, большей численностью клеток-персистеров в опытных культурах. Таким образом, первый эффект ГВ заключался в индукции образования клеток-персистеров, численность которых, в зависимости от концентраций ГВ, на 700‒1200% превышала уровень контроля (рис. 2) в 30-сут культурах. Эта разница сохранялась на несколько более низком уровне у созревших из персистеров покоящихся форм до 3 мес. хранения культур. Последующее снижение числа КОЕ может объясняться приобретением покоящимися клетками некультивируемого состояния. Отметим, что в состав ГВ входят замещенные фенолы и полифенолы, которые рассматривались нами как аналоги микробных регуляторных факторов − фенольных липидов класса алкилрезорцинов. Аналогично алкилрезорцинам ГВ способны вступать в физико-химические взаимодействия (Н…Н, электростатические и гидрофобные) с биополимерами клетки и мембранными липидами (Тихонов и соавт., 2010; Demkina et al., 2015), что будет приводить к конформационным изменениям макромолекул и изменению структурной организации мембран и, вследствие этого − их функциональной активности.
С одной стороны, эти изменения будут обусловливать развитие стресса, аналогично показанному для алкилрезорцинов (Голод и соавт., 2009), что, в свою очередь, индуцирует фенотипический переход вегетативных клеток в персистеры (Balaban et al., 2004, 2013). Эта стресс-потенцирующая функция ГВ была подтверждена в сравнительных опытах с Н2О2, вызывающим развитие окислительного стресса и, аналогично ГВ, индуцирующим образование клеток-персистеров.
Следует отметить, что микробные культуры и контрольных, и опытных вариантов хранились в провокационных условиях – в среде роста при доступе кислорода воздуха и комнатной температуре. Полученные результаты сравнительных экспериментов с внесением ГВ или Н2О2 позволили заключить, что помимо действия ГВ как стрессоров, индуцирующих образование персистеров, они проявляют также защитную функцию, обеспечившую более высокую выживаемость клеток в 3‒4-мес. культурах с ГВ, по сравнению с вариантами с Н2О2 (рис. 2, 6). Возможно, ГВ могут стабилизировать макромолекулы аналогично действию алкилрезорцинов, что было показано в наших работах (Николаев и соавт., 2006; Demkina et al., 2015). Эта функциональная активность ГВ определяет увеличение срока сохранения жизнеспособности покоящихся форм в провокационных условиях, в отличие от действия Н2О2, индуцирующего их образование, но не обладающего защитной функцией (рис. 2, 6). Наконец, следует отметить антиоксидантные функции фенольных соединений (как ловушек АФК), к которым относятся как алкилрезорцины (Степаненко и соавт., 2004; El-Registan et al., 2005; Николаев, 2013), так и ГВ (Дагуров и соавт., 2005). Сравнивая химический состав препаратов ГВ и их влияние на пролонгированное выживание (4 мес.) клеток A. junii, можно заключить, что индуцирующей образование персистеров активностью обладают наиболее окисленные, гидрофильные ГВ, а протекторной активностью – менее окисленные, содержащие наименьшее количество алкильных и карбоксильных групп, обеспечивающие более длительное, чем в контроле, сохранение клетками КОЕ-способности в провокационных условиях. При разработке способов хранения бакпрепаратов углеводородокисляющих бактерий, основанных на действии ГВ, условия хранения должны предусматривать защищенность клеток от кислорода воздуха. Этот прием был отработан нами при разработке способа хранения препаратов молочнокислых бактерий (Николаев и соавт., 2019).
Следующая характеристика, на которую следует обратить внимание – это изменения диссоциативного спектра популяций покоящихся форм A. junii, выживающих в течение 3 мес. хранения. Фенотипическая гетерогенность моноклональных бактериальных популяций рассматривается как форма реализации их адаптивного потенциала (Магданова, Галясная, 2013). Отметим, что изменение диссоциативного спектра популяций прорастающих покоящихся форм типа ЦПК является их дискриминирующей характеристикой наряду с другими (особенностями ультраструктурной организации клетки, сохранением жизнеспособности, стрессо-(термо)резистентностью, отсутствием метаболической активности), что было показано для ЦПК бактерий разных таксонов (Бухарин и соавт., 2005), и может проявляться в различиях как колониально-морфологических признаков, так и физиологических характеристик (Solyanikova et al., 2011).
В вариантах с внесением ГВ изменения диссоциативного спектра выживающих популяций зависели от сроков хранения и в меньшей степени – от концентрации ГВ (табл. 4): доля диссоциантов S типа снижалась в 3-мес. культурах при возрастании доли минорных Sпр и Sm вариантов. Диссоциативный спектр в вариантах с Н2О2 изменялся более значительно в зависимости и от сроков хранения, и от концентрации Н2О2.
Отметим также сходство диссоциативных спектров 3-мес. культур с наибольшими концентрациями как Н2О2, так и ГВ и их существенное отличие от спектров 3-мес. контрольных культур. Можно предположить, что стрессорные воздействия в зависимости от концентрации стрессора (силы стресса) влияют не только на численность образующихся, предназначенных для выживания популяции клеток, но и на свойства образующихся персистеров, а затем созревших из них покоящихся форм, прорастать в виде определенных колониально-морфологических вариантов. В настоящей работе мы не определяли физиологические характеристики диссоциантов углеводородокисляющих бактерий. Это будет отражено в следующих публикациях.
Таким образом, функциональная активность ГВ в повышении численности выживающих клеток и продлении срока сохранения ими жизнеспособности заключается в индукции образования клеток-персистеров, созревающих в покоящиеся формы, их защите от повреждающих воздействий и сохранении КОЕ-способности при хранении бактериальных культур в провокационных условиях.
Список литературы
Бухарин О.В., Гинцбург А.Л., Романова Ю.М., Эль-Регистан Г.И. Механизмы выживания бактерий. М.: Медицина, 2005. 367 с.
Голод Н.А., Лойко Н.Г., Лобанов К.В., Миронов А.С., Воейкова Т.А., Гальченко В.Ф., Эль-Регистан Г.И. Роль микробных ауторегуляторов – алкилоксибензолов, в контроле экспрессии стрессовых регулонов // Микробиология. 2009. Т. 78. С. 731‒741.
Golod N.A., Loiko N.G., Lobanov K.V., Mironov A.S., Voieikova T.A., Gal’chenko V.F., Nikolaev Yu.A., El’-Registan G.I. Involvement of alkylhydroxybenzenes, microbial autoregulators, in controlling the expression of stress regulons // Microbiology (Moscow). 2009. V. 78. P. 678‒688.
Давыдова О.К., Дерябин Д.Г., Никиян А.И., Эль-Регистан Г.И. О механизмах взаимодействия ДНК с химическими аналогами микробных аутоиндукторов анабиоза // Микробиология. 2005. Т. 74. С. 616‒625.
Davydova O.K., Deryabin D.G., Nikiyan A.N., El-Registan G.I. Mechanisms of interaction between DNA and chemical analogues of microbial anabiosis autoinducers // Microbiology (Moscow). 2005. V. 74. P. 533‒541.
Дагуров А.В. Стом Д.И., Вятчина О.Ф., Балаян А.Э., Кушнарев Д.Ф. О механизме антидотного действия гуматов по отношению к нефтепродуктам // Acta Biomedica Scientifica. 2005. № 6 (44). С. 143‒145.
Зайцев Г.М., Карасевич Ю.Н. Утилизация 4-хлорбензойной кислоты штаммом Arthrobacter globiformis // Микробиология. 1981. Т. 50. С. 35‒40.
Zaitcev G.M., Karasevich Yu.N. Utilization of 4-chlorobenzoic acid by Arthrobacter globiformis // Microbiology (Moscow). 1981. V. 50. P. 35‒40.
Ковалевский Д.В., Пермин А.Б., Перминова И.В., Петросян В.С. Выбор условий регистрации количественных 13С ЯМР-спектров гумусовых кислот // Вестн. Моск. ун-та.Cер. 2. Химия. 2000. Т. 41. С. 39–43.
Кондратенко Е.П., Сухих А.С., Вербицкая Н.В., Соболева О.М. Биостимулирующие и физико-химические свойства гумата натрия // Химия растительного сырья. 2016. № 3. С. 109‒118.
Крупянский Ю.Ф., Абдулнасыров Э.Г., Лойко Н.Г., Степанов С.А., Терешкина К.Б., Эль-Регистан Г.И. Возможные механизмы влияния гексилрезорцина на структурно-динамические и функциональные свойства белка лизоцима // Химическая физика. 2012. Т. 31. № 3. С. 60‒75.
Krupyanskii Yu.F., Abdulnasyrov E.G., Loiko N.G., Stepanov A.S., Tereshkina K.B., El’-Registan G.I. Possible mechanisms of the influence of hexylresorcinol on the structure-dynamic and functional properties of lysozyme protein // Russ. J. Phys. Chem. B. 2012. V. 6. P. 301‒314.
Куюкина М.С., Ившина И.Б. Пат. РФ 2180276. МКИ В09С1/10, С12N1/20, C12N1/26, С12R1/01 Олеофильный биопрепарат, используемый для очистки нефтезагрязненной почвы. № 2001104629/13.
Левинский Б.В. Все о гуматах. 4-е изд., перераб. и доп. Иркутск: Корф-Полиграф, 2000. 75 с.
Лойко Н.Г., Козлова А.Н., Николаев Ю.А., Гапонов А.М., Тутельян А.В., Эль-Регистан Г.И. Влияние стресса на образование антибиотикотолерантных клеток Escherichia coli // Микробиология. 2015. Т. 84. С. 512‒528.
Loiko N.G., Kozlova A.N., Nikolaev Y.A., Gaponov A.M., Tutel’yan A.V., El’-Registan G.I. Effect of stress on emergence of antibiotic-tolerant Escherichia coli cells // Microbiology (Moscow). 2015. V. 84. C. 595‒609.
Лойко Н.Г., Сузина Н.Е., Соина В.С., Смирнова Т.А., Орлова М.В., Азизбекян Р.Р., Синицын Д.О., Терешкина К.Б., Николаев Ю.А., Крупянский Ю.Ф., Эль-Регистан Г.И. Биокристаллические структуры в стационарных и покоящихся клетках прокариот // Микробиология. 2017. Т. 86. С. 703‒719.
Loiko N.G., Nikolaev Y.A., El’-Registan G.I., Suzina N.E., Soina V.S., Smirnova T.A., Zubasheva M.V., Azizbekyan R.R., Sinitsyn D.O., Tereshkina K.B., Krupyanskii Y.F. Biocrystalline structures in the nucleoids of the stationary and dormant prokaryotic cells // Microbiology (Moscow). 2017. V. 86. P. 714‒727.
Магданова Л.А., Голясная Н.В. Гетерогенность как адаптивное свойство бактериальной популяции // Микробиология. 2013. Т. 82. С. 3‒13.
Magdanova L.A., Golyasnaya N.V. Heterogeneity as an adaptive trait of microbial populations // Microbiology (Moscow). 2013. V. 82. P. 1‒10.
Меньщикова Е.Б., Ланкин В.З., Кандалинцена Н.В. Фенольные антиоксиданты в биологии и медицине. Строение, свойства, механизмы действия. Saarbruchen: LAPLambert Academic Publishing, 2012. 495 p.
Мулюкин А.Л., Сузина Н.Е., Дуда В.И., Эль-Регистан Г.И. Структурное и физиологическое разнообразие цистоподобных покоящихся форм бактерий рода Pseudomonas // Микробиология. 2008. Т. 77. С. 512‒523.
Mulyukin A.L., Suzina N.E., Duda V.I., El’-Registan G.I. Structural and physiological diversity among cystlike resting cells of bacteria of the genus Pseudomonas // Microbiology (Moscow). 2008. V. 77. P. 455‒465.
Мулюкин А.Л., Сузина Н.Е., Мельников В.Г., Гальченко В.Ф., Эль-Регистан Г.И. Cостояние покоя и фенотипическая вариабельность у Staphylococcus aureus и Corynebacterium pseudodiphtheriticum // Микробиология. 2014. Т. 83. С. 15–28.
Mulyukin A.L., Suzina N.E. Mel’nikov V.G., Gal’chenko V.F., El’-Registan G.I. Dormant state and phenotypic variability of Staphylococcus aureus and Corynebacterium pseudodiphtheriticum //Microbiology (Moscow). 2014. V. 83. P. 149‒159.
Мулюкин А.Л., Сузина Н.Е., Погорелова А.Ю., Антонюк Л.П., Дуда В.И., Эль-Регистан Г.И. Разнообразие морфотипов покоящихся клеток и условия их образования у Azospirillum brasilense // Микробиология. 2009. Т. 78. С. 42‒52.
Mulyukin A.L., Pogorelova A.Yu., El-Registan G.I., Suzina N.E., Duda V.I., Antonyuk L.P. Diverse morphological types of dormant cells and conditions for their formation in Azospirillum brazilense // Microbiology (Moscow). 2009. V. 78. P. 33‒41.
Николаев Ю.А., Мулюкин А.Л., Степаненко И.Ю., Эль-Регистан Г.И. Ауторегуляция стрессового ответа микроорганизмов // Микробиология. 2006. Т. 75. С. 489‒496.
Nikolaev Yu.A., Mulyukin A.L., Stepanenko I.Yu., El-Registan G.I. Autoregulation of stress response in microorganisms // Microbiology (Moscow). 2006. V. 75. P. 420‒426.
Николаев Ю.А., Шаненко Е.Ф., Эль-Регистан Г.И. Способ повышения жизнеспособности молочнокислых организмов // Микробиология. 2019. Т. 88. (в печати).
Nikolaev Yu.A., Shanenko E.Ph., El-Registan G.I. Approaches to enhancing the viability of lactic acid microorganisms // Microbiology (Moscow). 2019. V. 88. (in press).
Олескин А.В., Эль-Регистан Г.И., Шендеров Б.А. Роль нейромедиаторов в функционировании микробиоты человека // Микробиология. 2016. Т. 85. С. 3‒25.
Oleskin A.V., El’-Registan G.I., Shenderov B.A. Role of neuromediators in the functioning of the human microbiota: “Business talks” among microorganisms and the microbiota-host dialogue // Microbiology (Moscow). 2016. V. 85. P. 1‒22.
Петриков К.В., Власова Е.П., Понаморева О.И., Алферов В.А., Якшина Т.В., Нечаева И.А., Ахметов Л.И., Иунтус И.Ф. Сохранение жизнеспособности и деградативной активности микроорганизмов-нефтедеструкторов при различных способах хранения биомассы // Извеcтия ТулГУ. Естественные науки. Серия: Химия. 2008. № 2. С. 226–237.
Саламатова Ю.А., Минаева О.М., Акимова Е.Е. Эффективность хранения ряда бактериальных препаратов в жидкой форме // Вестн. Томского гос. ун-та. Серия: Биология. 2010. Т. 1. № 9. С. 20–28.
Степаненко И.Ю., Страховская М.Г., Беленикина Н.С., Николаев Ю.А., Мулюкин А.Л., Козлова А.Н., Ревина А.А., Эль-Регистан Г.И. Защита Saccharomyces cerevisiae алкилоксибензолами от окислительного и радиационного поражения // Микробиология. 2004. Т. 73. С. 204‒210.
Stepanenko I.Yu., Nikolaev Yu.A., Mulyukin A.L., Kozlova A.N., El’-Registan G.I., Strakhovskaya M.G., Belenikina N.S., Revina A.A. Protection of Saccharomyces cerevisiae against oxidative and radiation-caused damage by alkylhydroxybenzenes // Microbiology (Moscow). 2004. V. 73. P. 163‒169.
Тимергазина И.Ф., Переходова Л.С. К проблеме биологического окисления нефти и нефтепродуктов углеводородокисляющими микроорганизмами // Нефтегазовая геология. Теория и практика. 2012. Т. 7. № 1. С. 1–28.
Тихонов В.В. Якушев А.В., Завгородняя Ю.А., Бызов Б.А., Демин В.В. Дейстие гуминовых кислот на рост бактерий // Почвоведение. Серия: Биология почв. 2010. Т. 43. С. 333–341.
Tikhonov V.V., Yakushev A.V., Zavgorodnyaya Yu.A., Byzov B.A., Demin V.V. Effects of humic acids on the growth of bacteria // Euras. Soil Sci. 2010. V. 43. P. 305–313.
Штерншис М.В., Джалилов Ф.С., Андреева И.В., Томилова О.Г. Биопрепараты в защите растений. Новосибирск: НГАУ, 2000. 128 с.
Эль-Регистан Г.И., Мулюкин А.Л., Николаев Ю.А., Сузина Н.Е., Гальченко В.Ф., Дуда В.И. Адаптогенные функции внеклеточных ауторегуляторов микроорганизмов // Микробиология. 2006. Т. 75. С. 446‒456.
El-Registan G.I., Mulyukin A.L., Nikolaev Yu.A., Suzina N.E., Gal’chenko V.F., Duda V.I. Adaptogenic functions of extracellular autoregulators of microorganisms // Microbiology (Moscow). 2006. V. 75. P. 380‒389.
Aukema K.G., Kasinkas L., Aksan A., Wackett L.P. Use of silica-encapsulated Pseudomonas sp. strain NCIB 9816-4 in biodegradation of novel hydrocarbon ring structures found in hydraulic fracturing waters // Appl. Environ. Microbiol. 2014. V. 80. P. 4968–4976.
Balaban N.Q., Gerdes K., Lewis K., McKinney J.D. A problem of persistence: still more questions than answers? // Nature Rev. Microbiol. 2013. V. 11. P. 587‒591.
Balaban N.Q., Merrin J., Chait R., Kowalik L., Leibler S. Bacterial persistence as a phenotypic switch // Science. 2004. V. 305. P. 1622‒1625.
Chen T., D.A. Small M.K., McDermott M.K., Bentley W.E., Payne G.F. Enzymatic methods for in situ cell entrapment and cell release // Biomacromolecules. 2003. V. 4. P. 1558‒1563.
Demkina E., Mulyukin A., Kozlova A., Zolotareva B., El-Registan G.I. Response of amylase activity in buried paleosols and subsoil permafrost to low-molecular-weight compounds // Eur. J. Soil Biol. 2015. V. 70. P. 31‒37.
Donev T. Methods for conservation of industrial microorganisms. Sofia: NBIMCC, 2001. 93 p.
El-Registan G.I., Mulyukin A.L., Nikolaev Y.A., Stepanenko I.Y., Kozlova A.N., Martirosova E.I., Shanenko E.F., Strakhovskaya M.G., Revina A.A. The role of microbial low-molecular-weight autoregulatory factors (alkylhydroxybenzenes) in resistance of microorganisms to radiation and heat shock // J. Adv. Space Res. 2005. V. 36. P. 1718‒1728.
Fonseca F., Meneghel J., Cenard S., Passot S., Morris G.J. Determination of intracellular vitrification temperatures for unicellular micro organisms under conditions relevant for cryopreservation // PLoS One. 2016. V. 11. Article e0152939.
Helaine S., Kugelberg E. Bacterial persisters: formation, eradication, and experimental systems // Trends Microbiol. 2014. V. 22. P. 417‒424.
Hertkorn N., Permin A.B., Perminova I.V., Kovalevskii D.V., Yudov M.V., Kettrup A. Comparative analysis of partial structures of a peat humic and fulvic acid using one and two dimensional nuclear magnetic resonance spectroscopy // J. Environ. Qual. 2002. V. 31. P. 375‒387.
Levin-Reisman I., Braunera A., Ronina I., Balaban N.Q. Epistasis between antibiotic tolerance, persistence and resistance mutations // PNAS. 2019. V. 116. P. 14734‒14739. https://doi.org/10.1073/pnas.1906169116
Lewis K. Persister cells // Annu. Rev. Microbiol. 2010. V. 64. P. 357–372.
Meunier C.F., Dandoy P., Su B.L. Encapsulation of cells within silica matrixes: towards a new advance in the conception of living hybrid materials // J. Colloid Interface Sci. 2010. V. 342. P. 211–224.
Morgan C.A., Herman N., White P.A., Vesey G. Preservation of micro-organisms by drying: a review // J. Microbiol. Methods. 2006. V. 66. P. 183–193.
Perminova I.V., Frimmel F.H., Kovalevskii D.V., Abbt-Braun G., Kudryavtsev A.V., Hesse S. Development of a predictive model for calculation of molecular weight of humic substances // Water Res. 1998. V. 32. P. 872‒881.
Perminova I.V., Frimmel F.H., Kudryavtsev A.V., Kulikova N.A., Abbt-Braun G., Hesse S., Petrosyan V.S. Molecular weight characteristics of aquatic, soil, and peat humic substances as determined by size exclusion chromatography and their statistical evaluation // Environ. Sci. Technol. 2003. V. 37. P. 2477‒2485.
Polyak B., Geresh S., Marks R.S. Synthesis and characterization of a biotin-alginate conjugate and its application in a biosensor construction // Biomacromolecules. 2004. V. 5. P. 389–396.
Solyanikova I.P., Mulyukin A.L., Suzina N.E., El-Registan G.I., Golovleva L.A. Improved xenobiotic-degrading activity of Rhodococcus opacus strain 1cp after dormancy // J. Environ. Sci. Health B. 2011. V. 46. P. 638‒647.
Stasiuk M., Kozubek A. Biological activity of phenolic lipids // Cell. Mol. Life Sci. 2010. V. 67. P. 841‒860.
Van den Bergh B., Fauvart M., Michiels J. Formation, physiology, ecology, evolution and clinical importance of bacterial persisters // FEMS Microbiol. Rev. 2017. V. 41. P. 219–251.
Дополнительные материалы
- скачать Nikolaev_1.tiff
- Рис. 1S. (а, б, в). Изменение численности жизнеспособных клеток A. junii при длительном хранении в течение 120 сут в контрольном (1) и опытных вариантах с внесением препаратов: Гмумат+7 (а); в концентрациях: 2 ‒ 1.0 г/л; 3 – 2.0 г/л; Сахалинский (б) в концентрациях: 2 – 0.4%; 3 – 0.8%; ГУМИ-20 в концентрациях: 2 – 0.4%; 3 – 0.8%.
- скачать Nikolaev_2.tiff
- Рис. 1S. (а, б, в). Изменение численности жизнеспособных клеток A. junii при длительном хранении в течение 120 сут в контрольном (1) и опытных вариантах с внесением препаратов: Гмумат+7 (а); в концентрациях: 2 ‒ 1.0 г/л; 3 – 2.0 г/л; Сахалинский (б) в концентрациях: 2 – 0.4%; 3 – 0.8%; ГУМИ-20 в концентрациях: 2 – 0.4%; 3 – 0.8%.
- скачать Nikolaev_3.docx
- Таблица 1S. Количество жизнеспособных клеток (КОЕ/мл) Ac. junii при длительном хранении контрольных и опытных культур с внесением препарата Гумиком
- скачать Nikolaev_4.docx
- Таблица 2S. Количество жизнеспособных клеток A. junii при длительном хранении в вариантах с внесением Н2О2 в культуру стационарной фазы роста (48 ч) (в % от контроля, без внесения Н2О2)
- скачать Nikolaev_5.docx
- Таблица 3S. Удельная доля выживающих клеток A. junii при длительном хранении (в % от 100% образовавшихся в 1-сут культурах после внесения Н2О2)


