Микробиология, 2020, T. 89, № 1, стр. 59-73
Анализ ультраструктуры клеток в составе биопленок бактерий Azospirillum brasilense
А. В. Шелудько a, *, Д. И. Мокеев a, С. С. Евстигнеева a, Ю. А. Филипьечева a, А. М. Буров a, Л. П. Петрова a, Е. Г. Пономарева a, Е. И. Кацы a, **
a Институт биохимии и физиологии растений и микроорганизмов
Российской академии наук
410049 Саратов, Россия
* E-mail: shel71@yandex.ru
** E-mail: ei_katsy@mail.ru
Поступила в редакцию 26.04.2019
После доработки 02.07.2019
Принята к публикации 29.09.2019
Аннотация
Для эпифитных и эндофитных ризобактерий, стимулирующих рост растений, формирование био-пленок имеет равноценное адаптационное значение в связи с их первичной локализацией на поверхности растительной корневой системы. Азотфиксирующие штаммы Azospirillum brasilense в жидких средах в условиях лимита по азоту переходят преимущественно к биопленочному существованию. Впервые выявлены общие черты ультраструктуры клеток в составе биопленок вида A. brasilense и охарактеризованa их устойчивость к высушиванию и окислительному стрессу. Обнаружены нескольких типов одиночных и неразделившихся клеток, цистоподобные формы с выраженным морфологическим разнообразием у штаммов Sp7, Cd и Sp245. Устойчивость биопленочной популяции этих бактерий к высушиванию и окислительному стрессу выше, чем у планктонных азоспирилл. После 4 мес. хранения сухих биопленок Sp245, Sp7 и Cd, сформированных на среде без азота, покоящиеся формы остаются жизнеспособными, а в случае биопленок, сформированных в присутствии азота, – после 4, 3 и 2 мес. соответственно штамму. В случае биопленок величина МИК H2O2 составляет 1.0% для штаммов Sp7, Cd и 0.1% для Sp245. Покоящиеся формы, как и биопленки штамма Sp245, более чувствительны к негативному воздействию H2O2, чем у штаммов Sp7 и Cd. Впервые в биопленках азоспирилл выявлена пероксидазная активность.
Azospirillum brasilense – почвенные бактерии, вступающие в продуктивные ассоциативные отношения с разнообразными культурными растениями (Bashan, de-Bashan, 2010). Азоспириллы способны обеспечить растения фиксированным азотом, синтезировать фитогормоны, улучшать минеральное питание растений, повышать их устойчивость к тяжелым металлам, контролировать фитопатогены и нейтрализовать токсические вещества (Bashan, de-Bashan, 2010; Fibach-Paldi et al., 2012). Перечисленные свойства делают эти бактерии привлекательными для включения в состав биоудобрений, использование которых перспективно в практике аграрных биотехнологий. Определенное значение для успешного функционирования растительно-микробной ассоциации может иметь способность азоспирилл формировать биопленки на поверхности подземных органов растения-хозяина, что способствует не только адаптации микроорганизмов к существованию в динамичной почвенной среде, но и приносит пользу растению (Fibach-Paldi et al., 2012; Bogino et al., 2013). Бактериальные биопленки являются пространственно и метаболически структурированными сообществами заключенных в матрикс микроорганизмов (Flemming, Wingender, 2010). Матрикс биопленок, помимо структурного каркаса, является резервуаром ростовых факторов, ферментов и питательных веществ, играет защитную роль. Он представляет собой сильно гидратированную структуру, медленно высыхает, чем предохраняет микроорганизмы от изменений водного потенциала. Структурной основой внеклеточного матрикса биопленок является смесь экзополисахаридов, белков и нуклеиновых кислот. Жгутики и пили бактерий также интегрированы в матрикс и поддерживают его архитектуру. Так, сохранение полярного жгутика клетками штамма A. brasilense Sp245, интегрированными в зрелую биопленку, способствует поддержанию ее целостности в условиях гидродинамического сдвига (Shelud’ko et al., 2019). Разнообразие структурных компонентов матрикса биопленок сопоставимо с количеством видов бактерий, образующих биопленки (Flemming, Wingender, 2010; Bogino et al., 2013). Бактериальные клетки в биопленках также характеризуются морфологическим и функциональным разнообразием (Hunter, Beveridge, 2005). Исследованы состав, структура и функции основных биополимеров матрикса биопленок азоспирилл, обеспечивающих фиксацию зрелых пленок на твердой поверхности и выполняющих каркасную функцию, способствующих созданию в биопленках условий для фиксации азота (Ramírez-Mata et al., 2016; Wang et al., 2017; Шелудько и соавт., 2018; Shelud’ko et al., 2019). Морфологический и функциональный полиморфизм клеточных форм в биопленках азоспирилл практически не охарактеризован, хотя типичен для вегетативных клеток этих бактерий, выросших в жидких или на плотных средах (Döbereiner, Day, 1976; Eskew et al., 1977; Tarrand et al., 1978; Sadasivan, Neyra, 1987). Так, покоящиеся формы повышают устойчивость бактериальной популяции к таким негативным воздействиям, как нагревание и высушивание, окислительный стресс и др., в том числе, и в случае азоспирилл (Pope, Wyss, 1970; Eskew et al., 1977; Sadasivan, Neyra, 1987). Почвенные микроорганизмы, инфицирующие/заселяющие корневую систему, сталкиваются с окислительным стрессом, обусловленным продукцией растениями активных форм кислорода, в частности, H2O2 (Васильева и соавт., 2007; Прадедова и соавт., 2011). Таким образом, характеристика клеточных форм в биопленках необходима для понимания механизмов формирования и функционирования бактериальных биопленок, их устойчивости к внешним воздействиям, подбора способов управления данными процессами в экологических и биотехнологических целях. Анализ устойчивости биопленок к негативному влиянию перекиси водорода также интересен для осмысления их роли в адаптации азоспирилл к существованию не только в динамичной почвенной среде, но и в ассоциации с растениями.
Объектом нашего исследования стали штаммы Sp7, Cd и Sp245, являющиеся модельными в исследованиях способов и механизмов адаптации бактерий A. brasilense к жизнедеятельности в различных условиях существования, в том числе, и в ассоциации с растениями (Eskew et al., 1977; Tarrand et al., 1978; Baldani et al., 1983; Schloter et al., 1998; Shelud’ko et al., 2009; Bashan, de-Bashan, 2010; Петрова и соавт., 2010; Шелудько и соавт., 2010; Fibach-Paldi et al., 2012; Шелудько и соавт., 2015; Tugarova et al., 2017; Wang et al., 2017; Shelud’ko et al., 2019). Все использованные в работе штаммы фиксируют атмосферный азот (при отсутствии его связанных форм в среде инкубации), синтезируют фитогормоны, формируют биопленки на корнях растений, абиотических поверхностях и на разделе фаз жидкость/воздух (Петрова и соавт., 2010; Шелудько и соавт., 2010, 2015; Tugarova et al., 2017; Wang et al., 2017; Shelud’ko et al., 2019). Штамм Sp245 способен проникать внутрь корней и заселять межклетники проводящей системы и корневые волоски пшеницы (Schloter et al., 1998); выделение штамма Cd из стерилизованных с поверхностей корней свинороя пальчатого (Cynodon dactylon) (Eskew et al., 1977) также предполагает способность этой бактерии к проникновению в корневую систему растения-партнера.
Цель данной работы – исследовать полиморфизм клеточных форм в биопленках A. brasilense Sp7, Cd и Sp245 и охарактеризовать покоящиеся формы. В задачи исследования входил анализ ультраструктуры биопленок, сформированных на средах со связанным азотом и без него (условия, способствующие фиксации азоспириллами атмосферного азота), характеристика устойчивости биопленочных популяций к высушиванию и окислительному стрессу.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Штаммы бактерий и питательные среды. В работе использовали штаммы A. brasilense: Sp7, выделенный в Бразилии из ризосферы росички лежачей (Digitaria decumbens) (Tarrand et al., 1978), Cd, выделенный в США из корней cвинороя пальчатого (Cynodon dactylon) после инокуляции Sp7 (Eskew et al., 1977), и Sp245, выделенный в Бразилии из корней пшеницы (Triticum aestivum) (Baldani et al., 1983). Бактерии культивировали при 30°C на малатно-солевой среде (МСС) (Döbereiner, Day, 1976) с 1 г/л NH4Cl. При необходимости в среду добавляли агар (до 1.8% или 0.3%) или исключали из нее NH4Cl.
Определение скорости роста планктонных культур, подвижности и агрегации бактерий в условиях аэрации. Ночные (18 ч) культуры бактерий разводили до значений ОП590 = 0.05–0.10 (l = 0.5 см) в 100 мл стерильной МСС с NH4Cl, разлитой в конические колбы объемом 250 мл. Для создания условий интенсивной аэрации колбы помещали на горизонтальную платформу шейкера-инкубатора Excella E24 (“New Brunswick Scientific”, США) и инкубировали при 140 об./мин и температуре 30°С. Каждые 2 ч измеряли оптическую плотность бактериальной культуры при ОП590 (l = = 0.5 см).
В процессе культивирования планктонные культуры отбирали и использовали для определения степени агрегации клеток (Madi, Henis, 1989). Жидкие культуры отстаивали 30 мин, осторожно декантировали надосадочную среду, а из осевших клеточных агрегатов готовили взвесь в 50 мМ фосфатном буфере (ФБ; pH 7.0). После отстаивания полученной взвеси в течение 2 ч измеряли ОП590 надосадочной жидкости; затем бактерии диспергировали 2 мин на магнитной мешалке и опять определяли оптическую плотность взвеси. Для оценки процента агрегации клеток использовали формулу: А = {[(ОП590)2 – (ОП590)1]/(ОП590)1]} × × 100%, где (ОП590)1 – оптическая плотность надосадочной жидкости после оседания агрегатов, а (ОП590)2 – оптическая плотность взвеси, полученной после диспергирования осевших агрегатов бактерий.
Для изучения бактериальной подвижности 24-ч планктонные культуры разводили до ОП590 = 0.2–0.3 (l = 0.5 см), готовили препарат “висячая” капля. Предметные стекла просматривали в просвечивающий микроскоп JENAVAL (“Carl Zeiss Jena”, Германия) (техника фазово-контрастной микроскопии), используя объектив с широким охватом поля зрения. Во время наблюдений вели видеозапись с помощью видеокамеры DCR-TRV900E (“SONY”, Япония). Оценивали подвижность всех клеток в поле зрения микроскопа. Анализ видеоизображения выполняли с помощью компьютерной программы, разработанной в ИБФРМ РАН (Schelud’ko et al., 2009).
Анализ роста в статичных условиях планктонных культур, процесса формирования и микроструктуры биопленок азоспирилл. 24-ч культуры азоспирилл из жидкой МСС с азотом, выросшие в условиях аэрации, отмывали 50 мМ ФБ (pH 7.0), разводили свежей МСС с азотом или без него до значений ОП590 = 0.05–0.10 (l = 0.5 см), вносили в стеклянные пробирки (по 2 мл) и полистирольные чашки Петри (по 3 мл), на дне которых находились стеклянные покровные стекла для микроскопии, и инкубировали в течение 6 сут при 30°С в стационарных условиях. У азоспирилл к 6 сут инкубации стабилизируется относительное количество биомассы биопленок и завершается процесс их формирования на поверхности стекол (зрелые биопленки), находящихся в жидкой среде (Шелудько и соавт., 2015). Покровные стекла с образовавшимися на них биопленками использовали для анализа микроструктуры биопленок методами световой микроскопии.
Для оценки относительного количества биомассы в зрелых биопленках их окрашивали кристаллическим фиолетовым (O’Toole, Kolter, 1998). Перед окрашиванием биопленок из пробирок отбирали планктонные бактерии, которые использовали для определения оптической плотности (ОП590; l = 0.5 см) жидких культур, окружающих биопленки. К осторожно промытым дистиллированной водой биопленкам (в процессе промывания удаляли остатки планктонной культуры и незакрепленные на поверхности стекла фрагменты пленок, сформированных азоспириллами на разделе жидкая МСС/воздух, добавляли 2 мл 1% водного раствора кристаллического фиолетового, инкубировали при комнатной температуре 10 мин и, после удаления раствора, опять промывали водой. Связавшийся с биомассой биопленок краситель растворяли в 2 мл этанола и измеряли оптическую плотность полученного раствора при длине волны 590 нм на фотоколориметре КФК-2 (“Загорский оптико-механический завод”, Россия). В качестве контроля окрашивали пробирки, которые инкубировали 6 сут со стерильной средой. В контроле ОП590 (l = 0.5 см) десорбированного красителя не превышала 0.04 ед. Контрольные значения ОП590 (l = 0.5 см) вычитали из результатов окрашивания биомассы био-пленок.
В ряде экспериментов биопленки промывали, смывали, суспендировали в 50 мМ ФБ (pH 7.0) и наносили флотацией на сетки с формваровой подложкой (аналогичным образом наносили клетки из планктонной культуры). Сетки с нанесенными препаратами высушивали и использовали для анализа с применением просвечивающей электронной микроскопии.
Фазово-контрастную, флуоресцентную и просвечивающую электронную микроскопию биопленок, суспензий смытых биопленок и отдельных клеток из планктонных культур выполняли на приборах, находящихся в ЦКП “Симбиоз” ИБФРМ РАН (г. Саратов, Россия): Leica DM6000 B (“Leica-Microsystems”, Германия) и Libra 120 (“Carl Zeiss”, Германия).
Приготовление ультратонких срезов. Зрелые биопленки промывали и осторожно смывали аспирацией 50 мМ ФБ (pH 7.0), смывы, содержащие фрагменты пленок, осаждали центрифугированием в течение 15 мин при 6000 об/мин. Также осаждали 24-ч планктонные культуры из жидкой МСС с азотом, выросшие в условиях аэрации. Осадки биопленок или планктонных клеток фиксировали в 2.5%-ном растворе глутарового альдегида в 0.1 М какодилатном буфере (КБ; pH 7.2) 12 ч при 4°С, затем трижды отмывали 0.1 М КБ (pH 7.2) и фиксировали 1%-ным раствором OsO4 в том же буфере 4 ч при 20°С, проводили дегидратацию последовательно в спиртах (от 30 до 100%), в ацетоне и окиси пропилена. Обезвоженный материал заключали в эпоксидную смолу Epon 812. Срезы получали на ультратоме, переносили на сеточки и при необходимости контрастировали в 3% растворе уранилацетата в 70% спирте. Ультратонкие срезы просматривали в просвечивающем электронном микроскопе Libra 120 (“Carl Zeiss”, Германия) при ускоряющем напряжении 120 кВ.
Определение численности жизнеспособных форм в биопленках и их устойчивости к высушиванию. После удаления планктонных культур зрелые биопленки осторожно промывали 50 мМ ФБ (pH 7.0). Промытые пробирки использовали для определения количества колониеобразующих единиц (КОЕ) в нативных (не подвергавшихся каким-либо воздействиям) и сухих биопленках. В последнем случае промытые биопленки сушили при 30°С и хранили при 37°С (Sadasivan et al., 1987; Malinich, Bauer, 2018). Для определения КОЕ в пробирки с биопленками вносили 2 мл 50 мМ ФБ (pH 7.0), инкубировали 1 ч и смывали биомассу. Биомассу ресуспендировали и в течение 1 мин диспергировали на встряхивателе Vortex. Из полученной суспензии серию разведений по 100 мкл высевали на плотную МСС с азотом. Результаты с учетом разведения пересчитывали на 2 мл, что соответствует смыву 1 биопленки. Для контроля эффективности смывания биомассы биопленок пробирки после удаления пленок окрашивали кристаллическим фиолетовым (см. выше) и сравнивали с результатами окрашивания пробирок, которые инкубировали 6 сут со стерильной средой (контроль). Результаты окрашивания поверхности стекла после смывания пленок не отличались от контрольных значений и не превышали 0.04 ед. ОП590 (l = 0.5 см).
Для определения продолжительности сохранения жизнеспособности покоящихся форм пробирки с сухими биопленками, хранившиеся более 7 сут, каждые 15 дней заполняли полужидкой МСС (с 0.3% агара) без источника связанного азота и инкубировали. Данные условия культивирования способствуют прорастанию цистоподобных форм азоспирилл (Sadasivan et al., 1987). Через 24–48 ч инкубации в полужидкой среде жизнеспособные особи делятся и, перемещаясь в агаре, формируют полосу, сосредоточенную у поверхности полужидкого агара. Пробирки, в которых отсутствовал рост, продолжали инкубировать до 7 сут. Затем полужидкую среду из пробирок, в которых отсутствовал видимый рост, высевали на плотные среды. Отсутствие роста и в этом случае свидетельствует о гибели популяции.
Определение каталазной, пероксидазной активностей биомассы биопленок и анализ влияния перекиси водорода на жизнеспособность азоспирилл. Зрелые биопленки после удаления планктонных клеток осторожно промывали 50 мМ ФБ (pH 7.0). Буфер удаляли. Для оценки активности пероксидазы в пробирки вносили 1 мл раствора 0.03% о‑фенилендиамина и 0.02% перекиси водорода в 0.1 М натрий-цитратном буфере (рН 4.5), инкубировали 10 мин и добавляли 2 мл 1 н H2SO4 для остановки реакции. В контрольных пробах к биопленкам добавляли о-фенилендиамин без перекиси водорода. Измерение оптической плотности (ОП490) исследуемых проб проводили на фотометре Multiskan Ascent (“ThermoLabsystems”, Финляндия) в ЦКП “Симбиоз” ИБФРМ РАН (г. Саратов, Россия). ОП490 контрольных проб (биопленки + о-фенилендиамин) вычитали из ОП490 образцов, в которых присутствовала перекись водорода (биопленки + о-фенилендиамин + + H2O2). О характерной для азоспирилл каталазной активности судили по образованию пены после добавления к нативным биопленкам 1 или 2%-го раствора H2O2 (Tarrand et al., 1978; Методы общей бактериологии, 1983).
Для определения влияния H2O2 на жизнеспособность азоспирилл 24 ч планктонные культуры, выросшие в условиях перемешивания, или зрелые биопленки инкубировали 18 ч с раствором H2O2 (0.001, 0.01, 0.1 и 1%) в 50 мМ ФБ (pH 7.0). Пробирки с биопленками предварительно осторожно промывали этим же буфером, а затем после его удаления вносили 2.5 мл раствора H2O2. В случае планктонных бактерий 2 мл жидких культур, разведенных до ОП590 = 0.3–0.4 (l = 0.5 см) (содержат (5.5 ± 0.5) × 109/мл жизнеспособных особей), осаждали и ресуспендировали в 2.5 мл раствора H2O2. После 18 ч инкубации удаляли H2O2 из пробирок с биопленками, в случае планктонных культур клетки собирали центрифугированием. В пробирки с биопленками вносили 2.5 мл полужидкой МСС (0.3% агара) без азота. Осадок планктонных клеток вносили в стерильные пробирки с аналогичной средой. Через 24–48 ч инкубации фиксировали наличие роста под поверхностью агара. Отсутствие роста свидетельствует о гибели популяции.
Статистическая обработка результатов. Во всех случаях количественных измерений проводили не менее трех независимых экспериментов как минимум в двух повторностях. Оценку биомассы биопленок каждого штамма выполняли не менее шести раз. Каждый раз окрашивали биопленки, сформированные в пяти стеклянных пробирках. Результаты обрабатывали с использованием пакета Microsoft Office Excel 2010; доверительные интервалы определяли для 95% уровня значимости. Для выявления статистически значимых различий между средними значениями использовали однофакторный дисперсионный анализ (ANOVA) при уровне значимости 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование формирования биопленок. Сравнение роста штаммов A. brasilense Sp7, Cd и Sp245 в жидких средах показывает, что при интенсивном перемешивании их планктонные культуры после 24 ч инкубации находятся в стационарной фазе роста. Клетки из этих культур несут длинный жгутик, располагающийся на одном из полюсов клетки, при помощи которого бактерии плавают прямолинейно со случайным изменением направления движения. В случае Sp7, Cd или Sp245 соответственно, (85.5 ± 2.2), (87.3 ± 2.6) или (85.8 ± 3.8)% бактерий в культуре подвижны. Степень агрегации клеток планктонных культур Sp245 может достигать (42.4 ± 7.2)%, что превышает отмеченную у Sp7 или Cd. У Sp7 и Cd агрегация клеток достигает (21.6 ± 3.5)% и (17.7 ± 3.2)% соответственно. Таким образом, бактерии из планктонных культур штаммов Sp7, Cd и Sp245 существенно различаются свойствами клеточной поверхности, опосредующими клеточную агрегацию.
Охарактеризованные выше 24-ч планктонные культуры инокулировали в МСС с азотом или без него и инкубировали статично в стеклянных пробирках. Процесс формирования биопленок исследованными штаммами на поверхности раздела жидкой (МСС) и твердой (гидрофильная поверхность стекла) фаз включает последовательно адсорбцию и адгезию клеток (2–3 сут), прирост и стабилизацию биомассы биопленки (с 5 и 6 сут; зрелые биопленки). В первые сутки инкубации бактерии формируют тонкие пленки, при микроскопии которых просматриваются разрозненные клеточные агрегаты (микроколонии), легко смываемые при аспирации водой. С 3-х сут инкубации микроколонии сливаются в биопленку с более ровной поверхностью. Стоит отметить, что начиная со вторых суток инкубации, азоспириллы колонизируют не только твердую поверхность, но и образуют биопленку на разделе воздух/жидкость, которая с течением времени может оседать под толщу жидкости (на дно пробирки).
На среде с азотом количество биомассы зрелых пленок Sp7 и Sp245 не различается, а в случае Cd превышает показатели этих штаммов (табл. 1, столбцы б). Отсутствие азота в среде культивирования стимулирует накопление биомассы у Sp7 и Cd, но не влияет на биомассу биопленок Sp245 (табл. 1, столбцы б). Зрелые биопленки Sp7, Sp245 и Cd содержат примерно одинаковое количество жизнеспособных бактерий. В смывах из пробирок с биопленками число КОЕ варьирует в пределах порядка 1010 (КОЕ в биопленке, сформированной в 1 пробирке), независимо от количества биомассы биопленок и/или наличия источника связанного азота в среде (табл. 1, столбцы б, в).
Таблица 1.
Рост планктонных культур (а), биомасса (б) и количество КОЕ (в) в зрелых биопленках A. brasilense, сформированных в стеклянных пробирках под жидкой МСС
| Штамм | (а) ОП590 (l = 0.5 см) планктонных культур |
(б) ОП590 (l = 0.5 см) кристаллического фиолетового, десорбированного после окрашивания биопленок |
(в) *Количество КОЕ в нативной зрелой биопленке |
|||
|---|---|---|---|---|---|---|
| +NH4Cl | –NH4Cl | +NH4Cl | –NH4Cl | +NH4Cl | –NH4Cl | |
| Sp7 | 0.21 ± 0.03 Б |
0.15 ± 0.03 А |
0.79 ± 0.09 А |
1.12 ± 0.08 В |
(1.3 ± 0.2) × 1010 | (3.2 ± 0.5) × 1010 |
| Cd | 0.24 ± 0.03 Б |
0.17 ± 0.02 А |
0.96 ± 0.09 Б |
1.19 ± 0.06 В |
(2.7 ± 0.3) × 1010 | (2.9 ± 0.1) × 1010 |
| Sp245 | 0.32 ± 0.03 В |
0.14 ± 0.03 А |
0.78 ± 0.05 А |
0.73 ± 0.12 А |
(3.8 ± 0.6) × 1010 | (2.2 ± 0.2) × 1010 |
Примечание. Результаты однофакторного дисперсионного (ANOVA) анализа в колонках (а) или (б) представлены заглавными буквами; разными буквами обозначены статистически значимые различия между средними. В колонках (а) или (б) сравнения последовательно проводили в столбце и строке. А или А – средние значения с наименьшей величиной. * Биомассу биопленки смывали 2 мл 50 мМ ФБ (pH 7.0), в полученной суспензии определяли КОЕ.
Оптическая плотность планктонных культур, выросших параллельно с биопленками на среде без источника связанного азота, уступает данному показателю культур со среды с азотом у всех исследованных штаммов (табл. 1, столбцы а). В свою очередь, биомасса биопленок либо возрастает (у Sp7 и Cd), либо остается неизменной (у Sp245). Таким образом, наблюдаемые тенденции влияния азота на показатели, характеризующие интенсивность роста планктонных культур и формирования биопленок, свидетельствуют о том, что все исследованные штаммы, контактирующие с гидрофильной поверхностью, в условиях лимита по азоту переходят преимущественно к биопленочному существованию (табл. 1, столбцы а, б).
Анализ ультраструктуры клеток в составе био-пленок. Анализ ультраструктуры планктонных клеток штаммов Sp7, Cd и Sp245 из 24-ч жидких культур, выросших при перемешивании в МСС с азотом, показывает, что “вегетативные клетки” (“В-клетки”) являются вибрионами (рис. 1а, 1б; 3а; 4а) с минимальным количеством включений, которые, как сообщается, могут являться гранулами полигидроксибутирата (ПГБ) (Berg et al., 1980). Тонкий слой капсулы тесно связан с липополисахаридом наружной мембраны клеток (рис. 1а; 4а). Также присутствуют клетки, лишенные выраженной капсулы (рис. 1б; 3а). Необходимо отметить, что среди клеток присутствуют делящиеся особи и длинные клетки (“Дл-клетки”). Наличие Дл-клеток наиболее заметно в популяции планктонных культур Sp245 (рис. 4б).
Рис. 1.
Просвечивающая электронная микроскопия ультратонких срезов клеток A. brasilense Sp7 из планктонных 24-ч культур (а, б) и фрагментов зрелых биопленок (в–м). Бактерии и биопленки культивировали в жидкой МСС с NH4Cl (а, б, з–м) или без связанного азота (г–ж). Масштабная линейка соответствует 1 мкм. Обозначения: В – “В-клетки”, Д – “Дл-клетки”, ЦП – “ЦП-формы”, КВ – крупные везикулы, (кс) – слой капсулы, (вм) и (нм) – внутренняя и наружная мембраны, (пгб) – полигидроксибутират.

Исследование с помощью просвечивающей электронной микроскопии суспензий смытой с поверхности стекла биомассы зрелых биопленок Sp7, Cd и Sp245 показало, что среди нативных клеток присутствуют особи с полярным жгутиком. Сохранение полярного жгутика бактериями может способствовать поддержанию структурной целостности биопленок. Так, у Sp245 полярный жгутик является одним из элементов матрикса, повышающих устойчивость биопленок этого штамма к гидродинамическому сдвигу (Шелудько и соавт., 2015, Shelud’ko et al., 2019). Анализ ультратонких срезов биопленок показал, что бактерии в их составе имеют выраженный полиморфизм размера и формы (рис. 1–4) в случае всех исследованных штаммов. По форме их можно систематизировать как “В-клетки” (рис. 1в, 1д, 1з; 3г; 4д, 4ж), характерные для вегетативных особей планктонных культур, длинные и/или неразделившиеся клетки – “Дл-клетки” (рис. 1е–1з, 1к, 1л; 3б, 3г–3е; 4б, 4г, 4ж), “утолщенные клетки” (рис. 1и; 2б, 2в) и яйцевидные формы (рис. 1в, 1д, 1к, 1м; 2г–2е; 3б–3е; 4в, 4г, 4е) средних и больших размеров – “ЦП-формы” (цистоподобные формы), которые описаны в старых культурах азоспирилл (Berg et al., 1980), в частности, в среде без источника связанного азота. Часть “Дл-клеток” покрыты выраженным внешним слоем (рис. 3д).
Рис. 2.
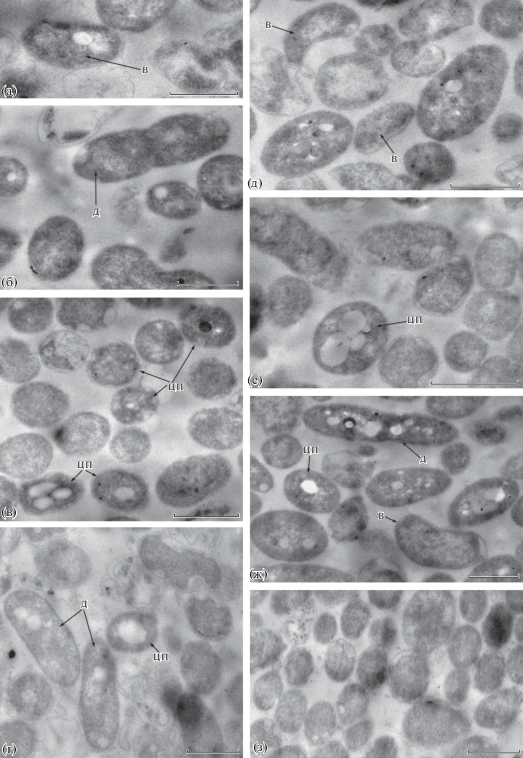
Просвечивающая электронная микроскопия ультратонких срезов цистоподобных форм A. brasilense Sp7 из фрагментов зрелых биопленок. Биопленки культивировали в жидкой МСС без NH4Cl. Масштабная линейка соответствует 1 мкм. Обозначения: (ц) – “центральное тело” (цI- (блок а, б), цII- (блок в, г), цIII- (блок д) и цIV- (блок е) варианты), (вс) – внешний слой, (пгб) – полигидроксибутират.
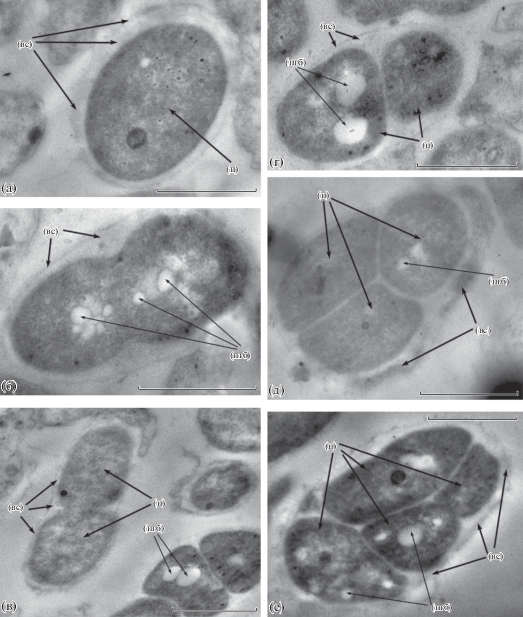
Рис. 3.
Просвечивающая электронная микроскопия ультратонких срезов клеток A. brasilense Cd из планктонных 24-ч культур (а) и фрагментов зрелых биопленок (б–е). Бактерии и биопленки культивировали в жидкой МСС с NH4Cl (а, г–е) или без (б, в). Масштабная линейка соответствует 1 мкм. Обозначения как на рис. 1.

Рис. 4.
Просвечивающая электронная микроскопия ультратонких срезов клеток A. brasilense Sp245 из планктонных 24-ч культур (а, б) и фрагментов зрелых биопленок (в–з). Бактерии и биопленки культивировали в жидкой МСС с NH4Cl (а, б, д–з) или без (в, г). Масштабная линейка соответствует 1 мкм. Обозначения как на рис. 1.
В биопленках также выявлены лизированные клетки, крупные (рис. 1м) и мелкие везикулы и электронно-плотные гранулы (см., например, рис. 1). Клеточные чехлы встречаются без четкой стратиграфии распределения интактных и лизированных особей (рис. 1в, 1з, 1к, 1м). Наличие в биопленках клеток с признаками разрушения частично может объяснять отсутствие зависимости между количеством биомассы биопленок и численностью КОЕ (табл. 1), высеваемых из них (необходимо также учитывать, что матрикс биопленок тоже вносит вклад в количество биомассы). Помимо клеток с явными признаками разрушения, обнаружены чехлы с сохранившейся клеточной стенкой, содержащие электронно-плотные гранулы в центральной части (рис. 4з), однако неясно, являются ли они мертвыми клетками.
На рис. 2 показаны срезы “ЦП-форм” A. brasilense Sp7 из биопленок, сформированных в жидкой среде без источника связанного азота. У данных клеточных форм центральное тело с неравномерной текстурой цитоплазмы содержит электронно-прозрачные крупные гранулы ПГБ и темные электронно-плотные гранулы небольшого размера. Видно, что центральное тело (цI-вариант) окружено слабо дифференцированным толстым внешним слоем. “ЦП-формы” со сложной организацией имеют более одного тела (цII- (рис. 2в, 2г), цIII- (рис. 2д) и цIV-варианты (рис. 2е), содержат соответственно два, три и более тел), которые находятся под толстым слоем, в котором можно выявить зоны: внешнюю, похожую на экзину, и менее электронно-плотную интину (рис. 2а, 2д, 2е).
Количество тел увеличивается после их деления непосредственно под покрывающим ЦП-форму толстым внешним слоем (см. рис. 2). Встречаются формы, у которых центральное тело окружает тонкий внешний слой, как правило, это цI-варианты (рис. 1д, 1к; 3г, 3е; 4е). Внешний слой, варьирующий по толщине, могут окружать мелкие черные электронно-плотные гранулы, которые, по-видимому, отвечают за пигментацию. Яйцевидные клетки азоспирилл сравнивают с цистами азотобактера (Pope et al., 1970; Berg et al., 1980). Заметным отличием ЦП-форм Azospirillum от цист Azotobacter является отсутствие четкой дифференциации внешнего слоя на экзину и интину (Berg et al., 1980). Однако у штамма Sp245 формирование ЦП-форм с четко дифференцированным внешним слоем происходит после перевода культур, выращенных на средах с минимальным содержанием азота, в условия полного голодания (Мулюкин и соавт., 2009). Формированию цистоподобных форм азоспирилл способствуют увеличение сроков культивирования (получение “стареющих культур”), интенсивная аэрация, замена источника углерода (например, легкодоступного для метаболизма малата на фруктозу) или азота (аммония на нитрат), перевод бактериальной культуры в условия лимита по азоту или фосфору, создание стресса голоданием (Sadasivan et al., 1987; Berg et al., 1980; Мулюкин и соавт., 2009).
Мы сравнили морфотипы клеточных форм трех штаммов в биопленках, сформированных в стандартной малатной синтетической среде с азотом и без него. Наибольшее разнообразие форм встречается в биопленках Sp7 из среды без азота: “В-клетки”, “Дл-клетки”, “ЦП-формы”, различающиеся по количеству центральных тел (варианты от цI- до цIV-). Практически все ЦП-формы из этой среды покрыты толстым внешним слоем (рис. 1 и 2). Формы с тонким внешним слоем встречаются реже – в основном, у цI-вариантов. Морфотип клеток Sp7 в биопленках из среды с азотом менее разнообразен и характеризуется отсутствием цIII- и цIV-вариантов, а цI-варианты преимущественно имеют тонкий внешний слой (рис. 1). В биопленках Cd присутствуют В- и Дл-клетки, цI- и цII-варианты ЦП-форм (рис. 3). Отсутствие азота способствует формированию в биопленках этого штамма лишь ЦП-форм с толстым внешним слоем (на среде с азотом преобладали варианты с тонким внешним слоем).
У штамма Sp245 независимо от наличия азота в среде биопленки содержат “В-клетки”, большое количество “Дл-клеток” и цI-варианты ЦП-форм с тонким/толстым внешним слоем (рис. 4). Биомасса биопленок азоспирилл из МСС с 1 г/л NH4Cl содержит ПГБ, накопление которого в заметных количествах у планктонных культур индуцируется, в основном, дефицитом азота (результаты ИК-Фурье-спектроскопии: Kamnev et al., 2012; Tugarova et al., 2017). По нашим наблюдениям, Дл- и ЦП-формы Sp245 содержат крупные электронно-прозрачные гранулы (рис. 4), характерные для ПГБ (Berg et al., 1980), в случае штаммов Sp7 и Cd гранулы небольшого размера присутствуют, преимущественно, в ЦП-формах.
Обнаруженные в биопленках ЦП-формы морфологически сходны с ранее описанными для азоспирилл цистоподобными формами, которые являются стойкими к голоду, окислительному стрессу и высыханию (Sadasivan et al., 1987; Мулюкин и соавт., 2009; Malinich, Bauer, 2018). Очевидно, в сухих биопленках после гибели вегетативных клеток (для достижения максимального эффекта высушенные культуры хранят не менее 1 недели ‒ см. Sadasivan et al., 1987; Malinich, Bauer, 2018) жизнеспособность сохранится только у цистоподобных форм. Определение КОЕ в таких образцах позволит количественно оценить численность покоящихся форм и получить представление о влиянии азота в среде культивирования на этот показатель.
Анализ влияния связанного азота в среде культивирования на численность жизнеспособных форм в биопленках и их устойчивость к высушиванию. Биопленки, выращенные на средах со связанным азотом и без него, были высушены при 30°C и заложены на хранение при 37°C (оптимальная температура для культивирования A. brasilense ‒ см. Tarrand et al., 1978). Через 7 сут хранения колониеобразующие покоящиеся формы были обнаружены в биопленках всех трех штаммов. Максимальная численность 104 КОЕ сохранялась в пленках, выращенных в среде без источника связанного азота (табл. 2). В среде с NH4Cl количество КОЕ снижается на порядок (у Sp245) и более (табл. 2). Необходимо отметить, что покоящиеся формы из биопленок, устойчивые к высушиванию, сохраняют жизнеспособность продолжительное время (в исследованном временном диапазоне). Так, в биопленках Sp245, Sp7 и Cd жизнеспособные формы сохраняются после 4 мес. хранения сухих образцов из среды без азота, а в случае сухих биопленок из сред с азотом после 4, 3 и 2 мес. соответственно штамму (табл. 2). При определении длительности сохранения жизнеспособности покоящихся форм пробирки с сухими биопленками заполняли полужидкой МСС (0.3% агара) без источника связанного азота и инкубировали. Данные условия культивирования способствуют прорастанию цистоподобных форм этих бактерий (Sadasivan et al., 1987). Через 24–48 ч после внесения в пробирки с сухими биопленками полужидкой среды делящиеся особи формируют полосу, сосредоточенную под поверхностью агара, что характерно для азоспирилл, являющихся микроаэрофилами (Wasim et al., 2009; Bashan, de-Bashan, 2010). Высеянные на плотные среды из этой зоны бактерии формируют колонии, характерные для вегетативных форм азоспирилл.
Таблица 2.
Влияние продолжительности хранения при 37°C на жизнеспособность A. brasilense в сухих зрелых биопленках
| Штамм | (а) *КОЕ из сухих биопленок после 7 сут хранения |
(б) **Наличие бактериального роста под поверхностью полужидкой среды при культивировании сухих биопленок из МСС |
|||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| +NH4Cl | –NH4Cl | +NH4Cl | –NH4Cl | ||||||||||
| хранение сухих биопленок при 37°C, сут | |||||||||||||
| 7 | 37 | 67 | 97 | 127 | 7 | 37 | 67 | 97 | 127 | ||||
| Sp7 | (2.5 ± 0.6) × 101 | (4.7 ± 0.7) × 104 | (+) | (+) | (+) | (+) | (–) | (+) | (+) | (+) | (+) | (+) | |
| Cd | (5.3 ± 0.9) × 101 | (4.6 ± 0.4) × 104 | (+) | (+) | (+) | (–) | (–) | (+) | (+) | (+) | (+) | (+) | |
| Sp245 | (4.9 ± 0.9) × 103 | (1.1 ± 0.1) × 104 | (+) | (+) | (+) | (+) | (+) | (+) | (+) | (+) | (+) | (+) | |
Таким образом, в случае трех штаммов A. brasilense наличие азота в среде культивирования не влияет на формирование в их биопленках покоящихся форм, сохраняющих жизнеспособность продолжительный период после высушивания (табл. 2). В отличие от пленочных, покоящиеся формы азоспирилл из жидких сред (планктонные культуры) с азотом при длительном хранении после высушивания быстрее теряют жизнеспособность (к 4-ым суткам бактерии гибнут), по сравнению с цистоподобными формами, сформированными в условиях инкубации без связанного азота (Sadasivan et al., 1987).
Анализ устойчивости биопленок к окислительному стрессу. Мы сравнили устойчивость исследованных штаммов к перекиси водорода в качестве агента окислительного стресса, оценивая действие различных концентраций H2O2 на жизнеспособность бактерий из планктонных культур, находящихся в стационарной фазе роста, или из зрелых биопленок. Для обработки H2O2 объем планктонных культур подобрали таким образом, чтобы суммарно число КОЕ составляло 1010 (в 2 мл суспензии), что соответствует содержанию КОЕ в 1 пленке (табл. 1). Значения КОЕ в сухих пленках представлены в табл. 2, столбец а.
Анализ чувствительности к окислительному стрессу, вызванному H2O2, показал, что планктонные культуры штаммов Sp7, Cd или Sp245 обладают сходной устойчивостью и сохраняют жизнеспособность в присутствии 0.001% H2O2 (например, в присутствии этой концентрации H2O2 около 10% клеток штамма Sp245 сохраняют жизнеспособность при культивировании в жидкой минимальной синтетической среде ‒ см. Wasim et al., 2009). МИК H2O2 для всех трех штаммов составила 0.01% (табл. 3, столбец а).
Таблица 3.
Устойчивость к окислительному стрессу 24 ч планктонных культур (а) и зрелых биопленок A. brasilense (б и в), сформированных в стеклянных пробирках под жидкими средами
| Штамм | *Наличие бактериального роста под толщей полужидкой среды после инкубации в растворе H2O2 | (г) Активность пероксидазы |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| (а) планктонные культуры из |
(б) нативные биопленки из МСС |
(в) **сухие биопленки из МСС |
нативные биопленки из МСС | ||||||||
| МСС + NH4Cl | +/– NH4Cl | +/– NH4Cl | +NH4Cl | –NH4Cl | |||||||
| H2O2, % | ОП490 о-фенилендиамина в присутствии 0.02% H2O2 |
||||||||||
| 0.001 | 0.01 | 0.001 | 0.01 | 0.1 | 1 | 0.001 | 0.01 | 0.1 | |||
| Sp7 | (+) | (–) | (+) | (+) | (+) | (–) | (+) | (+) | (–) | 0.17 ± 0.01 Б |
0.19 ± 0.02 Б |
| Cd | (+) | (–) | (+) | (+) | (+) | (–) | (+) | (+) | (–) | 0.21 ± 0.04 Б |
0.18 ± 0.02 Б |
| Sp245 | (+) | (–) | (+) | (+) | (–) | (–) | (+) | (–) | (–) | 0.13 ± 0.01 А |
0.14 ± 0.02 А |
Примечание. В случае планктонных культур результаты воспроизведены в 7 независимых экспериментах, влияние H2O2 на биопленки (б, в) воспроизведено в 5 независимых экспериментах. Результаты однофакторного дисперсионного (ANOVA) анализа в колонке (г) представлены заглавными буквами. Сравнения последовательно проводили в столбце и строке. А – средние значения с наименьшей величиной. * Планктонные культуры или биопленки после 18 ч инкубации с H2O2 48 ч культивировали в МСС с 0.3% агара без источника связанного азота, планктонные культуры (а) и нативные биопленки (б) содержали 109 КОЕ (в 2 мл суспензии или 1 биопленке соответственно), КОЕ в сухих биопленках (в) см. значения в табл. 2. ** Биопленки (а) высушили и хранили 7 сут при 37°C.
В случае нативных зрелых биопленок устойчивость азоспирилл к окислительному стрессу возрастает. Так, величина МИК 1.0% H2O2 характерна для бактерий из биопленок штаммов Sp7, Cd, независимо от наличия азота в среде (табл. 3, столбцы б). Для Sp245 состав среды также не влияет на МИК, но ее показатель снижается до 0.1% H2O2. Стоит отметить, что после добавления H2O2 к нативным биопленкам наблюдается образование пены, свидетельствующее о выраженной каталазной активности, характерной для азоспирилл (Tarrand et al., 1978). Пенообразование становится интенсивным через 5–10 мин после внесения H2O2. Несомненно, ферменты, позволяющие клеткам справиться с негативным воздействием окислителей, вносят определенный вклад в устойчивость бактерий к стрессу, вызванному H2O2. Для азоспирилл помимо каталазной характерна активность супероксиддисмутазы; алкилгидропероксидредуктаза тоже обеспечивает устойчивость этих бактерий к окислительному стрессу (Nur et al., 1982; Clara, Knowles, 1984; Wasim et al., 2009). Нативные биопленки Sp7, Cd и Sp245 также обладают ферментативной активностью, характерной для пероксидазы (табл. 3, столбцы г). В случае каждого штамма активность пероксидазы не зависит от количества биомассы биопленок (показатель, на который у Sp7 и Cd влияет наличие связанного азота в среде; см. табл. 1). Ферментативная активность в нативных биопленках Sp245 уступает таковой у Sp7 и Cd, что характерно для экстраклеточных пероксидаз фенолоксидазного комплекса этих штаммов (Никитина и соавт., 2010). Предстоит выяснить роль этих ферментов в биопленках. Вполне вероятно, что они помимо окисления токсических фенольных соединений участвуют в комплексном ответе бактерий на H2O2.
Покоящиеся формы Sp245 в сухих биопленках способны сохранять жизнеспособность после инкубации с 0.001% H2O2, а МИК для них составляет, как и для планктонных культур, 0.01% H2O2 (табл. 3, столбцы а, в). Для покоящихся форм Sp7 и Cd МИК составляет 0.1% H2O2, что превышает показатель, характеризующий устойчивость планктонных клеток этих штаммов, но уступает концентрации H2O2, вызывающей гибель бактерий в биопленках (табл. 3). Таким образом, по сравнению с планктонными культурами биопленочная популяция A. brasilense обладает большим потенциалом устойчивости к окислительному стрессу. Покоящиеся формы, являются частью механизмов, способствующих выживанию популяции в условиях данного стресса. По сравнению с Sp7 и Cd, покоящиеся формы, как и биопленки штамма Sp245, оказались более чувствительными к негативному воздействию H2O2, что может являться следствием особенностей адаптации к данному фактору стресса этого штамма, который способен проникать внутрь корней и заселять межклетники проводящей системы (Schloter et al., 1998). Ткани корневой системы пшеницы обладают активной системой, регулирующей уровень H2O2 (Прадедова и соавт., 2011).
Таким образом, на примере штаммов Sp7, Cd и штамма Sp245, заселяющего корневые волоски и межклетники проводящей системы растительного корня, удалось выявить общие черты ультраструктуры биопленок Azospirillum brasilense. Для биопленок бактерий данного вида свойственно наличие нескольких структурных типов одиночных (В- и Дл-клетки), неразделившихся (Дл-клетки) клеток, длинных клеток, покрытых толстым внешним слоем, и ЦП-форм, характеризующихся выраженным морфологическим разнообразием (варианты с различиями в количестве тел и толщине “внешнего слоя”, изолирующего их от внешней среды). Наибольшее морфологическое разнообразие цистоподобных форм обнаружено у штамма Sp7 в пленках, сформированных в условиях лимита по азоту. Цистами называют неподвижные, лишенные метаболической активности бактериальные формы, которые часто окружены толстым слоем капсулы. Для них характерны долгосрочное сохранение жизнеспособности при отсутствии деления, термостойкость, стойкость к высыханию, голоду и окислительному стрессу (Sadoff, 1975). Обычно бактериальная циста формируется из одной бактериальной клетки. Мы обнаружили у азоспирилл делящиеся клетки под толстым внешним слоем, покрывающим цистоподобные формы. Покрытые толстым внешним слоем длинные клетки азоспирилл потенциально могут также являться клеточными формами, устойчивыми к внешним воздействиям (Мулюкин и соавт., 2009).
Необходимо отметить, что морфотип цистоподобных форм, переход вегетативных активно делящихся клеток азоспирилл в цистоподобные, часто является следствием одновременного изменения нескольких параметров состава сред и условий культивирования (Sadasivan et al., 1987; Мулюкин и соавт., 2009). В биопленках азоспирилл из стандартной минимальной среды культивирования этих бактерий (Döbereiner, Day, 1976) присутствуют цистоподобные формы, морфология которых разнообразна, что вероятно заложено в “программу” формирования биопленок, как один из способов адаптации популяции к изменяющимся условиям и воздействию экстремальных факторов. Отсутствие азота в среде способствует увеличению численности морфотипов цистоподобных вариантов, что может объясняться необходимостью адаптации к этим условиям. Так, для покоящихся форм азоспирилл характерна некоторая метаболическая активность (выявлена с помощью транскриптомного анализа) (Malinich, Bauer, 2018). Предполагают, что клетки, морфологически похожие на цистоподобные, фиксируют азот воздуха в биопленках (Wang et al., 2017). Мы показали, что покоящиеся цистоподобные формы являются частью механизмов, способствующих выживанию биопленочной популяции в условиях окислительного стресса. Бактерии, устойчивые к высушиванию даже при низкой численности (в присутствии азота в среде) в биопленках трех штаммов A. brasilense, сохраняют жизнеспособность продолжительное время (в исследованном временном диапазоне – 4 мес.), что, несомненно, способствует устойчивости популяции в целом к данному виду стресса. Покоящиеся формы азоспирилл из жидких сред с азотом при длительном хранении после высушивания быстрее теряют жизнеспособность, по сравнению с клеточными формами, сформированными в условиях без азота (Sadasivan et al. 1987).
В заключение необходимо отметить, что цистоподобные формы азоспирилл обнаружены на корнях растений, заселенных этими бактериями (Bashan et al., 1991; Assmus et al., 1995). Полученные нами данные на модели биопленки/жидкость/стекло, не только согласуются с представлениями о морфологии азоспирилл, живущих на поверхности корня, но и дополняют их сведениями об ультраструктуре и устойчивости к экстремальным факторам биопленок, формирование которых является частью процесса колонизации растений, в том числе и эндофитными штаммами (Eskew et al., 1977; Schloter et al., 1998; Петрова и соавт., 2010; Шелудько и соавт., 2010).
Список литературы
Васильева Г.Г., Глянько А.К., Миронова Н.В., Путилина Т.Е., Лузова Г.Б. Активные формы кислорода в проростках гороха при взаимодействии с симбиотическими и патогенными микроорганизмами // Прикл. биохимия и микробиология. 2007. Т. 43. С. 240–245.
Vasil’eva G.G., Glyan’ko A.G., Mironova N.V., Putilina T.E., Luzova G.B. Active oxygen species in pea seedlings during the interactions with symbiotic and pathogenic microorganisms // Appl. Biochem. Microbiol. 2007. V. 43. P. 217–221.
Методы общей бактериологии / Под ред. Герхардт Ф.: Мир, 1983. Т. 3. 264 с.
Мулюкин А.Л., Сузина Н.Е., Погорелова А.Ю., Антонюк Л.П., Дуда В.И., Эль-Регистан Г.И. Разнообразие морфотипов покоящихся клеток и условия их образования у Azospirillum brasilense // Микробиология. 2009. Т. 78. С. 42–51.
Muliukin A.L., Suzina N.E., Pogorelova A., Antoniuk L.P., Duda V.I., El’-Registan G.I. Diverse morphological types of dormant cells and conditions for their formation in Azospirillum brasilense // Microbiology (Moscow). 2009. V. 78. P. 33–41.
Никитина В.Е., Ветчинкина Е.П., Пономарёва Е.Г., Гоголева Ю.В. Фенолоксидазная активность бактерий рода Azospirillum // Микробиология. 2010. Т. 79. С. 344–351.
Nikitina V.E., Vetchinkina E.P., Ponomareva E.G., Gogoleva Y.V. Phenol oxidase activity in bacteria of the genus Azospirillum // Microbiology (Moscow). 2010. V. 79. P. 327–333.
Петрова Л.П., Шелудько А.В., Кацы Е.И. Плазмидные перестройки и изменения в формировании биопленок Azospirillum brasilense // Микробиология. 2010. Т. 79. С. 129–132.
Petrova L.P., Shelud’ko A.V., Katsy E.I. Plasmid rearrangements and alterations in Azospirillum brasilense biofilm formation // Microbiology (Moscow). 2010. V. 79. P. 121–124.
Прадедова Е.В., Ищеева О.Д., Саляев Р.К. Классификация системы антиоксидантной защиты как основа рациональной организации экспериментального исследования окислительного стресса у растений // Физиология растений. 2011. Т. 58. С. 177–185.
Pradedova E.V., Isheeva O.D., Salyaev R.K. Classification of the antioxidant defense system as the ground for reasonable organization of experimental studies of the oxidative stress in plants // Russ. J. Plant Physiol. 2011. V. 58. P. 210–217.
Шелудько А.В., Широков А.А., Соколова М.К., Соколов О.И., Петрова Л.П., Матора Л.Ю., Кацы Е.И. Колонизация корней пшеницы бактериями Azospirillum brasilense с различной подвижностью // Микробиология. 2010. Т. 79. С. 696–704.
Shelud’ko A.V., Shirokov A.A., Sokolova M.K., Sokolov O.I., Petrova L.P., Matora L.Yu., Katsy E.I. Wheat root colonization by Azospirillum brasilense strains with different motility // Microbiology (Moscow). 2010. V. 79. P. 688–695.
Шелудько А.В., Филипьечева Ю.А., Шумилова Е.М., Хлебцов Б.Н., Буров А.М., Петрова Л.П., Кацы Е.И. Изменения в формировании биопленок у flhB1 мутанта бактерии Azospirillum brasilense Sp245, лишенного жгутиков // Микробиология. 2015. Т. 84. С. 175–183.
Shelud’ko A.V., Filip’echeva Y.A., Shumilova E.M., K-hlebtsov B.N., Burov A.M., Petrova L.P., Katsy E.I. Changes in biofilm formation in the nonflagellated flhB1 mutant of Azospirillum brasilense Sp245 // Microbiology (Moscow). 2015. V. 84. P. 144–151.
Шелудько А.В., Филипьечева Ю.А., Телешева Е.М., Буров А.М., Евстигнеева С.С., Бурыгин Г.Л., Петрова Л.П. Характеристика углеводсодержащих компонентов биопленок Azospirillum brasilense Sp245 // Микробиология. 2018. Т. 87. С. 483–494.
Shelud’ko A.V., Filip’echeva Y.A., Telesheva E.M., Burov A.M., Evstigneeva S.S., Burygin G.L., Petrova L.P. Characterization of carbohydrate-containing components of Azospirillum brasilense Sp245 biofilms // Microbiology (Moscow). 2018. V. 87. P. 610–620.
Assmus B., Hutzler P., Kirchhof G., Amann R., Lawrence J.R., Hartmann A. In situ localization of Azospirillum brasilense in the rhizosphere of wheat with fluorescently labeled, rRNA-targeted oligonucleotide probes and scanning confocal laser microscopy // Appl. Environ. Microbiol. 1995. V. 61. P. 1013–1019.
Baldani V.L.D., Baldani J.I., Döbereiner J. Effects of Azospirillum inoculation on root infection and nitrogen incorporation in wheat // Can. J. Microbiol. 1983. V. 29. P. 924–929.
Bashan Y., Levanony H., Whitmoyer R.E. Root surface colonization of non-cereal crop plants by pleomorphic Azospirillum brasilense Cd // J. Gen. Microbiol. 1991. V. 137. P. 187–196.
Bashan Y., de-Bashan L.E. How the plant growth-promoting bacterium Azospirillum promotes plant growth – a critical assessment // Adv. Agron. 2010. V. 108. P. 77–136.
Berg R.H., Tyler M.E., Novick N.J., Vasil V., Vasil I.K. Biology of Azospirillum–sugarcane association: enhancement of nitrogenase activity // Appl. Environ. Microbiol. 1980. V. 39. P. 642–649.
Bogino P.C., Oliva M.M., Sorroche F.G., Giordano W. The role of bacterial biofilms and surface components in plant-bacterial associations // Int. J. Mol. Sci. 2013. V. 14. P. 15838–15859.
Döbereiner J., Day J.M. Associative symbiosis in tropical grass: Characterization of microorganisms and dinitrogen fixing sites // Symposium on Nitrogen Fixation / Eds. Newton W.E., Nijmans C.J. Pullman: Washington State University Press, 1976. P. 518–538.
Eskew D.L, Focht D.D., Ting L.P. Nitrogen fixation, denitrification and pleomorphic growth in a highly pigmented Spirillum lipoferum // Appl. Environ. Microbiol. 1977. V. 34. P. 582–585.
Fibach-Paldi S., Burdman S., Okon Y. Key physiological properties contributing to rhizosphere adaptation and plant growth promoting abilities of Azospirillum brasilense // FEMS Microbiol. Lett. 2012. V. 326. P. 99–108.
Flemming H.-C., Wingender J. The biofilm matrix // Nat. Rev. Microbiol. 2010. V. 8. P. 623–633.
Hunter R.C., Beveridge T.J. High-resolution visualization of Pseudomonas aeruginosa PAO1 biofilms by freeze-substitution transmission electron microscopy // J. Bacteriol. 2005. V. 187. P. 7619–7630.
Madi L., Henis Y. Aggregation in Azospirillum brasilense Cd: conditions and factors involved in cell-to-cell adhesion // Plant Soil. 1989. V. 115. P. 89–98.
Malinich E.A., Bauer C.E. Transcriptome analysis of Azospirillum brasilense vegetative and cyst states reveals large-scale alterations in metabolic and replicative gene expression // Microb. Genom. 2018. V. 4. P. e000200.
Nur I., Okon Y., Henis Y. Effect of dissolved oxygen tension on production of carotenoids, poly-β-hydroxybutyrate, succinate oxidase and superoxide dismutase by Azospirillum brasilense grown in continuous culture // J. Gen. Microbiol. 1982. V. 128. P. 2937–2943.
O’Toole G.A., Kolter R. Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signalling pathways: a genetic analysis // Mol. Microbiol. 1998. V. 28. P. 449–461.
Pope L.M., Wyss O. Outer layers of the Azotobacter vinelandii cyst // J. Bacteriol. 1970. V. 102. P. 234–239.
Ramírez-Mata A., López-Lara L.I. Xiqui-Vázquez L., Jijón-Moreno S., Romero-Osorio A., Baca B.E. The cyclic-di-GMP diguanylate cyclase CdgA has a role in biofilm formation and exopolysaccharide production in Azospirillum brasilense // Res. Microbiol. 2016. V. 167. P. 190–201.
Sadasivan L., Neyra C.A. Cyst production and brown pigment formation in aging cultures of Azospirillum brasilense ATCC 29145 // J. Bacteriol. 1987. V. 169. P. 1670–1677.
Sadoff H.L. Encystment and germination in Azotobacter vinelandii // Bacteriol. Rev. 1975. V. 39. P. 516–539.
Schloter M., Hartmann A. Endophytic and surface colonization of wheat roots (Triticum aestivum) by different Azospirillum brasilense strains studied with strain-specific monoclonal antibodies // Symbiosis. 1998. V. 25. P. 159–179.
Schelud’ko A.V., Makrushin K.V., Tugarova A.V., Krestinenko V.A., Panasenko V.I., Antonyuk L.P., Katsy E.I. Changes in motility of the rhizobacterium Azospirillum brasilense in the presence of plant lectins // Microbiol. Res. 2009. V. 164. P. 149–156.
Shelud’ko A.V., Filip’echeva Y.A., Telesheva E.M., Yevstigneeva S.S., Petrova L.P., Katsy E.I. Polar flagellum of the alphaproteobacterium Azospirillum brasilense Sp245 plays a role in biofilm biomass accumulation and in biofilm maintenance under stationary and dynamic conditions // World J. Microbiol. Biotechnol. 2019. V. 35. № 2. P. 19.
Tarrand J.J, Krieg N.R., Döbereiner J. A taxonomic study of the Spirillum lipoferum group with description of a new genus, Azospirillum gen. nov. and two species, Azospirillum lipoferum (Beijerinck) comb. nov. and Azospirillum braslense sp. nov. // Can. J. Microbiol. 1978. V. 24. P. 967–980.
Tugarova A.V., Shelud’ko A.V., Dyatlova Yu.A., Filip’echeva Yu.A., Kamnev A.A. FTIR spectroscopic study of biofilms formed by the rhizobacterium Azospirillum brasilense Sp245 and its mutant Azospirillum brasilense Sp245.1610 // J. Mol. Struct. 2017. V. 1140. P. 142–147.
Wang D., Xu A., Elmerich C., Ma L.Z. Biofilm formation enables free-living nitrogen-fixing rhizobacteria to fix nitrogen under aerobic conditions // ISME J. 2017. V. 11. P. 1602–1613.
Wasim M., Bible A.N., Xie Z., Alexandre G. Alkyl hydroperoxide reductase has a role in oxidative stress resistance and in modulating changes in cell-surface properties in Azospirillum brasilense Sp245 // Microbiology (SGM). 2009. V. 155. P. 1192–1202.
Дополнительные материалы отсутствуют.


