Микробиология, 2020, T. 89, № 2, стр. 169-179
Выделение синглетного кислорода мембранами пурпурных фотосинтезирующих бактерий при облучении светом происходит при возможном участии каротиноидов
З. К. Махнева a, А. А. Ашихмин a, М. А. Большаков a, А. А. Москаленко a, *
a Институт фундаментальных проблем биологии РАН, ФИЦ ПНЦБИ РАН
142290 Пущино, Россия
* E-mail: andrey-moskalenko@rambler.ru
Поступила в редакцию 21.05.2019
После доработки 25.07.2019
Принята к публикации 29.09.2019
Аннотация
Изучена возможность выделения синглетного кислорода у пяти видов фотосинтезирующих бактерий при облучении светом с применением красителя Singlet Oxygen Sensor Green (SOSG), который, связывая синглетный кислород, переходит во флуоресцирующую эндопероксидную форму. Облучение проводили светом разного спектрального состава: красным (поглощение бактериохлорофилла, БХл) и белым (поглощение БХл и каротиноидов). На красном свету выделения синглетного кислорода не зафиксировано. Это означает, что БХл в данном процессе не участвует. На белом свету при увеличении времени освещения регистрируется повышение флуоресценции SOSG в мембранах четырех видов бактерий: Allochromatium vinosum МГУ, Rhodobacter sphaeroides G1C, Rba. blasticus К-1 и Rhodopseudomonas faecalis. У Rba. sphaeroides повышение флуоресценции SOSG не отмечено. Предполагается, что на белом свету указанный процесс происходит за счет пигментов, поглощающих в сине-зеленой области спектра, т.е. каротиноидов с количеством сопряженных двойных связей 8‒11 (нейроспорин, сфероиден, ликопин и родопин). Установлено, что SOSG может замедлять процесс выцветания БХл850 в мембранах Alc. vinosum МГУ также, как тролокс и, следовательно, эффективно выполнять роль ловушки синглетного кислорода.
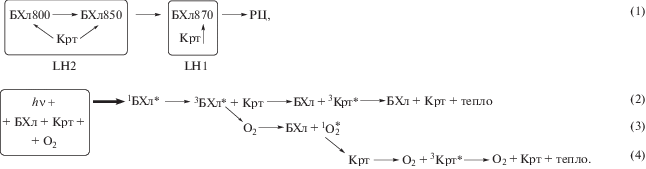
Фотосинтетический аппарат пурпурных фотосинтезирующих бактерий обычно включает два типа пигментов – бактериохлорофилл а (БХл) и каротиноиды, задача которых состоит в поглощении энергии квантов света и передаче поглощенной энергии к реакционному центру (РЦ), где происходит первичное разделение зарядов (Hoff, Deisenhofer, 1997; Cogdell et al., 2004). Основная часть этих пигментов локализована в двух типах светособирающих комплексов: периферийном LH2 (B800‒850) и прицентровом LH1 (B870 или В880). Соотношение этих комплексов может варьировать в зависимости от типа бактерии, условий выращивания и т.д., но в среднем составляет 3‒5 комплексов LH2 на комплекс LH1. В основе структуры светособирающих комплексов лежит гетеродимер. Он состоит из двух α- и β-полипептидов, с которыми нековалентно связаны 2 (комплекс LH1) или 3 молекулы БХл (комплекс LH2) и одна молекула каротиноида (Gabrielsen et al., 2009). Ниже представлены общие упрощенные схемы переноса энергии как внутри, так и между комплексами (1) и возможных сопутствующих процессов (2‒4).
В стандартной цепочке переноса энергии возбуждения в мембране (схема 1 ), которая происходит за счет синглет-синглетного взаимодействия между молекулами пигментов, ее конечным приемником является РЦ. Однако если РЦ не может принять эту энергию, то существует вероятность перехода БХл в комплексах LH2 и/или LH1 в триплетное состояние (схема 2 ). Триплет БХл, в свою очередь, может передать энергию кислороду с образованием синглетного кислорода ($^{1}{\text{О}}_{2}^{*};$ схема 3 ), который является сильным природным окислителем и имеет множество мишеней в клетке, включая белки, липиды, пигменты и т.д. Задача предотвратить образование синглетного кислорода решается в клетке с помощью каротиноидов двумя путями. Во-первых, это непосредственное тушение триплетов БХл и перевод полученной энергии в тепло (схема 2 ). Во-вторых, если синглетный кислород все же образовался, то каротиноиды могут тушить его, также рассеивая полученную энергию в виде тепла (схема 4 ). Подобные схемы в разных вариантах неоднократно приводились в литературе (Fraser et al., 2001; Cong et al., 2008; Gabrielsen et al., 2009). Таким образом, в рассмотренной общепринятой схеме в качестве основного компонента, который способен участвовать в образовании синглетного кислорода, рассматривается БХл. Основная часть этого пигмента (до 99%) локализована в светособирающих комплексах. Задача прямого детектирования выделения синглетного кислорода бактериальными комплексами с помощью флуоресцентных методов представляет достаточно сложную задачу, которая была решена только для выделенных РЦ (Arellano et al., 2007; Uchoa et al., 2008), а для светособирающих комплексов такие данные отсутствуют. Однако существуют косвенные методы выявления синглетного кислорода, которые включают использование ловушек синглетного кислорода и флуоресцентных маркеров. В первом случае используются ловушки типа гистидина или имидазола, которые способны связывать синглетный кислород. Поскольку он образуется из обычного кислорода, то по убыли последнего можно судить об образовании самого синглетного кислорода. Во втором случае флуоресцентный сенсор, который в обычном состоянии не флуоресцирует, после взаимодействия (связывания) с синглетным кислородом переходит во флуоресцирующую форму и, измеряя ее флуоресценцию, можно оценить выделение синглетного кислорода (Kraljic, Mohsni, 1978; Bortolus, Monti, 1989; Bancirova, 2011; Kim et al., 2013; Koh, Fluhr, 2016; Fatima et al., 2016).
В последнее время повысился интерес к влиянию синглетного кислорода на процессы в клетках несерных бактерий. В частности было установлено, что синглетный кислород выделяется в клетках этих бактерий на свету в аэробных условиях (Kochevar, 2004; Berghoff et al., 2011; Kim et al., 2013). Отметим, что синглетный кислород рассматривался в этих работах как сигнальная молекула, которая способна запустить синтез новых белков в клетке. Эти работы проводились с помощью флуоресцентного сенсора Singlet Oxygen Sensor Green (SOSG). Работая с серными бактериями, мы пришли к выводу, что их мембраны могут быть удобным объектом для исследования разных аспектов взаимодействия БХл с синглетным кислородом.
В данной работе мы оценили выделение синглетного кислорода мембранами ряда штаммов серных (Alc. vinosum МГУ) и несерных (Rba. sphaeroides 2R [дикий тип], Rba. sphaeroides G1C, Rba. blasticus К-1, Rps. faecalis) бактерий с помощью SOSG, а также попытались выяснить, можно ли использовать этот маркер как тушитель синглетного кислорода.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования и условия культивирования. В работе использованы мембраны, выделенные из клеток штаммов Alc. vinosum МГУ (старое название Alc. minutissimum МГУ), Rba. sphaeroides 2R (дикий тип), Rba. sphaeroides G1C, Rba. blasticus К-1 и Rps. faecalis. Клетки Alc. vinosum МГУ выращивали на среде Ларсена (Кондратьева, 1972), Rba. sphaeroides 2R и G1C – на среде Хатнера (Cohen-Bazire et al., 1957). Rba. blasticus К-1 и Rps. faecalis культивировали на среде, описанной в работе (Nuyanzina-Boldareva et al., 2014). Культуры Rba. blasticus К-1 и Rps. faecalis получены от профессора В.М. Горленко (Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН, Москва).
Для выделения пигментсодержащих мембран клетки ресуспендировали в 0.05 М Трис-HCl-буфере (рН 8.0) и разрушали на ультразвуковом дезинтеграторе УЗД2-0.1-22 (22 кГц, дважды по 60 с). Неразрушенные клетки и остатки клеточной стенки удаляли методом дифференциального центрифугирования, как описано в работе (Moskalenko et al., 2005). Выделенные мембраны хранили при температуре –18°С.
Методы спектроскопии. Спектры поглощения мембран регистрировали при комнатной температуре на спектрофотометре Cary 50 (“Varian”, Австралия), а спектры флуоресценции на модифицированном спектрофлуориметре Cary Eclipse (“Varian”, Австралия). Модификация заключалась в замене стандартного ФЭУ (R3896) на последнюю модель ФЭУ (R13456, “Hamamatsu”). Тем самым нам удалось увеличить его рабочую область до 950 нм вместо 830 нм у стандартного прибора.
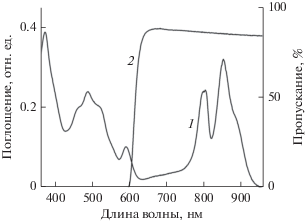
Выделение синглетного кислорода. Для определения возможности выделения синглетного кислорода к образцу добавляли SOSG до конечной концентрации 1 мкM. Облучение образца проводили на красном свету (светофильтр КС-11, λ > 600 нм), который перекрывал область с Qy переходами БХл обоих светособирающих комплексов (рис. 1) или белый свет (каротиноиды + БХл). Все эксперименты с облучением проводились в 1-см кювете при температуре 24°C в термостатируемой ячейке. В качестве осветителя использовали проектор ЛЭТИ с лампой КГМ-500 (500 Вт). Интенсивность красного света (КС-11) составляла 420 Вт/м2, а белого ‒ 700 Вт/м2. Затем регистрировали спектры поглощения, а также спектры флуоресценции образцов при длине волны возбуждающего света 445 нм, область измерения 500‒650 нм. Из значения максимальной флуоресценции образца (при 531 нм) вычитали значение его темновой флуоресценции, то же самое делали для SOSG. Затем из полученного нормированного значения флуоресценции образца вычитали нормированную флуоресценцию SOSG и в результате получали значение флуоресценции образца, связанное с выделением синглетного кислорода. Ошибка в таких измерениях варьировала в пределах 10‒20%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
SOSG синтезирован на основе флуоресцеина путем присоединения к нему молекулы антрацена (рис. 2, вставка) и является одним из немногих имеющихся в продаже флуоресцентных сенсоров синглетного кислорода. В обычном состоянии SOSG практически не флуоресцирует, но после взаимодействия с синглетным кислородом он переходит в эндопероксидную форму, которая имеет высокий квантовый выход флуоресценции. К недостаткам SOSG следует отнести способность самому генерировать синглетный кислород под действием света и возможность его фотодеградации при облучении светом определенной длины волны и интенсивности (Kim et al., 2013). Поэтому на первом этапе мы попытались оценить поведение SOSG при используемых нами параметрах облучения (рис. 2 и 3а). После 30 мин облучения белым светом отмечено небольшое уменьшение поглощения в основном максимуме SOSG при 509 нм и дополнительных максимумах при 374 и 395 нм. На разностном спектре основной отрицательный минимум сдвинут в красную область, по сравнению с основным максимумом поглощения, и локализован при 515 нм. На облучение красным светом SOSG реагирует незначительно (результаты не показаны). Интенсивность флуоресценции с максимумом при 530 нм после 30 мин облучения белым светом составляет около 170 отн. ед. (рис. 2, спектр 4). Представлены результаты одного опыта, а среднее значение трех опытов несколько выше и составляет 196 отн. ед. Если рассматривать флуоресценцию в процессе облучения SOSG, то на белом свету она возрастает пропорционально времени облучения, а на красном – она не растет и даже несколько уменьшается (рис. 3а). Полученные результаты для белого света хорошо совпадают с известными литературными данными при воздействии на SOSG другими параметрами облучения (Kim et al., 2013; Prasad et al., 2018). Известно, что белый свет перекрывает всю область поглощения пигментов (БХл и каротиноиды) у пурпурных бактерий, а красный – только область Qy-переходов БХл в обоих светособирающих комплексах (БХл800, БХл850 и БХл870‒880). Две последние формы БХл являются конечными акцепторами энергии, и именно они способны переходить в триплетное состояние и взаимодействовать с кислородом, образуя синглетный кислород (схемы 1 и 2 ). Исходя из данных представлений, можно предположить, что эффект выделения синглетного кислорода, если таковой имеет место, будет ниже на красном свету, чем на белом, так как последний охватывает практически всю область поглощения пигментов, включая полосу Соре БХл (374 нм) и каротиноиды, и его интенсивность в 1.75 раза выше, чем у красного света.
Рис. 2.
Изменения в спектре поглощения SOSG до (1) и после 30 мин облучения белым светом (2); 3 – разностный спектр SOSG “30 мин облучения – контроль”; 4 – спектр флуоресценции SOSG после 30 мин облучения белым светом. Вставка: химическая формула SOSG до и после взаимодействия с синглетным кислородом.
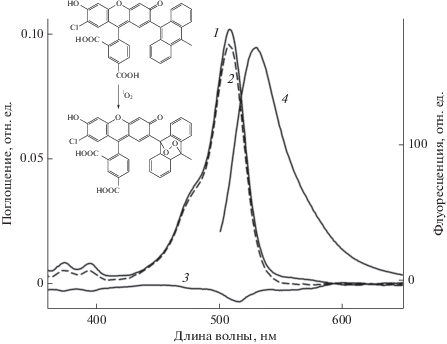
Рис. 3.
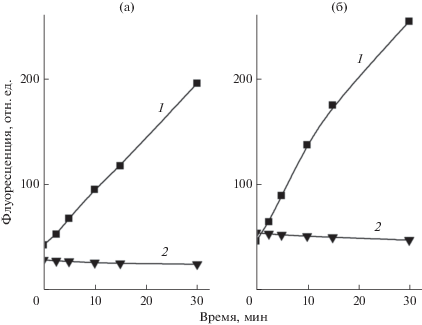
Изменение интенсивности флуоресценции SOSG при облучении белым (1) и красным (2) светом: 1 мкМ SOSG (а), мембраны Alc. vinosum МГУ с 1 мкМ SOSG (б).
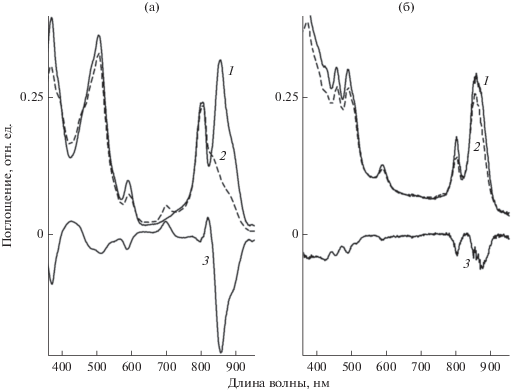
Было проверено действие красного (рис. 4) и белого (рис. 5) света на мембраны всех исследуемых бактерий. Красный свет вызывал небольшое уменьшение поглощения БХл850 в мембранах Alc. vinosum МГУ, что на разностном спектре проявляется как минимум при 861 нм (рис. 4а, спектр 3). Образования продукта окисления БХл не зафиксировано. Ранее мы получили подобные результаты в отсутствии SOSG (Москаленко, 1993). Этот свет не оказывал практически никакого действия на мембраны Rba. sphaeroides G1C (рис. 4б), Rba. sphaeroides, Rba. blasticus К-1 и Rps. faecalis (результаты не показаны). Наиболее существенные изменения наблюдались в спектре поглощения мембран Alc. vinosum МГУ при их облучении белым светом: уменьшались полосы Qy переходов БХл850 и БХл880, Qx перехода БХл590, полосы Соре БХл и каротиноидов (рис. 5а). Одновременно появился максимум поглощения продукта окисления БХл (3-ацетил-хлорофилл) при 699 нм. Его появление также наблюдается при облучении сине-зеленым светом или при химическом окислении БХл850 из Alc. vinosum МГУ (Москаленко, 1993; Махнева и соавт., 2016). Изменения в спектре поглощения мембран Rba. sphaeroides G1C под действием белого света менее выражены (рис. 5б). В этом образце немного выцветали полосы поглощения БХл870, БХл800 и нейроспорина (максимумы при 427, 460 и 490 нм). В мембранах Rba. sphaeroides, Rba. blasticus К-1 и Rps. faecalis незначительно выцветали полосы БХл в ближней ИК области (результаты не показаны). Таким образом, из пяти исследованных бактерий только у одной (Alc. vinosum МГУ) отмечены резкие изменения в спектре поглощения на белом свету. Полученные результаты совпадают с данными работы (Berghoff et al., 2011), в которой отмечено отсутствие деградации мембран Rba. sphaeroides 2.4.1 и Rsb. denitrificans OCh114 при облучении белым светом мощностью 800 Вт/м2 в течение 30 мин.
Рис. 4.
Изменения в спектре поглощения мембран Alc. vinosum МГУ (а) и Rba. sphaeroides G1C (б) в присутствии 1 мкМ SOSG до (1) и после (2) 30 мин облучения красным светом; 3 ‒ разностный спектр “30 мин облучения ‒ контроль”.
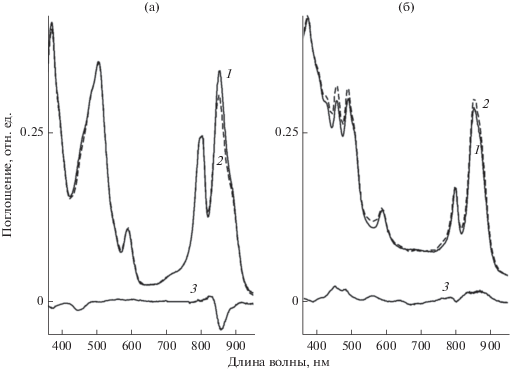
Рис. 5.
Изменения в спектре поглощения мембран Alc. vinosum МГУ (а) и Rba. sphaeroides G1C (б) в присутствии 1 мкМ SOSG до (1) и после 30 мин (2) облучения белым светом; 3 ‒ разностный спектр “30 мин облучения – контроль”.
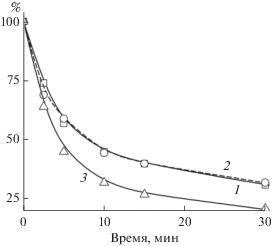
Изменение интенсивности флуоресценции SOSG при облучении белым или красным светом мембран Alc. vinosum МГУ показано на рис. 3б. На красном свету уровень флуоресценции SOSG несколько уменьшается, а на белом он растет с увеличением времени облучения и превышает уровень контроля на 50–60 отн. ед., что свидетельствует о небольшом выделении синглетного кислорода в этом образце на белом свету и фактическое отсутствие его выделения на красном. Результаты по флуоресценции SOSG для всех исследованных образцов суммированы на рис. 6. Из него следует, что на красном свету в мембранах синглетный кислород фактически не выделяется, более того, у Alc. vinosum МГУ и Rba. sphaeroides 2R отмечено уменьшение сигнала до отрицательных значений, причина которого не ясна. На белом свету все образцы, за исключением Rba. sphaeroides 2R, демонстрируют увеличение уровня флуоресценции SOSG, что, в свою очередь, означает, что он связывает часть молекул синглетного кислорода. Ранее SOSG характеризовался как чувствительный и специфический сенсор для синглетного кислорода, способный обнаруживать его низкие уровни, которые вырабатывались наномолярными концентрациями бенгальского розового (Koh, Fluhr, 2016). Мы попытались оценить, насколько SOSG эффективен в качестве ловушки синглетного кислорода. Известно несколько ловушек синглетного кислорода, в частности, гистидин, имидазол, тролокс и т.д., которые широко применяются на биологических объектах (Kraljic, Mohsni, 1978; Gutiérrez et al., 2001; Krieger-Liszkay, Trebst, 2006; Ohara et al, 2009; Махнева и соавт., 2019). Ранее мы провели оценку эффективности подобных ловушек в системе: мембраны + бенгальский розовый + свет + ловушка синглетного кислорода. Было показано, что в подобной системе (образцом служили мембраны Alc. vinosum МГУ) большая часть ловушек эффективно работала при миллимолярных концентрациях. Исключение составил тролокс, который был эффективен при микромолярных концентрациях (Махнева и соавт., 2019). Поэтому было проверено, как влияют 1 мкМ SOSG и 1 мкМ тролокс на выцветание БХл850 в мембранах Alc. vinosum МГУ на белом свету (рис. 7). Из этих результатов следует, что оба агента действуют практически одинаково, хотя между ними есть существенная разница: тролокс – это водорастворимый аналог витамина Е, а SOSG – гидрофобный агент. Возможно, что при увеличении действующей концентрации до 100 мкМ SOSG сможет замедлять данный процесс также эффективно, как тролокс, если не произойдет агрегации SOSG при добавлении его высоких концентраций к образцу.
Рис. 6.
Изменения интенсивности флуоресценции SOSG при облучении мембран 30 мин красным (а) или белым (б) светом. Идентификация образцов: 1 – Alc. vinosum МГУ; 2 – Rba. sphaeroides; 3 – Rba. sphaeroides G1C; 4 – Rba. blasticus К-1, 5 – Rps. faecalis.
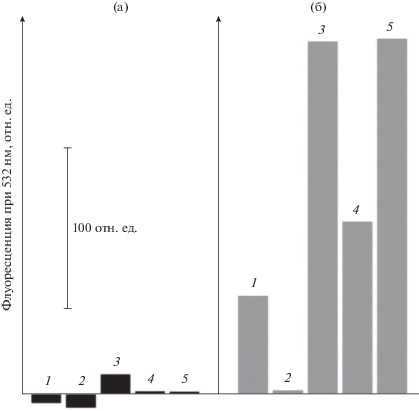
Рис. 7.
Выцветание полосы поглощения БХл850 в мембранах Alc. vinosum МГУ при облучении белым светом: 1 – “+1 мкМ SOSG”; 2 ‒ “+1 мкМ тролокс”; 3 – без добавок (контроль).
Оценивая представленные данные, можно отметить, что они не согласуются с высказанным выше предположением о возможности выделения синглетного кислорода в мембранах фотосинтезирующих бактерий на красном свету. На их основании можно сделать весьма обоснованный вывод о том, что БХл не участвует в этом процессе. Для его проверки был проведен дополнительный эксперимент с мембранами Rba. sphaeroides 2R, в которых часть комплексов (~30%) была разрушена нагреванием образца в течение 2 мин при 90°C, что привело к образованию мономерного БХл. На красном свету этот БХл быстро выцветал (рис. 8), однако увеличения флуоресценции SOSG зафиксировано не было (результаты не показаны). На разностном спектре данного образца (рис. 8, спектр 3) отсутствует максимум поглощения основного продукта окисления БХл – 3-ацетил-хлорофилла, и, по-видимому, происходит более глубокое окисление БХл. Известно, что при окислении БХл в растворителе под действием света образуется до 10 различных соединений, включая хлорины, билины и т.д. (Limantarai et al., 2006). Этот процесс связан с тем, что БХл в растворителях способен к выделению синглетного кислорода с высоким квантовым выходом (Redmond, Gamlin, 1999), который, в свою очередь, легко окисляет сам пигмент. Возможно, что такой же процесс происходит с мономерным БХл в мембранах на свету. Синглетный кислород в этом случае расходуется на окисление самого БХл, после чего его выделение прекращается и поэтому зафиксировать его присутствие при помощи SOSG в мембранах с некоторым количеством мономерного БХл не удается.
Рис. 8.
Изменения в спектре поглощения мембран Rba. sphaeroides, прогретых в течение 2 мин при 90°С до (1) и после (2) 30-мин облучения красным светом; 3 ‒ разностный спектр “30 мин облучения ‒ контроль”.
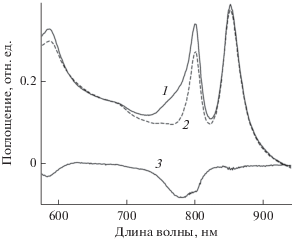
Очевидно, что выделение синглетного кислорода происходит при освещении сине-зеленой области спектра. Основными пигментами, которые поглощают в этой области, являются каротиноиды, и они, по общему мнению, должны тушить синглетный кислород. В классической работе (Griffith et al., 1955) было показано, что после подачи в среду выращивания кислорода, клетки бескаротиноидного мутанта Rba. sphaeroides R26 прекращали свой рост и, одновременно, отмечено уменьшение (окисление) концентрации БХл в течение 5 ч. Затем начинался небольшой рост клеток, а окисление БХл ускорялось. Авторы связали этот процесс с отсутствием каротиноидов. Результаты этой работы легли в основу общепринятого мнения о том, что в бескаротиноидных мутантах триплеты БХл взаимодействуют с кислородом, и в результате происходит образование синглетного кислорода, который и окисляет БХл. Следует отметить, что существует ряд работ, результаты которых не согласуются с этой гипотезой. В работе (Dworkin., 1958) было установлено, что кратковременная экспозиция бескаротиноидного мутанта Rba. sphaeroides R26 в темноте при продувании через него смеси 95% воздуха и 5% CO2 с последующим переносом на свет останавливала процесс разрушения БХл в клетках на 45 мин, хотя, в соответствии с общепринятой гипотезой, такой задержки быть не могло. Кроме того, процесс разрушения клеток этого мутанта сильно зависел от температуры и замедлялся на ~25% при понижении температуры от 30 до 20°C, а при 6°C останавливался, что также не согласуется с определяющей ролью каротиноидов в процессе защиты БХл от окисления. Ранее мы провели прямое тестирование устойчивости БХл в мембранах из диких штаммов серных и несерных бактерий и их бескаротиноидных аналогов к синглетному кислороду и показали, что БХл в мембранах бескаротиноидных мутантов несерных бактерий был более стабилен по сравнению с БХл из контрольных образцов (Махнева и соавт., 2019). Если учесть указанные данные и то обстоятельство, что мономерный БХл легко окисляется на красном свету в присутствии кислорода (результаты данной работы), то очевидно, что в бескаротиноидных мутантах на свету в аэробных условиях сначала должно произойти образование мономерного БХл (разрушение светособирающих комплексов), а затем его окисление. Такой процесс ведет к уменьшению количества БХл в популяции клеток бескаротиноидного мутанта, что и наблюдалось в работе Griffith et al. (1955).
Ранее (Glaeser, Klug, 2005) было продемонстрировано выделение синглетного кислорода культурой бескаротиноидного мутанта Rba. sphaeroides ТС67 при освещении 20 Вт/м2 в присутствии DanePy (3-(N-диэтиламиноэтил)-N-дансил-аминометил 2,5-дигидро-2,2,5,5-тетраметил-1H-пиррол). DanePy является одновременно сенсором синглетного кислорода и ЭПР меткой и, связывая синглетный кислород, переходит в нитроксидный радикал, флуоресценция которого уменьшается. К сожалению, в статье не установлено, как коррелирует выделение синглетного кислорода с уменьшением концентрации БХл, как было отмечено в классической работе (Griffith et al., 1955). Дикий штамм Rba. sphaeroides (2.4.1) в указанных условиях выделял небольшое количество синглетного кислорода только через 100‒120 мин при культивировании на белом свету интенсивностью 800 Вт/м2. Позднее эти результаты были подтверждены для Rba. sphaeroides (2.4.1), а также установлено, что бактерия Rsb. denitrificans Och114 способна выделять бóльшее количество (~4 раза) синглетного кислорода на белом свету (Bergoff et al., 2011). Представленные в данной статье результаты не совпадают с данными цитируемых работ для Rba. sphaeroides, что может быть связано с использованием разных штаммов этой бактерии, а также с быстрой дезактивацией синглетного кислорода. Остальные бактерии (Alc. vinosum МГУ, Rba. sphaeroides G1C, Rba. blasticus К-1 и Rps. faecalis), которые содержали каротиноиды, выделяли детектируемое с помощью SOSG некоторое количество синглетного кислорода при облучении белым светом.
Как уже отмечено выше, этот процесс может быть связан с присутствием в мембранах каротиноидов. Ранее мы неоднократно показали, что сине-зеленый свет, поглощаемый каротиноидами, инициирует окисление БХл850 комплекса LH2 Alc. vinosum МГУ до 3-ацетил-хлорофилла (Махнева и соавт., 2007, 2009; Большаков, 2012). В исследуемых нами образцах содержались следующие основные каротиноиды, содержание которых >10% (цифры округлены до целых значений): Alc. vinosum МГУ ‒ родопин 66%, спириллоксантин 16% и 3,4-дидегидрородопин 13%; Rba. sphaeroides 2R – сфероиден 96%; Rba. sphaeroides G1C ‒ нейроспорин 99%; Rba. blasticus К-1 ‒ сфероиден 81%; Rps. faecalis ‒ 3,4-дидегидрородопин 41%, ликопин 36% и родопин 23%. Оба образца, содержащие родопин, демонстрируют выделение синглетного кислорода. С образцами со сфероиденом ситуация более сложная: в диком штамме Rba. sphaeroides 2R выделение синглетного кислорода отсутствует, но оно регистрируется в диком штамме Rba. blasticus К-1 (сфероиден) и Rba. sphaeroides G1C, в котором сфероиден заменен нейроспорином.
Известно, что в нейтральном состоянии каротиноиды являются эффективными тушителями синглетного кислорода, и эффективность этого процесса зависит от количества сопряженных двойных связей (СДС) в молекуле пигмента: на уровне 11 СДС этот показатель практически достигает максимума в модельных системах (Foote et al., 1970). В наших образцах присутствуют каротиноиды с меньшим количеством СДС (нейроспорин ‒ 9, сфероиден – 10) и два каротиноида с 11 двойными связями (ликопин и родопин). При облучении белым светом каротиноиды проходят ряд возбужденных состояний. Основное внимание всегда уделялось разным аспектам взаимодействия каротиноидов с БХл (светособирающая функция, синглет-синглетное взаимодействие) и БХл с каротиноидами (тушение триплетов БХл каротиноидами) in vivo или тушению синглетного кислорода каротиноидами в модельных системах (Cong et al., 2008; Chi et al., 2015; Dilbeck et al., 2016; Hashimoto et al., 2018; Ашихмин и соавт., 2018). Работы по изучению возможности выделения синглетного кислорода после взаимодействия кислорода с возбужденными молекулами каротиноидов не проводились. Квантовый выход подобной реакции низкий, и чтобы ее зафиксировать, нужны целенаправленные измерения.
Таким образом, была изучена возможность выделения синглетного кислорода в мембранах Alc. vinosum МГУ, Rba. sphaeroides G1C, Rba. blasticus К-1, Rps. faecalis и Rba. sphaeroides при облучении белым и красным светом. Установлено, что у всех изученных бактерий, кроме Rba. sphaeroides дикого типа, регистрировалось увеличение флуоресценции SOSG на белом свету. На красном свету, в области поглощения Qу полос БХл, выделение синглетного кислорода в изученных мембранах не наблюдалось. Это означает, что БХл в этом процессе не участвует. Предполагается, что на белом свету указанный процесс происходит за счет пигментов, поглощающих в сине-зеленой области спектра, т.е. каротиноидов, и что они с количеством СДС 8‒11 (нейроспорин, сфероиден, ликопин и родопин) могут быть активны в этом процессе. Установлено, что SOSG может замедлять процесс выцветания БХл850 в мембранах Alc. vinosum МГУ также эффективно, как тролокс, и, следовательно, эффективно выполнять роль ловушки синглетного кислорода.
Список литературы
Ашихмин А.А., Махнева З.К., Большаков М.А., Москаленко А.А. Влияние количества сопряженных двойных связей в молекулах каротиноидов на эффективность переноса энергии на бактериохлорофилл в светособирающих комплексах LH2 из Allochromatium vinosum шт. МГУ // ДАН. 2018. Т. 483. С. 333–337.
Ashikhmin A.A., Makhneva Z.K., Bolshakov M.A., Moskalenko A.A. The influence of the number of conjugated double bonds in carotenoid molecules on the energy transfer efficiency to bacteriochlorophyll in light-harvesting complexes LH2 from Allochromatium vinosum strain MSU // Dokl. Biochem. Biophys. 2018. V. 483. P. 321–325.
Большаков М.А. Роль каротиноидов в процессе фотоокисления бактериохлорофилла in vivo. Автореферат дис. … канд. биол. наук. Пущино: Институт фундаментальных проблем биологии РАН, 2012. 22 с.
Кондратьева Е.Н. Фотосинтезирующие бактерии и бактериальный фотосинтез. М.: Изд-во МГУ, 1972. 76 с.
Махнева З.К., Ерохин Ю.Е., Москаленко А.А. Фотосенсибилизированное каротиноидами окисление димеров бактериохлорофилла светособирающих комплексов В800–850 в клетках Allochromatium minutissimum // ДАН. 2007. Т. 416. С. 408–411.
Makhneva Z.K., Erokhin Yu.E., Moskalenko A.A. Carotenoid-photosensitized oxidation of bacteriochlorophyll dimers in light-harvesting complexes B800‒850 in Allochromatium minutissimum cells // Dokl. Biochem. Biophys. 2007. V. 416. P. 256–259.
Махнева З.К., Большаков М.А., Ашихмин А.А., Ерохин Ю.Е., Москаленко А.А. Влияние синего света на стабильность структуры антенных комплексов из Allochromatium minutissimum с разным содержанием каротиноидов // Биол. мембраны. 2009. Т. 26. С. 188–193.
Makhneva Z.K., Bolshakov M.A., Ashikhmin A.A., Erokhin Y.E., Moskalenko A.A. Influence of blue light on the structure stability of antenna complexes from Allochromatium minutissimum with different content of carotenoids // Biochemistry (Moscow) Supplement. Series A: Membrane and Cell Biology. 2009. V. 3. P. 123–127.
Махнева З.К., Ашихмин А.А., Большаков М.А., Москаленко А.А. Образование 3-ацетил-хлорофилла в светособирающих комплексах пурпурных бактерий при химическом окислении // Биохимия. 2016. Т. 81. С. 282–294.
Makhneva Z.K., Ashikhmin A.A., Bolshakov M.A., Moskalenko A.A. 3-Acetyl-chlorophyll formation in light harvesting complexes of purple bacteria by chemical oxidation // Biochemistry (Moscow). 2016. V. 81. P. 176–186.
Махнева З.К., Ашихмин А.А., Большаков М.А., Москаленко А.А. Защита БХл850 от действия синглетного кислорода в мембранах серной фотосинтезирующей бактерии Allochromatium vinosum с помощью тушителей // Микробиология. 2019. Т. 88. С. 91–99.
Makhneva Z.K., Ashikhmin A.A., Bolshakov M.A., Moskalenko A.A. Protection of BChl850 from action of singlet oxygen in the membranes of sulfur photosynthetic bacterium Allochromatium vinosum strain MSU by quenchers // Microbiology (Moscow). 2019. V. 88. P. 79–86.
Москаленко А.А. Пигмент-белковые комплексы и их взаимодействие в структурах фотосинтетического аппарата бактерий и растений. Дис. … докт. биол. наук в форме научного доклада. ИПФС РАН. Пущино, 1993. 37 с.
Arellano J.B., Yousef Y.A., Melø T.B., Mahamad S.B., Cogdell R.J., Naqvi K.R. Formation and geminate quenching of singlet oxygen in purple bacterial reaction center // J. Photochem. Photobiol. 2007. V. 87. P. 105–112.
Berghoff B.A., Glaeser J., Nuss A.M., Zobawa M., Lottspeich F., Klug G. Anoxygenic photosynthesis and photooxidative stress: a particular challenge for Roseobacter // Environ. Microbiol. 2011. V. 13. P. 775–791.
Bortolus P., Monti S. Physical quenching and chemical reaction of singlet molecular oxygen with Azo dyes // J. Organic. Chem. 1989. V. 54. P. 534–540.
Bancirova M. Sodium azide as a specific quencher of singlet oxygen during chemiluminescent detection by luminol and Cypridina luciferin analogues // Luminescence. 2011. V. 26. P. 685–688.
Chi S.C., Mothersole D.J., Dilbeck P., Niedzwiedzki D.M., Zhang H., Qian P., Vasilev C., Grayson K.J., Jakson P.J., Martin C.E., Ying L., Neil Hunter C. Assembly of functional photosystem complexes in Rhodobacter sphaeroides incorporating carotenoids from the spirilloxanthin pathway // Biochim. Biophys. Acta – Bioenergetics. 2015. V. 1847. P. 189–201.
Cogdell R.J., Gardiner A.T., Roszak A.W., Law C.J., Southall J., Isaacs N.W. Rings, ellipses and horseshoes: how purple bacteria harvest solar energy // Photosynth. Res. 2004. V. 81. P. 207–214.
Cohen-Bazire G., Sistrom W.R., Stanier R.Y. Kinetic studies of pigment synthesis by non-sulfur purple bacteria // J. Cell. Comp. Physiol. 1957. V. 49. P. 25–68.
Cong H., Niedzwiedzki D.M., Gibson G.N., LaFountain A.M., Kelsh R.M., Gardiner A.T., Cogdell R.J., Frank H.A. Ultrafast time resolved carotenoid to-bacteriochlorophyll energy transfer in LH2 complexes from photosynthetic bacteria // J. Phys. Chem. B. 2008. V. 112. P. 10689–10703.
Dilbeck P.L., Tang Q., Mothersole D.J., Martin E.C., Hunter C.N., Bocian D.F., Holten D., Niedzwiedzki D.M. Quenching capabilities of long-chain carotenoids in light-harvesting-2 complexes from Rhodobacter sphaeroides with an engineered carotenoid synthesis pathway // J. Phys. Chem. B. 2016. V. 120. P. 5429–5443.
Dworkin M. Endogenous photosensitization in a carotenoidless mutant of Rhodopseudomonas spheroids // J. Gen. Physiol. 1958. V. 41. P. 1099–1112.
Fatima K., Masood N., Luqman S. Quenching of singlet oxygen by natural and synthetic antioxidants and assessment of electronic UV/Visible absorption spectra for alleviating or enhancing the efficacy of photodynamic therapy // Biomed. Res. Ther. 2016. V. 3. P. 514–527.
Foote C.S., Chang Y.C., Denny R.W. Chemistry of singlet oxygen. X. Carotenoid quenching parallels biological protection // J. Amer. Chem. Soc. 1970. V. 92. P. 5216–5218.
Fraser N.J., Hashimoto H., Cogdell R.J. Carotenoids and bacterial photosynthesis: The story so far... // Photosynth. Res. 2001. V. 70. P. 249–256.
Gabrielsen M., Gardiner A.T., Cogdell R.J. Peripheral complexes of purple bacteria // The Purple Phototrophic Bacteria / Eds. Hunter C.N., Daldal F., Thurnauer, M.C., Beatty, J.T. 2009. Ch. 8. P. 135–153. Glaeser J., Klug G. Photo-oxidative stress in Rhodobacter sphaeroides: protective role of carotenoids and expression of selected genes // Microbiology (SGM). 2005. V. 151. P. 1927–1938.
Griffith M., Sistrom W.R., Cohen-Bazire G., Stanier R.Y. Functions of carotenoids in photosynthesis // Nature. 1955. V. 176. P. 1211–1214.
Gutiérrez I., Criado S., Bertolotti S., Norman A., Garcia N. Dark and photoinduced interactions between trolox, a polar-solvent-soluble model for vitamin E, and riboflavin // J. Photochem. Photobiol. 2001. V. 62. P. 133–139.
Hashimoto H., Uragami C., Yukihira N., Gardiner A.T., Cogdell R.J. Understanding/unravelling carotenoid excited singlet states // J. R. Soc. Interface. 2018. V. 15. Article 20180026. https://doi.org/10.1098/rsif.2018.0026
Hoff A.J., Deisenhofer J. Photophysics of photosynthesis. Structure and spectroscopy of reaction centers of purple bacteria // Physics Rep. 1997. V. 287. P. l–247.
Kim S., Fujitsuka M., Majima T. Photochemistry of singlet oxygen sensor green // J. Phys. Chem. B. 2013. V. 117. P. 13985–13992.
Kochevar I.E. Singlet oxygen signaling: from intimate to global // Sci. STKE. 2004. V. 221. pe7. https://doi.org/10.1126/stke.2212004pe7
Koh E., Fluhr R. Singlet oxygen detection in biological systems: Uses and limitations // Plant Signal. Behav. 2016. V. 11. Article e1192742. https://doi.org/10.1080/15592324.2016.1192742
Kraljic I., Mohsni S.El. A new method for the detection of singlet oxygen in aqueous solutions // Photochem. Photobiol. 1978. V. 28. P. 577–581.
Krieger-Liszkay A., Trebst A. Tocopherol is the scavenger of singlet oxygen produced by the triplet states of chlorophyll in the PSII reaction centre // J. Exp. Bot. 2006. V. 57. P. 1677–1684.
Limantarai L., Koehler P., Wilhelm B., Robert J., Porra R.J., Scheer H. Photostability of bacteriochlorophyll a and derivatives: potential sensitizers for photodynamic tumor therapy // Photochem. Photobiol. 2006. V. 82. P. 770–780.
Moskalenko A.A., Makhneva Z.K., Fiedor L., Scheer H. Effects of carotenoid inhibition on the photosynthetic RC–LH1 complex in purple sulphur bacterium Thiorhodospira sibirica // Photosynth. Res. 2005. V. 86. P. 71–80.
Nuyanzina-Boldareva E.N., Kalashnikov A.M., Gaisin V.A., Sukhacheva M.V., Kuznetsov B.B., Gorlenko V.M. Characterization of a new strain of a purple nonsulfur bacterium from a thermal spring // Microbiology (Moscow). 2014. V. 83. P. 39–46.
Ohara K., Kikuchi K., Origuchi T., Nagaoka S. Singlet oxygen quenching by trolox C in aqueous micelle solutions // J. Photochem. Photobiol. B. 2009. V. 97. P. 132–137.
Prasad A., Sedlářová M., Pospíšil P. Singlet oxygen imaging using fluorescent probe Singlet Oxygen Sensor Green in photosynthetic organisms // Sci. Rep. 2018. V. 8. Article 13685. https://doi.org/10.1038/s41598-018-31638-5
Redmond R.W. Gamlin J.N. A compilation of singlet oxygen yields from biologically relevant molecules // Photochem. Photobiol. 1999. V. 70. P. 391–475.
Uchoa A.F., Knox P.P., Turchielle R., Seifullina N.Kh., Baptista S.M. Singlet oxygen generation in the reaction centers of Rhodobacter sphaeroides // Eur. Biophys. 2008. V. 37. P. 843–850.
Дополнительные материалы отсутствуют.