Микробиология, 2020, T. 89, № 3, стр. 276-283
Карбоангидраза аноксигенных фототрофных бактерий
Р. Н. Ивановский a, *, О. И. Кеппен a, Н. В. Лебедева a, Д. С. Груздев b
a Кафедра микробиологии биологического факультета МГУ им. М.В. Ломоносова
119192 Москва, Россия
b ФИЦ Фундаментальные основы биотехнологии РАН,
лаборатория молекулярной диагностики
119071 Москва, Россия
* E-mail: mguru@mail.ru
Поступила в редакцию 09.07.2019
После доработки 27.10.2019
Принята к публикации 01.11.2019
Аннотация
Гены карбоангидразы (КА) обнаружены у всех аноксигенных пурпурных бактерий. Несерные пурпурные бактерии, принадлежащие к α протеобактериям: Rhodospirillum rubrum, Rhodospirillum fulvum, Rhodoblastus acidophilus и Rhodopseudomonas palustris содержали гены α- и β-КА. α-Протеобактерии Rhodomicrobium vannielii, Blastochloris viridis, Rhodobacter sphaeroides, Rhodobacter capsulatus, Rhodobacter veldkampii, Rhodovulum euryhalinum, Rhodovulum sulfidophilum обладали только генами β-КА. Несерные пурпурные бактерии, относящиеся к β протеобактериям Rubrivivax gelatinosus, и пурпурные серные бактерии, относящиеся к γ-протеобактериям, содержали гены α- и β-КА. Зеленые серные бактерии Chlorobaculum limnaeum и Chlorobaculum parvum и зеленые несерные нитчатые бактерии Chloroflexus aurantiacus не содержали генов КА. Однако у Oscillochloris trichoides, принадлежащий к той же таксономической группе, обнаружен ген β-КА. γ-КА в геномах исследованных в данной работе фототрофных бактерий не обнаружена. Несмотря на наличие генов КА, у всех пурпурных бактерий активность α- и β-КА была выявлена только у 4 видов пурпурных несерных, относящихся к α-протеобактериям: Rhodospirillum rubrum, Rhodopseudomonas palustris, Rhodoblastus acidophilus и Rhodospirillum fulvum. Эти бактерии способны синтезировать КА как в фотоавтотрофных, так и в фотогетеротрофных условиях роста на средах с ацетатом, малатом или фруктозой. Кроме того, эти бактерии (за исключением Rhodospirillum fulvum, не способной расти в аэробных условиях) обладают КА-активностью и при росте в темноте в аэробных условиях.
В метаболизме бактерий имеется значительное число реакций, субстратом которых являются СО2 или ${\text{HCO}}_{3}^{ - }$. При этом различные пути автотрофной ассимиляции в качестве субстрата в реакциях карбоксилирования используют различные формы неорганического углерода (табл. 1). Концентрация углекислого газа в современной атмосфере составляет 0.04%, что соответствует 12 мкМ для СО2 и 120 мкМ для ${\text{HCO}}_{{\text{3}}}^{ - },$ растворенных в воде (DiMario, 2018). Это ниже величины Km для большинства ферментов, использующих CO2 и/или ${\text{HCO}}_{{\text{3}}}^{ - },$ осуществляющих реакцию карбоксилирования, таких как рибулозо-1,5-бисфосфаткарбоксилаза (РБК), пируваткарбоксилаза, ацетил-КоА-карбоксилаза, фосфоенолпируваткарбоксилаза, пируват- и 3-оксоглутаратсинтаза (Furdui, Ragsdale, 2000; DiMario, 2018). Кроме того, карбоксилазы, использующие СО2 в качестве субстрата, имеют низкое сродство к СО2 (Km) и низкую каталитическую активность. Kcat (число оборотов) для различных форм РБК колеблется в пределах от 4 до 11 s–1, а у пируватсинтазы Clostridium thermoaceticum равна 3.2 s–1 и Km = 2 мM (Furdui, Ragsdale, 2000; Badger, Bek, 2008).
Таблица 1.
Форма неорганического углерода (СО2/${\text{НСО}}_{{\text{3}}}^{ - }$), используемая в качестве субстрата различными карбоксилазами у фототрофных бактерий
| Путь автотрофной фиксации углерода | Фермент | Форма неорганического углерода |
|---|---|---|
| Восстановительный пентозофосфатный цикл (цикл Кальвина) | Рибулозо-1,5-бисфосфат карбоксилаза/оксигеназа | СО2 |
| Восстановительный цикл трикарбоновых кислот | Изоцитратдегидрогеназа | СО2 |
| Пируватсинтаза | СО2 | |
| 2-Оксоглутаратсинтаза | СО2 | |
| Фосфоенолпируваткарбоксилаза | ${\text{HCO}}_{3}^{ - }$ | |
| 3-Гидроксипропионатный цикл | Ацетил-КоА-карбоксилаза | ${\text{HCO}}_{3}^{ - }$ |
| Пропионил-КоА-карбоксилаза | ${\text{HCO}}_{3}^{ - }$ |
Для поддержания максимальной скорости функционирования карбоксилирующих ферментов необходимо восполнять концентрацию CO2/${\text{HCO}}_{{\text{3}}}^{ - },$ расходуемых в реакциях карбоксилирования. Эту функцию выполняет карбоангидраза (КА) (EC 4.2.1.1). Необходимость этого обусловлена тем, что спонтанная обратимая гидратация углекислоты СО2 + Н2О ⇆ ${\text{HCO}}_{{\text{3}}}^{ - }$ + Н+ – медленный процесс с Kcat = 15 и 50 s−1 в прямом и обратном направлении соответственно. Карбоангидраза ускоряет эту реакцию на 4–6 порядков (Kcat = 104–106 s−1) (Supuran, Capasso, 2017).
Гены КА обнаружены у представителей всех трех таксономических доменов: архей, бактерий и эукариот (Capasso, Supuran, 2015). Исключение составляют эндосимбионты или бактерии, растущие при высоком (1–5%) содержании СО2 в окружающей среде. Предполагается, что эти бактерии утратили КА в процессе адаптации к таким условиям (Ueda et al., 2012). Карбоангидразы бактерий принадлежат к трем генетически различным группам: α- β- и γ-КА. В их каталитическом центре содержатся ион Zn2+. α-КА локализована в периплазматическом пространстве и встречается только у грамотрицатальных бактерий (Supuran, Capasso, 2017). β- и γ-КА имеют цитоплазматическую локализацию (Gai et al., 2014; Capasso, Supuran, 2015). КА является также обязательным компонентом карбоксисом цианобактерий и хемолитоавтотрофных бактерий (Sawaya et al., 2006; Rae et al., 2013).
Исследование КА фототрофных организмов ограничено в основном высшими растениями, водорослями и цианобактериями (DiMario, 2018). КА фототрофных бактерий исследованы в значительно меньшей степени. Наличие карбоангидразной активности показано для двух видов: Rhodospirillum rubrum (Gill et al., 1984) и Rhodopseudomonas palustris (Puskas et al., 2000). КА обеих бактерий были очищены до гомогенного состояния, имели молекулярную массу 28 и 27 кДа соответственно и относились к КА α-типа. Локализация и функция КА исследованы только для Rps. palustris. КА Rps. palustris локализована в периплазматическом пространстве, и, по-видимому, ее основной функцией является участие в системе транспорта неорганического углерода в клетки бактерии, восполняя его убыль в периплазме в результате функционирования внутриклеточных реакций карбоксилирования. В пользу этого свидетельствует торможение роста R. palustris при добавлении ацетазоламида – ингибитора КА, и медленный рост мутантов, лишенных α-КА. Добавление высоких концентраций бикарбоната или СО2 восстанавливает скорость роста R. palustris (Puskas et al., 2000).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования были 23 штамма фототрофных бактерий из коллекции кафедры микробиологии Московского государственного университета им. М.В. Ломоносова. Бактерии Rhodospirillum rubrum, Phaeospirillum fulvum, Rhodopseudomonas palustris, Rhodomicrobium vannielii, Rhodobacter sphaeroides, Rhodobacter capsulatus, Blastochloris viridis выращивали на среде Ормерода (Ormerod et al., 1961); Rhodoblastus acidophilus, Rhodovulum euryhalinum, Rubrivivax gelatinosus, Rhodocyclus tenuis, Rhodocyclus purpureus, Allochromatium vinosum, Thiocapsa roseopersicina на среде Пфеннига (Schlegel, Pfennig, 1961); Chlorobaculum limnaeum на среде Ларсена (Larsen, 1952), Chloro-flexus aurantiacus j-10-fl и Oscillochloris trichoides DG-6 – на среде Кастенхольца (Castenholz, Pierson, 1981). В фотоавтотрофных условиях выращивание бактерий проводили в 500-мл флаконах с резиновой пробкой с 200 мл среды. Оставшийся объем заполняли молекулярным водородом. В фотогетеротрофных условиях бактерии выращивали во флаконах объемом 250 мл. Интенсивность света для фототрофного роста составляла 10000 лк. В темноте в аэробных условиях культуры выращивали на роторном шейкере в колбах объемом 750 мл с 250 мл среды. При выращивании клеток в качестве источника углерода использовали бикарбонат (0.1%) и органические субстраты: ацетат, малат или фруктозу (0.2%).
В опытах использовали клетки из культур, находящихся в середине линейной фазы роста. Клетки отделяли от среды центрифугированием при 8000 g и суспендировали в 30 мМ фосфатном буфере (рН 8.0). Для определения активности β-КА бактерии разрушали на ультразвуковом дезинтеграторе УЗДН-2М при 22 кГц. Все операции проводили при 0–4°С.
Активность карбоангидразы измеряли по скорости выделения Н+ в результате гидратации СО2 при 4°С. Для этого клеточную суспензию или бесклеточный экстракт, содержащие 0.05–2.0 мг белка, добавляли в охлажденный до 4°С реакционный сосуд, содержащий 14 мл К-фосфатного буфера (10 мМ, рН 8.0). Реакцию начинали добавлением 1 мл охлажденной до 4°С дистиллированной воды, насыщенной СО2. Измерения проводили, используя рН-метр Аквилон рН-410 (Россия), с регистрацией кинетики подкисления среды в диапазоне рН от 8.0 до 7.0. Активность карбоангидразы рассчитывали по уравнению U = (Т0 – Т)/Т мг–1 белка, где Т – время изменения pH от 8.0 до 7.0 в отсутствии испытуемого образца, Т0 – в присутствии суспензии клеток или бесклеточного экстракта. Активности β-КА определяли по увеличению карбоангидразной активности в разрушенных клетках по сравнению с неразрушенными на величину, превышающую точность измерения активности КА (более 0.2). Белок определяли по Лоури.
Поиск генов КА в геномах аноксигенных фототрофных бактерий проводили с использованием сервиса BlastKoala (Kanehisa et al., 2016) и BLASTp поиска (E-value < 1e‑20) (Altschul et al., 1990) в базе данных NCBI. Тип идентифицированных КА определяли по результатам филогенетического анализа с известными последовательностями α- β- и γ-КА. Для этого аминокислотные последовательности КА выравнивали с использованием MAFFT (Katoh et al., 2002) и проводили реконструкцию филогенетического дерева с применением алгоритма neighbour-joining, реализованного в MEGA7 (Kumar et al., 2016). Достоверность ветвления проверена с помощью “bootstrap”-анализа 5000 альтернативных деревьев.
У штаммов, для которых полногеномный сиквенс отсутствует (отмечены знаком “*”), тип и количество генов карбоангидраз (табл. 2) приведены для генома штамма того же вида, геном которого имеется в соответствующей базе данных (см. рис. 1). Наш биоинформационный анализ показал (данные не показаны), что если штаммы данного вида корректно определены, как принадлежащие к данному виду то тип и количество генов карбоангидраз у них не только совпадает, но и локализованы они внутри одного и того же кластера генов.
Таблица 2.
Карбоангидраза аноксигенных фототрофных бактерий
| Бактерии (штамм) | Тип КА | Активность |
|---|---|---|
| Несерные пурпурные бактерии (α-протеобактериии) | ||
| Rhodospirillum rubrum КМ МГУ 301* | α, β | 7.9 |
| Rhodospirillum fulvum КМ МГУ 325 | α, 2 β | 37.8 |
| Rhodoblastusacidophilus КМ МГУ 287* | α, β | 23.0 |
| Rhodopseudomonas palustris | α, 3 β | |
| КМ МГУ 285* | 32.5 | |
| КМ МГУ 286* | 26.0 | |
| КМ МГУ 287* | 27.0 | |
| Rhodomicrobium vannielii КМ МГУ 305* | 2 β | <0.1 |
| Blastochloris viridis | β | <0.1 |
| КМ МГУ 290* | <0.1 | |
| КМ МГУ 289* | <0.1 | |
| Rhodobacter sphaeroides | β | <0.1 |
| КМ МГУ 323* | <0.1 | |
| КМ МГУ 294* | <0.1 | |
| КМ МГУ 295* | <0.1 | |
| Rhodobacter capsulatus | β | <0.1 |
| B10 | <0.1 | |
| КМ МГУ 298* | <0.1 | |
| КМ МГУ 238* | <0.1 | |
| Rhodovulumeuryhalinum DSMZ 4868 | β | <0.1 |
| Rhodovulum sulfidophilum DSMZ 1374 | β | <0.1 |
| Rhodobacter veldkampii КМ МГУ 317* | 2 β | <0.1 |
| Несерные пурпурные бактерии (β-протеобактерии) | ||
| Rubrivivax gelatinosus DSM 149 | α, β | <0.1 |
| Пурпурные серные бактерии (γ-протеобактерии) | ||
| Allochromatium vinosum КМ МГУ 307* | α, β | <0.1 |
| Thiocapsa roseopersicina DSM 217 | 2 α, 3 β | <0.1 |
| Зеленые серные бактерии | ||
| Chlorobaculum limnaeum КМ МГУ 319* | Нет | <0.1 |
| Chlorobaculum parvum КМ МГУ 321* | Нет | <0.1 |
| Зеленые несерные нитчатые бактерии | ||
| Chloroflexus aurantiacus OK-70-fl | Нет | <0.1 |
| Oscillochloris trichoides DG-6 | β | <0.1 |
Примечание. У штаммов, отмеченных знаком “*”, для которых полногеномный сиквенс отсутствует, тип и количество генов карбоангидраз приведены для генома штамма того же вида, сиквенс генома которого имеется в соответствующей базе данных (см. рис. 1).
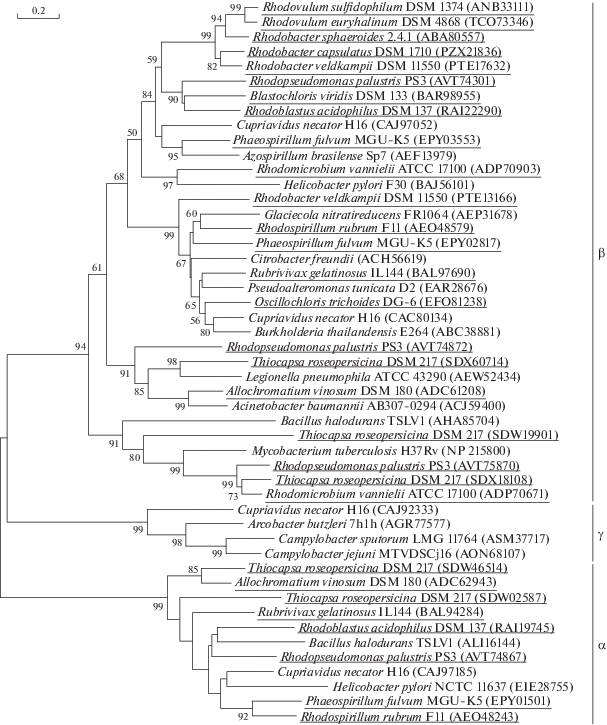
Рис. 1.
Филогенетическое дерево, основанное на анализе аминокислотных последовательностей КА. Дерево построено с использованием алгоритма neighbor-joining. Масштаб показывает эволюционное расстояние, соответствующее 0.2 замены на аминокислотную позицию. Цифрами показана достоверность ветвления на основании “bootstrap”-анализа 5000 альтернативных деревьев (показаны значения >50%). Последовательности КА аноксигенных фототрофных бактерий выделены подчеркиванием.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Распространение карбоангидразы. Гены КА обнаружены у всех аноксигенных пурпурных бактерий (рис. 1, табл. 2). Несерные пурпурные бактерии, принадлежащие к α-протеобактерииям (Rsp. rubrum, Phs. fulvum, Rbl. acidophilus и Rps. palustris), содержали гены α- и β-КА. α-Протеобактерии Rmi. vannielii, Blc. viridis, Rba. sphaeroides, Rba. capsulatus, Rba. veldkampii, Rvu. euryhalinum, Rvu. sulfidophilum обладали только генами β-КА. Несерные пурпурные бактерии Rubrivivax gelatinosus, относящиеся к β-протеобактериям, и пурпурные серные бактерии Allochromatium vinosum и Thiocapsa roseopersicina (γ-протеобактерии) содержали гены α- и β-КА. Несмотря на то, что у зеленых серных бактерий в реакциях карбоксилирования в восстановительном цикле трикарбоновых кислот используется СО2, у Cba. limnaeum и Cba. parvum гены КА отсутствуют. Причиной отсутствия КА у этих бактерий могут быть их физиологические особенности. Зеленые серные бактерии – строгие фотоавтотрофы, растущие в условиях высокого содержания сульфида, используя его в качестве основного донора электронов для фиксации СО2 (Frigaard, Dahl, 2009; Dahl, 2017). Сульфид является сильным ингибитором КА (Davis, 1959), что, возможно, и является причиной отсутствия КА у этих бактерий. Пурпурные серные бактерии Allochromatium vinosum и Thiocapsa roseopersicina (γ-протеобактерии) содержали гены α- и β-КА. Геномы зеленых несерных нитчатых бактерий семейства Chloroflexaceae – Cfl. aurantiacus, Cfl. aggregans и Cfl. islandicus, не содержали генов КА. Однако представитель семейства Oscillochloridaceae Osc. trichoides, принадлежащий к той же таксономической группе (порядок Chloroflexales), что и Cfl. aurantiacus, содержит ген β-КА. γ-КА в геномах исследованных в данной работе аноксигенных фототрофных бактерий не обнаружена.
Активность и локализация КА. О наличии и локализации КА судили по величине ее активности в целых и разрушенных ультразвуком клеток. При этом мы исходили из предположения, что КА, измеряемая с использованием целых клеток, отражает активность α-КА, локализованной в периплазме клеток. При этом β-КА, локализованная в цитоплазме, недоступна для измерения используемым методом. Она становится доступной для измерения после разрушения клеток ультразвуком. По увеличению активности КА в разрушенных клетках судили о наличии и активности β-КА. Несмотря на наличие генов КА у всех пурпурных бактерий, активность β-КА была выявлена только у пурпурных несерных, относящихся к α-протеобактериям и обладающим α-КА: Rsp. rubrum, Rps. palustris, Rbl. acidophilus и Phs. fulvum. Судя по увеличению активности КА (ΔU = U КА разрушенных клеток – U целых клеток) после разрушения клеток, эти бактерии обладают также и активностью β-КА. Величина активности β-КА ниже, чем α-КА, и в зависимости от условий выращивания колеблется у разных бактерий в пределах от 0.1 до 8 U/мг белка (табл. 3).
Таблица 3.
Активность карбоангидразы у аноксигенных пурпурных несерных бактерий, выросших в разных условиях (активность выражена в U)
| Бактерии | Малат | Ацетат | Фруктоза | СО2 (Н2) | Малат* | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | |
| Rsp. rubrum | 2.6 | 3.7 | 3.2 | 3.8 | 3.4 | 4.0 | 6.0 | 7.9 | 14.5 | 14.9 |
| ΔU | 1.1 | 0.6 | 0.6 | 1.9 | 0.4 | |||||
| Rps. palustris | 7.5 | 12.7 | 5.5 | 5.5 | 4.2 | 4.2 | 31.0 | 32.5 | 5.8 | 6.4 |
| ΔU | 5.2 | 0.0 | 0.0 | 0.1 | 0.6 | |||||
| Rbl. acidophilus | 38.0 | 43.0 | 27.0 | 35.0 | 34.0 | 33.9 | 21.0 | 23.0 | 7.0 | 7.1 |
| ΔU | 5.0 | 8.0 | 0.0 | 2.0 | 0.1 | |||||
| Phs. fulvum | 3.6 | 3.5 | 10.0 | 10.0 | 2.1 | 2.1 | 34.5 | 37.8 | # | # |
| ΔU | 0.1 | 0.0 | 0.0 | 3.3 | # | |||||
У α-протеобактерий, не содержащих генов α‑КА, но обладающих генами β-КА, – Rba. spha-eroides, Rba. capsulatus, Rba. veldkampii, Rvu. euryhalinum, Rvu. sulfidophilum и Blc. viridis, карбоангидразной активности ни в целых, ни в препаратах разрушенных клеток не обнаружено (табл. 2). Причиной этого может быть либо отсутствие экспрессии гена β-КА у этих бактерий, либо активность этих КА ниже чувствительности метода (<0.1), используемого для определения карбоангидразной активности. У серных пурпурных бактерий, относящихся к γ-протеобактериям (Alc. vinosum и Tca. roseopersicina), несмотря на наличие в их геномах генов α- и β-КА, карбоксилазной активности не выявлено (табл. 1) даже при выращивании их в фотоавтотрофных условиях на среде с водородом в качестве донора электронов.
Регуляция синтеза КА. Rsp. rubrum, Rps. palustris, Rbl. acidophilus, Phs. fulvum и Rmi. vannielii синтезируют α-КА независимо условий выращивания и используемого источника углерода (табл. 3). Однако у Phs. fulvum, Rps. palustris и Rmi. vannielii наблюдалось значительное (в 5–10 раз) увеличение активности карбоангидразы при росте культур в фотоавтотрофных условиях с использованием в качестве донора электронов молекулярного водорода. Это указывает на участие карбоангидразы в процессе транспорта неорганического углерода (СО2/${\text{HCO}}_{3}^{ - }$) в клетки бактерий. У Rsp. rubrum значительного увеличения синтеза КА не происходит (табл. 2). Проблема эффективности функционирования цикла Кальвина в условиях дефицита углекислоты у Rsp. rubrum в фотоавтотрофных условиях решается, видимо, не за счет ускорения ее транспорта в клетки, а в результате десятикратного увеличения уровня синтеза РБК. В этих условиях содержание РБК составляет почти 50% от растворимых белков в клетках Rsp. rubrum (Sarles, Tabita, 1983; Leustek et al., 1988). У Rbl. acidophilus увеличения карбоангидразной активности при росте в фотоавтотрофных условиях не обнаружено. Высокий уровень конститутивного синтеза карбоангидразы Rbl. acidophilus, по-видимому, связан с особенностями физиологии этой бактерии. В отличие от большинства пурпурных несерных бактерий, для которых рН оптимум роста близок к 7.0, оптимум рН для роста Rbl. acidophilus равен 5.8 (Imhoff, 2001). При этом значении рН основная часть углекислоты в среде (более 90%) находится в форме СО2. Активный транспорт неорганического углерода через цитоплазматическую мембрану осуществляется в форме ${\text{НСО}}_{{\text{3}}}^{ - }$ (Price et al., 2008; Burnap et al., 2015), что предполагает наличие высокой активности периплазматической α-КА для эффективной конверсии СО2 в ${\text{НСО}}_{{\text{3}}}^{ - }.$ У всех пурпурных бактерий, способных к синтезу карбоангидразы, она обнаружена не только у клеток, выросших на свету, но и в аэробных условиях в темноте, когда синтез ключевых ферментов цикла Кальвина репрессирован (Romagnoli, Tabita, 2009). В этих условиях КА обеспечивает функционирование карбоксилаз, участвующих в метаболизме органических соединений, используемых в качестве субстратов в темноте в аэробных условиях.
Характерной кинетической особенностью РБК – ключевого фермента цикла Кальвина и пируватсинтазы в восстановительном цикле трикарбоновых кислот является их низкая величина сродства к СО2 (Km) и каталитической эффективности (kcat) (Furdui, Ragsdale, 2000; Badger, Bek, 2008). Поэтому для увеличения скорости и эффективности функционирования карбоксилаз необходимо поддерживать высокую (выше Km) концентрацию СО2 вблизи их реакционных центров. Эту функцию у оксигенных и аноксигенных фототрофов выполняет СО2-концентрирующий механизм, в котором КА является обязательным компонентом (DiMario, 2018). Можно предположить, что наличие периплазматической α-КА обязательно для планктонных форм аноксигенных фототрофов в водных экосистемах с низким содержанием СО2. У аноксигенных фототрофов, растущих в составе цианобактериальных матов совместно с гетеротрофными микроорганизмами, продуцирующими значительные количества СО2, необходимость в периплазматической КА (α-КА) может отсутствовать. Однако при этом сохраняется необходимость увеличения внутриклеточной концентрации СО2 вблизи реакционного центра РБК. Эту функцию выполняет β-КА.
Список литературы
Altschul S.F., Gish W., Miller W., Myers E.W., Lipman D.J. Basic local alignment search tool // J. Mol. Biol. 1990. V. 215. P. 403–410.
Badger M.R., Bek E.J. Multiple Rubisco forms in proteobacteria: their functional significance in relation to CO2 acquisition by the CBB cycle // J. Exp. Bot. 2008. V. 59. P. 1525–1541.
Burnap R.L., Hagemann M., Kaplan A. Regulation of CO2 concentrating mechanism in cyanobacteria // Life (Basel). 2015. V. 5. P. 348–371.
Capasso C., Supuran C.T. An overview of the alpha-, beta- and gamma-carbonic anhydrases from Bacteria: can bacterial carbonic anhydrases shed new light on evolution of bacteria? // J. Enzyme Inhib. Med. Chem. 2015. V. 30. P. 325–332.
Castenholz R.W., Pierson B.K. Isolation of members of the family Chloroflexaceae // The Procaryotes / Eds. Staarr M.P., Truper H.G., Ballows A., Schlegel H.G. Berlin: Springer Verlag, 1981. V. 1. P. 290–298.
Dahl C. Sulfur metabolism in phototrophic bacteria // Modern Topics in the Phototrophic Prokaryotes. Metabolism, Bioenergetics and Omics / Eds. Hallenbeck P. Springer, 2017. P. 27–66.
Davis R.P. The kinetics of the reaction of human erythrocyte carbonic anhydrase. II. The effect of sulfanilamide, sodium sulfide and various chelating agents // J. Amer. Chem. Soc. 1959. V. 81. P. 5674–5678.
DiMario R.J., Machingura M.C., Waldrop G.L., Moroney J.V. The many types of carbonic anhydrases in photosynthetic organisms. // Plant Sci. 2018. V. 268. P. 11–17.
Frigaard N.U., Dahl C. Sulfur metabolism in phototrophic sulfur bacteria // Adv. Microb. Physiol. 2009. V. 54. P. 103–200.
Furdui C., Ragsdale S.W. The role of pyruvate ferredoxin oxidoreductase in pyruvate synthesis during autotrophic growth by the Wood-Ljungdahl pathway // J. Biol. Chem. 2000. V. 275. P. 28494–28499.
Gai C.S., Lu J., Brigham C.J., Bernardi A.C., Sinskey A.J. Insights into bacterial CO2 metabolism revealed by the characterization of four carbonic anhydrases in Ralstonia eutropha H16 // AMB Express. 2014. V. 4. Article 2. https://doi.org/10.1186/2191-0855-4-2
Gill S.R., Fedorka-Cray P.J., Tweten R.K., Sleeper B.P. Purification and properties of the carbonic anhydrase of Rhodospirillum rubrum // Arch. Microbiol. 1984. V. 138. P. 113–118.
Imhoff J.F. Transfer of Rhodopseudomonas acidophila to the new genus Rhodoblastus as Rhodoblastus acidophilus gen. nov., comb. nov. // Int. J. Syst. Evol. Microbiol. 2001. V. 51. P. 1863–1866.
Kanehisa M., Sato Y., Morishima K. BlastKOALA and GhostKOALA: KEGG Tools for Functional Characterization of Genome and Metagenome Sequences // J. Mol. B-iol. 2016. V. 428. P. 726–731.
Katoh K., Misawa K., Kuma K., Miyata T. MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform // Nucl. Acids Res. 2002. V. 30. P. 3059–3066.
Kumar S., Stecher G., Tamura K. MEGA7: Molecular Evolutionary Genetics Analysis Version 7.0 for Bigger Datasets // Mol. Biol. Evol. 2016. V. 33. P. 1870–1874.
Larsen H. On the culture and general physiology of the green sulfur bacteria // J. Bacteriol. 1952. V. 64. P. 187–196.
Leustek T., Hartwig R., Weissbach H., Brot N. Regulation of ribulose bisphosphate carboxylase expression in Rhodospirillum rubrum: characteristics of mRNA synthesized in vivo and in vitro // J. Bacteriol. 1988. V. 170. P. 4065–4071.
Ormerod J.G., Ormerod K.S., Gest H. Light-dependent utilization of organic compounds and photoproduction of molecular hydrogen by photosynthetic bacteria; relationships with nitrogen metabolism // Arch. Biochem. Biophys. 1961. V. 94. P. 449–463.
Price G.D., Badger M.R., Woodger F.J., Long B.M. Advances in understanding the cyanobacterial CO2-concentrating-mechanism (CCM): functional components, Ci transporters, diversity, genetic regulation and prospects for engineering into plants // J. Exp. Bot. 2008. V. 59. P. 1441–1461.
Puskas L.G., Inui M., Zahn K., Yukawa H. A periplasmic, alpha-type carbonic anhydrase from Rhodopseudomonas palustris is essential for bicarbonate uptake // Microbiology (SGM). 2000. V. 146. P. 2957–2966.
Rae B.D., Long B.M., Badger M.R., Price G.D. Functions, compositions, and evolution of the two types of carboxysomes: polyhedral microcompartments that facilitate CO2 fixation in Cyanobacteria and some Proteobacteria // Microbiol. Mol. Biol. Rev. 2013. V. 77. P. 357–379.
Romagnoli S., Tabita F.R. Carbon dioxide metabolism and its regulation in nonsulfur purple photosynthetic bacteria // The Purple Phototrophic Bacteria. Advances in Photosynthesis and Respiration / Eds. Hunter C.N., Daldal F., Thurnauer M.C., Beatty J.T. Dordrecht: Springer, 2009. V. 28. P. 563–576.
Sarles L.S., Tabita F.R. Derepression of the synthesis of D‑ribulose 1,5-bisphosphate carboxylase/oxygenase from Rhodospirillum rubrum // J. Bacteriol. 1983. V. 153. P. 458–464.
Sawaya M.R., Cannon G.C., Heinhorst S., Tanaka S., Williams E.B., Yeates T.O., Kerfeld C.A. The structure of beta-carbonic anhydrase from the carboxysomal shell reveals a distinct subclass with one active site for the price of two // J. Biol. Chem. 2006. V. 281. P. 7546–7555.
Schlegel H.G., Pfennig N. Enriched culture for various purple sulfur bacteria // Arch. Mikrobiol. 1961. V. 38. P. 1–39.
Supuran C.T., Capasso C. An overview of the bacterial carbonic anhydrases // Metabolites. 2017. V. 7. pii: E56. https://doi.org/10.3390/metabo7040056
Ueda K., Nishida H., Beppu T. Dispensabilities of carbonic anhydrase in proteobacteria // Int. J. Evol. Biol. 2012. V. 2012. Article 324549. https://doi.org/10.1155/2012/324549
Дополнительные материалы отсутствуют.


