Микробиология, 2020, T. 89, № 3, стр. 344-355
Функционирование микроводорослей подледного планктона и ледовой интерстициали в прибрежной зоне озера Байкал
Н. А. Бондаренко a, *, И. И. Русанов b, С. М. Черницына a, О. В. Шубенкова a, Н. В. Пименов b, Т. И. Земская a
a Лимнологический институт СО РАН
664033 Иркутск, Россия
b Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: nina@lin.irk.ru
Поступила в редакцию 12.12.2019
После доработки 14.01.2020
Принята к публикации 25.01.2020
Аннотация
В работе представлены результаты натурных исследований видового состава и продукционных (биомасса, интенсивность фотосинтеза, содержание хлорофилла “а”, ассимиляционные числа) показателей микроводорослей межкристаллической ледовой воды и планктона прибрежной зоны южной котловины озера Байкал, полученные в марте 2018 г. Фоновыми служили станции, расположенные в пелагиали озера. Приведены первые данные об интенсивности фотосинтеза микроводорослей льда Байкала. Комплексное исследование микроводорослей льда и планктона показало, что их продукционная активность на большинстве станций была относительно низкой. Значительные показатели у западного берега отмечены в местах впадения рек, подвергающихся активной антропогенной нагрузке. Здесь высокие количественные характеристики были обеспечены не только дополнительным притоком питательных веществ, но и вегетацией мелких форм микроводорослей и, в первую очередь, фитофлагеллят – показателей органического загрязнения воды, поступающих с водами малых рек. Методом главных компонент не удалось выявить достоверной корреляции во взаимосвязи между первичными продуцентами и микроорганизмами, участвующими в деструкции легко минерализуемого органического вещества (коэффициент корреляции равен 0.49). Отличие в результатах, полученных для станций, находящихся под воздействием антропогенного влияния, и фоновых свидетельствует, что доступность легко минерализуемых органических веществ способствовала интенсивному размножению жгутиконосцев. Несмотря на отсутствие типичных для озера крупноклеточных диатомовых водорослей, первичная продукция в таких районах достигала ~100–280 мг Сорг м–2, что сопоставимо со значениями, полученными ранее для подледного периода с интенсивной вегетацией диатомей. Высокий функциональный потенциал водорослей в местах с активным антропогенным влиянием позволяет накапливаться значительной биомассе. Это не только приводит к эвтрофированию прибрежной зоны, но и может служить источником для увеличения первичной продукции пелагиали озера.
В крупных водоемах основную часть органического вещества создают планктонные водоросли, а высшие растения и водоросли макро- и микрофитобентоса имеют небольшое значение. Это актуально и для озера Байкал, где на долю фитопланктона приходится 90% продуцированного органического вещества (Вотинцев и соавт., 1975). Продукционные характеристики фитопланктона позволяют судить о трофическом статусе водоема, об обеспеченности пищей первых гетеротрофных звеньев экосистемы, служат основой для детального изучения ее биопродукционной возможности в целом и характеризуют качество воды и состояние экосистемы. Это становится остро востребованным при современной антропогенной нагрузке на озеро (Timoshkin et al., 2016).
Систематические исследования первичной продукции фитопланктона с применением кислородного метода, охватившие всю акваторию озера во все сезоны года, были проведены в 60–70 гг. прошлого столетия (Вотинцев и соавт., 1975). Предшествующие определения относились, главным образом, к одной точке озера в Южном Байкале, в бухте Большие Коты (Вотинцев, Самарина, 1957). Для других районов Байкала имелись лишь разрозненные результаты, полученные в период краткосрочных экспедиционных исследований в летнее время, как кислородным, так и радиоуглеродным методами (Кузнецов и соавт., 1964; Бульон, 1983).
Данные, полученные К.К. Вотинцевым и соавт. (1975), позволили оценить годовые величины и сезонную ритмику интенсивности фотосинтеза фитопланктона, сравнить биопродукционный потенциал озера с аналогичной величиной в других водоемах. В районах открытого Байкала найденная величина составила 127 г Сорг под 1 м2 поверхности озера в год, а в целом для всего озера – 3925 тыс. т Сорг в год. Эти исследователи выяснили, что межгодовые изменения первичной продукции фитопланктона значительны: от 67 г Сорг м–2 в год (при отсутствии интенсивной вегетации диатомовых водорослей в подледный период) до 157 г Сорг м–2 в год (при массовом развитии подо льдом крупных диатомовых водорослей). Отмечено, что процесс фотосинтеза регистрируется на глубинах до 50–70 м, а трофогенный слой достигает в некоторые моменты времени 25–30 м. В связи с этим, при расчете первичной продукции на единицу площади поверхности озера она оказывается высокой, приближая Байкал – олиготрофное или даже ультраолиготрофное озеро, к водоемам мезотрофного типа (Винберг, 1960).
Исследования первичной продукции радиоуглеродным методом (Бондаренко, Гусельникова, 1989) показали, что среднегодовая величина ее для периода 1976–1985 гг. оказалась несколько больше, чем полученная ранее кислородным методом, в среднем 150 г Сорг м–2. По данным других авторов, использовавших также радиоуглеродный метод в своих исследованиях, в 1977–1980 гг. эта величина составила 58 г Сорг м–2 (Изместьева, Кожова, 1988).
Проведенные оценки концентрации хлорофилла “а” (Изместьева и соавт., 1990; Izmest’eva et al., 2016) показали, что содержание хлорофилла в трофогенном слое (0–25 м), как правило, свойственно олиготрофным водоемам (1.25–2.5 мкг л–1), и подтвердили вывод о наличии межгодовых изменений и нескольких максимумах биомассы фитопланктона в течение года.
Современных исследований функциональных характеристик фитопланктона озера в подледный период мало (Straškrábová et al., 2005), а ледовых водорослей нет вообще. Хорошо известно, что подледный период – важнейшее время для экосистемы Байкала (Антипова, 1963; Вотинцев и соавт., 1975; Поповская, 1987). В это время интенсивность развития водорослей подо льдом отличалась от года к году: биомасса подледного фитопланктона изменялась в десятки раз, наблюдались высоко- (при биомассе более 1 г м–3 и первичной продукции более 100 г Сорг м–2) и малопродуктивные годы (биомасса ~100 мг м–3, а первичная продукция менее 100 г м–2). Была оценена структура и роль ледовых сообществ в экосистеме Байкала (Оболкина и соавт., 2000; Bondarenko et al., 2012). Установлено, что в его ледовом покрове доминировали диатомовые и динофитовые водоросли, а состав и количественные характеристики организмов в ледовых сообществах менялись в межгодовом масштабе.
В последние годы в оз. Байкал наблюдаются изменения в ряде звеньев прибрежной зоны (Kravtsova et al., 2014; Timoshkin et al., 2016), в том числе и в фитопланктоне (Бондаренко, Логачева, 2016). Было показано, что в планктоне произошли резкие структурные изменения: появились новые для озера виды миксотрофных жгутиковых – показатели органического загрязнения воды, отмечено доминирование водорослей, имеющих более мелкие размеры.
В связи с этим обстоятельством целью данного исследования, которое является частью комплексных работ, проведенных 19–24 марта 2018 г. в южной котловине озера Байкал, было оценить особенности структуры и функционирования микроводорослей планктона и ледовой интерстициали в разных экологических условиях в современный период структурных перестроек.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Характеристика станций отбора проб. Было обследовано 9 станций отбора проб, схема и описание которых опубликованы ранее (Земская и соавт., 2019), 7 из которых располагались возле устьев рек Переемная, Малая и Большая Осиновки, Солзан (восточный берег), Каменушка, Крестовка, Большая Черемшаная (западный берег, залив Лиственничный). Здесь пробы отбирали в двух точках: в устье малого притока и на расстоянии 50 м от устья в озере. Две станции находились в пелагической зоне озера: первая – против г. Байкальск, над глубиной 380 м, вторая – в заливе Лиственничный, над глубиной ~600 м. Толщина льда на станциях варьировала от 25 до 90 см, толщина снежного покрова на юго-западе колебалась в пределах 0–5 см, а на юго-востоке 20–30 см. Температура воды в поверхностном слое составила 0.1–0.4°С, прозрачность по диску Секки в устьях рек была до дна, в их приустьевой акватории 3–3.5 м, в пелагиали озера 6–6.5 м. Отбор, подготовку проб воды и льда, химические анализы проводили, как описано ранее (Земская и соавт., 2019). Пробы воды отбирали в поверхностном слое озера из приготовленных майн. Для определения первичной продукции воду отбирали в затемненные фольгой 100 мл флаконы и помещали в сумку-холодильник. Пробы для определения видового состава планктонных водорослей разливали в пластиковые бутылки. Для исследования состава и функциональных показателей водорослей ледовой интерстициали от свежего керна откалывали нижнюю часть (10–15 см) льда, укладывали в темный пакет и транспортировали в стационарную лабораторию. Там лед растапливали при комнатной температуре в темноте, пробу воды тщательно перемешивали и делили на 3 части: 1 – на определение видового состава; 2 – для определения первичной продукции; 3 – для определения концентрации хлорофилла.
Измерение рН проводили в воде и в расплавах ледовых кернов с помощью прибора pH 3310 (“WTW”, Германия). Концентрацию кислорода измеряли методом Винклера. Содержание растворенного органического углерода (РОВ) определяли методом каталитического высокотемпературного окисления образцов при 850°С с последующим определением СО2 с помощью ИК детектора на высокотемпературном анализаторе углерода Vario TOC cube (“Elementar Analysensysteme GmbH”, Германия).
Пробы фитопланктона и ледовых водорослей объемом 1000 мл, фиксировали раствором Утермеля, концентрировали методом седиментации. При обработке материала применяли традиционные в гидробиологии методы (Киселев, 1956). Концентрат просматривали в тройной повторности в камере Нажотта объемом 0.1 мл в световом микроскопе “Peraval”. При увеличении микроскопа ×720 учитывали и идентифицировали сетные формы и нанопланктон, при увеличении ×1200 – пикопланктон. Биомассу водорослей определяли с учетом индивидуальных объемов их клеток (Макарова, Пичкилы, 1970). Определение водорослей проводили по определителям (Забелина и соавт., 1951; Голлербах и соавт., 1953; Матвiенко, Литвиненко, 1977; Царенко, 1990; Starmach, 1985; Komarek, Anagnostidis, 1998).
Скорость первичной продукции определяли радиоизотопным методом. Для каждой пробы использовали обернутый в фольгу темный флакон (в качестве контроля) и 2 светлых флакона объемом 100 мл. Пробы воды и расплавов льда наливали в стерильные 100 мл флаконы (предварительно споласкивая водой пробы) под пробку и выдерживали перед инкубацией несколько часов в холодильнике. Затем в каждый флакон вносили по 100 мкл раствора 14С-бикарбоната (3 мкКи). Флаконы закрепляли на горизонтальных крестовинах и экспонировали в условиях “in situ” в течение 1 сут в ледовой лунке, затемненной сверху куском льда. После суточной экспозиции, склянки с пробами извлекали из лунки и немедленно фиксировали 0.05 н HCl. Для определения скорости включения 14С в состав биомассы фитопланктона пробы фильтровали при 0.1 атм. через капроновые фильтры с диаметром пор 0.2 мкм. Для удаления остаточных карбонатов фильтры промывали 3-кратным объемом фильтрованной слабо подкисленной озерной воды. Фильтры заливали сцинтилляционной жидкостью и просчитывали на сцинтилляционном счетчике TRI-Carb TR (“Packard”, США). Для выявления включения 14С во фракцию растворенного органического вещества, фильтрат помещали в колбы установки для отгонки углекислоты, образующейся в результате химического окисления органических соединений (мокрое сжигание) с персульфатом калия. Перед расчетом интенсивности фотосинтеза, от величины активности в светлом флаконе отнимали величину активности в темном флаконе. Далее, как и для расчета интенсивности ТАУ (темновой ассимиляции углекислоты), вычисления проводили по ранее описанной формуле (Земская и соавт., 2019; Pimenov, Bonch-Osmolovskaya, 2006). Для расчета первичной продукции под 1 м2 поверхности озера использовали формулу, полученную В.В. Бульоном (1983) для Байкала:
где S – прозрачность, м; А0 – скорость фотосинтеза у поверхности; ΣА – первичная продукция под 1 м2 поверхности озера.Содержание хлорофилла “а” определяли согласно методике SCOR-UNESCO (1964). Пробы концентрировали на мембранные фильтры (“Владисарт”) с размером пор 0.45 мкм диаметром 47 мм. Объем профильтрованных проб варьировал от 1400 до 2060 мл. Экстракцию хлорофилла проводили 90% ацетоном с добавлением MgCO3. Измерения выполняли на спектрофотометре Cintra 20 (“GBC Scientific Equipment”, Австралия).
Для статистической обработки применяли метод главных компонент с нормализацией и центрированием данных, который был выполнен и визуализирован с использованием пакетов vegan и ggfortify в среде R (https://cran.r-project.org/), и метод корреляционного анализа Пирсона в рамках компьютерного математического приложения ExStatR (совместное использование Microsoft Excel и программы статистической обработки “R”) (Новаковский, 2016). Для статистического анализа использовали как оригинальные данные, так и результаты, полученные в ходе общего комплексного исследования, опубликованные ранее (Земская и соавт., 2019).
РЕЗУЛЬТАТЫ
Минерализация воды в исследуемых реках и приустьевых акваториях была низкой, варьировала от 33 до 126 мг л–1, вода была насыщена кислородом (12.7–14.3 O2 мг л–1). Воды исследуемых притоков и приустьевых акваторий озера различаются по рН и характеризуются как слабокислые (6.70–6.82), нейтральные (7.17–7.55) или щелочные (8.05–8.55). Содержание РОВ в реках и приустьевых акваториях юго-восточной части озера менялось в пределах от 1.03 до 2.74 мг л–1, юго-западной – от 0.85 до 4.85 мг л–1 (Земская и соавт., 2019).
В ледяных кернах из юго-восточной оконечности озера Байкал наблюдали смещение рН в сторону пониженных значений только в приустьевой акватории р. Переемная (рН 5.76–6.20). Значения рН в образцах из других рек колебались в пределах 6.05–7.42, на фоновых станциях 6.23–8.16. Содержание РОВ в ледяных кернах этой акватории озера варьировало от 1.4 до 3.3 мг л–1, при концентрации 1.1 мг л–1 на фоновой станции. Сумма ионов изменялась в широком диапазоне и составляла 2.9–33.84 при 13.01 мг л–1 на фоновой станции. Значения рН в ледяных кернах из юго-западной части озера соответствовали слабокислым условиям (рН 6.23–6.62), содержание РОВ варьировало от 1.1 до 1.8 мг л–1, сумма ионов – от 3.19 до 5.93 мг л–1, при значении 2.2 мг л–1 на фоновой станции (Земская и соавт., 2019).
Структура ледовых сообществ. Обитатели ледовой интерстициали фоновых станций были представлены как известными ранее динофитовыми Peridinium baicalense и Gymnodinium baicalense, диатомовыми Aulacoseira islandica, A. subarctica и Fragilaria radians, зеленой Koliella longiseta, так и видами, ранее не найденными во льду озера Байкал. Впервые зарегистрировано массовое размножение в ледовой интерстициали зеленой водоросли рода Chlamydomonas при доминировании Ch. komma, численность которого на разных станциях колебалась от 1.0 до 20.1 тыс. кл. л–1, максимальные значения отмечены в ледовых кернах из приустьевой акватории реки Большая Черемшаная. Количество других видов было незначительным, от 0.4 до 6.3 тыс. кл. л–1. В устьях рек состав населения льда более разнообразен за счет диатомовых водорослей бентоса. В большинстве расплавов льда были встречены Cocconeis placentula, Fragilaria vaucheriae, Gomphonema olivaceum, а также представители родов Hannaea и Navicula. Биомасса водорослей колебалась в широких пределах: от 0.4 до 121 мг м–3 (табл. 1).
Таблица 1.
Количественные характеристики микроводорослей интерстициальной ледовой воды в устьях притоков южной котловины и в прилегающей акватории оз. Байкал, март 2018 г.
| Станция | Точка отбора | Биомасса водорослей, мг м−3 |
Концентрация хлорофилла, мкг л–1 |
Скорость фотосинтеза, мкг С л–1 сут–1 |
РОУ, мкг С л–1 сут–1 |
САЧ | |
|---|---|---|---|---|---|---|---|
| 1/1 | р. Переемная | Устье | 11.50 | 0.06 | 0.45 | 0.16 | 7.5 |
| 1/3 | Озеро | 25.80 | 0.45 | 0.22 | 0.10 | 0.5 | |
| 2/1 | р. Солзан | Устье | 2.23 | 0.02 | 0.60 | 0.36 | 30.0 |
| 2/2 | Озеро | 48.70 | 0.47 | 0.42 | 0.20 | 0.9 | |
| 3/1 | р. Малая Осиновка | Устье | 13.00 | 0.03 | 5.10 | 3.88 | 170 |
| 3/4 | Озеро | 4.50 | 0.23 | 3.50 | 2.20 | 15.2 | |
| 4/1 | р. Большая Осиновка | Устье | 21.00 | 0.06 | 4.91 | 3.63 | 81.8 |
| 4/4 | Озеро | 0.40 | 0.17 | 4.70 | 3.51 | 27.6 | |
| 5 | Фоновая восточного берега | Озеро | 121.00 | 2.17 | 2.30 | 1.24 | 1.1 |
| 6/4 | р. Большая Черемшанка | Устье | 16.00 | 0.05 | 0.09 | 0.05 | 1.8 |
| Озеро | 14.00 | 0.15 | 0.20 | 0.13 | 1.3 | ||
| 7/1 | р. Крестовка | Устье | 3.62 | 0.13 | 0.56 | 0.39 | 4.3 |
| 7/6 | Озеро | 1.44 | 0.07 | 0.49 | 0.45 | 7.0 | |
| 8/1 | р. Каменушка | Устье | 1.42 | 0.08 | 0.22 | 0.17 | 2.8 |
| 8/2 | Озеро | 4.25 | 0.06 | 0.18 | 0.14 | 3.0 | |
| 9 | Фоновая западного берега | Озеро | 2.17 | 0.01 | 0.11 | 0.10 | 11.0 |
Структура фитопланктона. Фитопланктон в марте 2018 г. был беден, биомасса варьировала от 12 до 182 мг м–3 (табл. 2), что соответствует градации малопродуктивных лет (Вотинцев и соавт., 1975). В устьях рек состав доминантов гетерогенен. У восточного берега в планктоне регистрировали преимущественно донные формы диатомовых водорослей родов Hannaea, Navicula, Gomphonema. В толще воды рек западного берега доминировали нанопланктонные формы криптофитовых (табл. 3) и зеленых водорослей. Состав планктона на фоновых станциях озера был типичен для последних лет (Бондаренко, Логачева, 2016), доминантом являлась зеленая Koliella longiseta, 9.9–35.8 тыс. кл. л–1, (см. табл. 3), ей сопутствовали диатомовые Fragilaria radians, 2–5 тыс. кл. л–1, и Nitzschia graciliformis, 2–3 тыс. кл. л–1. Численность динофитовых G. baicalense также была невелика, 1.5–6.3 тыс. кл. л–1. В прибрежной зоне к этому комплексу присоединялись водоросли, поступающие в озеро с водами притоков. Так, в устье и приустьевой акватории реки Переемная найдены нерегистрируемые ранее в планктоне Байкала представители золотистых водорослей родов Dinobryon (см. табл. 3) и Chrysococcus.
Таблица 2.
Количественные характеристики микроводорослей планктона в устьях малых притоков южной котловины и в прилегающей акватории оз. Байкал, март 2018 г.
| Станция | Точка отбора | Биомасса водорослей, мг м−3 |
Концентрация хлорофилла, мкг л–1 |
Скорость фотосинтеза, мкг С л–1 сут–1 |
РОУ, мкг С л–1 сут–1 |
САЧ | |
|---|---|---|---|---|---|---|---|
| 1/1 | р. Переемная | Устье | 37.00 | 0.01 | 1.72 | 1.02 | 172.0 |
| 1/3 | Озеро | 45.00 | 0.51 | 3.56 | 2.92 | 7.0 | |
| 2/1 | р. Солзан | Устье | 12.00 | 0.12 | 3.56 | 2.22 | 29.7 |
| 2/2 | Озеро | 80.00 | 0.92 | 7.06 | 4.88 | 7.7 | |
| 3/1 | р. Малая Осиновка | Устье | 15.00 | 0.07 | 9.85 | 7.65 | 140.7 |
| 3/4 | Озеро | 77.50 | 1.39 | 16.16 | 11.71 | 11.6 | |
| 4/1 | р. Большая Осиновка | Устье | 42.00 | 0.35 | 6.98 | 5.62 | 19.9 |
| 4/2 | Озеро | 79.00 | 3.08 | 9.90 | 4.50 | 3.2 | |
| 5 | Фоновая восточного берега | Озеро | 165 | 3.26 | 15.89 | 8.73 | 4.9 |
| 6/4 | р. Большая Черемшаная | Устье | 182.00 | 1.21 | 7.93 | 5.46 | 6.6 |
| Озеро | 143.00 | 4.66 | 54.93 | 27.10 | 11.8 | ||
| 7/1 | Р. Крестовка | Устье | 146.00 | 6.41 | 45.50 | 24.34 | 7.1 |
| 7/6 | Озеро | 105.00 | 1.64 | 22.87 | 15.60 | 14.0 | |
| 8/1 | р. Каменушка | Устье | 96.00 | 1.41 | 7.01 | 4.70 | 5.0 |
| 8/2 | Озеро | 21.00 | 1.61 | 5.38 | 3.93 | 3.3 | |
| 9 | Фоновая западного берега | Озеро | 49.2 | 0.01 | 3.41 | 2.50 | 341.0 |
Таблица 3.
Доминирующие виды микроводорослей планктона в устьях малых притоков южной котловины и в прилегающей акватории озера Байкал и их численность, март 2018 г.
| Место исследования | Доминирующие виды | Численность, тыс. кл. л–1 |
|---|---|---|
| р. Переемная, устье | Dinobryon sp., цисты Dinobryon sp. | 22.9 |
| р. Переемная, прибрежье | Dinobryon sp., цисты Dinobryon sp. | 22.0 |
| Р. Солзан, устье | Hannaea spp. | 3.9 |
| р. Солзан, прибрежье | Koliella longiseta | 9.8 |
| р. Малая Осиновка, устье | Gomphonema olivaceum | 2.3 |
| р. Малая Осиновка, прибрежье | Koliella longiseta | 5.3 |
| р. Большая Осиновка, устье | Gomphonema olivaceum | 19.2 |
| р. Большая Осиновка, прибрежье | Koliella longiseta | 27.3 |
| Фоновая станция восточного берега | Koliella longiseta | 35.8 |
| р. Большая Черемшаная, устье | Cryptomonas erosa | 102.0 |
| р. Большая Черемшаная, прибрежье | Chlorella spp. | 45000.0 |
| р. Крестовка, устье | Cryptomonas erosa | 161.0 |
| C. reflexa | 120.3 | |
| р. Крестовка, прибрежье | Cryptomonas erosa | 48.4 |
| Р. Каменушка, устье | Cryptomonas erosa | 22.5 |
| р. Каменушка, прибрежье | Cryptomonas erosa | 6.1 |
| Фоновая станция западного берега | Koliella longiseta | 9.9 |
В устьях притоков залива Лиственничный Крестовка и Большая Черемшаная выявили массовое развитие нанопланктонных миксотрофных жгутиковых родов Cryptomonas (см. табл. 3) и Chlamydomonas. Их общая численность колебалась в пределах 120–289 тыс. кл. л–1. Доминирующие виды C. erosa и C. reflexa являются β-0- и β‑сапробами, с индивидуальным индексом сапробности 1.6–2.0 (Баринова и соавт., 2006). В устьях рек отмечены также эвгленовые Euglena proxima, E. viridis, E. gracilis, от 4 до 20 тыс. кл. л–1. Их индекс сапробности колеблется от 0.8 до 4 (Баринова и соавт., 2006). Обе находки свидетельствуют о достаточно сильном органическом загрязнении исследованных притоков. В прибрежной зоне залива эвгленовые встречались единично, количество криптофитовых уменьшалось до 6.1–84.9 тыс. кл. л–1, но виды рода Cryptomonas оставались доминантами, и только в приустьевой акватории реки Большая Черемшаная отмечено обильное развитие нанопланктонных видов другого рода, Chlorella, более 45 млн кл. л–1.
Концентрация хлорофилла “а”. В планктоне на большинстве станций концентрация хлорофилла была низкой (см. табл. 2), и только в воде станций, расположенных в зоне влияния притоков Большая Осиновка, Крестовка и Большая Черемшаная, содержание пигмента было высоким, от 3.08 до 6.41 мкг л–1. В межкристаллической ледовой воде содержание хлорофилла очень низкое, от 0.01 до 0.47 мкг л–1. Исключение составляла фоновая станция у восточного берега, где присутствовали типичные обитатели байкальского льда динофитовые Gymnodinium baicalense и G. baicalense var. minor.
Первичная продукция. Диапазон величин общей скорости первичной продукции в подледной водной толще был значительным, от 1.72 до 54.93 мкг С л–1 сут–1 (см. табл. 2). Максимальная общая продукция отмечена в заливе Лиственничный на 2-х станциях: в 50 м от устья реки Большая Черемшаная, 54.93 мкг С л–1 сут–1, и в устье реки Крестовки, 45.50 мкг С л–1 сут–1. В первом случае интенсивный фотосинтез обеспечивали нанопланктонные зеленые водоросли рода Chlorella при общей биомассе фитопланктона 143 мг м–3, во втором – нанопланктонные криптофитовые рода Cryptomonas, биомасса фитопланктона 146 мг м–3. Минимальная скорость фотосинтеза наблюдалась в устье реки Переемная, 1.72 мкг С л–1 сут–1, где фитопланктон был представлен преимущественно покоящимися стадиями (цистами) золотистых водорослей рода Dinobryon, 23 тыс. кл. л–1, с небольшой примесью донных диатомовых. В среднем, интенсивность первичной продукции фитопланктона в прибрежной водной толще юго-западной части исследованной акватории озера (21.01 мкг С л–1 сут–1) была в 2.5 раза выше, чем у юго-восточного (8.3 мкг С л–1 сут–1) берега. При этом прямо противоположные значения детектированы для фоновых станций. Общая интенсивность фотосинтеза на фоновой станции напротив Байкальска (15.89 мкг С л–1 сут–1) почти в 5 раз выше, чем на фоновой станции в Лиственничном заливе (3.41 мкг С л–1 сут–1).
Диапазон интенсивности первичной продукции в ледовой интерстициали также значительно изменялся – от 0.09 до 5.1 мкг С л–1 сут–1 (см. табл. 1), но сами величины в ледовых пробах значительно уступали активности фитопланктона. При этом отмечена обратная закономерность для активности ледового и планктонного фотосинтеза. На всех станциях юго-восточной части исследованной акватории скорости фотосинтеза в ледовой интерстициали были намного выше, чем на станциях юго-западной. Средняя величина для разных областей отличалась практически на порядок.
Внеклеточная продукция. Следует отметить значительную составляющую внеклеточной продукции (растворенного органического углерода, РОУ). Для фитопланктона продукция РОУ составила от 46 до 82% (среднее 60%), а для ледовой фракции от 35 до 91% (среднее 70%) от общей первичной продукции фотосинтеза. В распределении продукции РОУ не отмечено каких-либо закономерностей. Низкие и высокие значения в равной степени отмечены и в устьевых, и в озерных пробах обеих частей исследованной акватории, вне зависимости от абсолютных величин фотосинтеза.
Суточные ассимиляционные числа (САЧ) микроводорослей в интерстициальной ледовой воде были низкими, колебались в пределах 0.5–30.0, и только в устьях двух рек отмечены значительные показатели: 170 в ледовых сообществах Малой Осиновки и 81.8 Большой Осиновки (см. табл. 1). САЧ фитопланктона также были низкими, от 3.2 до 14.0 (см. табл. 2). Исключение составляли две станции в устьях рек, 140.7 в устье Малой Осиновки и 172.0 в устье реки Переемная, а также фоновая в заливе Лиственничный, где отмечено максимальное САЧ – 341.0.
ОБСУЖДЕНИЕ
Изученные показатели планктонных микроводорослей (видовой состав, биомасса, скорость фотосинтеза, содержание хлорофилла “а”, ассимиляционные числа) прибрежной зоны южной котловины озера Байкал, полученные во время комплексной экспедиции в марте 2018 г., изменялись от станции к станции. Ранее было установлено, что на подледный период приходятся самые резкие колебания видового состава микроводорослей, представленных крупными формами диатомовых (Антипова, 1963; Поповская, 1987), и первичной продукции фитопланктона (Вотинцев и соавт., 1975; Бондаренко, Гусельникова, 1989). Причем максимальные скорости фотосинтеза весной приходятся на вторую половину марта–начало апреля – период увеличения солнечной радиации и высоких скоростей наращивания биомассы микроводорослей, т.е. исследования весны 2018 г. пришлись на время максимального развития подледного фитопланктона озера Байкал. Полученные результаты свидетельствуют, что отмеченные в начале текущего столетия (Бондаренко, Логачева, 2016) структурные перестройки продолжаются, по-прежнему доминирующий комплекс водорослей, как в прибрежной зоне, так и в пелагиали, представлен мелкоразмерными видами (см. табл. 3). В планктоне большинства исследованных станций (район реки Переемная, залив Лиственничный) доминируют фитофлагелляты. Ранее исследователи озера Байкал не отмечали массового развития нанопланктонных жгутиковых водорослей (Мейер, 1930; Антипова, 1963; Вотинцев и соавт., 1975; Поповская, 1987), также как не регистрировали в составе планктона представителей рода Chlamydomonas. Их приводили только в списках альгофлоры притоков южной котловины Байкала (Бондаренко, 2001). Впервые в единичных количествах виды Chlamydomonas были найдены в акваториях, прилегающих к устьям малых рек, только в начале 2000-х гг. (Бондаренко, Логачева, 2016). В нашем исследовании максимальные количества этих фитофлагеллят найдены в воде и во льду притоков. Логично предположить, что именно отсюда они при изменении экологических условий и расселились в прибрежной зоне озера, но пока единичны (или отсутствуют) в его пелагиали.
Исходя из литературных источников (Оболкина и соавт., 2000; Bondarenko et al., 2012), необходимо отметить, что ледовые сообщества на момент изучения были недостаточно развиты. Состав водорослей в межкристаллической воде фоновых станций был, как и ранее (Оболкина и соавт., 2000; Bondarenko et al., 2012) сходен с морскими (Мельников, 1980; McRoy, Goering, 1974; Satoh et al., 1989; Thomas, Dieckman, 2002) и пресными речными сообществами (Юрьев, Лебедев, 1988; Frenette et al., 2008), основу которых составляли диатомовые и динофитовые водоросли. Анализ расплавов ледовых кернов показал, что, структура ледовых сообществ в заливе Лиственничный была отлична от таковой фоновых станций и имела сходство со структурой снежно-ледового покрова альпийских озер Европы, где доминировали жгутиковые (Felip et al., 1995). Если многолетние исследования (1976–1986 гг.) выявили, что биомасса и содержание хлорофилла морских ледовых водорослей выше, чем в фитопланктоне (Hsiao, 1992), то в нашем случае отмечена противоположная закономерность. На большинстве станций, как биомасса, так и содержание хлорофилла были выше в подледном планктоне (см. табл. 1, 2).
Наши работы были проведены как в мелководных участках южной котловины озера, так и в его пелагиали. Известно, что первичная продукция в расчете на 1 м2 поверхности озера в прибрежной зоне Байкала значительно ниже, чем в пелагиали (Вотинцев и соавт., 1975). Максимальные значения для прибрежной части в 2018 г. находились в пределах ~100–280 мг Сорг м–2 и были близки к значениям, полученным ранее для подледного периода высокопродуктивных лет (Вотинцев, Поповская, 1967), когда в пелагиали озера регистрировалось массовое развитие крупных диатомовых водорослей рода Aulacoseira. В марте 2018 г. интенсивного развития крупных форм водорослей не зафиксировано, биомасса была незначительной, но скорость фотосинтеза и концентрации хлорофилла на отдельных станциях соответствовали значениям высокопродуктивных лет, в том числе и на пелагической станции у западного берега, где первичная продукция составила 175 мг Сорг м–2. Высокие скорости фотосинтеза были обеспечены вегетацией мелких форм водорослей (примечание к табл. 3).
Факт прижизненного выделения внеклеточного органического вещества фитопланктоном и бактериопланктоном показан многими исследователями, как в морях, так и в озерах, и не вызывает сомнений. Аналогичные исследования известны и для Байкала (Straskrabova et al., 2005). Доля РОУ от общей продукции бывает разной в зависимости от условий и фазы роста, изменяясь в среднем от 20 до 80% от общей продукции ОВ. В нашем случае РОУ для планктона менялась в пределах 46–82%, для сообществ льда 35–91%. Благодаря подледному фотосинтезу образуется значительное количество органических веществ, запускающих микробную трофическую цепь. В подледном планктоне озера Байкал между скоростью фотосинтеза и общей численностью микроорганизмов отмечалась положительная связь, коэффициент корреляции равнялся 0.77, p < 0.05. На определенных этапах развития фито- и бактериопланктона наблюдаются как четко выраженный положительный характер зависимости, так и тенденция обратной связи (Rosenberg et al., 1986). Например, в северной Балтике экскреция внеклеточных продуктов фотосинтеза достигает 45–50% всего ассимилированного углерода. При этом микроорганизмы могут ассимилировать за сутки до 88% всех выделенных метаболитов (Rosenberg et al., 1986; Franck et al., 1987).
Содержание основного пигмента хлорофилла “а” (Хл), считающегося одной из важных эколого-физиологических характеристик развития и фотосинтетической активности водорослей (Бульон, 1983; Минеева, Щур, 2012; Reynolds, 2006), в нашем случае показывает существенное колебание показателей. Интервал величин изменяется от свойственных олиготрофным водам (Бульон, 1983) концентраций хлорофилла (от 0.01 до 1 мг м–3) на станциях восточного берега, до мезотрофных вод (от 3.08 до 6.41 мг м–3) на станциях западного. Последние величины отмечены для подледного планктона в годы с массовым развитием весеннего фитопланктона (Straškrábova et al., 2005; Izmest’eva et al., 2016). Дополнительный вклад в содержание хлорофилла внесли симбионтные инфузории. Этот факт хорошо описан ранее (Sekino et al., 2007; Bondarenko et al., 2019).
Еще одной распространенной характеристикой фотосинтетической активности водорослей является суточное ассимиляционное число (САЧ). За исключением двух станций в устьях рек и фоновой в заливе Лиственничный, САЧ озерного фитопланктона были низкими (от 3.2 до 14.0). При этом они были сравнимы с САЧ для летнего фитопланктона (от 2.5 до 10.0) (Бульон, 1983) и приближались к значениям часовых ассимиляционных чисел в водоемах разного типа. Высокие САЧ, полученные преимущественно в устьях рек, скорее всего, можно объяснить притоком питательных элементов, стимулирующих размножение микроводорослей. Повышенное САЧ фоновой станции объясняется значительным вкладом мелких водорослей в продукционный процесс. Известно, что мелкие формы водорослей обладают высоким фотосинтетическим потенциалом (Бульон, 1983; Минеева и соавт., 2012; Reynolds, 2006).
Ранее было написано о структурных изменениях в фитопланктоне озера, где произошла смена крупноклеточного байкальского комплекса водорослей на мелкоклеточный, представленный широко распространенными видами (Бондаренко, Логачева, 2016). Указанные авторы считают, что структурные перестройки в планктоне и доминирование видов, имеющих более мелкие размеры, свидетельствует об эвтрофировании прибрежной зоны озера Байкал. Факты, подтверждающие эвтрофирование зоны литорали озера, на примере залива Лиственничный, приведены и в микробиологической части комплексного исследования, опубликованной ранее (Земская и соавт., 2019). В указанной статье оценено влияние хозяйственно-бытовых сточных вод поселка Листвянка, обогащенных колиформными бактериями, мезофильными аэробными и факультативно анаэробными микроорганизмами, на качество вод рек Большая Черемшаная и Крестовка. В этих реках были выявлены высокие количества органотрофных и термотолерантных бактерий при низкой активности бактериопланктона и высокой концентрации органического углерода (Земская и соавт., 2019). Представленная в данном сообщении альгологическая часть комплексного исследования свидетельствует, что еще одним доказательством эвтрофирования прибрежной зоны озера является и доминирование фитофлагеллят. С помощью метода главных компонент с нормализацией и центрированием данных мы построили диаграммы (рис. 1) сопряженности численности фитофлагеллят, продукционных показателей всех планктонных микроводорослей, а также количества санитарно-значимых бактерий и некоторых химических параметров, представленных в сообщении (Земская и соавт., 2019). На рисунке видно различие связей между исследуемыми компонентами на разных станциях. Анализ данных показал, что для станций, расположенных в заливе Лиственничный, в районе рек Большая Черемшаная и Крестовка, векторы численности жгутиковых, термотолерантных и органотрофных бактерий расположены в одном кластере при слабой положительной связи между этими параметрами, коэффициент корреляции равен 0.49, p < 0.05. Достоверная положительная корреляция выявлена между численностью жгутиковых водорослей и перманганатной окисляемостью (r = 0.78, p < 0.05), а также первичной продукцией (r = 0.82, p < 0.05). Достоверных связей между численностью жгутиковых и концентрациями биогенных элементов (r колебался от –0.13 до 0.38, p < 0.05) не найдено. Еще более высокий коэффициент (r = 0.84, p < 0.05) между численностью фитофлагеллят и концентрацией хлора в воде этих станций указывает на тесную связь жгутиковых с бытовыми сточными водами – основным источником хлора в воде прибрежной зоны озера. Для станций, расположенных у восточного берега, в районе города Байкальск, такой зависимости не найдено. Образцы приустьевой акватории реки Солзан, а также образцы рек Большая и Малая Осиновки группируются в другой кластер. В этом районе отмечено поступление подземных вод с повышенными концентрациями некоторых ионов (сульфата, нитрата, нитрита) за счет влияния стоков из карт шлам-лигнина нефункционирующего Байкальского целлюлозно-бумажного комбината (Земская и соавт., 2019). Следует заметить, что микробиологические исследования (Земская и соавт., 2019) выяснили, что отличительной особенностью этих станций являются высокие значения темновой ассимиляции углекислоты, как в ледовых образцах, так и в воде устьев рек, в сравнении с реками западного берега. Отмечено, что высокие значения удельной эффективности бактериопланктона при существенно меньшей общей численности свидетельствуют о высоком проценте метаболически активных клеток, обеспечивающих включение углерода не только в биомассу бактериопланктона, но и в другие органические соединения (РОВ). В устьях рек западного берега озера Байкал при высокой общей численности микроорганизмов выявлена низкая активность микробных сообществ. Поэтому был сделан вывод, что в приустьевых акваториях рек Байкала с повышенной антропогенной нагрузкой происходит не только изменение продукционного потенциала микробиоценозов, но и снижение их роли как “биологического фильтра” на пути к пелагиали озера Байкал (Земская и соавт., 2019).
Рис. 1.
Диаграмма рассеяния точек в пространстве первых двух главных компонент, построенная на основе химического состава, фито- и микробиологических данных, рН, Σi, РОВ и ТАУ в водных образцах. Стрелками отображены векторы, направленные по градиентам изменения исследуемых показателей в образцах. Обозначения: ЧЖ – число жгутиковых, Ʃi –сумма ионов, ХПК – химическое потребление кислорода, ПО – перманганатная окисляемость воды, БФ – биомасса фитопланктона, ХЛФа – концентрация хлорофилла “а”, ОЧМ – общая численность микроорганизмов, ОБ – численность органотрофных бактерий, ОМЧ (22°С) – общее микробное число при температуре 22°С, ОМЧ (37°С) – общее микробное число при температуре 37°С, ПП (БМ) – первичная продукция, ПП(РОУ) – первичная продукция (внеклеточный растворенный органический углерод). ТАУ(БМ) – темновая ассимиляция углекислоты (биомасса микроорганизмов), ТАУ(РОУ) – темновая ассимиляция углекислоты (внеклеточный растворенный органический углерод).
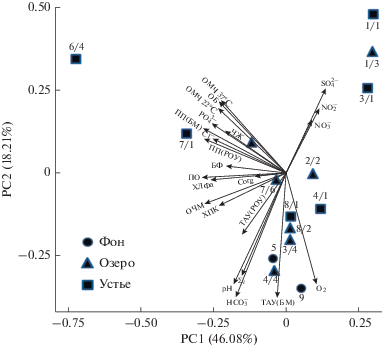
Высокие концентрации РОВ на станциях в заливе Лиственничный, где отмечено массовое развитие фитофлагеллят, а также статистический анализ, проведенный в данной работе, свидетельствуют, что доступность легко минерализуемых органических веществ, в свою очередь, способствует интенсивному размножению миксотрофных жгутиковых в прибрежной зоне (рис. 1). Высокие скорости фотосинтеза этих организмов позволяют накапливаться значительной биомассе, что не только приводит к эвтрофированию в литорали озера, но и, при снижении роли бактериопланктона как “биологического фильтра”, может служить источником для увеличения продуктивности пелагиали.
Исследования многолетней динамики фитопланктона во многих пресноводных водоемах планеты показывают аналогичные перестройки. Авторы связывают их не только с изменениями в биогенной нагрузке, но и с изменениями климата. Увеличение количества фитофлагеллят (криптофитовых и зеленых рода Chlamydomonas) – показателей эвтрофирования и органического загрязнения природных вод, было отмечено в середине прошлого века в Петрозаводской и Кондопожской губах Онежского озера, наиболее освоенных в промышленном отношении (Чекрыжева, 2008). Зеленые миксотрофные жгутиконосцы рода Chlamydomonas летом и осенью стали преобладать в озерах Татр, Альп и Пиренеев, что исследователи считают результатом ацидификации этих водоемов (Fott et al., 1999; Pugnetti, Bettinetti, 1999). В фитопланктоне водохранилищ Волги перестройки коснулись состава доминирующих видов, отмечено увеличение обилия и разнообразия миксотрофных фитофлагеллят (Корнева и соавт., 2018). Данные авторы считают, что увеличению обилия жгутиконосцев во втором десятилетии XXI века способствовало увеличение продолжительности безледного периода.
Таким образом, анализ результатов комплексного исследования микроводорослей межкристаллической ледовой воды и планктона в прибрежной зоне и пелагиали южной части озера Байкал, проведенного в марте 2018 г., позволил выявить ряд закономерностей. Показано, что продукционная активность (биомасса, скорость фотосинтеза, содержание хлорофилла “а”, суточные ассимиляционные числа) микроводорослей на большинстве станций пробоотбора была относительно низкой, по сравнению с аналогичными величинами, приводимыми для Байкала ранее (Антипова, 1963; Вотинцев и соавт., 1975; Поповская, 1987; Оболкина и соавт., 2000). Значительные показатели активности у юго-западного берега отмечены в местах впадения притоков, подвергающихся существенной антропогенной нагрузке. Здесь высокие количественные характеристики были обеспечены не только дополнительным поступлением биогенных веществ, но и вегетацией мелких форм водорослей и, в первую очередь, поступающих с водами рек фитофлагеллят – показателей органического загрязнения воды. У юго-восточного берега, напротив, максимальные показатели зарегистрированы на озерных станциях и, прежде всего, на “фоновой”, расположенной в пелагиали озера против г. Байкальск. На этих станциях фитопланктон был представлен типичными мелкоклеточными обитателями современного Байкала: зеленой Koliella longiseta, диатомовыми Fragilaria radians и Nitzschia graciliformis.
Проведенные работы также позволили выяснить, что основным фактором, стимулирующим рост жгутиконосцев в притоках, подвергающихся активной антропогенной нагрузке, и прилегающих к ним акваториях озера являлась доступность легко минерализуемых органических веществ. Дополнительным источником может служить также РОВ, образующееся как при функциональной активности (прижизненные выделения), так и при разложении макроводорослей и цианобактерий, интенсивно развивающихся на дне мелководных участков озера Байкал (Timoshkin et al., 2016), что показано для других водных экосистем (Trochine et al., 2010).
Список литературы
Антипова Н.Л. Сезонные и годовые изменения фитопланктона в озере Байкал // Исследования по микрофлоре и зоопланктону Байкала. М.-Л.: Изд-во АН СССР, 1963. С. 12–28.
Баринова С.С., Медведева Л.А., Анисимова О.В. Биоразнообразие водорослей-индикаторов окружающей среды. Тель Авив: PiliesStudio, 2006. 498 с.
Бондаренко Н.А. Водоросли. Фитопланктон // Флора и фауна заповедников. Вып. 92. Флора и фауна водоемов и водотоков Байкальского заповедника. М., 2001. С. 8–14.
Бондаренко Н.А., Гусельникова Н.Е. Продукция фитопланктона Южного Байкала // Изв. Сиб. отд. АН СССР. 1989. Вып. 1. С. 77–80.
Бондаренко Н.А., Логачева Н.Ф. Структурные изменения в фитопланктоне прибрежной зоны озера Байкал // Гидробиол. журн. 2016. № 6. С. 17–26.
Bondarenko N.A., Logacheva N.F. Structural changes in phytoplankton of the littoral zone of Lake Baikal // Hydrobiol. J. 2017. V. 53. № 2. P. 16–24.
Бульон В.В. Первичная продукция планктона внутренних водоемов. Л.: Наука, 1983. 149 с.
Винберг Г.Г. Первичная продукция водоемов. Минск: Изд-во АН БССР, 1960. 329 с.
Вотинцев К.К., Самарина А.В. Кислородный режим озера Байкал // Труды Всесоюз. гидробиол. общ-ва. 1957. Т. 8. С. 288–304.
Вотинцев К.К., Поповская Г.И. Годовая автотрофная продукция фитопланктона озера Байкал // Докл. АН СССР. 1967. Т. 176. № 1. С. 205–208.
Вотинцев К.К., Мещерякова А.И., Поповская Г.И. Круговорот органического вещества в озере Байкал. Новосибирск: Наука, 1975. 190 с.
Голлербах М.М., Косинская Е.К., Полянский В.И. Определитель пресноводных водорослей СССР. М.: Наука, 1953. Вып. 2. 652 с.
Забелина М.М., Киселев И.А., Прошкина-Лавренко А.И., Шешукова В.С. Определитель пресноводных водорослей СССР. Вып. 4. Диатомовые водоросли. М.: Советская наука, 1951. 399 с.
Земская Т.И., Захаренко А.С., Русанов И.И., Букин С.В., Погодаева Т.В., Нецветаева О.Г., Иванов В.Г., Штыкова Ю.Р., Пименов Н.В. Экология приустьевых акваторий малых рек Южного Байкала по данным химических и микробиологических исследований в весенний период // Микробиология. 2019. Т. 88. С. 673–684.
Zemskaya T.I., Zakharenko A.S., Rusanov I.I., Bukin S.V., Pogodaeva T.V., Netsvetaeva O.G., Ivanov V.G., Shtykova Yu.R., Pimenov N.V. Ecology of estuarine basins of Southern Baikal small rivers according to springtime chemical and microbiological investigation // Microbiology (Moscow). 2019. V. 13. P. 673–684.
Изместьева Л.Р., Кожова О.М. Структура и сукцессии фитопланктона // Долгосрочное прогнозирование состояния экосистем. Новосибирск: Наука. Сиб. отд-ние, 1988. С. 97–129.
Изместьева Л.Р., Кожова О.М., Усенко Н.Б. Фотосинтетические пигменты как компонент мониторинга Байкала // Водные ресурсы. 1990. № 3.С. 89–95.
Интернет-ресурс https://cran.r-project.org (дата обращения 15.11.19).
Киселёв И.А. Методы исследования планктона // Жизнь пресных вод. М.-Л., 1956. Т. 4. Ч. 1. С. 140–416.
Корнева Л.Г., Соловьева В.В., Макарова О.С., Гречухина Н.Г., Тарасова Н.Г. Распределение фитопланктона в волжских водохранилищах летом 2015 г. // Труды ИБВВ РАН. 2018. Вып. 82. № 85. С. 2–27.
Кузнецов С.И., Романенко В.И., Глазунов И.В. Продукция органического вещества за счет фотосинтеза фитопланктона в озере Байкал // Докл. АН СССР. 1964. Т. 156. № 6. С. 1444–1447.
Макарова И.В., Пичкилы Л.О. К некоторым вопросам методики вычисления биомассы фитопланктона // Ботанический журн. 1970. Т. 55. № 10. С. 1488–1494.
Матвiенко О.М., Литвиненко Р.М. Визначник прiсноводных водоростей Украiнськоi РСР. III. Частина 2. Пiрофитовi водоростi . Pyrrophyta. Киiв: Наукова Думка, 1977. 385 с.
Мейер К.И. Введение во флору водорослей оз. Байкал // Бюлл. МОИП. 1930. Т. 39. № 3–4. С. 179–392.
Мельников И.А. Экосистема арктического дрейфующего льда // Биология Центрального Арктического региона. М.: Наука, 1980. С. 61–97.
Минеева Н.М., Щур Л.А. Содержание хлорофилла а в единице биомассы фитопланктона // Альгология. 2012. Т. 22. № 4. С. 441–456.
Минеева Н.М., Щур Л.А., Бондаренко. Н.А. Функционирование фитопланктона крупных пресноводных систем при разной обеспеченности ресурсами // Гидробиол. журн. 2012. № 3. С. 21–33.
Новаковский А.Б. Взаимодействие Excel и статистического пакета R для обработки данных в экологии // Вестник ИБ Коми НЦ УрО РАН. 2016. № 3(197). С. 26–33. https://doi.org/10.31140/j.vestnikib.2016.3(197).4
Оболкина Л.А., Бондаренко Н.А., Дорощенко Л.Ф., Горбунова Л.А., Моложавая О.А. О находке криофильного сообщества в озере Байкал // ДАН. 2000. Т. 371. № 6. С. 815–817.
Поповская Г.И. Фитопланктон глубочайшего озера мира // Морской и пресноводный планктон. Л., 1987. С. 107–115.
Царенко П.М. Краткий определитель хлорококковых водорослей Украинской ССР. Киев: Наукова Думка, 1990. 208 с.
Чекрыжева Т.А. Изменения в структуре летнего фитопланктона Кондопожской губы Онежского озера в процессе антропогенного эвтрофирования // Труды Карельского НЦ РАН. Вып. 12. Сер. “Био-география”. Петрозаводск, 2008. С. 156–163.
Юрьев Д.Н., Лебедев Ю.М. Развитие ледового перифитона р. Амур в связи со световым фактором // Ботанический журн. 1988. Т. 73. № 11. С. 1546–1551.
Bondarenko N.A., Belykh O.I., Golobokova L.P., Artemyeva O.V., Logacheva N.F., Tikhonova I.V., Lipko I.A., Kostornova T.Ya., Parfenova V.V., Khodzher T.V., Ahn T.-S., Zo Y.-G. Stratified distribution of nutrients and extremophile biota within freshwater ice covering the surface of Lake Baikal // J. Microbiol. 2012. V. 50. P. 8–16.
Bondarenko N.A., Ozersky T., Obolkina L.A., Tikhonova I.V., Sorokovikova E.G., Sakirko M.V., Potapov S.A., Blinov V.V., Zhdanov A.A., Belykh O.I. Recent changes in the spring microplankton of Lake Baikal // Limnologica. 2019. V. 75. P. 19–29.
Felip M., Sattler B., Psenner R., Catalan J. Highly active microbial communities in the ice and snow cover of high mountain lakes // Appl. Environ. Microbiol. 1995. V. 61. P. 2394–2401.
Fott J., Blazo M., Stuchlík E., Strunecký O. Phytoplankton in three Tatra Mountain lakes of different acidification status // J. Limnol. 1999. V. 58. P. 107–116.
Franck H., Matthaus W., Sammler R. Major inflows of saline water into the Baltic Sea during the present century // Gerlands Beitr. Geophysik. 1987. № 96. P. 5–17.
Frenette J.-J., Thibeault P., Lapierre J.-F., Hamilton P. Presence of algae in freshwater ice cover of fluvial Lac Saint-Pierre (St. Lawrence river, Canada) // J. Phycology. 2008. V. 44. P. 284–291.
Hsiao S.I.C. Dynamics of ice algae and phytoplankton in Frobisher Bay // Polar Biology. 1992. V. 12. P. 645–651.
Izmest’eva L.R., Moore M.V., Hampton S.E., Ferwerda C.J., Gray D.K., Woo K.H. Pislegina H.V., Krashchuk L.S., Shimaraeva S.V., Silow E.A. Lake-wide physical and biological trends associated with warming in Lake Baikal // J. Great Lakes Res. 2016. V. 42. P. 6–17.
Komárek J., Anagnostidis K. Cyanoprokaryota. 1. Chlroococcales . Süßwasserflora von Mitteleuropa Spektrum. Berlin. Akad. Verl., 1998. V. 19. 548 p.
Kravtsova L.S., Izhboldina L.A., Khanaev I.V., Pomazkina G.V., Rodionova E.V., Domysheva V.M., Sakirko M.V., Tomberg I.V., Kostornova T.Y., Kravchenko O.S., Kupchinsky A.B. Nearshore benthic blooms of filamentous green algae in Lake Baikal // J. Great Lakes Res. 2014. V. 40. P. 441–448.
McRoy C.P., Goering J.J. The influence of ice on the Primary productivity of the Bering Sea // The Oceanography of the Bering Sea / Eds. Hood D., Kelley E. Institute of Marine Science, University of Alaska, 1974. P. 403–421.
Pimenov N.V., Bonch-Osmolovskaya E.A. In situ activity studies in thermal environments // Methods in Microbiology / Eds. Rainey F.A., Oren A. Amsterdam: Elsevier Ltd., 2006. V. 14. P. 29–53.
Pugnetti A., Bettinetti R. Biomass and species structure of the phytoplankton of an high mountain lake (Lake Paione Superiore, Central Alps, Italy) // J. Limnol. 1999. V. 58. P. 127–130.
Report of SCOR–UNESCO working group 17. Determination of photosynthetic pigments. Paris: UNESCO, 1964. 12 p.
Reynolds C.S. Ecology of Phytoplankton. Cambridge University Press. 2006. 535 p.
Rosenberg R., Larsson U., Edler L. Eutrophication in marine waters surrounding Sweden // Swed. Environ. Protect. 1986. Bd. 3054. 137 p.
Satoh H., Yamaguchi Y., Watanabe K. Photosynthetic nature of ice algae and their contribution to the primary production in lagoon Saroma Ko, Hokkaido, Japan // Polar Biol. 1989. V. 2. № 1–8. P. 1–8.
Sekino T., Genkai-Kato M., Kawabata Zi., Melnik N.G., Logacheva N.P., Belykh O.I., Obolkina L.A., Bondarenko N.A., Khodzher T.V., Gorbunova L.A., Tanichev A.I., Yoshida T., Kagami M., Gurung T.B., Urabe J., Higashi M., Nakanishi M. Role of phytoplankton size distribution in lake ecosystems revealed by a comparison of whole plankton community structure between Lake Baikal and Lake Biwa // Limnology. 2007. V. 8. P. 227–232.
Starmach K. Chrysophyceae und Haptophyceae. Jena: VEB Gustav Fischer Verlag, 1985. 515 p.
Straškrábová V., Izmest’yeva L.R., Maksimova E.A., Fietz S., Nedoma J., Boroveca J., Kobanova G.I., Shchetinina E.V., Pislegina E.V. Primary production and microbial activity in the euphotic zone of Lake Baikal (Southern Basin) during late winter // Global and Planetary Change. 2005. V. 46. P. 57–73.
Timoshkin O.A., Samsonov D.P., Yamamuro M., Moore M.V., Belykh O.I., Malnik V.V., Sakirko M.V., Shirokaya A.A., Bondarenko N.A., Domysheva V.M., Fedorova G.A., Kochetkov A.I., Kuzmin A.V., Lukhnev A.G., Medvezhonkova O.V., Nepokrytykh A.V., Pasynkova E.M., Poberezhnaya A.E., Potapskaya N.V., Rozhkova N.A., Sheveleva N.G., Tikhonova I.V., Timoshkina E.M., Tomberg I.V., Volkova E.A., Zaitseva E.P., Zvereva Yu.M., Kupchinsky A.B., Bukshuk N.A. Rapid ecological change in the coastal zone of Lake Baikal (East Siberia): Is the site of the world’s greatest freshwater biodiversity in danger? // J. Great Lakes Res. 2016. V. 42. P. 487–497.
Thomas D.N., Dieckman G.S. Antarctic sea ice – a habitat for extremophiles // Science. 2002. V. 295. P. 641–644.
Trochine C., Guerrieri M., Liboriussen L., Meerhoff M., Lauridsen T.L., Søndergaard M., Jeppesen E. Filamentous green algae inhibit phytoplankton with enhanced effects when lakes get warmer // Freshwater Biology. 2010. V. 56. № 3. P. 541–553.
Дополнительные материалы отсутствуют.


