Микробиология, 2020, T. 89, № 3, стр. 300-307
Трансформация гуминовой кислоты грибом Cerrena unicolor в условиях роста на целлюлозе и глюкозе
А. В. Лисов a, *, А. Г. Заварзина b, c, О. В. Белова a, А. А. Леонтьевский a
a Федеральный исследовательский центр “Пущинский научный центр биологических исследований
Российской академии наук”
142290 Пущино, Россия
b Факультет почвоведения МГУ им. М.В. Ломоносова
119234 Москва, Россия
c Палеонтологический институт им. А.А. Борисяка РАН
117647 Москва, Россия
* E-mail: ssl208@rambler.ru
Поступила в редакцию 20.12.2019
После доработки 29.12.2019
Принята к публикации 25.01.2020
Аннотация
Микробная деструкция лигноцеллюлозы и органического вещества почв – важнейший процесс, контролирующий потоки CО2 в атмосферу и осуществляемый в основном грибами. Около 30–70% Сорг почв составляет растворимая в щелочах фракция, в основном представленная ароматическими темноокрашенными соединениями фенольной природы – гуминовыми кислотами (ГК). Нами впервые показана возможность эффективной деструкции ГК почв в целлюлолитических условиях и доказана ключевая роль окислительного фермента целлюлолитического комплекса – целлобиозодегидрогеназы (ЦДГ) в этом процессе. Дереворазрушающий гриб Cerrena unicolor в условиях роста на среде с целлюлозой (продукция ЦДГ и лакказы) вызывал обесцвечивание ГК на 60%, а на среде с глюкозой (продукция лакказы) – на 20%. В экспериментах с культуральной жидкостью и чистыми ферментами методом гель-фильтрации показана деполимеризация ГК в присутствии ЦДГ и полимеризация – в присутствии фермента лакказы. Деструкцию ГК в присутствии ЦДГ ингибировали уловители радикалов, что указывает на радикальную природу процесса (предположительно реакция Фентона). Деполимеризация ГК ЦДГ снижалась в присутствие лакказы, а полимеризация ГК лакказой снижалась при наличии ЦДГ. Таким образом, на трансформацию ГК в целлюлолитических условиях влияет взаимодействие этих двух ферментов. Результаты работы существенно расширяют представления о механизмах деградации ароматических веществ почвенного гумуса микроорганизмами, а также об экологических функциях дереворазрушающих грибов при их росте в условиях деградации целлюлозы.
Растительная биомасса и почвенное органическое вещество (гумус) составляют главные резервуары Сорг в биосфере (550 и 1500 Гт соответственно; Batjes et al., 2006). Микробная деструкция лигноцеллюлозы и почвенного гумуса – важнейшие биосферные процессы, контролирующие потоки СO2 в атмосферу. Известно, что деструкция осуществляется в основном грибами, и наиболее эффективными являются грибы белой гнили древесины и родственные им базидиомицеты лесных подстилок (Osono, 2019). Уникальная роль этих микроорганизмов заключается в способности к разрушению как полисахаридов клеточных стенок (целлюлозы и гемицеллюлоз), так и лигнина до CO2 и растворимых фрагментов. Деструкция лигноцеллюлозы осуществляется комплексом внеклеточных гидролаз и оксидоредуктаз (Andlar et al., 2018), а также активными формами кислорода (${\text{O}}_{2}^{{\centerdot - }},$ •OH) продуцируемыми в гидрохинон редокс цикле при окислении гидрохинонов лакказами или пероксидазами (Gomez-Toribio et al., 2009). Установлено также, что лигнолитические оксидоредуктазы, к которым относятся Mn-зависимая пероксидаза (EC 1.11.1.13), лигнин пероксидаза (EC 1.11.1.14), универсальная пероксидаза (EC 1.11.1.16) и лакказа (EC 1.10.3.2), эффективно обесцвечивают и деполимеризуют гуминовые кислоты различного происхождения (Grinhut et al., 2007, 2011). Природа гуминовых кислот является в настоящее время предметом дискуссий (Lehmann, Kleber, 2015), тем не менее, эти темноокрашенные ароматические соединения, обогащенные фенольными и карбоксильными группами, составляют основу щелочных экстрактов, в которые переходит 30–70% Сорг почв, торфов и углей (Орлов, 1990). Оценка устойчивости веществ щелочных экстрактов к микробной деструкции представляет большое значение для понимания глобального цикла углерода и прогнозов эмиссии парниковых газов в атмосферу.
Известно, что деструкция лигнина и гумусовых кислот лигнолитическими грибами – процесс ко-метаболический, протекающий в присутствии легкоусвояемых субстратов. Однако профиль ферментов, секретируемых грибами, может быть различным в зависимости от источника углерода, используемого для роста. Большая часть исследований по деструкции лигнина и гумусовых кислот проводилась на культурах грибов, растущих на моносахаридах, в первую очередь глюкозе (Grinhut et al., 2007). В этих условиях грибы продуцируют лакказу и, при дефиците источников С, N или S, – лигнолитические пероксидазы. В отличие от роста на моносахаридах, при росте в условиях разложения целлюлозы грибы продуцируют полисахарид-разрушающие гидролазы (Lynd et al., 2002), литические полисахаридмонооксигеназы (Jagadeeswaran et al., 2016), а также целлобиозодегидрогеназу (EC 1.1.99.18). Целлобиозодегидрогеназа (ЦДГ) – окислительный вспомогательный фермент целлюлолитического комплекса, специфически связывающийся с целлюлозой и катализирующий окисление целлобиозы до целлобионолактона хинонами, которые в ходе реакции восстанавливаются до гидрохинонов (Fang et al., 1998; Zamocky et al., 2006). Кроме хинонов, акцепторами электронов при окислении целлобиозы могут быть ионы Fe3+ (которые восстанавливаются до Fe2+), Сu2+, фенокси-радикалы и, в слабой степени, молекулярный кислород, который восстанавливается до перекиси (Adler, 1994; Henriksson et al., 2000). Субстратами ЦДГ, кроме целлобиозы, могут быть другие редуцирующие дисахариды, а также олиго- и полисахариды с глюкозой или маннозой на редуцирующем конце, но не моносахариды (Henriksson et al., 2000). Фермент ЦДГ широко распространен в грибах белой гнили, а также был обнаружен в грибах-целлюлолитиках – грибах бурой гнили, аскомицетах и почвенных микромицетах (Henriksson et al., 2000; Zamocky et al., 2006). Показано, что ЦДГ участвует не только в деструкции целлюлозы, но и лигнина (Henriksson et al., 2000).
Можно предполагать, что в условиях роста грибов на целлюлозе ЦДГ может участвовать в деструкции гуминовых кислот почв, что существенно расширяет экологические функции микроорганизмов-целлюлолитиков. Однако работ по деструкции гуминовых веществ грибами при участии фермента ЦДГ нами не найдено. Определенный интерес представляет взаимодействие ЦДГ с ферментом лакказой в этом процессе. Внеклеточная лакказа продуцируется грибами белой гнили при наличии индукторов (Baldrian, 2006), которыми могут быть и ГК (Zavarzina et al., 2018). Лакказа катализирует окисление фенольных субстратов молекулярным кислородом с образованием фенокси-радикалов, хинонов и семихинонов, которые могут подвергаться спонтанной полимеризации или инициировать деструкцию фенольных субстратов через продукцию активных форм кислорода (Baldrian, 2006; Gomez-Toribio et al., 2009). Роль лакказ при деструкции лигнина и гуминовых кислот до конца не установлена, однако нами показано, что грибная лакказа способна к полимеризации/деполимеризации ГК in vitro (Zavarzina et al., 2004) и in vivo (Zavarzina et al., 2018). В целлюлолитических условиях за счет активности лакказы фенольные группы в ГК могут окисляться до хинонов, необходимых для окислительного действия ЦДГ.
Целью работы было изучить возможность окислительной трансформации ГК почв в целлюлолитических условиях, установить роль фермента ЦДГ в этом процессе и выяснить, как взаимодействие ферментов лакказы и ЦДГ влияет на трансформацию ароматических фенольных субстратов (таких как ГК) грибами. В качестве объекта исследований был выбран дереворазрушающий базидиомицет Cerrena unicolor, который является активным продуцентом глюкогидролаз, лакказы, ЦДГ (Michniewicz et al., 2006; Белова и соавт., 2014; Sulej et al., 2015).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Микроорганизм. Гриб Cerrena unicolor (Bull.) Murrill ВКМ F-3196 был получен из Всероссийской коллекции микроорганизмов (http://vkm.ru/). Культуру гриба поддерживали на чашках Петри с сусло-агаром, которые хранили при 4°С и пересевали один раз в месяц.
Гуминовые кислоты. В работе использовали препарат гуминовой кислоты (ГКДN2), полученный экстракцией 0.1 М NaOH в атмосфере азота из дерново-подзолистой почвы (Московская обл.). Выделение, очистка и физико-химическая характеристика препарата приведены в работе (Заварзина и соавт., 2019). Общее содержание золы в препарате составляло 4.8%. Элементный состав золы определяли методом масс-спектрометрии с индуктивно связанной плазмой на приборе 5110 Agilent ICP-OES (“Agilent Technologies”). Для этого навеску золы растворяли в 1.2 мл смеси HClконц и HNO3конц (3 : 1), нагревали 12 ч на водяной бане при 100°С, переносили в мерную колбу на 15 мл, куда вносили 0.2 мл HF (40%) для растворения кремний-содержащих соединений, через 30 мин доводили объем раствора до метки. Общее содержание Fe в препарате составило 1.5%.
Культивирование гриба на средах с глюкозой (среда G) и микрокристаллической целлюлозой (среда С). Погруженное культивирование гриба проводили в качалочных колбах Эрленмейера объемом 750 мл при 28°С на качалке при 120 об./мин. Объем среды в колбе составлял 100 мл. Использовали среду следующего состава (г/л): пептон – 2; дрожжевой экстракт – 2; KH2PO4 – 0.2; MgSO4 · · 7H2O – 0.2; глюкоза (среда G) или микрокристаллическая целлюлоза (среда C) – 20. Указанные компоненты растворяли в 20 мМ Na-тартратном буфере, рН 4.5. В качестве индуктора лакказы в среды вносили CuSO4 · 5H2O в концентрации 0.1 мМ.
Для получения инокулята мицелий гриба выращивали на чашке Петри с сусло-агаром при 28°С в течение 7 сут, вырезали из мицелия пробочным сверлом диски диаметром 1 см. Далее вносили в среду G диски мицелия – из расчета пять дисков на колбу со 100 мл среды G и выращивали в течение 5 сут в условиях, как указано выше. Выросший мицелий инокулята отмывали от среды G стерильным Na-тартратным буфером, гомогенизировали фарфоровыми бусами и вносили в среды для опыта – из расчета 1 мл гомогенизированного мицелия на 100 мл среды.
Определение активности ферментов. Активность ферментов определяли спектрофотометрически на спектрофотометре Shimadzu UV-2800. Активность лакказы определяли по скорости окисления АБТС в 20 мМ Na-ацетатном буфере (рН 4.5) при длине волны 420 нм (ε420 = 36000 M–1 cм–1) (Heinfling et al., 1998). Активность ЦДГ определяли по скорости восстановления 2,6-дихлорофенолининдофенола в аналогичном буферном растворе при длине волны 520 нм (ε520 = 7300 M−1 cм−1) (Pricelius et al., 2009). За единицу активности принимали количество фермента, катализирующего превращение одного микромоля субстрата за одну минуту.
Изучение трансформации ГК при росте гриба C. unicolor на средах G и C. Готовили исходный раствор ГК с концентрацией 20 мг/мл, для чего ГК растворяли в 0.1 М NaOH, рН доводили до 4.5 путем титрования 1 М NaCl. ГК стерильно – путем фильтрации через мембранный фильтр (0.22 мкм, “Watman”, США) – вносили в культуральные среды в момент максимальной активности оксидоредуктаз до конечной концентрации ГК 1 мг/мл. Обесцвечивание ГК отслеживали в течение трех суток культивирования путем измерения поглощения при 465 нм на спектрофотометре Shimadzu UV 1800 (Япония). Контролем служили среды без ГК.
Изучение трансформации ГК в культуральной жидкости сред G и C. Для проведения этого эксперимента была отобрана культуральная жидкость (КЖ) сред C и G; мицелий отделяли центрифугированием. Для удаления низкомолекулярных компонентов КЖ диализовали против 20 мМ ацетатного буфера, рН 4.5 (размер пор мембраны 12 кДа, “Sigma”, США). Далее в КЖ вносили ГК до конечной концентрации 1 мг/мл и проводили реакцию в течение 48 ч при 30°С. Проводили несколько серий опытов: (1) c исходной КЖ сред G и C; (2) с КЖ сред G и C, в которой подавляли активность лакказы внесением ингибитора лакказы NaN3 в концентрации 10 мМ; (3) c КЖ среды С, куда вносили субстрат ЦДГ целлобиозу в концентрации 10 мМ. Контролем служила реакция ГК с КЖ, инактивированной нагреванием 1 мин на кипящей водяной бане. Изменение молекулярно-массового распределения ГК во всех вариантах опыта исследовали с помощью гель-фильтрации на носителе Sephadex G-75, в 25 мМ Трис-HCl буфере (pH 8.2) с добавлением 50 мM NaCl и 0.1% додецилсульфата натрия, как описано ранее (Zavarzina et al., 2018). Использовали колонку размером 2 × 42 см, подключенную к системе AKTA pure (“GE Healthcare”, США).
Изучение трансформации ГК препаратами лакказы и ЦДГ. Препараты ферментов были получены, как описано ранее (Lisova et al., 2010; Lisov et al., 2018). Реакцию ферментов с ГК проводили в 20 мМ Na-ацетатном буфере (рН 4.5) при 30°С в течение 48 ч. Концентрация ГК была 1 мг/мл, количество фермента – 1 Ед/мл. Объем реакционной смеси – 2 мл. Для проверки роли радикалов в трансформации ГК ферментом ЦДГ в инкубационную смесь вносили уловители радикалов маннитол и диметилсульфоксид в концентрации 5 мМ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для достижения поставленной в работе цели были проведены эксперименты с культурой гриба C. unicolor, выращенной на средах с микрокристаллической целлюлозой и глюкозой; c культуральной жидкостью, свободной от мицелия; и чистыми ферментами лакказой и ЦДГ, выделенными из этого гриба.
Обесцвечивание гуминовых кислот культурой С. unicolor на средах G and C. Лакказа продуцируется грибами при их росте как на моносахаридах, так и олигосахаридах, но для продукции фермента у базидиомицетов необходимы индукторы (Baldrian, 2006). Фермент ЦДГ не продуцируется грибами при росте на моносахаридах, но продуцируется при росте на целлюлозе (Henriksson et al., 2000). Поэтому использование сред с различными сахарами в качестве основного источника углерода способствует продукции либо лакказы, либо лакказы и ЦДГ, что позволяет оценить действие этих ферментов на ГК.
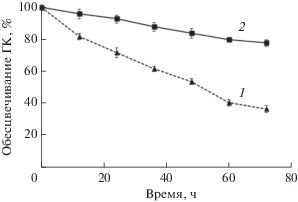
При выращивании гриба С. unicolor на среде с микрокристаллической целлюлозой и ионами меди как индукторами лакказы (среда С), в культуральную жидкость продуцировались ЦДГ и лакказа, а на среде с глюкозой и ионами меди (среда G) – только лакказа. Активность оксидоредуктаз при выращивании C. unicolor в данных условиях достигала максимума на 5-е сут (рис. 1). Активность лакказы в культуральной жидкости (КЖ) среды G на 5-е сут составляла 24 Ед/мл, активность лакказы в КЖ среды С составляла 17 Ед/мл, активность ЦДГ – 7 Ед/мл. В этот момент в культуру стерильно вносили ГК до конечной концентрации 1 мг/мл и отслеживали обесцвечивание ГК в течение 3 сут. По обесцвечиванию часто судят о деградации ГК. Обесцвечивание ГК в культуральной жидкости более активно происходило на среде С, чем на среде G (рис. 2). За 3 сут в среде С (продукция ЦДГ и лакказы) происходило обесцвечивание более 60% ГК, в то время как в среде G (продукция только лакказы) обесцветилось порядка 20% ГК. Таким образом, можно предполагать, что ЦДГ способствует деградации ГК. Интересно, что в присутствии лакказы в культуре гриба C. unicolor ГК обесцвечивались в меньшей степени, чем в присутствии лакказы в культуре дереворазрушающего гриба Lentinus tigrinus, где наблюдали 60% потерю окраски ГК из дерново-подзолистой почвы, 10% которой было связано с сорбцией ГК на мицелии (Zavarzina et al., 2018). Мицелий оказывал частичное влияние на потерю окраски ГК и в данной работе. В среде G мицелий становился темным и оставался таким до конца эксперимента. Однако в среде С (ЦДГ + лакказа) мицелий оставался светлым. Аналогичный эффект обесцвечивания мицелия наблюдали в культуре гриба L. tigrinus при деструкции ГК в присутствии универсальной пероксидазы (Zavarzina et al., 2018). Результаты настоящей работы показывают, что эффективная деструкция сорбированных на мицелии ГК возможна не только в лигнолитических условиях, но и в целлюлолитических условиях.
Рис. 1.
Продукция лакказы и ЦДГ грибом C. unicolor при росте на средах C и G: 1 – лакказа, среда G; 2 – лакказа, среда С; 3 – ЦДГ, среда С.
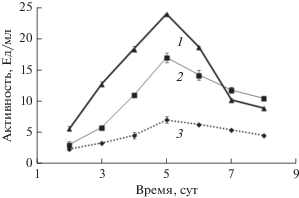
Рис. 2.
Обесцвечивание ГК в культуре гриба C. unicolor, выращенной на глюкозе или целлюлозе: 1 – среда с целлюлозой; 2 – среда с глюкозой.
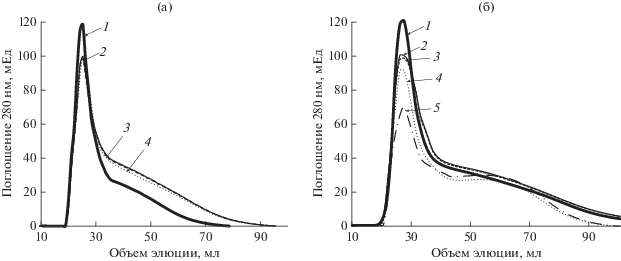
Tрансформация ГК культуральной жидкостью сред G и C без мицелия. Поскольку в присутствии мицелия деструкция ГК может зависеть не только от активности внеклеточных ферментов лакказы и ЦДГ, но и процессов на клеточных стенках, были проведены эксперименты по трансформации ГК культуральной жидкостью сред C и G без мицелия. Под воздействием КЖ среды G происходила полимеризация ГК (рис. 3а). Внесение в КЖ NaN3, ингибитора лакказы, полностью предотвращало полимеризацию ГК, что указывает на главную роль лакказы в этом процессе. Полимеризующая роль лакказы в отношении ГК была показана нами и ранее (Zavarzina et al., 2004, 2018). Если в КЖ среды С не вносили целлобиозу – субстрат ЦДГ, то происходила полимеризация ГК, как в случае КЖ среды G (рис. 3б). В случае внесения целлобиозы в КЖ среды C происходила деполимеризация ГК, что указывает на роль ЦДГ в этом процессе. Совместное использование целлобиозы и NaN3 приводило к еще большей деполимеризации ГК, что так же указывает на важную роль в этом процессе ЦДГ, поскольку NaN3 ингибирует лакказу, но слабо влияет на ЦДГ (Sulej et al., 2015).
Рис. 3.
Трансформация ГК культуральной жидкостью гриба C. unicolor по данным гель-фильтрации на Сефадексе G-75. (а) – КЖ среда c глюкозой (среда G): 1 – взаимодействие ГК с КЖ среды G; 2 – исходная ГК; 3 – ГК контроль с КЖ, нагретой 1 мин при 100°С; 4 – взаимодействие ГК с КЖ среды G в присутствии 10 мМ NaN3. (б) – КЖ среда c целлюлозой (среда C): 1 – взаимодействие ГК с КЖ среды C без целобиозы; 2 – исходная ГК; 3 – ГК контроль с КЖ, нагретой 1 мин при 100°С; 4 – взаимодействие ГК с КЖ среды C в присутствии 10 мМ целлобиозы; 5 – взаимодействие ГК с КЖ среды C в присутствии 10 мМ целлобиозы и 10 мМ NaN3.
Tрансформация ГК препаратами ЦДГ и лакказы. Для проверки роли лакказы и ЦДГ в трансформации ГК были проведены эксперименты с чистыми ферментами. Установлено, что ЦДГ деполимеризовала ГК, как это и наблюдали в КЖ среды С (рис. 4б). Для ЦДГ известна способность деполимеризовать лигнин с помощью генерируемых гидроксильных радикалов (Ander 1994; Henriksson et al., 2000). Образование радикалов ЦДГ возможно несколькими путями, все они основаны на реакции Фентона. Если акцептором электронов при окислении целлобиозы служит кислород, то ЦДГ восстанавливает O2 до H2O2, которая далее взаимодействует с Fe2+ с образованием Fe3+ и гидроксильных радикалов. Однако, установлено, что кислород является слабым акцептором для ЦДГ (Henriksson et al., 2000). Более вероятно образование •ОН радикалов в гидрохинон редокс цикле, как это описано для грибов бурой гнили (Arantes, Goodell, 2014). Если ЦДГ окисляет целлобиозу хинонами, то хиноны восстанавливаются до гидрохинонов, которые могут окисляться до семихинон-радикалов в присутствии хелатных комплексов Fe3+. В этой реакции Fe3+ восстанавливается до Fe2+, а семихиноны спонтанно образуют хиноны, восстанавливая O2 до •OOH, которые дисмутируют до H2O2. Далее Fe2+ реагирует с перекисью с образованием •ОН радикалов. На модельных соединениях лигнина установлено, что ЦДГ разрушает β-эфирные связи, способствует деметоксилированию ароматических структур лигнина и включению гидроксильных групп в нефенольные структуры, доминирующие в нативных лигнинах (Henriksson et al., 2000).
Рис. 4.
Трансформация ГК препаратами лакказы и ЦДГ гриба C. unicolor по данным гель-фильтрации. (a) – трансформация ГК лакказой и ЦДГ: 1 – трансформация ГК лаказой; 2 – ГК контроль; 3 – трансформация ГК лаказой и ЦДГ. (б) – трансформация ГК ЦДГ: 1 – ГК контроль; 2 – трансформация ГК ЦДГ в присутствии диметилсульфоксида; 3 – трансформация ГК ЦДГ; 4 – трансформация ГК ЦДГ в присутствии маннитола.
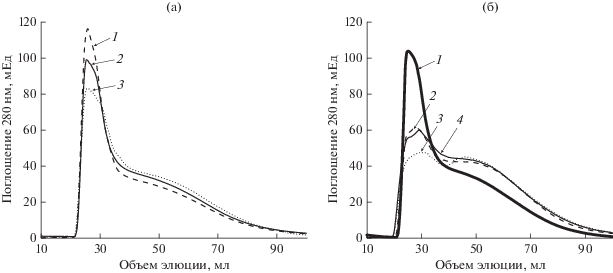
Для ГК возможность деструкции ее ЦДГ установлена впервые. Роль радикалов и реакции Фентона в деполимеризации ГК подтверждается тем, что уловители радикалов маннитол и диметилсульфоксид ингибировали этот процесс (рис. 4). В реакционную смесь не вносили ионы Fe2+. Однако, в препарате ГК содержится 1.5% Fe, частично в виде силикатов (данные не показаны), частично в форме Fe2+ (данные 57Fe-Мёссбауэровской спректроскопии, не показаны). Присутствие Fe3+ в форме хелатных комплексов также хорошо известно для ГК (Stevenson, 1994). Таким образом, акцепторами электронов при реакции ЦДГ c целлобиозой в присутствии ГК могут служить хинонные группировки, присутствующие в ГК (Заварзина и соавт., 2019), Fe3+ в виде хелатов в ГК или молекулярный кислород. Образующиеся в реакции Фентона •ОН радикалы могут способствовать разрыву эфирных связей в ГК, подобно действию ЦДГ на лигнин. Кроме того, потеря окраски ГК в присутствии ЦДГ, показанная в экспериментах с культурой гриба C. unicolor, свидетельствует о деструкции системы сопряженных двойных связей, которые отвечают за окраску ГК (Stevenson, 1994).
Лакказа катализировала полимеризацию ГК (рис. 4а), что наблюдали ранее с другими препаратами ГК (Zavarzina et al., 2004) и что подтверждает роль этого фермента в полимеризации ГК в опытах с КЖ. При воздействии на ГК совместно лакказы и ЦДГ происходила деполимеризация ГК, однако в меньшей степени, чем это наблюдали для ЦДГ без лакказы. ЦДГ, вероятно, препятствовала полимеризации ГК лакказой за счет восстановления фенокси-радикалов, возникающих в ГК под воздействием лакказы. Подобное взаимодействие между ЦДГ и оксидоредуктазами при окислении лигнина описано ранее (Cameron, Aust, 2001). Таким образом, полимеризация/деполимеризация ГК в культуре гриба зависит от взаимодействия лакказы и ЦДГ. В условиях роста гриба на целлюлозе и продукции ЦДГ наблюдается деполимеризация ГК. В случае наличия в среде лакказы деполимеризация ГК под воздействием ЦДГ снижается. Однако при этом так же снижается и полимеризация ГК под воздействием лакказы за счет ЦДГ.
В настоящей работе впервые установлена возможность окислительной деструкции ГК почв в целлюлолитических условиях и доказана ключевая роль фермента ЦДГ в этом процессе. Это существенно расширяет представления о биологических и экологических функциях дереворазрушающих грибов в условиях их роста на целлюлозе, а также расширяет представления о механизмах деградации темноокрашенных ароматических веществ гумуса грибами. Установлено, что присутствие лакказы снижает деполимеризующее действие ЦДГ в отношении ГК, а ЦДГ снижает полимеризацию ГК лакказой. Таким образом, общее направление трансформации ГК в целлюлолитических условиях зависит от взаимного действия этих двух ферментов.
Список литературы
Белова О.В., Лисов А.В., Винокурова Н.Г., Костеневич А.А., Сапунова Л.И., Лобанок А.Г., Леонтьевский А.А. Ксиланаза и целлюлаза гриба Cerrena unicolor ВКМ F-3196: получение, свойства, применение для осахаривания растительного сырья // Прикл. биохимия и микробиология. 2014. Т. 50. С. 171–176.
Belova O.V., Lisov A.V., Vinokurova N.G., Kostenevich A.A., Sapunova L.I., Lobanok A.G., Leont’evsky A.A. Xylanase and cellulase of fungus Cerrena unicolor VKM F-3196: Production, properties, and applications for the saccharification of plant material // Appl. Biochem. Microbiol. 2014. V. 50. P. 148–153.
Заварзина А.Г., Кравченко Е.Г., Константинов А.И., Перминова И.В., Чуков С.Н., Демин В.В. Сравнение свойств препаратов гуминовых кислот, выделенных из почв щелочной экстракцией в отсутствие и присутствие кислорода // Почвоведение. 2018. Т. 52. № 8. С. 910–922.
Zavarzina A.G., Kravchenko E.G., Konstantinov A.I., Perminova I.V., Chukov S.N., Demin V.V. Comparison of the properties of humic acids extracted from soils by alkali in the presence and absence of oxygen // Euras. Soil Sci. 2019. V. 52. P. 880–891.
Ander P. The cellobiose-oxidizing enzymes CBQ and CbO as related to lignin and cellulose degradation, a review // FEMS Microbiol. Rev. 1994. V. 13. P. 297–312.
Andlar M., Rezić T., Marđetko N., Kracher D., Ludwig R., Šantek B. Lignocellulose degradation: an overview of fungi and fungal enzymes involved in lignocellulose degradation // Engin. Life Sci. 2018. V. 18. P. 768–778.
Arantes V., Goodell B. Current understanding of brown-rot fungal biodegradation mechanisms: a review // Deterioration and Protection of Sustainable Biomaterials / Ed. Schultz T. Washington D.C.: American Chemical Society, 2014. P. 3–21.
Baldrian P. Fungal laccases: occurrence and properties // FEMS Microbiol. Rev. 2006. V. 30. P. 215–242.
Batjes N.H. Total carbon and nitrogen in the soils of the world // Eur. J. Soil Sci. 1996. V. 47. P. 151–163.
Cameron M.D., Aust S.D. Cellobiose dehydrogenase-an extracellular fungal flavocytochrome // Enzyme Microb. Technol. 2001. V. 28. P. 129–138.
Fang J., Liu W., Gao P.J. Cellobiose dehydrogenase from Schizophyllum commune: purification and study of some catalytic, inactivation, and cellulose-binding properties // Arch. Biochem. Biophys. 1998. V. 353. P. 37–46.
Gomez-Toribio V., Garcıa-Martın A.B., Martınez M.J., Martınez A.T., Guillen F. Induction of extracellular hydroxyl radical production by white-rot fungi through quinone redox cycling // Appl. Environ. Microbiol. 2009. V. 75. P. 3944–3953.
Grinhut T., Hadar Y., Chen Y. Degradation and transformation of humic substances by saprotrophic fungi: processes and mechanisms // Fung. Biol. Rev. 2007. V. 21. P. 179–189.
Grinhut T., Hertkorn N., Schmitt-Kopplin P., Hadar Y., Chen Y. Mechanisms of humic acids degradation by white rot fungi explored using 1H NMR spectroscopy and FTICR mass spectrometry // Environ. Sci. Technol. 2011. V. 45. P. 2748–2754.
Heinfling A., Martinez A.T., Martinez M.J., Bergbauer M., Szewzyk U. Purification and characterization of peroxidases from the dye-decolorizing fungus Bjerkandera adusta // FEMS Microbiol. Lett. 1998. V. 165. P. 43–50.
Henriksson G., Johansson G., Pettersson G. A critical review of cellobiose dehydrogenases // J. Biotechnol. 2000. V. 78. P. 93–113.
Jagadeeswaran G., Gainey L., Prade R., Mort A.J. A family of AA9 lytic polysaccharide monooxygenases in Aspergillus nidulans is differentially regulated by multiple substrates and at least one is active on cellulose and xyloglucan // Ap-pl. Microbiol. Biotechnol. 2016. V. 100. P. 4535–4547.
Lehmann J., Kleber M. The contentious nature of soil organic matter // Nature. 2015. V. 528. P. 60–68.
Lisov A.V., Belova O.V., Vinokurova N.G., Semashko T.V., Lobanok A.G., Leontievsky A.A. Transformation of cellobiose during the interaction of cellobiose dehydrogenase and β-glucosidase of Cerrena unicolor // J. Basic Microbiol. 2018. V. 58. P. 322–330.
Lisova Z.A., Lisov A.V., Leontievsky A.A. Two laccase isoforms of the basidiomycete Cerrena unicolor VKMF-3196. Induction, isolation and properties // J. Basic Microbiol. 2010. V. 50. P. 72–82.
Lynd L.R., Weimer P.J., van Zyl W.H., Pretorius I.S. Microbial cellulose utilization: fundamentals and biotechnology // Microbiol. Mol. Biol. Rev. 2002. V. 66. P. 506–577.
Michniewicz A., Ullrich R., Ledakowicz S., Hofrichter M. The white-rot fungus Cerrena unicolor strain 137 produces two laccase isoforms with different physico-chemical and catalytic properties // Appl. Microbiol. Biotechnol. 2006. V. 69. P. 682–688.
Osono T. Functional diversity of ligninolytic fungi associated with leaf litter decomposition // Ecol. Res. 2019. P. 1–14. https://doi.org/10.1111/1440-1703.12063
Pricelius S., Ludwig R., Lant N., Haltrich D. Substrate specificity of Myriococcum thermophilum cellobiose dehydrogenase on mono-, oligo-, and polysaccharides related to in situ production of H2O2 // Appl. Microbiol. Biotechnol. 2009. V. 85. P. 75–83.
Stevenson F.J. Humus Chemistry: Genesis, Composition, Reactions. 2nd ed. N.Y.: Wiley, 1994.
Sulej J., Janusz G., Osińska-Jaroszuk M., Rachubik P., Mazur A., Komaniecka I., Choma A., Rogalski J. Characterization of cellobiose dehydrogenase from a biotechnologically important Cerrena unicolor strain // Appl. Biochem. Biotechnol. 2015. V. 176. P. 1638–1658.
Zahmatkesh M., Spanjers H., Toran M.J., Blánquez P., van Lier J.B. Bioremoval of humic acid from water by white rot fungi: exploring the removal mechanisms // AMB Express. 2016. V. 6. P. 118.
Zamocky M., Ludwig R., Peterbauer C., Hallberg B.M., Divne C., Nicholls P., Haltrich D. Cellobiose dehydrogenase – a flavocytochrome from wood-degrading, phytopathogenic and saprotropic fungi // Curr. Protein Peptide Sci. 2006. V. 7. P. 255–280.
Zavarzina A.G., Leontievsky A.A., Golovleva L.A., Trofimov S.Y. Biotransformation of soil humic acids by blue laccase of Panus tigrinus 8/18: an in vitro study // Soil Biol. Biochem. 2004. V. 36. P. 359–369.
Zavarzina A.G., Lisov A.V., Leontievsky A.A. The role of ligninolytic enzymes laccase and a versatile peroxidase of the white-rot fungus Lentinus tigrinus in biotransformation of soil humic matter: comparative in vivo study // J. Geophys. Res: Biogeosci. 2018. V. 123. P. 2727–2742.
Дополнительные материалы отсутствуют.


