Микробиология, 2020, T. 89, № 3, стр. 315-323
Влияние органического источника углерода на биоокисление пирита умеренно-термофильными ацидофильными микроорганизмами
А. Г. Булаев *
Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: bulaev.inmi@yandex.ru
Поступила в редакцию 30.12.2019
После доработки 03.03.2020
Принята к публикации 05.03.2020
Аннотация
В процессах биовыщелачивания пирита из сульфидных руд и концентратов как в природных условиях, так и в биогидрометаллургических процессах доминируют железо- и сероокисляющие авто-, миксо- и гетеротрофные бактерии и археи. Целью данной работы было исследовать окисление пирита представителями доминирующих в биогидрометаллургических процессах групп микроорганизмов (миксотрофным железо- и сероокисляющим бактериальным штаммом Sulfobacillus thermosulfidooxidans ВКМВ1269T, автотрофным сероокисляющим бактериальным штаммом Acidithiobacillus caldus MBC-1 и гетеротрофным железо- и сероокисляющим штаммом архей Aсidiplasma sp. MBA-1), оценить потенциальное значение разных групп микроорганизмов, а также определить роль межвидовых взаимодействий в микробных сообществах в процессе окисления пирита. Было показано, что наиболее активно пирит выщелачивался штаммом S. thermosulfidooxidans ВКМВ 1269T при условии доступности органического источника углерода в среде: в эксперименте с чистой культурой ВКМВ 1269T на среде с 0.02% (м./об.) дрожжевого экстракта за 30 сут было выщелочено 17% пирита, тогда как в экспериментах с чистыми культурами A. caldus MBC-1 и Aсidiplasma sp. MBA-1 было выщелочено менее 1.5% пирита. Значительно более высокие результаты получены при использовании смешанных культур железоокисляющих штаммов и A. caldus MBC-1: степень выщелачивания пирита составила 26‒28%. При этом в экспериментах со смешанной культурой S. thermosulfidooxidans ВКМВ 1269T и A. caldus MBC-1 внесение органического источника углерода (дрожжевого экстракта) не влияло на степень выщелачивания пирита (25–26%). Наиболее высокой (38%) степень выщелачивания была в экспериментах с чистой культурой S. thermosulfidooxidans ВКМВ 1269T при периодическом внесении в среду дрожжевого экстракта: 0.02% в начале эксперимента, а также на 10 и 20 сут. Таким образом, в лабораторных условиях показано, что наибольшую роль в процессе окисления пирита играл штамм бактерии р. Sulfobacillus, но его активность в значительной степени зависела от доступности органического источника углерода в среде, который может быть представлен дрожжевым экстрактом или экзометаболитами автотрофных бактерий, присутствующих в сообществе микроорганизмов, выщелачивающих пирит из сульфидных руд и концентратов.
Биогидрометаллургические технологии, основанные на процессах разрушения кристаллической решетки сульфидных минералов ацидофильными железо- и сероокисляющими микроорганизмами, широко применяются в металлургической промышленности для извлечения различных металлов (меди, никеля, цинка, золота, урана) из сульфидных руд и концентратов (Johnson, 2014). Микроорганизмы, окисляющие сульфидные минералы активно изучаются уже несколько десятилетий (Silverman, Lungren, 1959; Johnson, 2014; Кондратьева и соавт., 2015). Показано, что в окислении сульфидных минералов могут принимать участие несколько десятков видов микроорганизмов, которые представляют собой филогенетически неоднородную группу и включают представителей нескольких филумов доменов Bacteria (Proteobacteria, Nitrospirae, Firmicutes, Actinobacteria) и Archaea (Euryarchaeota, Crenarchaeota) (Кондратьева и соавт., 2015; Mahmoud, et al., 2017).
Механизмы взаимодействия микроорганизмов-окислителей и сульфидных минералов также достаточно хорошо изучены (Mahmoud et al., 2017). Показано, что сульфидные минералы окисляются различными путями с образованием различных промежуточных соединений. Пирит, молибденит, тунгстенит разрушаются посредством тиосульфатного механизма: тиосульфат здесь является главным интермедиатом, окисляющимся до сульфата, а сера – побочным продуктом (Sand et al., 2001). Пирротин, галенит, сфалерит, халькопирит и большинство других сульфидных минералов окисляются с образованием полисульфида и элементной серы в качестве основного промежуточного продукта. Образующиеся полисульфиды при низких pH окисляются до элементной серы, которая может накапливаться на поверхности окисляемого минерала (Sand et al., 2001).
Технологические процессы в биогидрометаллургии всегда осуществляются микробными сообществами, формируемыми в процессе адаптации микроорганизмов к условиям, в которых осуществляется переработка минерального сырья. В зависимости от условий проведения технологического процесса и минералогического состава окисляемого концентрата состав микробных сообществ может различаться (Кондратьева и соавт., 2015). Одним из основных факторов, который влияет на состав микробных популяций, осуществляющих процессы биоокисления сульфидных руд и концентратов, является температура. Так как биоокисление сульфидных минералов сопровождается выделением тепла, то процессы в промышленном масштабе обычно осуществляются при относительно высокой температуре (40–45°C), при этом в реакторах биоокисления сульфидных концентратов применяются системы охлаждения для поддержания температуры. Поэтому в микробных популяциях, осуществляющих промышленные процессы биоокисления, обычно доминируют термотолерантные и умеренно-термофильные микроорганизмы (van Aswegen et al., 2007; Mahmoud et al., 2017). В технологических процессах зачастую доминируют термотолерантные штаммы бактерий р. Leptospirillum, умеренно-термофильные бактерии р. Sulfobacillus и умеренно-термофильные представители р. Acidi-thiobacillus (штаммы A. caldus), а также археи сем. Ferroplasmaceae (рр. Acidiplasma и Ferroplasma) (табл. 1). Нужно отметить, что относительно небольшая доля штаммов р. Leptospirillum способна расти и окислять железо при температуре 45°C и выше, поэтому очевидно, что при относительно высоких температурах они не могут играть основную роль в процессах биоокисления сульфидных концентратов (Coram, Rawlings, 2002).
Таблица 1.
Состав микробных популяций, которые сформировались в технологических процессах биоокисления различного минерального сырья
| Источник выделения | Т, °C | Видовой состав сообщества | Ссылка |
|---|---|---|---|
| Реакторы биоокисления пиритного концентрата | 42 | Leptospirillum ferriphilum, A. caldus, Ferroplasma acidiphilum, Sulfobacillus benefaciens | Morin, d’Hugues, 2007 |
| Реакторы биоокисления концентрата, содержащего пирит, халькопирит, сфалерит | 45 | A. caldus, L. ferriphilum, Sulfobacillus sp., Ferroplasma sp. | Okibe et al., 2003 |
| Реакторы биоокисления концентрата, содержащего пирит, арсенопирит, халькопирит | 45 | A. caldus, Sulfobacillus thermosulfidooxidans, “Sulfobacillus montserratensis” | Dopson, Lindstrom, 2004 |
| Реакторы биоокисления концентрата, содержащего пирит и арсенопирит | 40–50 | Sulfobacillus sp., A. caldus, L. ferriphilum, Ferroplasma sp., Acidiplasma sp. |
van Hille, 2013 |
| Реакторы биоокисления концентрата, содержащего пирит и арсенопирит | 45 | Sulfobacillus sp., A. caldus, Acidiplasma sp. | Muravyov, Bulaev, 2013 |
| Реакторы биоокисления концентрата, содержащего пирротин, пирит и арсенопирит | 39‒42 | A. thiooxidans, Acidiphilium multivorum, Acidiferrobacter thiooxidans, L. ferriphilum, F. acidiphilum | Bulaev et al., 2017 |
В микробных популяциях ацидофильных микроорганизмов, окисляющих сульфидные минералы, происходят взаимодействия между группами микроорганизмов с разными физиологическими свойствами. Среди ацидофильных микроорганизмов, окисляющих сульфидные минералы, есть облигатные автотофы, гетеротофы (многие из которых способны окислять соединения серы и двухвалентное железо) и миксотофы (которые способны как фиксировать диоксид углерода, так и использовать органические вещества) (Кондр-атьева и соавт., 2015). При росте автотрофных ацидофилов в среде накапливаются органические соединения, в том числе органические кислоты (Schnaitman, Lundgren, 1965; Borichewski, 1967; Nancucheo, Johnson, 2010), при этом концентрация растворенных органических соединений в среде может достигать достаточно высоких значений (до 100 мг/л), что может приводить к ингибированию активности микроорганизмов (Okibe, Johnson, 2004). Экзометаболиты автотрофных микроорганизмов могут использоваться миксо- и гетеротрофами в качестве источника углерода. Например, было показано, что археи F. acidiphilum способны расти в культуральной жидкости автотрофной сероокисляющей бактерии A. сaldus после удаления из культуры клеток (Nancucheo, Johnson, 2010). Таким образом, различия в углеродном метаболизме между различными ацидофилами приводят к тому, что в микробных сообществах между автотрофами с одной стороны, и гетеротрофами и миксотрофами с другой, возникают трофические связи. Потребление растворенных органических соединений миксо- и гетеротрофами обусловливает уменьшение их ингибирующего действия на автотрофов и стимулирует их рост. По этой причине, вероятно, наблюдается ускорение окисления сульфидных минералов, когда в смешанной культуре присутствуют гетеротрофы (Hallmann et al., 1992; Okibe, Johnson, 2004).
При температуре 40–45°C, при которой осуществляются промышленные процессы реакторного биоокисления, взаимодействия между авто-, миксо- и гетеротрофами могут быть особенно важными, так как многие из умеренно-термофильных ацидофильных микроорганизмов, доминирующих при этих температурах, являются миксо- и гетеротрофами, нуждающимися в органических источниках углерода (Кондратьева и соавт., 2015; Mahmoud, et al., 2017). Важно отметить, что при температурах 40–45°С в составе ацидофильных сообществ присутствуют облигатно автотрофные микроорганизмы, такие как A. caldus и L. ferriphilum (табл. 1), которые обеспечивают миксо- и гетеротрофные микроорганизмы (бактерии р. Sulfobacillus и археи семейства Ferroplasmaceae) органическими источниками углерода.
Целью данной работы было исследовать окисление пирита, наиболее распространенного сульфидного минерала, представителями доминирующих в биогидрометаллургических процессах групп микроорганизмов (бактерий р. Sulfobacillus, A. caldus и архей р. Acidiplasma), оценить потенциальное значение разных групп микроорганизмов, а также определить роль межвидовых взаимодействий в популяции в процессе окисления пирита.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования являлись штаммы Acidithiobacillus caldus MBC-1, Sulfobacillus thermosulfidooxidans ВКМВ1269T и Acidiplasma sp. MBA-1, выделенные ранее из образцов руд и пульпы реакторов биоокисления (Головачева, Каравайко, 1978; Muravyov, Bulaev, 2014). Свойства штаммов представлены в табл. 2.
Таблица 2.
Физиологические свойства штаммов, использованных при проведении экспериментов
| Штамм | Донор электронов | Углеродное питание | Температура, °С (оптимум/верхний предел) |
|---|---|---|---|
| Acidithiobacillus caldus MBC-1 | S0 | Автотроф | 45/53 |
| Sulfobacillus thermosulfidooxidans ВКМВ 1269T | Fe2+, S0 | Миксотроф | 45–48/60 |
| Acidiplasma sp. MBA-1 | Fe2+, S0 | Гетеротроф | 50‒55/63 |
В работе использован сульфидный минерал пирит (FeS2), измельченный до крупности не более 75 мкм.
Для проведения экспериментов использовали жидкую питательную среду, содержащую минеральные соли (г/л): (NH4)2SO4 – 3.0, KCl – 0.2, MgSO4 ⋅ 7H2O – 0.5, K2HPO4 – 0.5; дистиллированная вода – 1.0 л. Начальный pH 1.5 устанавливали, добавляя в среду 1.5 мл/л концентрированной серной кислоты. В некоторых вариантах эксперимента в среду добавляли 0.02% (м./об.) дрожжевого экстракта (ДЭ).
Микроорганизмы культивировали в колбах объемом 250 мл со 100 мл питательной среды и 2 г пирита на ротационной качалке (200 об./мин) в течение 30 сут. Эксперименты проводили при температуре 45°C, при которой могут расти все исследуемые штаммы.
В экспериментах использовали следующие сочетания штаммов микроорганизмов: (1) чистая культура S. thermosulfidooxidans ВКМВ 1269T; (2) чистая культура Aсidiplasma sp. MBA-1, (3) чистая культура A. caldus MBC-1, (4) смешанная культура S. thermosulfidooxidans ВКМВ 1269T и A. caldus MBC-1; (5) смешанная культура Aсidiplasma sp. MBA-1 и A. caldus MBC-1.
Микроорганизмы во всех экспериментах инокулировали таким образом, чтобы начальная численность клеток каждого штамма составляла примерно 1 × 107 кл/мл.
Для анализа активности процесса биовыщелачивания отбирали пробы жидкой фазы культуры каждые 5 сут в течение 30 сут эксперимента. В отобранных пробах измеряли pH и окислительно-восстановительный потенциал (Eh) с по-мощью pH метра pH-150МИ (“Измерительная техника”, Россия), содержание двух- и трехвалентного железа. Содержание ионов железа определяли с помощью спектрофотометрического анализа с роданидом калия (Резников и соавт., 1970). Степень выщелачивания пирита оценивали по концентрации ионов железа в среде, рассчитывая долю железа, содержавшегося в пирите, которая перешла в жидкую фазу в процессе биовыщелачивания.
РЕЗУЛЬТАТЫ
В первой серии экспериментов изучали биовыщелачивание пирита чистыми и смешанным культурами микроорганизмов в среде, содержащей 0.02% ДЭ. Результаты, полученные в экспериментах по биоокислению пирита, суммированы на рис. 1 и 2.
Рис. 1.
Изменения параметров среды в процессе биовыщелачивания пирита: а – pH среды; б – Eh среды; в – концентрации ионов Fe3+ (г/л); г –концентрации ионов Fe3+ (г/л); д – суммарной концентрации ионов железа (г/л). Обозначения: 1 – стерильный контроль; 2 – чистая культура S. thermosulfidooxidans ВКМВ 1269T; 3 – чистая культура Aсidiplasma sp. MBA-1, 4 – чистая культура A. caldus MBC-1, 5 – смешанная культура S. thermosulfidooxidans ВКМВ 1269T + A. caldus MBC-1; 6 – смешанная культура Aсidiplasma sp. MBA-1 + A. caldus MBC-1.
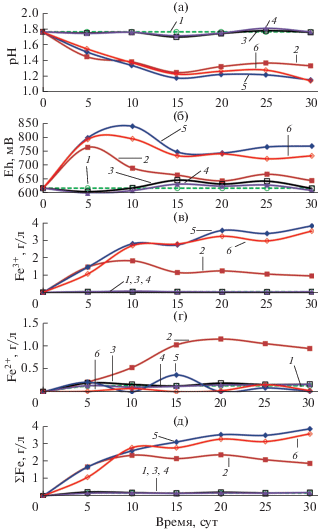
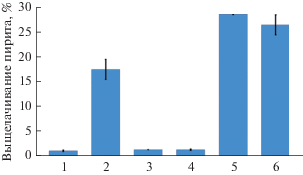
Рис. 2.
Степень выщелачивания пирита микроорганизмами (%): 1 – стерильный контроль; 2 – чистая культура S. thermosulfidooxidans ВКМВ 1269T; 3 – чистая культура Aсidiplasma sp. MBA-1, 4 – чистая культура A. caldus MBC-1, 5 – смешанная культура S. thermosulfidooxidans ВКМВ 1269T + A. caldus MBC-1; 6 – смешанная культура Aсidiplasma sp. MBA-1 + A. caldus MBC-1.
На рис. 1 представлены графики изменений параметров жидкой фазы, отражающие процессы биоокисления пирита чистыми культурами микроорганизмов, а также смешанными культурами S. thermosulfidooxidans ВКМВ1269T + A. caldus MBC-1 и Aсidiplasma sp. MBA-1 + A. caldus MBC-1.
Суммарная концентрация ионов железа Fe3+ и Fe2+ была наибольшей в вариантах биоокисления пирита смешанными культурами S. thermosulfidooxidans ВКМВ1269T + A. caldus MBC-1 и Aсidiplasma sp. MBA-1 + A. caldus MBC-1, достигая в этих вариантах к концу опыта величин 3.8 и 3.5 г/л соответственно (рис. 1д, кривые 5 и 6). Следует отметить, что в этих вариантах концентрация двухвалентного железа в растворе была низкой, и практически все железо было представлено ионами Fe3+ (рис. 1в и 1г, кривые 5 и 6), что подтверждалось относительно высокими значениями Eh среды (свыше 700 мВ к концу опыта) (рис. 1б, кривые 5 и 6). Этот показатель варьировал в процессе окисления пирита, вероятно, из-за колебаний концентрации ионов Fe2+. Значения pH среды в экспериментах со смешанными культурами S. thermosulfidooxidans ВКМВ1269T + A. caldus MBC-1 и Aсidiplasma sp. MBA-1 + A. caldus MBC-1 снижались быстрее, чем в других вариантах, и к концу эксперимента составили 1.15‒1.2 (рис. 1а, кривые 5 и 6).
Концентрация ионов железа в контрольном варианте (без инокуляции микроорганизмами), а также в экспериментах с чистыми культурами Aсidiplasma sp. MBA-1 и A. caldus MBC-1 оставалась низкой (рис. 1д, кривые 1, 3 и 4 соответственно). Eh в этих вариантах оставался невысоким (не более 650 мВ) (рис. 1б, кривые 1, 3 и 4 соответственно), значения рН практически не изменялись (рис. 1а, кривые 1, 3 и 4 соответственно). Это свидетельствует о том, что в данных вариантах пирит практически не окислялся.
Таким образом, анализ параметров жидкой фазы показывает, что в вариантах окисления пирита смешанными культурами процесс выщелачивания происходил более интенсивно, чем при его окислении чистыми культурами.
Необходимо отметить, что в варианте с чистой культурой S. thermosulfidooxidans ВКМВ1269T до 10-х сут эксперимета накопление ионов железа происходило почти так же быстро, как и в экспериментах со смешанными культурами S. thermosulfidooxidans ВКМВ1269T + A. caldus MBC-1 и Aсidiplasma sp. MBA-1 + A. caldus MBC-1 (рис. 1д, кривые 2, 5 и 6 соответственно). При этом после 10 сут биоокисления концентрация трехвалентного железа, достигнув максимума (1.8 г/л), начала снижаться, а двухвалентного железа – расти (рис. 1в и 1г, кривая 2), что привело и к снижению значений Eh (рис. 1б, кривая 2). Вероятно, после 10 сут бактерии перестали активно окислять железо, однако окисление пирита продолжилось вследствие взаимодействия минерала с ионами трехвалентного железа, накопленными в среде.
Окисление пирита микроорганизмами различных групп отличалось не только скоростью процесса, но и степенью выщелачивания пирита, рассчитанной по максимальной концентрации ионов железа в жидкой фазе. Из данных, представленных на рис. 2, видно, что степень выщелачивания в экспериментах со смешанными культурами S. thermosulfidooxidans ВКМВ1269T + A. caldus MBC-1 и Aсidiplasma sp. MBA-1 + A. caldus MBC-1 была максимальной и достигла 28 и 26% соответственно (рис. 2, столбцы 5 и 6). В экспериментах с чистой культурой S. thermosulfidooxidans ВКМВ1269T она составила 17% (рис. 2, столбец 2), а в контрольном варианте и при использовании с чистых культур A. caldus MBC-1 и Aсidiplasma sp. MBA-1 – не превышала 1.5% (рис. 2, столбцы 1, 3 и 4 соответственно).
Выявленные различия в скорости окисления пирита могут объясняться различиями физиологических свойств микроорганизмов. Так, A. caldus, окисляющий только серу (табл. 2), не способен окислять пирит в чистой культуре, так как окисление пирита требует генерации окислителя – ионов Fe3+. Вместе с тем, этот микроорганизм играет определенную роль в окислении пирита, так как в его присутствии и S. thermosulfidooxidans, и Aсidiplasma sp. MBA-1 окисляли пирит значительно интенсивнее, чем в чистых культурах (рис. 2). Это может быть обусловлено двумя факторами. Во-первых, A. caldus активно окисляет серу и способен удалять с поверхности пирита осадки элементарной серы, которая образуется в процессе окисления и блокирует доступ окислителя Fe3+ к поверхности минерала. Во-вторых, A. caldus является автотрофом и его метаболиты могут использоваться S. thermosulfidooxidans и Aсidiplasma sp. в качестве источников углерода, что, в свою очередь, увеличивает их активность.
Эти объяснения подтверждаются спадом окислительной активности чистой культуры S. thermosulfidooxidans ВКМВ1269T после 10-х сут окисления, который, по-видимому, связан с исчерпанием органического источника углерода в среде. Необходимо отметить, что, несмотря на указанное снижение активности, данный микроорганизм окислял пирит намного быстрее, чем другие чистые культуры. Проведенный анализ позволяет заключить, что бактерии S. thermosulfidooxidans могут вносить наиболее существенный вклад в окисление пирита в процессе его биовыщелачивания смешанными культурами микроорганизмов.
Для подтверждения предположения о роли штаммов S. thermosulfidooxidans и A. caldus в окислении пирита, была проведена вторая серия экспериментов по его биоокислению в условиях изменяющегося количества органического вещества. Эта серия экспериментов была спланирована таким образом, чтобы можно было проверить предположения как о том, что S. thermosulfidooxidans ВКМВ 1269Т играет ключевую роль в окислении минерала, так и том, что активность данного микроорганизма зависит от поступления органических веществ, в частности, экзометаболитов A. caldus.
Биоокисление пирита проводили в следующих условиях:
(1) чистой культурой S. thermosulfidooxidans ВКМВ 1269Т в автотрофных условиях (среда без добавления ДЭ);
(2) смешанной культурой S. thermosulfidooxidans ВКМВ 1269Т и A. caldus MBC-1 в автотрофных условиях (среда без добавления ДЭ);
(3) чистой культурой S. thermosulfidooxidans ВКМВ 1269Т в миксотрофных условиях (среда с 0.02% ДЭ);
(4) смешанной культурой S. thermosulfidooxidans ВКМВ 1269Т и A. caldus MBC-1 в миксотрофных условиях (среда с 0.02% ДЭ);
(5) чистой культурой S. thermosulfidooxidans ВКМВ 1269Т в миксотрофных условиях на среде с повышенным содержанием органического вещества (среда с 0.08% ДЭ);
(6) чистой культурой S. thermosulfidooxidans ВКМВ 1269Т в миксотрофных условиях с дробным внесением ДЭ (среда изначально содержала 0.02% ДЭ; на 10 и 20-е сут эксперимента дополнительно вносили 0.02% ДЭ).
Результаты второй серии экспериментов представлены на рис. 3 и 4. Как следует из представленных графиков, отражающих изменения параметров жидкой фазы в процессе биоокисления пирита (рис. 3) в различных условиях экспериментов накопление ионов железа в среде проходило с разной скоростью.
Рис. 3.
Изменения параметров среды в процессе биовыщелачивания пирита: а – pH среды; б – Eh среды; в – концентрации ионов Fe3+ (г/л); г – концентрации ионов Fe3+ (г/л); д – суммарной концентрации ионов железа (г/л). Обозначения: 1 – стерильный контроль; 2 – S. thermosulfidooxidans ВКМВ 1269Т, среда без добавления ДЭ; 3 – S. thermosulfidooxidans ВКМВ 1269Т + + A. caldus MBC-1, среда без добавления ДЭ; 4 – S. thermosulfidooxidans ВКМВ 1269Т, среда с 0.02% ДЭ; 5 – S. thermosulfidooxidans ВКМВ 1269Т + A. caldus MBC-1, среда с 0.02% ДЭ; 6 – S. thermosulfidooxidans ВКМВ 1269Т, среда с 0.08% ДЭ; 7 – S. thermosulfidooxidans ВКМВ 1269Т, с дробным внесением 0.02% ДЭ на 0, 10 и 20-е сутки эксперимента.
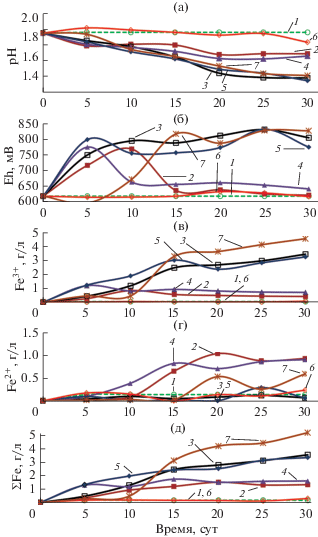
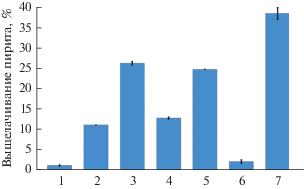
Рис. 4.
Степень выщелачивания окисления пирита микроорганизмами (%): 1 – стерильный контроль; 2 – S. thermosulfidooxidans ВКМВ 1269Т, среда без добавления ДЭ; 3 – S. thermosulfidooxidans ВКМВ 1269Т + + A. caldus MBC-1, среда без добавления ДЭ; 4 – S. thermosulfidooxidans ВКМВ 1269Т, среда с 0.02% ДЭ; 5 – S. thermosulfidooxidans ВКМВ 1269Т + A. caldus MBC-1, среда с 0.02% ДЭ; 6 – S. thermosulfidooxidans ВКМВ 1269Т, среда с 0.08% ДЭ; 7 – S. thermosulfidooxidans ВКМВ 1269Т, с дробным внесением ДЭ по 0.02% (м./об.) на 0, 10 и 20-е сутки эксперимента.
Наиболее активно пирит окислялся в экспериментах с чистой культурой S. thermosulfidooxidans ВКМВ 1269Т и дробным внесением дрожжевого экстракта (ДЭ). В данном варианте эксперимента (рис. 3, кривая 7) окислительная активность микроорганизма оставалась стабильно высокой на протяжении всего эксперимента. Концентрация ионов железа постепенно возрастала на протяжении эксперимента и на 30 сут достигла 5.1 г/л. При этом большая часть железа в среде была представлена ионами Fe3+, концентрация которых была на порядок выше, чем концентрация Fe2+ (рис. 3в, 3г и 3д, кривая 7).
В эксперименте с чистой культурой S. thermosulfidooxidans ВКМВ 1269Т и однократным внесением 0.02% ДЭ в среду (рис. 3, кривая 4) процесс окисления происходил аналогично соответствующему варианту первой серии экспериментов. Концентрация трехвалентного железа достигала максимума на 5 сут процесса (1.18 г/л), а затем постепенно снижалась и на 30 сут составила 0.7 г/л (рис. 3в, кривая 4). Также после 15 сут прекратила расти суммарная концентрация железа, максимальное значение которой составило 1.7 г/л (рис. 3д, кривая 4).
При этом в эксперименте с чистой культурой S. thermosulfidooxidans ВКМВ 1269Т без внесения ДЭ интенсивность окисления пирита была несколько ниже, чем в варианте с внесением ДЭ. Концентрация ионов Fe3+ в среде достигала максимума на 10 сут (0.9 г/л), затем снижалась и концу эксперимента составила 0.4 г/л (рис. 3в, кривая 2). Суммарная концентрация ионов железа достигла максимума на 20 сут – 1.5 г/л (рис. 3д, кривая 2).
Окислительная активность штамма S. thermosulfidooxidans ВКМВ 1269Т была наименьшей в эксперименте с внесением в среду повышенного количества ДЭ (0.08%), вероятно, из-за того, что слишком высокая концентрация органических веществ могла ингибировать активность штамма (рис. 3а–3д, кривая 6).
Необходимо отметить, что в экспериментах со смешанной культурой S. thermosulfidooxidans ВКМВ 1269Т + A. caldus MBC-1 и внесением ДЭ в среду, а также без внесения ДЭ скорости окисления пирита достаточно мало различались. Это может объяснить тем, что A. caldus в процессе роста за счет автотрофной фиксации углерода способен выделять достаточное количество экзометаболитов, чтобы поддерживать активность миксотрофного штамма S. thermosulfidooxidans ВКМВ 1269Т. В этих экспериментах суммарная концентрация ионов железа в среде постепенно возрастала на протяжении 30 сут и составила на момент окончания эксперимента для вариантов без внесения ДЭ и с внесением ДЭ в среду 3.3 и 3.5 г/л соответственно (рис. 3д, кривые 3 и 5).
В экспериментах с чистой культурой S. thermosulfidooxidans ВКМВ 1269Т при дробном внесении ДЭ в среду концентрация железа была наиболее высокой и возрастала на протяжении всего эксперимента, достигнув на 30 сут 5.1 г/л (рис. 3д, кривая 7). Необходимо отметить, что в данном варианте не наблюдалось снижения активности биоокисления, как в экспериментах с чистой культурой S. thermosulfidooxidans ВКМВ 1269Т и однократным внесением 0.02% ДЭ в среду (рис. 3а, кривая 4).
На рис. 4, где суммированы данные о степени выщелачивания пирита в разных экспериментах, видно, что (1) существенные различия были обнаружены между биовыщелачиванием пирита чистой культурой S. thermosulfidooxidans ВКМВ 1269Т и смешанной культурой S. thermosulfidooxidans ВКМВ 1269Т + A. caldus MBC-1; (2) в экспериментах со смешанными культурами без и с добавлением 0.02% ДЭ существенных различий по степени выщелачивания не было, также как и (3) между экспериментами с чистой культурой S. thermosulfidooxidans ВКМВ 1269Т без и с добавлением ДЭ; (4) наиболее высокой степень выщелачивания пирита была в эксперименте с чистой культурой S. thermosulfidooxidans ВКМВ 1269Т и дробным внесением ДЭ в среду.
Таким образом, вторая серия экспериментов по биоокислению пирита в лабораторных условиях позволила подтвердить заключения, сделанные по результатам первой серии:
(1) активность штамма S. thermosulfidooxidans ВКМВ 1269Т вносила наибольший вклад в биоокисление пирита;
(2) его активность в наибольшей степени зависела от доступности органических источников углерода;
(3) при этом роль автотрофного сероокислителя A. caldus MBC-1 сводилась, очевидно, к снабжению миксотрофного штамма сульфобациллы углеродом.
ОБСУЖДЕНИЕ
Несмотря на то, что состав микробных сообществ, осуществляющих процессы биовыщелачивания сульфидных концентратов в различных условиях, активно изучается (табл. 1), на настоящий момент нельзя утверждать, что вклад отдельных групп микроорганизмов, доминирующих в таких сообществах, в окисление разных сульфидных минералов является хорошо изученным и понятым. Проведенные исследования показали, что микроорганизмы ‒ представители групп, доминирующих в промышленных процессах биоокисления, окисляли пирит с различной скоростью. Эти различия обусловлены особенностями физиологических свойств микроорганизмов разных групп и взаимодействиями микроорганизмами в смешанных культурах. Таким образом, микроорганизмы разных групп вносят различный вклад в окисление пирита в процессах биоокисления.
Наиболее активен штамм S. thermosulfidooxidans ВКМВ 1269T, который окисляет двухвалентное железо, что наиболее важно при окислении пирита по тиосульфатному механизму (Sand et al., 2001), в котором окисляющим пирит агентом является ион Fe3+. Поэтому осуществляется этот процесс, главным образом, микроорганизмами, способными окислять Fe2+. Штамм автотрофной сероокисляющей бактерии A. caldus практически не был способен окислять пирит. Однако оказалось, что данная бактерия играет значительную роль в процессе окисления пирита, так как в смешанной культуре с A. caldus все исследованные железоокисляющие микроорганизмы намного активнее окисляли пирит, чем в чистых культурах. Роль A. caldus, очевидно, сводится к снабжению миксо- и гетеротрофных микроорганизмов органическим источником углерода, что было показано во второй серии экспериментов со смешанной культурой S. thermosulfidooxidans + A. caldus.
Необходимо отметить, что в процессе биоокисления пирита железоокисляющими микроорганизмами образуется целый ряд соединений серы (политионаты, сера), которые могут служить субстратом для развития сероокисляющих микроорганизмов (Schippers et al., 1996). Из этого следует, что в смешанных культурах сероокисляющие микроорганизмы не только делают возможным активное окисление пирита железоокислителями, но и сами зависят от окислительной активности последних, так как самостоятельно не способны окислять пирит с образованием соединений серы, являющихся для них питательным субстратом.
В ходе экспериментов было показано, что интенсивность окисления пирита чистой культурой S. thermosulfidooxidans ВКМВ 1269T зависит от доступности органического источника углерода в среде. Это открывает возможность регулировать активность биоокисления сульфидных концентратов в технологических процессах за счет снабжения микробных сообществ доступным источником углерода. Так, в работе (Muravyov, Bulaev, 2013) было показано, что внесение в среду дрожжевого экстракта позволило увеличить скорость биоокисления сульфидного концентрата в реакторе биоокисления при 45°C. Необходимо отметить, что активность бактерий Leptospirillum ferriphilum и A. caldus, которые являются доминирующими автотрофными микроорганизмами в реакторах биоокисления сульфидных концентратов, подавляется при температурах выше 45 и 50°С соответственно. При этом бактерии р. Sulfobacillus и археи семейства Ferroplasmaceae могут быть активны при более высоких температурах (55–60°C), чем те, которые в настоящее время используются в практике промышленных предприятий (40–45°C). Поэтому, при условии доступности в среде органического источника углерода, они потенциально способны осуществлять технологические процессы при более высоких температурах. Проведение процессов биоокисления сульфидных минералов при более высоких температурах в условиях доступности органического вещества может позволить как повысить эффективность биоокисления наиболее упорных минералов (пирит, халькопирит), так и снизить затраты на охлаждение реакторов биоокисления сульфидных минералов.
Таким образом, полученные новые данные, касающиеся особенностей взаимодействия разных групп микроорганизмов с сульфидными минералами минерального сырья и роли отдельных групп микроорганизмов в процессе биовыщелачивания пирита, могут позволить разработать подходы для оптимизации существующих технологий переработки. При этом эффективность предполагаемых путей оптимизации должна быть подтверждена в ходе проведения лабораторных испытаний в условиях, близких к тем, которые существуют в промышленных реакторах биоокисления.
Список литературы
Головачева Р.С., Каравайко Г.И. Sulfobacillus – новый род термофильных спорообразующих бактерий // Микробиология. 1978. Т. 47. С. 815–822.
Golovacheva R.S., Karavaiko G.I. A new genus of thermophilic spore-forming bacteria, Sulfobacillus // Microbiology (Moscow). 1978. T. 47. P. 815–822.
Кондратьева Т.Ф., Булаев А.Г., Муравьев М.И. Микроорганизмы в биогеотехнологиях переработки сульфидных руд. М.: Наука, 2015. 212 с.
Kondrat’eva T.F., Bulaev A.G., Muravyov M.I. Microorganisms in biotechnologies of sulfide ores processing. Moscow: Nauka, 2015. 212 p.
Резников А.А., Муликовская Е.П., Соколов И.Ю. Методы анализа природных вод. М.: Недра, 1970. 140 с.
Reznikov A.A., Mulikovskaya E.P., Sokolov I.Yu. Metody analiza prirodnykh vod (Methods for Analysis of Natural Waters), Moscow: Nedra, 1970. 140 p.
Borichewski R.M. Keto acids as growth-limiting factors in autotrophic growth of Thiobacillus thiooxidans // J. Bacteriol. 1967. V. 93. P. 597–599.
Bulaev A., Belyi A., Panyushkina A., Solopova N., Pivovarova T. Microbial population of industrial biooxidation reactors // Solid State Phenomena. 2017. V. 262. P. 48‒52.
Coram N.J., Rawlings D.E. Molecular relationship between two groups of the genus Leptospirillum and the finding that Leptospirillum ferriphilum sp. nov. dominates South African commercial biooxidation tanks that operate at 40°C // Appl. Environ. Microbiol. 2002. V. 68. P. 838–845.
Dopson M., Lindstrom E.B. Analysis of community composition during moderately thermophilic bioleaching of pyrite, arsenical pyrite, and chalcopyrite // Microb. Ecol. 2004. V. 48. P. 19–28.
Hallmann R., Friedrich A., Koops H.P., Pommereningroser A., Rohde K., Zenneck C., Sand W. Physiological-characteristics of Thiobacillus ferrooxidans and Leptospirillum ferrooxidans and physicochemical factors influence microbial metal leaching // Geomicrobiol. J. 1992. V. 10. P. 193–206.
Johnson D.B. Biomining ‒ biotechnologies for extracting and recovering metals from ores and waste materials // Curr. Opin. Biotechnol. 2014. V. 30. P. 24–31.
Mahmoud A., Cezac P., Hoadley A.F.A., Contaminea F., d’Hugues P. A review of sulfide minerals microbially assisted leaching in stirredtank reactors // Int. Biodeterior. Biodegr. 2017. V. 119. P. 118–146.
Morin D.H.R., d’Hugues P. Bioleaching of a cobalt containing pyrite in stirred reactors: a case study from laboratory scale to industrial application // Biomining / Eds. Raw-lings D.E., Johnson B.D. Berlin: Springer, 2007. P. 35–55.
Muravyov M.I., Bulaev A.G. Two-step oxidation of a refractory gold-bearing sulfidic concentrate and the effect of organic nutrients on its biooxidation // Minerals Engineering. 2013. V. 45. P. 108–114. https://doi.org/10.1016/j.mineng.2013.02.007
Mutch L.A., Watling H.R., Watkin E.L.J. Microbial population dynamics of inoculated low-grade chalcopyrite bioleaching columns // Hydrometallurgy. 2010. V. 104. P. 391–398.
Nancucheo I., Johnson D.B. Production of glycolic acid by chemolithotrophic iron- and sulfur-oxidizing bacteria and its role in delineating and sustaining acidophilic sulfide mineral-oxidizing consortia // Appl. Environ. Microbiol. 2010. V. 76. P. 461–467.
Okibe N., Gericke M., Hallberg K.B., Johnson D.B. Enumeration and characterization of acidophilic microorganisms isolated from a pilot plant stirred tank bioleaching operation // Appl. Environ. Microbiol. 2003. V. 69. P. 1936–1943.
Okibe N., Johnson D.B. Biooxidation of pyrite by defined mixed cultures of moderately thermophilic acidophiles in pH-controlled bioreactors: significance of microbial interactions // Biotechnol. Bioeng. 2004. V. 87. P. 574–583.
Sand W., Gehrke T., Jozsa P.-G., Schippers A. (Bio)chemistry of bacterial leaching ‒ direct vs. indirect bioleaching // Hydrometallurgy. 2001. V. 59. P. 159–175.
Schnaitman C., Lundgren D.G. Organic compounds in the spent medium of Ferrobacillus ferrooxidans // Can. J. Microbiol. 1965. V. 11. P. 23–27.
Schippers A., Jozsa P.-G., Sand W. Sulfur chemistry in bacterial leaching of pyrite // Appl. Environ. Microbiol. 1996. V. 62. P. 3424–3431.
Silverman M.P., Lungren D.C. Study on the chemoautotrophic iron bacterium Ferrobacillus ferrooxidans. An improved medium and harvesting procedure for securing high cell yield // J. Bacteriol. 1959. V. 77. P. 642–647.
van Aswegen P.C., van Niekerk J., Olivier W. The BIOX process for the treatment of refractory gold concentrate // Biomining / Eds. Rawlings D.E., Johnson B.D. Berlin: Springer, 2007. P. 1–35.
van Hille R.P., van Wyk N., Froneman T., Harrison S.T.L. Dynamic evolution of the microbial community in BIOX leaching tanks // Adv. Mater. Res. 2013. V. 825. P. 331–334.
Дополнительные материалы отсутствуют.


