Микробиология, 2020, T. 89, № 6, стр. 700-713
Исследование формирования и развития анаммокс-биопленок методами световой, эпифлуоресцентной и электронной микроскопии
А. Ю. Каллистова a, *, Ю. А. Николаев a, А. В. Марданов b, Ю. Ю. Берестовская a, В. А. Грачев a, Н. А. Кострикина a, А. В. Пелевина a, Н. В. Равин b, Н. В. Пименов a
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Институт биоинженерии, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: kallistoanna@mail.ru
Поступила в редакцию 15.06.2020
После доработки 06.07.2020
Принята к публикации 07.07.2020
Аннотация
С помощью световой, эпифлуоресцентной и электронной микроскопии исследованы этапы формирования и развития биопленок активного ила, осуществляющего процесс анаммокс, в лабораторном реакторе последовательно-периодического действия (sequencing batch reactor, SBR) с полным удержанием биомассы на загрузке. С помощью световой микроскопии показано, что биопленка формируется на носителе в течение недели. При этом важную роль в колонизации носителя играют палочковидные и нитчатые формы микроорганизмов, которые первыми закрепляются на носителе и служат каркасом для формирования биопленки. С помощью эпифлуоресцентной микроскопии в биопленках выявлены физиологически активные анаммокс-бактерии родов Candidatus “Brocadia” и Ca. “Jettenia”. Обнаружена избирательная автофлуоресценция колоний анаммокс-бактерий рода Ca. “Jettenia”. Возможно, что автофлуоресценцию вызывают специфические белки в составе экзополимерных соединений (ЭПС), и их синтез и/или количество зависят от возраста колонии и физиологического статуса клеток. С помощью электронной микроскопии исследована структурная организация колоний анаммокс-бактерий. С помощью метода высокопроизводительного секвенирования фрагментов гена 16S рРНК установлено присутствие в биопленках последовательностей, относящихся к представителям филумов Chloroflexi, Bacteroidetes, Planctomycetes и Proteobacteria. Помимо анаммокс-бактерий, выявлены анаэробные и факультативно анаэробные органотрофы, нитрификаторы I стадии, денитрификаторы и сульфатредукторы. Среди анаммокс-бактерий доминировали представители рода Ca. “Brocadia”, что может быть связано с лучшей адгезией их клеток на носителе, а также с их конкурентным преимуществом по сравнению с представителями рода Ca. “Jettenia” при добавлении в среду органических кислот (ацетата и формиата).
Анаммокс-бактерии, планктомицеты порядка Ca. “Brocadiales”, играют важную роль в глобальном круговороте азота в природе и используются в биотехнологии для очистки сточных вод от аммония. Эти бактерии осуществляют анаэробное окисление аммония нитритом до газообразного азота, сопряженное с образованием небольших количеств нитрата (Strous et al., 1998). Анаммокс-бактерии также способны анаэробно окислять такие летучие жирные кислоты (ЛЖК), как формиат, ацетат и пропионат, в процессе диссимиляционной нитратредукции. При этом анаммокс-бактерии образуют нитрит и аммоний из нитрата и далее используют их в качестве источника энергии в классическом хемолитоавтотрофном анаммокс-процессе. Было предположено, что ацетат напрямую в биомассу не включается, а сначала окисляется до CO2, затем СО2 ассимилируется по ацетил-СоА пути (Kartal et al., 2007, 2008; Kuenen, 2020). Недавно с помощью метагеномного и метатранскриптомного анализов выявлены различные пути ассимиляции ацетата анаммокс-бактериями. При добавлении ацетата в среду в клетках анаммокс-бактерий резко возрастало количество экспрессированных генов, связанных с ацетатным метаболизмом. Анаммокс-бактерии вида Ca. “Brocadia sinica” были в большей степени способны к метаболизму ацетата и ацетил-СоА, чем анаммокс-бактерии вида Ca. “Jettenia caeni”. У представителей вида Ca. “Brocadia sinica” выявлены более универсальные пути трансформации ацетата, что может обеспечивать им конкурентное преимущество над другими анаммокс-бактериями в миксотрофных условиях (Feng et al., 2019а). Органотрофные свойства анаммокс-бактерий могут быть выгодны для биотехнологии, поскольку добавление ЛЖК способствует более глубокому удалению азота и стабилизации процесса (Yin et al., 2019; Li et al., 2020).
Еще одна важная для биотехнологии особенность анаммокс-бактерий состоит в их склонности к агрегации и прикрепленному росту в виде биопленок, что способствует удержанию биомассы этих медленно растущих микроорганизмов в биореакторах. Агрегация анаммокс-бактерий происходит за счет обильного образования ими ЭПС – полисахаридов, глико(протеинов), нуклеиновых кислот и жиров. В составе ЭПС анаммокс-бактерий преобладают белки (Hou et al., 2015; Chen et al., 2019; Peeters, van Niftrik 2019). ЭПС содержит довольно много гидрофобных групп, что способствует флокообразованию и более высокой агрегации анаммокс-бактерий по сравнению с другими микроорганизмами. Зрелые биопленки неоднородны по составу, стратифицированы и содержат газовые карманы (Hou et al., 2015; Chen et al., 2019; Feng et al., 2019b; Peeters, van Niftrik, 2019; Wang et al., 2020а). ЭПС служат субстратом для многочисленных органотрофных микроорганизмов, поэтому анаммокс-биопленка представляет основу для развития комплексных микробных сообществ, обязательными компонентами которых являются сами анаммокс-бактерии, нитрификаторы обеих стадий, денитрификаторы и разнообразные органотрофы (Katal et al., 2010; Gonzalez-Martinez et al., 2014; Lawson et al., 2017). Между всеми микроорганизмами, тесно сосуществующими в анаммокс-биопленках, устанавливаются межвидовые отношения, основанные на пространственном и субстратном синергизме и конкуренции (Ding et al., 2013; Lawson et al., 2017; Zhao et al., 2018; Kuenen, 2020).
Медленный рост, склонность к формированию биопленок, а также отсутствие стандартного способа культивирования препятствуют выделению анаммокс-бактерий в чистые культуры, что, в свою очередь, значительно осложняет изучение их физиологии и биохимии (Peeters, van Niftrik, 2019). К настоящему времени не выделено ни одной чистой культуры анаммокс-бактерий. Метагеномный анализ, однако, позволяет заключить, что для поддержания жизнедеятельности анаммокс-бактерий не требуются особые микроорганизмы, а требуется лишь надлежащая минеральная среда. Вопрос о том, почему анаммокс-бактерии удается культивировать только в проточной системе, из которой удаляется часть отработанной среды, все еще остается открытым (Kuenen, 2020). Высокообогащенные накопительные культуры анаммокс-бактерий удается получить в двух типах проточных биореакторов: ~75% обогащения достигается в реакторах SBR-типа и ~95% – в мембранных реакторах (Peeters, van Niftrik, 2019 и ссылки там же). В современных рециркулирующих реакторах с мембранными модулями, где анаммокс-бактерии растут как отдельные суспендированные клетки, удается получить культуры с содержанием одного вида анаммокс-бактерий до 98% (Kuenen, 2020).
Для исследования клеточной биологии, физиологии, биохимии и филогении анаммокс-бактерий применяют разнообразные методические подходы. Широко используются молекулярные методы (высокопроизводительное секвенирование, метагеномный, метатранскриптомный анализы), которые позволяют получить наиболее полную информацию не только о составе микробного сообщества анаммокс-биопленок, но и построить схемы метаболических взаимоотношений между разными группами микроорганизмов в сообществе (Gonzalez-Gil et al., 2015; Марданов и соавт., 2016; Mardanov et al., 2017; Lawson et al., 2017; Zhao et al., 2018; Feng et al., 2019а и др.). Несмотря на неоспоримое лидерство молекулярных методов в современной микробиологии, такой классический микробиологический подход, как микроскопия, не утратил своей важной роли в исследовании анаммокс-бактерий. Фазово-контрастная световая микроскопия используется для изучения последовательных стадий формирования анаммокс-биопленок (Botchkova et al., 2015). Эпифлуоресцентная микроскопия используется для визуализации и определения доли различных групп микроорганизмов в анаммокс-биопленках, оценки их морфологических характеристик, изучения особенностей пространственной локализации, а также для выявления различных компонентов в составе ЭПС анаммокс-бактерий (Schmid et al., 2005; Kindaichi et al., 2007; Kartal et al., 2008; Ni et al., 2010; Vlaeminck et al., 2010; Almstrand et al., 2014; Lin, Wang, 2017; Böllmann et al., 2019; Boleij et al., 2020 и др.). Фундаментальные открытия в области структурной организации клеток анаммокс-бактерий сделаны с помощью электронной микроскопии (van Niftrik et al., 2008, van Niftrik, Jetten, 2012; van Teeseling et al., 2015; Peeters, van Niftrik, 2019).
Целью работы являлось исследование формирования и развития анаммокс-биопленок в лабораторном реакторе SBR-типа с использованием методов световой, эпифлуоресцентной и электронной микроскопии.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования. Объектом исследования служили микробные биопленки, иммобилизованные на твердом носителе (загрузке) лабораторного SBR-реактора последовательно-периодического действия с полным удержанием биомассы (рис. 1). Реактор объемом 4.5 л состоял из двух цилиндров, изготовленных из полиметилметакрилата. Пространство между внешним и внутренним цилиндром было герметично и использовалось для термостатирования реактора. Для этого во внешние стенки были врезаны штуцеры, позволяющие прогонять в непрерывном режиме воду с заданной температурой. В боковых стенках внутреннего цилиндра было врезано еще четыре штуцера – у дна и у поверхности, для подачи и слива воды и взятия образцов. Реактор оснащен цилиндрической загрузкой из волокнистых полиэтилена и полипропилена (материал типа Поливом, ООО НПФ “ЭТЕК ЛТД”, Россия) с внутренним диаметром 85 мм, высотой 200 мм, массой 82 г и общей площадью поверхности 11.6 дм2. Подачу воздуха в реактор осуществляли снизу с помощью компрессора SCHEGO SW2 (Германия); скорость подачи регулировали по ротаметру. В период без аэрации перемешивание осуществляли при помощи магнитной мешалки IKA C-MAG MS7 (Германия) в режиме 120–150 об. мин–1. Среду подавали в нижнюю часть реактора с помощью перистальтических насосов Masterflex L/S economy drive (США), вытесняя при этом очищенную воду через верхний штуцер. Температурный режим задавали при помощи термостата-бани EL-MI TV 2.03 (Латвия), который снабжен циркуляционным насосом для внешнего контура. Автоматизацию осуществляли с помощью программируемого таймера Siemens LOGO 6ED1 (Германия). Режим эксплуатации реактора включал стадию отстаивания, стадию подачи питательной среды с одновременным сливом очищенной воды и стадию аэрации. Время полного цикла составляло 6 ч, среднее время пребывания среды в реакторе – 27 ч. Реактор работал при температуре 30°С, концентрации кислорода 0.4–0.8 мг л–1, чередовании фаз аэрации и ее отсутствия 20 мин и расходе воздуха 20 л ч–1.
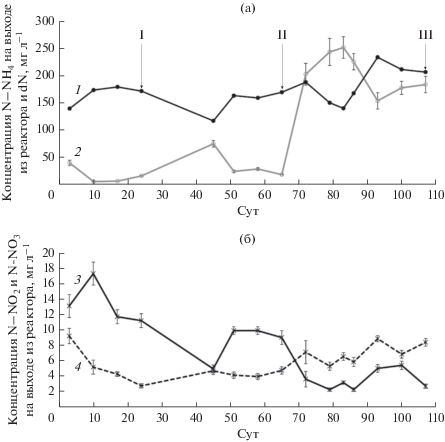
В реактор подавали среду следующего состава (г л–1): (NH4)2SO4 – 0.942; NaCH3COO · 3H2O – 0.04; KH2PO4 – 0.044; NaHCO3 – 2.1; рН 8.3 (Boeije et al., 1999). Готовили концентрированный раствор среды на дистиллированной воде. Концентрат разбавляли водопроводной водой в момент подачи в реактор; NaHCO3 добавляли непосредственно в водопроводную воду перед разбавлением концентрата; нитрит и микроэлементы не вносили. Отношение Cорг/N в среде составляло 0.04. После достижения эффективности удаления азота более 80% нагрузку по азоту увеличили с 200 до 400 мг N−NH4 л–1 и добавили формиат (в виде натриевой соли) в концентрации 75.5 мг л–1 (рис. 2а). Ацетат и формиат вносили с целью стимуляции органотрофного роста анаммокс-бактерий и осуществления ими процесса диссимиляционной нитрат редукции (Kartal et al., 2007; Feng et al., 2019а). Кроме того, формиат оказывает ингибирующее действие на нитрит-окисляющие бактерии (Wang et al., 2020b), что в совокупности должно способствовать стабилизации анаммокс-процесса при повышенной нагрузке по аммонию (Yin et al., 2019; Li et al., 2020; Wang et al., 2020b). Отношение Cорг/N после добавления формиата и увеличения нагрузки по аммонию составляло 0.05. Инокулятом служил содержащий анаммокс-бактерии активный ил (Mardanov et al., 2019). Для запуска реактора добавляли на 3.5 л среды 1 л инокулята с содержанием взвешенных веществ 3.8 г л–1. В очищенной воде еженедельно определяли концентрацию ионов аммония, нитрита и нитрата стандартными методами (Standard Methods for the Examination of Water and Wastewater, 2012). Суточное количество удаленного азота (dN, мг л–1) рассчитывали как разность между концентрацией аммонийного азота (N–NH4) в поступающей среде и суммарной концентрацией минеральных форм азота в очищенной воде (N–NH4, N–NO2, N–NO3). Эффективность удаления азота (%) рассчитывали как долю удаленного азота от концентрации его в поступающей воде.
Рис. 2.
Динамика изменения концентрации азотных соединений на выходе из реактора (мг л–1): а – суточное количество удаленного азота (dN) (1); N–NH4 (2); б – N–NO3 (3); N–NO2 (4). Маркеры на кривых 2–4 соответствуют средним значениям выборки с n = 3; планки погрешностей отображают стандартные отклонения по выборке. Для кривой 1 стандартные отклонения не представлены, т.к. значения dN получены не из выборки, а вычислены из средних значений концентраций азотных соединений. Римскими цифрами обозначены основные этапы эксперимента: I – помещение в рабочую зону реактора стекол обрастания (24 сут с момента запуска реактора); II – увеличение нагрузки по аммонию и добавление формиата (65 сут); III – отбор образцов ила обрастания для проведения электронной микроскопии, FISH и молекулярного анализа (107 сут).
Световая микроскопия. Световую фазово-контрастную микроскопию использовали для изучения последовательных стадий формирования и развития биопленок на стеклах обрастания. Предметные стекла помещали в рабочую зону реактора через 24 сут с момента его запуска (рис. 2а). Последовательно (через 1, 3, 5 и 7 сут инкубации) из реактора извлекали по одному стеклу и микроскопировали. Морфологию клеток изучали с использованием светового микроскопа Olympus CX41 (Япония) с фазово-контрастным устройством.
Эпифлуоресцентная микроскопия. Биопленки анаммокс-бактерий, иммобилизованные на загрузке, исследовали методом флуоресцентной in situ гибридизации (FISH). Образец был взят на 107 сут с момента запуска реактора (рис. 2а). Использовали меченые цианином 3 (Cy3) 16S рРНК олигонуклеотидные зонды: Amx368, специфичный к представителям анаммокс-бактерий родов Ca. “Brocadia”, Ca. “Kuenenia”, Ca. “Scalindua” (Schmid et al., 2003); Broc1, специфичный к представителям анаммокс-бактерий рода Ca. “Brocadia” (Nikolaev et al., 2018); Jett1, специфичный к представителям анаммокс-бактерий рода Ca “Jettenia” (Nikolaev et al., 2018). Процедуру гибридизации проводили по методике, описанной ранее (Каллистова и соавт., 2014; Nikolaev et al., 2018). Клетки, гибридизовавшиеся с зондами, визуализировали с помощью эпифлуоресцентного микроскопа Axio Imager.M2 (“Carl Zeiss Microscopy GmbH”, Германия), оснащенного цифровой камерой 503 mono и светофильтром Zeiss 43 (возбуждение 545/25 нм, эмиссия 605/70 нм). Неспецифическую автофлуоресценцию клеток в зеленом свете выявляли с помощью светофильтра Zeiss 38 (возбуждение 470/40 нм, эмиссия 525/50 нм). Фотографии обрабатывали с использованием программного обеспечения ZEN 2 (“Carl Zeiss Microscopy GmbH”, Германия). Наложение фотографий проводили с помощью программы Photoshop CS6 (“Adobe Inc.”, США).
Электронная микроскопия. Исследовали ультратонкие срезы иммобилизованных на загрузке биопленок, отобранных через 107 сут с момента запуска реактора (рис. 2а). Образцы фиксировали 2.5% глутаральдегидом в 0.1 М какодилатном буфере, промывали этим же буфером, до-фиксировали 1% ОsO4 в 0.1 М какодилатном буфере в течение 16 ч при 4°С, последовательно обезвоживали в серии растворов этанола и в ацетоне. Обезвоженные образцы заливали в эпоксидные смолы (“Sigma”, США). На микротоме LKB 8810A (Швеция) изготавливали ультратонкие срезы, контрастировали их последовательно в растворах уранилацетата и цитрата свинца и просматривали в электронном микроскопе JEM 100C (“JEOL”, Япония).
Молекулярный анализ. Метагеномную ДНК из образцов биопленки выделяли с помощью набора DNeasy PowerSoil Kit (“Qiagen”, Германия) по протоколам производителя. Для амплификации вариабельного участка V3–V4 гена 16S рРНК использовали два набора праймеров: универсальные праймеры, 341F CCTAYGGGDBGCWSCAG и 806R GGACTACNVGGGTHTCTAAT (Frey et al., 2016), и праймеры, специфичные для анаммокс-бактерий филума Planctomycetes, Amx368f TTCGCAATGCCCGAAAGG и Amx820r GGGCACTAAGTAGAGGGGTTTT (Sonthiphand, Neufeld, 2013). Полученные ПЦР фрагменты использовали для приготовления библиотек секвенирования с помощью наборов Nextera XT DNA Library Prep Kit (“Illumina”, США) по протоколам производителя. Мультиплексирование осуществляли с помощью наборов Nextera XT Index Kit v2 (“Illumina”, США). ПЦР фрагменты секвенировали с использованием Illumina MiSeq. Для каждого образца получали не менее 25 тыс. последовательностей фрагментов генов 16S рРНК.
Чтения из всех образцов были объединены вместе, были исключены низкокачественные чтения, синглетоны и химеры. Оставшиеся чтения были кластеризованы в операционные таксономические единицы (ОТЕ) с минимальной идентичностью 97%. Для определения доли ОТЕ в каждом из образцов, на репрезентативные последовательности ОТЕ были наложены исходные чтения (включая низкокачественные и синглетоны) с минимальной идентичностью 97% на всей длине чтения. Для выполнения всех этих процедур использовали пакет программ usearch (Edgar, 2010). Таксономическую идентификацию микроорганизмов по последовательностям генов 16S рРНК проводили с использованием usearch и базы данных Silva. Полученные последовательности депонированы в NCBI под номером SRR12031432.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изменение концентрации минеральных форм азота в процессе работы реактора. Весь активный ил, добавленный в реактор в качестве инокулята, закрепился на загрузке в течение первых 3 нед. с момента запуска реактора (рис. 1). В течение всего последующего периода работы реактора количество взвешенных частиц в среде не превышало 0.2 г л–1. Динамика изменения концентрации азотных соединений в реакторе представлена на рис. 2. Суточное количество удаленного азота в первые 2 мес. работы реактора колебалось в диапазоне 139–179 мг N л–1 (среднее значение 158.4 ± ± 20.9 мг N л–1) (рис. 2а). К 65 сут реактор удалял 170 мг N л–1, что соответствовало эффективности удаления аммония 84%. Нитрит в среду не вносили, однако он присутствовал в очищенной воде, что свидетельствовало о протекании I стадии нитрификации в реакторе. Концентрация нитрита в очищенной воде на протяжении первых 2-х мес. работы реактора стабильно поддерживалась на низком уровне (среднее значение 5 ± 2 мг N–NO2 л–1), что указывало на протекание процесса анаммокс и/или нитрификации II стадии (рис. 2б). При этом концентрация нитрата в очищенной воде также поддерживалась на низком уровне, составляя в среднем 11 ± 3.5 мг N–NO3 л–1, что в совокупности с низким содержанием органического вещества (ацетата) в среде (Cорг/N = 0.04) указывало на удаление азота, в основном, за счет процесса частичной нитрификации-анаммокс, а не нитрификации-денитрификации.
Нагрузка по азоту была увеличена на 65-е сут работы реактора путем повышения концентрации аммония с 200 до 400 мг N–NH4 л–1. Одновременно с этим в среду был добавлен формиат (Cорг/N = 0.05). Суточное количество удаленного азота понизилось в первые 3 нед. после увеличения нагрузки, однако затем работа реактора восстановилась до прежнего уровня. Начиная с 65 сут, среднее суточное количество удаленного азота составляло 185 ± 34.5 мг N л–1, что, однако, соответствовало более низкой общей эффективности процесса по сравнению с периодом до повышения нагрузки (46 vs 80%).
Внесение формиата стимулировало процесс диссимиляционной нитратредукции. Об этом свидетельствовало увеличение содержания нитрита в очищенной воде с 5 до 7 мг N–NO2 л–1 (средние значения) и снижение содержания нитрата с 11 до 3.5 мг N–NO3 л–1. Анаммокс-бактерии, как и денитрификаторы, способны образовывать газообразный азот из нитрата, но, в отличие от денитрификаторов, не восстанавливают нитрат через N2O. Они осуществляют диссимиляционное восстановление нитрата до аммония через нитрит, за которым следует анаэробное окисление аммония нитритом до N2. Окисление ЛЖК, сопряженное с восстановлением нитрата, помогает анаммокс-бактериям выживать в условиях лимита по аммонию и нитриту и снижает их зависимость от микроорганизмов, образующих эти соединения (Kartal et al., 2007). Предполагается, что при определенном соотношении Сорг/N происходит обогащение сообщества ЛЖК-окисляющими анаммокс-бактериями (Yin et al., 2019). Однако данные на этот счет противоречивы. Одни авторы показывают, что внесение ЛЖК стимулирует рост анаммокс-бактерий рода Ca. “Jettenia” по сравнению с Ca. “Kuenenia” и Ca. “Brocadia”, а также, что представители рода Ca. “Jettenia” предпочитают значения Сорг/N равные 0.1 (при внесении ацетата) и 0.22 (при внесении пропионата). Однако другие авторы, наоборот, указывают на более высокие специфические скорости роста представителей рода Ca. “Brocadia” по сравнению с представителями родов Ca. “Jettenia” и Ca. “Kuenenia ” в широком диапазоне значений Сорг/N от 0.05 до 0.8, а также что значение Сорг/N равное 0.1 приводит к накоплению представителей рода Ca. “Brocadia” (Huang et al., 2014; Liang et al., 2015; Shu et al., 2016; Yin et al., 2019). Достаточно быстрая селекция представителей вида Ca. “Brocadia fulgida” происходила из исходно разнообразного анаммокс-сообщества при соотношении Сорг/N ≥ 0.8 (Jenni et al., 2014). Было показано, что представители вида Ca. “Brocadia fulgida” способны вытеснять другие виды анаммокс-бактерий при добавлении ацетата в среду, т.к. более эффективно используют ацетат в качестве донора электронов в процессе диссимиляционной нитратредукции (Kartal et al., 2008). У анаммокс-бактерий вида Ca. “Brocadia sinica” выявлены более универсальные пути метаболизма ацетата, чем у анаммокс-бактерий вида Ca. “Jettenia caeni” (Feng et al., 2019а). Это может способствовать накоплению анаммокс-бактерий рода Ca. “Brocadia” при наличии ЛЖК в среде.
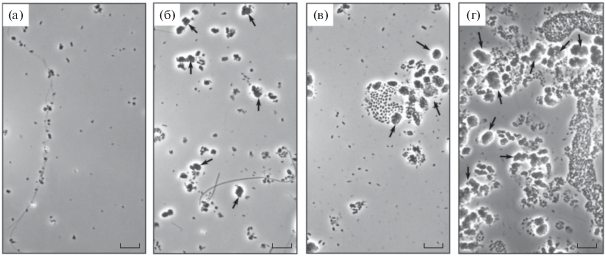
Изучение этапов формирования биопленок с помощью световой микроскопии. Исследование прикрепления и развития микробных биопленок на стеклах обрастания, помещенных в рабочую зону реактора через 24 сут с момента запуска, показало, что отдельные представители палочковидных и нитчатых форм микроорганизмов появлялись на стеклах в первые сутки инкубации (рис. 3а). Типичные для анаммокс-бактерий микроколонии появлялись на 3 сут инкубации после закрепления на носителе других форм микроорганизмов (рис. 3б). Биопленка начинала формироваться на 5 сут инкубации (рис. 3в) и к 7 сут заполняла практически всю доступную поверхность стекла (рис. 3г). Таким образом, микробное сообщество реактора довольно быстро, в течение недели, закреплялось и развивалось на стеклянном носителе. При этом важную роль играли палочковидные и нитчатые формы микроорганизмов, которые первыми колонизировали носитель и служили каркасом для формирования анаммокс-биопленки. Аналогичные результаты были получены ранее Бочковой и соавт. (Botchkova et al., 2015).
Рис. 3.
Колонизация стекол обрастания, помещенных в рабочую зону реактора: а – 1 сут инкубации стекол в реакторе; б – 3 сут; в – 5 сут; г – 7 сут. Фазовый контраст; масштабная метка – 10 мкм. Стрелками обозначены микроколонии, имеющие характерную для анаммокс-бактерий морфологию.
Выявление физиологически активных анаммокс-бактерий с помощью эпифлуоресцентной микроскопии. Положительный сигнал получен при гибридизации образцов ила обрастания со всеми использованными зондами: Amx368 (рис. 4а), Broc1 (рис. 4б) и Jett1 (рис. 4в), т.е. методом FISH выявлены физиологически активные анаммокс-бактерии родов Ca. “Brocadia” и Ca “Jettenia” в иммобилизованных биопленках. Интересные результаты получены при гибридизации образцов с зондом Jett1, специфичным к анаммокс-бактериям рода Ca “Jettenia”. Клетки, гибридизовавшиеся с зондом Jett1, образовывали крупные колонии, легко различимые при просмотре образцов в световой микроскоп с использованием фазового контраста (рис. 5, вертикальный ряд 1). Данные колонии в большом количестве встречались в образце, иногда занимая до 99% от поля зрения микроскопа (рис. 4с, 5). Однако с зондом Jett1 гибридизовались далеко не все колонии данной морфологии (рис. 5). Колонии, которые не давали положительного сигнала с зондом Jett1, имели интенсивную неспецифическую автофлуоресценцию в зеленом свете, и, наоборот, колонии, гибридизовавшиеся с зондом Jett1, собственной автофлуоресценцией не обладали (рис. 5). Клетки в автофлуоресцирующих колониях выглядели целыми (неповрежденными), и автофлуоресценция наблюдалась исключительно по периферии клеток (рис. 6).
Рис. 4.
Микрофотографии ила обрастания: слева – визуализация клеток, гибридизовавшихся с зондами Amx368 (а); Broc1 (б), Jett1(с), с использованием светофильтра Zeiss 43; справа – просмотр тех же полей зрения с использованием фазового контраста. Масштабная метка – 20 мкм.
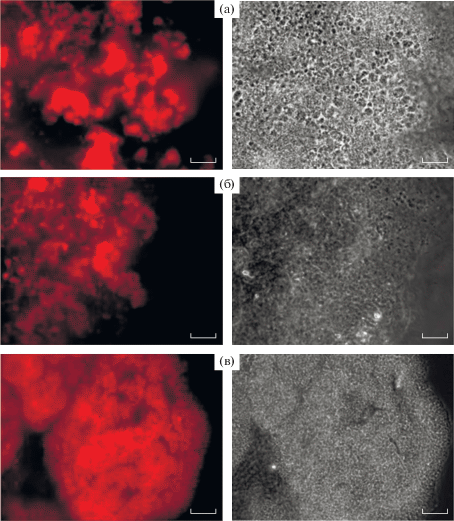
Рис. 5.
Микрофотографии ила обрастания: вертикальный ряд 1 – фазовый контраст; вертикальный ряд 2 – гибридизация с зондом Jett1, специфичным к Ca “Jettenia”; вертикальный ряд 3 – автофлуоресценция; вертикальный ряд 4 – три фотографии, наложенные друг на друга в программе Photoshop CS6. Масштабная метка – 20 мкм.
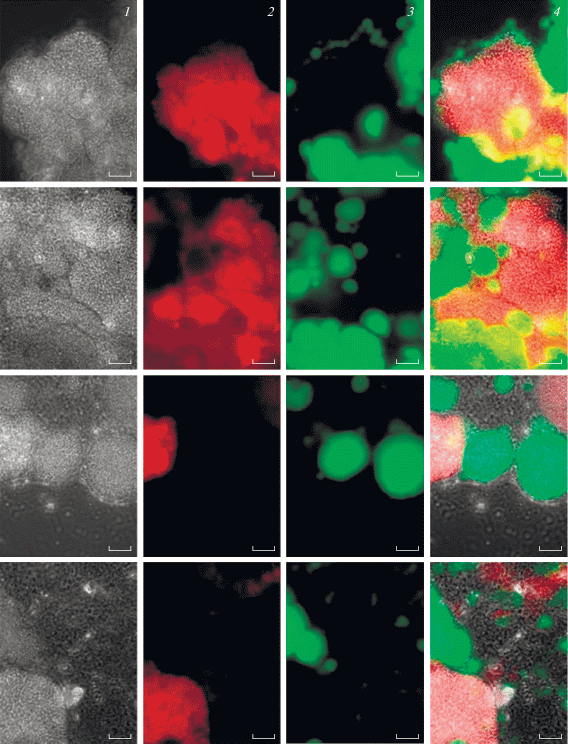
Рис. 6.
Увеличенное изображение автофлуоресцирующей колонии (светофильтр Zeiss 38). Масштабная метка – 20 мкм.
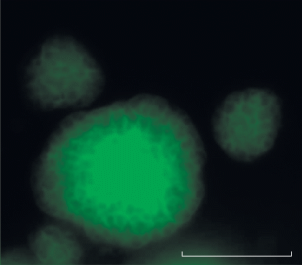
Одна из гипотез, объясняющих автофлуоресценцию колоний, состоит в том, что анаммокс-бактерии выделяют в составе ЭПС специфические флуоресцентные белки. Ранее было обнаружено, что агрегированные клетки анаммокс-бактерий вида Ca. “Brocadia fulgida” автофлуоресцировали в зеленом (возбуждение/эмиссия 490/520 нм) и красном (возбуждение/эмиссия 550/570 нм) свете. При этом автофлуоресценция отсутствовала у единичных (не агрегированных) клеток. Это позволило предположить, что источником автофлуоресценции является ЭПС-матрикс агрегированных биопленок. Экстрагированные из биопленок ЭПС флуоресцировали в диапазоне 390–630 нм с двумя максимумами возбуждения/эмиссии 352/464 и 442/521 нм, что указывало на два разных вещества – источника автофлуоресценции (Kartal et al., 2008). В ЭПС-матриксе анаммокс-бактерий преобладают ассоциированные с мембраной белки, причем наибольшее количество белков в составе ЭПС образуют анаммокс-бактерии рода Ca. “Jettenia”, по сравнению с анаммокс-бактериями родов Ca. “Brocadia”, Ca. “Kuenenia” и Ca. “Scalindua” (Chen et al., 2019). Возможно, что детектированная нами повышенная агрегация клеток анаммокс-бактерий рода Ca. “Jettenia” происходила за счет избыточного синтеза ЭПС в ответ на неблагоприятные условия (наличие органического вещества, повышенная нагрузка по аммонию и/или кислороду). Именно для представителей вида Ca. “Jettenia caeni” показано, что усиление агрегации клеток за счет повышения синтеза ЭПС-матрикса происходит в ответ на неблагоприятные условия. Этот процесс регулируется уровнем внутриклеточного содержания бис-(3'–5')-циклического димерного гуанозинмонофосфата (bis-(3'–5')-cyclic dimeric guanosine monophosphate, c-di-GMP). Увеличение уровня c-di-GMP в клетках Ca. “Jettenia caeni” приводило к увеличению образования предшественников ЭПС-слоя, а также таких известных ЭПС соединений, как альгинат и поли-N-ацетилглюкозамин (Guo et al., 2017). Анаммокс-бактерии, выделяя ЭПС в избытке и обволакивая ими клетки, могут таким образом защищать себя от токсичного влияние кислорода или других веществ. Плотный чехол из ЭПС на поверхности колоний также может служить физическим барьером, препятствующим проникновению специфического зонда внутрь колонии и гибридизации с целевыми клетками, поэтому такие колонии не дают положительного FISH-сигнала. В этом случае, даже с применением высокоспецифичного зонда, может происходить недоучет анаммокс-бактерий рода Ca “Jettenia” методом FISH.
Гипотеза об автофлуоресценции ЭПС, однако, не объясняет, почему автофлуоресцирующие ЭПС образуются не всеми, а только частью колоний, т.к. условия в реакторе должны быть одинаковыми для всех анаммокс-бактерий данного рода. Еще одна гипотеза, которая может объяснить избирательную автофлуоресценцию колоний представителей рода Ca “Jettenia”, заключается в том, что автофлуоресценция появляется у старых, физиологически малоактивных клеток, а также у клеток, находящихся в фазе отмирания или уже мертвых (пустых) клеток. Такие клетки не будут гибридизоваться с целевым зондом из-за низкого содержания в них рибосом, а также не будут участвовать в осуществлении процесса анаммокс в реакторе. В работе Картала и соавт. отмечено, что автофлуоресценция колоний появлялась постепенно после 4 мес. культивирования; молодые культуры анаммокс-бактерий не автофлуоресцировали (Kartal et al., 2008). Это позволяет предположить, что автофлуоресценция зависит от возраста культуры. В нашем случае максимальный возраст биопленок составлял 3.5 мес. Именно эти биопленки могли давать интенсивную автофлуоресценцию, аналогично описанной в работе Картала и соавт. (2008). Колонии, не имевшие автофлуоресценцию, вероятно являлись более молодыми, сформировавшимися в реакторе позднее, и, следовательно, физиологически активными, о чем свидетельствовал интенсивный сигнал FISH.
Боллманн и соавт (Böllmann et al., 2019) также детектировали автофлуоресценцию у клеток анаммокс-бактерий вида Ca. “Brocadia fulgida”. Автофлуоресценция была максимальна при длине волны возбуждающего света в диапазоне от УФ света (330–380 нм) до голубого (450–490 нм) с максимумом эмиссии между голубым и зеленым светом. Было отмечено, что автофлуоресценция клеток исчезала при пересеве накопительной культуры в свежую среду, что также может свидетельствовать о зависимости автофлуоресценции от возраста культуры. Наиболее интенсивную автофлуоресценцию демонстрировали большие агрегаты клеток, хотя в отличие от данных Картала и соавт., маленькие группы и единичные клетки также автофлуоресцировали. При этом не все автофлуоресцирующие клетки могли быть окрашены FISH-зондом или DAPI. Это позволило авторам предположить, что неокрашенные клетки были пустыми (мертвыми), но с ненарушенной клеточной стенкой или слоем ЭПС. Авторы не исключали того, что слой ЭПС мог быть непроницаем для зонда, но считали это маловероятным, поскольку они не наблюдали различий между окрашенными и неокрашенными клетками в интенсивности автофлуоресценции и морфологии (Böllmann et al., 2019).
На основании сравнения наших данных с результатами предыдущих исследований (Kartal et al., 2008; Böllmann et al., 2019), можно сделать вывод о том, что автофлуоресцируют не только клетки представителей Ca. “Brocadia fulgida”, но, как минимум, еще и Ca “Jettenia”. Вероятно, способность к автофлуоресценции более широко распространена среди анаммокс-бактерий, чем полагалось ранее. Возможно, что автофлуоресценцию вызывают специфические белки в составе ЭПС, и их синтез и/или количество зависят от возраста колонии и физиологического статуса клетки.
Исследование биопленок активного ила методом электронной микроскопии. С помощью электронной микроскопии в биопленках выявлены колонии, клетки в которых были погружены в мощный слой ЭПС-матрикса (рис. 7а). Клетки в этих колониях имели неправильную форму с сильным выпячиванием клеточной стенки. В клетках различима клеточная стенка, анаммоксосома и гранулы в цитоплазме, предположительно, гликогена (рис. 7б). Подобные гранулы довольно часто выявляют в клетках анаммокс-бактерий (van Niftrik et al., 2008). Гликоген является запасным веществом и обеспечивает клетку углеродом и энергией при неблагоприятных условиях, в том числе при голодании. Запасание гликогена может быть связано с избытком углерода и/или отсутствием необходимых питательных веществ (особенно азота) в среде. Гликоген также может использоваться клеткой для образования биопленки (van Niftrik et al., 2008; van Niftrik, Jetten, 2012). Можно спекулировать о том, что именно эти колонии, погруженные в толстый слой ЭПС-матрикса с клетками, наполненными гликогеном, автофлуоресцировали и не гибридизовались с зондом Jett1.
Рис. 7.
Микрофотографии ультратонких срезов ила обрастания: а – колонии анаммокс-бактерий первого морфотипа; б – увеличенное изображение клеток анаммокс-бактерий первого морфотипа; г – колонии анаммокс-бактерий второго морфотипа. 1 – ЭПС, 2 – клеточная стенка, 3 – анаммоксосома, 4 – гранулы гликогена, 5 – пустые (мертвые) клетки. Масштабная метка – 0.5 мкм.
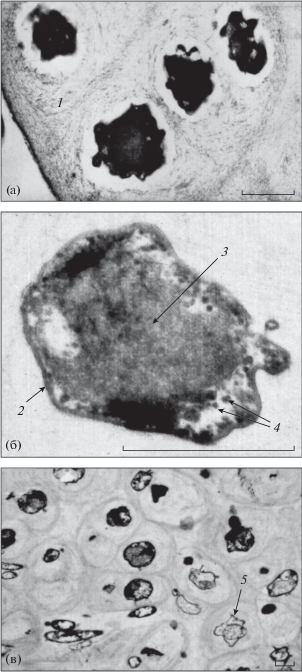
На рис. 7в представлен второй тип колоний анаммокс-бактерий. Слой ЭПС, образуемый клетками в этих колониях, был менее плотный и более неоднородный, чем в первом случае, поскольку в нем видны полости, содержащие клетки других микроорганизмов. Это может указывать на более молодой возраст колоний. Морфология клеток в этих колониях была схожа с морфологией клеток в колониях первого типа, но клетки располагались в матриксе более компактно, клеточная стенка имела гораздо меньше выпячиваний и была, в целом, более правильной округлой формы. При этом в колонии присутствовали полуразрушенные (мертвые) клетки, характеризовавшиеся отмеченными ранее выпячиваниями мембраны.
Молекулярный анализ разнообразия микроорганизмов в биопленке активного ила. Для подтверждения того, что ил обрастания действительно содержал анаммокс-бактерии, был выполнен анализ состава микробного сообщества с помощью метода высокопроизводительного секвенирования фрагментов гена 16S рРНК. Результаты анализа состава микробного консорциума биопленок представлены на рис. 8. В биопленках доминировали последовательности, относящиеся к представителям четырех филумов – Chloroflexi (41.3% от общего количества последовательностей гена 16S рРНК), Bacteroidetes (24.3%), Planctomycetes (24.2%) и Proteobacteria (9.5%). Представители филумов BRC1 и Verrucomicrobia (суммарный вклад 0.8%) составляли минорную часть сообщества (рис. 8а).
Рис. 8.
Разнообразие бактерий в биопленках ила обрастания, выявленное с помощью метода высокопроизводительного секвенирования фрагментов гена 16S рРНК: а – разнообразие бактерий на уровне филума; б – видовое разнообразие и соотношение различных представителей анаммокс-бактерий.
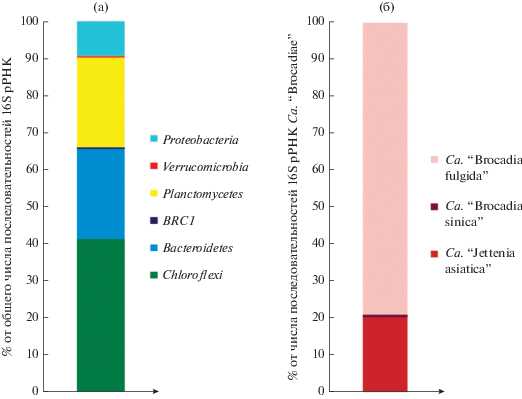
Доминирующий филум, Chloroflexi, был представлен в основном последовательностями бактерий класса Anaerolineae (нитчатые анаэробные органотрофы), которые часто детектируют в анаммокс-реакторах. Среди представителей филума Bacteroidetes 22% последовательностей принадлежало бактериям класса Ignavibacteria (факультативно анаэробные органотрофы). Представители класса Betaproteobacteria относились к трем родам: Nitrosomonas – 3.9% (нитрификаторы I стадии), Comamonas – 3.4%, и Thauera – 1.7%. Среди представителей двух последних родов встречаются денитрификаторы. Нитрификаторы II стадии в биопленках не выявлены, что может быть связано с ингибирующим влиянием на них формиата (Wang et al., 2020b). Класс Deltaproteobacteria был представлен сульфат- и тиосульфатредукторами, относящимися к семейству Desulfarculaceae. Представители рода Terrimicrobium (анаэробные бродильщики) идентифицированы в составе класса Verrucomicrobiae.
На третьем месте по относительной численности (суммарно 23%) стояли представители филума Planctomycetes. Из них 13% последовательностей приходилось на некультивируемых представителей класса Phycisphaerae и около 10% – на анаммокс-бактерии Ca. “Brocadiae”. Целевой таксон, Ca. “Brocadiae”, был представлен последовательностями, имеющими высокое сходство с фрагментами гена 16S рРНК трех анаммокс-бактерий: Ca. “Brocadia fulgida” (DQ459989), Ca. “Jettenia asiatica” (KJ002641) и Ca. “Brocadia sinica” (KT023580). На их долю приходилось, соответственно, 79, 20.3 и 0.7% последовательностей, аффилированных с классом Ca. “Brocadiae” (рис. 8б). Таким образом, в исследованных биопленках вклад анаммокс-бактерий рода Ca. “Brocadia” был выше, чем рода Ca. “Jettenia”. Это может быть связано с лучшей адгезией клеток представителей рода Ca. “Brocadia” на носителе. Выявлено, что представители вида Ca. “Brocadia sinica” образуют ЭПС с более гидрофобной поверхностью и менее гидрофильными функциональными группами, чем другие анаммокс-бактерии, Ca. “Jettenia caeni” и Ca. “Brocadia sapporoensis” (Ali et al., 2018). Преобладание анаммокс-бактерий рода Ca. “Brocadia” также может быть связано с их конкурентным преимуществом по сравнению с Ca. “Jettenia” при добавлении в среду ЛЖК (Kartal et al., 2008; Feng et al., 2019a).
В целом, сочетание методов световой, эпифлуоресцентной и электронной микроскопии с молекулярным анализом позволило связать информацию о морфологическом и таксономическом разнообразии микроорганизмов в биопленке с физиологическим статусом отдельных ее представителей.
Список литературы
Каллистова А.Ю., Пименов Н.В., Козлов М.Н., Николаев Ю.А., Дорофеев А.Г., Асеева В.Г., Грачев В.А., Менько Е.В., Берестовская Ю.Ю., Ножевникова А.Н., Кевбрина М.В. Изучение микробного состава активных илов московских очистных сооружений // Микробиология. 2014. Т. 83. С. 615–625.
Kallistova A.Yu., Pimenov N.V., Kozlov M.N., Nikolaev Yu.A., Dorofeev A.G., Aseeva V.G., Grachev V.A., Men’ko E.V., Berestovskaya Yu.Yu., Nozhevnikova A.N., Kevbrina M.V. Microbial composition of the activated sludge of Moscow wastewater treatment plants // Microbiology (Moscow). 2014. V. 83. P. 699–708.
Марданов А.В., Белецкий А.В., Каллистова А.Ю., Котляров Р.Ю., Николаев Ю.А., Кевбрина М.В., Агарев А.М., Равин Н.В., Пименов Н.В. Динамика изменения состава микробного консорциума в процессе запуска однореакторной проточной лабораторной установки нитритации/анаммокс // Микробиология. 2016. Т. 85. С. 663–675.
Mardanov A.V., Beletskii A.V., Kallistova A.Yu., Kotlyarov R.Yu., Nikolaev Yu.A., Kevbrina M.V., Agarev A.M., Ravin N.V., Pimenov N.V. Dynamics of the composition of a microbial consortium during start-up of a single-stage constant flow laboratory nitritation/anammox setup // Microbiology (Moscow). 2016. V. 85. P. 681–692.
Ali M., Shaw D.R., Zhang L., Haroon M.F., Narita Y., Emwas A.-H., Saikaly P.E., Okabe S. Aggregation ability of three phylogenetically distant anammox bacterial species // Water Res. 2018. V. 143. P. 10–18.
Almstrand R., Persson F., Daims H., Ekenberg M., Christensson M., Wilén B.-M., Sörensson F., Hermansson M. Three-dimensional stratification of bacterial biofilm populations in a moving bed biofilm reactor for nitritation-anammox // Int. J. Mol. Sci. 2014. V. 15. P. 2191–2206.
Botchkova E.A., Plakunov V.K., Nozhevnikova A.N. Dynamics of biofilm formation on microscopic slides submerged in an anammox bioreactor // Microbiology. 2015. V. 84. P. 456–460.
Boleij M., Kleikamp H., Pabst M., Neu T.R., van Loosdrecht M.C.M., Lin Y. Decorating the anammox house: sialic acids and sulfated glycosaminoglycans in the extracellular polymeric substances of anammox granular sludge // Environ. Sci. Technol. 2020. V. 54. P. 5218–5226.
Boeije G., Corstanje R., Rottiers A., Schowanek D. Adaptation of the CAS test system and synthetic sewage for biological nutrient removal. Part I: Development of a new synthetic sewage // Chemosphere. 1999. V. 38. P. 699–709.
Böllmann J., Engelbrecht S., Martienssen M. Autofluorescent characteristics of Candidatus Brocadia fulgida and the consequences for FISH and microscopic detection // Syst. Appl. Microbiol. 2019. V. 42. P. 135–144.
Chen Z., Meng Y., Sheng B., Zhou Z., Jin C., Meng F. Linking exoproteome function and structure to anammox biofilm development // Environ. Sci. Technol. 2019. V. 53. P. 1490–1500.
Ding S., Zheng P., Lu H., Chen J., Mahmood Q., Abbas G. Ecological characteristics of anaerobic ammonia oxidizing bacteria // Appl. Microbiol. Biotechnol. 2013. V. 97. P. 1841–1849.
Edgar R.C. Search and clustering orders of magnitude faster than BLAST // Bioinformatics 2010. V. 26. P. 2460–2461.
Feng Y., Zhao Y., Jiang B., Zhao H., Wang Q., Liu S. Discrepant gene functional potential and cross-feedings of anammox bacteria Ca. Jettenia caeni and Ca. Brocadia sinica in response to acetate // Water Res. 2019a. V. 165. Art. 114974.
Feng C., Lotti T., Lin Y., Malpei F. Extracellular polymeric substances extraction and recovery from anammox granules: evaluation of methods and protocol development // Chem. Eng. J. 2019b. V. 374. P. 112–122.
Frey B., Rime T., Phillips M., Stierli B., Hajdas I., Widmer F., Hartmann M. Microbial diversity in European alpine permafrost and active layers // FEMS Microbiol. Ecol. 2016. V. 92. fiw018.
Gonzalez-Gil G., Sougrat R., Behzad A.R., Lens P.N., Saikaly P.E. Microbial community composition and ultrastructure of granules from a full-scale anammox reactor // Microb. Ecol. 2015. V. 70. P. 118–131.
Gonzalez-Martinez A., Osorio F., Rodriguez-Sanchez A., Martinez-Toledo M.V., Gonzalez-Lopez J., Lotti T., van Loosdrecht M.C.M. Bacterial community structure of a lab-scale anammox membrane bioreactor // Biotechnol. Prog. 2015. V. 31. P. 186–193.
Guo Y., Liu S., Tang X., Yang F. Role of c-di-GMP in anammox aggregation and systematic analysis of its turnover protein in Candidatus Jettenia caeni // Water Res. 2017. V. 113. P. 181–190.
Hou X., Liu S., Zhang Z. Role of extracellular polymeric substance in determining the high aggregation ability of anammox sludge // Water Res. 2015. V. 75. P. 51–62.
Huang X.-L., Gao D.-W., Tao Y., Wang X.-L. C2/C3 fatty acid stress on anammox consortia dominated by Candidatus Jettenia asiatica // Chem. Eng. J. 2014. V. 253. P. 402–407.
Jenni S., Vlaeminck S.E., Morgenroth E., Udert K.M. Successful application of nitritation/anammox to wastewater with elevated organic carbon to ammonia ratios // Water Res. 2014. V. 49. P. 316–326.
Kartal B., Kuenen J.G., van Loosdrecht M.C. Sewage treatment with anammox // Science. 2010. V. 328. P. 702–703.
Kartal B., Kuypers M.M., Lavik G., Schalk J., Op den Camp H.J.M., Jetten M.S.M., Strous M. Anammox bacteria disguised as denitrifiers: nitrate reduction to dinitrogen gas via nitrite and ammonium // Environ. Microbiol. 2007. V. 9. P. 635–642.
Kartal B., van Niftrik L., Rattray J., van de Vossenberg J.L., Schmid M.C., Sinninghe Damsté J., Jetten M.S., Strous M. Candidatus “Brocadia fulgida”: an autofluorescent anaerobic ammonium oxidizing bacterium // FEMS Microbiol. Ecol. 2008. V. 63. P. 46–55.
Kindaichi T., Tsushima I., Ogasawara Y., Shimokawa M., Ozaki N., Satoh H., Okabe S. In situ activity and spatial organization of anaerobic ammonium-oxidizing (anammox) bacteria in biofilms // Appl. Environ. Microbiol. 2007. V. 73. P. 4931–4939.
Kuenen J.G. Anammox and beyond // Environ. Microbiol. 2020. V. 22. P. 525–536.
Lawson C.E., Wu S., Bhattacharjee A.S., Hamilton J.J., Mc-Mahon K.D., Goel R., Noguera D.R. Metabolic network analysis reveals microbial community interactions in anammox granules // Nat. Commun. 2017. V. 8. Art. 15416.
Li J., Li J., Peng Y., Wang S., Zhang L., Yang S., Li S. Insight into the impacts of organics on anammox and their potential linking to system performance of sewage partial nitrification-anammox (PN/A): a critical review // Bioresour. Technol. 2020. V. 300. Art. 122655.
Liang Y., Li D., Zhang X., Zeng H., Yang Y., Zhang J. Nitrate removal by organotrophic anaerobic ammonium oxidizing bacteria with C2/C3 fatty acid in upflow anaerobic sludge blanket reactors // Bioresour. Technol. 2015. V. 193. P. 408–414.
Lin X., Wang Y. Microstructure of anammox granules and mechanisms endowing their intensity revealed by microscopic inspection and rheometry // Water Res. 2017. V. 120. P. 22–31.
Mardanov A.V., Beletsky A.V., Nikolaev Yu., Kotlyarov R.Y., Kallistova A., Pimenov N.V., Ravin N.V. Metagenome of the microbial community of anammox granules in a nitritation/anammox wastewater treatment system // Genome Announc. 2017. V. 5. Art. e01115-17.
Mardanov A.V., Kotlyarov R.V., Beletsky A.V., Nikolaev Y.A., Kallistova A.Y., Grachev V.A., Berestovskaya Y.Y., Pimenov N.V., Ravin N.V. Metagenomic data of the microbial community of lab-scale nitritation-anammox sequencing-batch bioreactor performing nitrogen removal from synthetic wastewater // Data in Brief. 2019a. V. 27. Art. 104722.
Ni B.-J., Hu B.-L., Fang F., Xie W.-M., Kartal B., Liu X.-W., Sheng G.-P., Jetten M., Zheng P., Yu H.-Q. Microbial and physicochemical characteristics of compact anaerobic ammonium-oxidizing granules in an upflow anaerobic sludge blanket reactor // Appl. Environ. Microbiol. 2010. V. 76. P. 2652–2656.
Nikolaev Yu., Kallistova A., Kevbrina M., Dorofeev A., Agarev A., Mardanov A., Ravin N., Kozlov M., Pimenov N. Novel design and optimization of a nitritation/anammox setup for ammonium removal from filtrate of digested sludge // Environ. Technol. 2018. V. 39. P. 593–606.
Peeters S.H., van Niftrik L. Trending topics and open questions in anaerobic ammonium oxidation // Curr. Opin. Chem. Biol. 2019. V. 49. P. 45–52.
Schmid M., Walsh K., Webb R., Rijpstra W.I., van de Pas-Schoonen K., Verbruggen M.J., Hill T., Moffett B., Fuerst J., Schouten S., Damsté J.S., Harris J., Shaw P., Jetten M., Strous M. Candidatus “Scalindua brodae”, sp. nov., Candidatus “Scalindua wagneri”, sp. nov., two new species of anaerobic ammonium oxidizing bacteria // Syst. Appl. Microbiol. 2003. V. 26. P. 529–538.
Schmid M.C., Maas B., Dapena A., van de Pas-Schoonen K., van de Vossenberg J., Kartal B., van Niftrik L., Schmidt I., Cirpus I., Kuenen J.G., Wagner M., Sinninghe Damsté J.S., Kuypers M., Revsbech N.P., Mendez R., Jetten M.S.M., Strous M. Biomarkers for in situ detection of anaerobic ammonium-oxidizing (anammox) bacteria // Appl. Environ. Microbiol. 2005. V. 71. P. 1677–1684.
Shu D.T., He Y.L., Yue H., Gao J.L., Wang Q.Y., Yang S.C. Enhanced long-term nitrogen removal by organotrophic anammox bacteria under different C/N ratio constraints: quantitative molecular mechanism and microbial community dynamics // RSC Adv. 2016. V. 6. P. 87593–87606.
Sonthiphand P., Neufeld J.D. Evaluating primers for profiling anaerobic ammonia oxidizing bacteria within freshwater environments // PLoS One. 2013. V. 8. Art. e57242.
Standard Methods for the Examination of Water and Wastewater / Eds. Rice E.W., Bridgewater L. American Public Health Association, American Water Works Association, Water Environment Federation. 22nd ed. Washington, D.C.: American Public Health Association, 2012. 496 p.
Strous M., Heijnen J.J., Kuenen J.G., Jetten M.S.M. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms // Appl. Microbiol. Biotechnol. 1998. V. 50. P. 589–596.
van Niftrik L., Geerts W.J.C., van Donselaar E.G., Humbel B.M., Webb R.I., Fuerst J.A., Verkleij A.J, Jetten M.S.M., Strous M. Linking ultrastructure and function in four genera of anaerobic ammonium-oxidizing bacteria: cell plan, glycogen storage and localization of cytochrome c proteins // J. Bacteriol. 2008. V. 190. P. 708–717.
van Niftrik L., Jetten M.S.M. Anaerobic ammonium-oxidizing bacteria: unique microorganisms with exceptional properties // Microbiol. Mol. Biol. Rev. 2012. V. 76. P. 585–596.
van Teeseling M.C.F., Mesman R.J., Kuru E., Espaillat A., Cava F., Brun Y.V., VanNieuwenhze M.S., Kartal B., van Niftrik L. Anammox Planctomycetes have a peptidoglycan cell wall // Nat. Commun. 2015. V. 6. Art. 6878.
Vlaeminck S.E., Terada A., Smets B.F., De Clippeleir H., Schaubroeck T., Bolca S., Demeestere L., Mast J., Boon N., Carballa M., Verstraete W. Aggregate size and architecture determine microbial activity balance for one-stage partial nitritation and anammox // Appl. Environ. Microbiol. 2010. V. 76. P. 900–909.
Wang W., Yan Y., Zhao Y., Shi Q., Wang Y. Characterization of stratified EPS and their role in the initial adhesion of anammox consortia // Water. Res. 2020a. V. 169. Art. 115223.
Wang J.P., Liu Y.D., Meng F.G., Li W. The short- and long-term effects of formic acid on rapid nitritation start-up // Environ. Int. 2020b. V. 135. Art. 105350.
Yin X., Zhai J., Hu W., Li Y., Rahaman M.H., Mąkinia J. A fast start-up of the organotrophic anammox process inoculated with constructed wetland sediment // Ecol. Engin. 2019. V. 138. P. 454–460.
Zhao Y., Liu S., Jiang B., Feng Y., Zhu T., Tao H., Tang X., Liu S. Genome-centered metagenomics analysis reveals the symbiotic organisms possessing ability to cross-feed with anammox bacteria in anammox consortia // Environ. Sci. Technol. 2018. V. 52. P. 11285–11296.
Дополнительные материалы отсутствуют.



