Микробиология, 2020, T. 89, № 6, стр. 714-727
Проблема идентификации и криптическое разнообразие микроводорослей клады Chlorella (Chlorophyta)
Е. С. Кривина a, *, А. Д. Темралеева a
a Институт физико-химических и биологических проблем почвоведения
Российской академии наук – обособленное подразделение ФИЦ ПНЦБИ РАН
142290 Пущино, Россия
* E-mail: pepelisa@yandex.ru
Поступила в редакцию 20.02.2020
После доработки 25.05.2020
Принята к публикации 03.06.2020
Аннотация
В статье рассматривается система зеленых микроводорослей клады Chlorella, построенная на основании морфологических, физиологических, экологических и молекулярно-генетических данных. Обсуждаются диагностические признаки выделенных родов и видов, а также систематическое положение некоторых таксонов. Молекулярно-филогенетический анализ членов клады Chlorella показал, что использование одного гена 18S рРНК, который считается главным филогенетическим маркером для зеленых микроводорослей, не позволяет надежно разграничить виды и роды внутри клады. Применение вариабельных спейсеров ITS1 и ITS2 разрешило топологию дерева и усилило филогенетический сигнал. Подтверждена полифилетичность рода Chlorella. Часть видов рода образовали истинную кладу Chlorella – типовой вид C. vulgaris, C. heliozoae, C. pituita, C. chlorelloides, C. variabilis и Lobosphaeropsis lobophora. Остальные виды (C. pulchelloides, C. colonials, C. rotunda, C. singularis, C. elongata, C. sorokiniana, C. lewinii, C. volutis, C. thermophila) являются членами других клад, и их таксономическая принадлежность нуждается в уточнении. CBC-подход и поиск компенсаторных замен в консервативных регионах ITS2, как инструмент для разграничения видов, не был эффективен. Была подтверждена результативность использования интрона в качестве критерия разделения близкородственных видов. Анализ генетических дистанций позволил однозначно разделить штаммы на виды внутри родов Didymogenes, Hindakia, Heynigia. Для членов клады Chlorella характерно высокое криптическое разнообразие: ни одна из рассмотренных фенотипических характеристик по отдельности не позволяет однозначно определить таксономическую принадлежность водорослей клады. Некоторые морфологические признаки вариабельны, часто изменяются или утрачиваются после инструментальных манипуляций при пробоподготовке для мониторинга водоемов. Благодаря использованию комбинаций морфологических, биохимических, ультраструктурных, физиологических, экологических и молекулярно-генетических признаков (полифазный подход), нам удалось охарактеризовать восемь групп внутри клады Chlorella и выдвинуть предположения о разделении родов и видов внутри выделенных групп.
Род Chlorella sensu lato является архетипом одноклеточных зеленых микроводорослей (Chlorophyta). Изначально в него включали микроводоросли с коккоидной организацией таллома, шаровидной или эллипсоидной формой клеток, а также размножающиеся исключительно автоспорами. К роду было отнесено около 100 видов свободноживущих, эндосимбиотических и паразитических зеленых микроводорослей из пресноводных, морских и наземных экосистем (Guiry, Guiry, 2020). Более подробное изучение биохимических, ультраструктурных и генетических характеристик рода выявило его гетерогенность, в связи с этим было предпринято несколько попыток ревизии. Так, на основании различий в нуклеотидных последовательностях гена 18S рРНК и спейсера ITS2 Krienitz et al. (2004) выделили Chlorella kessleri в отдельный род Parachlorella. Впоследствии разделение Chlorella-клада и Parachlorella-клада на 2 сестринские группы было подтверждено Yamamoto et al. (2005) на основании ультраструктурных исследований синтеза клеточных стенок автоспор. Далее Luo et al. (2010) обобщили молекулярно-генетические, морфологические и онтогенетические результаты исследований (Wolf et al., 2002; Krienitz et al., 2004; Fawley et al., 2005; Pröschold et al., 2010) и предложили новую концепцию клады Chlorella, в настоящее время соответствующей семейству Chlorellaceae (Guiry, Guiry, 2020), в которую, помимо архетипа, были отнесены несколько родов с различной морфологией: Actinastrum (ранее семейство Coelastraceae), Didymogenes (ранее Scenedesmaceae), Hegewaldia, Meyerella и Micractinium (ранее Micractiniaceae).
Последняя масштабная ревизия пресноводных и наземных штаммов клады Chlorella проводилась Pröschold et al. (2010) и Bock et al. (2011). Однако с этого времени был описан целый ряд новых таксонов внутри клады: C. thermophila (Ma et al., 2015), род Carolibrandtia (Hoshina et al., 2017; Hoshina, Nakada, 2018), Micractinium singularis, M. variabile, M. simplicissimum (Chae et al., 2019). Недавнее исследование Darienko et al. (2019) касалось ограниченного ряда водорослей клады Chlorella, обитающих исключительно в морских экосистемах. В настоящее время правильная идентификация хлорелл по-прежнему затруднительна вследствие скудности и высокой фенотипической пластичности морфологических свойств и отсутствия надежных диакритических признаков для разграничения близкородственных таксонов. Особую сложность вызывает их идентификация при проведении мониторинга состояния водоемов. Общепринятой практикой при качественном и количественном анализе фитопланктона является обработка отфильтрованных, фиксированных 40%-ным формалином альгологических проб на световом микроскопе при увеличении ×600 в счетной камере Учинской или Нажотта (Методика изучения…, 1975). Точное определение микроводорослей Chlorella-клады в подобных пробах будет дополнительно затруднено изменением или утратой некоторых морфологических признаков, таких как слизь, соединительные тяжи, формирование колоний, щетинкообразование, вследствие методических инструментальных манипуляций (фильтрация, фиксация). Это приводит к снижению фактического биоразнообразия микроводорослей в экосистемах водоемов. Так, в составе альгофлоры планктона системы водохранилищ бассейна реки Волга по результатам многолетних наблюдений с 1953 г. по 2014 г. было обнаружено более 2000 видов, разновидностей и форм микроводорослей и цианобактерий. Из них к роду Chlorella относился всего 1 вид, к роду Actinastrum 4 вида, к роду Didymogenes 2 вида, к роду Micractinium 5 видов (Корнева, 2015). Столь же невелико видовое разнообразие Chlorella-подобных микроводорослей и в малых водоемах урбанизированных ландшафтов. В составе альгофлоры плактона данной группы водоемов в период изучения с 1991 г. по 2017 г. было зарегистрировано 451 вид микроводорослей и цианобактерий. При этом род Chlorella был представлен всего 2 видами, род Actinastrum – 1 видом, род Micractinium –1 видом (Кривина, 2018). Таким образом, валидная идентификация этой сложной в морфологическом плане группы микроводорослей крайне важна не только в фундаментальном аспекте для разработки таксономической классификации, но и в прикладном – для задач биомониторинга, биотестирования, биотехнологических приложений.
Цель данной работы заключалась в исследовании морфологии, экологии и филогении представителей клады Сhlorella, в том числе нового штамма ACSSI 198, для разграничения близкородственных таксонов на уровне вида и рода. В статье впервые были обобщены и проанализированы характеристики представителей группы, в первую очередь таксоны, открытые после последней ревизии клады в 2011 году.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования. Объектами данного исследования стали описанные штаммы, принадлежащие кладе Chlorella, и их нуклеотидные последовательности, депонированные в GenBank, а также новый штамм зеленой микроводоросли из пробы воды с поверхностного горизонта прибрежной зоны оз. Прудовиков, расположенного на северо-восточной границе г. Тольятти Самарской области (53°52′95′′ с.ш., 49°51′70′′ в.д.).
Изоляция и культивирование нового штамма. Каплю озерной воды без предварительной фильтрации наносили на твердую среду BG-11 с азотом (2% агар; pH 7.2) и далее многократно пересевали отдельные колонии. Полученные изоляты культивировали в климатостате в стандартных условиях (температура 23–25°С; свет 60–75 μмоль фотонов м–2 с–1; фотопериод 12 ч).
Микроскопия. Морфологию и жизненный цикл нового штамма изучали методами световой микроскопии (светлое поле и интерференционный контраст) с помощью микроскопов Leica DM750 и Carl Zeiss Axio Scope A1 (Германия) в ЦКП ИФХиБПП РАН. Результаты наблюдений документированы рабочими рисунками и фотографиями, снятыми с помощью цветных цифровых камер “Видеозавр” (Россия) и Carl Zeiss MRc 5 (Германия). Сроки наблюдения составили от 2 нед. до 12 мес. По данным микроскопии штамм был предварительно идентифицирован как Chlorella sp. и депонирован в Альгологическую коллекцию ACSSI (http://acssi.org/) под номером 198.
Выделение, амплификация, очистка и секвенирование ДНК. Суммарную ДНК из штамма ACSSI 198 выделяли с помощью колоночного набора DNeasy Plant Mini Kit (“Qiagen”, США), следуя протоколу производителя. Для амплификации использовали готовую смесь Screen Mix-HS (“Евроген”, Россия). Праймеры для ПЦР генов 18S, 5.8S рРНК и спейсеров ITS1, ITS2 были использованы из статей Katana et al. (2001) и White et al. (1990) (табл. 1). Детекцию целевых ПЦР-продуктов проводили электрофоретически в 1%-ном агарозном геле. Для дальнейшей очистки ампликонов из геля применяли набор Cleanup Standard (“Евроген”, Россия). Секвенирование нуклеотидных последовательностей осуществляли с праймерами, приведенными в табл. 1, на базе ЗАО “Синтол” (Россия).
Таблица 1.
Праймеры и условия амплификации генов 18S и 5.8S рРНК, спейсеров ITS1 и ITS2
| Локус | Праймер | Последовательность (5'–3') | Условия амплификации |
|---|---|---|---|
| 18S рРНК | 18SF | AACCTGGTTGATCCTGCCAGT | 95°C – 5 мин; 95°C – 30 c, 55°C – 30 c, 72°C – 2 мин, 35 циклов; 72°C – 5 мин |
| 18SR | TGATCCTTCTGCAGGTTCACCTACG | ||
| 402–23F* | GCTACCACATCCAAGGAAGGCA | ||
| 1323–44F* | CGAACGAGACCTCAGCCTGCTA | ||
| 898–919R* | TAAATCCAAGAATTTCACCTCT | ||
| 1308–39R* | CTCGTTCGTTAACGGAATTAACC | ||
| ITS1, 5.8S | ITS-AF | CGTTTCCGTAGGTGAACCTGC | 95°C – 3 мин; 95°C – 30 c, 57.6°C – 30 c, 72°C – 1 мин, 35 циклов; 72°C – 10 мин |
| ITS-BR | CATATGCTTAAGTTCAGCGGG | ||
| ITS2 | ITS3 | GCATCGATGAAGAACGCAGC | 95°C – 3 мин; 95°C – 30 с, 57.6°C – 30 с, 72°C – 1 мин, 35 циклов; 72°C – 10 мин |
| ITS4 | TCCTCCGCTTATTGATATGC |
Молекулярно-филогенетический анализ. Для уточнения филогенетического положения штамма ACSSI 198 и установления его связей внутри клады Chlorella был осуществлен поиск гомологии нуклеотидных последовательностей генов 18S, 5.8S рРНК и спейсеров ITS1, ITS2 по алгоритму BLASTn в GenBank (https://blast.ncbi.nlm.nih.gov). Отбор последовательностей осуществляли исходя из критериев максимального родства (сходство ≥95%), качества прочтения (без вырожденных и неизвестных нуклеотидов), длины прочтения (фрагмент 18S–ITS1–5.8S–ITS2 не менее 2300 п.н. длиной) и принадлежности к типовым видам и коллекционным аутентичным штаммам. В состав выборки для филогенетического анализа вошли 96 штаммов, характеристика которых представлена в дополнительных материалах (табл. S1 ). Названия таксонов приведены согласно Международной электронной базе данных AlgaeBase (Guiry, Guiry, 2020). При наличии интронов в гене 18S рРНК они удалялись из выравнивания, информация об обнаруженных интронах указана на рис. 1, 2. Множественное выравнивание было выполнено в программе BioEdit по алгоритму ClustalW. При выборе модели нуклеотидных замен использовали программу jModelTest и минимальное значение критерия AIC. Реконструкцию филогенетических взаимосвязей осуществляли с помощью метода максимального правдоподобия (ML) в программе PhyML. В качестве внешней группы выбрали представителей класса Trebouxiophyceae (Chlorophyta) – Dictyosphaerium ehrenbergianum, Parachlorella beijerinckii, P. kessleri.
Рис. 1.
Укорененное филогенетическое дерево зеленых водорослей клады Chlorella, построенное методом максимального правдоподобия (ML), на основе последовательностей генов 18S и 5.8S рРНК и спейсеров ITS1 и ITS2 (2611 п.н.). В качестве статистической поддержки узлов дерева указаны бутстреп-значения ML; значения <70% не показаны. Модель нуклеотидных замен: GTR + I + G. Обозначения: * – аутентичные штаммы; (T) – типовой вид. ◼ – образует колонии; ◻ – одиночные клетки; ◺ – не продуцирует щетинки; ◣ – продуцирует щетинки; ⚪ – свободноживущий организм; ⚫ – эндосимбиотический организм; “–” – нет информации; И – наличие интронов, рядом указано количество интронов; “–” – нет интрона.
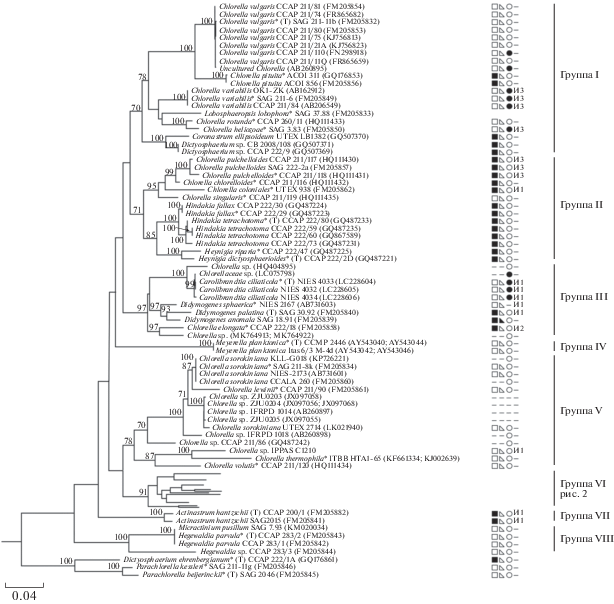
Рис. 2.
Фрагмент укорененного филогенетического дерева зеленых водорослей клады Chlorella (группа VI), построенного методом максимального правдоподобия (ML), на основе последовательностей генов 18S и 5.8S рРНК и спейсеров ITS1 и ITS2 (2611 п.н.). В качестве статистической поддержки узлов дерева указаны бутстреп-значения ML; значения <70% не показаны. Модель нуклеотидных замен: GTR + I + G. Обозначения: жирным шрифтом выделен штамм ACSSI 198; * – аутентичные штаммы; (T) – типовой вид. ◼ – образует колонии; ◻ – одиночные клетки; ◺ – не продуцирует щетинки; ◣ – продуцирует щетинки; ⚪ – свободноживущий организм; ⚫ – эндосимбиотический организм; И – наличие интронов, рядом указано количество интронов; “–” – нет интрона.

Статистическая поддержка топологии дерева была оценена с помощью бутстреп-анализа (1000 повторностей) и указана в узлах ветвей в виде процентов. Филогенетические деревья были визуализированы в программе FigTree v. 1.3.1. Генетические различия между нуклеотидными последовательностями гомологичных генов охарактеризовали с помощью генетических дистанций. Мерой генетических различий являлся процент несовпадений нуклеотидов при попарном сравнении выровненных последовательностей, вычисление которого проводили в программе ME-GA 6.0. Для сравнения топологии деревьев использовали данные статей (Krienitz et al., 2004; Hoshina et al., 2010; Luo et al., 2010; Bock et al., 2011a, 2011b; Pröschold et al., 2011; Ma et al., 2015; Hoshina et al., 2017; Hoshina, Nakada, 2018; Darienko et al., 2019).
Для анализа вторичной структуры ITS2 была выполнена аннотация спейсера в ITS2-DataBase (http://its2.bioapps.biozentrum.uni-wuerzburg.de) и его фолдинг с помощью веб-сервера Mfold (http://unafold.rna.albany.edu) в соответствии с принципом минимальной энергии. При оценке правильности фолдинга ITS2 зеленых микроводорослей ориентировались на работу Caisová et al. (2013). Сравнение вторичной структуры между штаммами, поиск консервативных мотивов и компенсаторных замен (CBC) осуществляли между всеми штаммами выборки в программе 4SALE. В качестве инструмента разделения видов был использован подход, предложенный Coleman (2000, 2009), которая показала, что наличие хотя бы одной CBC в консервативных регионах ITS2 (5 п.н. I шпильки, 11 п.н. II шпильки, вся III шпилька) у двух водорослей коррелирует с их полной половой несовместимостью. Напротив, CBC в менее консервативных регионах, а также полукомпенсаторные замены (hCBC) в консервативных регионах не были связаны со способностью к скрещиванию. Вторичные структуры были визуализированы в программе PseudoViewer3.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Главный молекулярно-филогенетический маркер для эукариотических организмов – ядерный ген 18S рРНК – достаточно консервативен и не всегда позволяет успешно разделять близкородственные виды зеленых микроводорослей (Fawley et al., 2006). В дополнительных материалах (рис. S1 ) представлено филогенетическое дерево клады Chlorella, построенное на основе последовательностей гена 18S рРНК. Доля консервативных сайтов составляла 88%, вариабельных – 12%, парсимони-информативных – 6%. Для усиления филогенетического сигнала использовали более длинный фрагмент, включаюший гены 18S и 5.8S рРНК, а также спейсеры ITS1 и ITS2. При увеличении длины нуклеотидной последовательности количество консервативных сайтов снизилось до 71%, доля вариабельных сайтов возросла более чем в 2 раза и составила 27%, доля парсимони-информативных сайтов увеличилась более чем в три раза и равнялась 22%. Было отмечено улучшение кластеризации и рост статистических поддержек узлов дерева. Поэтому в данной работе мы рассматриваем филогенетическое дерево, построенное на основании фрагмента 18S–ITS1–5.8S–ITS2. Клада Chlorella образовала группу с максимальным уровнем статистической поддержки (рис. 1), внутри разделяясь на 8 групп надродового и родового уровня со статистической поддержкой от 70 до 100%.
Все представители клады Chlorella имели коккоидную организацию таллома. Клетки одиночные или колониальные, соединенные слизистыми тяжами. Хлоропласт пристенный, преимущественно чашевидный. Пиреноид, как правило, один, кроме представителей рода Meyerella, у которых он отсутствует. Крахмальная обвертка пиреноида либо фрагментированная, состоящая из 2–4 скорлупок, либо сплошная. Размножение преимущественно бесполое – автоспорогенез, за исключением Micractinium pusillum и представителей рода Hegewaldia, у которых известен половой процесс (оогамия). Большинство микроводорослей клады Chlorella являются пресноводными свободноживущими планктонными организмами. Однако встречаются также свободноживущие обитатели солоноватых водоемов и морских вод, почв и эндосимбионты (Krienitz et al., 2004; Fawley et al., 2005; Luo et al., 2010; Pröschold et al., 2010; Bock et al., 2011a; Darienko et al., 2019).
Для всех штаммов, представленных на филогенетическом дереве, были смоделированы вторичные структуры ITS2. Длина ITS2 членов клады Chlorella варьировала в диапазоне от 221 до 268 н. Вторичная структура ITS2 обладала общими признаками, характерными для зеленых микроводорослей (Chlorophyta): четыре неразветвленные шпильки, пиримидин-пиримидиновый мисматч во II шпильке, консервативный мотив GGUAGG в самой длинной III шпильке. Далее мы приводим описание каждой из групп с морфологическими, молекулярно-генетическими и экологическими характеристиками.
Группа I объединяет с 70%-ной статистической поддержкой микроводоросли с шаровидными или слегка овальными клетками, которые не образуют щетинок. Хлоропласт пристенный, у большинства представителей клады чашевидный, реже поясковидный. Пиреноид один, c крахмальной обверткой из 2–4 скорлупок. Размножение автоспорами. Обитают, преимущественно, в пресных водах, реже в солоноватоводных и соленых водоемах и почве. Среди них есть как свободноживущие микроводоросли, так и симбионты пресноводных ресничных и амебоидных протистов (Luo et al., 2010; Pröschold et al., 2010; Bock et al., 2011a). В состав данной группы вошли:
– типовой вид рода Chlorella vulgaris (8 штаммов, в т.ч. аутентичный штамм SAG 211-11b) и некультивируемая микроводоросль Chlorella sp. Преимущественно пресноводные свободноживущие организмы. Однако встречаются обитатели солоноватоводных и соленых водоемов (штаммы CCAP 211/21A, CCAP 211/75) и эндосимбионты пресноводной инфузории Paramecium bursaria (штамм CCAP 211/110 и Chlorella sp.);
– C. pituita (2 штамма, включая аутентичный штамм ACOI 311). Отличительные черты: слизистые тяжи, формирование колоний, окруженных слизистой оболочкой, наличие, помимо чашевидного, блюдцевидного хлоропласта (Bock et al., 2011a);
– C. variabilis (3 штамма, в т.ч. аутентичный штамм SAG 211-6). В отличие от других представителей группы I штаммам C. variabilis для нормальной жизнедеятельности необходимы соединения аммония или органического азота, витамины B1 и B12 (Pröschold et al., 2011). Вероятно, это связано с симбиотическим образом жизни, поскольку все представители подгруппы являются эндосимбионтами инфузории Paramecia bursaria. Другой характерной чертой является наличие в составе гена 18S рРНК трех интронов длиной 326, 646 и 495 п.н. соответственно;
– аутентичный штамм Lobosphaeropsis lobophora SAG 37.88. К диакритическим признакам относятся лопастной хлоропласт, присутствие капель масла в цитоплазме (Ettl, Gärtner, 1995), почвенное местообитание. Отметим, что перенос C. lobophora к Lobosphaeropsis Reisigl, предложенный Ettl, Gartner (1995) не подтверждается в нашем исследовании, равно как в других работах (Krienitz et al., 2004; Luo et al., 2010; Bock et al., 2011a). Аутентичный штамм L. pyrenoidosa, типового вида рода Lobosphaeropsis, утерян, а единственный доступный штамм этого вида FG2/10.3 близок к роду Watanabea;
– аутентичный штамм C. rotunda CCAP 260/11, отличающийся наименьшими размерами в данной группе (3.3–4.5 мкм в диаметре) (Bock et al., 2011a);
– аутентичный штамм C. heliozoae SAG 3.83. Характерными признаками являются мантиевидный или блюдцевидный хлоропласт, эндосимбиотический образ жизни в теле центрохелидного солнечника Acanthocystis turfacea (Bock et al., 2011a), а также наличие в составе гена 18S рРНК трех интронов длиной 552, 435 и 387 п.н. соответственно;
– отдельную филогенетическую линию составляют 2 неаутентичных штамма Dictyosphaerium sp., отличающиеся наличием колоний, в которых клетки соединены слизистыми тяжами (Bock et al., 2011b);
– сестринской филогенетической линией к Dictyosphaerium sp. является неаутентичный штамм Coronastrum ellipsoideum UTEX LB1382, характерной чертой которого является способность формировать 4-клеточные ценобии при помощи коротких бесцветных нитей (Bock et al., 2011b). Можно предположить, что Dictyosphaerium sp. и C. ellipsoideum UTEX LB1382 являются новыми, пока не идентифицированными видами рода Chlorella.
В пределах группы I внутривидовые различия нуклеотидных последовательностей, включающих гены 18S и 5.8S рРНК и спейсеры ITS1 и ITS2, составляли 0–0.1%, межвидовые – 0.4–2.1%. Условно, обозначим данную группу как “истинные” хлореллы.
Применение СВС-подхода для разграничения видов внутри группы I не было полностью успешным. Так между видами С. vulgaris и С. pituita, а также между видами С. variabilis, C. rotunda и С. heliozoae в консервативных регионах ITS2 СВС не были обнаружены. При этом для некоторых видов удалось выявить СBC в консервативных регионах: C. vulgaris, C. pituita, L. lobophora отличались от остальных видов группы на 1 СВС в консервативном регионе II шпильки (A–U → G–C, 3 п.н.). C. vulgaris имела еще 1 СВС при сравнении с C. heliozoae и С. rotunda в III шпильке (U–A → → G–G, 3 п.н.). L. lobophora также отличалась от всех видов группы, кроме C. heliozoae, на 1 СВС в консервативном регионе I шпильки (U–A → C–G, 4 п.н.). У Coronastrum ellipsoideum и Dictyosphaerium sp. была отмечена 1 общая СВС в III шпильке (A–U → G–C, 24 п.н.), присущая только этой подгруппе. Кроме того, C. ellipsoideum имел еще одну специфическую СВС в III шпильке (A–U → → G–C, 23 п.н.), которая больше не встречалась ни у одного представителя группы.
Группа II. Отличительной особенностью всех представителей группы II является формирование колоний (за исключением одиночной Chlorella singularis), в которых шаровидные, овальные или широко эллипсоидные клетки соединены слизистыми тяжами. Количество клеток в колонии в целом варьирует от 4 до 64. Колонии окружены слизистой оболочкой. Клетки не продуцируют щетинки. Кроме чашевидного, широко распространен блюдцевидный хлоропласт. Пиреноид окружен, как правило, 2 крахмальными скорлупками. Размножение осуществляется автоспорами, которые после разрыва материнской оболочки в большинстве случаев прикрепляются к ее концам. Представители – преимущественно свободноживущие пресноводные организмы (Bock et al., 2010, 2011a). На филогенетическом дереве группа имеет статистическую поддержку 71% и включает в себя:
– C. pulchelloides (3 штамма, в т.ч. аутентичный штамм CCAP 211/117). Отличается часто встречающейся яйцевидной формой клеток, в особенности молодых; прикреплением клеток к слизистым тяжам широкой стороной; горизонтальным расхождением (либо под небольшим наклоном) автоспор после разрушения материнской оболочки (Bock et al., 2011a); наличием в гене 18S рРНК трех интронов длиной 420, 436 и 431 п.н. соответственно;
– аутентичный штамм C. chlorelloides CCAP 211/116. К характерным признакам относятся 4-х клеточные колонии, расхождение автоспор после разрушения материнской оболочки под углом 180° (Bock et al., 2011a);
– аутентичный штамм C. colonialis UTEX 938. Данный вид отличает следующая совокупность признаков: клетки овальные или широкоэллипсоидные, которые соединяются слизистыми тяжами; автоспоры после разрушения материнской оболочки расходятся под наклоном или горизонтально (Bock et al., 2011a); в составе гена 18S рРНК присутствует один интрон длиной 318 п.н. Типичное местообитание неизвестно;
– аутентичный штамм C. singularis CCAP 211/119. Диакритические признаки: клетки одиночные, шаровидные, в слизистой оболочке; размер взрослых клеток наибольший в группе II – 6.7–9 мкм в диаметре; после разрыва материнской оболочки автоспоры расходятся в разные стороны (Bock et al., 2011a);
– род Hindakia, выделенный на основании результатов молекулярно-генетического анализа, со 100%-й статистической поддержкой объединяет штаммы двух видов: H. fallax (2 штамма, включая аутентичный штамм CCAP 222/29) и типовой вид рода H. tetrachotoma (4 штамма, в т.ч. аутентичный штамм CCAP 222/80). Виды различаются формой молодых клеток: у H. fallax – ассиметрично копьевидная, у H. tetrachotoma – узкоовальная форма (Bock et al., 2010);
– сестринской подгруппой к роду Hindakia является род Heynigia (статистическая поддержка 85%). Этот род также был выделен на основании данных молекулярно-генетического анализа и включает аутентичные штаммы H. riparia CCAP 222/4 и H. dictyosphaerioides CCAP 222/2D (типовой вид рода). Отличительным признаком видов внутри рода являются размеры клеток: у H. riparia размер клеток составляет 5–7.5 мкм в диаметре, у H. dictyosphaerioides – 4.5–6 мкм (Bock et al., 2010).
Внутривидовые различия нуклеотидных последовательностей 18S–ITS1–5.8S–ITS2 в группе II составляли 0–0.3%, межвидовые – 0.4–1.5%, межродовые – 1–1.6%. Обобщая результаты изучения морфологических, экологических и молекулярно-генетических признаков, можно предположить, что виды C. pulchelloides, C. chlorelloides, C. colonialis и C. singularis не являются “истинными” хлореллами. Вероятно, это представители нового рода. Однако, исходя из величины генетических дистанций (0.9–1.5%) в сравнении с величинами внутривидовых и межродовых различий нуклеотидных последовательностей для всей клады Chlorella и неспособности C. singularis формировать колонии, мы предполагаем, что это может быть и группа близкородственных родов. Поэтому таксономическая принадлежность этих видов нуждается, на наш взгляд, в дальнейшем изучении и уточнении.
CBC-подход для разграничения видов, как и в случае с группой I, оказался неэффективен. При анализе вторичной структуры ITS2 в консервативных регионах только у штаммов C. pulchelloides и C. colonialis была обнаружена 1 CBC (U–A → C–G, 19 п.н.) в III шпильке, отличающая их от всех остальных штаммов группы. Молекулярной подписью микроводорослей рода Hindakia может быть более длинный пиримидин-пиримидиновый мисматч (UUU–UUU – у H. tetrachotoma, UUU–UCU – у H. fallax) во II шпильке ITS2.
Группа III морфологически весьма разнородна (статистическая поддержка – 97%) и объединяет виды как с одиночными клетками, так и колониальные. Преимущественно не продуцируют щетинки. Хлоропласт один, пристенный, чаше- или блюдцевидный. Пиреноид один с фрагментированной крахмальной обверткой. Размножение осуществляется автоспорами. Среди представителей клады встречаются как свободноживущие, так и симбиотические организмы (Hindák, 1974; Hoshina, Fujiwara, 2013; Hoshina et al., 2017; Hoshina, Nakada, 2018):
– род Carolibrandtia, представленный типовым видом C. ciliaticola (3 штамма, в т. ч. аутентичный штамм NIES 4033), который образует с Chlorellaceae sp. одну подгруппу со 100%-ной статистической поддержкой. Отличительными чертами являются субглобулярный пиреноид, потребность в казаминовых кислотах для роста и жизнедеятельности, эндосимбионтический образ жизни в инфузориях пресноводных водоемов (Hoshina et al., 2017; Hoshina, Nakada, 2018) и наличие интрона длиной 339 п.н. в гене 18S рРНК;
– штамм Chlorella sp. CCCryo 297-06, который является сестринской филогенетической линией рода Carolibrandtia, отличается свободноживущим образом жизни и отсутствием интрона в гене 18S рРНК;
– род Didymogenes с 97%-ной статистической поддержкой объединяет штаммы 3 видов: аутентичный штамм D. sphaerica NIES 2167, штамм D. palatina SAG 30.92 (типовой вид рода) и D. anomala SAG 18.91. Характерными чертами рода являются, как правило, сигмовидные клетки, соединенные в 2–16-клеточные ценобии; при бесполом размножении образуется спорангий с автоспорами, собранными в 2-х или 4-клеточные ценобии (Hindák, 1974; Hoshina, Fujiwara, 2013). D. sphaerica отличается от других видов рода одиночными шаровидными клетками и наличием интрона длиной 448 п.н. в гене 18S рРНК. Характерной чертой D. palatina является наличие интрона длиной 317 п.н. в гене 18S рРНК, D. anomala – отсутствие интрона в гене 18S рРНК и способность продуцировать щетинки. Представители рода Didymogenes являются пресноводными свободноживущими организмами, за исключением D. sphaerica, для которого типичное местообитание не установлено;
– аутентичный штамм Chlorella elongata CCAP 222/18. Отличительными являются следующие признаки: клетки овальные, образуют колонии, соединяясь слизистыми тяжами, наличие двух интронов длиной 490 и 326 п.н. в гене 18S рРНК (Bock et al., 2011). Является пресноводным свободноживущим организмом;
– некультивируемая микроводоросль Chlorella sp., близкородственная к C. elongata (статистическая поддержка 97%), отличается обитанием в соленой воде и отсутствием интронов в гене 18S рРНК;
Внутривидовые генетические различия в группе III не превышали 0.1%, межвидовые варьировали в диапазоне от 0.5 до 0.8%, межродовые – в пределах 0.9–1.4%. При этом, исходя из результатов филогенетического анализа и величины внутривидовых и межродовых генетических дистанций для всей клады Chlorella, штамм Chlorella sp. CCCryo 297-06 может рассматриваться как потенциально новый самостоятельный вид р. Carolibrandtia, а Chlorella elongata и Chlorella sp. (MK764913; MK764922) – как виды, относящиеся к одному роду.
CBC-подход для разграничения видов и родов в данном случае оказался неприменим, поскольку при анализе вторичной структуры ITS2 СВС в консервативных регионах обнаружено не было.
Группа IV состоит из монотипного рода Meyerella и включает в себя 2 штамма типового вида Meyerella planktonica, в т.ч. аутентичный штамм CCMP 2446. Отличительными признаками рода являются цилиндрическая или шаровидная форма зрелых клеток; пластинчатый хлоропласт в молодых клетках, корытоотбразный в зрелых; отсутствие пиреноида; угловато-элипсоидальные автоспоры, которые затем превращаются в короткий цилиндр с закругленными концами (Fawley et al., 2005).
Внутривидовые различия в нуклеотидных последовательностях отсутствовали, межродовые различия с остальными группами клады Chlorella составляли 1.5–2.6%.
Анализ вторичной структуры ITS2 не выявил каких-либо различий в консервативных регионах в пределах группы IV.
Группа V с 78%-ной статистической поддержкой объединяет микроводоросли с одиночными, преимущественно шаровидными клетками без слизи и щетинок. Кроме чашевидного, широко распространен блюдцевидный или поясковидный хлоропласт. Крахмальная обвертка в большинстве случаев фрагментирована на 2–4 скорлупки. Размножение осуществляется автоспорами. Все представители клады являются свободноживущими организмами, обитающими, преимущественно, в пресноводных водоемах, реже почве или наземно-воздушной среде (Shihira, Krauss, 1965; Bock et al., 2011):
– С. sorokiniana (аутентичный штамм SAG 211-8k и неаутентичные штаммы NIES 2173, CCALA 260, KLL-G018). Отличительной чертой является преимущественно эллипсоидальная форма клеток, которая при повышенном содержании глюкозы в среде становится шаровидной (Shihira, Krauss, 1965);
– аутентичный штамм C. lewinii CCAP 211/90. Характерные признаки – наличие клеток яйцевидной формы и почвенная среда обитания (Bock et al., 2011);
– отдельную подгруппу со статистической поддержкой 100% образуют неаутентичный штамм С. sorokiniana UTEX 2714, который на сайте коллекции обозначен как С. vulgaris, и штаммы Chlorella sp. ZJ0203, ZJ0204, IFRD 1014, ZJ0205. Данная подгруппа не имеет характерных морфологических признаков и отличается от остальных видов независимым филогенетическим положением;
– самостоятельную филогенетическую линию образует штамм Chlorella sp. IFRPD 1018, который со статистической поддержкой 100% кластеризуется с группой, включающей штаммы С. sorokiniana и C. lewinii. Штамм Chlorella sp. CCAP 211/86 примыкает к их кластеру (статистическая поддержка 70%). Штаммы нуждаются в дополнительном изучении и валидации;
– аутентичный штамм C. thermophila HTA1-65, диакритическими признаками которого являются двуслойная гладкая клеточная стенка, наименьший в группе IV размер клеток (1.5–2.5 мкм в диаметре), наличие в цитоплазме клеток липидных капель, термотолерантность (выдерживает температуру до 45°С), наземно-воздушное распространение и свободноживущий образ жизни (изолирован с обрастаний крыш) (Ma et al., 2015);
– сестринскую филогенетическую линию с C. thermophila образует Chlorella sp. IPPAS C1210 (статистическая поддержка 100%). Отличительные признаки: наличие интрона длиной 440 п.н. в составе гена 18S рРНК и свободноживущий образ жизни в пресной воде;
– аутентичный штамм CCAP 211/120 C. volutis, характеризующийся исключительно шаровидной формой клеток и их размером (5–6.5 мкм в диаметре), который является наибольшим в группе IV (Bock et al., 2011).
Различия внутри кластеров, которые можно рассматривать как потенциальные виды, нуждающиеся в дополнительном изучении и валидации (1-ый вид – C. sorokiniana KLL-G018, CCALA 260, NIES-2173 и аутентичный штамм SAG 211-8K; 2‑ой вид – C. sorokiniana ZJU0203, ZJU0204, IFRPD 1014, ZJU0205, UTEX 2714), составляли 0–0.3%. Межвидовые различия, с учетом выделения вышеуказанных потенциально новых видов, варьировали в пределах от 0.5–2.4%. Обобщая итоги изучения морфологических, физиологических, экологических и молекулярно-генетических характеристик представителей группы V, можно сказать, что, во-первых, согласно филогенетическому анализу все представители данной группы “истинными” хлореллами не являются. Во-вторых, вероятно, данная группа содержит несколько новых родов. Можно предположить, что в один род входят C. sorokiniana KLL-G018, CCALA 260, NIES-2173 и аутентичный штамм SAG 211-8K; 2-ой вид – C. sorokiniana (ZJU0203, ZJU0204, IFRPD 1014, ZJU0205, UTEX 2714); С. lewinii (генетеческие дистанции в данной подгруппе ≤0.7%). C. thermophila, Chlorella sp. IPPAS C1210, C. volutis могут быть как видами одного рода, так и представителями близких родов, т.к. генетическая дистанция между ними составляет 1.9–2.0%. Для выдвижения более или менее обоснованных предположений о таксономическом статусе штаммов Chlorella sp. IFRPD 1018 и Chlorella sp. CCAP 211/86 информации пока не достаточно.
СBC-подход, как и в предыдущих группах, оказался неэффективен. При анализе вторичной структуры ITS2 CBC были обнаружены лишь у C. thermophila: 1 CBC (U–A → C–G, 3 п.н.) в консервативном регионе I шпильки и 2 CBC (A–U → → G–C, 7 п.н.; G–C → A–U, 2 п.н.) в III шпильке, а также у Chlorella sp. IPPAS C-1210: 2 CBC (A–U → → G–C, 7 п.н.; G–C → A–U, 2 п.н.) в III шпильке.
Группа VI объединяет представителей рода Micractinium со статистической поддержкой 91% (рис. 2). Морфологически клада разнородна. Ранее главным фенотипическим признаком рода считалась способность формировать щетинки (Komárek, Fott, 1983). Однако на сегодняшний день известны виды, которые щетинки не продуцируют даже в условиях “пастбищной нагрузки” со стороны альгофагов (Luo et al., 2006). Клетки шаровидные или овальные, одиночные или собранные в колонии. Хлоропласт, как правило, пристенный, чаше- или блюдцевидный. Пиреноид один с крахмальной обверткой из 2–4 скорлупок. Размножение у большинства видов происходит 2–8 автоспорами. Среди представителей данной группы преобладают свободноживущие пресноводные организмы, однако встречаются и эндосимбионты. В состав группы входят:
– со 100%-статистической поддержкой отдельную подгруппу образуют аутентичный штамм М. singularis KSF0094, аутентичный штамм M. variabile KSF0085, 4 штамма Micractinium simplicissimum, в т.ч. аутентичный штамм KSF0112, 2 штамма M. inermum (аутентичный штамм NIES 2171). Данная подгруппа объединяет виды с одиночными клетками, шаровидными или овальными, преимущественно без слизи. Из всех представителей подгруппы только M. variabile способен продуцировать щетинки в условиях “пастбищной” нагрузки. Наряду с чашевидным, распространен поясковидный хлоропласт. Виды выделены на основании данных молекулярно-генетического анализа (Hoshina, Fujiwara, 2013; Chae et al., 2019);
– сестринскую филогенетическую линию к вышеописанной подгруппе образует некультивируемая зеленая микроводоросль Chlorophyta clone PA2009C7 (статистическая поддержка 85%). Пресноводный свободноживущий организм;
– M. pusillum (5 штаммов, в т.ч. аутентичный штамм CCAP 248/5) – типовой вид рода Micractinium. Диакритические признаки: формирование полиэдрических и тетраэдрических колоний; способность клеток под давлением альгофагов продуцировать щетинки, половое размножение (оогамия) (Komárek, Fott, 1983; Luo et al., 2006);
– аутентичный штамм M. bornhemiensis NIES 455 и неаутентичный штамм M. pusillum CCAP 248/3 формируют общую подгруппу со статистической поддержкой 100%. Отличительными чертами являются способность клеток формировать правильные пирамидальные ценобии и продуцировать щетинки, автоспоры по 4 (Komárek, Fott, 1983);
– отдельную филогенетическую линию образует штамм Micractinium sp. GB1k, который близкородственен M. pusillum, M. bornhemiensis, Micractinium sp. CCAP 248/7 (статистическая поддержка 71%). Пресноводный свободноживущий организм;
– M. belenophorum (2 штамма, в т.ч. аутентичный штамм SAG 42.98). Морфологические особенности данного вида: одиночные, овальные клетки с длинными щетинками на концах, которые размещены по одной прямой линии, и пластинчатый хлоропласт (Pröschold et al., 2010);
– Micractinium sp. CCAP 248/14 образует отдельную филогенетическую линию в кладе VI. Свободноживущий пресноводный организм;
– M. conductrix (4 штамма, включая аутентичный штамм SAG 241.80). Характерные черты: одиночные шаровидные клетки, которые не продуцируют щетинки даже при “пастбищной” нагрузке; размер 4–12 мкм в диаметре, хлоропласт может быть блюдцевидным и мантиевидным, пиреноид с крахмальной обверткой из 2–4 скорлупок; для роста и нормального обеспечения процессов жизнедеятельности необходимы витамины B1 и B12 (Pröschold et al., 2011). Единственный в группе облигатный эндосимбионт с интроном в гене 18S рРНК длиной 323 п.н.;
– выделенный нами штамм Chlorella sp. ACSSI 198 со 100%-ной статистической поддержкой образует группу с M. conductrix, морфологически с ним близок формой клеток и отсутствием щетинок. Отличительными признаками являются меньшие размеры клеток (2.9–4.7 мкм в диаметре), форма хлоропласта только чашевидная, пиреноид со сплошной крахмальной обверткой, при культивировании не испытывает потребности в витаминах группы B, а также является свободноживущим пресноводным организмом. Кроме того, в составе гена 18S рРНК отсутствует интрон;
– штамм Micractinium sp. CCAP 211/11F является сестринской филогенетической линией вида M. conductrix и отличается от последнего образом жизни (симбионт в лишайнике) и отсутствием интрона в гене 18S рРНК;
Внутривидовые различия нуклеотидных последовательностей 18S–ITS1–5.8S–ITS2 у представителей группы VI варьировали в пределах от 0 до 0.9%, межвидовые – 0.4–1.9%. Отметим, что уровень генетических различий внутри вида М. pusillum (1 группа – штаммы CCAP 248/3, SAG 13.81 и аутентичный штамм CCAP 248/5; 2 группа – штаммы SAG 48.93 и 72.98) составлял 0.9%, что в других группах (II, III) соответствовало различиям межвидового уровня. Это позволяет предположить, что, возможно, М. pusillum включает в себя 2 вида.
При сравнении вторичной структуры ITS2 между видами группы VI было выявлено, что виды М. singularis, M. variabile, M. simplicissimum, M. inermum отличаются от всех других представителей группы 1 СВС в III шпильке (A–U → C–G, 23 п.н.). Еще 1 характерная СВС для Micractinium simplicissimum, отличающая данный вид от всех, кроме М. singularis, M. variabile, Micractinium sp. CCAP 248/14, находится в консервативном регионе II шпильки (A–U → G–C, 3 п.н.). М. simplicissimum и M. inermum различаются на 1 СВС в III шпильке (G–C → A–U, 18 п.н.). Штаммы M. pusillum CCAP 248/5, CCAP 248/3, SAG 13.81 по сравнению с остальными представителями рода имеют 1 CBC в консервативном регионе I шпильки (A–U → G–C, 3 п.н.), штаммы M. pusillum SAG 48.93 и 72.98 – 1 CBC в консервативном регионе II шпильки (U–A → C–G, 9 п.н.). 2 СВС были обнаружены у штамма Micractinium sp. CCAP 246/14 в консервативных регионах II (U–A → C–G, 5 п.н), и III шпилек (A–U → G–C, 3 п.н.). При этом между целым рядом видов СВС не были обнаружены. Например, между М. singularis, M. variabile, M. simplicissimum не было обнаружено СВС в консервативных регионах вторичной структуры ITS2. Также не было СВС между M. inermum, М. singularis и M. variabile; между M. conductrix, M. belenophorum, M. bornhemiensis, Chlorella sp. ACS-SI 198 (вторичная структура ITS2 представлена на рис. S2 ), Micractinium sp. CCAP 211/11F.
Таким образом, в группе VI CBC-подход оказался частично пригоден для разделения некоторых видов рода Micractinium. Наряду с этим были обнаружены CBC в консервативных регионах между штаммами одного вида (M. pusillum), что подтверждает наше предположение о необходимости его разделения на 2 вида.
Клада VII объединяет представителей рода Actinastrum и состоит из 2 штаммов вида Actinastrum hantzschii (CCAP 200/1, SAG 2015), который является типом рода. Представители данной группы характеризуются вытянутой формой клеток, способны формировать трехмерные, звездообразные колонии. Клетки имеют радиально симметричное расположение и связаны друг с другом на проксимальных полюсах. В культурах колонии распадаются, и клетки становятся короче. Хлоропласт пристенный, с одним, не всегда отчетливым пиреноидом. Размножение автоспорами. Представители – преимущественно обитатели пресноводных водоемов (Luo et al., 2010). Штаммы в группе различаются длиной интрона в гене 18S рРНК: у штамма CCAP 200/1 – 599 п.н., у штамма SAG 2015 – 353 п.н.
Внутривидовая генетическая дистанция между штаммами составила 0.2%. Межродовая дистанция с другими членами клады Chlorella варьировала в диапазоне от 0.9 до 2.8%. СВС в консервативных регионах вторичной структуры ITS2 найдено не было.
Клада VIII объединяет представителей рода Hegewaldia и включает в себя 2 штамма типового вида Hegewaldia parvula, в т.ч. аутентичный штамм CCAP 283/2, Hegewaldia sp. CCAP 283/3 и M. pusillum SAG 7.93. Однако в последнем случае, вероятно, имело место неверное таксономическое определение штамма. Данный род характеризуется сочетанием следующих признаков: клетки одиночные, шаровидные, со щетинками или без них; размножение осуществляется как бесполым путем (автоспорами), так и половым – оогамией (Pröschold et al., 2011).
Внутригрупповые различия в нуклеотидных последовательностях варьировали в диапазоне 0–2.2%, межродовые различия с другими представителя клады Chlorella – 1.5–4.1%.
При сравнительном анализе вторичной структуры ITS2 было выявлено наличие одной CBC (U–A → C–G, 3 п.н.) в III шпильке штамма Hegewaldia sp. CCAP 283/3, по сравнению со штаммами H. parvula.
В целом, отметим, что CBC-критерий работает только в одном направлении, т.е. отсутствие CBC во вторичной структуре ITS2 не свидетельствует, что 2 организма принадлежат одному виду (Coleman, 2009). На основе мета-анализа большого числа данных Müller et al. (2007) установили, что наличие даже 1 CBC в 93% исследованных случаев, по крайней мере, для растений и грибов, указывает на их принадлежность к разным видам. Этими же авторами показано, что отсутствие CBC между 2 таксонами свидетельствует, что только в 77% случаев они принадлежат одному виду. Так как наличие/отсутствие CBC во вторичной структуре ITS2 сильно коррелирует с биологическими видами, авторы предложили использовать этот критерий как молекулярный индикатор для разделения минимального количества отдельных видов в метагеномных анализах. CBC-критерий может быть успешно использован для разграничения видов зеленых водорослей, размножающихся как половым, так и бесполым путем. Так как компенсаторная замена в консервативных регионах ITS2 – редкое эволюционное событие (Coleman, 2003), то наличие CBC является скорее мерой истекшего эволюционного времени, показывающее, что прошло достаточно времени для события видообразования, а не его необходимым условием. Ожидаемое количество CBC зависит от степени дивергенции, длины последовательности и скорости замен на участок.
Анализ генетических дистанций между различными представителями клады Chlorella позволил выявить четкие границ для разграничения видов и родов только у части таксонов (так внутри родов Didymogenes, Hindakia, Heynigia генетические дистанции между видами варьировали 0.4 до 0.8%). С другой стороны, уровень различий в исследуемом фрагменте между родами Didymogenes и Carolibrandtia изменялся в диапазоне 0.9–1.4%, между родами Hindakia и Heynigia 1.0–1.3%, тогда как генетическая дистанция между видами рода Hegewaldia составляла 2.2%. Подобные примеры не позволяют выделить общие и однозначные межвидовые и межродовые генетические пороги для всех представителей клады Chlorella.
Поиск эффективного универсального инструмента для выявления скрытого биоразнообразия микроводорослей клады Сhlorella продолжается. Так, Zou et al. (2016) была предпринята попытка идентификации представителей родов Сhlorella, Chloroidium, Dictyosphaerium и Actinastrum с помощью 4-х молекулярных маркеров (rbcL, ITS, tufA и 16S рРНК) и различных методов делиминации видов (GMYC, PTP, P ID, ABGD и символьный подход). В результате исследования был сделан вывод, что ген tufA может рассматриваться как потенциально пригодный “штрих-код” для микроводорослей клады Сhlorella. При этом было отмечено, что ДНК-баркодинг не всегда позволяет проводить идентификацию неизвестных образцов на уровне видов. Авторы подчеркнули, что для ДНК-баркодинга необходима большая выборка таксонов, чтобы обеспечить наличие заметного разрыва штрих-кода между межвидовой дивергенцией и внутривидовой изменчивостью, а также для подтверждения существования диагностических молекулярных признаков. Следовательно, несмотря на перспективность применения алгоритмов делиминации видов, они требуют как собственного дальнейшего развития, так и описания большего количества таксонов исследуемой группы организмов.
В данной работе на основе филогенетического анализа была подтверждена полифилетичность рода Chlorella. Мы предполагаем, что истинными представителями данного рода могут считаться виды группы I, которые кластеризуются с типовым видом рода – C. vulgaris, а именно: C. pituita, C. variabilis, L. lobophora, C. rotunda и C. heliozoae. Причем далеко не все виды этой группы описаны. Так, Dictyosphaerium sp. и Coronastrum ellipsoideum UTEX LB1382, вероятно, являются новыми, пока неидентифицированными представителями рода Chlorella. Остальные виды рода, определенные как Chlorella, но вошедшие в состав групп II–V, по-видимому, “истинными” хлореллами не являются, и их таксономическая принадлежность нуждается в дальнейшем изучении и уточнении.
Определенные расхождения с топологиями филогенетических деревьев ревизий (Luo et al., 2010; Pröschold et al., 2010; Bock et al., 2011a, 2013), в т.ч. кластеризация всех видов рода Сhlorella в одну группу c невысокими статистическими поддержками, было связано с большим количеством проанализированных последовательностей в нашей работе. Так, в изученную выборку вошли представители родов Carolibrandtia и Hegewaldia, расширен видовой состав родов Didymogenes, Micractinium, Chlorella, а также добавлены новые штаммы уже имеющихся видов, и штаммы, видовая принадлежность которых пока не установлена. Расширение выборки штаммов для филогенетического анализа позволило выделить группы клады Chlorella с высокими статистическими поддержками. При этом кластеры видов, которые в прошлых ревизиях имели высокую статистическую поддержку (≥70%), повторяются и в полученном дереве. Например, кластеризация C. vulgaris + C. pituita, C. pulchelloides + C. chlorelloides, C. rotunda + C. heliozoae, C. lewinii + C. sorokiniana. Отмечаются существенные расхождения в топологии дерева Heeg, Wolf (2015), как с деревом в работе Bock et al. (2011a, 2013), так с деревом в нашем исследовании. Это связано, во-первых, с тем, что в своей работе Heeg и Wolf используют только ген 18S рРНК и спейсер ITS2, а во-вторых, с составом и размером выборки. При построении филогенетического дерева 18S + ITS2 Heeg и Wolf используют 60 нуклеотидных последовательностей, 34 из которых относятся к кладе Chlorella. Кроме того, в анализе использованы неаутентичные штаммы Micractinium inermum NLP-F014 (KF597304), C. pulchelloides CCAP 211/17 (HQ111430), C. pituita ACOI 856 (FM205856), Crucigenia lauterbornia UTEX 1755 (JQ356710), H. tetrachotoma CCAP 222/54 (GQ487238), H. tetrachotoma CCAP 222/82 (GQ487232), Coronastrum ellipsoideum UTEX LB 1382 (GQ507370), тогда как аутентичные штаммы данных видов отсутствуют. В отличие от нашей работы не представлены роды Carolibrandtia, Meyerella, отсутствует ряд видов Сhlorella thermophila, Micractinium simplicissimum, M. variabile, M. singularis, M. bornhemiensis, а также ряд идентифицированных до рода таксонов, иллюстрирующих, на наш взгляд, криптическое разнообразие клады Chlorella. Различия в топологии филогенетических деревьев Ma et al. (2015) (объем выборки – 32 штамма), Darienko et al. (2019) (объем выборки 69 штаммов, из них к Chlorella-кладе относились 9 штаммов), Chae et al. (2019) (объем выборки 45 штаммов, из них к Chlorella-кладе относились 39 штаммов) объясняется меньшим объемом выборки, отсутствием представителей ряда видов и родов, а также, в отдельных случаях, невключением аутентичных штаммов (Chlorella pituita ACOI 856, C. pulchelloides SAG 222-2а, Micractinium pusillum CCAP 248/1 в работе Ma et al.).
Таким образом, для членов клады Chlorella характерно высокое криптическое разнообразие: ни одна из рассмотренных фенотипических характеристик по отдельности не позволяет однозначно определить таксономическую принадлежность водорослей клады. Кроме того, многие описанные морфологические признаки (слизь, соединительные тяжи, формирование колоний, щетинкообразование) представляют собой адаптивную реакцию на воздействие окружающей среды и чрезвычайно вариабельны. Особенно важно, что для осуществления мониторинговых наблюдений в результате методических манипуляций при пробоподготовке (фильтрация вакуумным насосом, фиксация формалином) данные признаки часто изменяются или полностью утрачиваются.
Молекулярно-филогенетический анализ членов клады Chlorella показал, что использование одного гена 18S рРНК, который считается главным филогенетическим маркером для зеленых микроводорослей, не позволяет надежно разграничить виды и роды внутри клады. Использование дополнительных, более изменчивых спейсеров ITS1 и ITS2, разрешило топологию дерева и усилило филогенетический сигнал. СВС-подход и поиск компенсаторных замен в консервативных регионах ITS2 как инструмент для разграничения видов не был эффективен. Была подтверждена результативность использования интрона в качестве критерия разделения близкородственных видов. Анализ генетических дистанций позволил однозначно разделить штаммы на виды только внутри родов Didymogenes, Hindakia, Heynigia. Таким образом, поиск эффективного универсального инструмента для выявления скрытого биоразнообразия микроводорослей клады Сhlorella продолжается. Благодаря использованию комбинаций морфологических, биохимических, ультраструктурных, физиологических, экологических и молекулярно-гетенетических признаков (полифазный подход), нам удалось охарактеризовать восемь групп внутри клады Chlorella и выдвинуть предположения о разделении родов и видов внутри выделенных групп.
Список литературы
Корнева Л.Г. Фитопланктон водохранилищ бассейна Волги / Под ред.Копылова А.И. Кострома: Костромской печатный дом, 2015. 284 с.
Кривина Е.С. Трансформация фитопланктона малых водоемов урбанизированных территорий в условиях изменения антропогенной нагрузки. Автореферат дис. … канд. биол. наук, 16.11.2018. Тольятти: ИЭВБ РАН, 2018. 19 с.
Методика изучения биогеоценозов внутренних водоемов / Под ред. Мордухай-Болтовского Ф.Д. М.: Наука, 1975. 240 с.
Bock C., Krienitz L., Pröschold T. Taxonomic reassessment of the genus Chlorella (Trebouxiophyceae) using molecular signatures (barcodes), including description of seven new species // Fottea. 2011a. V. 11. P. 293–312.
Bock C., Pažoutová M., Krienitz L. Phylogenetic position of Coronastrum ellipsoideum and description of Parachlorella hussii sp. nov. // Biologia. 2011b. V. 66. P. 585–594.
Bock C., Proschold T., Krienitz L. Two new Dictyosphaerium-morphotype lineages of the Chlorellaceae (Trebouxiophyceae): Heynigia gen. nov. and Hindakia gen. nov. // Eur. J. Phycol. 2010. V. 45. P. 267–277.
Caisová L., Marin B., Melkonian M. A consensus secondary structure of ITS2 in the Chlorophyta identified by phylogenetic reconstruction // Protist. 2013. V. 164. P. 482–496.
Coleman A.W. ITS2 is a double-edged tool for eukaryote evolutionary comparisons // Trends Genet. 2003. V. 19. Iss. 7. P. 370–375.
Coleman A.W. Is there a molecular key to the level of “biological species” in eukaryotes? A DNA guide // Mol. Phylogenet. Evol. 2009. V. 50. P. 197–203.
Coleman A.W. The significance of a coincidence between evolutionary landmarks found in mating affinity and a DNA sequence // Protist. 2000. V. 151. P. 1–9.
Chae H., Lim S., Kim H., Choi H.-G., Kim J.H. Morphology and phylogenetic relationships of Micractinium (Chlorellaceae, Trebouxiophyceae) taxa, including three new species from Antarctica // Algae. 2019. V. 34. P. 267–275.
Darienko T., Rad-Menéndez C., Campbel C., Pröschold T. Are there any true marine Chlorella species? Molecular phylogenetic assessment and ecology of marine Chlorella-like organisms, including a description of Droopiella gen. nov. // Syst. Biodivers. 2019. V. 17. P. 811–829.
Ettl H., Gärtner G. Syllabus der Boden-, Luft- und Flechtenalgen. Stuttgart: Gustav Fischer, 1995. 721 p.
Fawley M.W., Dean M.L., Dimmer S.K., Fawley K.P. Evaluating the morphospecies concept in the Selenastraceae (Chlorophyceae, Chlorophyta) // J. Phycol. 2006. V. 42. P. 142–154.
Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway, 2020. http://www.algaebase.org.
Hindák F. The chlorococcal algal genus Didymogenes Schmidle 1905 // Biologia. 1974. V. 29. P. 559–570.
Hoshina R., Fujiwara Y. Molecular characterization of Chlorella cultures of the National Institute for Environment Studies culture collection with description of Micractinium inermum sp. nov., Didymogenes sphaerica sp. nov. and Didymogenes soliella sp. nov. (Chlorellaceae, Trebouxiophyceae) // Phycol. Res. 2013. V. 61. P. 124–132.
Hoshina R., Iwataki M., Imamura N. Chlorella variabilis and Micractinium reisseri sp. nov. (Chlorellaceae, Trebouxiophyceae): Redescription of the endosymbiotic green algae of Paramecium bursaria (Peniculia, Oligohymenophorea) in the 120th year // Phycol. Res. 2010. V. 58. P. 188–210.
Hoshina R., Kobayashi M., Suzaki T., Kusuoka Y. Brandtia ciliaticola gen. et sp. nov. (Chorellaceae, Trebouxiophyceae) a commom symbiotic green coccoid of various ciliate species // Phycol. Res. 2017. V. 66. P. 76–81.
Hoshina R., Nakada T. Carolibrandtia nom. nov. as a replacement name for Brandtia Hoshina (Chlorellaceae, Trebouxiophyceae) // Phycol. Res. 2018. V. 66. P. 82–83.
Katana A., Kwiatowski J., Spalik K., Zakryś B., Szalacha E., Szymańska H. Phylogenetic position of Koliella (Chlorophyta) as inferred from nuclear and chloroplast small subunit rDNA // J. Phycol. 2001. V. 37. P. 443–451.
Komárek J., Fott B. Chlorophyceae (Grünalgen). Ordnung Chlorococcales // Die Binnengewässer. Bd 16, Tl 7. H. 1. Stuttgart, 1983. 1044 p.
Krienitz L., Hegewald E.H., Hepperle D., Huss V.A.R., Rohr T., Wolf M. Phylogenetic relationship of Chlorella and Parachlorella gen. nov. (Chlorophyta, Trebouxiophyceae) // Phycologia. 2004. V. 43. P. 529–542.
Luo W., Pflugmacher S., Pröschold T., Walz N., Krienitz L. Genotype versus phenotype variability in Chlorella and Micractinium (Chlorophyta, Trebouxiophyceae) // Protist. 2006. V. 157. P. 315–333.
Luo W., Pröschold T., Bock C. Krienitz L. Generic concept in Chlorella-related coccoid green algae (Chlorophyta, Trebouxiophyceae) // Plant Biol. 2010. V. 12. P. 545–553.
Ma S., Han B., Huss V.A.R., Hu X., Sun X., Zhang J. Chlorella termophyla (Trebouxiophyceae, Chlorophyta), a novel thermo-tolerant Chlorella species isolated from an occupied rooftop incubator) // Hydrobiologia. 2015. V. 760. P. 81–89.
Müller T., Philippi N., Dandekar T., Schultz J., Wolf M. Distinguishing species // RNA. 2007. V. 13. P. 1469–1472.
Pröschold T., Bock C., Luo W., Krienitz L. Polyphyletic distribution of bristle formation in Chlorellaceae: Micractinium, Diacanthos, Didymogenes and Hegewaldia gen. nov. (Trebouxiophyceae, Chlorophyta) // Phycol. Res. 2010. V. 58. P. 1–8.
Pröschold T., Darienko T., Silva P. C., Reisser W., Krienitz L. The systematics of “Zoochlorella” revisited employing an integrative approach // Environ. Microbiol. 2011. V. 13. P. 350–364.
Shihira I., Krauss R.W. Chlorella. Physiology and Taxonomy of Forty-One Isolates. Maryland: University of Maryland, College Park, 1965. P. 97.
White T.J., Bruns T., Lee S., Taylor J.W. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics // PCR Protocols: A Guide to Methods and Applications / Eds. Innis M.A., Gelfand D.H., Sninsky J.J., White T.J. San Diego: Acad. Press, 1990. V. 3. P. 315–322.
Wolf M., Krienitz L., Hepperle D. Phylogenetic position of Actinastrum hantzschii Lagerheim (Chlorophyta, Trebouxiophyceae) // Algol. Stud. 2002. V. 104. P. 59–67.
Yamamoto M., Kurihara I., Kawano S. Late type of daughter cell wall synthesis in one of the Chlorellaceae, Parachlorella kessleri (Chlorophyta, Trebouxiophyceae) // Planta. 2005. V. 221. P. 766–775.
Zou S., Fei C., Song J., Bao Y., He M., Wang C. Combining and comparing coalescent, distance and character-based approaches for barcoding microalgaes: a test with Chlorella-like species (Chlorophyta) // PLoS One. 2016. V. 11. P. 1–24. e0153833.
Дополнительные материалы
- скачать EMS_1.docx
- Таблица S1. Список штаммов зеленых микроводорослей, использованных в филогенетическом анализе
- скачать ESM_2.tiff
- Рис. S1. Укорененное филогенетическое дерево зеленых микроводорослей клады Chlorella, построенное методом максимального правдоподобия (ML), на основе последовательностей гена 18S рРНК (1779 п.н.). В качестве статистической поддержки узлов дерева указаны бутстреп-значения ML; значения <70% не показаны. Модель нуклеотидных замен: GTR + I + G.
- скачать ESM_3.tiff
- Рис. S2. Вторичная структура ITS2 штамма Chlorella sp. ACSSI 198.


