Микробиология, 2020, T. 89, № 6, стр. 675-687
Разнообразие и биотехнологический потенциал нитратредуцирующих бактерий из месторождений тяжелой нефти (Россия)
Е. М. Семенова a, А. П. Ершов a, Д. Ш. Соколова a, Т. П. Турова a, Т. Н. Назина a, *
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: nazina@inmi.ru
Поступила в редакцию 09.06.2020
После доработки 24.06.2020
Принята к публикации 25.06.2020
Аннотация
Нитраты отсутствуют в пластовой воде нефтяных резервуаров. В ряде нефтедобывающих компаний используется технология нагнетания нитрата в пласт для подавления коррозии стального оборудования и снижения концентрации сероводорода в нефтяном пласте. Эффективность применения этой технологии зависит от наличия в нефтяном пласте бактерий, способных восстанавливать нитрат до нитрита, подавляющего рост сульфатвосстанавливающих бактерий (СВБ), либо в пласт необходимо интродуцировать нитратредуцирующие бактерии, приспособленные к пластовым условиям. В настоящей работе определено филогенетическое разнообразие и потенциальная функциональная активность накопительных культур бактерий, восстанавливающих нитрат в среде с нефтью, полученных из нефтяных пластов Татарстана, и выделены бактерии, накапливающие нитрит в среде. Рост накопительных культур в среде с нефтью сопровождался образованием нитрита и снижением поверхностного и межфазного натяжения среды. Методом высокопроизводительного секвенирования V3–V4 региона гена 16S рРНК нитратредуцирующих культур показано преобладание в них Gammaproteobacteria, представленных бактериями рода Halomonas в культуре 5452-NR, и Pseudomonas, Stenotrophomonas и Escherichia–Shigella – в культуре 245D-NR. Анализ полученных библиотек гена 16S рРНК с помощью программы iVikodak позволил предсказать высокое потенциальное функциональное разнообразие бактерий в культурах, способность осуществлять денитрификацию с образованием нитрита и газообразных соединений азота и нитратредукцию с образованием нитрита и аммония и катаболизировать бензоат и другие ароматические соединения. Из культур было выделено 8 штаммов нитратредуцирующих бактерий родов Chromohalobacter, Halomonas, Bacillus, Nocardia, Gordonia, Ensifer и Pseudomonas, которые растут на н-алканах нефти в аэробных условиях. Вероятно, накопительные культуры в среде с нитратом и нефтью используют ароматические компоненты нефти. Бактерии родов Chromohalobacter и Halomonas могут быть использованы для интродукции в нефтяные пласты с низкой численностью нитратредуцирующих бактерий для восстановления нитрата до нитрита, снижения концентрации сульфида и подавления образования сероводорода сульфатвосстанавливающими бактериями в пласте.
Биодеградация нефти микроорганизмами нефтяного пласта рассматривается в качестве одного из процессов преобразования легкой кондиционной нефти в тяжелую нефть и битумы (Head et al., 2014). Органическое вещество нефти и продукты ее окисления, растворенные в пластовой воде, являются основными источниками углерода и энергии для микроорганизмов (Youssef et al., 2009). Акцепторами электронов в нефтяных пластах служат сульфат и углекислота; при заводнении пластов с нагнетаемой водой поступает растворенный кислород, что может способствовать окислению сульфидов железа и появлению Fе3+ в качестве акцептора электронов. Хотя бактерии, восстанавливающие нитраты, неоднократно выделяли из нефтяных пластов, эта функция в пласте, как правило, не реализуется, поскольку нитрат и другие окисленные соединения азота отсутствуют в пластовых водах.
При наличии сульфатов и сульфатвосстанавливающих бактерий (СВБ) и архей в пластовой воде основным терминальным процессом биодеградации нефти является сульфатредукция. Образующийся сероводород является токсичным соединением, вызывающим экологические проблемы и экономические потери вследствие коррозии стального оборудования, снижения качества нефти и нефтепродуктов, закупорки пластов сульфидами (Youssef et al., 2009; Gieg et al., 2011). Для борьбы с сульфатвосстанавливающими бактериями используют ингибиторы и бактерициды; однако их применение дает временный эффект при существенных затратах (Jenneman et al., 1999). В настоящее время ведется поиск дешевых экологически безопасных технологий подавления роста СВБ.
В ряде нефтедобывающих компаний используется биотехнология подавления роста сульфидогенных прокариот и снижения концентрации сероводорода, основанная на активизации нитратредуцирующих бактерий посредством нагнетания нитрата или нитрита в пласт (Youssef et al., 2009; Gieg et al., 2011; Fida et al., 2016). Гетеротрофные нитратредуцирующие бактерии (гНРБ) конкурируют с сульфатвосстанавливающими бактериями за низшие жирные кислоты, часто присутствующие в пластовой воде (Grigoryan et al., 2008). Продукты восстановления нитрата вызывают повышение окислительно-восстановительного потенциала среды до величины, превышающей Eh –100 мВ, подавляя рост СВБ. Нитрит ингибирует активность фермента сульфитредуктазы, препятствуя восстановлению сульфата (Sunde, Torsvik, 2005; Hubert, Voordouw, 2007). В пластовых водах, содержащих сульфид, автотрофные сульфидокисляющие нитратредуцирующие (соНРБ) бактерии при поступлении нитрата могут окислять сульфиды до сульфата или элементной серы (Jenneman et al., 1999; Garcia-de-Lomas et al., 2007). Нитрит также химически взаимодействует с сульфидом, окисляя его до элементной серы. Состав нитратредуцирующего/денитрифицирующего сообщества и его воздействие на СВБ зависит от соотношения нитрата, сульфата, сульфида и легкоутилизируемых субстратов (например, ацетата) и солености среды (An et al., 2017).
Положительный эффект снижения концентрации сульфида показан при внесении нитратов в нефтяные пласты, расположенные в США и Канаде (Davidova et al., 2001; Cornish Shartau et al., 2010). В некоторых экспериментах численность СВБ снижалась незначительно, и после прекращения нагнетания нитратов сульфид вновь образовывался в пластовой воде (Jenneman et al., 1999). Обработка нитратами приводила к подавлению роста и снижению разнообразия СВБ в призабойной зоне нагнетательных скважин на месторождении Северного моря (Bødtker et al., 2009).
Процессы биогенного восстановления нитрата возможны при наличии нитратредуцирующих бактерий в пластовой воде (da Silva et al., 2014). В отличие от хемолитоавтотрофных, гетеротрофные денитрифицирующие бактерии (ДНБ) встречаются во многих заводняемых нефтяных пластах и могут подавлять рост СВБ (Eckford, Fedorak, 2002; Grigoryan et al., 2008). Из нефтяных пластов выделен ряд аэробных и факультативно анаэробных органотрофных бактерий родов Pseudomonas, Halomonas, Geobacillus, Marinobacter, Arcobacter, Thauera, способных осуществлять денитрификацию/нитратредукцию в средах с разными органическими субстратами (летучие кислоты, ароматические соединения). На сырой нефти эти бактерии обычно растут в аэробных условиях (Назина и соавт., 2005; Hubert, Voordouw, 2007; Mnif et al., 2009). Известны нитратредуцирующие бактерии Marinobacter sp. BC36 и Pseudomonas balearica BerOc6, использующие н-алканы нефти, однако они характеризуются низкой скоростью роста (Mbadinga et al., 2011). При денитрификации бактерии восстанавливают нитрат через стадию нитрита с образованием газообразных соединений азота NO, N2O и N2. Ряд бактерий диссимиляционно восстанавливает нитраты до нитрита и далее до аммония. Для подавления роста СВБ в нефтяном пласте наиболее перспективны штаммы, способные накапливать нитрит в среде. Активация существующих в пласте нитратредуцирующих бактерий может способствовать подавлению роста СВБ и снижению концентрации сульфида в пластовой воде. Ряд нефтяных пластов, особенно с высокоминерализованными водами, характеризуется низкой численностью аэробных органотрофных и нитратредуцирующих бактерий (Назина и соавт., 2013). Для таких месторождений перспективной является интродукция в пласт образующих нитрит штаммов, приспособленных к высокой солености среды.
Целью настоящей работы было определение филогенетического разнообразия и потенциальной функциональной активности накопительных культур бактерий, восстанавливающих нитраты в среде с нефтью, оценка влияния нитратов на образование сероводорода микроорганизмами пластовой воды из нефтяных месторождений Татарстана и выделение нитратредуцирующих бактерий, накапливающих нитрит в среде.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования. Пробы пластовой воды были отобраны летом 2016 и 2018 гг. из нагнетательных и добывающих скважин Черемуховского, Восточно-Анзирского и Ромашкинского нефтяных месторождений (Татарстан, Россия) (Nazina et al., 2020). Нефтяные пласты залегают на глубине от 1225 до 1650 м ниже уровня моря и имеют температуру от 20.2 до 40°С. Оригинальные пластовые воды этих месторождений высоко минерализованы. Для поддержания пластового давления в пласты нагнетают отделенную от нефти пластовую воду, смешанную с поверхностной пресной водой, поэтому в зоне смешения с нагнетаемой водой соленость пластовой воды снижается до 10–70 г/л. Нефть Восточно-Анзирского и Ромашкинского (Альметьевская площадь) нефтяных месторождений в поверхностных условиях имеет плотность 0.856 и 0.813 г/cм3 соответственно; нефть Черемуховского месторождения относится к группе тяжелой нефти и характеризуется высокой плотностью 0.932 г/cм3 (Nazina et al., 2020).
Получение накопительных и чистых культур. Накопительные культуры нитратредуцирующих/денитрифицирующих бактерий были получены посевом проб пластовой воды из добывающих скважин 245D и 5452 и нагнетаемой воды скважин 1010 и 5600 на минеральную среду (ММ) с нитратом и тяжелой нефтью. Cреда содержала (г/л дистиллированной воды): K2HPO4 – 1.5; NH4Cl – 1.0; KH2PO4 – 0.75; NaNO3 – 0.85, MgSO4 – 0.2; KCl – 0.1; CaCl2 · 2H2O – 0.02; 1 мл/л – микроэлементы; pH 7.0–7.2. При получении культур из нагнетаемой (5600 и 1010) воды в среду вносили 5 г NaCl/л. Культуры из пластовой воды (5452 и 245D) получали в среде, содержащей 45 г NaCl/л, близкой по солености пластовой воде в зоне этих скважин. Среду кипятили для удаления растворенного кислорода. Инкубировали во флаконах объемом 100 мл, содержащих 50 мл среды и аргон в качестве газовой фазы и закрытых пробками из бутиловой резины. В качестве субстрата использовали стерильную тяжелую нефть (1.0 об./об. %) Черёмуховского месторождения. Среду засевали пластовой водой 10% (об./об.). Посевы инкубировали в стационарных условиях в темноте при 28°С. Поскольку большинство денитрифицирующих бактерий способно расти аэробно, чистые культуры получали путем высева накопительных культур аэробно на плотную среду (триптон – 5.0 г/л, дрожжевой экстракт – 2.5 г/л, глюкоза – 1.0 г/л, агар-агар – 20.0 г/л) и последовательных пересевов выросших единичных колоний. Рост выделенных штаммов проверяли также в среде ММ в присутствии глюкозы (5.0 г/л), глицерина (2.0 г/л), лактата натрия (2.0 г/л) и этанола (2 об./об. %).
Аналитические методы. Анаэробный рост нитратредуцирующих бактерий контролировали по изменению содержания нитрата и нитрита в среде, оксида азота и молекулярного азота в газовой фазе и приросту белка в культуральной жидкости. Содержание нитрат-иона определяли с помощью ионселективного нитратного электрода и ионометра “Эксперт-001” (“Эконикс-Эксперт”, Москва, Россия). Концентрацию нитрит-иона измеряли с помощью тест-полосок Quantofix (“Macherey-Nagel”, Германия). Молекулярный водород и азот в газовой фазе определяли газохроматографически, концентрацию сульфида в среде определяли методом Пахмайра с N,N-диметил-p-фенилендиамином как описано ранее (Nazina et al., 2020). Белок в культуральной жидкости определяли методом Бредфорда. Величины поверхностного и межфазного натяжения на границах раздела фаз (культуральная жидкость/воздух и культуральная жидкость/гексадекан соответственно) определяли при комнатной температуре методом отрыва кольца с помощью полуавтоматического тензиометра Surface Tensiomat 21 (“Cole-Parmer”, США). Рост на нефти контролировали по изменению содержания н-алканов в деградированной нефти относительно контрольной пробы (Борзенков и соавт., 2006).
Выделение ДНК, амплификация и секвенирование гена 16S рРНК. ДНК из накопительных и чистых культур выделяли, используя набор Pure Link Microbiome DNA Purification KIT (“Thermo Fisher Scientific”, США) в соответствии с рекомендациями производителя. Для определения последовательности гена 16S рРНК чистых культур ДНК амплифицировали с использованием универсальных праймеров 8-27f и 1492r. Для получения библиотек генов 16S рРНК накопительных культур, выращенных анаэробно в среде с нефтью и нитратом, был амплифицирован V3–V4 гипервариабельный регион этого гена на основе двойного баркодирования, как описано ранее (Fadrosh et al., 2014). В работе использовали праймеры Pro341F–Pro805R (Takahashi et al., 2014). Секвенирование проводили на платформе MiSeq (“Illumina”, США) c использованием набора реагентов MiSeq Reagent Kit v3 (600 cycles) (“Illumina”, США) в соответствии с рекомендациями производителя.
Биоинформатический анализ. Полученные фрагменты генa 16S рРНК были обрезаны с использованием программы trimmomatic-0.36 по алгоритму SLIDINGWINDOW:4:15 (Bolger et al., 2014). Разные прочтения объединяли программой SeqPrep (https://github.com/jstjohn/SeqPrep). Для обнаружения химер и демультиплексирования использовали фильтры Qiime (Caporaso et al., 2010). Последовательности c уровнем сходства ≥98% объединяли в операционные таксономические единицы (OTE) и идентифицировали с использованием онлайн-ресурса SILVA. На основании данных о представленности родов в полученных библиотеках, были предсказаны функциональные характеристики бактериальных сообществ с использованием пакета программ iVikodak (Nagpal et al., 2019). Модуль Global Mapper базы данных KEGG использовали для получения функциональных профилей, а Local Mapper – для прогнозирования индивидуальных профилей ферментов метаболизма бензоата и азота, представленных у бактерий исследуемых микробных сообществ. Тепловые карты функциональных профилей и ферментов, предсказанных для сообществ, были построены с использованием интернет-ресурса ClustVis (http://biit.cs.ut.ee/clustvis/, май 2020 г.).
Последовательности гена 16S рРНК штаммов HO-A4, HO-A7, HO-A12, HO-A13, HO-A22, HO-A23, HO-A24, HO-A25, HO-A31 и TAT1 депонированы в базе данных NCBI под номерами MT279913, MT495615, MT495781, MT495793, MT495799, MT495800, MT496773, MT499214, MT498853 и MK478935. Библиотеки фрагментов генов 16S рРНК накопительных культур 245D-NR и 5652-NR депонированы в NCBI под номерами SRR11849213 и SRR11849214 соответственно.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение накопительных культур нитратредуцирующих бактерий в среде с нефтью. Накопительные культуры нитратредуцирующих/денитрифицирующих бактерий получали посевом пластовой воды из добывающих скважин 245D и 5452 и нагнетаемой воды скважин 1010 и 5600 на среду с нитратом и тяжелой нефтью. Общая соленость нагнетаемой воды была в интервале 0.6–4.7 г/л, а у пластовой воды достигала 187 г/л. Значения рН варьировали от 6.3 до 8.0. Скорость сульфатредукции в пробах пластовой воды из скважин 5452 и 245D составляла 13 и 1982 нг S2–/(л сут) соответственно. Гидрохимическая и микробиологическая характеристика пластовой воды приведена ранее (Nazina et al., 2020). В оригинальных пробах нагнетаемой и пластовой воды численность культивируемых аэробных органотрофных бактерий достигала, соответственно, 106 и 103–104 кл./мл (табл. 1). Значительная часть аэробных бактерий была способна использовать углеводороды. Нитратредуцирующие бактерии, растущие в среде с ацетатом, были выявлены в большинстве проб пластовых жидкостей. Численность СВБ в исследованных пробах не превышала 103 кл./мл.
Таблица 1.
Численность культивируемых аэробных (органотрофных и углеводородокисляющих) бактерий и анаэробных (нитратредуцирующих, бродильных и сульфатвосстанавливающих) бактерий в пробах нагнетаемой и пластовой воды
| Месторождение (расположение) | Номер скважины | Общая соленость пластовой воды, г/л | pH | Численность культивируемых микроорганизмов, кл./мл | ||||
|---|---|---|---|---|---|---|---|---|
| аэробные | анаэробные | |||||||
| АОБ | УОБ | НРБ | брод. | СВБ | ||||
| Восточно-Анзирское (г. Набережные Челны) | 1010* | 2.0 | 7.98 | ≥106 | 106 | 102 | 104 | 0 |
| 245D | Н.д. | 6.27 | 103 | 102 | 102 | 103 | 102 | |
| Черемуховское (г. Нурлат) | 5600* | 0.62 | 7.86 | ≥106 | 106 | Н.д.** | 106 | 0 |
| 5452 | 14.20 | 7.60 | 104 | 102 | 10 | 106 | 103 | |
| Ромашкинское (г. Альметьевск) | 20990* | 4.76 | 7.0 | ≥106 | 104 | 103 | 105 | 103 |
Полученные накопительные культуры нитратредуцирующих/денитрифицирующих бактерий, 245D_NR и 5452_NR, росли анаэробно в среде с нефтью, образуя небольшую биомассу, восстанавливали нитрат до нитрита (${\text{NO}}_{2}^{ - }$), N2O или N2 (рис. 1). Динамика изменения концентраций нитрата, нитрита и белка в среде была различной для культур. Культура 5600_NR, в отличие от 1010_NR, почти не накапливала нитрита в среде, восстанавливая нитраты до молекулярного азота (данные не представлены). Культуры 245D_NR и 5452_NR накапливали до 40–80 мг нитрита на 1 л среды, молекулярный азот не образовывали. Восстановление нитрата до молекулярного азота дает больший выигрыш в энергии по сравнению с восстановлением до нитритов, поэтому в культурах 5600 и 1010 образовалось больше белка микробной биомассы, чем в культурах из добывающих скважин. Однако анализ фракции алифатических углеводородов не выявил изменений в спектре н‑алканов (данные не представлены). Накопительные культуры в процессе роста с нефтью и нитратом снижали величину межфазного натяжения среды (против гексадекана) с 36 до 15–18 мН/м (рис. 2), что служит косвенным показателем роста микроорганизмов на нефти и образования поверхностно-активных веществ. Бактерии, снижающие поверхностное натяжение культуральных сред более чем на 10 мН/м, считаются перспективными в качестве продуцентов ПАВ. Образование био-ПАВ и биопленок ДНБ способствует более эффективному подавлению роста СВБ в условиях повышенного содержания сульфида в среде (Fan et al., 2020).
Рис. 1.
Содержание ${{\text{N}} \mathord{\left/ {\vphantom {{\text{N}} {{\text{NO}}_{{\text{3}}}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{{\text{3}}}^{ - }}}$ (⚫), ${{\text{N}} \mathord{\left/ {\vphantom {{\text{N}} {{\text{NO}}_{{\text{2}}}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{{\text{2}}}^{ - }}}$ (▲) и белка (◆) в среде с тяжелой нефтью и нитратом в процессе роста накопительных культур 1010_NR (а) и 5600_NR (б) из нагнетательных скважин и культур 245D_NR (в) и 5452_NR (г) из добывающих скважин.

Рис. 2.
Тепловая карта, показывающая сравнение функциональных профилей нитратредуцирующих накопительных культур с использованием пакета программ iVikodak. Метаболические пути превращения соединений азота и деградации бензоата и ароматических соединений, рассмотренные в статье, выделены рамкой.

Филогенетическое разнообразие и потенциальные функциональные характеристики накопительных культур нитратредуцирующих бактерий, полученных в среде с нефтью. Накопительные культуры бактерий 5452_NR и 245D_NR, инкубируемые в течение 180 сут в среде с нефтью и нитратом, были исследованы методом высокопроизводительного секвенирования V3–V4 региона гена 16S рРНК. В обеих культурах присутствовали бактерии филумов Proteobacteria, Firmicutes, Bacteroidetes и Actinobacteria (табл. 2). Сульфатвосстанавливающие археи, обычно присутствующие в высокотемпературных нефтяных пластах, не были обнаружены в исследованных нефтяных пластах с невысокой температурой. Основной группой были Gammaproteobacteria, представленные бактериями рода Halomonas (74.7%) в культуре 5452-NR, и Pseudomonas (20.2%), Stenotrophomonas (16.6%) и Escherichia–Shigella (19.5%) – в культуре 245D-NR. Филум Firmicutes был представлен бактериями рода Bacillus. Бактерии родов Pseudomonas, Stenotrophomonas, Bacillus являются обычными обитателями заводняемых нефтяных пластов (Назина и соавт., 2005; Feng et al., 2011). Эти бактерии обнаруживаются как в призабойной зоне нагнетательных скважин, куда с нагнетаемой водой поступает растворенный кислород, так и в анаэробной зоне добывающих скважин. Бактерии родов Bacillus, Pseudomonas и Halomonas аэробно используют широкий спектр алифатических углеводородов и ароматические соединения (фенол, бензоат, нафталин, фенантрен, антрацен) при повышенном содержании NaCl (Fathepure et al., 2014). Некоторые члены родов Bacillus, Stenotrophomonas и Georgenia растут на ароматических соединениях в анаэробных условиях за счет восстановления нитрата (Yu et al., 2009; Fathepure et al., 2014). Присутствие бактерий кишечной группы Escherichia–Shigella, Ochrobactrum, Yersinia, Enterobacter в составе сообщества может свидетельствовать о примеси загрязненных поверхностных вод в пластовой воде из скважины 245D. Однако бактерии Ochrobactrum intermedium, способные окислять углеводороды нефти, были выделены также из нефтяного месторождения в Китае (Chai et al., 2015). Бактерии группы Escherichia–Shigella были обнаружены также в составе денитрифицирующих популяций, растущих на углеводородах (Feng et al., 2011). Показано, что в среде с нитратом и летучими жирными кислотами бактерии рода Pseudomonas образовывали до 3 мМ нитрита, подавляющего рост СВБ в консорциуме из пластовых вод месторождения Аргентины (Grigoryan et al., 2008). Денитрифицирующие бактерии рода Halomonas были основной группой в микробных консорциумах, окисляющих сульфид и подавляющих рост СВБ при повышенной солености среды (Liu et al., 2015; An et al., 2017).
Таблица 2.
Филогенетическое разнообразие прокариот домена Bacteria в накопительных культурах 5452-NR и 245D-NR
| Филум, класс, род | Ближайший культивируемый типовой штамм (% сходства фрагментов гена 16S рРНК) | % от общего количества последовательностей в библиотеке | |
|---|---|---|---|
| 5452-NR | 245D-NR | ||
| Bacteria | 100 | 99.6 | |
| Proteobacteria, Alphaproteobacteria | 1.6 | 10.5 | |
| Ochrobactrum | Ochrobactrum rhizosphaerae PR17T (100) | 1.1 | 7.2 |
| Proteobacteria, Betaproteobacteria | 4.0 | ||
| Bordetella | Bordetella hinzii NCTC 13199T (100) | 1.8 | |
| Proteobacteria, Gammaproteobacteria | 80.4 | 60.6 | |
| Halomonas | Halomonas alimentaria YKJ-16T, Halomonas stenophila N12T (96–100) | 74.7 | |
| Pseudomonas | Pseudomonas mandelii LMG 21607T (100) | 2.6 | 20.2 |
| Escherichia–Shigella | Shigella flexneri ATCC 29903T (100) | 19.5 | |
| Stenotrophomonas | Stenotrophomonas maltophilia NCTC10257T (100) | 1 | 16.6 |
| Yersinia | Yersinia canariae NCTC 14382T (100) | 2.5 | |
| Enterobacter | Enterobacter timonensis MT20T (100) | 1.4 | |
| Firmicutes, Bacilli | 10.0 | 15.9 | |
| Bacillus | Bacillus cereus CCM 2010T (100) | 7.5 | 9.0 |
| Geobacillus | Geobacillus stearothermophilus BGSC 9A20T (100) | 1.1 | |
| Faecalibacterium | Faecalibacterium prausnitzii ATCC 27768T (99) | 1.4 | |
| Actinobacteria | 3.5 | 4.6 | |
| Georgenia | Georgenia muralis NBRC 103560T (100) | 2.3 | |
| Leucobacter | Leucobacter aridicollis L-9T (100) | 2.2 | |
| Streptomyces | Streptomyces monticola NEAU-GS4T (100) | 1.1 | |
| Bacteroidetes, Bacteroidia | 1.5 | 5.0 | |
| Prevotella | Prevotella copri DSM 18205T (98) | 1.8 | |
С помощью модуля “Local Mapper” программы iVicodak были предсказаны функциональные характеристики исследуемых нитратредуцирующих сообществ (рис. 3). Бактерии, входящие в обе культуры, осуществляли основные пути метаболизма углеводородов и энергетического метаболизма, однако сообщество культуры 5452_NR обладало большей потенциальной способностью к осуществлению этих путей. С помощью базы данных KEGG показана потенциальная способность обоих сообществ к деградации ксенобиотиков, бензоата (“Benzoate_degradation”), а также связанных с ним путей деградации других ароматических ксенобиотиков: флюоробензоата, аминобензоата, ксилола и толуола, а кроме того также хлорсодержащих органических соединений. Наибольшей потенциальной способностью к осуществлению этих путей деградации обладала культура 5452_NR.
Рис. 3.
Тепловая карта, показывающая сравнение ферментативных профилей метаболических путей “Деградация бензоата” (а) и “Метаболизм азота” (б) с помощью пакета программ iVikodak у нитратредуцирующих накопительных культур. Специфические ферменты деградации бензоата и метаболизма азота отмечены черным и красным цветом соответственно.

Анализ ферментов пути “Деградация бензоата” показал, что в обеих культурах присутствовали бактерии, обладающие двумя ключевыми ферментами аэробной деградации бензоата (“benzoate degradation I”), бензоат-1,2-диоксигеназа (EC 1.14.12.10) и дигидрооксициклогексадиен дегидрогеназа (EC 1.3.1.25), которые катаболизируют бензоат до катехола. Кроме того, в исследуемых культурах предсказано наличие всех ферментов катаболизма катехола, как до сукцинил-КоА, так и до пирувата/ацетил-КоА (рис. 3а и S2). Частично были представлены также ферменты другого пути деградации бензоата (”Benzoate degradation II”), преимущественно используемого анаэробными бактериями, в том числе, денитрифицирующими. В этом пути бензоат катаболизируется через бензоил-КоА – интермедиат биодеградации многих ароматических соединений (рис. S2 ).
Этот же модуль программы iVicodak позволил оценить вклад бактерий различных таксонов в осуществление пути “Деградация бензоата”. Бактерии рода Halomonas отвечали за деградацию бензоата в культуре 5452_NR (рис. S3 а), а бактерии родов Pseudomonas и Stenotrophomonas – в культуре 245D_NR (рис. S3 б). Известно, что бактерии рода Pseudomonas являются модельным объектом для изучения биодеградации ряда соединений, в том числе бензоата, катехола и других ароматических и полициклических соединений (Nogales et al., 2017). Имеются также сведения о присутствии генов деградации бензоата и активности детерминируемых ими ферментов у некоторых штаммов Halomonas и Stenotrophomonas.
У бактерий, входящих в нитратредуцирующие сообщества, было предсказано наличие ферментов пути “Метаболизм азота” (“Nitrogen_metabolism”), участвующих в диссимиляционном восстановлении нитратов до молекулярного азота (собственно денитрификация) и аммония, а также в ассимиляционном восстановлении нитрата до аммония (рис. 4, S4 ). Наиболее обильно был представлен фермент нитратредуктаза (EC 1.7.5.1), который катализирует восстановление нитрата до нитрита в процессах денитрификации и диссимиляционной нитратредукции. Кроме него, были представлены остальные ферменты этих процессов, катализирующих восстановление нитрита до молекулярного азота и аммония соответственно. В меньшей степени в культурах были представлены ферменты ферредоксин-нитратредуктаза (EC 1.7.7.2), катализирующий восстановление нитрата до нитрита в процессе ассмиляционной нитратредукции, и ферредоксин-нитратредуктаза (EC 1.7.7.1), завершающий этот процесс восстановлением нитрита до аммония. Все ферменты пути метаболизма азота были наиболее представлены в культуре 5452_NR. Наибольший вклад в осуществление преобразований азота в культуре 5452_NR вносили Gammaproteobacteria рода Halomonas, а в культуре 245D_NR – Gammaproteobacteria родов Pseudomonas и Stenotrophomonas и Alphaproteobacteria рода Ochrobactrum (рис. S5 ).
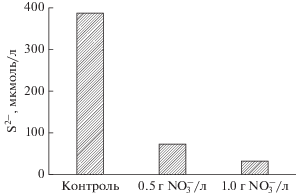
Рис. 4.
Образование сероводорода микробным сообществом нагнетаемой воды (скв. 20990) в среде с лактатом натрия в отсутствие нитрата (контроль) и при наличии 0.5 и 1.0 г ${\text{NO}}_{{\text{3}}}^{ - }$/л среды.
Эти данные согласуются с результатами филогенетической идентификции последовательностей генов 16S рРНК, выявленных в библиотеках обеих культур (табл. 2). Доминирующие последовательности библиотеки 5452_NR имели 96–100% сходства генов 16S рРНК с геном денитрифицирующей бактерии Halomonas alimentaria YKJ-16T. В библиотеке генов 16S рРНК культуры 245D_NR численно преобладали последовательности бактерии Pseudomonas mandelii LMG 21607T (100% сходства), также способной осуществлять денитрификацию, и Stenotrophomonas maltophilia, восстанавливающей нитраты до нитрита.
Выделение чистых культур нитратредуцирующих бактерий и их идентификация. Из нитратредуцирующих микробных сообществ выделено 8 чистых культур, которые были идентифицированы методом анализа гена 16S рРНК. Высокое сходство (98.97–100%) последовательностей гена 16S рРНК выделенных штаммов с генами типовых штаммов известных видов позволило отнести штаммы к видам Chromohalobacter salexigens HO-A4, Halomonas alimentaria HO-A25, Bacillus licheniformis HO-A7, Nocardia asteroides HO-A12, Gordonia amicalis HO-A13, Ensifer adhaerens HO-A22, Pseudomonas brassicacearum HO-A23 и Pseudomonas gessardii HO-A24 (табл. 3). Ген 16S рРНК штамма H. alimentaria HO-A25, выделенного из культуры 5452_NR, имел 99.5% сходства с геном доминирующего компонента этой культуры. Впоследствии штамм HO-A25 был утрачен, и в дальнейшей работе использовали штаммы Halomonas titanicae HO-A31 и TAT1 (acc. numbers MT498853 и MK478935 соответственно), также выделенные из нефтяных пластов. Проверена способность выделенных штаммов расти на сырой нефти в присутствии кислорода и нитрата. В аэробных условиях наибольшее использование н-алканов нефти показали штаммы C. salexigens HO-A4 и G. amicalis HO-A13 (рис. S6 ). В среде с нитратом не были зарегистрированы заметные изменения во фракции н-алканов (данные не представлены). Однако штаммы C. salexigens HO-A4 и H. titanicae TAT1 накапливали биомассу и нитрит, концентрация которого на 180 сут культивирования превышала 100 мг/л среды, что свидетельствует о росте штаммов на иных, чем н-алканы, компонентах нефти.
Таблица 3.
Таксономическая принадлежность выделенных штаммов и образование нитрита из нитрата в средах с разными субстратами за 14 сут
| Штамм | Ближайший вид, типовой штамм, acc. number | Cходство генов 16S рРНК, % | № скважины | Интервал NaCl для роста, % | Образование нитрита (мг/л) в среде | |||
|---|---|---|---|---|---|---|---|---|
| глюкоза | лактат | глицерин | этанол | |||||
| HO-A4 | Chromohalobacter salexigens, DSM 3043T, NR_074225 | 99.93 | 5452 | 0–>15 | 70 | 60 | 70 | 70 |
| HO-31** | Halomonas titanicae, ATCC BAA-1257T, NR_116997 | 99.42 | – | 0–20 | 0 | 0 | 60 | 0 |
| HO-A7 | Bacillus licheniformis, ATCC 14580T , CP034569 | 99.93 | 245D | 0–14 | 100 | 100 | 100 | 60 |
| HO-12 | Nocardia asteroids, NBRC 15531T, NR_117315 | 99.58 | 5600* | 0–8 | 80 | 90 | 100 | 50 |
| HO-A13 | Gordonia amicalis, DSM 44461T, NR_028735 | 99.14 | 5600* | 0–8 | 70 | 30 | 35 | 15 |
| HO-22*** | Ensifer adhaerens, NBRC 100388T, NR_113893 | 98.97 | 5600* | 0–2 | 0 | 0 | 0 | 0 |
| HO-23** | Pseudomonasbrassicacearum, CFBP 11706T, NR_024950 | 100 | 1010* | 0–2 | 0 | 0 | 0 | 0 |
| HO-24** | Pseudomonas gessardii, CIP 105469T, NR_024928 | 99.72 | 1010* | 0–0.8 | 0 | 0 | 0 | 0 |
Выделенные штаммы восстанавливали нитраты до нитрита, закиси азота или N2 в средах с разными органическими субстратами (табл. 3). Галотолерантный штамм B. licheniformis HO-A7 накапливал 100 мг нитрита/л в средах с глюкозой, лактатом и глицерином. Штамм H. titanicae HO-A31 продуцировал нитриты только в среде с глицерином, на других субстратах восстанавливал нитраты до молекулярного азота, как и штаммы HO-A23 и HO-A24 рода Pseudomonas. Бактерия E. adhaerens HO-A22 восстанавливала нитрат до закиси азота, зарегистрированной в газовой фазе. Ранее способность к денитрификации была показана для бактерий рода Ensifer, выделенных из загрязненных нитратами подземных вод (Safonov et al., 2018). Показана биодеградация полиароматических соединений, таких как полихлорбифенил, бактерией E. adhaerens (Xu et al., 2016). Таким образом, выделенные штаммы восстанавливали нитрат до газообразных соединений азота в средах с легкоутилизируемыми органическими субстратами, а заметный рост на н-алканах нефти осуществляли в аэробных условиях.
Подавление образования сероводорода сульфатвосстанавливающими бактериями путем стимуляции роста нитратредуцирующих бактерий. В эксперименте, моделирующем конкурентное подавление роста сульфатвосстанавливающих бактерий с помощью нитратредуцирующих бактерий, использовали пластовую воду, нагнетаемую в скважину 20990 Ромашкинского нефтяного месторождения. В пластовой воде присутствовали культивируемые аэробные органотрофные бактерии (106 кл./мл) и анаэробные бродильные (105 кл./мл), сульфатвосстанавливающие (103 кл./мл) и метаногенные (102 кл./мл) прокариоты (табл. 1). В среду с сульфатом и лактатом натрия вносили пластовую воду (10% об./об.) и нитрат в разной концентрации и анализировали образование сероводорода (рис. 4). Внесение 0.5 г NaNO3/л среды приводило к снижению образования сероводорода, а в присутствии 1 г NaNO3/л практически полностью подавлялся рост СВБ.
Полученные результаты свидетельствуют о том, что в нагнетаемой и пластовой воде исследованных нефтяных пластов присутствуют аэробные и факультативно анаэробные нитратредуцирующие бактерии, приспособленные к условиям пласта, способные восстанавливать нитрат с образованием нитрита при использовании неуглеводородных субстратов и сырой нефти. Эти бактерии могут быть активированы внесением нитрата для снижения продукции сероводорода в пласте. Выделенные пресноводные бактерии родов Nocardia и Gordonia и галотолерантные Chromohalobacter и Halomonas могут быть использованы для интродукции в нефтяные пласты с низкой численностью нитратредуцирующих бактерий для восстановления нитратов до нитрита в пласте, снижения концентрации сульфида и подавления образования сероводорода сульфатвосстанавливающими бактериями. Образование биосурфактантов, отмеченное в культурах нитратредуцирующих бактерий, также может оказывать положительный эффект на вытеснение нефти из пласта. Возможно также использование выделенных штаммов для биоремедиации загрязненных нефтью почв и других местообитаний.
Список литературы
Борзенков И.А., Милехина Е.И., Готоева М.Т., Розанова Е.П., Беляев С.С. Свойства углеводородокисляющих бактерий, изолированных из нефтяных месторождений Татарстана, Западной Сибири и Вьетнама // Микробиология. 2006. Т. 75. С. 82–89.
Borzenkov I.A., Milekhina E.I., Gotoeva M.T., Rozanova E.P., Belyaev S.S. The properties of hydrocarbon-oxidizing bacteria isolated from the oilfields of Tatarstan, Western Siberia, and Vietnam // Microbiology (Moscow). 2006. V. 75. P. 66–72.
Назина Т.Н., Соколова Д.Ш., Шестакова Н.М., Григорьян А.А., Михайлова Е.М., Бабич Т.Л., Лысенко А.М., Турова Т.П., Полтараус А.Б., Циньсян Фенг, Фангтиан Ни, Беляев С.С. Филогенетическое разнообразие аэробных органотрофных бактерий из высокотемпературного нефтяного месторождения Даган // Микробиология. 2005. Т. 74. С. 401–409.
Nazina T.N., Sokolova D.Sh., Shestakova N.M., Grigoryan A.A., Mikhailova E.M., Babich T.L., Lysenko A.M., Tourova T.P., Poltaraus A.B., Feng Q., Ni F., Belyaev S.S. The phylogenetic diversity of aerobic organotrophic bacteria from the Dagang high-temperature oil field // Microbiology (Moscow). 2005. V. 74. P. 343–351.
Назина Т.Н., Павлова Н.К., Татаркин Ю.В., Шестакова Н.М., Бабич Т.Л., Соколова Д.Ш., Ивойлов В.С., Хисаметдинов М.Р., Ибатуллин Р.Р., Турова Т.П., Беляев С.С., Иванов М.В. Микроорганизмы карбонатной нефтяной залежи 302 Ромашкинского месторождения и их биотехнологический потенциал // Микробиология. 2013. Т. 82. С. 191–202.
Nazina T.N., Pavlova N.K., Tatarkin Yu.V., Shestakova N.M., Babich T.L., Sokolova D.Sh., Ivoilov V.S., Khisametdinov M.R., Ibatullin R.R., Tourova T.P., Belyaev S.S., Ivanov M.V. Microorganisms of the carbonate petroleum reservoir 302 of the Romashkinskoe oilfield and their biotechnological potential // Microbiology (Moscow). 2013. V. 82. P. 190–200.
An B.A., Shen Y., Voordouw G. Control of sulfide production in high salinity Bakken shale oil reservoirs by halophilic bacteria reducing nitrate to nitrite // Front. Microbiol. 2017. V. 8. Art. 1164. https://doi.org/10.3389/fmicb.2017.01164
Bødtker G., Lysnes K., Torsvik T., Bjørnestad E.Ø., Sunde E. Microbial analysis of backflowed injection water from a nitrate-treated North Sea oil reservoir // J. Ind. Microbiol. Biotechnol. 2009. V. 36. P. 439–450.
Bolger A.M., Lohse M., Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data // Bioinformatics. 2014. V. 30. P. 2114–2120.
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N., Pena A.G., Goodrich J.K., Gordon J.I., Huttley G.A., Kelley S.T., Knights D., Koenig J.E., Ley R.E., Lozupone C.A., McDonald D., Muegge B.D., Pirrung M., Reeder J., Sevinsky J.R., Turnbaugh P.J., Walters W.A., Widmann J., Yatsunenko T., Zaneveld J., Knight R. QIIME allows analysis of high-throughput community sequencing data // Nat. Methods. 2010. V. 7. P. 335–336.
Cornish Shartau S.L., Yurkiw M., Lin S., Grigoryan A.A., Lambo A., Park H.-S., Lomans B.P., van der Biezen E., Jetten M.S.M., Voordouw G. Ammonium concentrations in produced waters from a mesothermic oil field subjected to nitrate injection decrease through formation of denitrifying biomass and Anammox activity // Appl. Environ. Microbiol. 2010. V. 76. P. 4977–4987. https://doi.org/10.1128/AEM.00596-10
Chai L.J., Jiang X.W., Zhang F., Zheng B.W., Shu F.Ch., Wang Zh.L., Cui Q.F., Dong H.P., Zhang Zh.Zh., Hou D.J., She Y.H. Isolation and characterization of a crude oil degrading bacteria from formation water: comparative genomic analysis of environmental Ochrobactrum intermedium isolate versus clinical strains // Biomed. Biotechnol. 2015. V. 16. P. 865–874.
da Silva M.L., Soares H.M., Furigo A., Jr., Schmidell W., Corseuil H.X. Effects of nitrate injection on microbial enhanced oil recovery and oilfield reservoir souring // Appl. Biochem. Biotechnol. 2014. V. 174. P. 1810–1821. https://doi.org/10.1007/s12010-014-1161-2
Davidova I., Hicks M.S., Fedorak P.M., Suflita J.M. The influence of nitrate on microbial processes in oil industry production waters // J. Ind. Microbiol. Biotechnol. 2001. V. 27. P. 80–86.
Eckford R.E., Fedorak P.M. Planktonic nitrate-reducing bacteria and sulfate-reducing bacteria in some western Canadian oil field waters // J. Ind. Microbiol. Biotechnol. 2002. V. 29. P. 83–92.
Fadrosh D.W., Ma B., Gajer P., Sengamalay N., Ott S., Brotman R.M., Ravel J. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform // Microbiome. 2014. V. 2. P. 6. https://doi.org/10.1186/2049-2618-2-6
Fan F., Zhang B., Liu J., Cai Q., Lin W., Chen B. Towards sulfide removal and sulfate reducing bacteria inhibition: function of biosurfactants produced by indigenous isolated nitrate reducing bacteria // Chemosphere. 2020. V. 238. Art. 124655. P. 1–10. https://doi.org/10.1016/j.chemosphere.2019.124655
Fathepure B.Z. Recent studies in microbial degradation of petroleum hydrocarbons in hypersaline environments // Front. Microbiol. 2014. V. 5. Art. 173. P. 1–16. https://doi.org/10.3389/fmicb.2014.00173
Feng W.W., Liu J.F., Gu J.D., Mu B.Zh. Nitrate-reducing community in production water of three oil reservoirs and their responses to different carbon sources revealed by nitrate-reductase encoding gene (napA) // Int. Biodeter. Biodegrad. 2011. V. 65. P. 1081–1086.
Fida T.T., Chen C., Okpala G., Voordouw G. Implications of limited thermophilicity of nitrite reduction for control of sulfide production in oil reservoirs // Appl. Environ. Microbiol. 2016. V. 82. P. 4190–4199. https://doi.org/10.1128/AEM.00599-16
Gevertz D., Telang A.J., Voordouw G., Jenneman G.E. Isolation and characterization of strains CVO and FWKO B, two novel nitrate-reducing, sulfide-oxidizing bacteria isolated from oil field brine // Appl. Environ. Microbiol. 2000. V. 66. P. 2491–2501.
Gieg L.M., Jack T.R., Foght J.M. Biological souring and mitigation in oil reservoirs // Appl. Microbiol. Biotechnol. 2011. V. 92. P. 263–282. https://doi.org/10.1007/s00253-011-3542-6
Grigoryan A.A., Cornish S.L., Buziak B. Lin Sh., Cavallaro A., Arensdorf J.J., Voordouw G. Competitive oxidation of volatile fatty acids by sulfate- and nitrate-reducing bacteria from an oil field in Argentina // Appl. Environ. Microbiol. 2008. V. 74. P. 4324–4335.
Head I.M., Gray N.D., Larter S.R. Life in the slow lane; biogeochemistry of biodegraded petroleum containing reservoirs and implications for energy recovery and carbon management // Front. Microbiol. 2014. V. 5. Art. 566. https://doi.org/10.3389/fmicb.2014.00566
Hubert C., Voordouw G. Oil field souring control by nitrate-reducing Sulfurospirillum spp. that outcompete sulfate-reducing bacteria for organic electron donors // Appl. Environ. Microbiol. 2007. V. 73. P. 2644–2652.
Jenneman G.E., Moffitt P.D., Bala G.A., Webb R.H. Sulfide removal in reservoir brine by indigenous bacteria // Prod. Facilities. 1999. V. 14. P. 219–225.
Liu Ch., Zhao D., Ma W., Guo Y., Wang A., Wang Q., Lee D.-J. Denitrifying sulfide removal process on high-salinity wastewaters in the presence of Halomonas sp. // Appl. Microbiol. Biotechnol. 2015. V. 100. P. 1421–1426. https://doi.org/10.1007/s00253-015-7039-6
Mbadinga S.M., Wang L.Y., Zhou L., Liu J.F., Gu J.D., Mu B.Z. Microbial communities involved in anaerobic degradation of alkanes // Int. Biodeter. Biodegrad. 2011. V. 65. P. 1–13. https://doi.org/10.1016/j.ibiod.2010.11.009
Mnif S., Chamkha M., Sayadi S. Isolation and characterization of Halomonas sp. strain C2SS100, a hydrocarbon-degrading bacterium under hypersaline conditions // J. Appl. Microbiol. 2009. V. 107. P. 785–794. https://doi.org/10.1111/j.1365-2672.2009.04251.x
Nagpal S., Haque M.M., Singh R., Mande S.S. iVikodak – A Platform and standard workflow for inferring, analyzing, comparing, and visualizing the functional potential of microbial communities // Front. Microbiol. 2019. V. 9. Art. 336. https://doi.org/10.3389/fmicb.2018.03336
Nazina T., Sokolova D., Grouzdev D., Semenova E., Babich T., Bidzhieva S., Serdukov D., Volkov D., Bugaev K., Ershov A., Khisametdinov M., Borzenkov I. The potential application of microorganisms for sustainable petroleum recovery from heavy oil reservoirs // Sustainability. 2020. V. 12. Art. 15. https://doi.org/10.3390/su12010015
Nogales J., García J.L., Díaz E. Degradation of aromatic compounds in Pseudomonas: A systems biology view // Aerobic Utilization of Hydrocarbons, Oils and Lipids. Handbook of Hydrocarbon and Lipid Microbiology / Ed. Rojo F. Springer International Publishing AG, 2017. P. 1–49. https://doi.org/10.1007/978-3-319-39782-5_32-1
Safonov A.V., Babich T.L., Sokolova D.S., Grouzdev D.S., Tourova T.P., Poltaraus A.B., Zakharova E.V., Merkel A.Y., Novikov A.P., Nazina T.N. Microbial community and in situ bioremediation of groundwater by nitrate removal in the zone of a radioactive waste surface repository // Front. Microbiol. 2018. V. 9. Art. 1985. https://doi.org/10.3389/fmicb.2018.01985
Sunde E., Torsvik T. Microbial control of hydrogen sulfide production in oil reservoirs // Petroleum Microbiology / Eds. Ollivier B., Magot M. Washington, DC: ASM Press, 2005. P. 201–213.
Takahashi S., Tomita J., Nishioka K., Hisada T., Nishijima M. Development of a prokaryotic universal primer for simultaneous analysis of Bacteria and Archaea using next-generation sequencing // PLoS One. 2014. V. 9. Art. e105592. https://doi.org/10.1371/journal.pone.0105592
Xu L., Chen X., Li H., Hu F., Liang M. Characterization of the biosorption and biodegradation properties of Ensifer adhaerens: a potential agent to remove polychlorinated biphenyls from contaminated water // J. Hazard. Mater. 2016. V. 302. P. 314–322.
Yu L., Liu Y., Wang G. Identification of novel denitrifying bacteria Stenotrophomonas sp. ZZ15 and Oceanimonas sp. YC13 and application for removal of nitrate from industrial wastewater // Biodegradation. 2009. V. 20. P. 391–400.
Youssef N., Elshahed M.S., McInerney M.J. Microbial processes in oil fields: culprits, problems, and opportunities // Adv. Appl. Microbiol. 2009. V. 66. P. 141–251. https://doi.org/10.1016/S0065-2164(08)00806-X
Дополнительные материалы
- скачать ESM_1.tiff
- Рис. S1. Поверхностное натяжение (ПН, 1) и межфазное натяжение против гексадекана (МН, 2) культуральной среды с бактериями первичных накопительных культур 5600_NR, 1010_NR, 245D_NR и 5452_NR в среде с нефтью и нитратом через ххх сут. инкубирования
- скачать ESM_2.tiff
- Рис. S2. Прогнозируемый профиль ферментов пути “Деградация бензоата” нитратредуцирующих накопительных культур, растущих в среде с нефтью.
- скачать ESM_3.tiff
- Рис. S3. Дендробарограммы, показывающие ключевые микроорганизмы (и их таксономическую принадлежность), участвующие в пути “Деградация бензоата”, в нитратредуцирующих накопительных культурах 5452_NR (а) и 245D_NR (б), растущих в среде с нефтью.
- скачать ESM_4.tiff
- Рис. S4. Прогнозируемый профиль ферментов пути “Метаболизм азота” нитратредуцирующих накопительных культур, растущих в среде с нефтью.
- скачать ESM_5.tiff
- Рис. S5. Дендробарограммы, показывающие ключевые микроорганизмы (и их таксономическую принадлежность), участвующие в пути “ Метаболизм азота”, в нитратредуцирующих накопительных культурах 5452_NR (а) и 245D_NR (б), растущих в среде с нефтью.
- скачать ESM_6.tiff
- Рис. S6. Профиль н-алканов нефти в среде после аэробной инкубации в отсутствие (а, в) и в присутствии штаммов Chromohalobacter salexigens HO-A4 (б) и Gordonia amicalis HO-A13 (г) при температуре 30°С в течение 24 сут.


