Микробиология, 2021, T. 90, № 1, стр. 43-63
Липиды микромицетов и стресс
Е. В. Федосеева a, *, О. А. Данилова b, Е. А. Януцевич b, В. А. Терехова c, d, В. М. Терешина b
a Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
117997 Москва, Россия
b Институт микробиологии им. С.Н. Виноградского, ФИЦ
“Фундаментальные основы биотехнологии” РАН
119071 Москва, Россия
c Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Россия
d Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: elenfedoseeva@gmail.com
Поступила в редакцию 25.06.2020
После доработки 10.07.2020
Принята к публикации 15.08.2020
Аннотация
Микроскопические грибы, среди многообразия живых организмов, не имеют себе равных по способности осваивать различные экологические ниши благодаря эволюционно сформированным механизмам адаптации к широкому диапазону изменчивости природно-климатических и техногенных факторов. Один из подходов к пониманию механизмов адаптации к меняющимся условиям среды связан с липидным метаболизмом. В обзоре дан критический анализ публикаций и собственных экспериментальных данных относительно изменчивости липидов микромицетов под влиянием стресс-факторов и связанных с этим возможных механизмов адаптации. Проанализированы функциональные, структурные и количественные изменения грибных липидов в условиях осмотического, теплового и холодового воздействий, а также токсичности среды. Биохимические изменения состава фосфолипидов и других мембранных липидов охарактеризованы, в целом, как многообразные и неоднозначные, зависящие от степени воздействия, исходного состава липидов, генетической резистентности грибов и способности к адаптации к экстремальным условиям среды. В обзоре обсуждается роль липидного обмена в комплексном ответе грибной клетки на стрессовые воздействия.
ВВЕДЕНИЕ
Среди многообразия живых организмов микроскопические грибы (микромицеты) не имеют себе равных по способности осваивать различные экологические ниши (Goncalves et al., 2012; Grum-Grzhimaylo et al., 2016). Они развиваются в широком диапазоне изменчивости природно-климатических и техногенных факторов (Горбунова, Терехова, 1995; Терехова, 2007; Grum-Grzhimaylo et al., 2016; Sazanova et al., 2019). Низкие температуры арктических и антарктических местообитаний, высокая инсоляция горных биотопов, горячие источники, экстремальные условия при повышенных уровнях радиации, минерализации, концентрации токсикантов являются стресс-факторами для подавляющего числа видов живых организмов. Среди микромицетов велика доля резистентных форм с эволюционно сформированными особыми механизмами адаптации к экстремальным условиям.
Один из подходов к пониманию механизмов адаптации к меняющимся условиям среды связан с липидным обменом. В пуле липидных структур выделяют маркеры состояния стресса (Януцевич и соавт., 2016). Изучение структурных и функциональных изменений липидного метаболизма грибов представляет не только теоретический интерес. Потенциальная возможность управлять адаптационными механизмами делает привлекательными подобные исследования в различных направлениях биотехнологии, среди которых особой привлекательностью выделяется продукция биологически активных соединений экстремофилами и экстремотолерантами. Интерес к познанию механизмов адаптации микромицетов к стрессовым условиям связан также с внедрением в экологические исследования ОМИКС-технологий, представляющих новую возможность оценки биоразнообразия на основе молекулярно-генетических анализов, в том числе липидных профилей (Vaskovsky et al., 1991; Розенцвет и соавт., 2018).
В обзоре проанализированы функциональные, структурные и количественные изменения липидов микромицетов в условиях осмотического, теплового и холодового воздействий. Отдельный раздел посвящен техногенному стрессу и воздействию загрязняющих веществ. Результаты такого анализа позволяют приблизиться к пониманию механизмов стрессоустойчивости и адаптации микромицетов, а также стабильности грибных липидных профилей в изменяющихся температурных, осмотических условиях и изменении токсичности среды обитания. В обзоре обсуждается роль липидного обмена в общем комплексном ответе грибной клетки на воздействия стрессорных факторов.
РАЗНООБРАЗИЕ ЛИПИДОВ МИКРОМИЦЕТОВ
Разнообразие липидов в клетках эукариотных организмов на порядок выше, чем у прокариотных. Число наименований липидных молекул у прокариотных организмов не превышает 100, тогда как у эукариотных их насчитывают около 1000 (Simons, Sampaio, 2011). Состав липидов микромицетов достаточно прост, по сравнению с более сложно устроенными эукариотами, однако его основные свойства сравнимы с липидомом любой эукариотической клетки. Триацилглицерины (ТАГ) и эфиры стеринов (ЭС) служат запасными липидами, источниками свободных жирных кислот (СЖК), из которых клетка получает энергию в процессе β-окисления (Klose et al., 2012). Основу мембран составляют глицерофосфолипиды (ФЛ), сфинголипиды (СЛ) и стерины (Ст). Разнообразие липидов обусловлено различными комбинациями строительных блоков – полярных головок и ацильных цепей. В состав фосфолипидов (ФЛ) входят фосфатидилэтаноламины (ФЭ), фосфатидилхолины (ФХ), фосфатидные кислоты (ФК), фосфатидилсерины (ФС), фосфатидил-инозиты (ФИ), лизофосфатидилэтаноламины (ЛФЭ) и лизофосфатидилхолины (ЛФХ), фосфатидилглицерины (ФГ) и кардиолипины (КЛ) (рис. 1). Основными жирными кислотами (ЖК) в составе липидов грибов являются пальмитиновая (C16:0), стеариновая (C18:0), олеиновая (C18:1n9c), линолевая (C18:2n6c) и α-линоленовая (C18:3n3) (Weete, 1974) (рис. 1). Некоторые ЖК, Ст, ФЛ и СЛ могут выполнять сигнальные функции в клетке (Pan et al., 2018).
Рис. 1.
Разнообразие грибных липидов: а – мембранные: глицерофосфолипиды (зеленый и серый), стерины (красный) и сфинголипиды (желтый) (модифиц. по Ernst et al., 2016); б – жирные кислоты (формулы взяты с https://pubchem.ncbi.nlm.nih.gov). Обозначения: ЖК – жирные кислоты; ФГ – фосфатидилглицерины; ФИ – фосфатидилинозиты; ФС – фосфатидилсерины; ФХ – фосфатидилхолины; ФЭ – фосфатидилэтаноламины; ФК – фосфатидные кислоты; ИФЦ –инозилфосфорил церамид.
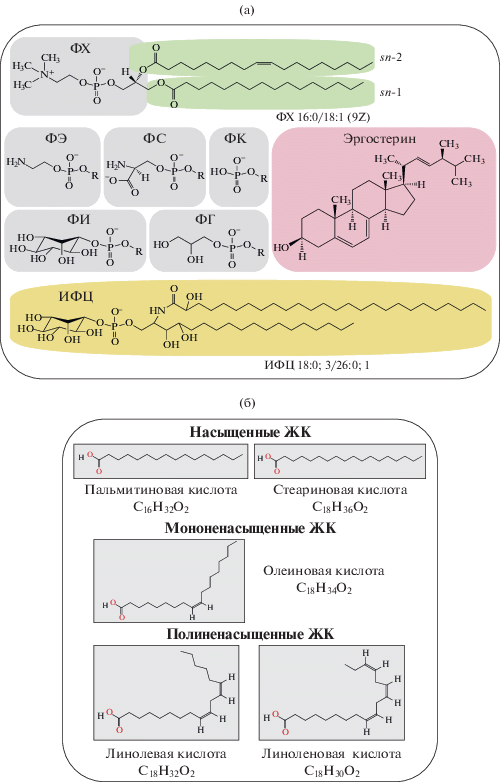
Строение мембран микромицетов согласуется с жидкостно-мозаичной моделью. Согласно этой модели, основу мембраны представляет липидный бислой с интегрированными и периферическими мембранными белками и гликопротеинами, а также микродоменами (липидными рафтами) (Nicolson, 2014). У грибов содержание липидов в мембране колеблется от 30 до 50%, соотношение белков к липидам – от 0.95 до 2.1 (Weete, 1980).
В зависимости от относительного размера полярной головки и гидрофобных цепей ФЛ делят на бислойные и небислойные. Бислойные липиды (ФХ, ФИ) имеют цилиндрическую форму и потому способны образовать бислой. Небислойные липиды (ФЭ, ФК, КЛ) имеют коническую форму и образуют инвертированную гексагональную фазу (мицеллы). В присутствии бислойных липидов небислойные могут формировать бислой, образуя при этом изгибы мембран, что требуется в процессах слияния и деления клеток (van den Brink-van der Laan et al., 2004). Липидный бислой может находиться в двух фазах – жидко-кристаллической (менее вязкая и упорядоченная) и гелевой (более вязкая и упорядоченная). Температура фазового перехода (Tm) меняется в зависимости от состава ФЛ, а также увеличивается по мере удлинения ацильных цепей и уменьшается по мере введения ненасыщенных ЖК в молекулу ФЛ (Renne, Kroon de, 2018).
Липиды с длинными насыщенными ацильными цепями (например, СЛ) увеличивают вязкость мембран, за счет плотной упаковки молекул и липид-липидных взаимодействий. Ненасыщенные ЖК в составе липидов, наоборот, приводят к разрыхлению бислоя, поскольку изгибы ацильных цепей предотвращают плотную упаковку молекул, что способствует процессам эндоцитоза (Harayama, Riezman, 2018). Молекулы Ст оказывают двунаправленное стабилизирующее действие на мембрану. Они препятствуют образованию геля, встраиваясь между ацильными цепями и раздвигая их, что способствует увеличению текучести, а в жидкокристаллическом состоянии уменьшают подвижность ацильных цепей, способствуя уменьшению текучести (Holthuis, Menon, 2014). Высказана гипотеза компартментализации мембран (Simons, Sampaio, 2011). В мембране могут образовываться динамичные наноразмерные микродомены, рафты – упорядоченные структуры, обогащенные Ст, СЛ и специфическими белками в метастабильном состоянии, которое может быть активировано липид-липидными, липид-белковыми или белок-белковыми взаимодействиями.
Контроль содержания различных липидов в клетке может осуществляться как непосредственно, так и косвенно. Так, фактор транскрипции Upc2, контролирующий экспрессию генов биосинтеза Ст, регулируется путем непосредственного связывания с молекулой эргостерина. Аналогично, ФС-синтаза-1 ингибируется молекулой ФС, обеспечивая поддержание количества ФС на нужном уровне (Harayama, Riezman, 2018). Уровни ФЛ контролируются их предшественниками (накопление ФК, ДАГ). Степень ненасыщенности ФЛ у дрожжей контролируется фактором транскрипции Mga2, который активируется в случае повышенного содержания насыщенных ЖК в составе мембранных липидов, приводя к ап-регуляции генов десатуразы Ole1 (Covino et al., 2016).
Биосинтез мембранных липидов микромицетов можно разделить на 4 основные части: синтез ЖК, ФЛ, СЛ и Ст (Ernst et al., 2016). В основе синтеза мембранных липидов лежит пул свободных ЖК. Как правило, у эукариот их синтез de novo приводит к образованию пальмитиновой кислоты, которая подвергается дальнейшим модификациям ферментами элонгазами и десатуразами с образованием большого разнообразия молекул ЖК. Поддержание гомеостаза мембран требует постоянного образования ФЛ, которые синтезируются в ЭПР, аппарате Гольджи и митохондриях. Синтез ФЛ включает последовательное присоединение ацилтрансферазами ацильных цепей в положения sn-1 и sn-2 молекулы глицерол-3-фосфата с образованием ФК, из которой далее через цитидин дифосфат-диацилглицериновый путь синтезируется все разнообразие ФЛ. Однако существует и альтернативный путь синтеза ФХ и ФЭ путем включения холина и этаноламина в ФК через путь Кеннеди (Redón et al., 2012). Замена ацильных цепей ФЛ в положении sn-2 осуществляется в цикле Ланда (Yamashita et al., 2014). Путь синтеза СЛ состоит из серии реакций, в которых первоначально образуются сфингоидные основания с разной длиной цепи, количеством гидроксильных групп, степенью ненасыщенности (СН), которые превращаются в церамиды – предшественники инозитол-содержащих СЛ у дрожжей (Ernst et al., 2016). Путь синтеза Ст у грибов включает около 30 реакций, конечным продуктом является эргостерин (Weete, Gandhi, 1996; Espenshade, Hughes, 2007). Нейтральные липиды (ТАГ, ЭС) являются источниками СЖК, Ст и ДАГ. ДАГ, образующиеся при распаде ФК, служaт основными предшественникaми ТАГ, тогда как эргостерин является предшественником ЭС (Pan et al., 2018).
ЛИПИДЫ МИКРОМИЦЕТОВ В УСЛОВИЯХ ОСМОТИЧЕСКИХ ВОЗДЕЙСТВИЙ
Осмотический шок (ОШ) – это воздействие на организм гипер-/гипоосмотической среды, которое вызывает диффузию свободной воды из/в клетку через полупроницаемую цитоплазматическую мембрану, что приводит к изменению объема и формы клетки, снижению скорости роста и метаболизма, возникновению окислительного стресса (Ramos-Moreno et al., 2019).
Адаптационный ответ клетки на ОШ является комплексным. На морфологическом уровне он проявляется в изменении размера и пигментации колоний, утолщении клеточной стенки, изменении ее структуры и усилении меланизации (Abu-Seidah, 2007; Liu et al., 2017b; Ahumada-Rudolph et al., 2019). На биохимическом уровне происходит синтез осмолитов (сахароспиртов и трегалозы), ферментов защиты от АФК, изменяется состав мембран.
Основным модельным объектом изучения механизмов резистентности к осмотическому фактору долгое время являлись дрожжи Saccharomyces cerevisiae, однако по степени устойчивости они значительно уступают выделенным относительно недавно галофильным (Wallemia ichthyophaga) и галотолерантным (Hortaea werneckii, Debaryomyces hansenii) дрожжам, механизмы осмоадаптации которых на настоящий момент интенсивно изучаются (Gunde-Cimerman et al., 2018).
В отличие от двуступенчатой сигнальной системы прокариот, для эукариот характерна многоступенчатая система фосфорилирования (МСФ), которая участвует в восприятии и трансдукции разнообразных сигналов, поступающих из внешней среды (Jacob, Thines, 2017). Многокомпонентность этой системы обеспечивает большее количество этапов регулирования, что облегчает задачу передачи сигналов в различные клеточные компартменты. Кроме участия в трансдукции внешних сигналов МСФ участвует в процессах цитодифференцировки, хемотаксиса, в первичном и вторичном метаболизме и необходима для вирулентности (Manfiolli et al., 2019; Román et al., 2020). Первой МСФ, идентифицированной у эукариот, был HOG путь (high osmolarity glycerol – HOG – pathway), который участвовал в адаптации к осмотическому стрессу у S. cerevisiae (Brewster et al., 1993). HOG-путь включает две цепи передачи сигнала через осмосенсорные белки гистидинкиназы SLN1 и SHO1, обладающие аутокиназной, фосфотрансферной и фосфатазной активностями (Tatebayashi et al., 2020). Показано, что SLN1 и SHO1 чувствительны к изменениям физико-химических свойств мембраны, однако тонкий механизм рецепции сигнала остается неясным. Показана чувствительность SLN1 и SHO1 к изменению вязкости мембраны (Hayashi, Maeda, 2006). Установлено, что в регуляции активности SLN1 и SHO1 участвуют рафты, и высказано предположение об их участии в регуляции осмосенсерных механизмов HOG-пути. Предполагают, что клетки дрожжей могут воспринимать осмотический стресс как изменения структурных и/или физических свойств рафтов (Tanigawa et al., 2012). В оптимальных условиях гистидин-киназный домен SLN1 автофосфорилирован, при участии фосфотрансферного белка YPD1 фосфат передается на регулятор ответа SSK1, что ингибирует каскад MAP-киназ.
При осмотическом воздействии происходит ингибирование фосфорилирования SLN1, в результате чего SSK1 оказывается нефосфорилированной и становится способной активировать каскад MAP-киназ, что приводит в итоге к активации MAP-киназы HOG1, которая переносится в ядро и активирует экспрессию генов синтеза и обмена глицерина. В геномах мицелиальных грибов идентифицировано большое число генов гистидинкиназ: 10 у Magnaporthe oryzae, 11 у Neurospora crassa, 16 у Fusarium verticillioides, 17 у Botrytis cinerea и 21 у Cochliobolus heterostrophus (Catlett et al., 2003). В отличие от генов гистидинкиназ, для фосфотрансферного белка YPD1 известен только один ген, ортологи которого обнаружены в геномах различных в систематическом отношении грибов (Ascomycota, Basidiomycota, Zygomycota) (Fassler, West, 2013).
В условиях осмотического стресса необходимым условием является поддержание стабильности и гибкости мембраны. При этом показано, что большие колебания текучести мембран связаны с низкой способностью к выживанию экстремофильных дрожжей в условиях осмотического стресса (Turk et al., 2011). На текучесть мембраны влияют такие параметры, как СН ЖК мембранных ФЛ и соотношение Ст и ФЛ. Увеличение СН способствует повышению текучести, а увеличение соотношения Ст и ФЛ – ее снижению. У галотолерантных дрожжей D. hansenii показано, что при повышении солености оба механизма работают одновременно (Turk et al., 2007b), что, по-видимому, способствует поддержанию вязкости мембраны. Также показано, что сильный галотолерант H. werneckii в оптимальном диапазоне концентраций NaCl 6–14% поддерживает текучесть и соотношение Ст и ФЛ на постоянном уровне (Turk et al., 2004).
Повышение СН мембранных ФЛ (увеличение в их составе долей ненасыщенных ЖК) является одним из наиболее распространенных ответов грибов на гиперосмотическое воздействие и характерно для дрожжей Candida membranefaciens, H. wernekii, Aureobasidium pullulans, D. hansenii, Zygosaccharomyces rouxii и мицелиального гриба Aspergillus niger (Khaware et al., 1995; Turk et al., 2004; Turk et al., 2007; Ianutsevich et al., 2016a; Wang et al., 2020). При этом у галотолерантных дрожжей H. werneckii и A. pullulans при повышении солености в диапазоне концентраций NaCl, в котором наблюдается достаточно высокая скорость роста культур, показано повышение экспрессии генов ферментов синтеза ненасыщенных ЖК – десатураз Δ9-(OLE1), Δ12-(ODE12) и элонгазы (ELO1) (Gostinčar et al., 2008, 2009), что согласуется с ранее полученными биохимическими данными. Повышение экспрессии генов Δ9-, Δ12-десатураз в ответ на гиперосмотическое воздействие показано также у Aspergillus oryzae (He et al., 2018). Однако при повышении синтеза полиненасыщенных ЖК возрастает уровень окислительного стресса (Ruenwai et al., 2011), что является дополнительным стрессовым фактором. Падение экспрессии генов десатураз при дальнейшем повышении солености, вероятно, связано со снижением скорости роста культур, а также с повышением уровня окислительного стресса (Gostinčar et al., 2009).
Кроме того, корреляция между повышением СН и ростом осмоустойчивости показана на примере мутантных штаммов S. cerevisiae (Rodríguez-Vargas et al., 2007). Установлено, что дикий штамм S. cerevisiae, содержащий только Δ9-десатуразу и поэтому способный синтезировать только мононенасыщенные ЖК, был менее устойчивым к гиперосмотическому воздействию, по сравнению с мутантными штаммами, содержащими дополнительно встроенные гены Δ12-десатураз, экспрессия которых приводила к накоплению в составе мембранных липидов линолевой кислоты (С18:2 Δ9,12) и, как следствие, повышению их СН.
Напротив, у галофильного мицелиального гриба Aspergillus montevidensis ZYD4 под действием гиперосмотического шока наблюдалась обратная тенденция – повышалась экспрессия генов, отвечающих за синтез насыщенных ЖК и β-окисление (Ding et al., 2019), что говорит о том, что у данного гриба, возможно, задействованы другие механизмы защиты от гиперосмотического воздействия.
Другим важным компонентом мембран являются Ст, которые участвуют в поддержании стабильности/целостности мембраны, регулируют текучесть, способствуют снижению пассивной диффузии путем уменьшения проницаемости мембраны (Athanasopoulos et al., 2019). Наряду со СЛ и белками, Ст входят в состав рафтов, участвующих в везикулярном транспорте и сигналлинге, в том числе, в восприятии сигнала об изменении осмотических условий среды (Golub et al., 2004; Lingwood, Simons, 2010; Tanigawa et al., 2012). В результате осмотического воздействия у S. cerevisiae, D. hansenii, Z. rouxii растет количество Ст (Hosono, 1992; Turk et al., 2004; Turk et al., 2007a). Также показано, что мутанты S. cerevisiae, неспособные синтезировать эргостерин, более чувствительны к осмотическому стрессу (Kodedová, Sychrová, 2015). Однако в отдельных исследованиях на примере S. cerevisiae и Candida glabrata показана активация генов синтеза ФЛ под действием осмотического стресса (Rep et al., 2000; Wu et al., 2019).
Соотношение Ст и ФЛ в мембране оказывает влияние на ее текучесть. Высказано предположение о том, что относительно низкое соотношение Ст и ФЛ является важной характеристикой галотолерантных грибов, что показано на примере H. wernekii, P. triangularis, Fusarium sp., и D. hansenii, тогда как у осмочувствительных грибов, таких как S. cerevisiae и Z. rouxii, соотношение Ст и ФЛ более высокое и при увеличении солености растет (Hosono, 1992; Turk et al., 2004, 2007a; Smolyanyuk et al., 2013).
Таким образом, изменения состава липидов грибов в гиперосмотических условиях многообразны и связаны с регуляцией текучести мембран и модификацией структуры мембранных рафтов. Среди них сложно выделить универсальные реакции адаптации к данному виду стрессовых воздействий, что связано, возможно, с видовыми особенностями грибов, а также с методическими различиями в подходах к изучению этого явления. Тем не менее, наиболее распространенным ответом на осмотическое воздействие является повышение СН мембранных ФЛ, а общей чертой галофильных и галотолерантных грибов является поддержание соотношения Ст и ФЛ на относительно низком уровне.
ЛИПИДЫ МИКРОМИЦЕТОВ В УСЛОВИЯХ ХОЛОДОВЫХ ВОЗДЕЙСТВИЙ
Холодовой шок (ХШ) возникает, когда культуру гриба, растущего в оптимальных температурных условиях, помещают в условия, где наблюдается остановка ростовых процессов. Обычно такие условия соответствуют понижению температуры на 15–20°С относительно оптимальных условий, но в целом зависят от температурного диапазона роста гриба. Различают умеренный ХШ и холодовое воздействие в области кристаллизации воды (0–4°С). В отличие от тепловых, холодовые воздействия не приводят к деградации биополимеров, но значительно изменяют их свойства. Так, при ХШ наблюдается снижение активности мембраносвязанных ферментов и транспортеров, скорости трансляции и фолдинга, возникает стабилизация вторичных структур РНК и ДНК, повышается упорядоченность мембранных липидов, приводящая к снижению текучести, т.е. ригидификации мембран (Sahara et al., 2002; Redón et al., 2012).
В восприятии и трансдукции холодового сигнала у S. cerevisiae участвует HOG-путь, причем только ветвь SLN1 (Hayashi, Maeda, 2006). Но пока нет ясности в том, что “чувствует” сенсор гистидинкиназа SLN1, – ригидификацию мембраны под воздействием холода или фазовый переход мембранных липидов.
Ответ на ХШ является комплексным и включает синтез осмолитов (глицерина, трегалозы), белков ТШ, компонентов антиоксидантной системы, изменение состава мембранных липидов (Inouye, Phadtare, 2014).
На генетическом уровне при воздействии умеренного ХШ (10°С) на культуру S. cerevisiae, растущую в оптимальных условиях (30°С), наблюдается глубокая перестройка метаболизма, сопровождающаяся изменением экспрессии 25% генов, причем стимуляция экспрессии наблюдается в 536 генах, а снижение – в 488 генах (Sahara et al., 2002). При холодовом воздействии наблюдается переход мембраны от жидкокристаллического к гелевому состоянию. Для жидкокристаллического состояния характерно сочетание высокой упорядоченности с большой подвижностью молекулярных компонентов мембраны. В гелевом состоянии увеличивается плотность упаковки липидов, в результате чего существенно изменяются свойства ферментов, каналов, переносчиков и других функционально значимых компонентов мембраны. Это, в свою очередь, приводит к изменению проницаемости мембраны, нарушению биохимических реакций, рецепторных и других процессов. Текучесть мембраны зависит от свободного движения ацильных групп мембранных ФЛ, латеральной диффузии и колебательного движения ФЛ, а также взаимодействия между различными доменами в мембране (Hayashi, Maeda, 2006).
Одним из основных ответов на холодовое воздействие является стимуляция экспрессии генов десатураз, действие которых приводит к появлению дополнительных двойных связей в ацильных цепях ФЛ, вследствие чего текучесть мембраны повышается. У S. cerevisiae за этот процесс отвечает единственная десатураза OLE1 (Δ9-десатураза), которая кодируется геном OLE1 (Nakagawa et al., 2002). Этот связанный с мембраной ЭПР фермент катализирует внедрение двойной связи между 9-м и 10-м углеродными атомами пальмитоил-КоА и стеароил-КоА. У дрожжей при росте в холодных условиях (5°С) дополнительно наблюдается повышение активности синтетазы ЖК, что приводит к усиленному образованию пальмитиновой кислоты, из которой с помощью Δ9-десатуразы образуется пальмитолеиновая кислота, т.е. происходит не только увеличение СН ацильных цепей мембранных липидов, но и их укорочение. У мицелиального мезофильного гриба A. niger (Ianutsevich et al., 2016a) и у термофила Rhizomucor miehei (Ianutsevich et al., 2020b) под действием ХШ обнаружено повышение СН мембранных липидов за счет увеличения доли линолевой кислоты.
Однако на текучесть мембран влияют не только СН ЖК, но и белки теплового шока (БТШ; heat shock proteins, HSP). Так, малый белок теплового шока HSP12 образуется в ответ на различные воздействия (тепловой, холодовой, осмотический, окислительный шоки, высокие концентрации сахаров и этанола) (Inouye, Phadtare, 2014; Tiwari et al., 2015). У S. cerevisiae холодовое воздействие (10°С) приводит к подавлению экспрессии большинства белков теплового шока и стимуляции экспрессии HSP12 и HSP26 (Sahara et al., 2002). Полагают, что эти белки могут влиять на текучесть мембран, а HSP12 необходим для криоустойчивости.
На текучесть мембран холодоустойчивых дрожжей влияет и состав мембранных липидов, в частности, соотношение Ст/ФЛ (Gostinčar, Gunde-Cimerman, 2018): снижение этого соотношения приводит к увеличению текучести мембран. Однако исследование влияния экзогенных ЖК и Ст на адаптацию мезофильных дрожжей к холодовым условиям (13°С) показало, что наибольшим эффектом обладали пальмитолеиновая кислота и эргостерин, при этом в клетках наблюдалось самое высокое соотношение Ст/ФЛ (Redón et al., 2009). У мезофильного гриба A. niger под воздействием умеренного ХШ (16°С, 6 ч) возрастали доли Cт и ФК на фоне снижения ФХ и ФЭ (Ianutsevich et al., 2016a). Тогда как у термофильного гриба R. miehei (оптимум роста 40°С) ХШ (20°С) в течение 6 ч приводил к повышению доли ФК, но снижению доли Ст и изменению их состава: существенно снижалась доля эргостерина на фоне увеличения 5-дигидроэргостерина (Ianutsevich et al., 2020). Поддержание гомеостаза мембран требует постоянного образования ФЛ, которые синтезируются в ЭПР, аппарате Гольджи и митохондриях. Делеция гена HNM1, кодирующего пермеазу, отвечающую за транспорт холина и этаноламина в клетку, показала, что центральную роль при адаптации к низким температурам играет путь синтеза ФЛ de novo. Мутант S. cerevisiae opi3Δ с низким содержанием ФХ, в отличие от мутанта hnm1Δ, не способен к росту при понижении температуры до 13°С (Redón et al., 2012).
Для понимания механизмов адаптации к холодовым воздействиям важно исследовать не только ответ на ХШ у мезофильных грибов, но и особенности адаптации к низким температурам у холодоустойчивых грибов, которые колонизируют глубины океанов, ледники и полярные районы, выполняя важную роль в круговороте веществ. Земля – холодная планета, более 85% биосферы постоянно подвергается холодовому воздействию ниже 5°С (Margesin, Miteva, 2011). Облигатными психрофилами называют грибы, не способные к росту при температуре выше 20°С, но растущие при 0°С или ниже, при этом оптимальный температурный диапазон роста составляет 10–15°С (Rossi et al., 2009). В отличие от мезофила S. cerevi--siae, имеющего одну Δ9-десатуразу, психрофильные дрожжи при росте в условиях 4°С значительно увеличивают количество полиненасыщенных ЖК общих липидов, особенно линолевой (С18:2 Δ9,12) и α-линоленовой (С18:3 Δ9,12,15). Например, у психрофильных дрожжей Leucosporidium frigidum и L. nivalis, которые растут при температуре –1°С, 80% ЖК представлены линоленовой (35–50%) и линолевой (25–30%) кислотами, что приводит к очень высокой СН (>2) (Watson et al., 1976).
Важное значение для криоустойчивости имеют осмолиты трегалоза и глицерин, синтез которых регулируется HOG-путем. Делеция гена HOG1 не влияет на рост дрожжей при 12°С, но снижает криоустойчивость при 4°С, поскольку не происходит индукции генов синтеза трегалозы и глицерина (Inouye, Phadtare, 2014). Нужно подчеркнуть, что трегалоза является уникальным осмолитом, защищающим от окисления двойные связи ацильных цепей ФЛ путем образования многочисленных водородных связей с их головками, что в итоге оказывает протекторный эффект для макромолекул и мембран клетки (Sum et al., 2003; Rangel, 2011). Грибы вечно холодных мест обитания подвергаются жесткому действию ультрафиолетовых лучей (УФ), в основном УФ-А (315–400 нм) и УФ-В (280–315 нм), которые оказывают как прямое, так и опосредованное (путем образования АФК) повреждающее действие на клеточные макромолекулы и мембраны. Холодоустойчивые дрожжи синтезируют фотозащитные соединения – каротиноиды (торулародин, торулен, β-каротин и γ-каротин) и микоспорин глутаминол-глюкозид (Moliné et al., 2014). Полагают, что каротиноиды могут быть ассоциированы с мембранами, влиять на их проницаемость, защищать от АФК, возникающих при различных стрессорных воздействиях. Так, дрожжи рода Dioszegia являются рекордсменами по выживаемости в условиях УФ-облучения, образуя наибольшее количество каротиноидов и микоспорина. Роль повышенной меланизации у холодоустойчивых грибов связывают не только с защитой от УФ излучений, но и с термальным меланизмом – механизмом терморегуляции, обусловленным способностью меланина поглощать энергию и превращать ее в тепло (Cordero et al., 2018).
Защитным дейтствием обладают антифризные белки, способные связываться с кристаллами льда и тормозить его рост. Например, у дрожжей рода Glaciozyma антифризный белок LeIBP секретируется клеткой и защищает цитоплазматическую мембрану от кристаллизации воды (Kim et al., 2014). Усиливают это действие соли и внеклеточные полисахариды, которые накапливаются в каналах льда и помогают сохранить воду в жидком состоянии.
Состав Ст у психрофильных грибов малоисследован, но обнаруженная взаимосвязь между устойчивостью к холоду и системой деградации неполноценных белков в ЭПР (Endoplasmic reticulum-associated degradation, ERAD) может быть связана с ферментами синтеза ЖК и Ст, которые локализованы в мембранах ЭПР. При увеличении количества неправильно свернутых белков, что наблюдается при всех стрессовых воздействиях, возникает ответ, приводящий к активации транскрипции шаперона Kar2 из семейства HSP70 (Haas, 2014) и ERAD пути. Показано, что 10-кратное увеличение количества связанного c мембраной ЭПР фермента 3-гидрокси-3-метил-глутарил-КоА редуктазы способствует биогенезу кармелл (karmellae) – уникального участка гладкого ЭПР со складчатыми мембранами и ядром. Этот фермент контролирует ключевую реакцию пути синтеза Ст – образование мевалоновой кислоты. Было установлено, что три гена (UBC7, CUE1 и DOA10) необходимы как для биогенеза кармелл, так и для адаптации к низким температурам. Под воздействием умеренного холода (16°С) у S. cerevisiae происходит нарушение образования кармелл, и существенно снижается доля эргостерина на фоне повышения долей его предшественников в составе Ст (Loertscher et al., 2006). Кроме того, транскрипция гена OLE1, кодирующего единственную Δ9 десатуразу у дрожжей S. cerevisiae, регулируется локализованным в мембране ЭПР транскрипционным фактором Mga2p (Nakagawa et al., 2002). Полагают, что неактивная форма Mga2p (120 кДа) действует как низкотемпературный сенсор, “чувствующий” повышенную плотность укладки ФЛ, в результате чего изменяется конформация фактора, что приводит к его убиквитинизации и протеасомному процессингу. Образующаяся активная форма Mga2p (90 кДа) переносится в ядро и активирует экспрессию гена OLE1 (Ballweg et al., 2020).
Исследования состава мембранных липидов психрофильных грибов до настоящего времени фокусировались только на изучении их жирнокислотного состава, причем в общих липидах, а не в мембранных. Для понимания роли мембран в адаптации к холоду у психрофилов необходимы дальнейшие исследования состава ФЛ и Ст как основных компонентов мембран. Нужно подчеркнуть, что защита мембран в условиях холодовых воздействий осуществляется не только с помощью изменения их состава, но и путем синтеза протекторных соединений – трегалозы, глицерина, малых белков теплового шока, каротиноидов и микоспоринов, антифризных белков. В результате сравнения ответа на ХШ у мезофильных грибов и механизмов адаптации психрофильных можно сделать вывод о том, что эти механизмы схожи в случае умеренных температур и заметно различаются в зоне кристаллизации воды, где возникают дополнительно специфические изменения.
ЛИПИДЫ МИКРОМИЦЕТОВ ПРИ ТЕПЛОВЫХ ВОЗДЕЙСТВИЯХ
Тепловой шок (ТШ) возникает при повышении температуры на 8–12°С выше оптимальной (Singer, Lindquist, 1998), что приводит к остановке клеточного цикла, вызывает денатурацию белков и образование белковых агрегатов, повреждение клеточного цитоскелета, разрушение актиновых филаментов, нарушение транспортных процессов, снижение уровня АТФ, повреждение РНК (Verghese et al., 2012), а также сопровождается окислительным стрессом вследствие образования активных форм кислорода (Morano et al., 2012). Ответ на ТШ является комплексным и включает синтез БТШ, трегалозы, ферментов антиоксидантной защиты, изменение структуры воды и состава мембран (Piper, 1993).
Повышение температуры приводит к изменению конформации белков, молекул РНК, а также вызывает изменения структуры мембран (Balogh et al., 2013). Каждый из вышеуказанных компонентов может служить в качестве клеточного термосенсора. Хотя мембранные липиды сами не обладают каталитической активностью, функции ряда мембраносвязанных белков, отвечающих за термосенсинг и передачу сигналов, напрямую зависят от состава и структуры липидного бислоя (Escribá et al., 2008). Снижение вязкости мембран в результате повышения температуры играет ключевую роль в запуске ответа на ТШ (Balogh et al., 2013).
У S. cerevisiae индукция генов в ответ на ТШ может происходить по двум регуляторным путям, контролируемым факторами транскрипции Msn2/Msn4 (специфичны для грибов) и Hsf1 (консервативны у всех эукариот) (Kimata et al., 2018). Фактор Msn2/Msn4 отвечает за экспрессию генов ферментов антиоксидантной системы и метаболизма углеводов и может также участвовать в ответе на общий стресс окружающей среды (ESR – environmental stress response) (Leach et al., 2016). Фактор Hsf1 отвечает за экспрессию генов молекулярных шаперонов и их кофакторов, а также трегалозы при ТШ; играет роль в вирулентности C. albicans (Leach et al., 2016). ТШ также активирует HOG-путь у дрожжей через мембраносвязанный сенсор гистидинкиназу SHO1 (Winkler et al., 2002). У Aspergillus fumigatus в адаптации к ТШ участвуют гомологи HOG1 – MpkC и SakA (Bruder Nascimento et al., 2016). В результате воздействия ТШ начинается экспрессия особых белков теплового шока (БТШ), которые выполняют различные функции для защиты клетки от повышенных температур (Rangel, 2011). Малые БТШ способны повышать ригидность бислоя, стабилизируя его во время ТШ (Horváth et al., 2008). В стабилизации мембран на ранних стадиях ТШ участвуют малые БТШ Hsp16, Hsp15.8 у дрожжей S. pombe (Glatz et al., 2016) и Hsp12 у S. cerevisiae (Welker et al., 2010).
Для защиты макромолекул и мембран клетки от ТШ важно накопление нередуцирующего дисахарида трегалозы (Hong et al., 2015; Zhang, Xu, 2018). Высокие уровни трегалозы были зарегистрированы как у мезофильных микромицетов при ТШ (Терёшина и соавт., 2010; Morano et al., 2012), так и у термофилов при оптимальной температуре роста (Yanutsevich et al., 2014; Ianutsevich et al., 2016b, 2020a). Помимо множества других функций (резервный углевод, использующийся в процессах прорастания и хранения спор грибов; протектор при различных стрессорных воздействиях; регулятор процесса гликолиза; стабилизатор концентрации глюкозы и АТФ в клетке; антиоксидант, снижающий скорость окисления ненасыщенных ЖК), трегалоза стабилизирует мембраны клетки, образуя многочисленные водородные связи с полярными головками ФЛ (Sum et al., 2003).
Снижение вязкости мембран при ТШ путем изменения СН мембранных ФЛ подразумевает увеличение доли насыщенных ЖК в составе мембранных липидов, что увеличивает температуру фазового перехода (Sinensky, 1974). Такая закономерность обычно наблюдается при длительном выращивании при повышенной температуре (Glatz et al., 2016; Péter et al., 2017; Renne, Kroon de, 2018). Известно, что у эукариот отсутствуют сатуразы, способные к быстрому превращению ненасыщенных ацильных цепей ФЛ в насыщенные (Balogh et al., 2013), поэтому накопление насыщенных ЖК возможно только путем их синтеза de novo (Weete, 1974; Péter et al., 2017), который в условиях ТШ затруднителен. Состав мембранных липидов мезофильных микромицетов при ТШ коррелирует с составом мембран термофильных грибов, приспособленных к жизни при высоких температурах. Жирнокислотный состав мембранных липидов термофилов и мезофилов схож: основными ЖК являются пальмитиновая (C16:0), стеариновая (C18:0), олеиновая (C18:1n9c), линолевая (C18:2n6c) и α-линоленовая (C18:3n3) (Weete, 1974; Ianutsevich et al., 2016b; Salar, 2018). При этом, по сравнению с мезофилами, термофильные грибы содержат больше насыщенных ЖК в составе мембранных липидов (Satyanarayana, Johri, 1999; Salar, 2018). В то же время, при ТШ на примере трех мезофильных (A. niger, Pleurotus ostreatus, Cunninghamella japonica) (Терёшина et al., 2010, 2011) и трех термофильных (R. miehei, Rhizomucor tauricus, Myceliophthora thermophila) грибов различного систематического положения не было обнаружено снижения СН основных мембранных ФЛ (Yanutsevich et al., 2014; Ianutsevich et al., 2016b). У дрожжей S. cerevisiae при ТШ был показан рост уровня мононенасыщенных ЖК (C16:1, C18:1), коррелирующий с повышением термоустойчивости организма (Kim et al., 2006). На примере зигомицета Cunninghamella echinulata было показано, что длительная адаптация к повышенным температурам также вызывает увеличение содержания олеиновой кислоты (C18:1) в составе ФЛ (Li et al., 2019). Интересным представляется возможный механизм регуляции СН мембранных липидов при ТШ у Schizosaccharomyces pombe: синтез ТАГ из ФЛ позволяет синтезированным de novo насыщенным ЖК присоединяться к полярным головкам структурных липидов (Péter et al., 2017).
Гомеовязкостная адаптация представляет собой комплексный механизм и осуществляется не только путем изменения СН ФЛ, но и за счет изменения соотношения различных ФЛ в мембране.
При тепловых воздействиях происходит рост уровня стабилизирующих мембрану компонентов: молекул ФХ, образующих бислойные структуры, или молекул ФИ, способных образовывать водородные связи с соседними ФЛ, уплотняя структуру бислоя (Klose et al., 2012). На примере C. echinulata было показано, что продолжительное воздействие температур, на 8–10°C превышающих оптимальное значение (длительная адаптация), приводило к увеличению соотношения ФХ/ФЭ, что объясняется активацией ферментов синтеза ФХ из ФС и ФИ (Li et al., 2019). Снижение содержания небислойных ФЭ также наблюдалось при повышении температуры у S. pombe (Glatz et al., 2016). В клетках дрожжей, выращенных при повышенных температурах, наблюдалось снижение количества небислойных ФЭ, несмотря на их более высокую температуру фазового перехода по сравнению с бислойными ФХ (Renne, Kroon de, 2018). В то же время для ряда микромицетов было показано увеличение доли небислойных ФЛ, что может служить сигналом к запуску клеточного ответа. Так, у дрожжей при снижении соотношения ФХ/ФЭ происходит накопление стабилизирующего мембрану малого БТШ HSP12 и отвечающего за образование изгибов мембраны белка RTN2 (Thibault et al., 2012). Небислойные липиды отвечают за формирование Lε участков мембран в гексагональной фазе, что облегчает связывание с ними G-белков и влияет на стабильность трансмембранных белковых комплексов путем изменения профиля латерального давления (Escribá et al., 2008; Renne, Kroon de, 2018). У ряда микромицетов при ТШ наблюдалось повышение доли небислойных ФК на фоне снижения долей ФХ и ФЭ. Эта закономерность была характерна для мезофильных грибов A. niger, P. ostreatus и C. japonica (Терёшина и соавт., 2010, 2011), а также для термофилов R. miehei, R. tauricus и M. thermophila (Yanutsevich et al., 2014; Ianutsevich et al., 2016b). Накопление ФК было отмечено при ТШ у базидиомицета Ganoderma lucidum (Liu et al., 2017b), а также у дрожжей Yarrowia lipolytica при выращивании в условиях повышенной температуры (Sekova et al., 2019). С одной стороны, ФК можно рассматривать как соединение, с которого начинается синтез ФЛ. Тогда увеличение количества ФК может свидетельствовать о деградации ФЛ в условиях ТШ в результате активизации мембраносвязанной фосфолипазы D (Liu et al., 2017b). С другой стороны, ФК является биологически активным соединением с сигнальной и регуляторной функциями (Shin, Loewen, 2011; Jang et al., 2012; Barman et al., 2018). Наиболее вероятной функцией ФК в условиях ТШ считают участие в процессах эндо- и экзоцитоза, что обусловлено способностью ФК образовывать микродомены и участвовать в образовании изгибов мембран и везикул (McMahon, Gallop, 2005; Cazzolli et al., 2006; Kooijman, Burger, 2009). Интересно, что для термофильных грибов характерно поддержание высокого уровня ФК (до 35% от суммы мембранных липидов) при оптимальных условиях (Yanutsevich et al., 2014; Ianutsevich et al., 2016b; Salar, 2018). То есть состав мембранных липидов у мезофилов в условиях ТШ приближен к термофилам.
Поддержание вязкости мембран может осуществляться при помощи стабилизирующих соединений – Ст и СЛ. Накопление Ст и СЛ в составе мембран микромицетов при ТШ связывают с образованием мембранных микродоменов, рафтов (Alvarez et al., 2007). Рост уровня Ст при ТШ наблюдался у микромицетов различного систематического положения, как мезофилов, так и термофилов (Терёшина и соавт., 2010; Ianutsevich et al., 2016b). Упорядочивая ацильные цепи в жидкокристаллической фазе, Cт повышают ригидность мембран при повышении температуры (Ernst et al., 2016). Стоит отметить, что для термофильных грибов характерно высокое содержание Ст в составе мембранных липидов на всех стадиях роста при оптимальных условиях (Yanutsevich et al., 2014; Ianutsevich et al., 2016b).
Рост уровня СЛ при ТШ был показан для дрожжей и мицелиальных грибов (Chen et al., 2013; Ianutsevich et al., 2016b; Řezanka et al., 2018). Повышенный уровень СЛ необходим для активации процессов трансляции при ТШ (Meier et al., 2006). СЛ являются сигнальными молекулами (Epstein, 2013; Fernandes et al., 2018), регулируют начало процессов трансляции, формируя p-тельца (Cowart et al., 2010).
Таким образом, липидный бислой играет важную роль в сенсинге и запуске ответа на ТШ. На ранних стадиях ТШ защита мембран осуществляется при помощи протекторных соединений – трегалозы и БТШ. Дальнейшая стабилизация бислоя осуществляется также путем изменения собственно состава мембранных липидов. Это может осуществляться за счет замещения ацильных цепей ФЛ, изменения соотношения бислойных и небислойных компонентов мембран, а также повышения содержания СЛ и Ст.
ЛИПИДЫ МИКРОМИЦЕТОВ И ТОКСИЧНОСТЬ СРЕДЫ
Грибы секвестрируют, разлагают и/или преобразуют широкий спектр загрязнителей: органических и неорганических веществ, как биотического происхождения, так и ксенобиотиков (Gadd, 2016). Грибные популяции и сообщества, будучи активно вовлеченными в круговорот веществ в локальном и глобальном масштабах, участвуют в ослаблении негативных эффектов загрязнителей и микоремедиации загрязненных сред. В целом грибы характеризуются устойчивостью к загрязняющим веществам, благодаря широкому набору адаптационных признаков, что делает их типичными обитателями загрязненных сред (Марфенина, 2005; Терехова, 2007). Механизмы резистентности к неблагоприятным условиям исследованы недостаточно. Устойчивые виды грибов обычно редко встречаются в незагрязненных почвах, однако могут стать доминирующими при стрессе (например, токсичных металлов) (Марфенина, 2005; Терехова, 2007). При этом загрязняющие вещества способны проявлять по отношению к грибам токсичность (pollutant toxicity), т.е. вызывать нарушение биохимических, морфологических, физиологических характеристик организмов, что в итоге приводит к изменениям на уровне популяций и сообществ (Терехова, Швед, 1994; Gadd, 2016; Терехова и соавт., 2017).
Органические и неорганические загрязнители оказывают разнообразные токсические воздействия на грибные клетки: 1) ингибируют ферментативную активность; 2) вызывают окислительный стресс или взаимодействуют с системами, которые обычно защищают от вредного воздействия свободных радикалов; 3) токсичные металлы вытесняют или заменяют незаменимые ионы металлов; 4) вызывают нарушение целостности мембран (Горбунова, Терехова, 1995; Baldrian, 2010; Calonne et al., 2014). Первым физико-химическим барьером, который встречают загрязняющие вещества на пути продвижения внутрь грибных клеток, являются клеточная стенка и цитоплазматическая мембрана, которая отвечает за взаимодействие с окружающей средой (Mantil et al., 2019; Hąc-Wydro et al., 2019). Воздействуя на мембраны грибов, загрязняющие вещества способны вызывать количественные и качественные изменения их липидного состава.
Органические загрязняющие вещества (ОЗВ) в большинстве своем подвержены грибной деградации, поэтому интерес к исследованиям различных аспектов их взаимодействия с грибами связан с перспективой внедрения микоремедиации природных сред. Преимущественно оценивают влияние ОЗВ на грибы, которые могут выступать в качестве их деструкторов. Спектр изучаемых ОЗВ гетерогенен и включает полициклические ароматические углеводороды – ПАУ (антрацен и бенз(а)пирен), бисфенолы (A, S и F), гербициды (хлорацетанилидные гербициды и гербицид 2,4-D), персистирующие загрязнители (трибутултин и его хлорид).
ОЗВ способны проникать через клеточную мембрану, нарушая ее целостность. Эксперименты по измерению поверхностного давления в липидных монослоях показали, что бисфенолы активнее проникают через модельные грибные мембраны, чем через модельные бактериальные мембраны (Hąc-Wydro et al., 2019). Такой механизм действия напрямую связывают со способностью бисфенолов образовывать водородные связи с молекулами ФЛ (Hąc-Wydro et al., 2019). На примере мицелиальных грибов была подтверждена способность ОЗВ к проникновению через плазматическую мембрану и нарушению ее целостности путем повышения проницаемости. В экспериментах по поглощению йодистого пропидия показано, что хлорид трибутултина повышает проницаемость мембраны гриба Metarhizium robertsii (Siewiera et al., 2015), а гербицид 2,4-D – Trichoderma harzianum (Mironenka et al., 2020). Авторы (Nykiel-Szymańska et al., 2019) зафиксировали различную степень изменения проницаемости мембран (а значит нарушение их целостности) среди 34 видов Trichoderma spp., на которые воздействовали хлорацетанилидными гербицидами. Авторы отмечают, что оба механизма, как поддержание целостности, так и ее частичное нарушение, могут рассматриваться как адаптационные механизмы грибов, что будет обсуждено ниже. Изменение целостности мембран под действием ОЗВ происходит за счет качественной и количественной трансформации состава липидов (Li et al., 2006; Siewiera et al., 2015; Nykiel-Szymańska et al., 2019; Mironenka et al., 2020).
Под действием ОЗВ изменяется содержание и активность биосинтеза Ст, ФХ и ФЭ. Снижением количества Ст (в частности, 24-метилхолестерина) и ФХ, а также накоплением продуктов перекисного окисления липидов (ПОЛ) объясняют угнетение роста арбускулярно-микоризного гриба Glomus irregulare при загрязнении ПАУ (концентрации антрацена – 25 и 50 мг/л; бенз(а)пирена – 35.3 и 70.6 мг/л) (Debiane et al., 2011). Воздействие бенз(a)пирена в наибольшей из исследованных концентраций (71 мг/л) способствовало уменьшению количества предшественников Ст и ФЛ (в основном за счет ФХ, ФС и ФГ) в мицелии другого микоризообразующего вида Rhizophagus irregularis, не угнетая при этом мицелиальный рост (Calonne et al., 2014). При индуцированном окислительном стрессе, вызванным обработкой бенз(a)пиреном, отмечено снижение количества ФХ (Debiane et al., 2011; Calonne et al., 2014). Интересно, что на фоне снижения уровня ФХ происходила активация их биосинтеза, что свидетельствует о регенерации основных ФЛ (Calonne et al., 2014). Снижение доли ФХ и, следовательно, снижение отношения ФХ/ФЭ происходили в составе ФЛ коллекционных культур: у M. robertsii под действием хлорида трибутилтина (при концентрации 2.5 мг/л) (Siewiera et al., 2015) и T. harzianum под действием гербицида 2,4-D (при концентрации 100 мг/л) (Mironenka et al., 2020). Однако после инкубации 34 видов Trichoderma spp. с хлорацетанилидными гербицидами (при концентрации 50 мг/л) в составе ФЛ регистрировали как снижение, так и увеличение отношения ФХ/ФЭ (Nykiel-Szymańska et al., 2019). У коллекционного штамма мицелиального гриба Cunninghamella elegans трибутилтин (при концентрации 5 мг/л) вызывал снижение долей ФЭ и ФС на фоне повышения долей ФК, ФИ и ФХ, что приводило к росту отношения ФХ/ФЭ (Bernat et al., 2014).
Биосинтезы ФХ и ФЭ взаимосвязаны, и ФХ могут быть синтезированы из ФЭ (Xia et al., 2011). Соотношение между ФХ и ФЭ может характеризовать целостность мембраны. Повышение содержания ФХ стабилизирует липидный бислой, в то время как небислойный липид ФЭ имеет тенденцию образовывать гексагональную фазу, тем самым снижая текучесть мембраны и повышая проницаемость, что приводит к потере ее целостности (Li et al., 2006). Под действием ОЗВ адаптивные реакции липидного метаболизма у грибов могут выражаться как в снижении, так и в повышении отношения ФХ/ФЭ. Грибы, у которых в ответ на стресс этот показатель повышается, можно охарактеризовать как более устойчивые, способные к сохранению целостности бислоя (например, C. elegans и некоторые виды Trichoderma spp.). Снижение текучести мембран путем уменьшения соотношения ФХ/ФЭ запускает другой вид адаптивного механизма – компенсаторного. Такой механизм направлен на обеспечение постепенного поглощения ОЗВ и их деградации внутри клеток, что возможно при концентрациях, не вызывающих сильного токсического эффекта.
Помимо влияния на уровень ФХ и ФЭ, ОЗВ вызывают изменение содержания и активности биосинтеза других ФЛ, в частности ФК и КЛ, а также модификацию СН ФЛ. Включение [1-14C] ацетата в ФК усиливалось на фоне неизменности их количества в экстрарадикальном мицелии R. irregularis в присутствии бенз(а)пирена (Calonne et al., 2014). Авторы предполагают, что деградация ФК, являющихся предшественниками ФГ и ФС, компенсируется активацией их биосинтеза. Расходование ФК на передачу сигналов стресса может привести к замедлению биосинтеза ФГ, в котором участвуют ФК (Munnik, 2001; Nykiel-Szymańska et al., 2019). Увеличение доли ФК в составе ФЛ наблюдали у нескольких протестированных видов Trichoderma spp. при воздействии хлорацетанилидными гербицидами и у C. elegans при воздействии трибутилтином (Bernat et al., 2014; Nykiel-Szymańska et al., 2019). В липидном профиле обработанного гербицидом мицелия T. harzianum регистрировали более высокую долю молекулярных видов КЛ 72:7 и более низкую долю КЛ 72:8, что связывают со снижением соотношения между жирными кислотами С18:2 и С18:1 (Mironenka et al., 2020). Снижение степени ненасыщенности ФЛ отмечали в присутствии трибутилтина в мицелии C. elegans (Bernat et al., 2014). Из-за повышенного ПОЛ в обработанном гербицидом мицелии T. harzianum регистрировали еще и более высокое количество оксилипинов (9-HODE и 13-HODE) (Mironenka et al., 2020).
Качественные и количественные изменения в составе запасных липидов под действием ОЗВ не так очевидны. В работе Calonne et al. (2014) авторы зафиксировали активизацию гидролиза ТАГ в мицелии арбускулярно-микоризных грибов в присутствии ПАУ, что связывают с усилением синтеза хитина для укрепления клеточной стенки и блокировки поступления ПАУ внутрь грибных клеток. Как известно из более ранних исследований (Debiane et al., 2011), в ответ на вызванный присутствием ПАУ стресс клеточные стенки арбускулярно-микоризных грибов утолщаются.
Из ряда неорганических загрязняющих веществ наиболее часто исследуемыми являются тяжелые металлы (ТМ) и металлоиды, по причине их широкой распространенности в почвах (Baldrian, 2010) и потенциальной фунгицидной активности (Vesentini et al., 2007). Катионы некоторых металлов участвуют в обеспечении процессов жизнедеятельности живых организмов, токсичные же элементы (Hg, Cd, Pb, As) оказывают, в основном, негативное воздействие, накапливаясь в клетках. По отношению к неразлагаемым соединениям ТМ грибы проявляют способность к аккумуляции. ТМ проявляют по отношению к грибам различную токсичность, которая зависит от степени индуцируемых количественных и качественных изменений в составе мембранных липидов.
Подробные исследования состава грибных липидов при действии ТМ проведены на двух видах микромицетов: выделенном из незагрязненной почвы Curvularia lunata (Paraszkiewicz et al., 2009, 2010) и выделенном из сильно загрязненной металлами почвы Paecilomyces marquandii (Słaba et al., 2013). В работе (Paraszkiewicz et al., 2009) изучен состав ЖК C. lunata при обработке ионами Ni, Cu, and Zn в концентрациях, которые не ингибировали грибной рост (0.06, 0.32 и 0.98 г/л соответственно). В работе других авторов (Słaba et al., 2013) изучены липидные профили, состав ЖК и целостность цитоплазматической мембраны гриба P. marquandii при воздействии Zn, Cu, Pb, Ni и Cd в концентрациях, ингибирующих мицелиальный рост на 50% – ЕС50 (0.78, 0.29, 0.77, 0.18 и 0.28 г/л соответственно).
Под воздействием ионов Pb в составе ФЛ мицелия P. marquandii отмечено снижение доли ФХ и ненасыщенных ЖК, что приводило к существенным повреждениям цитоплазматической мембраны: авторы фиксировали почти 30-кратное увеличение поглощения йодистого пропидия относительно контроля (Slaba et al., 2013). По их мнению, сокращение доли ФХ, сопровождаемое значительным повышением доли ФК, возможно из-за активации фосфолипазы D, которая гидролизует ФХ до ФК.
Ответная реакция P. marquandii на воздействие Cd и Ni выражалась в увеличении доли ФХ в составе ФЛ мицелия (Słaba et al., 2013). Ионы Cd стимулировали возрастание степени насыщенности ФЛ в мицелии P. marquandii (Słaba et al., 2013), а ионы Ni – в мицелии как P. marquandii (Słaba et al., 2013), так и C. lunata (Paraszkiewicz et al., 2009, 2010). Изменение степени насыщенности в основном происходило за счет увеличения содержания стеариновой кислоты (С18:0) и уменьшения содержания линолевой кислоты (С18:2) (Paraszkiewicz et al., 2009, 2010; Słaba et al., 2013). По мнению авторов (Słaba et al., 2013), увеличение содержания ФХ в сочетании с возрастанием степени их насыщенности у P. marquandii способствовало поддержанию надлежащей текучести мембраны и приводило к снижению стресса, вызванного Cd и Ni. Интересно, что ионы Ni были более токсичными для C. lunata, вызывая заметные изменения ростовых и морфологических характеристик (Paraszkiewicz et al., 2009). Это может быть связано с тем, что выделенный из незагрязненной почвы гриб не имел резистентности к ТМ. Кроме этого C. lunata, способный в ответ на токсический стресс образовывать защитный внеклеточный полимер, под действием ионов Ni его не синтезировал (Paraszkiewicz et al., 2009).
Ионы Cu, одновременно с повышением доли ФХ и отношения ФХ/ФЭ в составе ФЛ, приводили к существенному повреждению мембран P. marquandii (Słaba et al., 2013). По мнению (Azevedo et al., 2007), высокая токсичность меди может быть связана с тем, что как переходный металл она вызывает повреждение мембран вследствие активации окислительного стресса. Аналогичные явления – окислительный стресс и ПОЛ – вызывает и никель (Paraszkiewicz et al., 2010).
Наименее токсичный из исследованного ряда металлов – цинк – не вызывал изменений состава ФЛ P. marquandii, а способствовал заметному увеличению доли ненасыщенных ЖК в составе ФЛ, в основном, за счет увеличения содержания линолевой кислоты (С18:2) (Słaba et al., 2013). Цинк оказался наименее токсичным и для C. lunata: в его присутствии не отмечены изменения в составе ЖК ФЛ (Paraszkiewicz et al., 2009).
Таким образом, регулирование липидного профиля и степени насыщенности ФЛ может быть важным адаптационным механизмом грибов в ответ на токсическое воздействие загрязняющих веществ, способствуя выживанию грибов в неблагоприятных условиях. ФЛ и Ст составляют основу клеточных мембран и отвечают за целостность их структуры. Наиболее универсальными откликами микромицетов, способствующими их устойчивости к воздействию загрязняющих веществ, являются увеличение содержания ФХ и насыщенных ЖК в составе ФЛ, активация биосинтеза ФК. Токсиканты, вызывая снижение количества ФХ и Ст, активацию ПОЛ, способны повреждать мембрану и ингибировать рост грибов.
ЗАКЛЮЧЕНИЕ
Ответ грибной клетки на стрессовые воздействия (осмотическое, холодовое, тепловое, токсическое) является комплексным, внутри которого липидный обмен играет одну из основных ролей. Сигнал стресса, передаваемый извне через меняющую свои физико-химические свойства цитоплазматическую мембрану, поступая в клетку, запускает многоступенчатую систему форфорилирования и экспрессию соответствующих генов, что приводит к синтезу мембраностабилизирующих компонентов (рис. 2). К данным компонентам относятся мембранные липиды; ферменты синтеза насыщенных и ненасыщенных ЖК; малые БТШ; белки-шапероны; осмолиты (трегалоза и глицерин); ферменты антиоксидантной защиты; протекторные пигменты. Мембраностабилизующие компоненты влияют на липидный обмен: трегалоза защищает от окисления двойные связи ацильных цепей ФЛ, малые БТШ способны повышать ригидность липидного бислоя.
Рис. 2.
Упрощенная иллюстрация комплексного ответа грибной клетки на стрессовые воздействия и роли в нем липидного обмена.
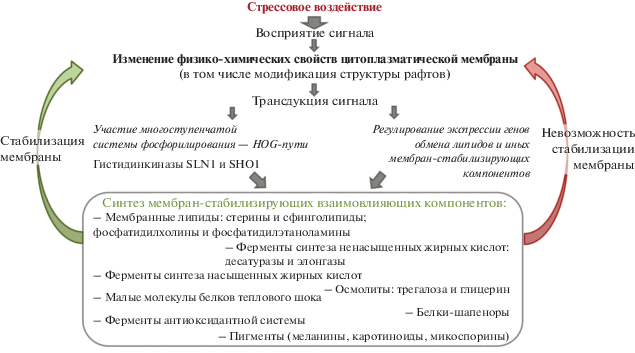
Воздействия стрессорных факторов приводят к качественным и количественным изменениям липидного состава, обеспечивающим адаптацию грибов к неблагоприятным условиям среды обитания. Изменения состава ФЛ, Ст и СЛ охарактеризованы как многообразные и неоднозначные, зависящие от силы воздействия, исходного состава липидов, генетически закрепленной резистентности грибов и способности к адаптации к внешним воздействиям (табл. 1). Важным условием для поддержания стабильности в условиях стресса является вязкость мембраны грибной клетки, которая зависит от СН ФЛ и отношения Ст/ФЛ. Изменение вязкости мембраны (как увеличение, так и уменьшение) рассматривается как адаптационный механизм в ответ на стрессорные воздействия и характерен для многих изученных видов грибов. Регулирование СН ФЛ чаще всего происходит за счет модулирования количества стеариновой (С18:0) и линолевой (С18:2) кислот. Представление о целостности мембран может составить соотношение между ФХ и ФЭ. Повышение уровня бислойных ФХ стабилизирует липидный бислой, в то время как небислойные ФЭ имеют тенденцию образовывать гексагональную фазу. Отсюда следует, что изменения общего содержания двух основных групп ФЛ (ФХ и ФЭ) представляют собой адаптивный ответ грибных клеток, в частности, на токсическое действие загрязняющих веществ. Ст и СЛ играют важную роль в стабилизации мембран, регулируя их текучесть. Грибы с высоким содержанием эргостерина менее чувствительны к экстремальным осмотическим и температурным воздействиям, токсичности загрязняющих веществ. Увеличение доли ФК в составе мембранных липидов является универсальной реакцией на описанные в обзоре неблагоприятные воздействия и может служить маркером состояния стресса микромицетов.
Таблица 1.
Обобщенные паттерны качественных и количественных изменений состава липидов грибов в результате осмотического, температурного воздействий и токсичности среды
| Грибы | Изменения липидов в результате стрессовых воздействий | Источник |
|---|---|---|
| Гиперосмотическое воздействие | ||
| Fusarium sp. | Повышение доли ФК и снижение доли Ст в составе мембранных липидов; снижение соотношения Ст/ФЛ | Smolyanyuk et al., 2013 |
| Saccharomyces cerevisiae | Повышение доли ФЭ в составе ФЛ; повышение количества Ст и соотношения Ст/ФЛ; небольшое повышение СН ФЛ | Turk et al., 2004 |
| Debariomyces hansenii | Повышение долей ФГ и Ст, снижение долей ФИ и ФС в составе мембранных липидов; повышение соотношения Ст/ФЛ и СН ФЛ | Turk et al., 2007 |
| Hortaea werneckii | Снижение доли ФХ в составе ФЛ; небольшое снижение соотношения Ст/ФЛ; небольшое увеличение СН ФЛ | Turk et al., 2004 |
| Phaeotheca triangularis | Небольшое снижение долей ФХ и ФЭ в составе ФЛ; количество Ст не меняется; повышение соотношения Ст/ФЛ | Turk et al., 2004 |
| Холодовое воздействие | ||
| Мезофильные дрожжи Saccharomyces cerevisiae | Небольшие изменения СН общих липидов при 4, 18, 30°С | Rossi et al., 2009 |
| Мезофильные дрожжи Candida sake |
Повышение СН общих липидов при 15 и 0°С | Gostinčar, Gunde-Cimerman, 2018 |
| Мезофильный микромицет Aspergillus niger | Ответ на холодовой шок: повышение долей ФК и Ст в составе мембранных липидов; повышение соотношения Ст/Фл; повышение СН ФЛ | Ianutsevich et al., 2016 |
| Термофильный микромицет Rhizomucor miehei | Ответ на холодовой шок: повышение доли ФК в мембранных липидах; снижение соотношения Ст/ФЛ; повышение СН ФЛ | Ianutsevich et al., 2020 |
| Психрофильные дрожжи Leucosporidium frigidurn, L. nivalis, L. gelodum | Повышение СН общих липидов за счет роста доли α-С18:3 при 17, 8 и –1°С | Watson et al., 1976 |
| Тепловое воздействие | ||
| Aspergillus niger, Pleurotus ostreatus, Cunninghamella japonica | Повышение доли ФК, Ст и СЛ в составе мембранных липидов; СН ФЛ не снижается | Терёшина и соавт., 2010, 2011 |
| Rhizomucor miehei, R. tauricus, Myceliophthora thermophila | Повышение доли ФК, Ст и СЛ в составе мембранных липидов; СН ФЛ не снижается | Yanutsevich et al., 2014; Ianutsevich et al., 2016 |
| Yarrowia lipolytica | Повышение доли ФК, Ст и СЛ в составе мембранных липидов; СН ФЛ не снижается | Sekova et al., 2019 |
| Schizosaccharomyces pombe | Снижение доли ФЭ в составе ФЛ; снижение СН ФЛ | Glatz et al., 2016; Péter et al., 2017 |
| Saccharomyces cerevisiae | Повышение доли СЛ в составе мембранных липидов | Cowart et al., 2010; Chen et al., 2013 |
| Воздействие токсикантов | ||
| Glomus irregulare | Снижение количества Ст и ФХ | Debiane et al., 2011 |
| Rhizophagus irregularis | Снижение количества предшественников Ст и ФЛ; интенсификация биосинтеза ФК | Calonne et al., 2014 |
| Metarhizium robertsii; отдельные культуры Trichoderma spp. |
Снижение доли ФХ и соотношения ФХ/ФЭ в составе ФЛ | Siewiera et al., 2015; Nykiel-Szymańska et al., 2019 |
| Trichoderma harzianum | Снижение доли ФХ и соотношения ФХ/ФЭ в составе ФЛ; повышение доли молекулярных видов КЛ 72:7 и снижение доли КЛ 72:8; повышение количества оксилипинов (9-HODE и 13-HODE) | Mironenka et al., 2020 |
| Cunninghamella elegans, отдельные культуры Trichoderma spp. | Снижение долей ФЭ и ФС на фоне повышения долей ФК, ФИ и ФХ в составе ФЛ; повышение соотношения ФХ/ФЭ; увеличение доли ФК | Bernat et al., 2014; Nykiel-Szymańska et al., 2019 |
| Paecilomyces marquandii; Curvularia lunata | Тяжелые металлы по мере снижения токсичности (Pb > Cu > Ni = Cd > Zn) вызывают меньшюю степень изменения долей ФХ и ненасыщенных ЖК в составе ФЛ | Paraszkiewicz et al., 2009; Paraszkiewicz et al., 2010; Słaba et al., 2013 |
Примечание. Обозначения как на рис. 1.
Таким образом, анализ литературы и собственные экспериментальные исследования позволяют заключить, что изменчивость липидных профилей, прежде всего мембранных структур, играет большую роль в адаптации микромицетов к стрессовым условиям среды. Мы полагаем, что именно с преобразованиями в липидном составе мембран связан основной механизм экологической пластичности и резистентности, способствующий повсеместному распространению грибов на Земле.
Список литературы
Горбунова Е.А., Терехова В.А. Тяжелые металлы как фактор стресса для грибов: проявление их действия на клеточном и организменном уровнях // Микология и фитопатология. 1995. Т. 29. № 4. С. 63–69.
Марфенина О.Е. Антропогенная экология почвенных грибов. М.: Медицина для всех, 2005. 195 с.
Розенцвет О.А., Федосеева Е.В., Терехова В.А. Липидные биомаркеры в экологической оценке почвенной биоты: анализ жирных кислот (обзор) // Успехи современной биологии. 2019. Т. 139. С. 161–177. https://doi.org/10.1134/S0042132419020078
Терёшина В.М., Меморская А.С., Котлова Е.Р., Феофилова Е.П. Состав мембранных липидов и углеводов цитозоля в условиях теплового шока у Aspergillus niger // Микробиология. 2010. Т. 79. С. 45–51.
Терёшина В.М., Меморская А.С., Котлова Е.Р. Влияние различных тепловых воздействий на состав мембранных липидов и углеводов цитозоля у мицелиальных грибов // Микробиология. 2011. Т. 80. С. 447–453.
Tereshina V.M., Memorskaya A.S., Kotlova E.R. The effect of different heat influences on composition of membrane lipids and cytosol carbohydrates in mycelial fungi // Microbiology (Moscow). 2011. V. 80. P. 455–460. https://doi.org/10.1134/S0026261711040199
Терехова В.А. Микромицеты в экологической оценке водных и наземных экосистем. М.: Наука, 2007. 215 с.
Терехова В.А., Шитиков В.К., Иванова А.Е., Кыдралиева К.А. Оценка экологического риска техногенного загрязнения почвы на основе статистического распределения встречаемости видов микромицетов // Экология. 2017. Т. 48. С. 339–346. https://doi.org/10.7868/S0367059717050031
Terekhova V.A., Shitikov V.K., Ivanova A.E., Kydralieva K.A. Assessment of the ecological risk of technogenic soil pollution on the basis of the statistical distribution of the occurrence of micromycete species // Russ. J. Ecol. 2017. V. 48. P. 417–424. https://doi.org/10.1134/S1067413617050125
Терехова В.А., Швед Л.Г. Изменение морфо-биохимических признаков водных грибов под воздействием тяжелых металлов // Экология. 1994. № 6. С. 77–79.
Alvarez F.J., Douglas L.M., Konopka J.B. Sterol-rich plasma membrane domains in fungi // Eukaryot. Cell. 2007. V. 6. P. 755–763. https://doi.org/10.1128/EC.00008-07
Athanasopoulos A., André B., Sophianopoulou V., Gournas C. Fungal plasma membrane domains // FEMS Microbiol. Lett. 2019. V. 43. P. 642–673.
Azevedo M.-M., Carvalho A., Pascoal C., Rodrigues F., Cássio F. Responses of antioxidant defenses to Cu and Zn stress in two aquatic fungi // Sci. Total Environ. 2007. V. 377. P. 233–243. https://doi.org/10.1016/j.scitotenv.2007.02.027
Baldrian P. Effect of heavy metals on saprotrophic soil fungi // Soil Heavy Metals / Eds. Sherameti I. and Varma A. Soil Biology. 2010. V. 19. https://doi.org/10.1007/978-3-642-02436-8
Ballweg S., Sezgin E., Doktorova M., Covino R., Reinhard J., Wunnicke D., Hänelt I., Levental I., Hummer G., Ernst R. Regulation of lipid saturation without sensing membrane fluidity // Nat. Commun. 2020. V. 11. P. 1–13. https://doi.org/10.1038/s41467-020-14528-1
Balogh G., Péter M., Glatz A., Gombos I., Török Z., Horváth I., Harwood J.L., Vigh L. Key role of lipids in heat stress management // FEBS Lett. 2013. V. 587. P. 1970–1980. https://doi.org/10.1016/j.febslet.2013.05.016
Barman A., Gohain D., Bora U., Tamuli R. Phospholipases play multiple cellular roles including growth, stress tolerance, sexual development, and virulence in fungi // Microbiol. Res. 2018. V. 209. P. 55–69. https://doi.org/10.1016/j.micres.2017.12.012
Bernat P., Gajewska E., Szewczyk R., Słaba M., Długoński J. Tributyltin (TBT) induces oxidative stress and modifies lipid profile in the filamentous fungus Cunninghamella elegans // Environ. Sci. Pollut. Res. 2014. V. 21. P. 4228–4235. https://doi.org/10.1007/s11356-013-2375-5
Brewster J., Valoir T. de, Dwyer N., Winter E., Gustin M. An osmosensing signal transduction pathway in yeast // Science. 1993. V. 259. P. 1760–1763. https://doi.org/10.1126/science.7681220
Bruder Nascimento A.C.M. de O., Reis T.F. dos, Castro P.A. de, Hori J.I., Bom V.L.P., Assis L.J. de, Ramalho L.N.Z., Rocha M.C., Malavazi I., Brown N.A., Valiante V., Brakhage A.A., Hagiwara D., Goldman G.H. Mitogen activated protein kinases SakA HOG1 and MpkC collaborate for Aspergillus fumigatus virulence // Mol. Microbiol. 2016. V. 100. P. 841–859. https://doi.org/10.1111/mmi.13354
Calonne M., Fontaine J., Debiane D., Laruelle F., Grandmougin-Ferjani A., Lounès-Hadj Sahraoui A. The arbuscular mycorrhizal Rhizophagus irregularis activates storage lipid biosynthesis to cope with the benzo[a]pyrene oxidative stress // Phytochemistry. 2014. V. 97. P. 30–37. https://doi.org/10.1016/j.phytochem.2013.10.014
Catlett N.L., Yoder O.C., Turgeon B.G. Whole-genome analysis of two-component signal transduction genes in fungal pathogens // Eukaryot. Cell. 2003. V. 2. P. 1151–1161. https://doi.org/10.1128/EC.2.6.1151-1161.2003
Cazzolli R., Shemon A.N., Fang M.Q., Hughes W.E. Phospholipid signalling through phospholipase D and phosphatidic acid // IUBMB Life. 2006. V. 58. P. 457–461. https://doi.org/10.1080/15216540600871142
Chen P.W., Fonseca L.L., Hannun Y.A., Voit E.O. Coordination of rapid sphingolipid responses to heat stress in yeast // PLoS Comput. Biol. 2013. V. 9. e1003078. https://doi.org/10.1371/journal.pcbi.1003078
Cordero R.J.B., Robert V., Cardinali G., Arinze E.S., Thon S.M., Casadevall A. Impact of yeast pigmentation on heat capture and latitudinal distribution // Curr. Biol. 2018. V. 28. P. 2657–2664.e3. https://doi.org/10.1016/j.cub.2018.06.034
Covino R., Ballweg S., Stordeur C., Michaelis J.B., Puth K., Wernig F., Bahrami A., Ernst A.M., Hummer G., Ernst R. A Eukaryotic sensor for membrane lipid saturation // Mol. Cell. 2016. V. 63. P. 49–59. https://doi.org/10.1016/j.molcel.2016.05.015
Cowart L.A., Gandy J.L., Tholanikunnel B., Hannun Y.A. Sphingolipids mediate formation of mRNA processing bodies during the heat-stress response of Saccharomyces cerevisiae // Biochem. J. 2010. V. 431. P. 31–38. https://doi.org/10.1042/BJ20100307
Debiane D., Calonne M., Fontaine J., Laruelle F., Grandmougin-Ferjani A., Lounes-Hadj Sahraoui A. Lipid content disturbance in the arbuscular mycorrhizal, Glomus irregulare grown in monoxenic conditions under PAHs pollution // Fungal Biol. 2011. V. 115. P. 782–792. https://doi.org/10.1016/j.funbio.2011.06.003
Ding X., Liu K., Lu Y., Gong G. Morphological, transcriptional, and metabolic analyses of osmotic-adapted mechanisms of the halophilic Aspergillus montevidensis ZYD4 under hypersaline conditions // Appl. Microbiol. Biotechnol. 2019. V. 103. P. 3829–3846. https://doi.org/10.1007/s00253-019-09705-2
Epstein S. Sphingolipid signaling in yeast potential implications for understanding disease // Front. Biosci. 2013. V. E5. P. E599. https://doi.org/10.2741/E599
Ernst R., Ejsing C.S., Antonny B. Homeoviscous adaptation and the regulation of membrane lipids // J. Mol. Biol. 2016. V. 428. P. 4776–4791. https://doi.org/10.1016/j.jmb.2016.08.013
Escribá P.V., González-Ros J.M., Goñi F.M., Kinnunen P.K.J., Vigh L., Sánchez-Magraner L., Fernández A.M., Busquets X., Horváth I., Barceló-Coblijn G. Membranes: A meeting point for lipids, proteins and therapies: Translational Medicine // J. Cell. Mol. Med. 2008. V. 12. P. 829–875. https://doi.org/10.1111/j.1582-4934.2008.00281.x
Espenshade P.J., Hughes A.L. Regulation of sterol synthesis in eukaryotes // Annu. Rev. Genet. 2007. V. 41. P. 401–427. https://doi.org/10.1146/annurev.genet.41.110306.130315
Fassler J.S., West A.H. Histidine phosphotransfer proteins in fungal two-component signal transduction pathways // Eukaryot. Cell. 2013. V. 12. P. 1052–1060. https://doi.org/10.1128/EC.00083-13
Fernandes C.M., Goldman G.H., Poeta M. Del Biological roles played by sphingolipids in dimorphic and filamentous fungi // MBio. 2018. V. 9. №3. P. 1–13. https://doi.org/10.1128/mBio.00642-18
Gadd G. Fungi and industrial pollutants // Environmental and Microbial Relationships. The Mycota. V. 4. / Eds. Druzhinina I.S., Kubicek C.P. Springer, 2016. 3 ed. V. 4. P. 99–125. https://doi.org/10.1007/978-3-319-29532-9
Glatz A., Pilbat A., Németh G.L., Vince-Kontár K., Jósvay K., Hunya Á., Udvardy A., Gombos I., Péter M., Balogh G., Horváth I., Vígh L., Török Z. Involvement of small heat shock proteins, trehalose, and lipids in the thermal stress management in Schizosaccharomyces pombe // Cell Stress Chaperones. 2016. V. 21. P. 327–338. https://doi.org/10.1007/s12192-015-0662-4
Golub T., Wacha S., Caroni P. Spatial and temporal control of signaling through lipid rafts // Curr. Opin. Neurobiol. 2004. V. 14. P. 542–550. https://doi.org/10.1016/j.conb.2004.08.003
Goncalves N.V., Aline B.M., Rosa C.A. Diversity and distribution of fungal communities in lakes of Antarctica // FEMS Microbiol. Ecol. 2012. V. 82. P. 459–471. https://doi.org/10.3390/microorganisms7100445
Gostinčar C., Turk M., Trbuha T., Vaupotič T., Plemenitaš A., Gunde-Cimerman N. Expression of fatty-acid-modifying enzymes in the halotolerant black yeast Aureobasidium pullulans (de Bary) G. Arnaud under salt stress // Stud. Mycol. 2008. V. 61. P. 51–59. https://doi.org/10.3114/sim.2008.61.04
Gostinčar C., Turk M., Plemenitaš A., Gunde-Cimerman N. The expressions of Δ9-, Δ12-desaturases and an elongase by the extremely halotolerant black yeast Hortaea werneckii are salt dependent // FEMS Yeast Res. 2009. V. 9. P. 247–256. https://doi.org/10.1111/j.1567-1364.2009.00481.x
Gostinčar C., Gunde-Cimerman N. Overview of oxidative stress response genes in selected halophilic fungi // Genes (Basel). 2018. V. 9. Art. 143. P. 1–13. https://doi.org/10.3390/genes9030143
Grum-Grzhimaylo A.A., Georgieva M.L., Bondarenko S.A., Debets A.J.M., Bilanenko E.N. On the diversity of fungi from soda soils // Fungal Diversity. 2016. V. 76. P. 27–74. https://doi.org/10.1007/s13225-015-0320-2
Gunde-Cimerman N., Plemenitaš A., Oren A. Strategies of adaptation of microorganisms of the three domains of life to high salt concentrations // FEMS Microbiol. Rev. 2018. V. 42. P. 353–375. https://doi.org/10.1093/femsre/fuy009
Haas K. Role of sterol metabolism and endoplasmic reticulum-associated degradation of proteins in cold adaptation of yeasts // Cold-Adapted Yeasts / Eds. Buzzini P., Margesin R. Berlin, Heidelberg: Springer Berlin Heidelberg, 2014. P. 281–293.
Hąc-Wydro K., Połeć K., Broniatowski M. The comparative analysis of the effect of environmental toxicants: Bisphenol A, S and F on model plant, fungi and bacteria membranes. The studies on multicomponent systems // J. Mol. Liq. 2019. V. 289. P. 111136. https://doi.org/10.1016/j.molliq.2019.111136
Harayama T., Riezman H. Understanding the diversity of membrane lipid composition // Nat. Rev. Mol. Cell Biol. 2018. V. 19. P. 281–296. https://doi.org/10.1038/nrm.2017.138
Hayashi M., Maeda T. Activation of the HOG pathway upon cold stress in Saccharomyces cerevisiae // J. Biochem. 2006. V. 139. P. 797–803. https://doi.org/10.1093/jb/mvj089
He B., Ma L., Hu Z., Li H., Ai M., Long C., Zeng B. Deep sequencing analysis of transcriptomes in Aspergillus oryzae in response to salinity stress // Appl. Microbiol. Biotechnol. 2018. V. 102. P. 897–906. https://doi.org/10.1007/s00253-017-8603-z
Holthuis J.C.M., Menon A.K. Lipid landscapes and pipelines in membrane homeostasis // Nature. 2014. V. 510. P. 48–57. https://doi.org/10.1038/nature13474
Hong J., Gierasch L.M., Liu Z. Its preferential interactions with biopolymers account for diverse observed effects of trehalose // Biophys. J. 2015. V. 109. P. 144–153. https://doi.org/10.1016/j.bpj.2015.05.037
Horváth I., Multhoff G., Sonnleitner A., Vígh L. Membrane-associated stress proteins: More than simply chaperones // Biochim. Biophys. Acta – Biomembr. 2008. V. 1778. P. 1653–1664. https://doi.org/10.1016/j.bbamem.2008.02.012
Hosono K. Effect of salt stress on lipid composition and membrane fluidity of the salt-tolerant yeast Zygosaccharomyces rouxii // J. Gen. Microbiol. 1992. V. 138. P. 91–96. https://doi.org/10.1099/00221287-138-1-91
Ianutsevich E.A., Danilova O.A., Groza N.V., Tereshina V.M. Membrane lipids and cytosol carbohydrates in Aspergillus niger under osmotic, oxidative, and cold impact // Microbiology (Moscow). 2016a. V. 85. P. 302–310. https://doi.org/10.1134/S0026261716030152
Ianutsevich E.A., Danilova O.A., Groza N. V., Kotlova E.R., Tereshina V.M. Heat shock response of thermophilic fungi: Membrane lipids and soluble carbohydrates under elevated temperatures // Microbiology (SGM). 2016b. V. 162. P. 989–999. https://doi.org/10.1099/mic.0.000279
Ianutsevich E.A., Danilova O.A., Kurilov D.V., Zavarzin I.V., Tereshina V.M. Osmolytes and membrane lipids in adaptive response of thermophilic fungus Rhizomucor miehei to cold, osmotic and oxidative shocks // Extremophiles. 2020a. V. 24. P. 391–401. https://doi.org/10.1007/s00792-020-01163-3
Ianutsevich E.A., Danilova O.A., Kurilov D.V., Zavarzin I.V., Tereshina V.M. Osmolytes and membrane lipids in adaptive response of thermophilic fungus Rhizomucor miehei to cold, osmotic and oxidative shocks // Extremophiles. 2020b. V. 24. P. 391–401. https://doi.org/10.1007/s00792-020-01163-3
Inouye M., Phadtare S. Cold-shock response and adaptation to near-freezing temperature in cold-adapted yeasts // Cold-Adapted Yeasts / Eds. Buzzini P., Margesin R. Berlin, Heidelberg: Springer Berlin Heidelberg, 2014. P. 243–257.
Jacob S., Thines E. Multistep phosphorelay in fungi: the enigma of multiple signals and a limited number of signaling pathways // Mycol. Prog. 2017. V. 16. P. 1007–1013. https://doi.org/10.1007/s11557-017-1342-9
Jang J.H., Lee C.S., Hwang D., Ryu S.H. Understanding of the roles of phospholipase D and phosphatidic acid through their binding partners // Prog. Lipid Res. 2012. V. 51. P. 71–81. https://doi.org/10.1016/j.plipres.2011.12.003
Khaware R.K., Koul A., Prasad R. High membrane fluidity is related to NaCl stress in Candida membranefaciens // Biochem. Mol. Biol. Int. 1995. V. 35. №4. P. 875–880.
Kim H.J., Lee J.H., Do H., Jung W. Production of antifreeze proteins by cold-adapted yeasts // Cold-Adapted Yeasts / Eds. Buzzini P., Margesin R. Berlin, Heidelberg: Springer Berlin Heidelberg, 2014. P. 259–280.
Kim I.-S., Moon H.-Y., Yun H.-S., Jin I. Heat shock causes oxidative stress and induces a variety of cell rescue proteins in Saccharomyces cerevisiae KNU5377 // J. Microbiol. 2006. V. 44. P. 492–501.
Kimata Y., Nguyen T.M.P., Kohno K. Response and cytoprotective mechanisms against proteotoxic stress in yeast and fungi // Stress Response Mechanisms in Fungi / Ed. Skoneczny M. Cham: Springer International Publishing, 2018. P. 161–188.
Klose C., Surma M.A., Gerl M.J., Meyenhofer F., Shevchenko A., Simons K. Flexibility of a eukaryotic lipidome – insights from yeast lipidomics // PLoS One. 2012. V. 7. e35063. https://doi.org/10.1371/journal.pone.0035063
Kodedová M., Sychrová H. Changes in the sterol composition of the plasma membrane affect membrane potential, salt tolerance and the activity of multidrug resistance pumps in Saccharomyces cerevisiae // PLoS One. 2015. V. 10. e0139306. P. 1–19. https://doi.org/10.1371/journal.pone.0139306
Kooijman E.E., Burger K.N.J. Biophysics and function of phosphatidic acid: A molecular perspective // Biochim. Biophys. Acta – Mol. Cell Biol. Lipids. 2009. V. 1791. P. 881–888. https://doi.org/10.1016/j.bbalip.2009.04.001
Laroche C., Beney L., Marechal P.A., Gervais P. The effect of osmotic pressure on the membrane fluidity of Saccharomyces cerevisiae at different physiological temperatures // Appl. Microbiol. Biotechnol. 2001. V. 56. P. 249–254. https://doi.org/10.1007/s002530000583
Leach M.D., Farrer R.A., Tan K., Miao Z., Walker L.A., Cuomo C.A., Wheeler R.T., Brown A.J.P., Wong K.H., Cowen L.E. Hsf1 and Hsp90 orchestrate temperature-dependent global transcriptional remodelling and chromatin architecture in Candida albicans // Nat. Commun. 2016. V. 7. Art. 11704. https://doi.org/10.1038/ncomms11704
Li S., Yu H., Liu Y., Zhang X., Ma F. The lipid strategies in Cunninghamella echinulata for an allostatic response to temperature changes // Process Biochem. 2019. V. 76. P. 85–94. https://doi.org/10.1016/j.procbio.2018.11.005
Li Z., Agellon L.B., Allen T.M., Umeda M., Jewell L., Mason A., Vance D.E. The ratio of phosphatidylcholine to phosphatidylethanolamine influences membrane integrity and steatohepatitis // Cell Metab. 2006. V. 3. P. 321–331. https://doi.org/10.1016/j.cmet.2006.03.007
Lingwood D., Simons K. Lipid rafts as a membrane-organizing principle // Science. 2010. V. 327. P. 46–50. https://doi.org/10.1126/science.1174621
Liu K.-H., Ding X.-W., Narsing Rao M.P., Zhang B., Zhang Y.-G., Liu F.-H., Liu B.-B., Xiao M., Li W.-J. Morphological and transcriptomic analysis reveals the osmoadaptive response of endophytic fungus Aspergillus montevidensis ZYD4 to high salt stress // Front. Microbiol. 2017a. V. 8. P. 1–12. https://doi.org/10.3389/fmicb.2017.01789
Liu Y.-N., Lu X.-X., Chen D., Lu Y.-P., Ren A., Shi L., Zhu J., Jiang A.-L., Yu H.-S., Zhao M.-W. Phospholipase D and phosphatidic acid mediate heat stress induced secondary metabolism in Ganoderma lucidum // Environ. Microbiol. 2017b. V. 19. P. 4657–4669. https://doi.org/10.1111/1462-2920.13928
Loertscher J., Larson L.L., Matson C.K., Parrish M.L., Felthauser A., Sturm A., Tachibana C., Bard M., Wright R. Endoplasmic reticulum-associated degradation is required for cold adaptation and regulation of sterol biosynthesis in the yeast Saccharomyces cerevisiae // Eukaryot. Cell. 2006. V. 5. P. 712–722. https://doi.org/10.1128/EC.5.4.712-722.2006
Manfiolli A.O., Mattos E.C., Assis L.J. De, Silva L.P., Ulas M., Brown N.A., Silva-Rocha R., Bayram Ö., Goldman G.H. Aspergillus fumigatus high osmolarity glycerol mitogen activated protein kinases SakA and MpkC physically interact during osmotic and cell wall stresses // Front. Microbiol. 2019. V. 10. https://doi.org/10.3389/fmicb.2019.00918
Mantil E., Crippin T., Avis T.J. Supported lipid bilayers using extracted microbial lipids: domain redistribution in the presence of fengycin // Colloids Surfaces B Biointerfaces. 2019. V. 178. P. 94–102. https://doi.org/10.1016/j.colsurfb.2019.02.050
Margesin R., Miteva V. Diversity and ecology of psychrophilic microorganisms // Res. Microbiol. 2011. V. 162. P. 346–361. https://doi.org/10.1016/j.resmic.2010.12.004
McMahon H.T., Gallop J.L. Membrane curvature and mechanisms of dynamic cell membrane remodelling // Nature. 2005. V. 438. P. 590–596. https://doi.org/10.1038/nature04396
Meier K.D., Deloche O., Kajiwara K., Funato K., Riezman H. Sphingoid base is required for translation initiation during heat stress in Saccharomyces cerevisiae // Mol. Biol. Cell. 2006. V. 17. P. 1164–1175. https://doi.org/10.1091/mbc.E05-11-1039
Mironenka J., Różalska S., Soboń A., Bernat P. Lipids, proteins and extracellular metabolites of Trichoderma harzianum modifications caused by 2,4-dichlorophenoxyacetic acid as a plant growth stimulator // Ecotoxicol. Environ. Saf. 2020. V. 194. P. 110383. https://doi.org/10.1016/j.ecoenv.2020.110383
Moliné M., Libkind D., Garcia V. de, Giraudo M.R. Production of pigments and photo-protective compounds by cold-adapted yeasts // Cold-Adapted Yeasts / Eds. Buzzini P., Margesin R. Berlin, Heidelberg: Springer Berlin Heidelberg, 2014. P. 193–224.
Morano K.A., Grant C.M., Moye-Rowley W.S. The response to heat shock and oxidative stress in Saccharomyces cerevisiae // Genetics. 2012. V. 190. P. 1157–1195. https://doi.org/10.1534/genetics.111.128033
Munnik T. Phosphatidic acid: An emerging plant lipid se-cond messenger // Trends Plant Sci. 2001. V. 6. P. 227–233. https://doi.org/10.1016/S1360-1385(01)01918-5
Nakagawa Y., Sakumoto N., Kaneko Y., Harashima S. Mga2p is a putative sensor for low temperature and oxygen to induce OLE1 transcription in Saccharomyces cerevisiae // Biochem. Biophys. Res. Commun. 2002. V. 291. P. 707–713. https://doi.org/10.1006/bbrc.2002.6507
Nicolson G.L. The fluid-mosaic model of membrane structure: still relevant to understanding the structure, function and dynamics of biological membranes after more than 40 years // Biochim. Biophys. Acta – Biomembr. 2014. V. 1838. P. 1451–1466. https://doi.org/10.1016/j.bbamem.2013.10.019
Nykiel-Szymańska J., Różalska S., Bernat P., Słaba M. Assessment of oxidative stress and phospholipids alterations in chloroacetanilides-degrading Trichoderma spp. // Ecotoxicol. Environ. Saf. 2019. V. 184. P. 109629. https://doi.org/10.1016/j.ecoenv.2019.109629
Pan J., Hu C., Yu J.H. Lipid biosynthesis as an antifungal target // J. Fungi. 2018. V. 4. P. 1–13. https://doi.org/10.3390/jof4020050
Paraszkiewicz K., Bernat P., Naliwajski M., Długoński J. Lipid peroxidation in the fungus Curvularia lunata exposed to nickel // Arch. Microbiol. 2010. V. 192. P. 135–141. https://doi.org/10.1007/s00203-009-0542-3
Paraszkiewicz K., Bernat P., Długoński J. Effect of nickel, copper, and zinc on emulsifier production and saturation of cellular fatty acids in the filamentous fungus Curvularia lunata // Int. Biodeterior. Biodegr. 2009. V. 63. P. 100–105. https://doi.org/10.1016/j.ibiod.2008.03.015
Péter M., Glatz A., Gudmann P., Gombos I., Török Z., Horváth I., Vígh L., Balogh G. Metabolic crosstalk between membrane and storage lipids facilitates heat stress management in Schizosaccharomyces pombe // PLoS One. 2017. V. 12. №3. P. e0173739. https://doi.org/10.1371/journal.pone.0173739
Piper P.W. Molecular events associated with acquisition of heat tolerance by the yeast Saccharomyces cerevisiae // FEMS Microbiol. Rev. 1993. V. 11. P. 339–355. https://doi.org/10.1111/j.1574-6976.1993.tb00005.x
Rangel D.E.N. Stress induced cross-protection against environmental challenges on prokaryotic and eukaryotic microbes // World J. Microbiol. Biotechnol. 2011a. V. 27. P. 1281–1296. https://doi.org/10.1007/s11274-010-0584-3
Redón M., Guillamón J.M., Mas A., Rozès N. Effect of lipid supplementation upon Saccharomyces cerevisiae lipid composition and fermentation performance at low temperature // Eur. Food Res. Technol. 2009. V. 228. P. 833–840. https://doi.org/10.1007/s00217-008-0996-6
Redón M., Borrull A., López M., Salvadó Z., Cordero R., Mas A., Guillamón J.M., Rozès N. Effect of low temperature upon vitality of Saccharomyces cerevisiae phospholipid mutants // Yeast. 2012. V. 29. P. 443–452. https://doi.org/10.1002/yea.2924
Renne M.F., de Kroon A.I.P.M. The role of phospholipid molecular species in determining the physical properties of yeast membranes // FEBS Lett. 2018. V. 592. P. 1330–1345. https://doi.org/10.1002/1873-3468.12944
Rep M., Krantz M., Thevelein J.M., Hohmann S. The transcriptional response of Saccharomyces cerevisiae to osmotic shock // J. Biol. Chem. 2000. V. 275. P. 8290–8300. https://doi.org/10.1074/jbc.275.12.8290
Řezanka T., Kolouchová I., Gharwalová L., Doležalová J., Nedbalová L., Sigler K. Sphingolipidomics of thermotolerant yeasts // Lipids. 2018. V. 53. P. 627–639. https://doi.org/10.1002/lipd.12076
Rodríguez-Vargas S., Sánchez-García A., Martínez-Rivas J.M., Prieto J.A., Randez-Gil F. Fluidization of membrane lipids enhances the tolerance of Saccharomyces cerevisiae to freezing and salt stress // Appl. Environ. Microbiol. 2007. V. 73. P. 110–116. https://doi.org/10.1128/AEM.01360-06
Román E., Correia I., Prieto D., Alonso R., Pla J. The HOG MAPK pathway in Candida albicans: more than an osmosensing pathway // Int. Microbiol. 2020. V. 23. P. 23–29. https://doi.org/10.1007/s10123-019-00069-1
Rossi M., Buzzini P., Cordisco L., Amaretti A., Sala M., Raimondi S., Ponzoni C., Pagnoni U.M., Matteuzzi D. Growth, lipid accumulation, and fatty acid composition in obligate psychrophilic, facultative psychrophilic, and mesophilic yeasts // FEMS Microbiol. Ecol. 2009. V. 69. P. 363–372. https://doi.org/10.1111/j.1574-6941.2009.00727.x
Ruenwai R., Neiss A., Laoteng K., Vongsangnak W., Dalfard A.B., Cheevadhanarak S., Petranovic D., Nielsen J. Heterologous production of polyunsaturated fatty acids in Saccharomyces cerevisiae causes a global transcriptional response resulting in reduced proteasomal activity and increased oxidative stress // Biotechnol. J. 2011. V. 6. P. 343–356. https://doi.org/10.1002/biot.201000316
Sahara T., Goda T., Ohgiya S. Comprehensive expression analysis of time-dependent genetic responses in yeast cells to low temperature // J. Biol. Chem. 2002. V. 277. P. 50015–50021. https://doi.org/10.1074/jbc.M209258200
Salar R.K. Thermophilic Fungi: Basic Concepts and Biotechnological Applications. CRC Press, 2018. 352 p.
Satyanarayana T., Johri B.N. Physiology and biochemistry of thermophilic moulds // Thermophilic Moulds in Biotechnology / Eds. Johri B.N., Satyanarayana T., Olsen J. Dordrecht: Springer Netherlands, 1999. P. 85–113.
Sazanova K.V., Senik S.V., Kirtsideli I.Yu., Shavarda A.L. Metabolomic profiling and lipid composition of Arctic and Antarctic strains of micromycetes Geomyces pannorum and Thelebolus microsporus grown at different temperatures // Microbiology (Moscow). 2019. V. 88. P. 282–291. https://doi.org/10.1134/S002626171903011
Sekova V.Y., Dergacheva D.I., Isakova E.P., Gessler N.N., Tereshina V.M., Deryabina Y.I. Soluble sugar and lipid readjustments in the Yarrowia lipolytica yeast at various temperatures and pH // Metabolites. 2019. V. 9. P. 307. https://doi.org/10.3390/metabo9120307
Shin J.J., Loewen C.J. Putting the pH into phosphatidic acid signaling // BMC Biol. 2011. V. 9. P. 85. https://doi.org/10.1186/1741-7007-9-85
Siewiera P., Bernat P., Różalska S., Długoński J. Estradiol improves tributyltin degradation by the filamentous fungus Metarhizium robertsii // Int. Biodeterior. Biodegradation. 2015. V. 104. P. 258–263. https://doi.org/10.1016/j.ibiod.2015.06.014
Simons K., Sampaio J. Membrane organization and lipid rafts // Cold Spring Harb. Perspect. Biol. 2011. V. 3. P. a004697. https://doi.org/10.1101/cshperspect.a004697
Sinensky M. Homeoviscous adaptation – a homeostatic process that regulates the viscosity of membrane lipids in Escherichia coli // Proc. Natl. Acad. Sci. USA. 1974. V. 71. P. 522–525.
Singer M.A., Lindquist S. Multiple effects of trehalose on protein folding in vitro and in vivo // Mol. Cell. 1998. V. 1. P. 639–648. https://doi.org/10.1016/S1097-2765(00)80064-7
Słaba M., Szewczyk R., Piątek M.A., Długoński J. Alachlor oxidation by the filamentous fungus Paecilomyces marquandii // J. Hazard Mater. 2013. V. 261. P. 443–450. https://doi.org/10.1016/j.jhazmat.2013.06.064
Smolyanyuk E.V., Bilanenko E.N., Tereshina V.M., Kachalkin A.V., Kamzolkina O.V. Effect of sodium chloride concentration in the medium on the composition of the membrane lipids and carbohydrates in the cytosol of the fungus Fusarium sp. // Microbiology (Moscow). 2013. V. 82. P. 600–608. https://doi.org/10.1134/S0026261713050111
Sum A.K., Faller R., de Pablo J.J. Molecular simulation study of phospholipid bilayers and insights of the interactions with disaccharides // Biophys. J. 2003. V. 85. P. 2830–2844. https://doi.org/10.1016/S0006-3495(03)74706-7
Tanigawa M., Kihara A., Terashima M., Takahara T., Maeda T. Sphingolipids regulate the yeast high-osmolarity glycerol response // Mol. Cell. Biol. 2012. V. 32. P. 2861–2870. https://doi.org/10.1128/MCB.06111-11
Tatebayashi K., Yamamoto K., Tomida T., Nishimura A., Takayama T., Oyama M., Kozuka-Hata H., Adachi-Akahane S., Tokunaga Y., Saito H. Osmostress enhances activating phosphorylation of Hog1 MAP kinase by mono-phosphorylated Pbs2 MAP 2K // EMBO J. 2020. V. 39. P. 1–25. https://doi.org/10.15252/embj.2019103444
Thibault G., Shui G., Kim W., McAlister G.C., Ismail N., Gygi S.P., Wenk M.R., Ng D.T.W. The membrane stress response buffers lethal effects of lipid disequilibrium by reprogramming the protein homeostasis network // Mol. Cell. 2012. V. 48. P. 16–27. https://doi.org/10.1016/j.molcel.2012.08.016
Tiwari S., Thakur R., Shankar J. Role of heat-shock proteins in cellular function and in the biology of fungi // Biotechnol. Res. Int. 2015. V. 2015. P. 1–11. https://doi.org/10.1155/2015/132635
Turk M., Méjanelle L., Šentjurc M., Grimalt J.O., Gunde-Cimerman N., Plemenitaš A. Salt-induced changes in lipid composition and membrane fluidity of halophilic yeast-like melanized fungi // Extremophiles. 2004. V. 8. P. 53–61. https://doi.org/10.1007/s00792-003-0360-5
Turk M., Montiel V., Žigon D., Plemenitaš A., Ramos J. Plasma membrane composition of Debaryomyces hansenii adapts to changes in pH and external salinity // Microbio-logy (SGM). 2007a. V. 153. P. 3586–3592. https://doi.org/10.1099/mic.0.2007/009563-0
Turk M., Abramović Z., Plemenitaš A., Gunde-Cimerman N. Salt stress and plasma-membrane fluidity in selected extremophilic yeasts and yeast-like fungi // FEMS Yeast Res. 2007b. V. 7. P. 550–557. https://doi.org/10.1111/j.1567-1364.2007.00209.x
Turk M., Plemenitaš A., Gunde-Cimerman N. Extremophilic yeasts: Plasma-membrane fluidity as determinant of stress tolerance // Fungal Biol. 2011. V. 115. P. 950–958. https://doi.org/10.1016/j.funbio.2011.04.006
van den Brink-van der Laan E., Killian J.A., de Kruijff B. Nonbilayer lipids affect peripheral and integral membrane proteins via changes in the lateral pressure profile // Biochim. Biophys. Acta – Biomembr. 2004. V. 1666. P. 275–288. https://doi.org/10.1016/j.bbamem.2004.06.010
Vaskovsky V.E., Khotimchenko S.V., Benson A.A. Identification of diacylglycero-4'-o-(N,N,N-trimethyl)homosrine in mushrooms // Lipids. 1991. V. 26. P. 254–256.
Verghese J., Abrams J., Wang Y., Morano K.A. Biology of the heat shock response and protein chaperones: budding yeast (Saccharomyces cerevisiae) as a model system // Microbiol. Mol. Biol. Rev. 2012. V. 76. P. 115–158. https://doi.org/10.1128/MMBR.05018-11
Vesentini D., Dickinson D.J., Murphy R.J. The protective role of the extracellular mucilaginous material (ECMM) from two wood-rotting basidiomycetes against copper to-xicity // Int. Biodeterior. Biodegr. 2007. V. 60. P. 1–7. https://doi.org/10.1016/j.ibiod.2006.11.006
Wang D., Zhang M., Huang J., Zhou R., Jin Y., Wu C. Zygosaccharomyces rouxii combats salt stress by maintaining cell membrane structure and functionality // J. Microbiol. Biotechnol. 2020. V. 30. P. 62–70.
Watson K., Arthur H., Shipton W.A. Leucosporidium yeasts: obligate psychrophiles which alter membrane-lipid and cytochrome composition with temperature // J. Gen. Microbiol. 1976. V. 97. P. 11–18. https://doi.org/10.1099/00221287-97-1-11
Weete J.D. Introduction to fungal lipids // Fungal Lipid Biochemistry / Ed. Kritchevsky D. New York: Springer US, 1974. Ch. 1. P. 3–36.
Weete J.D. Lipid Biochemistry of Fungi and Other Orga-nisms. Boston, MA: Springer US, 1980. 388 p.
Weete J.D., Gandhi S.R. Biochemistry and molecular biology of fungal sterols // The Mycota. III Biochemistry and Molecular Biology. Berlin, Heidelberg, N.Y.: Springer-Verlag, 1996. P. 421–438.
Welker S., Rudolph B., Frenzel E., Hagn F., Liebisch G., Schmitz G., Scheuring J., Kerth A., Blume A., Weinkauf S., Haslbeck M., Kessler H., Buchner J. Hsp12 is an intrinsically unstructured stress protein that folds upon membrane association and modulates membrane function // Mol. Cell. 2010. V. 39. P. 507–520. https://doi.org/10.1016/j.molcel.2010.08.001
Winkler A., Arkind C., Mattison C.P., Burkholder A., Knoche K., Ota I. Heat stress activates the yeast high-osmolarity glyce-rol mitogen-activated protein kinase pathway, and protein tyrosine phosphatases are essential under heat stress // Eu-karyot. Cell. 2002. V. 1. P. 163–173. https://doi.org/10.1128/EC.1.2.163-173.2002
Wu C., Zhang J., Zhu G., Yao R., Chen X., Liu L. Cg Hog1-mediated Cg Rds2 phosphorylation alters glycerophospholipid composition to coordinate osmotic stress in Candida glabrata // Appl. Environ. Microbiol. 2019. V. 85. P. 1–19. https://doi.org/10.1128/AEM.02822-18
Xia J., Jones A.D., Lau M.W., Yuan Y.-J., Dale B.E., Balan V. Comparative lipidomic profiling of xylose-metabolizing S. cerevisiae and its parental strain in different media reveals correlations between membrane lipids and fermentation capacity // Biotechnol. Bioeng. 2011. V. 108. P. 12–21. https://doi.org/10.1002/bit.22910
Yamashita A., Hayashi Y., Nemoto-Sasaki Y., Ito M., Oka S., Tanikawa T., Waku K., Sugiura T. Acyltransferases and transacylases that determine the fatty acid composition of glycerolipids and the metabolism of bioactive lipid mediators in mammalian cells and model organisms // Progr. Lipid Res. 2014. V. 53. P. 18–81. https://doi.org/10.1016/j.plipres.2013.10.001
Yanutsevich E.A., Memorskaya A.S., Groza N. V., Kochkina G.A., Tereshina V.M. Heat shock response in the thermophilic fungus Rhizomucor miehei // Microbiology (Moscow). 2014. V. 83. P. 498–504. https://doi.org/10.1134/S0026261714050282
Zhang Y., Xu J. Molecular mechanisms of fungal adaptive evolution // Molecular Mechanisms of Microbial Evolution Grand Challenges in Biology and Biotechnology / Ed. Rampelotto P. Springer, Cham, 2018. P. 409–435.
Дополнительные материалы отсутствуют.


