Микробиология, 2021, T. 90, № 2, стр. 204-214
Pantoea brenneri AS3 и Bacillus ginsengihumi М2.11 как потенциальные агенты биоконтроля и стимуляторы роста растений
Д. Л. Иткина a, *, А. Д. Сулейманова a, М. Р. Шарипова a
a Казанский (Приволжский) федеральный университет
420008 Казань, Россия
* E-mail: laia9301@mail.ru
Поступила в редакцию 19.07.2020
После доработки 10.10.2020
Принята к публикации 11.11.2020
Аннотация
Исследовали механизмы биоконтрольного действия штаммов Pantoea brenneri AS3 и Bacillus ginsengihumi М2.11. Установлена способность штаммов к выделению ионов аммония и цианидов, целлюлазной и протеазной активности, фиксации азота, а также к мобилизации почвенных фосфатов и фитатов. Выявлена способность штаммов к синтезу сидерофоров, максимальная продукция которых обнаружена на 48 ч культивирования и составляла 198 ± 8 мкМ у штамма B. ginsengihumi М2.11 и 84 ± 7 мкМ у штамма P. brenneri AS3. Бактерии продуцировали фитогормон – индолилуксусную кислоту (ИУК), выход которой на 24 ч роста составил 34 ± 3 мкг/мл у B. ginsengihumi М2.11 и 29 ± 2 мкг/мл у P. brenneri AS3. Установлено, что оба штамма обладали фунгицидной активностью против фитопатогенов рода Fusarium: рост представителей разных видов Fusarium подавлялся более чем на 90% в присутствии бактерий P. brenneri AS3 и B. ginsengihumi М2.11. Сделано заключение, что обладая множественными полезными для растений характеристиками, штаммы P. brenneri AS3 и B. ginsengihumi М2.11 могут быть использованы в качестве объектов для создания технологий биоудобрений и стимуляторов роста растений.
Борьба с заболеваниями растений, вызванными фитопатогенными микроорганизмами, является главным направлением в развитии агробиотехнологии для увеличения качества и урожайности возделываемых культур. Поиск новых метаболитов микробиологического происхождения, обладающих фунгицидным действием, направлен на создание экологически безопасного производства средств защиты растений и продуктов сельского хозяйства, поскольку использование химических пестицидов и фунгицидов связано с загрязнением окружающей среды и нарушением естественного баланса микрофлоры почвы (Veliz et al., 2017). Кроме того, присутствие остатков пестицидов и фунгицидов на пищевых продуктах может оказывать неблагоприятное воздействие на здоровье человека, в связи с чем становится очевидной необходимость в использовании новых эффективных агентов биологического контроля (Norovsuren et al., 2018).
Все большую значимость приобретает применение бактериальных удобрений на основе ассоциативных ризобактерий, стимулирующих рост растений (plant growth-promoting rhizobacteria – PGPR), которые являются неотъемлемой частью ризосферной биоты (Muller et al., 2017). В связи с высокой адаптацией в широком диапазоне активных сред, быстрым темпом роста и биохимической универсальностью метаболизма, ризобактерии рассматриваются как необходимый компонент в управлении сельскохозяйственной агрокультурой. Микробиологический способ защиты растений от болезней основан на природном явлении антагонизма бактерий по отношению к фитопатогенам, используя различные механизмы, такие как способность к конкурированию за питательные вещества и пространство, продукция сидерофоров, литических ферментов, антибиотиков и др. (Коряжкина, 2012; Хрусталева, Аллахвердиев, 2016).
Представители рода Pantoea связаны с широким спектром растений-хозяев: бактерии способны колонизировать корни растений, его листья и стебли, могут приносить пользу путем биосинтеза фитогормона – индолилуксусной кислоты (ИУК), осуществляют мобилизацию почвенных фосфатов или азотфиксацию (De Maayer et al., 2012). Описаны штаммы Pantoea, которые обеспечивают эффективную защиту растений от различных бактериозов и микозов, а также сохранность урожая продовольственных зерновых культур (Smits et al., 2011).
Бактерии рода Bacillus населяют ризосферу, филосферу растений, являясь основными эндофитами. Многие штаммы бацилл обладают рядом хозяйственно-ценных свойств: они способны синтезировать биоконтрольные вещества, фитогормоны и витамины, фиксировать азот атмосферы. Важной особенностью бацилл является их высокая конкурентоспособность при колонизации растений и образовании бактериально-растительных ассоциаций. Все вышеперечисленные свойства позволяют отнести бациллы к PGPR-микроорганизмам (Коряжкина, 2012). Установлено, что 40% бацилл, выделенных из внутренних тканей растений, проявляют антагонистическую активность к возбудителям болезней растений, таких как Fusarium cuhnorum, Alternaría alternata, Aspergillus nidulans, Bipolaris sorokiniana. Антагонизм микроорганизмов рода Bacillus по отношению ко многим грибам-фитопатогенам объясняется способностью разных видов бацилл синтезировать различные вещества: антибиотики, сидерофоры, токсины, целлюлазы, гемицеллюлазы (Коряжкина, 2012; Khan et al., 2018).
Целью работы явилось изучение механизма биологического контроля и стимуляции роста растений новых PGPR-штаммов Pantoea brenneri AS3 и Bacillus ginsengihumi М2.11 для оценки их потенциала при использовании в качестве биоудобрений.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования служили бактериальные штаммы P. brenneri AS3 ВКПМ В-12911 и B. ginsengihumi М2.11 ВКПМ В-11988, выделенные из почвы Республики Татарстан по признаку максимальной фитазной активности на дифференциальной среде PSM и идентифицированные молекулярно-генетическими методами (Suleimanova et al., 2015; Akhmetova et al., 2015; Сулейманова и соавт., 2017).
Культивирование микроорганизмов проводили на среде LB (г/л): триптон – 1.0; дрожжевой экстракт – 0.5; NaCl – 0.5; pH 8.5. Агаризованная среда LB включала дополнительно 2% агара. Бактерии культивировали в термостате при температуре 37°С и в термостате-шейкере фирмы “IKA®KS 4000” (Германия) при 37°C и интенсивности качания 200 об./мин. Оптическую плотность культуры измеряли на спектрофотометре “Bio-Rad” (США) при длине волны 590 нм.
Определение способности к продукции аммиака (NH3), синильной кислоты – цианидов (HCN) и целлюлозолитической активности штаммами P. brenneri AS3 и B. ginsengihumi М2.11 исследовали по методу Сю и Ким (Xu, Kim, 2014).
Протеолитическую активность определяли на среде с молочным агаром Эйкмана (1 и 2% молока) путем внесения 5 мкл инокулята. После 72 ч инкубации при 37°С, чашку заливали 15% ТХУ на 15 мин при комнатной температуре и оценивали зоны просветления вокруг бактериальных колоний, означающие расщепление белков молока (Шепелин, Дятлов, 2017).
Фосфат-мобилизующую способность определяли на агаризованной среде NBRIP, содержащей нерастворимый фосфат кальция Ca3(PO4)2 в качестве единственного источника фосфора. Бактерии инкубировали на чашках Петри в течение 3 сут при 37°С, затем оценивали зоны просветления (растворения нерастворимого фосфата) вокруг бактериальной колонии. Cреда NBRIP (National Botanical Research Institute’s Phosphate growth medium) (г/л dH2O): глюкоза – 10.0; Са3(РО4)2 – 5.0; MgCl2 · · 6H2O – 5.0; MgSO4 · 7 H2O – 0.25; KCl – 2.0; (NH4)2SO4 – 0.1; aгар – 2; pH 6.8–7.0.
Количественное определение содержания свободных фосфатов определяли калориметрически с помощью молибдата аммония. Мeтод основан на способности неорганических фосфатов в кислой срeдe образовывать с молибдатом аммония соединение желтого цвета – фосфорно-молибденовокислый аммоний (Горшкова и соавт., 2015). В две опытные пробирки вносили по 100 мкл культуральной жидкости штаммов бактерий P. brenneri AS3 и B. ginsengihumi М2.11, выращенные на жидкой срeдe NBRIP. В качестве контроля использовали стерильную питательную среду NBRIP. Во все пробирки вносили по 750 мкл свежеприготовленного рeагeнта ААМ (10 мМ гeптамолибдат аммония, раствор 5 н H2SO4 и ацетон в соотношении 1 : 1 : 2). Затeм в пробирки добавляли по 50 мкл 1 М лимонной кислоты. Пробирки цeнтрифугировали в течение 5 мин при 8000 об./мин. Оптичeскую плотность проб измeряли на спeктрофотомeтрe “iMark™ Bio-Rad” (США) в сравнении с плотностью дистиллированной воды при длине волны излучения λ = 355 нм в 1 см кювeтe. Концeнтрацию свободных фосфатов определяли по калибровочному графику стандартного раствора фосфорнокислого калия, молярная концeнтрация фосфатов в котором составляла 5 мкмоль/мл, готовили серию разведений. При внесении штаммов P. brenneri AS3 и B. ginsengihumi М2.11 в питательную среду, концентрация фосфатов в среде составляла около 100 мкмоль/мл. Это значение взято за исходный показатель для оценки активности штамма.
Фитат-мобилизующую способность определяли на агаризованной среде PSM, содержащей нерастворимый фитат кальция в качестве единственного источника фосфора. PSM (Phytase Screening Medium) (г/л dH2O): CaCl2 – 2; NH4NO3 – 5; KCl – 0.5; MgSO4 · 7H2O – 0.5; FeSO4 · 7H2O – 0.01; MnSO4 · H2O – 0.01; глюкоза – 20; фитат натрия – 4; aгар – 2; pH 6.8–7.0. Фитат-гидролизующую способность оценивали после инкубации в течение 3 сут при 37°С по наличию зон просветления вокруг бактериальной колонии.
Способность штаммов к фиксации атмосферного азота определяли на селективной питательной среде Эшби, не содержащей источника азота, поэтому только бактерии, обладающие способностью фиксировать азот из атмосферы, образовывали колонии на данной среде (Концевая, 2017).
Синтез сидерофоров определяли на дифференциальной среде с хромазуролом S (агаризованная CAS среда) (Payne et al., 1994). Для посева бактерии P. brenneri AS3 и B. ginsengihumi М2.11 на CAS среду использовали 12-часовой инокулят, выращенный на среде LB при 37°С и 200 об./мин. Выращенный инокулят центрифугировали при 6 тыс. об./мин в течение 2 мин, осажденные клетки трижды промывали минимальной средой М9. На CAS среду посев проводили путем внесения 5 мкл суспензии промытых клеток в среде М9. В качестве контрольного штамма использовали Salmonella typhimurium, который образует сидерофоры (Muller et al., 2017). Плотность клеток опытного и контрольного штамма (ОП600) составляла 0.1.
Способность штаммов к биосинтезу сидерофоров катехолового ряда определяли на минимальной солевой среде М9 в объеме 20 мл с добавлением 2,2-бипиридила (3.36 мкл) по методу Арноу (Payne et al., 1994). Метод Арноу позволяет детектировать формирование сидерофоров катехолового типа по их способности связывать гидроксильные группы с металлом (Na2MoO4), в результате чего образуется розовая окраска. Количество продуцируемых сидерофоров определяли с помощью калибровочной кривой по 2,3-дигидроксибензойной кислоте (2,3-DHBA), растворенной в спирте.
Определение продукции ИУК тестировали по модифицированному методу Брик (Bric et al., 1991). Концентрацию ИУК в супернатанте определяли с помощью калибровочной кривой, построенной с использованием раствора синтетической ИУК с шагом 20 мкг/мл.
Для определения фунгицидной активности штаммов использовали метод лунок Petatan-Sagahon (Petatаn-Sagahоn et al., 2011). В качестве тест-организмов в работе использовали следующие штаммы микромицетов: Fusarium solani, F. tricinctum, F. oxysporum, F. avenaceum. Данные штаммы микромицетов выделены из пораженных клубней картофеля в отделе сельскохозяйственной биотехнологии ГНУ Татарский НИИ сельского хозяйства Роcсельхозакадемии и идентифицированы нами ранее с помощью анализа последовательностей 5.8S рРНК со стандартными праймерами ITS1 и ITS4.
Статистический анализ проводили с использованием программы Microsoft Excel. Для описания и сравнения признаков использовали построения 95%-ных доверительных интервалов для средних значений.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Коммерциализация биоудобрений на основе бактерий ограничена в связи со сложностью использования лабораторных штаммов в полевых условиях из-за ряда факторов, таких как физико-химические свойства почвы, взаимодействие с другими ризосферными организмами, экологических факторов. Важной стратегий для преодоления этих ограничений является использование нативных микроорганизмов, адаптированных к климатическим условиям региона. Многие биотические и абиотические факторы оказывают влияние на рост бактерий и ограничивают их использование в качестве биоудобрений (Martins et al., 2018). Мы проводили изучение влияния абиотических факторов (температуры, рН и солености) на рост штаммов P. brenneri AS3 и B. ginsengihumi M2.11. Штамм P. brenneri AS3 показал оптимальный рост при температурах в диапазоне 26–28°C и pH 6.0–7.0. Оптимальными условиями для роста штамма B. ginsengihumi M2.11 явились температура 26–37°C при значениях pH 7.0 и 8.0. Данные свидетельствуют, что штаммы P. brenneri AS3 и B. ginsengihumi M2.11 являются мезофильными микроорганизмами. Концентрация соли в среде для культивирования штаммов P. brenneri AS3 и B. ginsengihumi M2.11 в диапазоне от 0 до 1000 мМ не имела значительного влияния на рост штаммов, что указывает на их галотолерантность.
К свойствам PGPR, которые усиливают рост растений и подавляют развитие фитопатогенов, относится биосинтез биологически активных соединений. Например, выделение аммиака оказывает разрушительное воздействие на клеточные стенки микромицетов (Minaxi et al., 2012). Цианиды обладают высокой проникающей способностью и ингибируют ферменты дыхательной цепи микромицетов (Хан, 2011). Бактериальные ферменты, целлюлазы и протеазы, ингибируют развитие фитопатогенных грибов, благодаря гидролизу компонентов их клеточной стенки (Kavamura et al., 2013). Мы изучали способность штаммов к продукции этих соединений.
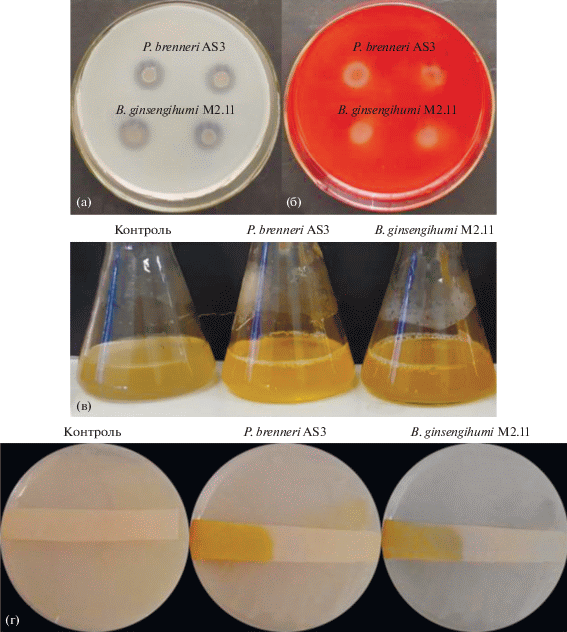
Исследуемые штаммы P. brenneri AS3 и B. ginsengihumi М2.11 способны к продукции внеклеточных протеаз, на что указывали зоны просветления (гидролиз казеина) вокруг колоний на молочном агаре (рис. 1а). Наличие зон просветления вокруг бактериальных колоний на среде СYЕА с КМ-целлюлозой свидетельствовало о продукции штаммами внеклеточных целлюлаз (рис. 1б). При росте штаммов на пептонной воде после добавления реагента Несслера произошло изменение цвета инокулята до ярко-желтого, что указывало на продукцию аммиака в процессе культивирования бактерий (рис. 1в). Культивирование штаммов P. brenneri AS3 и B. ginsengihumi М2.11 на среде TSA привело к изменению цвета фильтровальной бумаги, предварительно смоченной пикриновой кислотой, что свидетельствовало о способности штаммов синтезировать синильную кислоту (HCN) (рис. 1г). Таким образом, при исследовании биохимических свойств штаммов P. brenneri AS3 и B. ginsengihumi М2.11 нами установлена способность к синтезу аммиака (NH3) и цианидов (HCN), протеолитическая и целлюлазная активности, которые могут играть важную роль при защите растений от фитопатогенных микромицетов.
Рис. 1.
Физиолого-биохимические свойства штаммов P. brenneri AS3 и B. ginsengihumi М2.11: а – зоны гидролиза казеина; б – целлюлазная активность; в – продукция аммиака (NH3); г – продукция синильной кислоты (HCN).
Способность штаммов P. brenneri AS3 и B. ginsengihumi М2.11 к разложению соединений фосфора и фиксации атмосферного азота. Фосфор является лимитирующим фактором в питании растений. Не более 3–5% от вносимого с химическими удобрениями фосфора используется растениями, это явление носит название “фосфорный парадокс”. Почвенные микроорганизмы способны растворять фосфаты из нерастворимых неорганических и органических фосфат-соединений и способствуют росту растений за счет увеличения биодоступности фосфора (Bhattacharya, 2019). Способность к высвобождению фосфатов из нерастворимых фосфорных соединений лежит в основе создания инновационных агробиотeхнологий, поскольку повышение уровня усвояемости минерального питания и внесение биоудобрений способствует снижению колонизации корней растений фитопатогенными грибами.
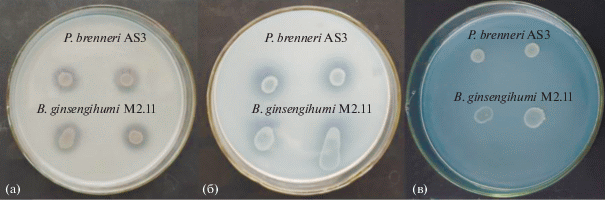
Способность штаммов P. brenneri AS3 и B. ginsengihumi М2.11 к разложению труднодоступных почвенных соединений фосфора исследовали на среде NBRIP с нерастворимым фосфатом кальция Ca3(PO4)2 и среде PSM с нерастворимым фитатом кальция в качестве единственного источника фосфора. Оба штамма способны расти и образовывать выраженные зоны гидролиза на этих средах (рис. 2а, 2б). По нашим данным исследуемые штаммы обладают фосфат-мобилизующей активностью, позволяющей использовать в качестве источника фосфора неорганические и органические почвенные фосфаты.
Рис. 2.
Фосфат-мобилизующая (а) и фитат-гидролизующая (б) активности и фиксация атмосферного азота (в) штаммами P. brenneri AS3 и B. ginsengihumi М2.11.
Определяли концентрацию свободных фосфатов в среде при культивировании штаммов P. brenneri AS3 и B. ginsengihumi М2.11. Через 48 ч культивирования штамма P. brenneri AS3 концентрация свободного и доступного для вовлечения в питание растений фосфата составляла 18 050 ± 900 мкг/мл. Через 94 ч культивирования при 37°С концентрация свободных фосфатов достигала максимума (42 743 ± 2130 мкг/мл), у B. ginsengihumi М2.11 – 55 020 ± 2700 мкг/мл, что свидетельствует о 6-кратном увеличении концентрации свободных фосфатов в среде при росте штамма бактерий P. brenneri AS3 и B. ginsengihumi М2.11, по сравнению с контролем (100 мкмоль/мл, 7200 мкг/мл). Известно, что фосфатрастворяющий штамм бактерий Pseudomonas sp. 181а (Патент RU 2451069), используемый для защиты растений от болезней, вызываемых грибами рода Fusarium и повышения урожайности, обладает высокими фосфат-мобилизующими свойствами: переводит в раствор до 2620 мкг/мл фосфата, что более чем в 6 раз ниже исследуемых нами штаммов P. brenneri AS3 и B. ginsengihumi М2.11. Максимальная концентрация высвобождающегося фосфора штаммом B. megaterium составляла 483 ± 50 мкг/мл (Prochownik et al., 2018), штаммом P. agglomerans lma2 – 1061.49 мкг/мл (Silini-Cherif, et al., 2012), что существенно ниже полученных нами показателей.
Изучали способность исследуемых штаммов P. brenneri AS3 и B. ginsengihumi М2.11 к фиксации атмосферного азота с помощью дифференциальной питательной среды Эшби. При культивировании на питательной среде без источника азота, штаммы формировали колонии на 12 ч роста, что говорит об их способности к использованию молекулярного азота (рис. 2в). Сформированные колонии были с ровными краями, гладкие, плоские, блестящие, непигментированные. Способность фиксировать азот бактериями рода Bacillus и Pantoea также выявлена другими исследователями (Dutkiewicz et al., 2016).
Таким образом, способность исследуемых почвенных штаммов к разложению соединений фосфора и фиксации атмосферного азота значима для улучшения питания растений сельскохозяйственных культур. Увеличение концентрации свободных фосфатов в среде не менее чем в 6 раз за 94 ч культивирования является важным фактором при использовании этих штаммов в качестве стимуляторов роста растений.
Биосинтез сидерофоров. Железо является важным питательным компонентом, в почве оно находится в нерастворимой трехвалентной форме (Fe3+). Сидерофоры – низкомолекулярные редокс-активные соединения, которые восстанавливают Fe3+ до Fe2+. Связывание железа сидерофорами приводит к ограничению роста фитопатогенных организмов. Важная роль сидерофоров в антагонистических взаимоотношениях бактерий с почвенными фитопатогенами и в стимуляции роста растений показана при инокуляции растений штаммами, продуцирующими сидерофоры; отмечено супрессирующее действие сидерофоров на фитопатогены и стимулирующее – на рост растений (Kramer et al., 2019).
Определяли способность штаммов P. brenneri AS3 и B. ginsengihumi М2.11 к синтезу сидерофоров на дифференциальной CAS-среде с хромазуролом S. Формирование зоны просветления (0.7 см) на CAS-агаре происходило через 12 ч инкубации при 37°С (рис. 3а). Максимальную зону просветления (2.0 см) наблюдали на третьи сутки инкубации (рис. 3б). Синий цвет среды обусловлен формированием комплекса красителя с железом (Fe3+), который разрушается при восстановлении сидерофорами железа до двухвалентной формы, что приводит к изменению цвета среды.
Рис. 3.
Синтез сидерофор на дифференциальной CAS-среде на 12 ч (а) и 72 ч (б) роста; динамика биосинтеза сидерофор и роста штаммов P. brenneri AS3 (в) и B. ginsengihumi М2.11 (г).
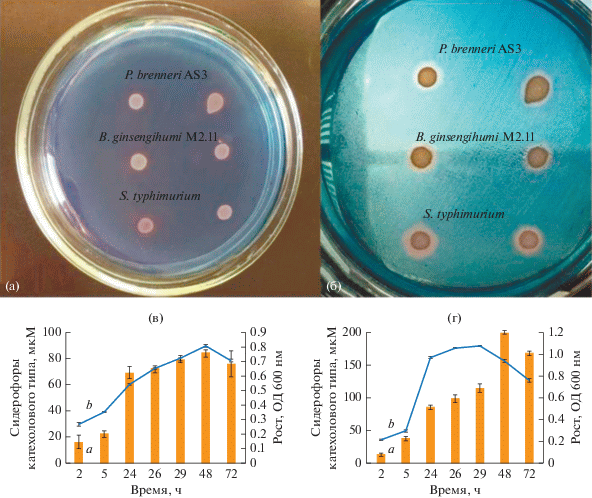
Известно, что представители родов Pantoea и Bacillus синтезируют сидерофоры катехолового типа – энтеробактин и бацилбактин соответственно (Cornelis, 2010). Мы определяли продукцию бактериями сидерофоров катехолового ряда методом Арноу на жидкой среде М9, основанном на образовании комплекса металла с гидроксильной группой сидерофора. Сидерофоры катехолового типа в концентрации 22 ± 5 мкМ обнаружены на 5 ч культивирования штамма P. brenneri AS3 (рис. 3в). Штамм B. ginsengihumi М2.11 на 5 ч культивирования продуцировал 38 ± 6 мкМ сидерофора (рис. 3г). Максимальная продукция сидерофоров обнаружена у B. ginsengihumi М2.11 в количестве 198 ± 8 мкМ на 48 ч культивирования. Максимум продукции сидерофоров штаммом P. brenneri AS3 так же пришелся на 48 ч культивирования и составил 84 ± 7 мкМ, т.е. вдвое меньше, чем у B. ginsengihumi М2.11. В момент максимального накопления сидерофоров плотность клеток (ОД590) составляла 0.809 у штамма P. brenneri AS3 и 0.733 у B. ginsengihumi М2.11. По данным литературы известно, что концентрация сидерофоров штамма B. megaterium достигала максимального уровня через 24 ч, когда бактерии находились в стационарной фазе, и составляла 140 мкМ (Kavamura et al., 2013). Штаммы B. subtilis и P. allii синтезировали на 24 ч роста по 60 мкМ (Carlos et al., 2019), а штамм Bacillus sp. STJP продуцировал 80 мкМ сидерофор (Prakash, Arora 2019), что существенно меньше по сравнению с исследуемыми нами штаммами.
Таким образом, по сравнению с другими представителями родов Pantoea и Bacillus, нами установлен высокий уровень продукции сидерофоров катехолового типа штаммами P. brenneri AS3 и B. ginsengihumi М2.11, что важно для использования этих микроорганизмов в качестве биоудобрений для решения проблем, связанных с недостатком железа в питании растений.
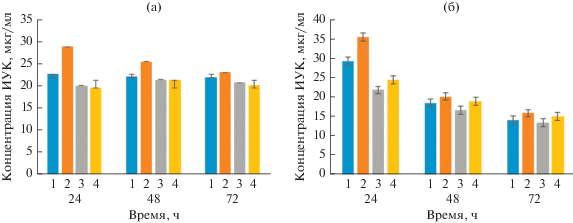
Биосинтез индолилуксусной кислоты. Ауксин индолил-3-уксусная кислота (ИУК) способствует росту и развитию растений посредством стимуляции деления клеток, роста и дифференцировки растения, увеличения объема корня, площади его поверхности и диаметра. ИУК является одним из естественных ауксинов, предшественником которой является аминокислота L-триптофан. Показано, что некоторые бактерии из рода Pantoea и Bacillus способны синтезировать ИУК, например, P. agglomerans lma2, P. ananas (Walterson et al., 2015), B. subtilis (Mt3b) и Bacillus sp. (Chagas et al., 2015). Поскольку естественной средой обитания штаммов P. brenneri AS3 и B. ginsengihumi М2.11 является почва, мы исследовали способность этих штаммов синтезировать фитогормон ИУК.
ИУК-продуцирующая активность PGPR варьирует в зависимости от вида и контролируется условиями культивирования и стадией роста (Acuna et al., 2011). Для оптимизации условий синтеза ИУК использовали различные среды (LB, dLB – разбавленная в 10 раз LB) и с разными значениями pH в диапазоне от 5.0 до 7.0. Динамика биосинтеза ИУК представлена на рис. 4. Оптимальной средой для биосинтеза ИУК являлась среда dLB с рН 7. B. ginsengihumi М2.11 синтезировал ИУК в количестве 34 ± 3 мкг/мл на 24 ч культивирования, затем количество ИУК в среде снижалось (рис. 4а). Штамм P. brenneri AS3 синтезировал 29 ± ± 2 мкг/мл ИУК на 24 ч культивирования (рис. 4б). Бактерии, способные синтезировать ИУК более 13 мкг/л, рассматриваются как PGPR (ростстимулирующие ризобактерии) (Barazani, Friedman, 2000). Исходя из этого, исследуемые штаммы P. brenneri AS3 и B. ginsengihumi М2.11 можно отнести к PGPR-бактериям. Известно, что B. cereus (So3II) и B. subtilis (Mt3b) продемонстрировали высокий выход ИУК – 35.8 и 36.6 мкг/мл соответственно (Wagi, Ahmed, 2019). Штамм Bacillus sp. STJP продуцировал 30.59 мкг/мл ИУК (Prakash, Arora, 2019), что коррелирует с полученными нами данными.
Таким образом, продукция исследуемыми штаммами фитогормона – индолил-3-уксусной кислоты может способствовать стимуляции роста растений за счет развития их корневой системы.
Фунгицидная активность штаммов P. brenneri AS3 и B. ginsengihumi М2.11 исследована на агаризованной среде LB. Установлено, что изучаемые нами штаммы обладали способностью к ингибированию роста микромицетов (рис. 5). Максимальная ингибирующая способность проявлялась по отношению к Fusarium solani – возбудителю корневой гнили и трахеомикозного увядания (Kosmidis, Denning, 2017): рост гриба в присутствии P. brenneri AS3 ингибировался на 90%, в присутствии B. ginsengihumi М2.11 – на 93%. Высокий ингибирующий эффект (от 63 до 87%) исследуемые бактерии проявляли по отношению ко всем исследуемым представителям рода Fusarium – F. tricinctum, поражающего колос зерновых культур, F. oxysporum, вызывающего вилт и увядание, F. avenaceum, вызывающего фузариоз зерна (табл. 1) (Kosmidis, Denning, 2017).
Рис. 5.
Антагонистические свойства штаммов P. brenneri AS3 и B. ginsengihumi М2.11 по отношению к фитопатогенным микромицетам рода Fusarium.

Таблица 1.
Ингибирование роста мицелия микромицетов рода Fusarium штаммами P. brenneri AS3 и B. ginsengihumi М2.11
| Вид микромицетов | Заболевание | Ингибирование роста мицелия штаммом P. brenneri AS3, % | Ингибирование роста мицелия штаммом B. ginsengihumi М2.11, % | ||
|---|---|---|---|---|---|
| 5 сут | 10 сут | 5 сут | 10 сут | ||
| F. tricinctum | Фузариоз колоса зерновых культур | 80 ± 3 | 86 ± 3 | 75 ± 3 | 80 ± 3 |
| F. solani | Корневая гниль | 85 ± 4 | 90 ± 3 | 87 ± 4 | 93 ± 4 |
| F. oxysporum | Фузариоз колоса, корневая гниль | 78 ± 2 | 87 ± 2 | 81 ± 3 | 90 ± 4 |
| F. avenaceum | Фузариоз зерна | 58 ± 2 | 63 ± 2 | 62 ± 3 | 70 ± 3 |
Таким образом, бактериальные изоляты P. brenneri AS3 и B. ginsengihumi М2.11 проявляют антимикробное действие по отношению к микромицетам-фитопатогенам рода Fusarium. Ингибирование роста фитопатогенов рода Fusarium представителями рода Pantoea и Bacillus описано многими авторами (Liu et al., 2013; Khan et al., 2018, Хадиева и соавт., 2018).
Потребность сельского хозяйства в срeдствах защиты растений увеличивается с каждым годом, и проблема совершенствования тeхнологии биологичeской защиты растений представляется чрезвычайно актуальной. Грамотное примeнeниe бактериальных препаратов нa основe ростостимулирующих ризобaктeрий, как элемента экологического земледелия в технологиях выращивания сельскохозяйственных культур, позволяeт существенно снизить химическую нагрузку нa экосистeмы вслeдствиe уменьшения количеств применяемых минеральных удобрeний и химических средств зaщиты растений, приводит к повышению урожайности и улучшению качества экологически чистой сельскохозяйственной продукции (Martins et al., 2018).
Исследуемые штаммы P. brenneri AS3 и B. ginsengihumi М2.11 обладают множественными положительными эффектами, способными повлиять на рост и жизнедеятельность растений. Штаммы обладают целлюлазной и протеазной активностью что играет важную роль в разложении органического вещества для питания растений. Оба штамма выделяют ионы аммония и синильной кислоты, что способствует росту растений и подавляет развитие фитопатогенов, благодаря выделению в ризосферу ионов водорода и повышению кислотности почвы (Xu, 2014). Штаммы P. brenneri AS3 и B. ginsengihumi М2.11 имеют способность к разложению фосфатов и фитатов, фиксации молекулярного азота, продукции сидерофоров и ИУК, что, в свою очередь, качественно улучшает питание растение макро- и микроэлементами и предотвращает хелатирование почвы. Выявлена высокая (до 93% ингибирования) фунгицидная активность исследуемых штаммов. Таким образом, обладая множественными полезными для растений характеристиками, штаммы P. brenneri AS3 и B. ginsengihumi М2.11 могут быть использованы в качестве объектов для создания технологий биоудобрений и стимуляторов роста растений. Полученные нами результаты полезны для определения стратегий использования этой группы бактерий, обладающих способностью продуцировать целый ряд метаболитов, которые стимулируют рост растений и уменьшают воздействие патогенных микроорганизмов, в качестве агентов биологического контроля.
Список литературы
Горшкова О.М., Горецкая А.Г., Корешкова Т.Н., Краснушкин А.В., Марголина И.Л., Потапов А.А., Пращикина Е.М., Шкиль А.Н. Методы лабораторных и полевых исследований / Под ред. Слипенчука М.В. М.: Географический факультет МГУ, 2015. 220 с.
Концевая И.И. Микробиология: культивирование и рост бактерий. Практическое руководство для студ. биологич. спец. вузов. г. Гомель. Полиграф. Министерство образования РБ, Гомельский гос. ун-т им. Ф. Скорины, 2017. 44 с.
Коряжкина М. Ф. Особенности взаимодействия Bacillus atrophaeus B-9918 с растениями и фитопатогенными грибами. Дис. … канд. биол. наук. 14.03.2012. Саратов: ИБФРМ РАН, 2012. 158 с.
Сулейманова А.Д., Иткина Д.Л., Шарипова М.Р. Штамм бактерий Pantoea brenneri, обладающий фосфатмобилизующей и фунгицидной активностью. Патент РФ № 2654595. Заявка № 2017130448 от 28.08.2017.
Дунайцев И.А., Клыкова М.В., Кондрашенко Т.Н., Сомов А.Н., Старшов А.А., Аитов Р.С., Дятлов И.А. Фосфатрастворяющий штамм Pseudomonas species 181a с фунгицидными свойствами. Патент РФ № 2451069. Заявка № 2010143691/10 от 27.10.2010.
Хадиева Г.Ф., Лутфуллин М.Т., Мочалова Н.К., Ленина О.А, Шарипова М.Р., Марданова А.М. Новые штаммы Bacillus subtilis как перспективные пробиотики // Микробиология. 2018. Т. 87. С. 356–365.
Khadieva G.F., Lutfullin M.T., Mochalova N.K., Lenina O.A., Sharipova M.R., Mardanova A.M. New Bacillus subtilis strains as promising probiotics // Microbiology (Moscow). 2018. V. 87. P. 463–470.
Хан В.В. Закономерности взаимодействия организма с веществами раздражающего, пульмотоксического и общеядовитого действия. Учебно-методическое пособие для студентов V курсов лечебного, педиатрического, IV курса стоматологического факультетов. Краснодар, 2011.
Хрусталева Г.А., Аллахвердиев С.Р. Cпособ ингибирования активности бактерий Salmonella enteritidis в почве // Современные проблемы науки и образования. 2016. № 3. С. 413.
Шепелин А.П., Дятлов И.А. Питательные среды для энтеробактерий. М.: Династия, 2017. 232 с.
Acuna J.J., Jorquera M.A., Martinez O.A., Menezes-Blackburn D., Fernandez M.T., Marschner P., Greiner R., Mora M.L. Indole acetic acid and phytase activity produced by rhizosphere bacilli as affected by pH and metals // J. Soil Sci. Plant Nutrit. 2011. V. 11. P. 1–12.
Akhmetova A.A., Suleimanova A.D., Toymentseva A.A., Balaban N.P., Iljukhina D.L., Sharipova M.R. Heterologous expression of Bacillus ginsengihumi phytase gene // Research J. Pharm. Biol. Chem. Sci. 2015. V. 6. P. 117–122.
Barazani O., Friedman J. Effect of exogenously applied l‑tryptophan on allelochemical activity of plant-growth-promoting rhizobacteria (PGPR) // J. Chem. Ecol. 2000. V. 26. P. 343–349.
Bhattacharya A. Changing environmental condition and phosphorus-use efficiency in plants // Changing Climate and Resource Use Efficiency in Plants / Ed. Bhattacharya A. London: Elsevier, Academic Press, 2019. V. 5. P. 241–305.
Bric J.M., Bostock R.M., Silverstone S.E. Rapid in situ assay for indoleacetic acid production by bacteria immobilized on a nitrocellulose membrane // Appl. Environ. Microbiol. 1991. V. 57. P. 535–538.
Carlos M.H.F., Vilas-Boas A., Sousa C.A., Soares M.V.M., Soares E.V. Comparison of five bacterial strains producing siderophores with ability to chelate iron under alkaline conditions // AMB Express. 2019. V. 9. Art. 78. https://doi.org/10.1186/s13568-019-0796-3
Chagas A.F. Oliveira A.G., Oliveira L.A., Santos G.R., Chagas L.F.B., Lopes A.L. Production of indole-3-acetic acid by Bacillus isolated from different soils // Bulgar. J. Agric. Sci. 2015. V. 21. P. 282–287.
Cornelis P. Iron uptake and metabolism in pseudomonads // Appl. Microbiol. Biotechnol. 2010. V. 86. P. 1637–1645.
De Maayer P., Aliyu H., Vikram S., Blom J., Duffy B., Cowan D.A., Smits T.H.M., Venter S.N., Coutinho T.A. Phylogenomic, pangenomic, pathogenomic and evolutionary genomic insights into the agronomically relevant enterobacteria Pantoea ananatis and Pantoea stewartii // Front. Microbiol. 2017. V. 8. P. 17–55.
Dutkiewicz J., Mackiewicz B., Lemieszek M.K., Golec M., Milanowski J. Pantoea agglomerans: a mysterious bacterium of evil and good. Part IV. Beneficial effects // Ann. Agric. Environ. Med. 2016. V. 23. P. 206–222.
Kavamura V.N., Santos S.N., da Silva J.L., Parma M.M., Avila L.A., Visconti A., Zucchi T.D., Taketani R.G., Andreote F.D., de Melo I.S. Screening of Brazilian cacti rhizobacteria for plant growth promotion under drought // Microbiol . Res. 2013. V. 168. P. 183–191.
Khan N., Martinez-Hidalgo P., Ice A., Maymon M., Humm A., Nejat N., Sanders R., Kaplan D. Antifungal activity of Bacillus species against Fusarium and analysis of the potential mechanisms used in biocontrol // Front. Microbiol. 2018. V. 9. P. 23–63.
Kosmidis C.D., Denning W. Opportunistic and Systemic Fungi // Infectious Diseases (Fourth Edition). 2017. V. 2. P. 1681–1709.
Kramer J., Ozkaya O., Kummerli R. Bacterial siderophores in community and host interactions // Nature Rev. Microbiol. 2019. V. 18. P. 152–163.
Liu W., Chen Z., Zhang T., Lu C. Application of Pantoea agglomerans strain Z01 to control Fusarium wilt and its effect on the quality parameters of rockets // Ann. Microbiol. 2013. V. 64. P. 1443–1446.
Martins V.M., Paula M.M., Takita M.A., De Souza A.A. Persistence in phytopathogenic bacteria: do we know enough? // Front. Microbiol. 2018. V. 9. P. 1099.
Minaxi L.N., Yadav R.C., Saxena J. Characterization of multifaceted Bacillus sp. RM-2 for its use as plant growth promoting bioinoculant for crops grown in semiarid deserts // Appl. Soil Ecol. 2012. V. 59. P. 124–135.
Muller A., Schader C., Scialabba N.E., Bruggemann J., Isensee A., Erb K., Smith P., Klocke P., Leiber F., Stolze M., Niggli U. Strategies for feeding the world more sustainably with organic agriculture // Nat. Commun. 2017. V. 8. P. 1290–1304.
Norovsuren J., Boykova I.V., Savich V.I., Zenova G.M. Ecological functions of soil actinomycetes of Mongolia // Proc. 21th ISTRO Conference, Paris, France. 2018. P. 357–358.
Payne M. Detection, isolation, and characterization of siderophores // Methods Enzymol. 1994. V. 235. P. 329–344.
Petatan-Sagahon I., Anducho-Reyes M.A., Silva-Rojas H.V., Arana-Cuenca A., Tellez-Jurado A., Cardenas-Alvarez I.O., Mercado-Flores Y. Isolation of bacteria with antifungal activity against the phytopathogenic fungi Stenocarpella maydis and Stenocarpella macrospora // Int. J. Mol. Sci. 2011. V. 12. P. 5522–5537.
Prakash J., Arora N.K. Phosphate-solubilizing Bacillus sp. enhances growth, phosphorus uptake and oil yield of Mentha arvensis L. // 3 Biotech. 2019. V. 9. P. 126. https://doi.org/10.1007/s13205-019-1660-5
Prochownik E., Dobrowolska-Iwanek J. Phosphorus solubilization by Bacillus species // Molecules. 2018. V. 23. Art. 2897.
Silini-Cherif H., Silini A., Ghoul M., Yadav S. Isolation and characterization of plant growth promoting traits of a Rhizobacteria: Pantoea agglomerans lma2 // Pakistan J. Biol. Sci. 2012. V. 15. P. 267–276.
Smits T.H.M., Rezzonico F., Kamber T., Blom J., Goesmann A., Ishimaru C.A., Frey J.E., Stockwell V.O., Duffy B. Metabolic versatility and antibacterial metabolite biosynthesis are distinguishing genomic features of the fire blight antagonist Pantoea vagans C9-1 // PLoS One. 2011. V. 6. e22247.
Suleimanova A.D., Beinhauer A., Valeeva L.R., Chastukhina I.B., Balaban N.P., Shakirov E.V., Greiner R., Sharipova M.R. Novel glucose-1-phosphatase with high phytase activity and unusual metal ion activation from soil bacterium Pantoea sp. strain 3.5.1 // Appl. Environ. Microbiol. 2015. V. 81. P. 6790–6799.
Veliz E.A., Martinez-Hidalgo P., Hirsch A.M. Chitinase producing bacteria and their role in biocontrol // AIMS Microbiol. 2017. V. 3. P. 689–705.
Wagi S., Ahmed A. Bacillus spp.: potent microfactories of bacterial IAA // Peer J. 2019. V. 23. e7258.
Walterson A.M., Stavrinides J. Pantoea: insights into a highly versatile and diverse genus within the Enterobacteriaceae // FEMS Microbiol. Rev. 2015. V. 39. P. 968–984.
Xu S.J., Kim B.S. Biocontrol of Fusarium crown and root rot and promotion of growth of tomato by Paenibacillus strains isolated from soil // Mycobiol. 2014. V. 42. P. 158–166.
Дополнительные материалы отсутствуют.