Микробиология, 2021, T. 90, № 2, стр. 236-242
Сравнительное исследование путей метаногенеза в осадках термокарстовых и полигенетических ямальских озер
А. Ю. Каллистова a, *, В. В. Кадников a, А. С. Саввичев a, И. И. Русанов a, Ю. А. Дворников b, М. О. Лейбман c, А. В. Хомутов c, Н. В. Равин a, Н. В. Пименов a
a ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Департамент ландшафтного проектирования и устойчивых экосистем, Аграрно-технологический институт, РУДН
117198 Москва, Россия
c Институт криосферы Земли, ФИЦ Тюменский научный центр СО РАН
625000 Тюмень, Россия
* E-mail: kallistoanna@mail.ru
Поступила в редакцию 11.11.2020
После доработки 24.11.2020
Принята к публикации 25.11.2020
Аннотация
Проведено сравнительное исследование разнообразия метаногенов и потенциальной активности различных путей метаногенеза в осадках молодых термокарстовых и зрелых полигенетических ямальских озер. Важную роль в образовании метана в термокарстовых озерах играл гидрогенотрофный метаногенез; также выявлены ацетокластический и метилотрофный пути метаногенеза. В полигенетическом озере с содержанием растворенного органического вещества, наиболее близком к термокарстовым озерам, метаногенез протекал более интенсивно, и относительная доля метаногенов, особенно ацетокластических, была выше, чем в термокарстовых озерах; предполагается активность метил-редуцирующих метаногенов. В осадках всех озер выявлены метаногены родов Methanothrix, Methanoregula и представители семейства Methanomassiliicoccaceae. Также детектированы метанокисляющие бактерии (Methylobacter, “Candidatus Methylomirabilis”) и археи (“Ca. Methanoperedens”).
Вечная мерзлота является одним из крупнейших наземных пулов углерода (Ciais et al., 2013; Saunois et al., 2016; Oliva, Fritz, 2018). Важным следствием таяния вечной мерзлоты в условиях глобального потепления считается высвобождение захороненного в ней органического вещества и рост эмиссии парниковых газов из северных широт (Ciais et al., 2013). В результате вытаивания высокольдистых многолетнемерзлых пород происходит образование просадочных форм рельефа и формирование термокарстовых озер (Общее мерзлотоведение, 1978). Термокарстовые озера составляют значимую часть арктической пресноводной системы и обусловливают специфику тундровых и лесотундровых ландшафтов (Кравцова, 2009). Многие термокарстовые озера характеризуются высокими скоростями эмиссии метана, и в них предполагается дальнейшее увеличение интенсивности метаногенеза за счет современных микробных процессов разложения постепенно оттаивающего органического вещества вечной мерзлоты (Walter et al., 2007; Heslop et al., 2015; Martinez-Cruz et al., 2015; Vonk et al., 2015; Wik et al., 2016; Townsend-Small et al., 2017; Serikova et al., 2019, Zabelina et al., 2020). В настоящее время ведутся интенсивные исследования цикла метана в термокарстовых озерах Аляски и Канады, где выявлены ацетокластический, гидрогенотрофный и метилотрофный пути метаногенеза, идентифицированы различные представители метаногенных архей (Negandhi et al., 2013; Vonk et al., 2015; Matheus Carnevali et al., 2015, 2018; Townsend-Small et al., 2017; de Jong et al., 2018; in’t Zandt et al., 2020). При этом процесс метаногенеза в молодых термокарстовых озерах редко рассматривают в сравнении с процессом метаногенеза в зрелых полигенетических озерах, расположенных в том же географическом регионе. Арктические полигенетические озера находятся под таким же влиянием современных климатических изменений, но в отличие от молодых термокарстовых озер, в них работает “зрелое” микробное сообщество, которое включает в себя все функциональные группы микроорганизмов, необходимые для минерализации органического вещества до непосредственных субстратов метаногенеза.
Целью настоящей работы являлось сравнение осадков термокарстовых и полигенетических арктических озер по таксономическому составу и относительной доле метаногенов in situ и их потенциальной активности на субстратах, обеспечивающих ацетокластический, гидрогенотрофный, метилотрофный и метил-редуцирующий пути метаногенеза. Эта работа является первым сообщением о путях метаногенеза в осадках термокарстовых озер России.
Объектом исследования служили осадки 4-х озер, расположенных в зоне сплошного распространения вечной мерзлоты (Центральный Ямал). Два из них (LK-002 и LK-010) являлись типичными мелководными (1.2 и 2 м соответственно) термокарстовыми озерами, другие два (LK-003, LK-004) – глубоководными (10.6 и 11.5 м) “зрелыми” полигенетическими озерами. Водная толща всех озер была аэробной; осадки слабо-окисленными. Физико-химические характеристики водной толщи и осадков, а также данные по интенсивностям микробных процессов и составу сообществ, представлены в другой нашей публикации (Savvichev et al., в печати). Содержание углерода в растворенном органическом веществе (С-РОВ) иловой воды осадков определяли на анализаторе Shimadzu TOC-Vcph (Япония). Содержание метана определяли методом фазово-равновесной дегазации (McAuliffe, 1971). Состав микробных сообществ определяли с помощью высокопроизводительного секвенирования вариабельных участков V3−V4 гена 16S рРНК. Использовали набор универсальных праймеров 341F и 806R (Yu et al., 2005). Выделение ДНК, амплификацию, секвенирование, анализ фрагментов гена 16S рРНК, кластеризацию последовательностей в оперативные таксономические единицы (ОТЕ), удаление химерных последовательностей и таксономическую идентификацию ОТЕ проводили по методикам, описанным в Savvichev et al. (в печати). Полученные нуклеотидные последовательности депонированы в GenBank под номерами SRR11972844–SRP266728 и доступны через BioProject PRJNA636944. Образцы, отобранные со средней глубины слоя осадков (табл. 1) инкубировали с добавлением субстратов, обеспечивающих ацетокластический (ацетат), гидрогенотрофный (Н2/СО2; формиат), метилотрофный (триметиламин, ТМА; метанол, МеОН; диметилсульфоксид, ДМСО) и метил-редуцирующий (ТМА + Н2; МеОН + Н2; ДМСО + Н2) пути метаногенеза. Готовили суспензии придонной воды и осадков (1 : 1, по объему); придонную воду предварительно кипятили и остужали до комнатной температуры в токе аргона. Инкубацию проводили при 10°С; подробная методика инкубации описана в Kallistova et al. (2020). Количество образованного метана рассчитывали на 1 г сух. веса (СВ) суспензии (вода + осадок); СВ определяли высушиванием образца до постоянного веса при 105°С.
Таблица 1.
Содержание органического вещества, концентрация метана и относительное обилие микроорганизмов цикла метана в осадках термокарстовых и полигенетических ямальских озер
| Озера | Глубина, см | C-РОВ, мг/л | CН4, мкмоль/дм3 | Метаногены | Метанотрофы |
|---|---|---|---|---|---|
| % от общего числа последовательностей 16S рРНК | |||||
| Полигенетические | |||||
| LK-003 | 0–3 | 14 | 594 | 27.5 | 4.3 |
| 3–7* | 22 | 978 | 34.8 | 2.6 | |
| 7–12 | 28 | 986 | 31.8 | 3.0 | |
| LK-004 | 0–4 | 9 | 10.8 | 4.6 | 5.4 |
| 4–9* | 7 | 132 | 13.1 | 2.4 | |
| 9–15 | 6 | 407 | 8.4 | 0.9 | |
| Термокарстовые | |||||
| LK-002 | 0–4 | 38 | 93.7 | 2.7 | 4.3 |
| 4–9* | 30 | 235 | 16.1 | 1.7 | |
| 9–14 | 18 | 376 | 18.2 | 2.5 | |
| LK-010 | 0–3 | 32 | 32.8 | 2.1 | 5.4 |
| 3–6* | 26 | 291 | 5.9 | 4.6 | |
| 6–12 | Н.д. | 365 | 12.5 | 1.6 | |
Содержание С-РОВ в осадках термокарстовых озер было выше, чем в осадках полигенетических озер (табл. 1). Вероятно, органическое вещество поступает в эти озера, в том числе и при оттаивании вечной мерзлоты. Однако часть этого органического вещества, очевидно, находится в недоступной для метаногенов форме, на что в совокупности указывают данные по концентрации метана (табл. 1), относительной доле и разнообразию метаногенов (табл. 1, рис. 1), эндогенной (контроль без добавления субстратов метаногенеза) и потенциальной метаногенной активности осадков озер на разных субстратах метаногенеза (рис. 2). Сравнение результатов анализа полигенетического оз. LK-003, в котором содержание С-РОВ было наиболее близко по значениям к термокарстовым озерам LK-002 и LK-010, показывает, что в оз. LK-003 образуется больше метана, относительная доля метаногенов выше и метаногенез протекает более интенсивно (табл. 1, рис. 2). Полигенетическое оз. LK-003 отличается от термокарстовых озер в первую очередь более высоким относительным обилием ацетокластических метаногенов рода Methanothrix (рис. 1), что указывает на присутствие в составе органического вещества осадков свободного ацетата. Вероятно в “зрелом” полигенетическом озере уже сформировалось сбалансированное микробное сообщество, обеспечивающее метаногенов основными субстратами роста. Об избытке в осадках этого озера эндогенных субстратов метаногенеза также свидетельствует интенсивное образование метана в контроле (рис. 2). На фоне высокого эндогенного метаногенеза невозможно четко выделить влияние внесения субстратов гидрогенотрофного, ацетокластического и метилотрофного метаногенеза. При этом наиболее потенциально активным в этом озере оказался метил-редуцирующий метаногенез (рис. 2). Напротив, в полигенетическом оз. LK-004 с минимальным содержанием РОВ (в среднем в ~4 раза ниже, чем в термокарстовых озерах) эндогенный метаногенез минимален, а относительное обилие метаногенов разных групп близко к таковому в термокарстовых озерах (рис. 1, 2).
В молодых термокарстовых озерах при избытке органического вещества, наблюдается недостаток непосредственных субстратов метаногенеза. Возможно, растворенный углерод находится в трудноусвояемой форме в виде сложных соединений растительного происхождения (Покровский и соавт., 2012), а в микробном сообществе термокарстовых озер отсутствуют или находятся в низкой численности микроорганизмы, его разлагающие. Это, однако, не исключает того, что со временем микробное сообщество термокарстовых озер обогатится требуемыми организмами из окружающих почв, и тогда скорость образования и количество метана значительно увеличатся. В целом, для обоих термокарстовых озер был характерен более интенсивный гидрогенотрофный метаногенез (на Н2/СО2 и формиате) в первые 2 нед. с начала инкубации. Начиная с 3 нед. инкубации, происходила активация ацетокластического и метилотрофного путей метаногенеза. Вероятно, в силу доступности субстрата именно гидрогенотрофные метаногены были активны в осадках in situ, поэтому в инкубационных экспериментах они начинали работать первыми, без существенной лаг-фазы. Для остальных метаногенов при добавлении субстрата требовалось время для накопления и достижения ими максимальной активности (рис. 2).
Метаногенные популяции осадков термокарстовых и полигенетических озер были близки по таксономическoму составу; различалось только относительное обилие различных таксонов. Во всех озерах детектированы представители, осуществляющие гидрогенотрофный (Methanoregula) и ацетокластический (Methanothrix) метаногенез (рис. 1). Секвенирование фрагментов гена 16S рРНК не выявило в осадках озер представителей метилотрофных метаногенов. Однако результаты инкубационного эксперимента с добавлением ТМА и МеОН (рис. 2) указывают на наличие метилотрофного пути метаногенеза в термокарстовом озере LK-002. Следует отметить, что во всех озерах детектированы некультивируемые представители класса Thermoplasmata (до 32% от общего количества последовательностей 16S рРНК). Часть из этих последовательностей (около 1%) может быть отнесена к представителям семейства Methanomassiliicoccaceae, среди которых выявлены метил-редуцирующие метаногены (Dridi et al., 2012). Также обнаружены единичные последовательности (макс. 0.03%) метил-редуцирующих представителей порядка Methanofastidiosales (на рис. 1 не показаны). Метил-редуцирующий метаногенез может быть предположен на основании результатов инкубационного эксперимента в полигенетическом оз. LK-003 (рис. 2).
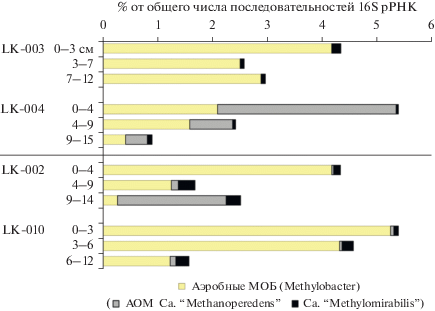
Важно отметить, что количество метана в осадках может быть тем ниже, чем сильнее мет-анокисление. Осадки озер, однако, были близки между собой в отношении суммарного обилия метанотрофов (табл. 1). Верхний слой осадков всех озер был слабо окисленным, и, одновременно с метаногенезом, в нем происходило метанокисление, причем как аэробное, так и анаэробное. В осадках термокарстовых и полигенетических озер обнаружены аэробные метанотрофы рода Methylobacter, традиционно детектируемые в пресных бореальных озерах (He et al., 2012; Crevecoeur et al., 2017; Martinez-Cruz et al., 2017; Rissanen et al., 2018 и др.). Также выявлены анаэробные метанотрофы: нитрит-зависимые бактерии “Ca. Methylomirabilis” (NC10) и нитрат-зависимые археи “Ca. Methanoperedens” (ANME-2d) (рис. 3). Подробное описание метанокисления в озерах приведено в другой публикации (Savvichev et al., в печати).
Рис. 1.
Разнообразие и относительная доля метаногенов в осадках термокарстовых (LK-002, LK-010) и полигенетических (LK-003, LK-004) озер. Стрелками отмечен слой осадков, образцы из которого использовали для постановки инкубационных экспериментов с добавлением субстратов метаногенеза.
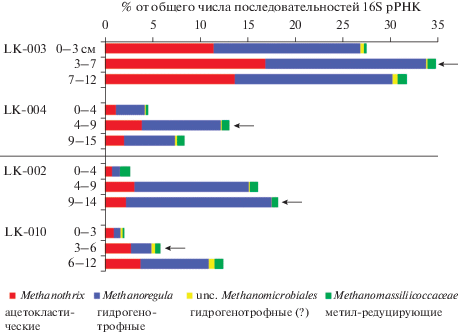
Рис. 2.
Образование метана при инкубации осадков с различными субстратами метаногенеза: сравнительная динамика образования метана в термокарстовых озерах LK-002 и LK-010 (а), сравнительная динамика образования метана в термокарстовых (LK-002) и полигенетических (LK-003 и LK-004) озерах (б). Цифры в легенде обозначают продолжительность инкубации (нед.); горизонтальными пунктирными линиями обозначены максимальные количества образованного метана в эндогенных контролях (без добавления субстрата) в соответствующих озерах.
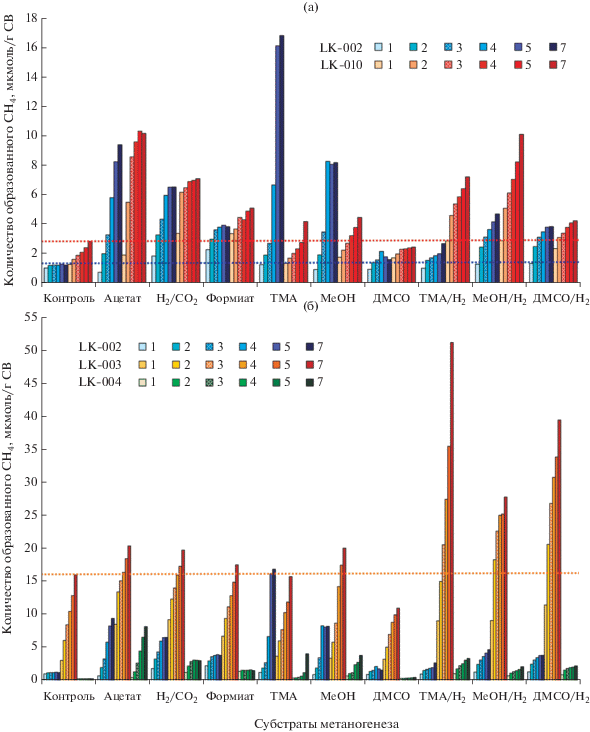
Рис. 3.
Разнообразие и относительная доля метанотрофов в осадках термокарстовых (LK-002, LK-010) и полигенетических (LK-003, LK-004) озер. МОБ – аэробные метанoкисляющие бактерии, АОМ – анаэробные метанокисляющие микроорганизмы.
Таким образом, в молодых термокарстовых озерах содержание РОВ выше, чем в полигенетических; часть РОВ при этом, вероятно, находится в недоступной для метаногенов форме. Важную роль в образовании метана играет гидрогенотрофный путь метаногенеза. В полигенетических озерах метаногенез тем интенсивнее, чем выше содержание РОВ. В озере с минимальным содержанием РОВ (в среднем в 4 раза ниже, чем в термокарстовых озерах) эндогенный метаногенез минимален, а относительное обилие метаногенов разных групп близко к таковому в термокарстовых озерах. Напротив, в полигенетическом озере с более высоким содержанием РОВ (в среднем в 1.3 раза ниже, чем в термокарстовых озерах) эндогенный метаногенез и относительная доля метаногенов, особенно ацетокластических, выше, чем в термокарстовых озерах.
Список литературы
равцова В.И. Распространение термокарстовых озер в России // Вестн. Моск. ун-та. Сер. география. 2009. № 3. С. 33–42
Общее мерзлотоведение / Под ред. Кудрявцева В.А. М.: Изд-во Моск. ун-та, 1978. 463 с.
Покровский О.С., Широкова Л.С., Кирпотин С.Н. Микробиологические факторы, контролирующие цикл углерода в термокарстовых водных объектах Западной Сибири // Вестн. Томского гос. ун-та. Биология. 2012. № 3(19). С. 199–217.
Ciais P., Sabine C., Bala G., Bopp L., Brovkin V., Canadell J., Chhabra A., DeFries R., Galloway J., Heimann M., Jones C., Le QuéréC., Myneni R.B., Piao S., Thornton P. Carbon and other biogeochemical cycles // Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change / Eds. Stocker T.F., Qin D., Plattner G.-K., Tignor M., Allen S.K., Boschung J., NauelsA., Xia Y., Bex V., Midgley P.M. Cambridge: Cambridge University Press, UK, 2013. P. 465–570.
Crevecoeur S., Vincent W.F., Comte J., Matveev A., Lovejoy C. Diversity and potential activity of methanotrophs in high methane-emitting permafrost thaw ponds // PLoS One. 2017. V. 12. e0188223.
de Jong A.E.E., in’t Zandt M.H., Meisel O.H., Jetten M.S.M., Dean J.F., Rasigraf O., Welte C.U. Increases in temperature and nutrient availability positively affect methane-cycling microorganisms in Arctic thermokarst lake sediments // Environ. Microbiol. 2018. V. 20. P. 4314–4327.
Dridi B., Fardeau M.-L., Ollivier B., Raoult D., Drancourt M. Methanomassiliicoccus luminyensis gen. nov., sp. nov., a methanogenic archaeon isolated from human faeces // Int. J. Syst. Evol. Microbiol. 2012. V. 62. P. 1902–1907.
He R., Wooller M.J., Pohlman J.W., Quensen J., Tiedje J.M., Leigh M.B. Shifts in identity and activity of methanotrophs in arctic lake sediments in response to temperature changes // Appl. Environ. Microbiol. 2012. V. 78. P. 4715–4723.
Heslop J.K., Walter Anthony K.M., Sepulveda-Jauregui A., Martinez-Cruz K., Bondurant A., Grosse G., Jones M.C. Thermokarst lake methanogenesis along a complete talik profile // Biogeosci. 2015. V. 12. P. 4317–4331.
in ’t Zandt M.H., Frank J., Yilmaz P., Cremers G., Jetten M.S.M., Welte C.U. Long-term enriched methanogenic communities from thermokarst lake sediments show species-specific responses to warming // FEMS Microbes. 2020. xtaa008. https://doi.org/10.1093/femsmc/xtaa008
Kallistova A., Merkel A., Kanapatskiy T., Boltyanskaya Yu., Tarnovetskii I., Perevalova A., Kevbrin V., Samylina O., Pimenov N. Methanogenesis in the Lake Elton saline aquatic system // Extremophiles. 2020. V. 24. P. 657–672.
Martinez-Cruz K., Sepulveda-Jauregui A., Anthony K.W., Thalasso F. Geographic and seasonal variation of dissolved methane and aerobic methane oxidation in Alaskan lakes // Biogeosci. 2015. V. 12. P. 4595–4606.
Martinez-Cruz K., Leewis M.C., Herriott I.C., Sepulveda-Jauregui A., Anthony K.W., Thalasso F., Leigh M.B. Anaerobic oxidation of methane by aerobic methanotrophs in sub-Arctic lake sediments // Sci. Total Environ. 2017. V. 607–608. P. 23–31.
Matheus Carnevali P.B., Rohrssen M., Williams M.R., Michaud A.B., Adams H., Berisford D., Love G.D., Priscu J.C., Rassuchine O., Hand K.P., Murray A.E. Methane sources in arctic thermokarst lake sediments on the North Slope of Alaska // Geobiology. 2015. V. 13. P. 181–197.
Matheus Carnevali P.B., Herbold C.W., Hand K.P., Priscu J.C., Murray A.E. Distinct microbial assemblage structure and archaeal diversity in sediments of Arctic thermokarst lakes differing in methane sources // Front. Microbiol. 2018. V. 9. Art. 1192. https://doi.org/10.3389/fmicb.2018.01192
McAuliffe C.C. GC determination of solutes by multiple phase equilibration // Chem. Technol. 1971. V. 1. P. 46–51.
Negandhi K., Laurion I., Lovejoy C. Bacterial communities and greenhouse gas emissions of shallow ponds in the High Arctic // Polar Biol. 2014. V. 37. P. 1669–1683.
Oliva M., Fritz M. Permafrost degradation on a warmer Earth: Challenges and perspectives // Curr. Opin. Environ. Sci. Health. 2018. V. 5. P. 14–18.
Rissanen A.J., Saarenheimo J., Tiirola M., Peura S., Aalto S.L., Karvinen A., Nykänen H. Gammaproteobacterial methanotrophs dominate methanotrophy in aerobic and anaerobic layers of boreal lake waters // Aquat. Microb. Ecol. 2018. V. 81. P. 257–276.
Savvichev A., Rusanov I., Dvornikov Y., Kadnikov V., Kallistova A., Veslopolova E., Chetverova A., Leibman M., Sigalevich P., Pimenov N., Ravin N., Khomutov A. The water column of the Yamal tundra lakes as a microbial filter preventing methane emission // Biogeosci. Discuss. 2020. В печати. https://doi.org/10.5194/bg-2020-317
Saunois M., Bousquet P., Poulter B., Peregon A., Ciais P., Canadell J.G., Dlugokencky E.J., Etiope G., Bastviken D., Houweling S., Janssens-Maenhout G., Tubiello F.N., Castaldi S., Jackson R.B., Alexe M., Arora V.K., Beerling D.J., Bergamaschi P., Blake D.R., Brailsford G., Brovkin V., Bruhwiler L., Crevoisier C., Crill P., Covey K., Curry C., Frankenberg C., Gedney N., Höglund-Isaksson L., Ishizawa M., Ito A., Joos F., Kim H.-S., Kleinen T., Krummel P., Lamarque J.-F., Langenfelds R., Locatelli R., Machida T., Maksyutov S., McDonald K.C., Marshall J., Melton J.R., Morino I., Naik V., O’Doherty S., Parmentier F.-J.W., Patra P.K., Peng C., Peng S., Peters G.P., Pison I., Prigent C., Prinn R., Ramonet M., Riley W.J., Saito M., Santini M., Schroeder R., Simpson I.J., Spahni R., Steele P., Takizawa A., Thornton B.F., Tian H., Tohjima Y., Viovy N., Voulgarakis A., van Weele M., van der Werf G.R., Weiss R., Wiedinmyer C., Wilton D.J., Wiltshire A., Worthy D., Wunch D., Xu X., Yoshida Y., Zhang B., Zhang Z., Zhu Q. The global methane budget 2000–2012 // Earth. Syst. Sci. Data. 2016. V. 8. P. 697–751.
Serikova S., Pokrovsky O.S., Laudon H., Krickov I.V., Lim A.G., Manasypov R.M., Karlsson J. High carbon emissions from thermokarst lakes of Western Siberia // Nat. Commun. 2019. V. 10. 1552.https://doi.org/10.1038/s41467-019-09592-1
Townsend-Small A., Åkerström F., Arp C.D., Hinkel K.M. Spatial and temporal variation in methane concentrations, fluxes, and sources in lakes in Arctic Alaska // J. Geophys. Res: Biogeosci. 2017. V. 122. P. 2966–2981.
Vonk J.E., Tank S.E., Bowden W.B., Laurion I., Vincent W.F., Alekseychik P., Amyot M., Billet M.F., Canário J., Cory R.M., Deshpande B.N., Helbig M., Jammet M., Karlsson J., Larouche J., MacMillan G., Rautio M., Walter Anthony K.M., Wickland K.P. Reviews and syntheses: Effects of permafrost thaw on Arctic aquatic ecosystems // Biogeosci. 2015. V. 12. P. 7129–7167.
Walter K.M., Smith L.C., Chapin F.S. Methane bubbling from northern lakes: present and future contributions to the global methane budget // Philos. Trans. A Math. Phys. Eng. Sci. 2007. V. 365. P. 1657–1676.
Wik M., Varner R.K., Anthony K.W., MacIntyre S., Bastviken D. Climate-sensitive northern lakes and ponds are critical components of methane release // Nat. Geosci. 2016. V. 9. P. 99–105.
Yu Y., Lee C., Kim J., Hwang S. Group-specific primer and probe setsto detect methanogenic communities using quantitative real-time polymerasechain reaction // Biotechnol. Bioeng. 2005. V. 89. P. 670–679.
Zabelina S.A., Shirokova L.S., Klimov S.I., Chupakov A.V., Lim A.G., Polishchuk Y.M., Polishchuk V.Y., Bogdanov A.N., Muratov I.N., Guerin F., Karlsson J., Pokrovsky O.S. Carbon emission from thermokarst lakes in NE European tundra // Limnol. Oceanogr. 2020. https://doi.org/10.1002/lno.11560
Дополнительные материалы отсутствуют.


