Микробиология, 2021, T. 90, № 6, стр. 718-727
Штамм AZ-130 из нефтезагрязненной почвы Азербайджана: изоляция, антибактериальный скрининг и оптимизация условий культивирования
А. Г. Агаева a, b, *, С. Дж. Стритфилд a, И. М. Гусейнова b
a Фраунхофер США, Центр Средней Атлантики
DE 19711 Ньюарк, Соединенные Штаты Америки
b Институт молекулярной биологии и биотехнологий НАН Азербайджана
AZ1073 Баку, Азербайджан
* E-mail: aytanaghayeva@gmail.com
Поступила в редакцию 14.04.2021
После доработки 21.07.2021
Принята к публикации 30.07.2021
Аннотация
Целью представленной работы является изоляция бактерий из нефтезагрязненных почв Азербайджана, их антибактериальный скрининг и выбор оптимальных условий для максимальной продукции веществ, обладающих антибактериальной активностью, так как исследование необычных и ранее не анализированных источников представляет значительный интерес для выделения штаммов бактерий с новыми свойствами. В результате проведенных исследований из нефтезагрязненного образца почвы, собранного в поселке Лёкбатан, были выделены 44 бактериальных штамма, которые анализировались на наличие антибактериальной активности против одного грамотрицательного и двух грамположительных условно-патогенных штаммов методом подавления роста. После первичного скрининга установлено, что 3 штамма продуцировали соединения, обладающие антибактериальной активностью, по меньшей мере, против одного индикаторного организма. При скрининге супернатанта штамм AZ-130 показал сильную антиграмположительную активность и методом секвенирования гена 16S рРНК был идентифицирован как Bacillus vallismortis. Поиск в APD3 показал, что на данный момент нет известных антибиотиков, продуцируемых бактерий B. vallismortis. Для дальнейшей очистки и характеристики антимикробного соединения, продуцируемого данным штаммом, условия выращивания (среда, температура и время культивирования), при которых синтез антимикробного соединения достигает наивысших значений, были оптимизированы. Исследовано влияние компонентов четырех сред при четырех различных температурах на продукцию биоактивной молекулы AZ-130. Супернатанты, собранные от культур AZ-130, выращенных при соответствующих условиях, очищали и анализировали на антибактериальную активность против Staphylococcus aureus методом подавления роста и микроразведения в бульоне. Продукция молекулы AZ-130 достигает наивысшего уровня при культивировании штамма в среде TB + 2% глюкоза в течение 2 сут при температуре 32°C.
Антибиотики, являясь очень важными натуральными продуктами для здоровья человека, внесли значительный вклад в борьбу с инфекционными заболеваниями (Li, Vederas, 2009; Newman, Cragg, 2012). С 1928 года, когда А. Флемингом был открыт пенициллин, антибиотики стали основным средством борьбы с такими патогенными микроорганизмами, как Staphylococcus aureus, Enterococcus faecium, Acinetobacter baumannii, Klebsiella pneumoniae, Pseudomonas aeruginosa и другими (Fleming, 1929; Aminov, 2010). Однако в последние годы многие патогенные бактерии приобретают устойчивость к антибиотикам (метициллин-устойчивый S. aureus (MRSA), устойчивый к карбапенемам A. baumannii (CRAB), полирезистентный P. aeruginosa (MDR) и т.д.), что приводит к тому, что многие коммерчески доступные антибиотики постепенно теряют свою эффективность (Manchanda et al., 2010; Okwu et al., 2019). Стремительное увеличение числа устойчивых к антибиотикам патогенов (Otto, 2013; Prestinaci et al., 2015; Ventola, 2015; van Duin and Paterson, 2016; Johnning et al., 2018) и существующие трудности в процессе разработки новых антибиотиков (Kim 2013; Carrano et al., 2015) становится серьезной угрозой глобальному здоровью. Например, в последнее время увеличивается число грамотрицательных патогенных бактерий, несущих плазмиду с геном New Delhi metallo-beta-lactamase-1 (NDM-1), который способствует возникновению устойчивости почти ко всем имеющимся на рынке бета-лактамным антибиотикам и быстро распространяется между разными видами бактерий посредством горизонтального переноса генов (Fomda et al., 2014; Khan et al., 2017; Lerminiaux, Cameron, 2019). Антибиотикотерапия инфекций, вызванных бактериями с геном NDM-1, практически невозможна (Raghunath, 2010; Munita, Arias, 2016).
В то время как число устойчивых к антибиотикам штаммов быстро растет, очень мало новых антибиотиков-кандидатов проходит через фармацевтическую разработку (Dadgostar, 2019; Rončević et al., 2019). За последние 20 лет были лицензированы только два новых класса антибактериальных препаратов ‒ линезолид в 2000 г. и даптомицин в 2003 г. (Ali et al., 2018). Следовательно, возникает острая необходимость в поиске и разработке новых безопасных и эффективных антимикробных соединений против бактериальных инфекций. Для разработки новых антибиотиков очень важно идентифицировать новые, ранее некультивированные штаммы-продуценты, так как большинство применяемых в медицине антибиотиков были выделены непосредственно из живых организмов или представляют собой модифицированные соединения, основные структуры которых имеют природное происхождение (Jones et al., 2017; Ali et al., 2018). Одним из важнейших элементов идентификации новых бактериальных штаммов является образец, из которого изолируются бактерии. Известно, что продуцентами 70% коммерчески доступных антибиотиков являются почвенные бактерии, принадлежащие, в основном, к родам Streptomyces и Bacillus (Smith, 2000; Procópio et al., 2012; Baindara et al., 2013). Вероятной причиной невозможности идентифицировать новые антимикробные соединения может быть тот факт, что большая часть микроорганизмов, населяющих обычные исследуемые образцы почв, почти полностью изучены и идентифицированы. Считается, что новые биоактивные молекулы можно идентифицировать из необычных источников, которые никогда не анализировались. Различные виды бактерий адаптировались и выживали в необычных условиях в течение сотен миллионов лет, формируя специфическую для данных условий микробиоту. Естественно, что бактерии, населяющие такие почвы, также выработали специфические метаболиты и механизмы для защиты от микробов-конкурентов.
Открытие и разработка нового антимикробного соединения, начиная от идентификации цели до утверждения для продажи, ‒ это очень долгий и дорогостоящий процесс (Ekins et al., 2019). Одним из основных шагов в разработке антибиотиков является оптимизация условий культивирования штамма-продуцента для максимального увеличения выхода конечного метаболита. Компоненты среды и их уровни имеют решающее значение для производства вторичных метаболитов; даже небольшие изменения в питательной среде могут повлиять не только на количество целевого метаболита, но и на общий метаболический профиль штамма-продуцента. Поэтому перед началом любого крупномасштабного производства метаболитов необходимо оптимизировать условия роста штамма-продуцента (Wang et al., 2011; Arul Jose et al., 2013; Singh et al., 2017).
Учитывая критическую важность разработки новых антибиотиков, основной целью данной работы является изоляция бактерий из ранее не анализированных образцов, их антибактериальный скрининг и выбор оптимальных условий для максимальной продукции интересующего нас соединения. Для реализации поставленной цели, мы решили изолировать бактерии из нефтезагрязненных почв Азербайджана, которые никогда не были изучены на наличие антимикробной активности. Как известно, из 8660 тыс. га общей территории Азербайджана приблизительно 21 тыс. га приходится на долю нефтезагрязненных почв (Мамедов, Халилов, 2005; Асланов, Сафарли, 2008). Загрязнение почв нефтью отрицательно влияет на окружающую среду, поскольку разливы нефти сохраняются в почве в течение длительного времени (Marinescu et al., 2017), что приводит к изменениям в качестве почвы, растительности и микробном разнообразии (Margesin et al., 2003). Учитывая, что в литературе практически нет информации об антимикробных свойствах бактерий, выделенных из нефтезагрязненных почв Азербайджана, наши шансы на обнаружение нового штамма с ценными фармацевтическими и промышленными свойствами возрастают.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Изоляция бактерий. Объектом исследования служил нефтезагрязненный образец почвы (рис. 1а), собранный с глубины 5‒10 см в поселке Лёкбатан Гарадагского района города Баку (AZ1063, Азербайджан). Изоляция бактериальных штаммов была осуществлена методом стандартного серийного разведения во Фраунхоферском Центре Средней Атлантики (США) (Агаева, 2020). Для этого к 1 г образца добавляли 2 мл однократного натрий-фосфатного буфера и тщательно перемешивали на вортексе. Для осаждения почвенных частиц, полученную смесь инкубировали при комнатной температуре 2 ч. По истечении времени инкубации образец подвергался серийному разведению (от 10–1 до 10–3) в стерильном однократном натрий-фосфатном буфере. В качестве плотной питательной среды использовали триптический соевый агар (TSA). Для посева бактерий 100 мкл неразбавленного и серийно разбавленных образцов почвенной суспензии наносили на чашки Петри и равномерно распределяли по поверхности питательной среды, используя стерильный шпатель Дригальского. Чашки Петри инкубировали при 32°С в течение 1‒7 сут. Бактериальные колонии с разными морфологическими характеристиками, такими как форма колонии, рельеф и характер поверхности, цвет, хромогенез, размер и консистенция, формирующиеся в течение 1‒7 сут, переносили на свежую питательную среду, очищали и хранили в 15% глицерине при ‒80°С. На данной стадии все изолированные штаммы считались неизвестными бактериями и были подвергнуты антибактериальному скринингу.
Рис. 1.
Место сбора образца нефтезагрязненной почвы, пос. Лёкбатан Гарадагского района города Баку, Азербайджан (а). Результаты антибактериального скрининга (б): штамм AZ-130 показывает слабую активность в культуре (с) против S. aureus; активность в культуре против E. faecalis отсутствует. Супернатант (s) штамма AZ-130 показывает ~4 мм активность против S. aureus и ~7 мм активность против E. faecalis.

Антибактериальный скрининг культуры клеток. Первичный скрининг выделенных бактерий на наличие антибактериальной активности проводили методом подавления роста, как описано Хокет (Hockett, Baltrus, 2017) с некоторыми модификациями против трех условно-патогенных индикаторных штаммов: Staphylococcus aureus ATCC 29213, Enterococcus faecalis и Escherichia fergusonii. Штаммы Enterococcus faecalis (идентифицирован методом секвенирования гена 16S рРНК как Enterococcus faecalis NBRC 100480) и Escherichia fergusonii (идентифицирован методом секвенирования гена 16S рРНК как Escherichia fergusonii ATCC 35469) были получены во Фраунхоферском Центре Средней Атлантики, США. Для осуществления скрининга к 3 мл мягкого агара (0.8%) добавляли 10 мкл свежеприготовленной суспензии штамма-индикатора (при OD600 = 0.5), полученную смесь выливали на чашки Петри с TSA средой и оставляли на несколько минут при комнатной температуре для остывания. В результате получали TSA среду, засеянную штаммом-индикатором. Далее 10 мкл свежеприготовленной суспензии клеток изолированных культур добавляли на чашки Петри с TSA средой, содержащей штамм-индикатор (Balouiri et al., 2016; Hockett, Baltrus, 2017). Чашки инкубировали 20‒24 ч при 37°С. Активность определяли по наличию зоны ингибирования (прозрачного кольца) вокруг того места, где была добавлена суспензия. Диапазон антибактериальной активности, или зону подавления роста (ЗПР), выражали в миллиметрах. Для определения ЗПР измеряли толщину прозрачного кольца от края тестируемой колонии до края роста индикаторного штамма. При ЗПР меньше 1 мм активность оценивали как слабую, больше 1 мм ‒ сильную.
Антибактериальный скрининг супернатанта. Для того чтобы определить, секретируют ли активные в культуре бактерии антибактериальное соединение в культуральную жидкость, супернатанты были подвергнуты скринингу. Скрининг по-прежнему осуществляли методом подавления роста (Balouiri et al., 2016; Hockett, Baltrus, 2017). 50 мл жидкой питательной среды TSB (триптический соевый бульон) инокулировали одной колонией активного в культуре штамма и выращивали при 32°С и 180 об./мин в течение 24 ч. По истечении времени инкубации супернатант очищали от клеток сначала центрифугированием при 10 000 g в течение 15 мин при 4°C культуры, а затем фильтрованием через 0.22 мкм PES-мембрану (мембрану из полиэфирсульфона). Клетки и супернатант культуры исследуемого штамма наносили на чашки Петри с TSA средой, содержащей штамм-индикатор и инкубировали при 37°С в течение 20‒24 ч. Диапазон антибактериальной активности, выраженной в миллиметрах, определяли путем измерения диаметра прозрачной зоны (зоны подавления роста индикаторного организма).
Секвенирование гена 16S рРНК и поиск в APD3 на наличие известных антибиотиков. Идентификация штаммов, супернатанты которых показали наибольшую активность, была осуществлена путем секвенирования гена 16S рРНК, для чего штаммы были отправлены в лабораторию Charles Liver (223 Lake Drive, Newark, DE, 19702). После идентификации выбранных изолятов был осуществлен литературный поиск, чтобы узнать какие известные антимикробные молекулы продуцируют изолированные нами штаммы.
Оптимизация состава среды и условий культивирования для максимального производства антибактериального соединения. Для определения оптимального состава среды, температуры и времени наивысшей продукции антибактериального соединения были проанализированы четыре различных типа питательных сред (TSB, TSB с 2% глюкозой, TB, TB с 2% глюкозой) при четырех различных температурах (18, 25, 32, 37°C). Состав триптического соевого бульона (TSB): пептон казеиновый (панкреатический гидролизат) ‒ 17 г/л, пептон соевый (папаиновый гидролизат) – 3 г/л, гидроортофосфат калия (K2HPO4) ‒ 2.5 г/л, хлорид натрия ‒ 5 г/л, декстроза (глюкоза) ‒ 2.5 г/л; обезвоженной питательной среды бульона Terrific (TB): триптон (панкреатический гидролизат казеина) ‒ 12 г/л, дрожжевой экстракт ‒ 24 г/л, гидроортофосфат калия (K2HPO4) ‒ 9.4 г/л, дигидроортофосфат калия (KH2PO4) ‒ 2.2 г/л. Чтобы начальная плотность колоний во всех исследуемых условиях была одинаковой, 10 мл питательной среды были инокулированы одной колонией продуцента и инкубированы при 32°C и 250 об./мин в течение 2 ч (прекультура). Через 2 ч все четыре исследуемые среды (TB +/‒ глюкоза; TSB +/‒ глюкоза) инокулировали 1 мл прекультуры и культивировали при соответствующих температурах (18, 25, 32 и 37°C). Через 24, 48 ч и т.д. отбирали 1 мл образца из культуры для анализа. Супернатант очищали от клеточной культуры центрифугированием при 10 000 g в течение 15 мин при 4°C и фильтрованием через 0.22 мкм PES-мембрану. Вначале все собранные супернатанты были протестированы на ингибирующую активность против S. aureus ATCC 29213 методом подавления роста, как описано выше (Hockett, Baltrus, 2017). 10 мкл отобранных образцов супернатантов наносили на чашку с TSA средой, содержащую штамм-индикатор. Чашки Петри инкубировали при 37°C в течение ночи и измеряли диаметр зоны подавления роста. Затем, для определения условий, в которых концентрация антибактериальных единиц самая высокая, все супернатанты с активностью были проанализированы методом микроразведения в бульоне (Coyle et al., 2005), следуя рекомендациям Института клинических и лабораторных стандартов (CLSI). 100 мкл супернатанта добавляли в первую ячейку 96-ячеечного планшета и дважды разбавляли вдоль ряда. Затем в каждую ячейку добавляли 50 мкл S. aureus ATCC 29213 до конечной концентрации 5 × 104 клеток на ячейку. Для положительного контроля (100% рост индикатора) к 50 мкл среды добавляли 50 мкл индикаторного организма; отрицательным контролем (отсутствие индикатора) служила только питательная среда ‒ 100 мкл. Планшеты закрывали крышкой и инкубировали при 37°C в течение ночи в открытом пакете (для удержания влаги внутри). После инкубации измеряли оптическую плотность при 650 нм с использованием аппарата Molecular Devices Spectra MaxPlus, а затем в каждую ячейку планшета добавляли 10 мкл реагента для определения жизнеспособности клеток PrestoBlue (“Invitrogen”, A13262) и инкубировали планшеты при комнатной температуре в течение 30 мин. Измерение флуоресценции осуществляли при длине волны возбуждения 560 нм и эмиссии 590 нм с использованием флуоресцентного считывателя микропланшетов (Fluorescent microplate reader).
Высокоэффективная жидкостная хроматография (ВЭЖХ). Для того чтобы определить, что антибактериальная активность обусловлена одним действующим компонентом супернатанта, а не несколькими, супернатант, собранный и очищенный из культуры, выращенной в 50 мл ТВ среды при 32°С в течение ночи, был проанализирован методом обращенно-фазовой ВЭЖХ. В качестве контроля использовали среда ТВ. Для ВЭЖХ 100 мкл анализируемого материала загружали в колонку с обращенной фазой С18 Zorbax Eclipse XDB-C18 (4.6 × 150 мм, номер по каталогу 993967-902) с использованием Agilent 1100 HPLC. В качестве подвижных фаз использовали ВЭЖХ H2O/0.1% TFA (трифторуксусная кислота) (буфер Д) и ацетонитрил/0.1% TFA (буфер Б). Элюцию осуществляли в градиенте 5‒95% буфера Б. 24 фракции объемом 1 мл собирали в течении первых 24 мин. Анализ на наличие активности осуществляли методом подавления роста против S. au-reus ATCC 29213, для чего 10 мкл каждой фракции и загруженного материала наносили на чашку с TSA средой, засеянной штаммом-индикатором.
Сравнительный анализ активности супернатантов различных культур. Для осуществления сравнительного анализа супернатантов 50 мл ТВ среды инокулировали одной колонией продуцента. Колбы инкубировали в течение 22‒24 ч при 32°C и 220 об./мин. По истечении времени инкубации супернатанты были очищены от клеточной культуры путем центрифугирования при 10 000 g (30 мин при 4°C) и фильтрования через 0.22 мкм PES-мембрану. Анализ отобранных образцов против S. aureus ATCC 29213 и E. faecalis осуществляли методом подавления роста, а против самих продуцентов ‒ как методом подавления роста, так и микроразведения в бульоне, методика проведения которых описана выше.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
44 бактериальных штамма были выделены из нефтезагрязненного образца почвы, собранного в поселке Лёкбатан Гарадагского района города Баку, и проверены на антибактериальную активность против трех условно-патогенных индикаторных организмов методом подавления роста. После первичного скрининга из 44 выделенных культур только 3 обладали активностью (рис. 1б). Культура штамма AZ-130 показала слабую активность против грамположительного штамма S. aureus и грамотрицательного E. fergusonii, культура штамма AZ-134 показала слабую активность против E. faecalis, а культура штамма AZ-195 ‒ слабую антиграмположительную активность против S. aureus и E. faecalis. Все 3 активные в культуре изолята были проанализированы на наличие активности в бесклеточном культуральном супернатанте. Из трех протестированных штаммов только AZ-130 обладал сильной антиграмположительной активностью в супернатанте против S. aureus (ЗПР = 4 мм) и E. faecalis (ЗПР = 7 мм) (рис. 1б). Учитывая сильную активность в супернатанте, для дальнейшей характеристики был выбран штамм AZ-130. Описание колонии AZ-130: форма – круглая, профиль – выпуклый, контур края – ровный, поверхность – шероховатая, цвет ‒ бежевый, размер ‒ средний.
На следующем этапе для максимальной продукции антимикробного соединения штаммом AZ-130 были протестированы 16 различных условий культивирования. Собранные по истечении определенного времени супернатанты, очищенные из культур, выращенных в соответствующих условиях, были вначале проанализированы на наличие антибактериальной активности методом подавления роста (табл. 1). Как видно из табл. 1, супернатанты, собранные на 1, 2 и 3 сут из культур, выращенных при 18°C, не обладали никакой активностью. При трех других тестируемых температурах производство антимикробного соединения зависело как от компонентов среды, так и от времени и температуры инкубации. Продукция биоактивной молекулы штаммом AZ-130, выращенным в питательной среде TSB, возрастала по мере увеличения температуры и времени инкубации в течение первых двух суток (ЗПР на 1 сут: при 25°C ‒ отсутствует, при 32°C ‒ 8 мм, при 37°C ‒ 11 мм; ЗПР на 2 сут: при 25°C ‒ 6 мм/неполная, при 32°C ‒ 11 мм и при 37°C ‒ 12 мм) и уменьшалась на 3 или 5 сут (ЗПР при 25°C ‒ отсутствует, при 32°C ‒ 4 мм и при 37°C ‒ 10 мм).
Таблица 1.
Суммарная таблица активности собранных супернатантов (СН) штамма AZ-130 против S. aureus ATCC 29213, проанализированных методом подавления роста
| Температура | Среда | Зона подавления роста (ЗПР), мм | ||
|---|---|---|---|---|
| СН, 1 сут | СН, 2 сут | СН, 3 сут/5 сут | ||
| 18°C | TSB | – | – | – |
| TB | – | – | – | |
| TSB + 2% глюкоза | – | – | – | |
| TB + 2% глюкоза | – | – | – | |
| 25°C | TSB | – | 6/неполн. | – |
| TB | Сл. | 9 | Сл. | |
| TSB + 2% глюкоза | – | – | – | |
| TB + 2% глюкоза | – | – | – | |
| 32°C | TSB | 8 | 11 | 4 |
| TB | 12 | 11 | 7 | |
| TSB + 2% глюкоза | – | Сл. | – | |
| TB + 2% глюкоза | 4 | 8 | 7 | |
| 37°C | TSB | 11 | 12 | 10 |
| TB | 11 | 11 | 5 /неполн. | |
| TSB + 2% глюкоза | – | 11 | 7 | |
| TB + 2% глюкоза | 10 | 12 | 10 | |
Производство антибактериального соединения AZ-130 штаммом AZ-130, выращенным в среде TB, также колеблется в зависимости от температуры роста и времени инкубации. Слабая активность в супернатанте, наблюдаемая на 1 сут при 25°C, резко возрастала до высокой активности в 11‒12 мм при 32 и 37°C. Такая же тенденция к увеличению активности в супернатантах наблюдалась на 2 сут (ЗПР при 25°C ‒ 9 мм, при 32°C ‒ 11 мм, при 37°C ‒ 11 мм). Активность AZ-130 в супернатанте частично уменьшалась на 3 или 5 сут (ЗПР при 25°C ‒ слабая, при 32°C ‒ 7 мм, при 37°C ‒ 5 мм/неполная).
Штамм AZ-130, выращенный в питательной среде TSB + 2% глюкоза, не продуцировал достаточное количество соединения на 1 сут. Однако на 2 сут концентрация антибактериального соединения увеличивалась по мере повышения температуры (ЗПР при 25°C ‒ отсутствует, при 32°C ‒ слабая, при 37°C ‒ 11 мм) и снова уменьшалась на 3 или 5 сут (ЗПР при 25°C ‒ отсутствует, при 32°C ‒ отсутствует и при 37°C ‒ 7 мм).
Что касается среды TB + 2% глюкоза, то при культивировании на ней штамм AZ-130 продуцировал антимикробное соединение при 32 и 37°C. Активность AZ-130, культивированной в данной среде при 32°C, увеличивалась с 4 мм на 1 сут до 8 мм на 2 сут и незначительно снижалась до 7 мм на 5 сут. Аналогичная тенденция в активности AZ‑130 наблюдалась при температуре культивировании 37°C (ЗПР на 1 сут ‒ 10 мм, на 2 сут ‒ 12 мм и на 5 сут ‒ 10 мм).
Подводя итог результатов анализа методом подавления роста, можно сделать вывод, что штамм AZ-130 производит наибольшее количество антимикробного соединения при культивировании при 32 и 37°C. Мы не обнаружили какую-либо активность в супернатантах культур AZ-130, выращенных при 18°C. Некоторая активность наблюдалась в супернатантах из культур AZ-130, выращенных при 25°C, но эта активность не была настолько выраженной, как в супернатантах из культур, выращенных при 32 и 37°C.
На следующем этапе, чтобы сравнить концентрацию антибактериальных единиц в активных супернатантах из культур, выращенных при 32 и 37°C, они были проанализированы методом микроразбавления в бульоне (табл. 2).
Таблица 2.
Суммарная таблица активности собранных супернатантов штамма AZ-130 против S. aureus ATCC 29213, проанализированных методом микроразведения в бульоне
| Температура | Среда | Супернатант активен при разбавлении | ||
|---|---|---|---|---|
| СН, 1 сут | СН, 2 сут | СН, 5 сут | ||
| 32°C | TSB | 8 | 16 | 8 |
| TB | 16 | 8 | 8 | |
| TSB + 2% глюкоза | Неразб. | 8 | 4 | |
| TB + 2% глюкоза | 16 | 32 | 16 | |
| 37°C | TSB | 8 | 16 | 8 |
| TB | 8 | 16 | 8 | |
| TSB + 2% глюкоза | Неразб. | 8 | 8 | |
| TB + 2% глюкоза | 16 | 16 | 16 | |
Наибольшая продукция соединения AZ-130 штаммом AZ-130, выращенным при 32°C, в трех из четырех протестированных сред наблюдалась на 2 сут. Супернатант, собранный из TSB + 2% глюкоза активен после 8-кратного, из TSB ‒ после 16-кратного и из TB + 2% глюкоза ‒ после 32-кратного разведения. Супернатант, собранный из TB среды, показывает свою максимальную активность в 16-кратного разведения на 1 сут.
Как видно из результатов анализа супернатантов из тестируемых сред при 37°C, активность разведенного в 16 раз супернатанта, полученного из среды TB + 2% глюкоза, стабильна даже после 5 сут инкубации. Супернатанты AZ-130, собранные из сред TB и TSB при 37°C, показали максимальную 16-кратную активность на 2 сут; супернатанты, собранные из TSB + 2% глюкозы, показали максимальную 8-кратную активность на 2 и 5 сут.
Супернатанты, анализированные методом микроразведения в бульоне, также были проанализированы на жизнеспособность клеток штамма-индикатора путем добавления ко всем ячейкам 96‑ячеечного планшета реагента PrestoBlue. Визуальное подтверждение наличия живых клеток штамма-индикатора определяли по изменению цвета в ячейке. Синий цвет означал отсутствие живых клеток, то есть полное ингибирование, а розовый – наличие живых клеток условно-патогенного штамма. После добавления PrestoBlue, достоверность всех полученных выше результатов подтвердили результаты измерения флуоресценции в ячейках при возбуждении 560 нм и эмиссии 590 нм. Полученные результаты полностью подтвердили измерения оптической плотности.
Согласно полученным результатам, максимальная продукция биоактивного соединения AZ-130 наблюдалась при культивировании штамма-продуцента в питательной среде TB + 2% глюкоза при 32°C в течение 2 сут. Число ингибирующих единиц в супернатанте из этой среды было, как минимум, в два раза выше по сравнению со всеми другими исследуемыми условиями. Наблюдаемая активность высокая и стабильная, поскольку биомолекула AZ-130 не теряет активности даже после 5 сут инкубации.
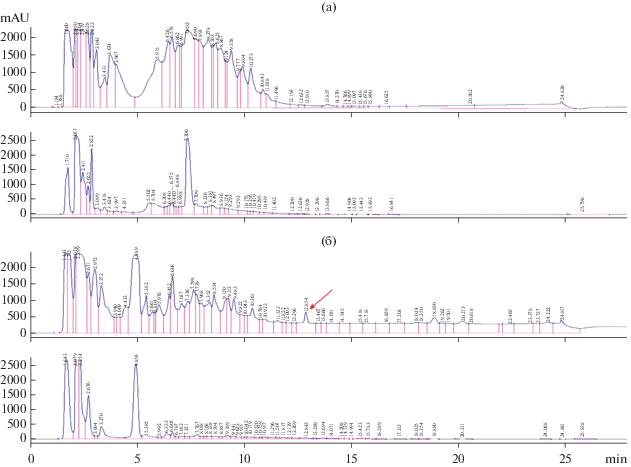
На следующем этапе, для того чтобы определить количество антибактериальных компонентов в супернатанте штамма AZ-130, супернатант и ТВ среда были проанализированы методом С18 ВЭЖХ (рис. 2).
В процессе ВЭЖХ, начиная с момента инъекции материала, фракции объемом 1 мл были собраны и проанализированы на наличие активности против S. aureus ATCC 29213. Пик в хроматограмме со временем удерживания 12.854 мин соответствует фракции 13, продолжение этого пика также наблюдается во фракции 14. Судя по хроматограмме, концентрация соединения во фракции 14 должна быть меньше, что и подтверждают результаты анализа собранных фракций методом подавления роста. Загруженный в колонку супернатант обладал активностью равной 14 мм, фракция 13 и 14 – слабая и очень слабая соответственно. Если сравнить хроматограммы (рис. 2) супернатанта AZ-130 и контроля, а также учитывая результаты антибактериального скрининга, пик со временем удерживания 12.854 мин соответствует активной биомолекуле, продуцируемой штаммом AZ-130. Отсутствие активности во всех остальных фракциях свидетельствует о том, что штамм AZ-130 продуцирует одно соединение с антибактериальной активностью (Rt 12.854 мин). Как видно из результатов, высокая активность, наблюдаемая в супернатанте, ослабевает в собранных фракциях, что непосредственно связано с объемами анализируемых материалов. Так, объем загруженного в колонку супернатанта был 100 мкл, а общий объем активных фракций 13 и 14 – 2 мл, что означает, что активность разбавляется приблизительно в 20 раз.
Штамм AZ-130, обладающий сильной и стабильной активностью в супернатанте, путем секвенирования гена 16S рРНК был идентифицирован как Bacillus vallismortis. Поиск в APD3 показал, что на данный момент нет известных антибиотиков, продуцируемых бактерией B. vallismortis. С другой стороны, B. vallismortis очень схожа с B. subtilis, которая является продуцентом ряда антибактериальных соединений (Sumi et al., 2015; Caulier et al., 2019). Для выявления сходств и различий в механизмах активности антибактериальных соединений штаммов AZ-130 и B. subtilis был осуществлен сравнительный анализ супернатантов этих культур. Штамм B. subtilis был получен во Фраунхоферском Центре Средней Атлантики, США и идентифицирован методом секвенирования гена 16S рРНК как Bacillus subtilis ssp. spizizenii str. NBRC 101239. Результаты анализа супернатантов из культур AZ-130 и B. subtilis методом подавления роста против штаммов S. aureus ATCC 29213 и E. faecalis (табл. 3), показывают, что штаммы AZ‑130 и B. subtilis обладают высокой антиграмположительной активностью в супернатанте. Однако, учитывая, что условия инокуляции и роста обеих штаммов являлись одинаковыми, активность супернатанта AZ-130 (против S. aureus ATCC 29213 – 7 мм, E. faecalis – 10 мм) значительно выше по сравнению с B. subtilis (S. aureus ATCC 29213 – слабая, E. faecalis – 7 мм).
Таблица 3.
Суммарная таблица активностей супернатантов, собранных из культур AZ-130 и B. subtilis
| Штамм | Супернатант B. vallismortis AZ-130 | Супернатант B. subtilis | ||
|---|---|---|---|---|
| ЗПР, мм | активное разведение | ЗПР, мм | активное разведение | |
| S. aureus ATCC 29213 | 7 | Н/а | Сл. | Н/а |
| E. faecalis | 10 | Н/а | 7 | Н/а |
| B. vallismortis AZ-130 | – | – | 9 | 8 |
| B. subtilis | – | – | – | – |
Собранные супернатанты были также проанализированы на ингибирующую активность против самих штаммов и друг против друга (табл. 3). Как выяснилось, супернатант B. subtilis показал активность в 9 мм против штамма AZ-130, в то время как супернатант AZ-130 не обладал активностью против штамма B. subtilis. Анализ супернатантов методом микроразведения в бульоне подтвердил результаты, полученные методом подавления роста: супернатант B. subtilis, даже при 8-кратном разбавлении, полностью ингибирует рост штамма AZ-130, однако в супернатанте AZ-130 не отмечено никакой активности против штамма B. subtilis. Учитывая, что продуценты обладают устойчивостью к антимикробным соединениям, которые они продуцируют, подавление роста штамма AZ-130 супернатантом B. subtilis указывает на возможные различия в структуре и механизмах действия антибактериальных веществ, секретируемых штаммами AZ-130 и B. subtilis.
Количество выделенных бактерий, отличающихся друг от друга морфологическими характеристиками, свидетельствует о целесообразности поиска новых штаммов с полезными свойствами в загрязненных нефтью почвах Азербайджана. Судя по нашим результатам, этот тип почвы может служить источником бактерий, продуцирующих антимикробные препараты. Штамм AZ-130, идентифицированный как Bacillus vallismortis, продуцирует антимикробное соединение AZ-130, которое обладает сильной антиграмположительной активностью. Механизм активности антимикробного соединения, продуцируемого штаммом AZ-130, отличается от антибактериальных соединений, секретируемых штаммом B. subtilis. Полученные результаты подтверждают важность оптимизации даже самых незначительных параметров при культивировании микроорганизмов. Компоненты питательной среды, температура и время инкубации играют важную роль в продукции биомолекулы AZ-130 бактериальным штаммом AZ-130.
Список литературы
Агаева А.Г. Создание бактериальной коллекции на основе штаммов, изолированных из почв Азербайджана и их скрининг на наличие новых антибактериальных биомолекул // Журн. Наук о Жизни и Биомедицины. 2019. Т. 1(74). № 2. С. 13‒19.
Асланов Г.К., Сафарли С.А. Нефтезагрязненные земли Азербайджана, их рекултивация и освоение. Баку: Наука, 2008. 191 с.
Мамедов Г.Ш., Халилов М.Ю. Экология и охрана окружающей среды. Баку: Наука, 2005. 880 с.
Ali S.M., Siddiqui R., Khan N.A. Antimicrobial discovery from natural and unusual sources // J. Pharm. Pharmacol. 2018. V. 70. P. 1287‒1300.
Aminov R.I. A brief history of the antibiotic era: lessons learned and challenges for the future // Front. Microbiol. 2010. V. 1. Art. 134.
Arul Jose P., Sivakala K.K., Jebakumar S.R. Formulation and statistical optimization of culture medium for improved production of antimicrobial compound by Streptomyces sp. JAJ06 // Int. J. Microbiol. 2013. Art. ID 526260.
Baindara P., Mandal S.M., Chawla N., Singh P.K., Pinnaka A.K., Korpole S. Characterization of two antimicrobial peptides produced by a halotolerant Bacillus subtilis strain SK.DU.4 isolated from a rhizosphere soil sample // AMB Express. 2013. V. 3. 2.
Balouiri M., Sadiki M., Ibnsouda S.K. Methods for in vitro evaluating antimicrobial activity: A review // J. Pharm. Anal. 2016. V. 6. P. 71‒79.
Carrano L., Marinelli F. The relevance of chemical dereplication in microbial natural product screening // J. Appl. Bioanal. 2015. V. 1. P. 55‒67.
Caulier S., Nannan C., Gillis A., Licciardi F., Bragard C., Mahillon J. Overview of the antimicrobial compounds produced by members of the Bacillus subtilis group // Front. Microbiol. 2019. V. 10. Art. 302.
Coyle M.B., Coord. Ed. Manual of Antimicrobial Susceptibility Testing. American Society for Microbiology, 2005.
Dadgostar P. Antimicrobial resistance: Implications and costs // Infect. Drug Resist. 2019. V. 12. P. 3903–3910.
Ekins S., Puhl A.C., Zorn K.M., Lane T.R., Russo D.P., Klein J.J., Hickey A.J., Clark A.M. Exploiting machine learning for end-to-end drug discovery and development // Nature Mater. 2019. V. 18. P. 435–441.
Fleming A. On the antibacterial action of cultures of Penicillium, with special reference to their use in the isolation of B. influenza // Br. J. Exp. Pathol. 1929. V. 10. P. 226–236.
Fomda B.A., Khan A., Zahoor D. NDM-1 (New Delhi metallo beta lactamase-1) producing Gram-negative bacilli: Emergence & clinical implications // Indian J. Med. Res. 2014. V. 140. P. 672‒678.
Hockett K.L., Baltrus D.A. Use of the soft-agar overlay technique to screen for bacterially produced inhibitory compounds // J. Vis. Exp. 2017. V. 119. Art. 55064.
Johnning A., Karami N., Hallbäck T.E., Müller V., Nyberg L., Buongermino P.M., Stewart C., Ambjörnsson T., Westerlund F., Adlerberth I., Kristiansson E. The resistomes of six carbapenem-resistant pathogens – a critical genotype–phenotype analysis // Microbial Genomics. 2018. V. 4. Art. e000233.
Jones M.B., Nierman W.C., Shan Y., Frank B.C., Spoering A., Ling L., Peoples A., Zullo A., Lewis K., Nelson K.E. Reducing the bottleneck in discovery of novel antibiotics // Microbial Ecol. 2017. V. 73. P. 658‒667.
Khan A.U., Maryam L., Zarrilli R. Structure, genetics and worldwide spread of New Delhi Metallo-β-lactamase (NDM): a threat to public health // BMC Microbiol. 2017. V. 17. 101. https://doi.org/10.1186/s12866-017-1012-8
Lerminiaux N.A., Cameron A.D.S. Horizontal transfer of antibiotic resistance genes in clinical environments // Can. J. Microbiol. 2019. V. 65. P. 34‒44.
Lewis K. Platforms for antibiotic discovery // Nature Reviews. Drug Discovery. 2013. V. 12. P. 371‒387.
Li J.W.H., Vederas J.C. Drug discovery and natural products: end of an era or an endless frontier? // Science. 2009. V. 325. P. 161–165.
Manchanda V., Sanchaita S., Singh N.P. Multidrug resistant Acinetobacter // J. Glob. Infect. Dis. 2010. V. 2. P. 291‒304.
Margesin R., Labbe D., Schinner F., Greer C., Whyte L. Characterization of hydrocarbon-degrading microbial populations in contaminated and pristine alpine soils // Appl. Environ. Microbiol. 2003. V. 69. P. 3085‒3092.
Marinescu M., Lacatusu A., Gament E., Plopeanu G., Carabulea V. Bioremediation potential of native hydrocarbons degrading bacteria in crude oil polluted soil // Bulletin USAMV. Ser. Agriculture. 2017. V. 74. https://doi.org/10.15835/buasvmcn-agr:12654
Munita J.M., Arias C.A. Mechanisms of antibiotic resistance // Microbiol. Spectr. 2016. V. 4. https://doi.org/10.1128/microbiolspec.VMBF-0016-2015
Newman D.J., Cragg G.M. Natural products as sources of new drugs over the 30 years from 1981 to 2010 // J. Nat. Prod. 2012. V. 75. P. 311–335.
Okwu M.U., Olley M., Akpoka A.O., Izevbuwa O.E. Methicillin-resistant Staphylococcus aureus (MRSA) and anti-MRSA activities of extracts of some medicinal plants: A brief review // AIMS Microbiol. 2019. V. 5. P. 117–137.
Otto M. Community-associated MRSA: what makes them special? // Int. J. Med. Microbiol. 2013. V. 303. P. 324‒330.
Prestinaci F., Pezzotti P., Pantosti A. Antimicrobial resistance: a global multifaceted phenomenon // Pathog. Glob. Health. 2015. V. 109. P. 309–318.
Procópio R.E., Silva I.R., Martins M.K., Azevedo J.L., Araújo J.M. Antibiotics produced by Streptomyces // Braz. J. Infect. Dis. 2012. V. 16. P. 466‒471.
Raghunath D. New metallo β-lactamase NDM-1 // Indian J. Med. Res. 2010. V. 132. P. 478–481.
Rončević T., Puizina J., Tossi A. Antimicrobial peptides as anti-infective agents in pre-post-antibiotic era // Int. J. Mol. Sci. 2019. V. 20. Art. 5713.
Singh V., Haque S., Niwas R., Srivastava A., Pasupuleti M., Tripathi C.K. Strategies for fermentation medium optimization: An in-depth review // Front. Microbiol. 2017. V. 7. Art. 2087.
Smith T. Antibiotics from soil bacteria // Nat. Struct. Biol. 2000. V. 7. P. 189‒190.
van Duin D., Paterson D.L. Multidrug resistant bacteria in the community: Trends and lessons learned // Infect. Dis. Clin. North. Am. 2016. V. 30. P. 377–390.
Sumi C.D., Yang B.W., Yeo I.C., Hahm Y.T. Antimicrobial peptides of the genus Bacillus: a new era for antibiotics // Can. J. Microbiol. 2015. V. 61. P. 93‒103.
Ventola C.L. The antibiotic resistance crisis. Part 1: Causes and threats // Pharmacy and Therapeutics. 2015. V. 40. P. 277–283.
Wang Y., Fang X., An F., Wang G., Zhang X. Improvement of antibiotic activity of Xenorhabdus bovienii by medium optimization using response surface methodology // Microb. Cell Fact. 2011. V. 14. Art. 98. https://doi.org/10.1186/1475-2859-10-98
Дополнительные материалы отсутствуют.