Микробиология, 2021, T. 90, № 6, стр. 706-717
Микроорганизмы дерново-подзолистой почвы, деградирующие нефть и полициклические ароматические углеводороды
Н. А. Манучарова a, *, М. А. Большакова a, Т. Л. Бабич b, Т. П. Турова b, Е. М. Семенова b, А. С. Янович a, А. Б. Полтараус c, А. Л. Степанов a, Т. Н. Назина b
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
b Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
c Институт молекулярной биологии им. В.А. Энгельгардта РАН
119991 Москва, Россия
* E-mail: manucharova@mail.ru
Поступила в редакцию 08.07.2021
После доработки 21.07.2021
Принята к публикации 25.07.2021
Аннотация
В настоящей работе определено филогенетическое и функциональное разнообразие микроорганизмов образцов дерново-подзолистой почвы, загрязненной и незагрязненной углеводородами, и урбостратозема. Методом высокопроизводительного секвенирования V3–V4 региона гена 16S рРНК показано, что в исследованных образцах почв преобладали бактерии филумов Proteobacteria, Actinobacteria и Acidobacteria. Наибольшей потенциальной функциональной активностью в преобразовании соединений азота, деградации хлоралканов, хлоралкенов и бензоата обладали бактерии родов Sphingomonas, Bradyrhizobium и Pseudolabrys в образцах дерново-подзолистой почвы и бактерии родов Brevundimonas, Stenotrophomonas и Streptomyces – в образцах урбостратозема. Из нефтезагрязненных почв были выделены штаммы Stenotrophomonas maltophilia, деградирующие нефть, нефтепродукты и полициклические ароматические углеводороды (ПАУ) (фенантрен, антрацен и пирен). Микроорганизмы дерново-подзолистой почвы в условиях микрокосма эффективно деградировали разные компоненты нафтено-метановой и метано-нафтеновой нефти. Количество ароматических компонентов нафтено-метановой нефти, деградированных микробным сообществом почвы, и сообществом, обогащенным штаммом S. maltophilia П420в, было практически одинаковым, однако в варианте с биоаугментацией процесс деградации этих компонентов протекал на 14 сут быстрее. Обогащение почвы целевыми деструкторами ПАУ и ароматических соединений может быть целесообразным для почв северных регионов с низкой продолжительностью летнего периода, загрязненных нефтью с высоким содержанием ароматических и асфальто-смолистых соединений.
Поступление органического углерода нефти в почвы приводит к увеличению содержания алканов, битуминозных веществ, ароматических соединений и полициклических ароматических углеводородов (ПАУ) и сопровождается тяжелыми экологическими последствиями (Atlas, 1981). Изменяются физико-механические, агрохимические и продукционные свойства почвы, гибнут растения, почвы становятся непригодными для хозяйственного использования. Некоторые нефти обладают бластомогенным и канцерогенным действием. Обычно наиболеезагрязненными оказываются верхние слои почвенного профиля, что приводит к снижению водо- и воздухопроницаемости почвы.
Дерново-подзолистые и подзолистые почвы составляют основной фон почвенного покрова России и занимают 15 и 26% площади соответственно. Нефть и нефтепродукты являются основными загрязняющими веществами для почв этого типа. Биоразлагаемость компонентов нефти обычно снижается в ряду: н-алканы > алканы с разветвленной цепью > разветвленные алкены > > низкомолекулярные ароматические соединения с н-алкильной цепью > моноароматические соединения > циклические алканы > полициклические ароматические углеводороды (ПАУ) > асфальтены (van Hamme et al., 2003). Для биоремедиации загрязненных нефтепродуктами почв широко используются биотехнологии биостимуляции и биоаугментации (Tyagi et al., 2011). Биостимуляция включает внесение источников азота, фосфора, калия, акцепторов электронов и воды для стимуляции активности автохтонного микробного сообщества, тогда как биоаугментация предполагает внесение экзогенных микроорганизмов для увеличения активности целевой группы. Часто оба метода используются одновременно. Показано, что деградация нефти происходит под воздействием почвенных микробных сообществ вследствие “самоочищающей способности” почв (Sutton et al., 2013). Наименее подвержены биодеструкции асфальто-смолистые компоненты нефти (Wang et al., 2016), которые могут накапливаться в поверхностных горизонтах почвы и ухудшать ее свойства. В этой связи необходим поиск микроорганизмов, эффективно деградирующих нефть и полициклические ароматические углеводороды (ПАУ). Для более полной очистки экосистем от нефтяных загрязнений необходимо использовать микроорганизмы, способные осуществлять биодеградацию разных компонентов нефти. В обзоре (Tyagi et al., 2011) рассмотрены преимущества и ограничения метода биоаугментации на примере ряда лабораторных и полевых испытаний.
В лабораторном эксперименте консорциум бактерий родов Pseudomonas, Stenotrophomonas, Achromobacter, Brevibacillus и Staphylococcus, полученных из высокозагрязненных почв, деградировал до 60% нефтяного загрязнения почвы (Samarghandi et al., 2018). В полевом эксперименте по очистке загрязненных нефтью почв (Poi et al., 2017) был успешно использован консорциум из 22 видов, принадлежащих, главным образом, к родам Bacillus, Pseudomonas и Acinetobacter. Внесение биопрепарата, включающего 4 штамма бактерий родов Rhodococcus и Pseudomonas и дрожжи Candida sp., в почву, загрязненную 60 м3 нефти, приводило к 78.8% снижению содержания нефти (Сидоров и соавт., 1997). Использование в технологии биоаугментации бактериальных и грибных культур, приспособленных к условиям почвы и нефтяного загрязнения, имеет несомненные преимущества перед внесением микроорганизмов из других местообитаний (Eriksson et al., 1999).
Целью настоящей работы было определение филогенетического и функционального разнообразия микроорганизмов образцов дерново-подзолистой почвы, загрязненной и не загрязненной углеводородами, выделение чистых культур, деградирующих полициклические ароматические углеводороды и нефтепродукты, и оценка влияния бактерий рода Stenotrophomonas на биодеградацию нефти микрокосмами почв.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования. Объектами микробиологических исследований были образцы гумусового горизонта (А) дерново-подзолистой постагрогенной оподзоленной глинисто-иллювиированной почвы (по классификации Шишова и соавт., 2004) или, соответственно, Umbric Luvisol (Классификация IUSS Working group…, 2014), отобранные с участка, расположенного в пределах городской черты и части пригородных территорий г. Электроугли (Московская обл.). Образцы почв S1 и S2 отбирали по мере удаления от “Электроуглинского завода технического углерода, ЗАО” на расстоянии 0.3 км (завод) (55.728016, 38.217825) и 12 км (фон) (55.724371, 38.387340) соответственно. Территория исследования находилась в течение длительного времени под техногенным воздействием, вызванным функционированием завода по производству технического углерода из графита, сажи и каменноугольной смолы. Загрязняющие вещества поступали из этого источника через атмосферу на большую часть территории. В пределах промышленной зоны и вблизи нее присутствует также большое количество твердого материала, представленного различными отходами производства, в том числе углеводородсодержащими веществами (Геннадиев и соавт., 2015). Для сравнения исследовали образцы урбостратозема песчаного (S3), отобранного в г. Москве (Манучарова и соавт., 2017), дерново-среднеподзолистой почвы (S4), отобранной на почвенном стационаре в Чашниково (Солнечногорский район, Московской обл.), а также загрязненные нефтью (S5, S6, S420 и S417) образцы почв, отобранные на территории залежи 302 Ромашкинского нефтяного месторождения (г. Лениногорск, Татарстан).
Состав сред и условия культивирования. Для выделения микроорганизмов, деградирующих ПАУ и нефтепродукты, готовили почвенную суспензию в стерильной воде (1 : 10), которую использовали для засева сред с разными органическими субстратами. Специальных методов десорбции микроорганизмов с почвенных частиц не применяли. Минеральная среда включала (г/л): К2НРО4 – 1.5; КН2РО4 – 0.75; (NH4)2SO4 – 0.05; MgSO4 · 7H2O – 0.01; Ca(NO3)2 · 4H2O – 0.0005; FeSO4 · 7Н20 – 0.0055. Субстраты вносили в среду в следующих концентрациях: предельные углеводороды (тетрадекан (С14H30), гексадекан (С16H34)), нефть, нефтяные масла – 2 об. %, сахара, пептон – 2–5 г/л, спирты – 5 мл/л. Полициклические ароматические углеводороды (пирен, фенантрен, аценафтен, флуорен), а также бифенил растворяли в ацетоне и вносили в жидкую среду в концентрации 50 мг/л, в течение суток среду оставляли при комнатной температуре для испарения ацетона и затем засевали почвенной суспензией или полученными чистыми культурами бактерий. Посевы инкубировали в стационарных условиях при температуре 20–23°C в течение 14 сут. Чистые культуры аэробных бактерий, использующих ПАУ, были выделены из накопительных культур методом последовательных пересевов с жидких сред на соответствующие плотные среды, содержащие 15 г агар-агара/л. Процедуру выделения из единичных колоний повторяли трижды. Чистоту культур контролировали микроскопическим методом и посредством анализа гена 16S рРНК колоний, полученных на плотной среде. Физиологические свойства штаммов, содержание Г + Ц в ДНК и ДНК–ДНК сходство определяли, как описано ранее (Nazina et al., 2001).
Биодеградация нефти и ПАУ почвенными микрокосмами. Навески почвы (S4) в воздушно-сухом состоянии массой по 20 г помещали в чашки Петри. Нефть растворяли в гексане в пропорции 1 : 25 (вес/вес, %), после чего раскапывали в каждую чашку из расчета 200 мг нефти на 20 г почвы, охватывая всю поверхность почвы. Источники NPK не вносили. Смесь пирена и фенантрена в соотношении 1 : 2 (вес/вес, %) также растворяли в гексане и вносили из расчета 5 мг пирена и 10 мг фенантрена на 1 чашку. Чашки Петри с почвой и внесенными углеводородами выдерживали 2 сут в термостате при 30°С для испарения гексана. Затем почвенный микрокосм инициировали увлажнением до 60% от предельной полевой влагоемкости (Воронин, 1986). В течение опыта влажность почвы поддерживали постоянной, для чего контролировали вес каждой чашки и доливали стерильную водопроводную воду по необходимости. Чашки Петри с почвой инкубировали при температуре 30°С. В работе использовали нафтено-метановую нефть, отобранную на Ромашкинском месторождении (пласт Д0), и метано-нафтеновую нефть Хыльчуюского месторождения (пласт Р2). Характеристика нефти приведена в таблице S1 (Геология и разработка…, 1996).
Биоаугментация почвы углеводородокисляющими бактериями. Штамм Stenotrophomonas maltophilia П420в, выделенный из загрязненной нефтью почвы Ромашкинского месторождения, наращивали на плотной среде с пептоном, затем делали смыв клеток и вносили в почву из расчета 1 × 107 кл./г почвы.
Аналитические методы. Прирост биомассы чистых культур при росте на жидких средах оценивали по величине оптической плотности (OD590). Для определения концентрации ПАУ в почве и в жидкой среде, ПАУ экстрагировали хлороформом, пробу высушивали, растворяли в 5 мл гексана и оценивали спектрофотометрически изменение концентрации. Изменение ароматической фракции в составе нефти также определяли спектрофотометрически при длине волны 254 нм (Dark, 1982). Состав предельных углеводородов нефти определяли на хроматографе “Кристалл 5000.1” (ЗАО СКБ “Хроматэк”, Россия) с пламенно-ионизационным детектором и 15-м капиллярной колонкой Zebron ZB-FFAP. Газом-носителем служил гелий. Температура колонки в ходе анализа возрастала от 100 до 320°С со скоростью нагрева 5°С/мин. Количественную расшифровку хроматограмм производили по методу внутренней нормализации, рассчитывая содержание каждого алкана в относительных весовых процентах. Индекс Кi, который является показателем биодеградации нефти, рассчитывали по формуле:
Он отражает отношение суммы наиболее показательных изопренанов – пристана и фитана, к сумме нормальных насыщенных н-алканов – гептадекана и октадекана. По мере биодеградации нефти индекс Кi увеличивается. Остаточное содержание нефти в почве определяли весовым методом после экстракции углеводородов из навески почвы горячим гексадеканом в аппарате Сокслета (Современные методы…, 1984). Все варианты опыта проводили в трех повторностях для каждого времени инкубации.
Методы идентификации чистых культур и определения состава микробного сообщества почв. Чистые культуры бактерий были идентифицированы методом анализа гена 16S рРНК с праймерами 8–27f/1492r (Lane, 1991). Филогенетический анализ последовательностей гена 16S рРНК выделенных штаммов проводили с использованием программы BLAST сервера NCBI (www.ncbi.nlm.nih.gov/blast/). Филогенетическое разнообразие прокариот (бактерий и архей) в исследованных пробах почв определяли методом высокопроизводительного секвенирования ампликонов V3–V4 участка гена 16S рРНК и последующей биоинформатической обработки полученных данных.
Выделение ДНК, амплификация и секвенирование генов 16S рРНК прокариот. ДНК выделяли из образцов почв S1, S2 и S3 с использованием набора для выделения Power Soil DNA Isolation Kit (“MO BIO”, США) в соответствии с инструкцией производителя. Полученные препараты ДНК были использованы для амплификации V3–V4 участка гена 16S рРНК прокариот методом полимеразной цепной реакции (ПЦР). Амплификацию фрагментов гена 16S рРНК осуществляли с помощью вырожденных праймеров, комплементарных последовательностям, как бактерий, так и архей: PRK341F (CCTACGGGRBGCASCAG) и PRK806R (GGACTACYVGGGTATCTAAT). Полученные ПЦР-фрагменты очищали на колонках QIAquick согласно протоколу производителя. Каждый ПЦР-фрагмент растворяли в 50 мкл ТЕ-буфера, полученного материала было достаточно для дальнейшего анализа. Нуклеотидные последовательности вариабельных фрагментов генов 16S рРНК из образцов метагеномной ДНК определяли с помощью высокопроизводительного секвенирования на полигеномном секвенаторе MiSeq (“Illumina”, США).
Биоинформатический анализ. Полученные фрагменты гена 16S рРНК были обрезаны с использованием программ trimmomatic-0.36 по алгоритму SLIDINGWINDOW:4:15 (Bolger et al., 2014). Прямые и обратные прочтения объединяли программой SeqPrep (https://github.com/jstjohn/ S-eqPrep). Для обнаружения химер и демультиплексирования использовали фильтры QIIME (Caporaso et al., 2010). Полученные последовательности распределяли по операционным таксономическим единицам (ОТЕ) с уровнем сходства более 97%. Полученные ОТЕ идентифицировали с использованием баз данных QIIME, онлайн-ресурса SILVA (Quast et al., 2014; https://www.arb-silva.de/ ngs/) и Knomics Biota. Статистические подсчеты осуществляли с помощью Microsoft Excel. Онлайн-ресурс ClustVis (Metsalu, Vilo, 2015; https:// biit.cs.ut.ee/clustvis/) был использован для создания тепловых карт (heatmaps) членов сообщества на родовом уровне. OTE, идентифицированные с использованием онлайн-ресурса SILVA, использовали для предсказания функциональных характеристик бактериальных сообществ с использованием пакета программ iVikodak (Nagpal et al., 2019). Модуль Global Mapper этой программы на основании базы данных KEGG использовали для получения функциональных профилей, а Local Mapper – для прогнозирования индивидуальных профилей ферментов метаболизма азота, бензоата и полициклических ароматических углеводородов, представленных у бактерий исследуемых микробных сообществ. Тепловые карты функциональных профилей и ферментов, предсказанных для сообществ, были построены с использованием интернет-ресурса ClustVis (http://biit.cs.ut.ee/ clustvis/, июнь 2021 г.).
Библиотеки фрагментов гена 16S рРНК прокариотных сообществ образцов почвы депонированы в NCBI, BioProject PRJNA744753.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
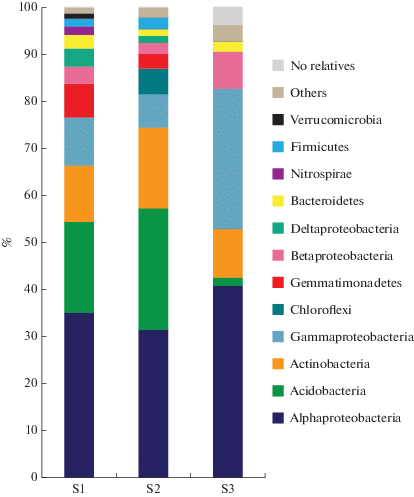
Разнообразие и потенциальная функциональная активность микробных сообществ образцов почв. В библиотеках гена 16S рРНК прокариот из образцов дерново-подзолистой почвы, отобранной в районе расположения завода технического углерода (библиотека S1) и на расстоянии 12 км от него (библиотека S2), были выявлены последовательности представителей домена Bacteria; археи не были обнаружены. Оба сообщества имели большое сходство на уровне высших таксонов (рис. 1). В составе почвенных сообществ преобладали бактерии филумов Proteobacteria (53.1 и 42.0% от количества последовательностей в библиотеках S1 и S2 соответственно), Acidobacteria (19.0 и 25.8%), Actinobacteria (12.2 и 17.2%), Gemmatimonadetes (6.8 и 3.2%), Bacteroidetes (3.1 и 1.8%) и Firmi-cutes (1.5 и 2.1%). Последовательности бактерий филумов Nitrospirae (2.1%) и Verrucomicrobia (1.2%) были выявлены только в библиотеке S1, а Chloroflexi (5.8%) – в библиотеке S2. В образце урбостратозема S3 доля Proteobacteria была также высока и достигала 79.1%; второй по представленности группой были Actinobacteria (10.1%). В библиотеке S3 были выявлены последовательности архей (0.2%) филума Nanoarchaeota, принадлежащие некультивируемым Candidatus Woesearchaeota.
Рис. 1.
Относительная доля последовательностей фрагментов гена 16S рРНК Bacteria, представленных на уровне филумов/классов в библиотеках из образцов незагрязненной и загрязненной углеводородами почвы. Перечислены таксоны, составляющие >1% в каждой библиотеке.
На родовом уровне в образцах S1 и S2 преобладали альфапротеобактерии рода Sphingomonas (34.7 и 43.7%) и некультивируемые Acidobacteria (13.3 и 13.9%) (рис. 2). Представители рода Sphingomonas распространены в различных местообитаниях, таких как почва, пресноводные и морские водоемы, воздух, песок пустыни, осадочные породы, растения и загрязненные тяжелыми металлами рудничные воды. Бактерии рода Sphingomonas обладают множественными функциями, включающими деградацию широкого ряда загрязнений окружающей среды (нефтепродуктов, ПАУ, хлорсодержащих углеводородов, тяжелых металлов, металлоорганических соединений и других) и образование полезных фитогормонов, таких как сфинган и геллановая камедь (Asaf et al., 2020). Отмечаются большие перспективы в использовании представителей рода Sphingomonas в экологических биотехнологиях.
Рис. 2.
Тепловая карта (heatmap) распределения 25 доминантных родов в библиотеках фрагментов гена 16S рРНК бактериальных сообществ из образцов почв. Двойная иерархическая дендрограмма показывает распределение бактерий в этих библиотеках. Переход цвета от синего до красного обозначает относительные величины содержания отдельных родов (от менее представленного к более представленному роду в библиотеке). Цифры на диаграмме обозначают % от общего количества последовательностей в библиотеке из каждой пробы.

В образце урбостратозема S3 преобладали протеобактерии родов Brevundimonas (39.1%) и Stenotrophomonas (25.0%) и актинобактерии рода Streptomyces (6.9%), известные способностью деградировать сложные органические компоненты гумусового комплекса, нефтепродукты, хлорсодержащие ароматические соединения и ПАУ (Mukherjee, Roy, 2016; Hocinat et al., 2020; Ray et al., 2021).
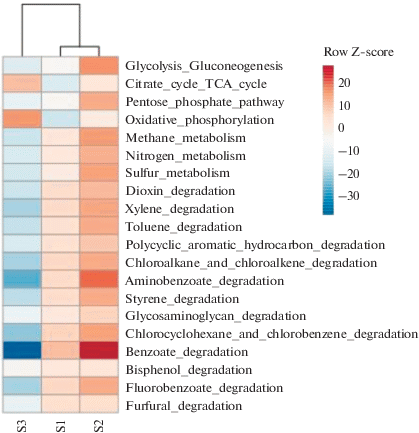
Результаты определения филогенетического разнообразия прокариот в образцах почв были проанализированы с помощью программного обеспечения iVikodak для оценки потенциальной функциональной активности микробных сообществ почв (Nagpal et al., 2019). С помощью модуля “Global Mapper” программы iVicodak было предсказано, что бактерии, входящие в сообщества, осуществляли основные пути метаболизма углеводов и энергетического метаболизма (рис. 3). Сообщество незагрязненной нефтью дерново-подзолистой почвы S2 обладало большей, по сравнению с сообществом загрязненной почвы S1, потенциальной способностью к осуществлению этих путей, а также путей метаболизма азота и серы, деградации ксенобиотиков, бензоата и связанных с ним путей деградации полициклических ароматических углеводородов, аминобензоата, катехола и хлорсодержащих органических соединений.
Рис. 3.
Тепловая карта, показывающая сравнение функциональных профилей бактериальных сообществ образцов почв (в относительных процентах) в программе iVikodak.
Бензоат является центраболитом деградации многих ароматических углеводородов. В сообществах S1 и S2 присутствовали бактерии, обладающие двумя ключевыми ферментами пути аэробной деградации бензоата (“Benzoate degradation I”), бензоат-1,2-диоксигеназой (EC: 1.14.12.10) и дигидрооксициклогексадиен дегидрогеназой (EC: 1.3.1.25), которые катаболизируют бензоат до катехола (рис. S1 а, S1б, доп. материалы). У бактериальных сообществ предсказано наличие всех ферментов катаболизма катехола, как до сукцинил-КоА, так и до пирувата/ацетил-КоА. Кроме того, у бактерий обеих сообществ присутствовал фермент бензоат-КoA-лигаза (EC: 6.2.1.25), катализирующий превращение бензоата до бензоил-КоА – интермедиата биодеградации многих ароматических соединений. Однако ферменты пути анаэробной деградации бензоата через бензоил-КоА отсутствовали у исследуемых сообществ. В сообществах S1 и S2 за деградацию бензоата отвечали Alphaproteobacteria родов Sphingomonas, Bradyrhizobium и Pseudolabrys (рис. S2 а, S2б, доп. материалы). Присутствующие в этих образцах почв бактерии осуществляли лишь единичные реакции превращений ПАУ (рис. S3 а, S3б и S4а, S4б, доп. материалы).
У бактерий, входящих в S1 и S2 сообщества, было предсказано наличие ферментов комплекса “Метаболизм азота” участвующих в диссимиляционном восстановлении нитратов до молекулярного азота (собственно денитрификация) и нитратредукции с образованием аммония, а также в ассимиляционном восстановлении нитрата до аммония (рис. S5 а, S5б, доп. материалы). Потенциальная представленность фермента нитратредуктазы (EC: 1.7.5.1), катализирущего восстановление нитрата до нитрита в процессах денитрификации и диссимиляционной нитратредукции, была сравнительно высокой, как и представленность остальных ферментов этих путей, катализирующих восстановление нитрита до молекулярного азота и аммония соответственно. В меньшей степени у микроорганизмов этих сообществ был представлен фермент ферредоксин-нитратредуктаза (EC: 1.7.7.2), катализирующий восстановление нитрата до нитрита в процессе ассимиляционной нитратредукции, и фермент ферредоксин-нитритредуктаза (EC: 1.7.7.1), завершающий этот процесс восстановлением нитрита до аммония. Все ферменты пути метаболизма азота были наиболее представлены у микроорганизмов S2 сообщества незагрязненной дерново-подзолистой почвы. Наибольший вклад в преобразование азота в сообществах S1 и S2 вносили Alphaproteobacteria родов Sphingomonas, Bradyrhizobium и Pseudolabrys, среди которых известны виды, способные к денитрификации (рис. S6 а, S6б, доп. материалы).
В соответствии с представленностью в библиотеке рибосомных генов микроорганизмов урбостратозема (S3), бактерии родов Brevundimonas, Stenotrophomonas и Streptomyces характеризовались наибольшей потенциальной активностью в преобразовании соединений азота, деградации хлоралканов, хлоралкенов и бензоата (рис. S7–S10 , доп. материалы). Однако помимо этих родов потенциально активными в деградации полициклических ароматических углеводородов были также бактерии рода Pusillimonas (рис. S11, S12 ), представленность которых в S3 библиотеке генов 16S рРНК не превышала 3%. Неоднократно отмечалось участие бактерий родов Brevundimonas, Stenotrophomonas, Streptomyces и Pusillimonas в деградации загрязненных нефтью почв, нефтяных шламов, хлорсодержащих соединений и ПАУ (Arulazhagan et al., 2017; Egorova et al., 2021; Al-Mur et al., 2021; Lara-Moreno et al., 2021).
Использование нефтепродуктов и ароматических углеводородов микроорганизмами почвы. Исследована способность микробных сообществ образцов почв использовать сырую нефть, нефтяные масла, насыщенные прямоцепочечные углеводороды (С12–С16), ароматические соединения (нафталин, бифенил) и ПАУ (фенантрен, флуорен и пирен). Рост микроорганизмов был обнаружен в посевах всех исследованных почвенных образцов на жидкие среды с нефтью. Наиболее богатый рост наблюдали в средах с насыщенными углеводородами и нефтяными маслами, особенно с минеральным маслом (табл. S2 ). На средах с использованием фенантрена и пирена наблюдался наилучший рост микроорганизмов: изменялся цвет среды и образовывалась биопленка на поверхности жидкости. Поскольку существовала вероятность роста микроорганизмов за счет веществ, присутствующих в почве, полученные накопительные культуры трижды последовательно пересевали на среды с соответствующими субстратами. Микроорганизмы, присутствующие в исследованных образцах почв, были способны расти на ароматических субстратах и ПАУ в 4-х последовательных пересевах (табл. S3 ). Накопительные культуры, полученные из нефтезагрязненной почвы на территории Ромашкинского нефтяного месторождения, демонстрировали лучший рост за счет ПАУ.
Выделение чистых культур углеводородокисляющих бактерий. Накопительные культуры, полученные в средах с бифенилом и ПАУ (фенантреном и пиреном), были использованы для выделения чистых культур. Методом последовательных пересевов с плотных сред на жидкие среды было выделено 25 чистых культур. Полученные штаммы поддерживали на средах с бифенилом, фенантреном и пиреном, соответственно тому, на каком субстрате они были выделены. Наиболее полно потребляли бифенил – штаммы Б420б и Б417а (рис. S13 а), фенантрен – штамм Ф420б (рис. S13 б), пирен – штаммы П420в и П417г (рис. S13 в). Ряд штаммов, наиболее эффективно деградирующих углеводороды, был идентифицирован методом анализа последовательности гена 16S рРНК. Гены штаммов Б420г, ФП1в и П420в имели, соответственно, 100, 97 и 96% сходства с геном Stenotrophomonas maltophilia, а ген штамма Б417а был идентичен гену Micrococcus oxydans (100% сходства). Содержание Г + Ц в ДНК штаммов Stenotrophomonas spp. Б420г, ФП1в и П420в составляло 66.2, 62.1 и 66.6 мол. % соответственно, и было близко величине Г + Ц в ДНК типового штамма вида S. maltophilia (66.6 мол. %). Величина ДНК–ДНК гибридизации штамма Б420г со штаммами П420в и ФП1в составляла 99 и 21%, что позволяет отнести штаммы Б420г и П420в к виду Stenotrophomonas maltophilia, а штамм Б420г, вероятно, принадлежит к новому виду этого рода. Штаммы S. maltophilia ФП1в и П420в использовали насыщенные прямоцепочечные н-алканы (С12–С16), ароматические углеводороды (нафталин, фенантрен, бифенил, флуорен, пирен), различные нефтяные масла (моторное, турбинное, трансформаторное, компрессорное и минеральное) и нефть. Фенотипические признаки штамма S. maltophilia П420в соответствовали таковым бактерий рода Stenotrophomonas. Штамм П420в рос в интервале рН от 5.5 до 7.8 с оптимумом рН 6.5–7.0, в интервале температуры от 10 до 35°С с оптимумом около 20°С (табл. S4 ). Поскольку бактерии рода Stenotrophomonas входят в состав микробных сообществ загрязненных нефтью почв (например, образца S3), и выделенные штаммы Stenotrophomonas maltophilia используют широкий спектр прямоцепочечных н-алканов и ПАУ, штамм S. maltophilia П420в был выбран для дальнейшей работы с микрокосмами почв. Мы полагали, что культура, растущая на пирене, состоящем из слитых четырех бензольных колец, будет использовать и менее сложные ПАУ. Представители этого рода известны своей способностью к росту на широком ряде субстратов, в том числе ароматической природы (Mukherjee, Roy, 2016).
Биодеградация ПАУ и нефти микрокосмами дерново-подзолистой почвы. В модельных экспериментах в условиях искусственного загрязнения почвы S4 смесью ПАУ или нефтью исследована способность почвы к самоочищению и влияние внесения углеводородокисляющей бактерии S. maltophilia П420в (биоаугментации) на биодеградацию этих субстратов. Автохтонная микрофлора дерново-подзолистой почвы использовала внесенную в почву смесь ПАУ (рис. S14 ). Однако в течение первых 14-сут эксперимента рост микроорганизмов был подавлен, и наблюдалась лаг-фаза в деструкции ПАУ. Затем почвенное сообщество, вероятно, адаптировалось к токсичным веществам, и в течение третьей недели был использован весь фенантрен и часть пирена. Обогащение почвенного сообщества штаммом-деструктором ПАУ, S. maltophilia П420в, приводило к небольшому увеличению скорости разложения поллютантов, но к концу эксперимента (42 сут) в обоих вариантах пирен и фенантрен были использованы полностью, причем фенантрен был использован быстрее, чем пирен. Внесение штамма-деструктора ПАУ лишь сокращало время разложения загрязнителей микробным сообществом почвы.
В лабораторном эксперименте в условиях микрокосма почву искусственно загрязняли метано-нафтеновой и нафтено-метановой нефтью и исследовали способность почвенной микробиоты к самоочищению и влияние интродуцированного штамма S. maltophilia П420в на деградацию нефти. Была оценена биодеградация разных компонентов нефти (насыщенных углеводородов, изоалканов и ароматических соединений).
Для оценки абиотических потерь за счет испарения компонентов нефти были поставлены контроли со стерильной почвой. Метано-нафтеновая нефть содержала больше легких насыщенных углеводородов, чем нафтено-метановая нефть (табл. S1 ). За 42 сут инкубации потери за счет испарения легких компонентов нафтено-метановой и метано-нафтеновой нефти составили 20 и 77% соответственно. Помимо испарения абиотические потери нефти были обусловлены также сорбционными процессами, при которых высокомолекулярные компоненты нефти необратимо сорбировались почвой и не извлекались далее растворителями.
Всего с учетом абиотических факторов и биогенных процессов за 42 сут эксперимента в варианте с почвенным сообществом было деградировано 42%, а в варианте с биоаугментацией штаммом П420в деградировано 43% от общего количества внесенной нафтено-метановой нефти (рис. 4а). В начале эксперимента, когда использовались преимущественно алифатические углеводороды, было деградировано больше нефти, чем в последующий период, когда использовались ароматические компоненты нефти.
Рис. 4.
Деградация нафтено-метановой (а) и метано-нафтеновой (б) нефти микрокосмами дерново-подзолистой почвы (1), а также при биоаугментации почвы штаммом S. maltophilia П420в (2) с учетом абиотического снижения нефти в контрольной почве.
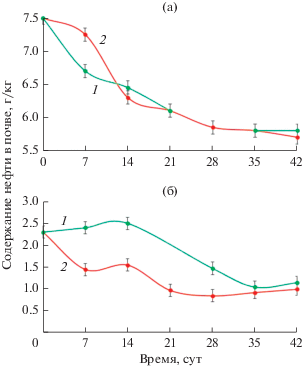
Скорость разложения метано-нафтеновой нефти была выше в присутствии штамма П420в (рис. 4б). Через 14 сут инкубации в варианте с автохтонным микробным сообществом биодеградация еще не началась, а в варианте с интродукцией – было деградировано около 10% нефти. Через 35 сут количество деградированной нефти в почве в обоих вариантах практически сравнялось и составило 15%. Таким образом, внесение культуры ускорило на 14 сут процесс разрушения метано-нафтеновой нефти, но не повлияло на величину ее остаточного содержания в почве. В результате абиотических процессов было удалено больше легкой метано-нафтеновой нефти (77%), чем в ходе биогенных процессов (15%).
Изменение компонентного состава нефти микрокосмами почв. Под воздействием почвенного микробного сообщества происходило изменение группового состава нефти и содержания индивидуальных углеводородных соединений. Изменился состав алифатической части обеих нефтей: содержание н-алканов существенно уменьшилось; содержание изоалканов – изменилось в меньшей степени за счет потребления соединений с небольшим числом атомов углерода. Анализ алифатической составляющей нафтено-метановой нефти (рис. S15 ) показал, что в варианте со штаммом S. maltophilia П420в и в варианте без интродукции содержание н-алканов уменьшалось практически одинаково в течение 21 сут эксперимента и впоследствии не изменялось; за это время микроорганизмы использовали доступные им предельные углеводороды. Коэффициент Кi, отражающий соотношение между изо- и н-алканами, в нафтено-метановой нефти изменился с 0.78 (в исходной нефти) до 1.20 и 1.33 к концу эксперимента в вариантах без интродукции и с интродукцией штамма соответственно. На 21 сут биодеградация насыщенных УВ практически прекратилось, и в период 35–42 сут эксперимента большее значение приобрело разрушение ароматических компонентов нефти, когда их содержание снизилось на 53% (рис. S16 а). Всего за 42 сут эксперимента микроорганизмы почвы деградировали 72.9% ароматических УВ. Почвенное сообщество, обогащенное штаммом S. maltophilia П420в, деградировало 74.9% ароматических компонентов нафтено-метановой нефти.
Динамика потребления предельных углеводородов метано-нафтеновой нефти была иной (данные не представлены). Микробное сообщество почвы потребляло значительную часть н-алканов, оставшихся в нефти после испарения, и интродукция штамма П420в в почву практически не отразилась на скорости биодеградации этих соединений. Соотношение между изо- и н-алканами в метано-нафтеновой нефти (коэффициент Кi) изменилось с 0.63 (в исходной нефти) до 0.79 и 0.80 к концу эксперимента (варианты без интродукции и с интродукцией соответственно). В метано-нафтеновой нефти микроорганизмы потребляли в основном н-алканы.
Внесение штамма S. maltophilia П420в ускоряло потребление ароматической фракции в обоих исследованных типах нефти (рис. S16 а, S16б). Интродукция штамма-деструктора ПАУ в почву, загрязненную нафтено-метановой нефтью, не сказалось на остаточном содержании ароматической фракции в деградированной нефти, но ускорила процесс ее разрушения по сравнению с ее деградацией почвенным сообществом. В случае с метано-нафтеновой нефтью в присутствии интродуцированного штамма было деградировано 62.1% ароматических углеводородов, что на 10.6% больше по сравнению с количеством ароматических углеводородов, деградированных автохтонным сообществом почвы (50.6%).
Две фазы процесса биоремедиации почв от нефти, когда большая часть деградации происходила на первом этапе (50% снижение за 35–45 дней), а во вторую фазу деградировало около 10% нефти, отмечали и другие исследователи (Kaplan, Kitts, 2004; Liu et al., 2011; Sutton et al., 2013; Samarghandi et al., 2018). На ранней стадии биоремедиации разрушались преимущественно нормальные алканы и низкомолекулярные ароматические соединения (Venosa et al., 1997).
Нами показана большая роль испарения при очистке почв, особенно от легкой метано-нафтеновой нефти; 77% этой нефти было удалено из почвы вследствие абиотических процессов. Для нафтено-метановой нефти, содержащей меньшее количество легких парафинов, роль этого абиотического фактора при ее удалении из почвы была существенно меньше.
Проведенные исследования позволяют оценить метаболический потенциал почвенного микробного сообщества в деградации углеводородов, потребление разных компонентов нефти в динамике, количественно оценить вклад абиотических и биогенных процессов в деградацию нефти. Однако в лабораторных экспериментах не учитывается ряд природных факторов, влияющих на преобразование нефти, таких как реальная температура и ее флуктуация в течение суточного цикла, влажность и структура почвы, наличие растительности и другие.
Полученные результаты свидетельствуют о том, что самоочищающая способность дерново-подзолистой почвы от нефтяных загрязнений высока; скорость биодеградации ряда ароматических компонентов нефти может быть повышена в присутствии таких бактерий как Stenotrophomonas maltophilia – деструкторов специфических углеводородов. В литературе неоднократно упоминается использование Stenotrophomonas maltophilia в составе микробных консорциумов для биоаугментации почв загрязненных нефтью (Xu et al., 2018). Способность выделенных штаммов бактерий разлагать алканы и ПАУ может иметь практическое значение при биоремедиации сред загрязненных нефтью с высоким содержанием ПАУ. В северных районах России, где теплый период года непродолжителен, процессы биодеградации не успевают развернуться в полной мере. В этом случае целесообразно обогащение почвенного микробного сообщества консорциумами бактерий, деградирующих целевые классы нефтяных углеводородов. Перед использованием бактериальных препаратов для биоремедиации почв необходимо предварительные исследования воздействия биопрепарата на определенный тип нефтяного загрязнения для конкретных почвенно-климатических условий.
Список литературы
Воронин А.Д. Физика почв. М.: МГУ, 1986. С. 158–159.
Геннадиев А.Н., Пиковский Ю.И., Жидкин А.П., Ковач Р.Г., Кошовский Т.С., Смирнова М.А., Хлынина Н.И., Цибарт А.С. Факторы и модификации углеводородного состояния почв // Почвоведение. 2015. № 11. С. 1314–1329.
Gennadiev A.N., Pikovskii Y.I., Zhidkin A.P., Kovach R.G., Koshovskii T.S., Smirnova M.A., Khlynina N.I., Tsibart A.S. Factors and features of the hydrocarbon status of soils // Euras. Soil Sci. 2015. V. 48. P. 1193–1206. https://doi.org/10.1134/S1064229315110071
Геология и разработка крупнейших и уникальных нефтяных и нефтегазовых месторождений России / Под ред. Гавуры В.Е., М.: ВНИИОЭНГ, 1996. Т. 1. С. 50.
Манучарова Н.А., Кутейникова Ю.В., Иванов П.В., Николаева С.К., Трофимов В.Т., Степанов П.Ю., Тяпкина Е.В., Липатов Д.Н., Степанов А.Л. Молекулярный анализ гидролитической прокариотной компоненты почв, загрязненных нефтепродуктами и восстановленных внесением хитина // Микробиология. 2017. Т. 86. С. 373–382. https://doi.org/10.7868/S0026365617030119
Manucharova N.A., Kuteinikova Yu.V., Ivanov P.V., Nikolaeva S.K., Trofimov V.T., Stepanov P.Yu., Tyapkina E.V., Lipatov D.N., Stepanov A.L. Molecular analysis of the hydrolytic component of petroleum contaminated soils and of soils remediated with chitin // Microbiology (Moscow). 2017. V. 86. P. 395–402. https://doi.org/10.1134/S0026261717030092
Сидоров Д.Г., Борзенков И.А., Ибатуллин Р.Р., Милехина Е.И., Храмов И.Т., Беляев С.С., Иванов М.В. Полевой эксперимент по очистке почвы от нефтяного загрязнения с использованием углеводородокисляющих микроорганизмов // Прикл. биохимия и микробиология. 1997. Т. 33. С. 497–502.
Современные методы исследования нефтей / Отв. ред. Богомолов А.И. Л.: Heдpa, 1984. 431 с.
Шишов Л.Л., Тонконогов В.Д., Лебедева И.И. Классификация и диагностика почв России. Смоленск: О-йкумена, 2004. 342 с.
Al-Mur B.A., Pugazhendi A., Jamal M.T. Application of integrated extremophilic (halo-alkalo-thermophilic) bacterial consortium in the degradation of petroleum hydrocarbons and treatment of petroleum refinery wastewater under extreme condition // J. Hazard Mater. 2021. V. 413. Art. 125351. https://doi.org/10.1016/j.jhazmat.2021.125351
Arulazhagan P., Al-Shekri K., Huda Q., Godon J.J., Basahi J.M., Jeyakumar D. Biodegradation of polycyclic aromatic hydrocarbons by an acidophilic Stenotrophomonas maltophilia strain AJH1 isolated from a mineral mining site in Saudi Arabia // Extremophiles. 2017. V. 21. P. 163–174. https://doi.org/10.1007/s00792-016-0892-0
Asaf S., Numan M., Khan A.L., Al-Harrasi A. Sphingomonas: from diversity and genomics to functional role in environmental remediation and plant growth // Crit. Rev. Biotechnol. 2020. V. 40. P. 138–152. https://doi.org/10.1080/07388551.2019.1709793
Atlas R.M. Microbial degradation of petroleum hydrocarbons: An environmental perspective // Microbiol. Rev. 1981. V. 45. P. 180–209.
Bolger A.M., Lohse M., Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data // Bioinformatics. 2014. V. 30. P. 2114–2120.
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N., Pena A.G., Goodrich J.K., Gordon J.I., Huttley G.A., Kelley S.T., Knights D., Koenig J.E., Ley R.E., Lozupone C.A., McDonald D., Muegge B.D., Pirrung M., Reeder J., Sevinsky J.R., Turnbaugh P.J., Walters W.A., Widmann J., Yatsunenko T., Zaneveld J., Knight R. QIIME allows analysis of high-throughput community sequencing data // Nat. Methods. 2010. V. 7. P. 335–336.
Dark W.A. Crude oil hydrocarbon group separation quantitation // J. Liquid Chromatogr. 1982. V. 5. P. 1645–1652.
Egorova D., Kir’yanova T., Pyankova A., Anan’ina L., Plotnikova E. Selective pressure of biphenyl/polychlorinated biphenyls on the formation of aerobic bacterial associations and their biodegradative potential // Folia Microbiol. (Praha). 2021. Epub ahead of print. PMID: 33966251.https://doi.org/10.1007/s12223-021-00873
Eriksson M., Dalhammar G., Borg-Karlson A.-K. Aerobic degradation of a hydrocarbon mixture in natural uncontaminated potting soil by indigenous microorganisms at 20°C and 6°C // Appl. Microbiol. Biotechnol. 1999. V. 51. P. 532–535.
Hocinat A., Boudemagh A., Ali-Khodja H., Medjemadj M. Aerobic degradation of BTEX compounds by Streptomyces species isolated from activated sludge and agricultural soils // Arch Microbiol. 2020. V. 202. P. 2481–2492. https://doi.org/10.1007/s00203-020-01970-4
IUSS Working group WRB. World reference base for soil resources 2014: International soil classification system for naming soils and creating legends for soil maps. World Soil Resources Report No. 106. FAO, Rome, 2014. 181 p.
Kaplan C.W., Kitts C.L. Bacterial succession in a petroleum land treatment unit // Appl. Environ. Microbiol. 2004. V. 70. P. 1777–1786.
Lane D.J. 16S/23S rRNA sequencing // Nucleic Acid Techniques in Bacterial Systematics / Ed. Stackebrandt E., Goodfellow. M. New York: John Wiley& Sons, 1991. P. 115–175.
Lara-Moreno A., Morillo E., Merchán F., Villaverde J. A comprehensive feasibility study of effectiveness and environmental impact of PAH bioremediation using an indigenous microbial degrader consortium and a novel strain Stenotrophomonas maltophilia CPHE1 isolated from an industrial polluted soil // J. Environ. Manage. 2021. V. 289. Art. 112512. https://doi.org/10.1016/j.jenvman.2021.112512
Liu P.-W.G., Chang T.C., Whang L.-M., Kao C.-H., Pan P.-T., Cheng S.-S. Bioremediation of petroleum hydrocarbon contaminated soil: effects of strategies and microbial community shift // Int. Biodeterior. Biodegr. 2011. V. 65. P. 1119–1127.
Metsalu T., Vilo J. ClustVis: A web tool for visualizing clustering of multivariate data using Principal Component Analysis and heatmap // Nucl. Acids Res. 2015. V. 43. Art. W566–W570.
Mukherjee P., Roy P. Genomic potential of Stenotrophomonas maltophilia in bioremediation with an assessment of its multifaceted role in our environment // Front. Microbiol. 2016. V. 7. Art. 967. https://doi.org/10.3389/fmicb.2016.00967
Nagpal S., Haque M.M., Singh R., Mande S.S. iVikodak ‒ A Platform and standard workflow for inferring, analyzing, comparing, and visualizing the functional potential of microbial communities // Front. Microbiol. 2019. V. 9. Art. 3336. https://doi.org/10.3389/fmicb.2018.03336
Nazina T.N., Tourova T.P., Poltaraus A.B., Novikova E.V., Grigoryan A.A., Ivanova A.E., Lysenko A.M., Petrunyaka V.V., Osipov G.A., Belyaev S.S., Ivanov M.V. Taxonomic study of aerobic thermophilic bacilli: descriptions of Geobacillus subterraneus gen. nov., sp. nov. and Geobacillus uzenensis sp. nov. from petroleum reservoirs and transfer of Bacillus stearothermophilus, Bacillus thermocatenulatus, Bacillus thermoleovorans, Bacillus kaustophilus, Bacillus thermoglucosidasius and Bacillus thermodenitrificans to Geobacillus as the new combinations G. stearothermophilus, G. thermocatenulatus, G. thermoleovorans, G. kaustophilus, G. thermoglucosidasius and G. thermodenitrificans // Int. J. Syst. Evol. Microbiol. 2001. V. 51. P. 433‒446.
Poi G., Aburto-Medina A., Mok P.C., Ball A.S., Shahsavari E. Large scale bioaugmentation of soil contaminated with petroleum hydrocarbons using a mixed microbial consortium // Ecol. Engin. 2017. V. 102. P. 64–71.
Quast C., Pruesse E., Yilmaz P., Gerken J., Schweer T., Yarza P., Peplies J., Glöckner F.O. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools // Nucl. Acids Res. 2013. V. 41 (Database issue). Art. D590–D596. https://doi.org/10.1093/nar/gks1219
Ray M., Kumar V., Banerjee C., Gupta P., Singh S., Singh A. Investigation of biosurfactants produced by three indigenous bacterial strains, their growth kinetics and their anthracene and fluorene tolerance // Ecotoxicol. Environ. Saf. 2021. V. 208. Art 111621. https://doi.org/10.1016/j.ecoenv.2020.111621
Samarghandi M.R., Arabestani M.R., Zafari D., Rahmani A.R., Afkhami A., Godini K. Bioremediation of actual soil samples with high levels of crude oil using a bacterial consortium isolated from two polluted sites: investigation of the survival of the bacteria // Global NEST J. 2018. V. 20. P. 432–438.
Sutton N.B., Maphosa F., Morillo J.A., Al-Soud W.A., Langenhoff A.A.M., Grotenhuis T., Rijnaarts H.H.M., Smidt H. Impact of long-term diesel contamination on soil microbial community structure // Appl. Environ. Microbiol. 2013. V. 79. P. 619–630.
Tyagi M., da Fonseca M., de Carvalho C. Bioaugmentation and biostimulation strategies to improve the effectiveness of bioremediation processes // Biodegradation. 2011. V. 22. P. 231–241. https://doi.org/10.1007/s10532-010-9394-4
Van Hamme J.D., Singh A., Ward O.P. Recent advances in petroleum microbiology // Microbiol. Mol. Biol. Rev. 2003. V. 67. P. 503–549. https://doi.org/10.1128/MMBR.67.4.503-549.2003
Venosa A., Suidan M., King D., Wrenn B. Use of hopane as a conservative biomarker for monitoring the bioremediation effectiveness of crude oil contaminating a sandy beach // J. Ind. Microbiol. Biotechnol. 1997. V. 18. P. 131–139.
Wang L., Li F., Zhan Y., Zhu L. Shifts in microbial community structure during in situ surfactant-enhanced bioremediation of polycyclic aromatic hydrocarbon-contaminated contaminated soils // Environ. Sci. Pollut. Res. 2016. V. 23. P. 14451–14461. https://doi.org/10.1007/s11356-016-6630-4
Xu X., Liu W., Tian S., Wang W., Qi Q., Jiang P., Gao X., Li F., Li H., Yu H. Petroleum hydrocarbon-degrading bacteria for the remediation of oil pollution under aerobic conditions: A perspective analysis // Front. Microbiol. 2018. V. 9. Art. 2885. https://doi.org/10.3389/fmicb.2018.02885
Дополнительные материалы
- скачать ESM.docx
- Таблица S1. - Таблица S4.
Рис. S1. - Рис. S16.


