Микробиология, 2021, T. 90, № 6, стр. 728-737
Влияние скачкообразного увеличения нагрузки по аммонию на активность сообщества анаммокс-бактерий в биореакторе последовательно-периодического действия
А. Г. Дорофеев b, *, Ю. А. Николаев a, В. А. Грачёв a, А. Ю. Каллистова a, Ю. Ю. Берестовская a, Н. В. Пименов a
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Институт биоинженерии, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: dorofeevag@mail.ru
Поступила в редакцию 15.07.2021
После доработки 26.07.2021
Принята к публикации 27.07.2021
Аннотация
Исследован переходный процесс, вызванный скачкообразным увеличением нагрузки по аммонию (в 2.5 раза) на микробное сообщество, развивающееся в биореакторе последовательно-периодического действия и осуществляющее процесс очистки воды от азота путем “нитритация‒анаммокс”. Сообщество, сформированное в биореакторе с загрузкой при входной концентрации аммония 200 мг N/л, удаляло 76.5% поступающего азота и удовлетворительно описывалось математическим симулятором BioWin с использованием скорректированных коэффициентов. Скачкообразное увеличение нагрузки по азоту увеличением концентрации аммония в поступающей среде с 200 до 500 мг N/л привело к росту концентрация аммония на выходе из биореактора с 27 до 280‒290 мг N/л и падению эффективности удаления азота до 40%. Выполненный на симуляторе BioWin расчет показал, что в течение месяца эффективность процесса “нитритация‒анаммокс” должна повыситься и стабилизироваться на уровне, близком к исходному (76.5%). Однако экспериментальные данные не подтвердили расчетные: в течение этого срока заметного повышения эффективности процесса не наблюдалось. Вероятной причиной расхождения экспериментальных и расчетных данных могут быть изменения структурно-функциональных характеристик биопленок или агрегатов, не учитывающиеся при моделировании.
Анаммокс-бактерии, относящиеся к планктомицетам порядка Ca. “Brocadiales”, осуществляют анаэробное окисление аммония нитритом до молекулярного азота и используются для очистки сточных вод от аммония. Биотехнологии на основе процесса анаммокс считаются наиболее перспективными для удаления азота (Agraval et al., 2018; Кевбрина и соавт., 2019), сочетая два самостоятельных процесса: частичную нитрификацию (нитритацию), которая включает окисление около половины аммония до нитрита, и окисление аммония нитритом до молекулярного азота в бескислородных условиях (собственно процесс анаммокс). В настоящее время функционируют более сотни полномасштабных установок, причем около половины из них работают в реакторах последовательно-периодического действия (SBR, sequencing-batch reactor) (Ni et al., 2020), циклически осуществляющих вывод части отработанной среды и добавление свежей среды. По сравнению с непрерывно-проточными системами использование реакторов SBR-типа имеет существенные преимущества: в них накапливается значительное количество целевой биомассы, они более компактны, легче адаптируются к новым технологическим режимам. Масштабирование технологий очистки вод, разработанных в таких реакторах, осуществляется более надежно (Artan, Orhon, 2005; Tchobanoglous et al., 2014).
Доминирование процессов нитритации и анаммокс в одном биореакторе и оптимальное их сочетание требует достаточно жесткого регулирования физико-химических условий, учитывающего влияние совокупности факторов, среди которых существенную роль играет нагрузка микробного сообщества по аммонию (Каллистова и соавт., 2016; Cho et al., 2020). В реальных условиях нагрузка может варьировать в широких пределах в связи с нестабильностью объема подающейся в биореактор среды и концентрации в ней аммония.
Один из эффективных приемов исследования, расчета и оптимизации биотехнологий очистки сточных вод – использование математического моделирования (Baeten et al., 2019; Seco et al., 2020). Как правило, при моделировании биореакторов исследуют стационарные состояния, однако в естественных и технологических экосистемах не менее важны переходные процессы, вызванные варьированием условий и характерные для реальных ситуаций. В настоящее время распространение получили несколько симуляторов, среди которых BioWin – один из наиболее широко используемых, объединяющий химические, физические и биологические модели процессов, включая процесс анаммокс (Дорофеев и соавт., 2017; Shao et al., 2021). Вместе с тем, существенным барьером, усложняющим применение математического моделирования, служит особенность существования анаммокс-бактерий ‒ их склонность к агрегации и прикрепленному росту в виде биопленок (Wang et al., 2020; Каллистова и соавт., 2020). Агрегация и обрастание играют важную роль в биотехнологических процессах, способствуя удержанию биомассы в биореакторах, но затрудняют экспериментальное нахождение “истинных” физиологических кинетическо-стехиометрических характеристик (Lotti et al., 2014) и усложняют использование математического аппарата необходимостью дополнительного моделирования процессов массообмена меду жидкой фазой и биопленкой.
Ранее с использованием программного продукта BioWin нами было проведено математическое моделирование удаления аммонийного азота с использованием процесса нитритации‒анаммокс и получены стационарные решения показателей работы биореактора при различных значениях концентрации растворенного кислорода и температуры (Дорофеев и соавт., 2017). Найденные в результате моделирования оптимальные температура и концентрация растворенного кислорода были близки к соответствующим показателям, полученным экспериментально.
Целью настоящей работы было исследование переходного процесса, вызванного скачком концентрации аммония в поступающей среде, и сравнение результатов моделирования с экспериментальными данными.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальная часть
Эксперименты проводили в лабораторном биореакторе SBR-типа с рабочим объемом 4.5 л. В качестве носителя в реактор была помещена цилиндрическая загрузка из волокнистых полиэтилена и полипропилена массой 82 г и общей площадью поверхности 11.6 дм2 (Поливом, “ООО НПО “Этек”, Россия). В биореактор подавали синтетическую среду следующего состава (г/л): (NH4)2SO4 – 0.942 и 2.36 (соответственно, 200 и 500 мг N–NH4/л); NaCH3COO · 3H2O – 0.04; KH2PO4 – 0.044; NaHCO3 – 2.1; рН 8.3. Готовили концентрированный раствор среды на дистиллированной воде. Концентрат разбавляли водопроводной водой в момент подачи в реактор; NaHCO3 добавляли непосредственно в водопроводную воду перед разбавлением концентрата.
Продолжительность каждого цикла SBR составляла 6 ч. Цикл состоял из следующих фаз: фаза чередования аэрации и механического перемешивания – 310 мин; фаза отстаивания – 20 мин; фаза одновременной подачи 1 л свежей и слив 1 л отработанной среды – 30 мин. Реактор работал при температуре 32°С и концентрации кислорода 0.4–0.8 мг/л; рН 8.3.
Регулярно из биореактора отбирали образцы отходящей воды и биопленок для проведения химического анализа, электронной микроскопии и молекулярного анализа. Детальное описание биореактора, условий культивирования и методов анализа приведено ранее (Каллистова и соавт., 2020).
Исходным инокулятом служил консорциум анаммокс-бактерий, выращенный в лабораторном реакторе SBR-типа (Каллистова и соавт., 2020). Через 15 нед. выращивания при концентрации в подающейся среде 200 мг N/л концентрацию аммония повышали до 500 мг N/л.
Концентрацию удаленного азота рассчитывали как разность между концентрацией аммонийного азота (N–NH4) в поступающей среде и суммарной концентрацией минеральных форм азота в очищенной воде (N–NH4, N–NO2, N–NO3). Эффективность удаления азота (%) рассчитывали как долю удаленного азота от его содержания в поступающей среде.
Описание используемой в BioWin модели
Математическое моделирование проводили с применением симулятора BioWin 3.0 (версия 2007 г., “EnviroSim Associates Ltd.”, Канада) (Сайт компании “Envirosim”), в основе которого лежит модель активного ила ASDM (activated sludge process/anaerobic digestion model), по существу близкая к группе моделей активного ила ASM, разработанных международной научно-исследовательской группой IWAQ (Henze et al., 2000). Модель ASDM включает около 50 переменных состояния, объединенных в 60 уравнениях. Базовая модель описывает основные аэробные и анаэробные микробиологические процессы (потребление субстратов, образование и распад биомассы, образование продуктов метаболизма), протекающие в ходе биологической очистки сточных вод активным илом, а также реакции химического осаждения, массопереноса газ‒жидкость и т.п. В расчетах учитывались следующие процессы биологической трансформации азота: 1) нитрификация до нитрита аммоний-окисляющими бактериями (АОБ); 2) нитрификация до нитрата нитрит-окисляющими бактериями (НОБ); 3) денитрификация; 4) трансформация соединений азота анаммокс-бактериями; 5) потребление азота на нужды биосинтеза; 6) аммонификация отмершей биомассы.
Краткое описание модуля функционирования анаммокс-бактерий. Анаммокс-бактерии осуществляют конверсию аммиака и нитрита в газообразный азот и нитраты. Энергия этого процесса используется для синтеза органического материала фиксацией углекислоты. Источником азота для биосинтеза является аммиак. Эффективная (наблюдаемая) скорость роста анаммокс-бактерий определяется как сумма скорости роста и распада биомассы. Удельная скорость роста анаммокс-бактерий описывается уравнением Моно, в котором аммоний и нитрит – лимитирующие субстраты роста. Скорость роста изменяется с учетом условий окружающей среды: рост прекращается при пороговой концентрации кислорода и ингибируется нитритом, а также ограничивается по основным питательным веществам (фосфаты, неорганический углерод, другие катионы и анионы). Скорость распада биомассы меняется в зависимости от концентрации растворенного кислорода и концентрации нитритов. В последнем случае нитритная токсичность моделируется увеличением скорости распада путем произведения константы нитритной чувствительности и концентрации нитрита. Значения используемых в качестве базовых кинетико-стехиометрических параметров анаммокс-бактерий, а также аммоний- и нитрит-окисляющих бактерий (соответственно, АОБ и НОБ), приведены в таблицах (табл. 1, табл. 2). Значения используемых в BioWin по умолчанию физико-химических параметров не меняли, за исключением случаев, оговоренных в разделе “Результаты и обсуждение”.
Таблица 1.
Значения используемых в модели кинетических параметров анаммокс-бактерий, АОБ и НОБ
| Параметр | Значение | Температурный коэффициент | Значение | Температурный коэффициент | Значение | Температурный коэффициент |
|---|---|---|---|---|---|---|
| анаммокс-бактерии | АОБ | НОБ | ||||
| Максимальная удельная скорость роста (1/сут) | 0.1 | 1.1 | 0.9 | 1.072 | 0.7 | 1.06 |
| Субстратная константа полунасыщения для NH4 (мг N/л) | 2.0 | 1.0 | 0.7 | 1.0 | ‒ | ‒ |
| Субстратная константа полунасыщения для нитрита (мг N/л) | 1.0 | 1.0 | ‒ | ‒ | 0.05 | 0.05 |
| Аэробная удельная скорость распада биомассы (1/сут) | 0.019 | 1.029 | 0.17 | 1.029 | 0.17 | 1.029 |
| Удельная скорость распада биомассы в аноксидных/ анаэробных условиях (1/сут) | 0.0095 | 1.029 | 0.08 | 1.029 | 0.08 | 1.09 |
| Константа ингибирования нитритом Ki (мг N/л) | 1000 | 1.0 | 0.07 | 1.0 | ‒ | ‒ |
| Константа нитритной чувствительности (л/(сут мг N)) | 0 | 1.0 | ‒ | ‒ | ‒ | ‒ |
| Константа ингибирования аммиаком Ki(NH3) (ммоль/л) | ‒ | ‒ | ‒ | ‒ | 0.075 | 1.0 |
Таблица 2.
Значения используемых в модели стехиометрических коэффициентов анаммокс-бактерий, АОБ и НОБ
| Параметр | Анаммокс-бактерии | АОБ | НОБ |
|---|---|---|---|
| Экономический коэффициент (мг химически потребляемого кислорода (ХПК)/мг N) | 0.114 | 0.15 | 0.09 |
| Образование нитрата в анаммокс-процессе (мг N/мг ХПК биомассы) | 2.28 | ‒ | ‒ |
| Азот в биомассе (мг N/мг ХПК биомассы) | 0.07 | 0.07 | 0.07 |
| Фосфор в биомассе (мг Р/мг ХПК биомассы) | 0.022 | 0.022 | 0.022 |
| Доля бионеразлагаемых остатков после эндогенного распада биомассы | 0.08 | 0.08 | 0.08 |
| Отношение ХПК/(беззольная биомасса) (мг ХПК/мг беззольного вещества биомассы) | 1.42 | 1.42 | 1.42 |
В связи с тем, что в наших экспериментах развитие и накопление биомассы происходило в прикрепленной к загрузочному материалу биопленке, в расчетах задействовали модуль, описывающий рост биопленок на поверхности инертного материала. В программе BioWin для этой цели используется 1D-модель роста биопленок и диффузии растворенных веществ и твердых частиц (клеток), разработанная Wanner и Reichert и встроенная в общую модель ASDM (Wanner, Reichert, 1996). Значения используемых в BioWin по умолчанию параметров, описывающих диффузионные процессы и характеристики биопленок, не меняли, за исключением отдельно оговоренных случаев.
Алгоритм расчетов. Учитывая, что расчет по ASDM долгосрочной динамики в биореакторах типа SBR с импульсной подачей свежей среды (в технологии – поступающей сточной воды) занимает длительный период, нами был выбран следующий алгоритм расчетов, состоящий из трех основных этапов.
На первом этапе с использованием BioWin рассчитывали стационарные состояния, полагая, что среда в биореактор подается с постоянной (усредненной по циклу выращивания) скоростью. Полученные стационарные состояния служили исходными состояниями для следующих этапов моделирования.
На втором этапе в динамике рассчитывали изменения, происходящие в системе после смены концентрации аммонийного азота с 200 на 500 мг/л, полагая, как и на первом этапе, что среда в биореактор подается с постоянной (усредненной по циклу выращивания) скоростью.
На третьем этапе рассчитывали динамику основных показателей при импульсном режиме, соответствующем реальному режиму работы биореактора. Исходным состоянием культуры (“посевным материалом”, сосредоточенным в биопленке на загрузке) было стационарное состояние, найденное на первом этапе моделирования.
Схема процесса и исходные данные. Для моделирования использовали упрощенную технологическую схему процесса, включающую источник поступающей сточной воды (подача среды), биореактор с загрузкой и выход отработанной (очищенной) сточной воды (рис. 1). Для расчетов в модель были введены значения состава и соотношения компонентов в подающейся в биореактор среды (табл. 3).
Таблица 3.
Основные компоненты подающейся среды, учитываемые в симуляторе BioWin
| Компоненты | Значения |
|---|---|
| Fbs ‒ Легко биоразлагаемое органическое вещество (ацетат) (г ХПК/г общего ХПК) | 0.16 |
| Fac ‒ Ацетат (г ХПК/г легко биоразлагаемого ХПК) | 0.15 |
| Fxsp – Неколлоидное медленно биоразлагаемое вещество (г ХПК/г медленно биоразлагаемого ХПК) | 0.75 |
| Fus ‒ Растворимое бионеразлагаемое органическое вещество (г ХПК/г суммарного ХПК) | 0.05 |
| Fup ‒ Твердое бионеразлагаемое органическое вещество (г ХПК/г суммарного ХПК) | 0.13 |
| Fna ‒ Аммоний (г NH4−N/г общего азота по Кьельдалю) | 0.98 |
| Fnox – Органический азот в твердой фазе (г N/г органического N) | 0 |
| Fnus – Растворенный бионеразлагаемый азот по Кьельдалю (г N/г общего азота) | 0 |
| FupN – Отношение N : ХПК для бионеразлагаемой части ХПК (г N/г ХПК) | 0 |
| ${{{\text{F}}}_{{{\text{P}}{{{\text{O}}}_{4}}}}}$ ‒ Фосфаты (г PO4−P/г общего фосфора) | 0.5 |
| FupP – Отношение P : ХПК для бионеразлагаемой части ХПК в подающейся среде (г P/г ХПК) | 0.011 |
| FZbh – Гетеротрофныe организмы, не относящиеся к фосфат-аккумулирующим организмам (ФАО) (г ХПК/г общего ХПК) | 0.0001 |
| FZbm – Метанол-потребляющие аноксидные организмы (г ХПК/г общего ХПК) | 0.0001 |
| FZaob – Аммоний-окисляющие микроорганизмы (г ХПК/г общего ХПК) | 0.0001 |
| FZnob – Нитрит-окисляющие микроорганизмы (г ХПК/г общего ХПК) | 0.0001 |
| FZamob – Анаммокс-бактерии (г ХПК/г общего ХПК) | 0.0001 |
| FZbp ‒ ФАО (г ХПК/г общего ХПК) | 0.0001 |
| FZbpa – Ацетогеные пропионовокислые бактерии (г ХПК/г общего ХПК) | 0.0001 |
| FZbam – Ацетотрофные метаногены (г ХПК/г общего ХПК) | 0.0001 |
| FZbhm ‒ H2-потребляющие метаногены (г ХПК/г общего ХПК) | 0.0001 |
При расчетах динамического поведения системы в режиме импульсной подачи среды (третий этап моделирования) в модель вводили следующее условие: в течение 0.5 ч в биореактор подается свежая среда со скоростью 2 л/ч (содержащая 200 или 500 мг N/л) и отводится равное количество среды для сохранения постоянства объема. Затем в течение 5.5 ч культура развивается в периодическом режиме. Цикл повторяется через каждые 6 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
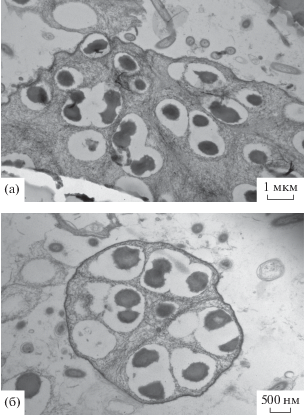
После инокуляции биореактора активным илом в течение первых дней происходило его закрепление на загрузочном материале. При этом содержание свободноплавающих взвешенных веществ снизилось и в дальнейшем не превышало 200 мг/л. В течение эксперимента наблюдалось образование и рост прикрепленной биомассы в виде биопленок, толщина которых через 2‒3 мес. работы биореактора достигла нескольких миллиметров и стабилизировалась. Образовавшиеся биопленки содержали типичные анаммокс-бактерии (рис. 2), и развивающийся в биореакторе консорциум микроорганизмов проявлял выраженную анаммокс-активность. При входной концентрации аммония 200 мг N–NH4/л содержание аммония на выходе из биореактора (в сливе в конце цикла культивирования) постепенно снижалось, достигнув на 105 сут 26.6 мг N–NH4/л, а концентрация нитритов и нитратов составила 6.1 и 14.4 мг N/л соответственно. Анализ состава микробного сообщества с помощью метода высокопроизводительного секвенирования фрагментов гена 16S рРНК показал, что из трех основных групп азот-конвертирующих микроорганизмов в биопленках доминировали анаммокс-бактерии, а минорную часть консорциума составляли нитрификаторы второй стадии (Каллистова и соавт., 2020). Полученные результаты свидетельствуют о том, что в биореакторе сложился стабильный консорциум, эффективно осуществляющий процесс нитритации‒анаммокс и удаляющий из подающейся среды 70‒80% азота.
При использовании значений параметров, предустановленных в BioWin по умолчанию, стационарных состояний (первый этап моделирования), в которых осуществляется процесс анаммокс, найдено не было. В связи с этим, мы изменили значения следующих коэффициентов, относящихся к свойствам анаммокс-бактерий и физико-химическими характеристикам процессов, протекающих в биопленке:
1) Учитывая опыт выполненных нами ранее работ, мы свели к минимуму константу чувствительности к нитриту, установив ее значение 0 вместо 0.016 (л/сут/мг N) (Дорофеев и соавт., 2017).
2) В связи с тем, что в наших экспериментах наблюдалось образование биопленки значительной толщины, для имитации этого явления мы снизили используемую в BioWin по умолчанию скорость открепления биопленки до 8000 г/(м3 сут).
3) Для повышения интенсивности массообмена между биопленкой и внешней средой увеличили эффективную скорость диффузии основных азотсодержащих субстратов (табл. 4).
Таблица 4.
Значения коэффициентов диффузии, принятые в модели
| Показатель | Эффективный коэффициент диффузии (м2/с) | Температурный коэффициент |
|---|---|---|
| Аммоний | 3.00 × 10 (‒9) | 1.029 |
| Нитрит | 2.98 × 10 (‒8) | 1.029 |
| Нитрат | 2.98 × 10 (‒8) | 1.029 |
После использования в BioWin новых параметров были рассчитаны стационарные состояния, устанавливающиеся при входной концентрации аммония 200 мг N−NH4/л, характеристики которых были близки к результатам, полученным экспериментально (табл. 5).
Таблица 5.
Расчетные и экспериментально полученные показатели работы биореактора с загрузкой при концентрации аммония в подающейся в реактор среде 200 мг N–NH4/л
| Концентрация в очищенной воде, мг N/л | Эффективность удаления азота, % | |||
|---|---|---|---|---|
| аммоний | нитриты | нитраты | ||
| Экспериментальные данные | 26.6 | 6.1 | 14.4 | 76.5 |
| Расчетные стационарные значения | 11.9 | 7.3 | 10.38 | 76 |
| Диапазон колебаний при импульсной подаче среды | 0‒38 | 3‒8.5 | 16.5‒20.2 | 71‒85.5 |
На следующем этапе нами была рассчитана динамика концентраций минеральных азотсодержащих компонентов в течение нескольких суток с учетом импульсной подачи среды, с использованием в качестве исходных данных (нулевая точка) стационарных значений, полученных на предыдущем этапе моделирования. В результате расчетов была получена пилообразная кривая, состоящая из повторяющихся колебаний концентрации аммония, нитритов и нитратов (рис. 3). Воспроизводимость расчетных циклов указывает на то, что в модельной системе установилось квазистационарное состояние. Диапазон изменения расчетных концентраций аммония и нитритов в течение цикла включал в себя экспериментально найденные значения, но концентрация нитратов была в среднем на 28% выше (табл. 6).
Рис. 3.
Расчетная динамика изменения концентраций азотсодержащих компонентов в биореакторе при импульсной подаче среды с концентрацией аммония 200 мг N−NH4 /л. 1 – N–NH4; 2 – N–NO3; 3 – N–NO2.
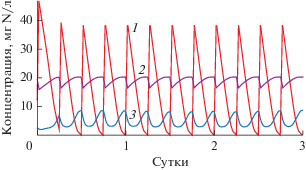
Таблица 6.
Экспериментально полученные и расчетные показатели работы биореактора через четверо суток после смены концентрации аммония с 200 до 500 мг N–NH4/л
| Концентрация в очищенной воде, мг N/л | Эффективность удаления азота, % | |||
|---|---|---|---|---|
| аммоний | нитриты | нитраты | ||
| Экспериментальные данные | 280‒290 | 9‒13 | 11‒15 | 36‒40 |
| Расчетные значения при непрерывной подаче следы | 255 | 3 | 22 | 44 |
| Диапазон колебаний расчетных значений при импульсной подаче среды | 230‒280 | 2‒3 | 20‒23 | 40‒50 |
Переходный процесс, вызванный увеличением концентрации аммония
В эксперименте после смены концентрации аммония в поступающей среде с 200 на 500 мг N/л, концентрация аммония на выходе из биореактора быстро возрастала до 280‒290 мг N/л, и в дальнейшем в течение месяца существенно не менялась (рис. 4). Содержание нитритов и нитратов увеличилось до 9‒13 и 11‒15 мг N/л соответственно. Эффективность удаления азота из системы снизилась в среднем с 76 до 40‒41% (табл. 7). Анализ состава микробного сообщества показал, что смена концентрации аммония в среде принципиально не повлияла на соотношение основных участников превращения азота (неопубликованные данные).
Рис. 4.
Экспериментальная динамика концентраций неорганических соединений азота в очищенной воде биореактора до и после увеличения концентрации аммонийного азота с 200 до 500 мг N/л. 1 – N–NH4; 2 – N–NO3; 3 – N–NO2. Время смены концентрации аммония соответствует 10 суткам.
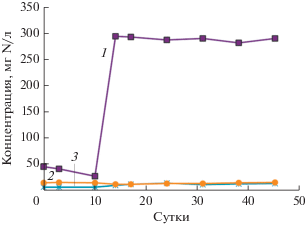
Таблица 7.
Сравнение экспериментальных и расчетных стационарных значений эффективности удаления растворимых форм азота
| Эффективность удаления азота, % | ||
|---|---|---|
| Концентрация аммония в подающейся среде, мг N/л | 200 | 500 |
| Эксперимент | 76* | 36.5‒38.5** |
| Расчет | 83 | 77 |
Расчет по модели, предполагающей непрерывный поток среды (второй этап моделирования) показал быстрое увеличение концентрации аммония и снижение эффективности удаления азота с 83 до 43% в течение первых четырех суток после смены концентраций аммония в подающейся среде (рис. 5), что на коротком отрезке времени соответствовало поведению реального сообщества биореактора. Такая же тенденция была получена и при моделировании импульсной подачи среды (третий этап моделирования): через четверо суток концентрация аммония в течение цикла изменялась от 230 до 280 мг N−NH4 /л (рис. 6).
Рис. 5.
Расчетная динамика соединений азота в среде в условиях непрерывной подачи среды при скачкообразной смене концентрации аммония с 200 на 500 мг N−NH4/л. 1 – N−NH4; 2 – N−NO3; 3 – N−NO2.
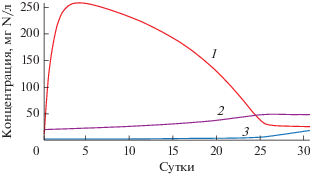
Рис. 6.
Расчетная динамика соединений азота в среде в условиях импульсной подачи среды при скачкообразной смене концентрации аммония с 200 на 500 мг N−NH4 /л. 1 – N−NH4; 2 – N−NO3; 3 – N−NO2. Момент смены концентрации аммония показан стрелкой.
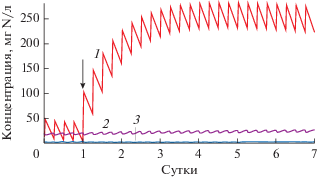
Вместе с тем, моделирование переходного периода на более длительном отрезке времени показало, что постепенно концентрация аммония на выходе из биореактора падает с тенденцией к стабилизации, и через 30 сут расчетная величина составляла 26‒27 мг N/л, а эффективность удаления азота повысилась до 80%, что сопоставимо с эффективностью удаления азота при исходной концентрации аммония в подающейся среде 200 мг/л. Расчетные стационарные концентрации аммония, нитритов и нитратов в очищенной воде при входной концентрации аммония 500 мг N/л имели, соответственно, значения 23.4, 48.65 и 45.15 мг N/л, а эффективность удаления азота составила 77%, что существенно расходилось с экспериментальными данными (табл. 7). Такие расхождения результатов эксперимента и моделирования свидетельствуют о том, что долгосрочный переходный процесс, вызванный резкой сменой нагрузки на анаммокс-сообщество по аммонию, не сводится к простому изменению физико-химических и тотальных биологических показателей (концентрации биомассы, толщины биопленки и т.п.), заложенных в используемой модели.
Ранее в подобных экспериментальных условиях нами уже был исследован переходный период анаммокс-сообщества, вызванный сменой нагрузки по аммонию увеличением его концентрации с 200 до 400 мг/л (Каллистова и соавт., 2020). Как и в настоящей работе, после увеличения нагрузки происходило резкое возрастание концентрации аммония в очищенной воде и падение эффективности удаления азота (с 84 до 46%), не восстанавливающееся в течение месяца. Одинаковая реакция сообщества свидетельствует о наличии специфических механизмов, характерных для переходных процессов, вызванных изменением нагрузки. К сожалению, переходным периодам процесса нитритация‒анаммокс, возникающим при переходе от одного стационарного состояния к другому, уделяется недостаточно внимания, а использование симулятора BioWin ограничивается, как правило, оптимизацией работы очистных сооружений в постоянных условиях или прогнозами влияния краткосрочных изменений тех или иных факторов (Jones et al., 2007; Wett et al., 2010; Дорофеев и соавт., 2017). Определенные успехи связаны с использованием других симуляторов и моделированием анаммокс-содержащего гранулированного активного ила для оптимизации режима работы биореакторов SBR-типа (Corbala-Robles et al., 2016; Al-Hazmi et al., 2021). Однако, по нашим данным, систематических исследований переходных состояний с использованием других симуляторов также не проводилось.
Вероятной причиной полученных в нашей работе расхождений эксперимента и расчета могут быть произошедшие в переходный период существенные изменения структурно-функциональных характеристик биопленок или агрегатов, не учитывающиеся при моделировании. Косвенно на наличие таких изменений указывает возникшая необходимость использовать в модели более высокие скорости диффузионных процессов, чем заложены в BioWin по умолчанию. Возможной причиной может быть двуслойность сформированной на загрузке биопленки. При выполнении наших ранних исследований (Каллистова и соавт., 2020) и в настоящей работе было отмечено, что биопленка анаммокс-сообщества состоит из двух частей: во внутренней части, расположенной между волокнами загрузочного материала, создаются условия с затрудненным доступом кислорода, тогда как во внешней, более рыхлой, облегчены диффузионно-массообменные процессы. Также известно, что микроколонии анаммокс-бактерий отличаются наличием мощной экзополисахаридной матрицы, а развитие включающих нитрифицирующие и анаммокс-бактерии биопленок характеризуется не просто нарастанием суммарной прикрепленной биомассы, но затрагивает более сложные структурно-функциональные процессы (Каллистова и соавт., 2016). В этой связи следует отметить открытие у гранул анаммокс-бактерий процесса массообмена, напоминающего легочное дыхание высших организмов (Xu et al., 2019). В соответствии с гипотезой авторов, сформированные гранулы биомассы анаммокс-бактерий способны к сокращению и расширению, наподобие легких, благодаря образованию и выбросу из гранул газовых пузырьков с молекулярным азотом. Такой механизм значительно ускоряет процессы массообмена между агрегатами и жидкой фазой в сравнении с обычной диффузией. Вероятно, развитие таких сложных структур требует большего времени, чем заложенное в моделях нарастание простейшей биопленки, что может быть причиной расхождения экспериментальных и расчетных данных.
Кроме структурных изменений в биопленках, неучтенными в модели факторами могут быть изменение состава микробного сообщества и, соответственно, изменение его биохимических и кинетико-стехиометрических характеристик, изменение свойств материалов обрастания, отложение неорганических веществ. Очевидно, что для более глубокого понимания протекающих в биопленках процессов и повышения прогностической ценности моделирования необходимы дальнейшие экспериментальные исследования биопленок и развитие математического аппарата их описания.
В заключение следует отметить, что результаты наших исследований могут представлять интерес для реальных очистных сооружений, где в цикле очистки сточных вод задействован процесс Анаммокс. Например, в случае аварийных сбросов сточных вод с высоким содержанием аммония процесс восстановления рабочего режима может значительно увеличиваться, что необходимо учитывать для устранения последствий снижения эффективности функционирования анаммокс-реактора.
Список литературы
Дорофеев А.Г., Николаев Ю.А., Козлов М.Н., Кевбрина М.В., Агарев А.М., Каллистова А.Ю., Пименов Н.В. Моделирование процесса Анаммокс с использованием пакета прикладных программ BioWin // Прикл. биохимия и микробиология. 2017. Т. 53. С. 88–95.
Dorofeev A.G., Nikolaev Yu.A., Kozlov M.N., Kevbrina M.V., Agarev A.M., Kallistova A.Yu., Pimenov N.V. Modeling of Anammox process with the BioWin software suite // App. Biochem. Microbiol. (Moscow). 2017. V. 53. P. 78–84.
Каллистова А.Ю., Николаев Ю.А., Марданов А.В., Берестовская Ю.Ю., Грачев В.А., Кострикина Н.А., Пелевина А.В., Равин Н.В., Пименов Н.В. Исследование формирования и развития анаммокс-биопленок методами световой, эпифлуоресцентной и электронной микроскопии // Микробиология. 2020. Т. 89. С. 700‒713.
Kallistova A.Yu., Nikolaev Yu.A., Mardanov A.V., Berestovskaya Yu.Yu., Grachev V.A., Kostrikina N.A., Pelevina A.V., Ravin N.V., Pimenov N.V. Investigation of formation and development of anammox biofilms by light, epifluorescence, and electron microscopy // Microbiology (Moscow). 2020. V. 89. P. 708‒719.
Каллистова А.Ю., Дорофеев А.Г., Николаев Ю.А., Козлов М.Н., Кевбрина М.В., Пименов Н.В. Роль анаммокс-бактерий в очистке сточных вод от соединений азота // Микробиология. 2016. Т. 85. С. 126–144.
Kallistova A.Yu., Dorofeev A.G., Nikolaev Yu.A., Kozlov M.N., Kevbrina M.V., Pimenov N.V. Role of anammox bacteria in removal of nitrogen compounds from wastewater // Microbiology (Moscow). 2016. V. 85. P. 140‒156.
Кевбрина М.В., Дорофеев А.Г., Агарёв А.М., Козлов М.Н., Николаев Ю.А., Асеева В.Г. Анаммокс – перспективная технология удаления азота из сточных вод // Водоснабжение и санитарная техника. 2019. № 5. С. 28‒35.
Сайт компании Envirosim https://envirosim.com/products
Agrawal S., Seuntjens D., Cocker P.D., Lackner S., Vlaeminck S. Success of mainstream partial nitritation/anammox demands integration of engineering, microbiome and modeling insights // Curr. Opin. Biotechnol. 2018. V. 50. P. 214–221.
Al-Hazmi H.E., Lu X., Majtacz J., Kowal P., Xie L., Makinia J. Optimization of the aeration strategies in a deammonification sequencing batch reactor for efficient nitrogen removal and mitigation of N2O production // Environ. Sci. Technol. 2021. V. 55. P. 1218‒1230.
Artan N., Orhon D. Mechanism and Design of Sequencing Batch Reactors for Nutrient Removal. Scientific and Technical Report Series, № 19. London: IWA Publishing, 2005. 116 p.
Baeten J.E., Batstone D.J., Schraa O.J., van Loosdrecht M.C.M., Volcke E.I.P. Modelling anaerobic, aerobic and partial nitritation anammox granular sludge reactors ‒ A review // Water Res. 2019. V. 149. P. 322–341.
Cho S., Kambey C., Nguyen V.K. Performance of anammox processes for wastewater treatment: a critical review on effects of operational conditions and environmental stresses // Water. 2020. V. 12. Art. 20. https://doi.org/10.3390/w12010020
Corbala-Robles L., Picioreanu C., van Loosdrecht M.C.M., Perez J. Analysing the effects of the aeration pattern and residual ammonium concentration in a partial nitritation-anammox process // Environ. Technol. 2016. V. 37. P. 694‒702.
Henze M., Gujer W., Mino T., Van Loosdrecht M. Activated sludge models ASM1, ASM2, ASM2d and ASM3 / Eds. IWA Task Group on Mathematical Modelling for Design and Operation of Biological Wastewater Treatment. London.: IWA Publishing, 2000. 121 p. https://doi.org/10.2166/9781780402369
Jones R.M., Dold P.L., Takacs I., Chapman K., Wett B., Murthy S., Shaughnessy M.O. Simulation for operation and control of reject water treatment processes // Proceedings of the Water Environment Federation. 2007. V. 2007. P. 4357‒4372. https://doi.org/10.2175/193864707787974599
Lotti T., Kleerebezem R., Lubello C., van Loosdrecht M.C.M. Physiological and kinetic characterization of a suspended cell anammox culture // Water Res. 2014. V. 60. P. 1–14.
Ni S.Q., Ahmad H.A., Zhao Y., Li Q., Dong Y., Ahmad S., Cui Z., Qiao Z. Energy-efficient anaerobic ammonia removal: from laboratory to full-scale application // Microbial Bioremediation & Biodegradation / Ed. Shah M.P. Singapore: Springer, 2020. P. 505‒526.
Seco A., Ruano M.V., Ruiz-Martinez A., Robles A., Barat R., Serralta J., Ferrer J. Plant-wide modelling in wastewater treatment: showcasing experiences using the Biological Nutrient Removal Model // Water Sci. Technol. 2020. V. 81. P. 1700‒1714.
Shao Q., Wan F., Du W., He J. Enhancing biological nitrogen removal for a retrofit project using wastewater with a low C/N ratio ‒ a model-based study // Environ. Sci. Pollut. Res. 2021. P. 1–13. https://doi.org/10.1007/s11356-021-14396-2
Tchobanoglous G., Burton F.L., Stensel H.D. Wastewater Engineering: Treatment and Reuse. Metcalf and Eddy, Mc-Graw Hill, New York, USA, 2014. 2044 p.
Wang W., Yan Y., Zhao Y., Shi Q., Wang Y. Characterization of stratified EPS and their role in the initial adhesion of anammox consortia // Water. Res. 2020. V. 169. Art. 115223. https://doi.org/10.1016/j.watres.2019.115223
Wanner O., Reichert P. Mathematical modelling of mixed-culture biofilms // Biotechnol. Bioeng. 1996. V. 49. P. 172‒184.
Wett B., Nyhuis G., Takacs I., Murthy S. Development of enhanced deammonification selector // Water Environment Federation Technical Exhibition and Conference. New Orleans, Louisiana. 2010. P. 5917. https://doi.org/10.2175/193864710798194139
Xu D., Kang D., Yu T., Ding A., Lin Q., Zhang M., Hu Q., Zheng P. A secret of high-rate mass transfer in anammox granular sludge: “Lung-like breathing” // Water Res. 2019. V. 154. P. 189‒198. https://doi.org/10.1016/j.watres.2019.01.039
Дополнительные материалы отсутствуют.