Микробиология, 2021, T. 90, № 6, стр. 738-746
Ингибирование биосинтеза каротиноидов в пигмент-белковых комплексах LH2 и LH1-RC пурпурной серной бактерии Thermochromatium tepidum
М. А. Большаков a, *, А. А. Ашихмин a, З. К. Махнева a, А. А. Москаленко a
a Институт фундаментальных проблем биологии Российской академии наук –
обособленное подразделение ФИЦ ПНЦБИ РАН
142290 Пущино, Московская обл., Россия
* E-mail: lfbv22@gmail.com
Поступила в редакцию 12.04.2021
После доработки 02.06.2021
Принята к публикации 07.06.2021
Аннотация
Изучено влияние качественного и количественного содержания каротиноидов на сборку светособирающих комплексов, выделенных из термоустойчивой пурпурной серной бактерии Thermochromatium (T.) tepidum. Для уменьшения содержания каротиноидов в фотосинтетических мембранах и комплексах использовали ингибитор каротиноидгенеза – дифениламин (ДФА). Минимальное содержание каротиноидов составило 40% при выращивании клеток T. tepidum в присутствии 120 мкМ ДФА. При повышении концентрации ДФА рост культуры останавливался. Из ДФА-клеток были выделены фотосинтетические ДФА-мембраны и ДФА-комплексы LH2 и LH1-RC, содержание каротиноидов в которых составило 45 и 55% соответственно. Их спектральные характеристики в ближней ИК-области не зависели от количества каротиноидов в комплексах и были аналогичны характеристикам нативных комплексов дикого типа. Одновременно с общим уменьшением содержания каротиноидов, в ДФА-комплексах появлялись каротиноиды из более ранних этапов биосинтеза, такие как нейроспорин, ζ-каротин и их гидрокси-производные. Появление в ДФА-комплексах каротиноидов с более короткой, чем в контроле цепью сопряженных двойных связей приводило к увеличению эффективности переноса энергии с каротиноидов на бактериохлорофилл.
Фотосинтезирующие бактерии имеют достаточно простой фотосинтетический аппарат. Его светособирающая антенна состоит из двух типов пигмент-белковых комплексов: периферийного LH2 и прицентрового LH1, которые располагаются во внутренней цитоплазматической мембране (Cogdell et al., 2006). Комплекс LH1 окружает реакционный центр (RC), образуя с ним коровый комплекс или комплекс LH1–RC. Оба светособирающих комплекса получены в чистом виде и хорошо изучены (Cogdell et al., 2006; Gabrielsen et al., 2009). В зависимости от вида бактерии комплекс LH1 в ближней ИК-области имеет основной максимум поглощения при ≥865 нм, а комплекс LH2 – два максимума (при ~800 и ~850 нм) (Cogdell et al., 2006; Gabrielsen et al., 2009). Эти комплексы построены у пурпурных бактерий по аналогичному модульному принципу и состоят из двух типов полипептидов (α и β), бактериохлорофилла (БХл) и каротиноидов (Cogdell et al., 2006). Основной структурной субъединицей светособирающих комплексов является состоящий из α- и β-полипептидов α/β-гетеродимер, с которым нековалентно связаны молекулы БХл и каротиноидов. В комплексе LH2 это три молекулы БХл (одна БХл800 и две БХл850), в комплексе LH1 – две молекулы БХл870‒890 и по одной молекуле каротиноида на каждый α/β-гетеродимер (Gabrielsen et al., 2009). У несерных пурпурных бактерий комплексы LH2 состоят из 8‒9 α/β-гетеродимеров (McDermott et al., 1995; Koepke et al., 1996), а комплекс LH1 – из 16 (Roszak et al., 2003). В комплексе LH2 содержится 24‒27 молекул БХл и 8‒9 молекул каротиноидов, а в LH1 – 32 молекулы БХл и 16 молекул каротиноидов. Согласно модели, описанной в работе (Löhner et al., 2015), у серных пурпурных бактерий комплекс LH2 может состоять из 12 пар α/β-гетеродимеров, как, например, у Allochromatium vinosum, и обладать более сложным пептидным составом. В клетках данной бактерии обнаружено шесть разных пар α- и β-полипептидов (Carey et al., 2014). Они в разном сочетании присутствуют в комплексе LH2. Также получены данные о том, что комплекс LH2 из пурпурной серной бактерии Ectothiorhodospira (Ect.) haloalkaliphila похож на комплекс LH2 из Rhodospirillum molischianum и представляет собой октамер, состоящий из 8 пар α/β-гетеродимеров (Leiger et al., 2019). Молекулы каротиноидов, которые могут содержать различное количество сопряженных двойных связей (СДС), расположены в светособирающих комплексах между α/β-полипептидами, в так называемых “каротиноидных карманах” и взаимодействуют как с аминокислотными остатками обоих полипептидов, так и с молекулами БХл (Cogdell et al., 2006).
В настоящее время все еще не установлены механизмы сборки светособирающих комплексов in vivo. Известно только, что сборка светособирающих комплексов проходит в цитоплазматической мембране бактерий. Затем путем инвагинации этой мембраны комплексы переносятся внутрь клетки с образованием внутрицитоплазматических мембран – хроматофоров (Niederman, 2006). Понятно, что для осуществления этого процесса должны совмещаться биосинтезы α- и β-полипептидов, БХл и каротиноидов. Для изучения сборки комплексов in vivo необходимо сравнивать свойства этих объектов с каротиноидами, БХл, α- и β-полипептидами и без них. Однако получить жизнеспособные клетки и комплексы в настоящий момент удается только без каротиноидов.
Имеется много данных о том, что комплекс LH2 типа В800‒850 у бескаротиноидных мутантов пурпурных несерных бактерий не собирается (Chi et al., 2015). Для пурпурных серных бактерий получение бескаротиноидных комплексов возможно с помощью ингибирования биосинтеза каротиноидов с помощью дифениламина (ДФА), что позволяет получить полный набор этих комплексов с сохранением нативных спектральных характеристик БХл в ИК-области (Moskalenko, Makhneva, 2012; Ashikhmin et al., 2014; Большаков и соавт., 2015, 2016). Однако этот метод имеет ограничения и подходит не для всех видов пурпурных серных бактерий.
В настоящее время среди фотосинтезирующих бактерий особое внимание получила пурпурная серная бактерия Thermochromatium (T.) tepidum. Она была выделена Мадиганом в 1984 г. из термальных источников Йеллоустонского национального парка и отличается от всех известных пурпурных бактерий тем, что ее оптимальная температура роста близка к 50°С (Madigan, 1984). Подобно другим фотосинтезирующим бактериям, она содержит БХл а, растет автотрофно и окисляет сульфид до элементарной серы, которая находится внутри клетки. Поскольку в настоящее время известно только две культуры (Alc. vinosum штамм МГУ и Ect. haloalkaliphila), в которых удается полностью подавить биосинтез каротиноидов и сохранить светособирающий комплекс LH2 с нативными спектральными характеристиками (Moskalenko, Makhneva, 2012; Ashikhmin et al., 2014; Большаков и соавт., 2015, 2016), то целью данной работы был поиск других бактерий, соответствующих этим условиям. Причиной выбора для исследования культуры T. tepidum является ее рост при температуре 50°С (Madigan, 1984), что делает возможным получение более устойчивых комплексов LH2 с минимальным содержанием каротиноидов, поскольку известно, что у Alc. vinosum и Ect. haloalkaliphila бескаротиноидные комплексы LH2 очень лабильны и легко разрушаются при воздействии температуры и детергентов (Ashikhmin et al., 2014; Большаков и соавт., 2015, 2016).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования и условия культивирования. Клетки T. tepidum ATCC 43061 выращивали на модифицированной среде ATCC 1449 (2000 лк; 48°C) (Madigan, 1984). В качестве источника света использовали лампы накаливания мощностью 75 Вт. Клетки собирали в стационарной фазе роста (4–6 сут). Полученную биомассу использовали сразу или хранили при ‒20°С. Для ингибирования биосинтеза каротиноидов использовали разные концентрации ДФА: 71 и 120 мкМ. Собранные клетки разрушали с помощью ультразвука с использованием генератора УЗГ13-0.1-22 (“Ультразвуковая техника”, Россия). Неповрежденные клетки и фрагменты клеточных стенок осаждали на центрифуге K24 (“Janetzki”, Германия) в течение 10 мин при 10 000 об./мин. Пигмент-белковые комплексы выделяли методом электрофореза в ПААГ (Москаленко, Ерохин, 1974). Образцы концентрировали центрифугированием в пробирках Amicon Ultra 50 K (“Millipore”, США).
Анализ каротиноидов. Пигментный анализ мембран, пигмент-белковых комплексов и изолированных каротиноидов проводили с помощью ВЭЖХ системы Shimadzu (“Shimadzu”, Япония), используя колонку с обращенной фазой Agilent Zorbax SB-C18 5 мкм 4.6 × 250 мм (“Agilent”, США). Установка для ВЭЖХ в этом случае состояла из насоса LC-10ADVP с модулем FCV-10ALVP, который позволял создавать градиент растворителей на стороне низкого давления, детектора с диодной матрицей SPD-M20A и термостата CTO-20AC. Скорость подачи растворителей была 1 мл/мин (Makhneva et al., 2008; Большаков и соавт., 2015, 2016). Каротиноиды идентифицировали путем сравнения с известными образцами из различных штаммов бактерий в соответствии с их спектрами поглощения, временем выхода с колонки и молярным коэффициентом экстинкции (Connor, 1991; Gall et al., 2005).
Методы спектроскопии. Спектры поглощения регистрировали на спектрофотометре Cary 50 (“Agilent Technology”, США). Спектры возбуждения флуоресценции (область возбуждения 300‒650 нм) получали с помощью модифицированного спектрофлуориметра Cary Eclipse (“Agilent Technology”, США). Модификация заключалась в замене стандартного ФЭУ (R3896) на последнюю модель ФЭУ (R13456, “Hamamatsu”). Тем самым нам удалось увеличить рабочую область спектрофлуориметра до 950 нм вместо 830 нм у стандартного прибора. Перенос энергии возбуждения от каротиноидов на БХл определяли на длине волны 500 нм (Niedzwiedzki et al., 2011) по кривой Fflu exc(λ)/(1 ‒ T(λ)) по методике (Razjivin et al., 2021), где Fflu exc(λ) – корректированный спектр возбуждения флуоресценции БХл, а (1 ‒ ‒ Т(λ)) = (1 ‒ 10–A(λ)), где Т – пропускание, A(λ) – оптическое поглощение образца после вычитания кривой светорассеяния. Спектры кругового дихроизма регистрировали на спектрополяриметре Chirascan (“Applied Photophysics”, Великобритания).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В спектре поглощения фотосинтетических мембран T. tepidum (рис. 1а, спектр 1) максимумы поглощения БХл локализованы при 800, 856 и 915 нм (Qy – переходы БХл). Полосы поглощения с максимумами при 800 и 856 нм принадлежат комплексу LH2 (рис. 1а, спектр 2), а при 915 нм – комплексу LH1 (рис. 1а, спектр 3). При низкотемпературных измерениях в спектре поглощения этого комплекса LH2 полоса В800 расщепляется на 2 отдельные полосы (как и у Alc. vinosum) (Carey et al., 2014). Этот эффект связан с тем, что в состав комплекса LH2 могут входить три различные пары α- и β-полипептидов, с которыми молекулы БХл800 могут иметь различные взаимодействующие лиганды в каждой α/β-субъединице.
Рис. 1.
Спектры поглощения мембран (1) и пигмент-белковых комплексов LH2 (2) и LH1-RC (3), полученных из контрольных (а) и ДФА-клеток (б) T. tepidum. Для лучшего восприятия спектры 2 и 3 сдвинуты вверх на 0.5 и 1.7 опт. ед. относительно спектра 1 соответственно.
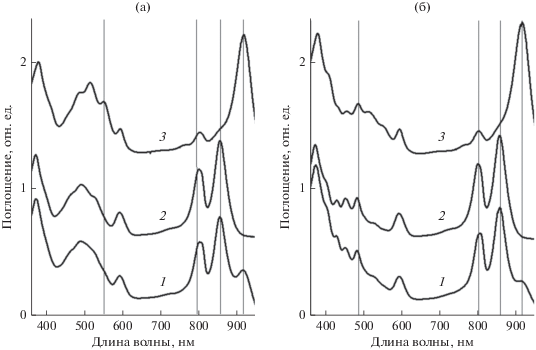
Полоса поглощения комплекса LH1 (при 915 нм) более сдвинута в длинноволновую область (рис. 1а, спектр 3) по сравнению с другими представителями семейства Chromateaceae, что, вероятно, связано с присутствием в нем ионов Ca2+, которые определяют термоустойчивость этой культуры (Niwa et al., 2014).
Был изучен каротиноидный состав контрольных комплексов методом ВЭЖХ. В выделенных из T. tepidum комплексах LH2 преобладают родопин (43.9%, СДС = 11), дидегидрородопин (29.9%, СДС = 12) и ангидрородовибрин (11.2%, СДС = 12), а в комплексе LH1-RC – спириллоксантин (51.5%, СДС = 13) (табл. 1). Содержание каротиноидов в комплексах LH2 данной бактерии ранее было изучено разными группами исследователей. Было показано, что основными каротиноидами в комплексе LH2 являются родопин (66%), спириллоксантин (20%) и ангидрородовибрин (9%) (Yang et al., 2010). В работе Niedzwiedzki et al. (2011) значения следующие: родопин (35%), спириллоксантин (40%), родовибрин (25%, СДС = 12) и ангидрородовибрин (25%). Наблюдаемые различия в каротиноидном составе могут отражать гибкость пути каротиноидгенеза у этой бактерии в различных условиях роста. Более того, комплексы LH2 из T. tepidum могут быть гетерогенны по каротиноидному составу, как показано для такого представителя семейства Chromatiaceae, как Alc. minutissimum (Makhneva et al., 2008).
Таблица 1.
Каротиноидный состав (мол. %) контрольных и ДФА-мембран и комплексов LH2 и LH1-RC, выделенных из клеток T. tepidum
| Каротиноид | Дикий тип | ДФА | ||||
|---|---|---|---|---|---|---|
| мембраны | комплекс LH2 | комплекс LH1-RC | мембраны | комплекс LH2 | комплекс LH1-RC | |
| Деметилспириллоксантин | 1.0 | 0.2 | 1.9 | ‒ | ‒ | ‒ |
| Родовибрин | 1.3 | 0.4 | 2.0 | ‒ | ‒ | ‒ |
| Дидегидрородопин | 24.0 | 29.9 | 5.6 | 1.9 | 3.2 | 1.2 |
| Родопин | 44.9 | 43.9 | 26.9 | 8.3 | 9.4 | 11.7 |
| Спириллоксантин | 14.6 | 9.6 | 51.5 | 0.9 | ‒ | 12.4 |
| ОН-нейроспорин | 0.6 | 0.6 | Следы | 15.3 | 22.7 | 8.4 |
| ОН-ζ-каротин | ‒ | ‒ | ‒ | 6.5 | 5.9 | 3.4 |
| Ангидрородовибрин | 9.5 | 11.2 | 9.8 | 0.6 | 0.6 | 1.7 |
| Ликопин | 3.9 | 4.2 | 1.6 | ‒ | ‒ | ‒ |
| Нейроспорин | Следы | Следы | 0.1 | 0.4 | ‒ | 4.5 |
| ζ-Каротин | 0.2 | Следы | 0.6 | 4.7 | 1.2 | 11.8 |
| ОН-сфероиден* | ‒ | ‒ | 1.4 | 2.1 | ‒ | |
| СКК* | ‒ | ‒ | ‒ | 60.0 | 55.0 | 45.0 |
Особо отметим, что в мембранах и комплексах T. tepidum в следовых количествах обнаруживались нейроспорин и его гидрокси-производная (табл. 1), что нехарактерно для культур пурпурных серных бактерий, у которых работает четырехстадийная фитоиндесатураза, и биосинтез каротиноидов идет по спириллоксантиновому пути (Takaichi, 2009). Присутствие этих каротиноидов можно объяснить тем, что высокая температура (50°С), при которой данная бактерия обитает в естественной среде, является причиной сбоя в работе четырехстадийной фитоиндесатуразы, в результате чего промежуточные продукты ее работы встраиваются в комплексы LH2 и LH1-RC.
Обычно для выращивания бактерий Alc. vinosum шт. МГУ и Ect. haloalkaliphila с полностью подавленным биосинтезом каротиноидов использовали 71 мкМ (12 мг/л) ДФА (Москаленко и соавт., 1991; Makhneva et al., 2008; Ashikhmin et al., 2014; Большаков и соавт., 2015). Однако в случае T. tepidum при использовании данной концентрации ингибитора достичь желаемого результата не удалось. В клетках присутствовало значительное (≥80%) количество каротиноидов. При повышении концентрации до 120 мкМ ДФА рост клеток замедлялся вдвое, а содержание каротиноидов в клетках снижалось до 40% по сравнению с клетками дикого типа. Получить клетки с более низким содержанием каротиноидов не удалось. Возможно, это связано с высоким температурным оптимумом для роста этой бактериальной культуры (48°С). При этой температуре ДФА мог частично деградировать, и его эффективная концентрация в среде культивирования падала.
Из полученных ДФА-клеток были выделены фотосинтетические мембраны и светособирающие комплексы (рис. 1б). Максимумы полос поглощения БХл в ДФА-мембранах и комплексах (рис. 1б) не изменились (800, 856 и 915 нм) по сравнению с контролем. Это свидетельствует о сохранении принципов сборки ДФА-комплексов LH2 и LH1-RC. В спектре поглощения последних заметно уменьшилась амплитуда полос поглощения каротиноидов (420‒550 нм), и произошло смещение их максимумов. Это указывает на изменение качественного и количественного содержания каротиноидов в этих образцах (рис. 1б, спектры 2, 3).
В ДФА-мембранах из T. tepidum преобладали нейроспорин, ζ-каротин и их гидрокси-производные. В ДФА-комплексе LH2 основными каротиноидами были ОН-нейроспорин и родопин, а в ДФА-комплексе LH1-RC – спириллоксантин, родопин, а также производные нейроспорина. Необычно, что в ДФА-комплексе LH1-RC содержание каротиноидов было выше (55%), чем в ДФА-комплексе LH2 (45%). В случае Alc. vinosum шт. МГУ и Ect. haloalkaliphila при ингибировании биосинтеза каротиноидов с помощью ДФА больший эффект всегда отмечался в комплексе LH1-RC (Makhneva et al., 2008; Ashikhmin et al., 2014; Большаков и соавт., 2017). Отметим, что в ДФА-мембранах T. tepidum количество предшественников каротиноидов – фитоина и фитофлуина к отношению окрашенных каротиноидов составляет 0.74 (М/М). В выделенных ДФА-комплексах они отсутствуют, что указывает на неспецифическое связывание фитоина и фитофлуина в мембранах.
Отметим, что в ДФА-мембранах и ДФА-комплексах LH2 был обнаружен в небольшом количестве ОН-сфероиден (табл. 1, рис. 2), который был идентифицирован по спектру поглощения и по времени удержания на колонке (Connor, 1991). Гидрокси-производное сфероидена не является обычным продуктом спириллоксантиновой ветви биосинтеза каротиноидов, а характерно для сфероиденового пути биосинтеза. Ее появление может быть связано с образованием в ДФА-клетках нейроспорина как отдельного продукта, который не вовлекается в синтез ликопина. Нейроспорин является конечным продуктом работы трехстадийной фитоиндесатуразы (фитоин → фитофлуин → → ζ-каротин → нейроспорин), найденной в клетках несерных бактерий (Takaichi, 2009). Нейроспорин является начальным звеном в биосинтезе сфероидена у Rhodobacter sphaeroides (Cogdell et al., 2006). Для дальнейшего превращения нейроспорина в сфероиден необходима работа гидратазы (CrtC), десатуразы (CrtD) и метилтрансферазы (CrtF) (Chi et al., 2015). Очевидно, присутствие спириллоксантина в ДФА-клетках связано с активностью этих ферментов. В результате их работы происходит образование из нейроспорина небольшого количества сфероидена, который может присоединить ОН-группу с помощью фермента гидратазы (CrtC), в результате чего образуется ОН-сфероиден. Ранее присутствие подобного каротиноида было обнаружено при ингибировании биосинтеза каротиноидов у пурпурной серной бактерии Alc. vinosum ATCC 17899 (Большаков и соавт., 2016).
Рис. 2.
Часть ВЭЖХ хроматограммы экстрактов пигментов из контрольных (а) и ДФА (б) комплексов LH2 из T. tepidum. Идентификация пиков: 1 – БХл; 2 – дидегидрородопин; 3 – родопин; 4 – спириллоксантин; 5 – ОН-сфероиден; 6 – ОН-нейроспорин; 7 – ангидрородовибрин; 8 – ОН-ζ-каротин; 9 – ликопин; 10 – ζ-каротин. Хроматограмма записана при 270‒800 нм. Хроматограммы нормированы по содержанию БХл (пик 1).
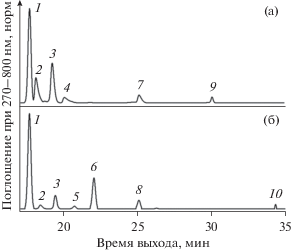
Хорошо известно, что в комплексах LH2 пурпурных бактерий один α/β-гетеродимер нековалентно связывает только одну молекулу каротиноида. Комплексы LH2 из T. tepidum по своим спектральным свойствам похожи на комплексы LH2 из Alc. vinosum, состоящие из 12 α/β-гетеродимеров, поэтому предположим, что у T. tepidum комплекс LH2 также состоит из 12 α/β-гетеродимеров. Таким образом, у T. tepidum на один ДФА-комплекс LH2 приходится в среднем 5 молекул каротиноидов (12*0.4~5). Согласно ранее выявленной гетерогенности комплексов LH2 по каротиноидному составу (Makhneva et al., 2008) это может означать присутствие в популяции отдельных комплексов, содержащих как ≥5, так и <5 молекул каротиноидов. Теоретически мы можем говорить также о присутствии у T. tepidum бескаротиноидных комплексов LH2. В пользу этого предположения можно привести опыт по изучению термостабильности у ДФА-комплексов LH2 из Rbl. acidophilus с ~46%-ным содержанием каротиноидов. Из этих комплексов с помощью термической обработки удалось получить фракцию комплексов LH2 со средним содержанием каротиноидов 90% и фракцию разрушенных ДФА-комплексов LH2 с содержанием каротиноидов менее 1 молекулы на комплекс. Это указывает на возможное существование двух пулов комплексов. Первый – без каротиноидов и второй – с некоторым содержанием каротиноидов, по-видимому, с 1 и более молекулами каротиноидов на комплекс.
Одна из основных функций каротиноидов в фотосинтезе – перенос энергии возбуждения (ПЭВ) к БХл, поэтому мы оценили данный параметр во всех выделенных пигмент-белковых комплексах. ПЭВ определяли с учетом светорассеяния, как описано в разделе “Материалы и методы исследования”. Для контрольных комплексов LH2 и LH1-RC величина ПЭВ составила 40.5 и 40.9% соответственно (рис. 3). Снижение содержания каротиноидов приводило к увеличению ПЭВ в ДФА-комплексе LH2 до 76.6%, а в ДФА-комплексе LH1-RC до 65.1%.
Рис. 3.
Перенос энергии возбуждения (ПЭВ) от каротиноидов к БХл в контрольных комплексах LH2 (а) и LH1-RC (б) из T. tepidum. Сплошная линия – оптическое поглощение образца после вычитания кривой светорассеяния (1 ‒ Т(λ)), пунктирная линия – корректированный спектр возбуждения флуоресценции БХл (Fflu exc(λ)), а штрихпунктирная линия – ПЭВ (Fflu exc(λ)/(1 ‒ T(λ)).
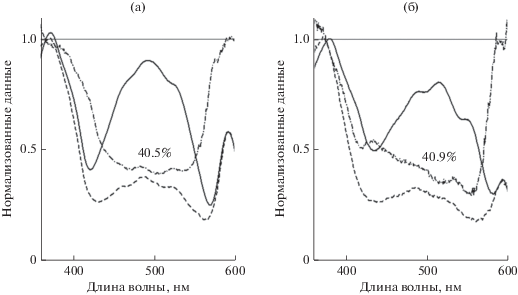
Отметим, что, несмотря на различия в каротиноидном составе контрольных комплексов LH2 и LH1-RC (табл. 1), ПЭВ у них был практически идентичным. Разница в каротиноидном составе между контрольными и ДФА-комплексами LH2 и LH1-RC заключается в снижении содержания длинноволновых каротиноидов: спириллоксантина (13 СДС), ангидрородовибрина (12 СДС), а также дидегидрородопина (12 СДС) и родопина (11 СДС) и появлении в больших количествах каротиноидов с более коротким хромофором: нейроспорина (7 СДС), ζ-каротина (5 СДС) и их гидрокси-производных (табл. 1). Можно сделать вывод, что увеличение содержания каротиноидов с более короткой цепью СДС (табл. 1), приводит к увеличению показателя ПЭВ в ДФА-комплексах LH2 по сравнению с контролем. Эти результаты согласуются с литературными данными и общепризнанным мнением, что каротиноиды с более короткой цепью СДС с более высокой эффективностью переносят энергию на БХл (Niedzwiedzki et al., 2020). Если рассчитывать показатель ПЭВ без учета светорассеяния, то получатся в два раза меньшие значения. При данной методике расчета ПЭВ для контрольных и ДФА-комплексов LH2 составил 25%, что совпадает с данными работы (Niedzwiedzki et al., 2011), где светорассеяние не учитывалось.
Мы предполагаем, что, хотя каротиноиды в комплексах LH2 и LH1-RC обладают общими свойствами, их эффективность в передаче энергии на БХл также зависит от специфических характеристик самих комплексов, в которых они находятся. Вероятно, что на этот процесс существенное влияние оказывает аминокислотное окружение α- и β-полипептидов, из которых и построены комплексы LH2 и LH1-RC.
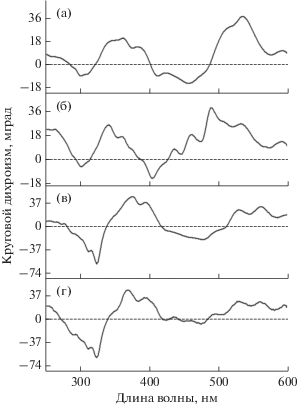
Измерение сигнала кругового дихроизма (КД) в области 220‒600 нм показало зависимость между содержанием каротиноидов в комплексах и интенсивностью сигнала КД этих пигментов (рис. 4). В спектрах КД контрольных комплексов LH2 из T. tepidum отмечены положительные полосы с максимумами при 345, 360, 385, 515, 540 и 590 нм и отрицательные – с максимумами при 300, 412 и 455 нм. В ДФА-комплексах в спектре КД отмечена тенденция к уменьшению как положительных, так и отрицательных сигналов, что коррелирует с уменьшением содержания каротиноидов. В спектре КД контрольных и ДФА-комплексов LH1-RC основные максимумы смещены в длинноволновую область на 10‒20 нм по сравнению с аналогичными комплексами LH2: положительные при 345, 375, 395, 525, 560 и 590 нм и отрицательные при 325 и 475 нм. Форма КД-спектров комплексов LH2 и LH1-RC из T. tepidum и других изученных пурпурных серных бактерий отличаются незначительно, что указывает на схожие принципы их организации и пространственное расположение в них каротиноидов (Moskalenko, Karapetyan, 1996).
Рис. 4.
Спектры КД контрольных комплексов LH2 (а), ДФА-комплексов LH2 (б), контрольных комплексов LH1-RC (в) и ДФА-комплексов LH1-RC (г) из T. tepidum.
Исходя из полученных данных, можно сделать несколько выводов:
1) показана возможность сборки ДФА-комплексов LH2 и LH1-RC из T. tepidum с уменьшенным содержанием каротиноидов по сравнению с комплексами дикого типа;
2) спектральные характеристики ДФА-комплексов в ближней ИК-области были аналогичны характеристикам нативных комплексов дикого типа;
3) с увеличением концентрации ДФА в среде культивирования одновременно с общим уменьшением количественного содержания каротиноидов в комплексах появляются каротиноиды из более ранних этапов биосинтеза, такие как нейроспорин, ζ‑каротин и их гидрокси-производные;
4) показано, что эффективность передачи энергии от каротиноидов к БХл в контрольных и ДФА-комплексах LH2 зависела от состава каротиноидов в образцах.
Список литературы
Большаков М.А., Ашихмин А.А., Махнева З.К., Москаленко А.А. Периферийный светособирающий комплекс LH2 может собираться в клетках пурпурной несерной бактерии Rhodoblastus acidophilus без каротиноидов // Биохимия. 2015. Т. 80. С. 1420–1430.
Bolshakov M.A., Ashikhmin A.A., Makhneva Z.K., Moskalenko A.A. Peripheral light harvesting LH2 complex can be assembled in cells of nonsulfur purple bacterium Rhodoblastus acidophilus without carotenoids // Biochemistry (Moscow). 2015. V. 80. P. 1169–1177.
Большаков М.А., Ашихмин А.А., Махнева З.К., Москаленко А.А. Влияние интенсивности освещения и ингибирования биосинтеза каротиноидов на сборку периферийных светособирающих комплексов пурпурной серной бактерии Allochromatium vinosum ATCC 17899 // Микробиология. 2016. Т. 85. С. 403–414.
Bolshakov M.A., Ashikhmin A.A., Makhneva Z.K., Moskalenko A.A. Effect of illumination intensity and inhibition of carotenoid biosynthesis on assembly of peripheral light-harvesting complexes in purple sulfur bacteria Allochromatium vinosum ATCC 17899 // Microbiology (Moscow). 2016. V. 85. P. 420–429.
Большаков М.А., Ашихмин А.А., Махнева З.К., Москаленко А.А. Встраивание спириллоксантина в пигмент-белковые комплексы LH2 и LH1-RC пурпурной серной бактерии Allochromatium minutissimum // Микробиология. 2017. Т. 86. С. 538–550.
Bolshakov M.A., Ashikhmin A.A., Makhneva Z.K., Moskalenko A.A. Spirilloxanthin incorporation into the LH2 and LH1-RC pigment-protein complexes from a purple sulfur bacterium Allochromatium minutissimum // Microbiology (Moscow). 2017. V. 86. P. 403–414.
Москаленко А.А., Бриттон Ж., Коннор А., Йанг А., Торопыгина О.А. Содержание каротиноидов в хроматофорах и пигмент-белковых комплексах, выделенных из клеток Chromatium minutissimum // Биол. мембраны. 1991. V. 8. P. 249–260.
Moskalenko A.A., Britton J., Connor A., Yang A., Toropygina O.A. The content of carotenoids in chromatophores and pigment-protein complexes isolated from Chromatium minutissimum cells // Biol. Membranes. 1991. V. 8. P. 249–260 (in Rus.).
Москаленко A.A., Ерохин Ю.Е. Выделение пигмент-липопротеиновых комплексов из пурпурных бактерий методом препаративного электофореза в полиакриламидном геле // Микробиология. 1974. Т. 43. С. 654–657.
Moskalenko A.A., Erokhin Yu.E. Isolation of the pigment–lipoprotein complexes from purple bacteriaby preparative polyacrylamide gel electrophoresis // Microbiology (Moscow). 1974. V. 43. P. 654–657 (in Rus.).
Ashikhmin A., Makhneva Z., Moskalenko A. The LH2 complexes are assembled in the cells of purple sulfur bacterium Ectothiorhodospira haloalkaliphila with inhibition of carotenoid biosynthesis // Photosynth. Res. 2014. V. 119. P. 291–303.
Carey A.M., Hacking K., Picken N., Honkanen S., Kelly S., Niedzwiedzki D.M., Blankenship R.E., Shimizu Y., Wang-Otomo Z.Y., Cogdell R.J. Characterization of the LH2 spectral variants produced by the photosynthetic purple sulphur bacterium Allochromatium vinosum // Biochim. Biophys. Acta. 2014. V. 1837. P. 1849–1860.
Chi S.C., Mothersole D.J., Dilbeck P., Niedzwiedzki D.M., Zhang H., Qian P., Vasilev C., Grayson K.J., Jackson P.J., Martin E.C., Li Y., Holten D., Hunter C.N. Assembly of functional photosystem complexes in Rhodobacter sphaeroides incorporating carotenoids from the spirilloxanthin pathway // Biochim. Biophys. Acta, Bioenerg. 2015. V. 1847. P. 189–201.
Cogdell R.J., Gall A., Kohler J. The architecture and function of the light-harvesting apparatus of purple bacteria: from single molecules to in vivo membranes // Q. Rev. Biophys. 2006. V. 39. P. 227–324.
Connor A.E. Carotenoids of phototrophic bacteria // Harold Cohen Library; PhD thesis. 1991. P. 130.
Gabrielsen M., Gardiner A.T., Cogdell R.J. Peripheral complexes of purple bacteria // The Purple Phototrophic Bacteria / Ed. Daldal F., Thurnauer M.C., Beatty J.T., Hunter C.N. New York: Springer, 2009. P. 135–153.
Gall A., Henry S., Takaichi S., Robert B., Cogdell R.J. Preferential incorporation of coloured-carotenoids occurs in the LH2 complexes from non-sulphur purple bacteria under carotenoid-limiting conditions // Photosynth. Res. 2005. V. 86. P. 25–35.
Koepke J., Hu X., Muenke C., Schulten K., Hartmut M. The crystal structure of the light-harvesting complex II (B800–850) from Rhodospirillum molischianum // Structure. 1996. V. 4. P. 581–597.
Leiger K., Linnanto J.M., Rätsep M., Timpmann K., Ashikhmin A.A., Moskalenko A.A., Fufina T.Y., Gabdulkhakov A.G., Freiberg A. Controlling photosynthetic excitons by selective pigment photooxidation // J. Phys. Chem. B. 2019. V. 123. P. 29−38.
Madigan M.T. A novel photosynthetic purple bacterium isolated from a Yellowstone hot spring // Science. 1984. V. 225. P. 313–315.
Makhneva Z., Bolshakov M., Moskalenko A. Heterogeneity of carotenoid content and composition in LH2 of the purple sulphur bacterium Allochromatium minutissimum grown under carotenoid-biosynthesis inhibition // Photosynth. Res. 2008. V. 98. P. 633–641.
McDermott G., Prince S., Freer A., Hawthornthwaite-Lawless A., Papiz M., Cogdell R., Isaacs N. Crystal structure of an integral membrane light-harvesting complex from photosynthetic bacteria // Nature. 1995. V. 374. P. 517‒521.
Moskalenko A.A., Karapetyan N.V. Structural role of carotenoids in photosynthetic membranes // Z. Naturforsch. 1996. V. 51. P. 763–771.
Moskalenko A.A., Makhneva Z.K. Light-harvesting complexes from purple sulfur bacteria Allochromatium minutissimum assembled without carotenoids // J. Photochem. Photobiol. B: Biol. 2012. V. 108. P. 1–7.
Niederman R.A. Structure, function and formation of bacterial intracytoplasmic membranes // Complex Intracellular Structures in Prokaryotes. Microbiology Monographs / Ed. Shively J.M. Berlin, Heidelberg: Springer-Verlag, 2006. V. 2. P. 193–227. https://doi.org/10.1007/7171_025
Niedzwiedzki D.M., Kobayashi M., Blankenship R.E. Triplet excited state spectra and dynamics of carotenoids from the thermophilic purple photosynthetic bacterium Thermochromatium tepidum // Photosynth. Res. 2011. V. 107. P. 177–186.
Niedzwiedzki D.M., Swainsbury J.K., Canniffe D.P., Hunter C.N., Hitchcock A. A photosynthetic antenna complex foregoes unity carotenoid-to-bacteriochlorophyll energy transfer efficiency to ensure photoprotection // Proc. Natl. Acad. Sci. USA. 2020. V. 117. P. 6502–6508.
Niwa S., Takeda K., Wang-Otomo Z.-Y., Miki K. Structure of the LH1-RC complex from Thermochromatium tepidum at 3.0 A // Nature. 2014. V. 508. P. 228–232.
Scholz M., Dedic R., Breitenbach T., Hala J. Singlet oxygen-sensitized delayed fluorescence of common watersoluble photosensitizers // Photochem. Photobiol. Sci. 2014. V. 13. P. 1203‒1212.
Razjivin A., Götze J., Lukashev E., Kozlovsky V., Ashikhmin A., Makhneva Z., Moskalenko A., Lokstein H., Paschenko V. Lack of excitation energy transfer from the bacteriochlorophyll soret band to carotenoids in photosynthetic complexes of purple bacteria // J. Phys. Chem. B. 2021. V. 125. P. 3538−3545.
Roszak A.W., Howard T.D., Southall J., Gardiner A.T., Law C.J., Isaacs N.W., Cogdell R.J. Crystal structure of the RC-LH1 core complex from Rhodopseudomonas palustris // Science. 2003. V. 302. 1969–1972.
Takaichi S. Distribution and biosynthesis of carotenoids // The Purple Phototrophic Bacteria / Eds. Daldal F., Thurnauer M.C., Beatty J.T., Hunter C.N. New York: Springer, 2009. P. 97‒117.
Дополнительные материалы отсутствуют.


