Микробиология, 2021, T. 90, № 6, стр. 747-752
Оценка продукции гомосерин лактонов изолятами Pseudomonas spp.
И. Ф. Каримов a, *, Т. О. Федорова a, О. О. Жеребятьева a, С. Д. Борисов a, Е. А. Михайлова a
a Оренбургский государственный медицинский университет
460006 Оренбург, Россия
* E-mail: ifkarimov@yandex.ru
Поступила в редакцию 15.03.2021
После доработки 13.06.2021
Принята к публикации 07.07.2021
Аннотация
Ацильные производные гомосерин лактона являются одними из ключевых факторов межклеточной коммуникации грамотрицательных бактерий. Они обеспечивают коллективное поведение бактерий и активацию вирулентности, устойчивости к действию внешних факторов, образование био-пленок и других свойств, не наблюдающихся у одиночных форм клеток. В работе рассмотрена продукция сигнальных молекул во времени и при изменении температуры семи штаммов Pseudomonas. Установлено, что при 25°C отдельные виды продуцируют большее количество аутоиндукторов на ранних этапах, а при 37°C наблюдается двухфазность процесса их синтеза во внеклеточное пространство.
Бактерии рода Pseudomonas представляют собой обитателей водной и почвенной среды, которые относятся к группе неферментирующих грамотрицательных бактерий. Основываясь на физиологических, включая образование пигмента, структуру колонии и строение жгутика, а также биохимических свойствах, псевдомонад подразделяют на группы и виды (Jun et al., 2015). Филогеномный анализ по данным таксономического дерева NCBI позволил выявить семь групп псевдомонад, пять из которых обладают высокой степенью разнообразия (группы P. fluorescens, P. pertucinogena, P. putida, P. stutzeri и P. syringae), а две другие являются более консервативными и определяются наличием специфических белков (группы P. chlororaphis и P. aeruginosa) (Nicolaidis et al., 2020). Современные методы полногеномного секвенирования позволили выявить особенности нуклеотидной последовательности разных видов и штаммов (Kiewitz, Tümmler, 2000), и на данный момент по информации с портала “The Pseudomonas Genome Database” имеются данные о 613 геномах бактерий рода Pseudomonas, характеризующих 61 вид, из которых наибольшее число секвенированных полных геномов принадлежит P. aeruginosa (215) и P. chlororaphis (47). С другой стороны, изучение некоторых фенотипических свойств по-прежнему остается важной составляющей при описании бактериальных штаммов, так как наличие генов не свидетельствует о наличии признака (Suzuki, 2014), а лишь о возможности его проявления вследствие влияния внешних факторов и регуляторных систем генной экспрессии (Dötsch et al., 2015), что требует более сложного транскриптомного и метаболомного анализа. Подобные исследования являются необходимыми в контексте разработки методов борьбы с микроорганизмами, при этом отдельного внимания заслуживает изучение кворум-зависимых систем, обусловливающих коллективное поведение бактерий, синтез аутоиндукторов и образование биопленок.
Для Pseudomonas характерным является образование различных вариантов N-ацетил-гомосерин лактона (АГЛ) и регуляции с их помощью работы подконтрольных генов, построенной по типу LuxI‒LuxR систем. Она наиболее охарактеризована для P. aeruginosa, которая продуцирует два типа АГЛ и синтезирует три вида рецепторных белков: LasR, RhlR и QscR. При этом последний, не имея своей соответствующей АГЛ-синтазы, способен воспринимать различные виды ацил-производных гомосерин лактона (Chugani, Greenberg, 2014). Регуляторные ансамбли системы чувства кворума запускают ряд стрессорных генов и факторов патогенности, в том числе образование биопленки (Alayande et al., 2018). В настоящий момент направление по поиску возможности разобщения коммуникационных сигналов у бактерий является одним из перспективных в науке (Bali et al., 2019; Liu et al., 2020). Известно, что для P. aeruginosa типичными АГЛ являются N-бутирил-L-гомосерин лактон и N-(3-оксододеканоил)-L-гомосерин лактон (Smith, Iglewski, 2003), запускающих, соответственно, работу рецепторных белков LasR и RhlR. Иные виды Pseudomonas осуществляют синтез более широкого, но структурно близкого ряда ауторегуляторов, например, для P. putida характерно образование гомосерин лактонов с ацильными хвостами с длиной углеродного хвоста от 6 до 14 атомов (Dubern et al., 2006). Другие группы неферментирующих грамотрицательных бактерий, помимо АГЛ-ассоциированных (Gotschlich et al., 2001), имеют системы чувства кворума, построенные не на производных гомосерин лактона, а на различных производных цис-2-ненасыщенных жирных кислот (Wang et al., 2020).
Согласно классической схеме работы системы чувства кворума LuxI‒LuxR типа, накопление АГЛ является плотностно-зависимым процессом, и концентрация аутоиндуктора в среде растет с течением времени (Miller, Bassler, 2001). Тем не менее, наблюдаются штаммовые различия в продукции сигнальных молекул, в том числе и у P. aeruginosa, разница между которыми может достигать одного порядка (Favre-Bonté et al., 2007). Однако в некоторых случаях процесс накопления АГЛ является стадийным и может иметь несколько максимумов, сменяющихся падением концентрации (Fekete et al., 2010). Такая динамика может определяться последовательным включением регуляторных генов (Beasley et al., 2020) или спонтанной деградацией аутоиндукторов до гомосерин лактона или гомосерина (Huang et al., 2003), причем последнее может зависеть также от температуры культивирования и кислотности среды (Yates et al., 2002). Для P. putida была показана динамика активности гена ppuI, кодирующего АГЛ-синтазу, пик который приходится на девятый час жизни культуры, однако не было описано наличие ацилгомосерин лактона в среде (Bertani, Venturi, 2004).
Целью нашей работы было изучение продукции АГЛ во времени и разных температурных условиях выделенными изолятами Pseudomonas spp., характеризующимися свободным образом жизни или ассоциированными с инфекционным процессом. Обсуждается роль динамичного изменения количества аутоиндуктора во внешней среде в коллективной жизни бактериальных клеток.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Бактериальные штаммы получали путем высева из мочи, раневого отделяемого, мокроты, крови, отделяемого уха, почвы широколиственного леса на модифицированную среду Кинг А (“HiMedia”, Индия), после чего отбирали колонии для оценки типа метаболизма в ОФ-тесте, а также наличия цитохромоксидазы с использованием тест-полосок OXY-test (“Lachema”, Чехия). Чистую культуру идентифицировали с использованием реактивов и тест систем НЕФЕРМтест 24 (“Lachema”, Чехия) и API 20 NE (“bioMereuix”, Франция). Для этого готовили суспензию бактерий в 0.9% растворе хлорида натрия с плотностью 2.0 единицы по МакФарланду путем сравнения с эталонным раствором, представляющим собой смесь 0.2 мл 1% раствора BaCl2 (“Химреактивснаб”, Россия) и 9.8 мл 1% раствора H2SO4 (“Химреактивснаб”, Россия). Полученную суспензию по 100 мкл вносили в лунки трех стрипов набора, а в первые пять лунок дополнительно перекрывали парафиновым маслом. Плашку инкубировали в течение 24 и 48 ч при 37°C в термостате ТС-1/80 (“Смоленское СКТБ СПУ”, Россия), после чего анализировали полученные результаты с использованием книги кодов для наборов тест-систем.
Аутоиндукторы получали путем культивирования бактерий в LB-бульоне (“Sigma-Aldrich”, США) в течение 24 ч при 25 или 37°C с отбором проб на 6, 12 и 24 ч выращивания. После этого клетки осаждали при 12 100 g на центрифуге MiniSpin с ротором F-45-12-11 (“Eppendorf”, Германия), а надосадочную жидкость отбирали для дальнейшего исследования.
Для определения количества аутоиндуктора в полученном супернатанте был использован рекомбинантный штамм Salmonella typhimurium LT2 rck:lux, в котором промотор гена устойчивости к действию системы комплемента (rck) подконтрольный регулятору SdiA семейства LuxR-белков был клонирован перед кассетой генов свечения luxC-DABE Photorhabdus luminescens ZM1. Результатом активации данного промотора является дозозависимая индукция свечения, отражающая присутствие аутоиндукторов первого типа в среде. В качестве контроля активности биосенсоров использовали N-(3-оксо)-гексаноил-L-гомосерин лактон (“Sigma-Аldrich”, США). Для данного метода использовалась суточная культура бактерий S. typhimurium LT2 rck:lux, выращенная на агаре LB (“Sigma-Aldrich”, США) с добавлением 100 мкг/мл ампициллина в качестве селективного фактора. Культуру клеток смывали стерильным бульоном LB до концентрации 107 кл./мл и дополнительно подращивали до экспоненциальной фазы роста в течение 90 мин при 37°C и 180 об./мин на шейкере OS-20 (“BioSan”, Латвия) в термостате ТС-1/80 (“Смоленское СКТБ СПУ”, Россия). Суспензию бактерий вносили по 100 мкл в непрозрачные лунки планшета для биолюминесцентного анализа, в которых уже были добавлены по 100 мкл испытуемой смеси супернатанта, содержащего аутоиндукторы, либо по 100 мкл бульона в лунках, используемых в качестве контролей. Измерение кинетики свечения проводилось в течение 2 ч с помощью планшетного люминометра LM-01T (“Immunotech”, Чехия) и прилагаемого программного обеспечения Kilia.
Оценку формирования биопленки изолятами проводили с помощью полистироловых микропланшетов. Для этого готовили суспензию клеток LB-бульоне (“Sigma-Aldrich”, США) до оптической плотности 0.10 единиц против чистой среды путем измерения 200 мкл суспензии в прозрачных лунках стрипованного планшета (“НИИ Медполимер”, Россия) при длине волны 535 нм на фотометре StatFax303+ VIS (“Awareness”, США). Полученную суспензию инкубировали 18 ч при 37°C в термостате ТС-1/80 (“Смоленское СКТБ СПУ”, Россия), а затем разбавляли в соотношении 1 : 100 свежим LB бульоном и по 100 мкл полученной суспензии переносили в 96-луночный планшет. Инкубировали при 37°C в течение 24 ч без встряхивания, после чего аккуратно промывали планшет водой для удаления планктонных форм клеток, добавляли по 200 мкл 0.1% водного раствора кристаллического фиолетового и оставляли на 15 мин. Затем удаляли краситель и аккуратно промывали планшет водой от остатков несвязанного красителя, после чего добавляли по 200 мкл 95% этанола. Полученный окрашенный раствор переносили в новый планшет и замеряли оптическую плотность на фотометре StatFax 303+ VIS при длине волны 590 нм.
Расчеты средней арифметической, ошибки средней арифметической, а также статистическую значимость различий осуществляли путем расчета порогового t-критерия Стьюдента при заданном уровне значимости 0.05 с использованием программы Excel 2007 (“Microsoft”, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученные изоляты неферментирующих грамотрицательных бактерий с использованием набор тест-систем были идентифицированы как Pseudomonas aeruginosa (штамм CI2) из мочи больного уретритом, P. aeruginosa (штамм CI3) из раневого отделяемого, P. aeruginosa (штамм CI8) из мокроты, P. putida (штамм TP307) из крови, P. luteola (штамм TL5) из почвы широколиственного леса, P. fluorescens (штамм TF17) из отделяемого уха больного отитом и P. alcaligenes (штамм TA84) из раневого отделяемого.
Оценка присутствия аутоиндукторов в суточной культуре, выращенной при 25 и 37°C, показала, что не все из рассматриваемых штаммов способны к продукции АГЛ (рис. 1). В частности, супернатанты от двух штаммов (P. aeruginosa CI2 и P. putida TP307) характеризовались низким (достоверно не отличимым от фонового) уровнем свечения и не имели отличий в зависимости от температуры выращивания бактериальных культур. При этом биопленку образовывали все штаммы, но у P. fluorescens TF17 и P. alcaligenes TA84 данная надклеточная структура содержала на 22 и 41% меньше общей биомассы.
Рис. 1.
Индукция свечения биосенсора под воздействием супернатанта культур псевдомонад, культивированных в течение 24 ч при 25°C (1 ‒ светлые столбцы) и 37°C (2 ‒ темные столбцы).
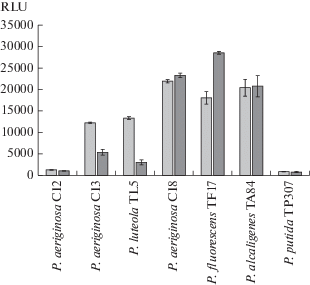
Эффект отсутствия аутоиндукторов может быть связан либо с дефектом продукции АГЛ, либо продукцией сигнальных молекул, не регистрируемых используемым люминесцирующим биосенсором. В частности, изучение физиологических свойств P. fluorescens, выделенного из молока, показало отсутствие продукции аутоиндукторов первого типа, но при этом было зарегистрировано формирование биопленок (Martins et al., 2014). В то же время, использованный сенсорный штамм, у которого сенсорным гомологом LuxR является белок SdiA, имеет большую степень сродства к гомосерин лактонам с длиной алкильного хвоста 6‒10 атомов углерода (Michael et al., 2001).
Культуры клеток P. aeruginosa (штаммы CI3 и CI8), P. luteola TL5, P. fluorescens TF17 и P. alcaligenes TA84 синтезировали АГЛ, однако в неодинаковом количестве, и, в некоторых случаях, этот процесс зависел от температуры выращивания бактерий. Наибольшее количество аутоиндуктора было зарегистрировано в супернатанте P. fluorescens TF17, культивированной в течение 1 сут при 37°C, но рост при 25°C привел к меньшему на треть выходу сигнальных молекул. С другой стороны, для штамма P. aeruginosa CI8 подобная разница продуктивности весьма незначительна, а для P. alcaligenes TA84 не было обнаружено выраженного влияния температуры культивирования на синтез АГЛ. Напротив, для штаммов P. aeruginosa CI3 и P. luteola TL5 зарегистрирован обратный эффект, заключающийся в более высокой продукции АГЛ при 25°C и снижению синтеза сигнальных молекул при 37°C. Действительно, температура, как один из ключевых факторов внешней среды, определяет не только скорость роста популяции в целом, но и запуск отдельных генов, в том числе и стресс-генов, стабильность белковых комплексов и, как следствие, продукцию аутоиндукторов, что позволяет клеткам адаптироваться к условиям и формировать стратегию клеточного ответа (Hansen et al., 2015; Li et al., 2018; Mizan et al., 2018). Помимо этого, изменение температуры может вести к лактонолизу и формированию линейных форм молекул, не обладающих индукционной активностью по отношению к рецепторным белкам (Yates et al., 2002).
Далее нами было определено присутствие аутоиндукторов в среде культивирования бактерий при 25 и 37°C на 6, 12 и 24 ч роста клеток (рис. 2). Три штамма, для которых ранее не было обнаружено продукции АГЛ, на ранних сроках роста также не синтезировали данные соединения. Однако в режиме культивирования при 25°C для других пяти культур наблюдалось снижение количества аутоиндуктора в среде с течением времени. Так, максимальный ответ биосенсора был получен от надосадочной жидкости, отобранной от штамма P. aeruginosa CI8 на шестом часу культивирования, причем через 6 ч наблюдалось резкое снижение концентрации аутоиндукторов на 45%, а в суточной культуре снижение происходило еще на 19%. Наибольшая относительная остаточная концентрация АГЛ на 24 ч инкубации (по сравнению с шестым часом существования культуры) была характерна для штамма P. alcaligenes TA84. В этом случае было зарегистрировано изменение отклика сенсорного штамма с 35 777 ± 277 до 20 409 ± ± 1953 RLU, что составляет 57%. В целом, при таком температурном режиме штаммы показывают сходную динамику продукции аутоиндукторов, характеризующуюся максимумом на шестом часу и дальнейшим снижением до уровня 57‒75% на 12 ч и остатком в 36‒57% на 1 сут культивирования.
Рис. 2.
Определение продукции АГЛ в супернатанте культур псевдомонад, культивированных при 25°C (а) и 37°C (б). Обозначения: 1 – P. aeriginosa CI2; 2 – P. aeriginosa CI3; 3 – P. luteola TL5; 4 – P. aeriginosa CI8; 5 – P. fluorescens TF17; 6 – P. alcaligenes TA84; 7 – P. putida TP307.
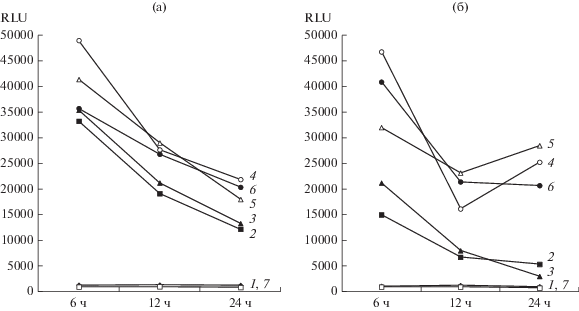
Картина продукции аутоиндукторов во времени значительно изменяется при культивировании бактериальных изолятов при температуре 37°C. Для штаммов P. aeruginosa CI3, P. luteola TL5 и P. fluorescens TF17 зарегистрировано снижение продукции АГЛ на шестой час роста культуры на 55, 41 и 23% соответственно по сравнению с ростом при комнатной температуре. Остальные штаммы к данному временному интервалу существования культуры выработали объем ацильных производных гомосерин лактона, достоверно не отличимое от результатов, полученных в ходе культивирования при 25°C. Примечательным является тот факт, что все штаммы, для которых зарегистрировано наличие АГЛ в надосадочной жидкости, гораздо быстрее теряли данный экзопродукт при 37°C на 12 ч культивирования. По всей видимости, этот эффект связан с более высокой скоростью роста клеток и более ранним включением системы чувства кворума, что привело к связыванию свободных молекул аутоиндуктора и понижению его концентрации во внешней среде.
Помимо этого, для штаммов P. aeruginosa CI8 и P. fluorescens TF17 был зарегистрирован второй всплеск продукции аутоиндукторов на 24 часу культивирования при 37°C, характеризующийся увеличением содержания сигнальных молекул на 44 и 23% соответственно. Подобная двухфазность продукции сигнальных молекул связана с особенностями регуляции системы Quorum sensing у псевдомонад. После активации регуляторных белков происходит также индукция экспрессии генов АГЛ-синтазы, что ведет к увеличению продукции производных гомосерин лактона (Jimenes et al., 2012). К тому же белки семейства LuxR уже находятся в связи с аутоиндукторами, и вновь образующиеся молекулы оказываются свободными и выходят во внешнюю среду (Lee, Zhang, 2015; Turkina, Vikström, 2019). С другой стороны, для штаммов P. aeruginosa CI3 и P. luteola TL5 было зарегистрировано снижение продукции АГЛ, хотя кривая интенсивности падения при 37°C была более сглаженная, чем при 25°C, что может быть связано с общим низким выходом аутоиндукторов при данной температуре культивирования.
Таким образом, результаты демонстрируют различия в продукции аутоиндукторов первого типа различными видами и штаммами псевдомонад, зависимость данного процесса от температуры культивирования, а также изменение содержания сигнальных молекул в среде с течением времени. Подобные физиологические особенности необходимо рассматривать как в контексте исследования систем чувство кворума бактерий, так и поиска методов борьбы с бактериальными инфекциями (Mahan et al., 2020) путем регулирования межклеточной сигнализации.
Список литературы
Alayande A.B., Aung M.M., Kim I.S. Correlation between quorum sensing signal molecules and Pseudomonas aeruginosa’s biofilm development and virulency // Curr. Microbiol. 2018. V. 75. P. 787‒793.
Bali E.B., Türkmen K.E., Erdönmez D., Sağlam N. Comparative study of inhibitory potential of dietary phytochemicals against quorum sensing activity of and biofilm formation by Chromobacterium violaceum 12472, and swimming and swarming behaviour of Pseudomonas aeruginosa PAO1 // Food Technol. Biotechnol. 2019. V. 57. P. 212‒221.
Beasley K.L., Cristy S.A., Elmassry M.M., Dzvova N., Colmer-Hamood J.A., Hamood A.N. During bacteremia, Pseudomonas aeruginosa PAO1 adapts by altering the expression of numerous virulence genes including those involved in quorum sensing // PLoS One. 2020. V. 15. e0240351.
Bertani I., Venturi V. Regulation of the N-acyl homoserine lactone-dependent quorum-sensing system in rhizosphere Pseudomonas putida WCS358 and cross-talk with the stationary-phase RpoS sigma factor and the global regulator GacA // Appl. Environ. Microbiol. 2004. V. 70. P. 5493‒5502.
Chugani S., Greenberg E.P. An evolving perspective on the Pseudomonas aeruginosa orphan quorum sensing regulator QscR // Front. Cell. Infect. Microbiol. 2014. V. 4. Art. 152.
Dötsch A., Schniederjans M., Khaledi A., Hornischer K., Schulz S., Bielecka A., Eckweiler D., Pohl S., Häussler S. The Pseudomonas aeruginosa transcriptional landscape is shaped by environmental heterogeneity and genetic variation // mBio. 2015. V. 6. e00749-15.
Dubern J.F., Lugtenberg B.J., Bloemberg G.V. The ppuI-rsaL-ppuR quorum-sensing system regulates biofilm formation of Pseudomonas putida PCL1445 by controlling biosynthesis of the cyclic lipopeptides putisolvins I and II // J. Bacteriol. 2006. V. 188. P.2898‒2906.
Favre-Bonté S., Chamot E., Köhler T., Romand J.A., van Delden C. Autoinducer production and quorum-sensing dependent phenotypes of Pseudomonas aeruginosa vary according to isolation site during colonization of intubated patients // BMC Microbiol. 2007. V. 7. Art. 33.
Fekete A., Kuttler C., Rothballer M., Hense B.A., Fischer D., Buddrus-Schiemann K., Lucio M., Müller J., Schmitt-Kopplin P., Hartmann A. Dynamic regulation of N-acyl-homoserine lactone production and degradation in Pseudomonas putida IsoF // FEMS Microbiol. Ecol. 2010. V. 72. P. 22‒34.
Gotschlich A., Givskov M., Molin S., Eberl L. The cep quorum-sensing system of Burkholderia cepacia H111 controls biofilm formation and swarming motility // Microbiology (SGM). 2001. V. 147. P. 2517‒2528.
Hansen H., Purohit A.A., Leiros H.K., Johansen J.A., Kellermann S.J., Bjelland A.M., Willassen N.P. The autoinducer synthases LuxI and AinS are responsible for temperature-dependent AHL production in the fish pathogen Aliivibrio salmonicida // BMC Microbiol. 2015. V. 15. Art. 69.
Huang J.J., Han J.I., Zhang L.H., Leadbetter J.R. Utilization of acyl-homoserine lactone quorum signals for growth by a soil pseudomonad and Pseudomonas aeruginosa PAO1 // Appl. Environ. Microbiol. 2003. V. 69. P. 5941‒5949.
Jimenez P.N., Koch G., Thompson J.A., Xavier K.B., Cool R.H., Quax W.J. The multiple signaling systems regulating virulence in Pseudomonas aeruginosa // Microbiol. Mol. Biol. Rev. 2012. V. 76. P. 46‒65.
Jun S.R., Wassenaar N.M., Nookaew I., Hauser L., Wanchai V., Land M., Timm C.M., Lu T.Y.S., Schadt C.W., Doktycz M.J., Pelletier D.A., Ussery D.V. Diversity of Pseudomonas genomes, including populus-associated isolates, as revealed by comparative genome analysis // Appl. Environ. Microbiol. 2015. V. 82. P. 375‒383.
Kiewitz C., Tümmler B. Sequence diversity of Pseudomonas aeruginosa: impact on population structure and genome evolution // J. Bacteriol. 2000. V. 182. P. 3125‒3135.
Lee J., Zhang L. The hierarchy quorum sensing network in Pseudomonas aeruginosa // Protein Cell. 2015. V. 6. P. 26‒41.
Li T., Yang B., Li X., Li J., Zhao G., Kan J. Quorum sensing system and influence on food spoilage in Pseudomonas fluorescens from turbot // J. Food Sci. Technol. 2018. V. 55. P. 3016‒3025.
Liu J., Sun X., Ma Y., Zhang J., Xu C., Zhou S. Quorum quenching mediated bacteria interruption as a probable strategy for drinking water treatment against bacterial pollution // Int. J. Environ. Res. Public. Health. 2020. V. 17. P. 9539.
Mahan K., Martinmaki R., Larus I., Sikdar R., Dunitz J., Elias M. Effects of signal disruption depends on the substrate preference of the lactonase // Front. Microbiol. 2020. V. 14. Art. 3003.
Martins M.L., Uelinton M.P., Riedel K., Vanetti M.C.D., Mantovani H.C., Araújo E.F. Lack of AHL-based quorum sensing in Pseudomonas fluorescens isolated from milk // Braz. J. Microbiol. 2014. V. 45. P. 1039‒1046.
Michael B., Smith J.N., Swift S., Heffron F., Ahmer B.M. SdiA of Salmonella enterica is a LuxR homolog that detects mixed microbial communities // J. Bacteriol. 2001. V. 183. P. 5733‒5742.
Miller M.B., Bassler B.L. Quorum sensing in bacteria // A-nnu. Rev. Microbiol. 2001. V. 55. P. 165‒199.
Mizan M.F.R., Jahid I.K., Park S.Y., Silva J.L., Kim T.J., Myoung J., Ha S.D. Effects of temperature on biofilm formation and quorum sensing of Aeromonas hydrophila // Ital. J. Food Sci. 2018. V. 30. P. 456‒466.
Nikolaidis M., Mossialos D., Oliver S.G., Amoutzias G.D. Comparative analysis of the core proteomes among the pseudomonas major evolutionary groups reveals species-specific adaptations for Pseudomonas aeruginosa and Pseudomonas chlororaphis // Diversity. 2020. V. 12. Art. 289.
Smith R.S., Iglewski B.H. Pseudomonas aeruginosa quorum sensing as a potential antimicrobial target // J. Clin. Invest. 2003. V. 112. P. 1460‒1465.
Suzuki S., Horinouchi T., Furusawa C. Prediction of antibiotic resistance by gene expression profiles // Nat. Commun. 2014. V. 5. Art. 5792. https://doi.org/10.1038/ncomms6792
Turkina M.V., Vikström E. Bacteria-host crosstalk: Sensing of the quorum in the context of Pseudomonas aeruginosa infections // J. Innate Immun. 2019. V. 11. P. 263‒279.
Wang H., Liao L., Chen S., Zhang L.H. A quorum quenching bacterial isolate contains multiple substrate-inducible genes conferring degradation of diffusible signal factor // Appl. Environ. Microbiol. 2020. V. 86. e02930-19.
Yates E.A., Philipp B., Buckley C., Atkinson S., Chhabra S.R., Sockett R.E., Goldner M., Dessaux Y., Cámara M., Smith H., Williams P. N-acylhomoserine lactones undergo lactonolysis in a pH-, temperature-, and acyl chain length-dependent manner during growth of Yersinia pseudotuberculosis and Pseudomonas aeruginosa // Infect. Immun. 2002. V. 70. P. 5635‒5646.
Дополнительные материалы отсутствуют.


