Микробиология, 2021, T. 90, № 6, стр. 681-691
Микробное разнообразие грунтов архипелага Земля Франца-Иосифа, загрязненных нефтепродуктами
Е. М. Семенова a, *, Т. Л. Бабич a, Д. Ш. Соколова a, А. С. Добрянский b, А. В. Корзун c, Д. Р. Крюков d
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Институт географии РАН
119017 Москва, Россия
c МГУ имени М.В. Ломоносова
119991 Москва, Россия
d Национальный парк “Русская Арктика”
163051 Архангельск, Россия
* E-mail: semenova_inmi@mail.ru
Поступила в редакцию 20.06.2021
После доработки 18.07.2021
Принята к публикации 18.07.2021
Аннотация
В настоящей работе исследованы филогенетическое разнообразие и потенциальная функциональная активность микроорганизмов образцов арктических грунтов, в различной степени загрязненных углеводородами. Методом высокопроизводительного секвенирования V4 региона гена 16S рРНК показано преобладание в библиотеках из загрязненных грунтов последовательностей бактерий филумов Proteobacteria и Actinobacteria. Доля последовательностей бактерий филумов Acidobacteria, Chloroflexi и Gemmatimonadetes была ниже в библиотеках образцов загрязненных грунтов по сравнению с образцами, не загрязненными углеводородами. Выявлены последовательности генов 16S рРНК потенциальных нефтедеструкторов родов Alkanindiges, Aquabacterium, Polaromonas, Pseudomonas, Sphingomonas. Численность культивируемых углеводородокисляющих бактерий (УОБ) в пробах грунта, определяемая при 5 и 15°C, варьировала от 104 до 106 кл/г грунта. Выделено 13 чистых культур УОБ, принадлежащих к родам Arthrobacter, Bacillus, Brevibacillus, Janthinobacterium, Paenibacillus, Pseudomonas, Rhodococcus, Sphingomonas, способных использовать углеводороды, снижая поверхностное натяжение среды. Полученные сведения расширяют имеющиеся представления о составе и физиологических особенностях микробных сообществ арктических грунтов.
В настоящее время освоение Арктики приобретает все большее значение. Арктические территории могут содержать около 90 млрд баррелей нефти, 47 трл м3 природного газа и 44 млрд баррелей сжиженного природного газа. Более половины (58%) разведанных запасов приходится на территорию России (Henderson, Loe, 2014). Помимо добычи полезных ископаемых, Арктический регион – место развития туризма и научной деятельности.
С ростом социально-экономической активности в регионе неизбежно возрастают экологические риски. Основной загрязнитель арктических почв – нефтепродукты (в том числе дизельное топливо), которые используются для отопления, получения электричества, заправки техники. Разливы топливанеизбежны при его транспортировке и хранении. В опубликованных обзорах проанализирован рост числа публикаций, посвященных очистке от углеводородов (УВ) в холодных регионах (Verasoundarapandian et al., 2021; Yap et al., 2021). По данным этих исследователей, наибольшее число публикаций посвящено очистке от дизельного топлива.
Особенности климата Арктики и логистические трудности приводят к тому, что применение здесь физических, химических и термических методов очистки от углеводородов нерентабельно (Naseri et al., 2014). Одним из возможных решений задачи по очистке природных экосистем является биоремедиация, т.е. использование метаболических способностей природной микрофлоры. Биоремедиация – широко применяемый, экологически безопасный и экономичный способ очистки почв и водоемов от нефти и нефтепродуктов, однако в условиях высоких широт, возникают дополнительные трудности при его использовании (Kim et al., 2018; Yap et al., 2021).
Арктические условия характеризуются чрезвычайно низкими значениями температуры в зимний период, сильными ветрами, малым количеством осадков летом и нехваткой азота и фосфора в арктических почвах и грунтах (Malard, Pearce, 2018; Yap et al., 2021). Зачастую микроорганизмы подвергаются сразу нескольким стрессовым факторам, включающим низкую температуру и высокую соленость среды обитания. Микробное окисление углеводородов было зарегистрировано при ‒6°C в загрязненных почвах Шпицбергена (Rike et al., 2005). Минимальная температура, при которой в настоящее время зарегистрирована микробная активность, составляет ‒20°C (Rivkina et al., 2000).
Микробные сообщества полярных почв и грунтов и их метаболический потенциал слабо изучены (Harding et al., 2011; Rizzo et al., 2019; Hidalgo et al., 2020). В Генбанке мало представлены сведения о бактериальных сообществах холодных регионов, особенно выделенных из почв северных широт России (Malard, Pearce, 2018).
Целью настоящей работы было определение состава микробных сообществ проб арктических грунтов с различной степенью загрязнения дизельным топливом, отобранных на территории Национального парка “Русская Арктика” (архипелаг Земля Франца-Иосифа), и оценка способности этих сообществ и чистых культур микроорганизмов использовать углеводороды при низкой температуре.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
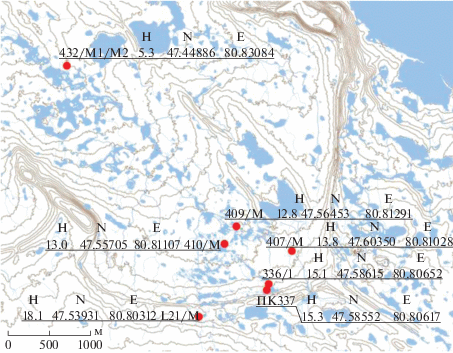
Объекты исследования. Пробы грунта отбирали летом 2019 г. на острове Земля Александры архипелага Земля Франца-Иосифа на территории Национального парка “Русская Арктика” в очаге загрязнения грунтов нефтепродуктами. Пробы отбирали на площадке, где до 2015 г. размещались склады горюче-смазочных материалов (ГСМ) (преимущественно дизельного топлива), а также в зоне миграции нефтепродуктов от очага загрязнения с поверхностным стоком и грунтовыми надмерзлотными водами (рис. 1). Усредненные по глубине пробы грунта отбирали из сезонно-талого слоя с глубины до 40 см. Пробы L21/M, ПК337, 336/1, 407/М, 409/М, 410/М представляют собой грунт разной степени загрязнения нефтепродуктами. Проба 432/М1 отобрана с поверхности береговых отложений временного водотока, проба 432/М2 – из донных отложений того же водотока. Обе пробы отобраны за пределами зоны распространения загрязнения.
Рис. 1.
Схема мест отбора проб грунтов на о. Земля Александры архипелага Земля Франца-Иосифа. H – высота над уровнем моря, N – С.Ш., E – З.Д.
Мерзлотные почвы архипелага Земля Франца-Иосифа представлены псаммоземами (Cryosol (Arenic)), пелоземами (Cryosol (Loamic)), криоземами (Oxyaquic Cryosols), литоземами (Leptosols (Loamic)) и серогумусовыми (Cryosols (Loamic, Humic)). Наибольшие запасы органического углерода обнаружены в литоземах грубогумусированных в условиях защиты от сильных ветров (23.2 кг С/м2 в верхнем полуметровом слое), а также в пелоземах и псаммоземах, содержащих погребенное криотурбациями органическое вещество (13.7 и 20.7 кг С/м2 соответственно) (Никитин и соавт., 2020).
Состав питательных сред, условия культивирования и учета микроорганизмов. Для получения микробной суспензии усредненную навеску образцов грунта и осадков массой 10 г вносили в 90 мл стерильной водопроводной воды и перемешивали на качалке в течение 30 мин со скоростью 120 об./мин. Полученную суспензию выдерживали 5 мин для осаждения твердой фазы. Водную фракцию использовали для выделения ДНК и засева жидких селективных питательных сред. Численность микроорганизмов определяли путем посева суспензии в жидкие питательные среды методом предельных десятикратных разведений в двух повторностях. Результаты оценивали методом наиболее вероятного числа по таблице Мак Креди. Все посевы микроскопировали с помощью эпифлуоресцентного микроскопа Axio Imager.D1 (“Carl Zeiss”, Германия) с цифровой камерой Axio Cam HRc и компьютерным программным обеспечением Axio Vision.
Анализируемые группы включали аэробные органотрофные, олиготрофные и углеводородокисляющие микроорганизмы. Численность аэробных органотрофных микроорганизмов оценивали в среде следующего состава (г/л): бакто-триптон – 5.0; дрожжевой экстракт – 2.5; глюкоза – 1.0; NaCl – 1.0; микроэлементы – 1 мл; рН 7.0–7.2. Олиготрофные микроорганизмы учитывали в среде состава (г/л): Na2HPO4 – 0.8; KH2PO4 – 0.5; NH4Cl – 0.5; MgSO4 – 0.2; CaCl2 · 2H2O – 0.1; NaCl – 1.0; микроэлементы – 1 мл; дрожжевой экстракт – 0.05; рН 7.2. Углеводородокисляющие микроорганизмы учитывали в среде состава (г/л): KH2PO4 – 0.75; K2HPO4 – 1.5; NH4Cl – 1.0; NaCl – 1.0; KCl – 0.1; MgSO4 – 0.2; CaCl2 · 2H2O – 0.02; микроэлементы – 1 мл. В качестве субстрата вносили стерильное дизельное топливо в концентрации 0.5 об. %. Значение рН составляло 7.0–7.2. Посевы инкубировали при 15°C в течение 10 сут и при 5°C в течение 28 сут.
Чистые культуры олиготрофных и углеводородокисляющих микроорганизмов выделяли методом последовательных пересевов, используя агаризованные среды того же состава, посевы инкубировали при 5 и 15°C. В качестве субстрата для углеводородокисляющих микроорганизмов использовали стерильное дизельное топливо, каплю которого распределяли шпателем по поверхности плотной среды. Интервал и оптимум содержания NaCl в среде для роста микроорганизмов определяли на среде LB, содержащей (г/л): бакто-триптон – 10.0; дрожжевой экстракт – 5.0; с разным содержанием NaCl. Температурные границы роста определяли на среде LB с оптимальным для каждого штамма содержанием NaCl. Посевы инкубировали стационарно в течение 7 сут при 5 или 15°C.
Аналитические методы. Белок в культуральной жидкости накопительных культур определяли методом Лоури. Величину поверхностного и межфазного натяжения на границах раздела фаз культуральная жидкость/воздух и культуральная жидкость/гексадекан, соответственно, определяли при комнатной температуре методом отрыва кольца с помощью полуавтоматического тензиометра Surface Tensiomat 21 (“Cole-Parmer”, США). Индекс эмульгирования Е24 рассчитывали через 24 ч после добавления к 1 мл культуральной жидкости 1 мл гексадекана и интенсивного встряхивания в течение 3 мин и выражали в процентах, которые составляла эмульсия от объема смеси. Контролем служила стерильная питательная среда.
Рост на дизельном топливе определяли по изменению содержания н-алканов в составе алифатической фракции после культивирования относительно контрольной пробы (Борзенков и соавт., 2006).
Выделение ДНК, амплификация и секвенирование гена 16S рРНК. Идентификацию чистых культур и определение состава микробного сообщества проводили методом анализа гена 16S рРНК. ДНК из полученной суспензии и чистых культур выделяли, используя набор Pure Link Microbiome DNA Purification KIT (“Thermo Fisher Scientific”, США), в соответствии с рекомендациями производителя. Для определения последовательности гена 16S рРНК чистых культур ДНК амплифицировали с использованием универсальных праймеров 8-27f и 1492r. Для получения библиотек генов 16S рРНК микробных сообществ анализируемых проб был амплифицирован V4 гипервариабельный регион этого гена на основе двойного баркодирования. Библиотеки V4 региона гена 16S рРНК были созданы и использованием следующих праймеров: прямого (5'-CAAGCAGAAGACGGCATACGAGATGTACTGGAGTTCAGACGTGTGCTCTTCCGATCT XXXXXX ZZZZ GTGBCAGCMGCCGCGGTAA-3') и обратного (5'-AAT-GATACGGCGACCACCGAGATCTACACTCTTTC-CCTACACGACGCTCTTCCGATCT XXXXXX ZZZZ GACTACNVGGGTMTCTAATCC-3') (Merkel et al., 2019). Секвенирование проводили на платформе MiSeq (“Illumina”, США) c использованием набора реагентов MiSeqReagentKitv3 (600 циклов) (“Illumina”, США) в соответствии с рекомендациями производителя.
Биоинформатический анализ. Получение библиотек фрагментов последовательностей гена 16S рРНК, функциональных профилей и прогнозирование индивидуальных профилей ферментов метаболизма бензоата, нафталина и полиароматических углеводородов выполняли, как было описано ранее (Семенова и соавт., 2020). Тепловые карты функциональных профилей, предсказанных для сообществ, построены с использованием интернет-ресурса ClustVis (http://biit.cs.ut.ee/ clustvis/, май 2021 г.).
Полученные последовательности гена 16S рРНК микробных сообществ и чистых культур были депонированы в ГенБанке под номерами PRJNA738511 и MZ411475–MZ411487 соответственно.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
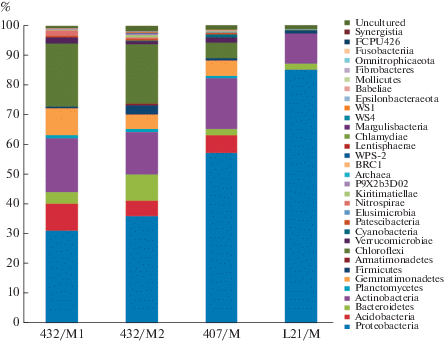
Филогенетическое разнообразие прокариот в пробах арктических грунтов. Методом высокопроизводительного секвенирования V4 региона гена 16S рРНК был определен состав микробных сообществ в четырех пробах грунтов: 432/М1, 432/М2, 407/М и L21/М. В результате анализа было получено четыре библиотеки, содержащих суммарно 45 457 фрагментов генов (ридов). На рис. 2 представлено филогенетическое разнообразие прокариот в исследуемых пробах на уровне филума. Микробные сообщества незагрязненных дизелем проб грунта 432/M1 и 432/M2, отобранных с разной глубины, имели похожий состав микроорганизмов. Доля последовательностей представителей домена Archaea в библиотеках из незагрязненных грунтов была низка и составляла 0.03–0.09% от общего количества последовательностей и снижалась до 0.01% в библиотеках из загрязненных проб грунта. В полученных библиотеках преобладали последовательности гена 16S рРНК, принадлежащие представителям филума Proteobacteria, причем их доля возрастала с увеличением степени загрязненности грунта углеводородами. Известно, что многие нефтеокисляющие микроорганизмы принадлежат к филуму Proteobacteria, поэтому увеличение их представленности в сообществе может быть связано с откликом микробного сообщества на загрязнение грунта углеводородами. Доля последовательностей бактерий филумов Ac-idobacteria, Chloroflexi и Gemmatimonadetes, напротив, снижалась в загрязненных нефтепродуктами участках. По-видимому, УВ ингибировали развитие представителей указанных филумов. Доля последовательностей Actinobacteria варьировала в пределах 14–18% и только в пробе L21/M снижалась до 10%.
Рис. 2.
Таксономическая классификация (на уровне филумов/классов) в библиотеках фрагментов гена 16S рРНК прокариотных сообществ исследованных образцов арктических грунтов.
На рис. 3 приведена тепловая карта биоразнообразия исследованных сообществ на родовом уровне. В библиотеках из незагрязненных проб преобладали последовательности некультивируемых Chloroflexi (54 и 40.6% от общего числа последовательностей), которые практически отсутствовали в пробах загрязненных почв. В библиотеке пробы L21/M доминировали последовательности представителей родов Gallionella и Sulfuriferula. Значительное количество выявленных последовательностей гена 16S рРНК принадлежало бактериям родов Galbitalea, Pseudomonas, Rhodoferax. В сообществе пробы 407/М доминировали представители родов Oryzihumus, Sulfuritalea, Rhizobacter и Polaromonas. Выявленные бактерии характерны для почвенных сообществ, в том числе, олиготрофных. Пурпурные несерные бактерии рода Rhodoferaх ранее были выявлены в составе микробных сообществ снега и воздуха Арктических островов Канады (Harding et al., 2011). Представители родов Oryzihumus и Rhizobacter – обычные обитатели почв. Бактерии рода Oryzihumus были выявлены молекулярно-биологическими методами в почвах субарктической тундры, а представители Rhizobacter – в составе микробных матов антарктических почв (Kim et al., 2014; Tytgat et al., 2014). Бактерии родов Janthinobacterium, Geobacter, Sphingomonas, Gallionella и Pedobacter часто выявляют в олиготрофных местообитаниях, их также относят к бактериям, связанным с микробной трансформацией неорганических минеральных веществ (биотита, железа, апатита и т.д.) (Kim et al., 2014; Tytgat et al., 2014; Naoum, 2016). Факультативные олиготрофные бактерии родов Flavobacterium, Alteromonas, Glaciecola были выявлены в составе микробных сообществ морских вод Арктики и Антарктики (Mergaert et al., 2001; Van Trappen et al., 2004; Zhang et al., 2011; Li et al., 2017).
Рис. 3.
Тепловая карта (heatmap) распределения доминантных родов в библиотеках фрагментов гена 16S рРНК прокариотных сообществ, выделенных из образцов арктических грунтов. Двойная иерархическая дендрограмма показывает распределение микроорганизмов в этих пробах. Цветовой переход от синего к красному соответствует изменению относительных величин содержания отдельных родов в библиотеке от менее представленных к более представленным. Цифрами на диаграмме обозначены % от общего количества последовательностей в библиотеке из каждой исследованной пробы грунта.
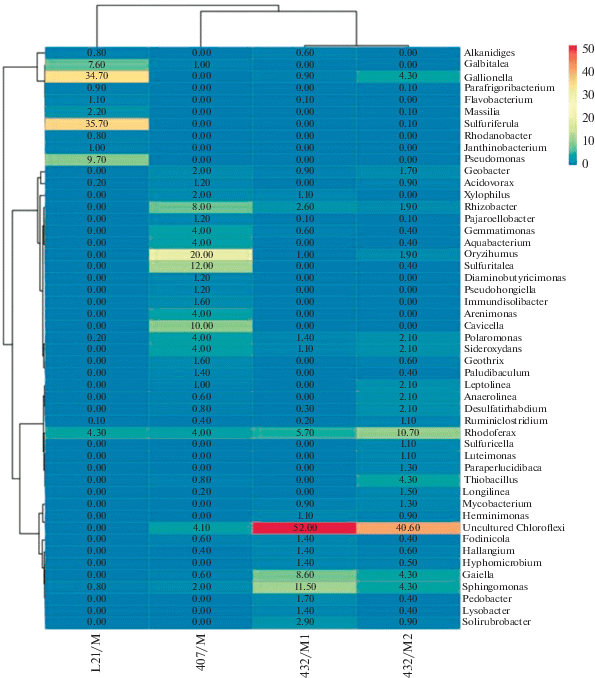
Молекулярными методами углеводородокисляющие бактерии были выявлены во всех исследованных пробах арктических грунтов. В незагрязненных пробах доминировали представители родов Sphingomonas, Alkanindiges и Polaromonas, в загрязненных пробах возрастала представленность бактерий родов Pseudomonas, Aquabacterium и Janthinobacterium, известных способностью использовать разные УВ.
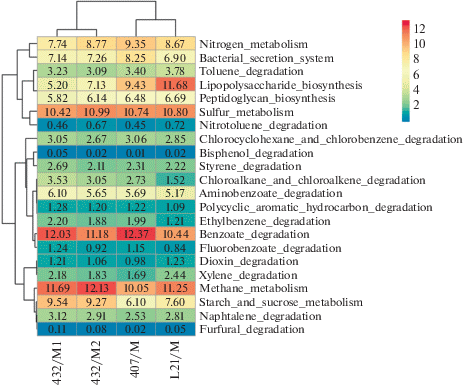
Потенциальная функциональная активность микробных сообществ арктических грунтов. С помощью модуля Local Mapper программы iVikodak были предсказаны потенциальные функциональные возможности исследованных микробных сообществ (рис. 4). Во всех исследованных сообществах присутствовали микроорганизмы, способные использовать различные углеводороды, наибольшая интенсивность на тепловой карте соответствовала метаболизму бензоата, нафталина, ксилола, толуола, хлорбензола и стирола. Выявлена способность к производству экзополисахаридов микроорганизмами, входящих в состав исследованных сообществ.
Рис. 4.
Тепловая карта, показывающая сравнение функциональных профилей прокариотных сообществ, выделенных из образцов арктических грунтов, с использованием пакета программ iVikodak.
С помощью базы данных KEGG были построены дендрограммы вклада бактерий в метаболизм бензоата (а), нафталина (б) и полициклических ароматических углеводородов (в) (рис. S1 ). Бактерии родов Rhodoferax, Herpetosiphon, Pseudomonas и Sphingomonas вносили определенный вклад в метаболизм указанных выше соединений. Последовательности генов 16S рРНК представителей филума Chloroflexi обнаруживали ранее в пробах воды Северно-Ледовитого океана. Было показано наличие многочисленных генов, отвечающих за разрушение ароматических углеводородов у представителей этого филума (Colatriano et al., 2018). Представители рода Herpetosiphon относятся к мезофильным бактериям–хищникам, способным расти на других микроорганизмах (Livingstone et al., 2018). Hа момент написания статьи нам не удалось обнаружить сведений о том, что бактерии этого рода могут расти на углеводородах при низкой температуре. Бактерии рода Rhodoferax (Rhodoferax antarcticus) ранее были обнаружены в пробах, загрязненных ароматическими углеводородами, и, по-видимому, принимают участие в деградации бензола (Aburto et al., 2011). Фототрофные психрофильные бактерии Rhodoferax antarcticus, ранее выделенные из микробного мата Антарктики, росли в интервале температуры от 0 до 25°С (Madigan et al., 2000).
Бактерии родов Pseudomonas и Sphingomonas – известные деструкторы углеводородов, которые используются при очистке от УВ загрязнений, в том числе, при низкой температуре (Thomassin-Lacroix et al., 2002). Психрофильные и психротолерантные представители этих родов были неоднократно выделены из вечной мерзлоты и других холодных местообитаний (Yakimov et al., 2004; Steven et al., 2006).
Определение численности культивируемых микроорганизмов в образцах грунта. Численность аэробных органотрофных (АОБ), олиготрофных (ОЛ) и углеводородокисляющих (УОБ) бактерий определяли при температуре 5 и 15°C (рис. S2 ). Показано, что численность микроорганизмов исследуемых групп при 15°C была выше, чем при 5°C. Углеводородокисляющие бактерии были обнаружены во всех исследованных пробах, где их численность варьировала в пределах 104–106 кл/г грунта. Максимальная численность была в пробах ПК337 и 409/M, загрязненных нефтепродуктами, в то время как в незагрязненных пробах 432/M1 и 432/M2 численность УОБ не превышала 104 кл/г грунта. Часто микроорганизмы образовывали биопленку на поверхности жидкой среды с дизельным топливом.
Численность углеводородокисляющих бактерий в пробах загрязненных нефтепродуктами арктических грунтов, их рост на среде, содержащей в качестве единственного источника углерода дизельное топливо, указывает на потенциал этой группы микроорганизмов в качестве агентов для самоочищения почвы и возможность использования их в биоремедиации.
Рост накопительных культур углеводородокисляющих микроорганизмов на дизельном топливе. Первичные накопительные культуры УОБ, в которых был отмечен рост, были отобраны для посева на дизельное топливо в жидкую минеральную среду. Посевы инкубировали в течение 45 сут при 5°C в стационарных условиях. Во всех полученных культурах было отмечено накопление белка от 45 до 190 мкг/мл (табл. 1). Максимальное количество белка зафиксировано в посевах из проб 409/M, 407/M, 432/M, 336/1. Во всех посевах отмечено снижение поверхностного натяжения культуральной жидкости с бактериями на 15.6–29.3 мН/м, а межфазного натяжения на границе культуральная жидкость/гексадекан – на 11.6–35.3 мН/м по сравнению с контролем, что свидетельствует о присутствии деструкторов углеводородов в составе исследуемых накопительных культур. Большинство накопительных культур формировали стойкую эмульсию при смешивании с гексадеканом. Величина индекса эмульгирования (E24) достигала 50–70% (табл. 1).
Таблица 1.
Реологические характеристики и содержание белка в накопительных культурах углеводородокисляющих бактерий при росте на дизельном топливе
| Показатель | Стерильная среда | L21/M | ПК337 | 409/M | 407/M | 432/M1 | 336/1 | 410/M |
|---|---|---|---|---|---|---|---|---|
| Белок, мкг/мл | 0 | 57 | 95 | 110 | 105 | 180 | 105 | 45 |
| ПН, мН/м | 64.2 | 47.4 | 39.6 | 34.9 | 41.9 | 41.1 | 43.8 | 43.5 |
| МН, мН/м | 45.0 | 30.6 | 9.7 | 17.8 | 23.5 | 22.1 | 22.8 | 30.6 |
| Е24, % | 0 | 10 | 50 | 50 | 60 | 70 | 70 | 0 |
| ПН − поверхностное натяжение, МН − межфазное натяжение. | ||||||||
Культивирование микроорганизмов в среде с дизельным топливом сопровождалось изменением состава алифатической фракции при росте накопительных культур 432/М1, ПК337, 409/М и 336/1 (рис. S3 ). Микроорганизмы из накопительной культуры 432/M1, полученной из незагрязненного участка, использовали н-алканы с длиной цепи С10–С26. Культуры из загрязненных участков ПК337 и 409/М использовали коротко- и среднецепочечные н-алканы, а микроорганизмы из пробы 336/1 деградировали н-алканы с длиной цепи С10–С25, но степень их потребления была невелика. Поскольку накопление белка и изменение реологических характеристик было отмечено для всех исследованных культур, можно предположить, что в тех культурах, где не было отмечено изменений в алифатической фракции, происходило использование других компонентов дизельного топлива.
Выделение чистых культур микроорганизмов и их физиологические характеристики. Из полученных накопительных культур олиготрофов и углеводородокисляющих бактерий методом последовательных пересевов было выделено и очищено 13 штаммов бактерий (табл. 2). Культуры инкубировали при 5 и 15°C.
Таблица 2.
Физиологические характеристики углеводородокисляющих бактерий, выделенных из арктических грунтов
| Штамм | Ближайший типовой штамм | % сходства гена 16S рРНК | Источник выделения, температура инкубации |
Интервал температур, °С, (оптимум) |
NaCl, % (оптимум) | Субстрат* | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| Д/т** | С14–С16 | нафталин | ацетат | этанол | ||||||
| Ar-K10 | Arthrobacter alpinus S6-3, NR_117254 |
99.8 | 407/M, 5°С | 5–28 (10) | 0–>7 (3) | ++ | Н.д. | +/‒ | + | + |
| Ar-6-1 | Bacillus wiedmannii FSL W8-0169 MN117669 |
99.8 | 432/M, 15°С | 5–50 (37) | 0–>6 (3) | +/‒ | +/‒ | ‒ | + | ‒ |
| Ar-8-1 | Brevibacillus agri DSM 6348, NR_040983 |
99.9 | 410/M, 15°С | 5–45 (28) | 0–4 (3) | ++ | + | + | + | ++ |
| Ar-OL-9 | Janthinobacterium lividum DSM 1522, NR_026365 |
99.9 | 432/M2, 5°С | 5–37 (10) | 0–2 (0‒0.2) | + | ++ | ‒ | ++ | +/‒ |
| Ar-4-1 | Paenibacillus ehimensis KCTC 3748, NR_025666 |
99.8 | 407/M, 15°С | 15–50 (37) | 0–1 (0.5) | ‒ | ‒ | +/‒ | + | + |
| Ar-K6 | Pseudomonas fildesensis KG01, MK859934 |
99.8 | ПК337, 5°С | 5–42 (5–15) | 0–4.5 (3) | + | +++ | +/‒ | ++ | ++ |
| Ar-OL-10 | Pseudomonas frederiksbergensis DSM 13022, NR_117177 |
99.9 | 432/M2, 5°С | 5–30 (5–10) | 0–4.5 (0.5–1) | + | + | +/‒ | ++ | + |
| Ar-K7 | Pseudomonas frederiksbergensis DSM 13022, NR_117177 |
98.7 | 409/M, 5°С | 5–37 (5) | 0–3 (0.5–1) | +++ | ++ | + | ++ | ++ |
| Ar-K18 | Pseudomonas kitaguniensis MAFF 212408, LC500864 |
99.4 | 432/M2, 5°С | 5–37 (5) | 0–>6 (3) | +/‒ | ++ | + | ++ | + |
| Ar-K12 | Pseudomonas silesiensis A3, NR_156815 |
99.6 | 407/M, 5°С | 5–42(5–10) | 0–3 (0.5–2) | + | + | +/‒ | ++ | ++ |
| Ar-OL-11 | Pseudomonas fildesensis KG01, MK859934 |
99.5 | ПК337, 5°С | 5–42 (5–10) | 0–4.5 (3) | +/‒ | ++ | +/‒ | ++ | ++ |
| Ar-K9 | Rhodococcus globerulus DSM 43954, NR_118617 |
99.3 | 407/M, 5°С | 5–30 (5) | 0–6 (0.5–2) | ++ | +++ | +/‒ | ++ | ++ |
| Ar-OL-41 | Sphingomonas echinoides NRRL B-3126, G745876 | 98.5 | 407/M, 5°С | 5–30 (28) | 0–1 (0.2) | ++ | ++ | ‒ | ‒ | + |
Все штаммы, выделенные при 15°C, были мезофильными спорообразующими бактериями и относились к родам Bacillus, Brevibacillus и Paenibacillus. Из незагрязненных образцов грунта были выделены бактерии родов Pseudomonas, Arthrobacter, Janthinobacterium, которые не были выявлены молекулярными методами. Однако бактерии родов Pseudomonas и Janthinobacterium входили в состав микробного сообщества пробы L21/M. Для сообществ антарктических микробных матов было показано, что результаты высокопроизводительного секвенирования дают более полную картину биоразнообразия исследованных микробных сообществ, однако многие группы бактерий, не были выявлены этим методом, в отличие от культивирования (Tytgat et al., 2014). Это указывает на необходимость использования как молекулярных, так и традиционных микробиологических методов исследования для получения полной картины состава микробного сообщества природных сообществ.
Выделенные чистые культуры микроорганизмов, за исключением штамма Ar-4-1, росли при низкой температуре. Большинство штаммов относились к психрофильным микроорганизмам и имели оптимальные значения температуры для роста 5–10°C. Штаммы Ar-OL-9, Ar-OL-10, Ar-OL-11, Ar-OL-41, выделенные на среде для олиготрофов, росли на бедной среде при низкой температуре, что свидетельствует об их приспособленности к условиям высоких широт.
Среди выделенных штаммов присутствовали пресноводные и галотолерантные бактерии. Так, штаммы Janthinobacterium lividum Ar-OL-9 и Sphingomonas echinoides Ar-OL-41 не росли в среде с содержанием хлорида натрия выше 1%. Штаммы Arthrobacter alpinus Ar-K10 и Bacillus wiedmannii Ar-6-1 показали наибольшую толерантность к содержанию соли в среде и росли в присутствии 6–7% NaCl. Все выделенные штаммы росли также в отсутствие NaCl в среде. Однако для большинства изолятов оптимальные значения солености среды 2–3% NaCl, что соответствует содержанию соли в морской воде.
Большинство выделенных штаммов использовали глюкозу, ацетат, глицерин, этанол и УВ. Штаммы Pseudomonas fildesensis Ar-K6, Pseudomonas kitaguniensis Ar-K18 и Rhodococcus globerulus Ar-K9 росли на алифатических углеводородах, а штамм Pseudomonas frederiksbergensis Ar-K7 – на дизельном топливе. Штамм Ar-K9 лучше рос на смеси углеводородов С14–С16, чем на глюкозе. При росте на нафталине штамм Ar-K18 образовывал биопленку, прикрепленную к кристаллам нафталина.
Для восьми штаммов, показавших интенсивный рост на дизельном топливе или смеси углеводородов, были проанализированы реологические характеристики культуральных жидкостей. В отличие от накопительных культур, ни для одного штамма не было выявлено эмульгирующей активности сред. Штаммы A. alpinus Ar-K10, B. agri Ar-8-1, P. kitaguniensis Ar-K18, P. veronii Ar-OL-11 и R. globerulus Ar-K9 показали значительное снижение поверхностного и межфазного натяжения (табл. 3). Штамм R. globerulus Ar-K9 был наиболее перспективным для очистки почв от углеводородных загрязнений при низких температурах и солености 2% NaCl в среде.
Таблица 3.
Реологические характеристики культуральных сред с бактериями, выросших на средах с дизельным топливом и C14–C16н-алканами
| Номер штамма | Стерильная среда |
A. alpinus Ar-K10 | B. agri Ar-8-1 |
J. lividum Ar-OL-9 | P. fildesensis Ar-K6 | P. frederiksbergensis Ar-K7 | P. kitaguniensis Ar-K18 | P. veronii Ar-OL-11 |
R. globerulus Ar-K9 |
|---|---|---|---|---|---|---|---|---|---|
| Субстрат | ‒ | Д/т* | Д/т | C14–C16 | C14–C16 | Д/т | C14–C16 | C14–C16 | C14–C16 |
| ПН, мН/м | 62.4 | 43.3 | 40.4 | 50.0 | 47.6 | 43.8 | 55.1 | 45.1 | 29.3 |
| МН, мН/м | 45.0 | 9.7 | 16.9 | 34.0 | 33.5 | 27.8 | 22.7 | 13.8 | 0.5 |
Таким образом, микробные сообщества арктических грунтов, отобранных на острове Земля Александры архипелага Земля Франца-Иосифа, включают микробные популяции, способные использовать компоненты дизельного топлива, н-алканы, ароматические соединения и другие углеводороды при низкой температуре. Полученные сведения расширяют имеющиеся представления о составе и физиологических особенностях микробных сообществ арктических грунтов.
Список литературы
Борзенков И.А., Милехина Е.И., Готоева М.Т., Розанова Е.П., Беляев С.С. Свойства углеводородокисляющих бактерий, изолированных из нефтяных месторождений Татарстана, Западной Сибири и Вьетнама // Микробиология. 2006. Т. 75. С. 82–89.
Borzenkov I.A., Milekhina E.I., Gotoeva M.T., Rozanova E.P., Belyaev S.S. The properties of hydrocarbon oxidizing bacteria isolated from the oilfields of Tatarstan, Western Siberia, and Vietnam // Microbiology (Moscow). 2006. V. 75. P. 66–72. https://doi.org/10.1134/S0026261706010127
Никитин Д.А., Лысак Л.В., Мергелов Н.С., Долгих А.В., Зазовская Э.П., Горячкин С.В. Микробная биомасса, запасы углерода и эмиссия СО2 в почвах Земли Франца-Иосифа: высокоарктические тундры или полярные пустыни? // Почвоведение. 2020. № 4. С. 444–462. https://doi.org/10.31857/S0032180X20040115
Nikitin D., Lysak L.V., Mergelov N.S., Dolgikh A.V., Zazovskaya E.P., Goryachkin S.V. Microbial biomass, carbon stocks, and CO2 emission in soils of Franz Josef Land: high-arctic tundra or polar deserts? // Euras. Soil Sci. 2020. V. 53. P. 467–484. https://doi.org/10.1134/S1064229320040110
Семенова Е.М., Ершов А.П., Соколова Д.Ш., Турова Т.П., Назина Т.Н. Разнообразие и биотехнологический потенциал нитратредуцирующих бактерий из месторождений тяжелой нефти (Россия) // Микробиология. 2020. Т. 89. С. 675–687. https://doi.org/10.31857/S0026365620060166
Semenova E.M., Ershov A.P., Sokolova D.Sh., Tourova T.P., Nazina T.N. Diversity and biotechnological potential of ni-trate-reducing bacteria from heavy-oil reservoirs (Russia) // Microbiology (Moscow). 2020. V. 89. P. 685–696. https://doi.org/10.1134/s0026261720060168
Aburto A., Peimbert M. Degradation of a benzene-toluene mixture by hydrocarbon-adapted bacterial communities // Ann. Microbiol. 2011. V. 61. P. 553–562. https://doi.org/10.1007/s13213-010-0173-6
Colatriano D., Tran P.Q., Guéguen C., Williams W.J., Lovejoy C., Walsh D.A. Genomic evidence for the degradation of terrestrial organic matter by pelagic Arctic Ocean Chloroflexi bacteria // Biol. Commun. 2018. V. 1. Art. 90. https://doi.org/10.1038/s42003-018-0086-7
Harding T., Jungblut A.D., Lovejoy C., Vincent W.F. Microbes in high arctic snow and implications for the cold biosphere // Appl. Environ. Microbiol. 2011. V. 77. P. 3234–3243. https://doi.org/10.1128/AEM.02611-10
Henderson J., Loe J. The prospects and challenges for arctic oil development // Oxford Institute for Energy Studies. 2014. Art. 54. P. 1–60.
Hidalgo K.J., Sierra-Garcia I.N., Dellagnezze B.M., de Oliveira V.M. Metagenomic insights into the mechanisms for biodegradation of polycyclic aromatic hydrocarbons in the oil supply chain // Front. Microbiol. 2020. V. 11. Art. 561506. https://doi.org/10.3389/fmicb.2020.561506
Kim H.M., Jung J.Y., Yergeau E., Hwang C.Y., Hinzman L., Nam S., Hong S.G., Kim O.S., Chun J., Lee Y.K. Bacterial community structure and soil properties of a subarctic tundra soil in Council, Alaska // FEMS Microbiol. Ecol. 2014. V. 89. P. 465‒475. https://doi.org/10.1111/1574-6941.12362
Kim J., Lee A.H., Chang W. Enhanced bioremediation of nutrient-amended, petroleum hydrocarbon-contaminated soils over a cold-climate winter: the rate and extent of hydrocarbon biodegradation and microbial response in a pilot-scale biopile subjected to natural seasonal freeze-thaw temperatures // Sci. Total. Environ. 2018. V. 612. P. 903–913. https://doi.org/10.1016/j.scitotenv.2017.08.227
Li D.D., Liu C., Zhang Y.Q., Wang X.J., Wang N., Peng M., Song X.Y., Su H.N., Zhang X.Y., Zhang Y.Z., Shi M. Flavobacterium arcticum sp. nov., isolated from Arctic seawater // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 1070‒1074. https://doi.org/10.1099/ijsem.0.001804
Livingstone P.G., Morphew R.M., Cookson A.R., Whitworth D.E. Genome analysis, metabolic potential, and predatory capabilities of Herpetosiphon llansteffanense sp. nov. // Appl. Environ. Microbiol. 2018. V. 84. Art. e01040–18. https://doi.org/10.1128/AEM.01040-18
Madigan M.T., Jung D.O., Woese C.R., Achenbach L.A. Rhodoferax antarcticus sp. nov., a moderately psychrophilic purple nonsulfur bacterium isolated from an Antarctic microbial mat // Arch. Microbiol. 2000. V. 173. P. 269–277. https://doi.org/10.1007/s002030000140
Malard L.A., Pearce D.A. Microbial diversity and biogeography in Arctic soils // Env. Microbiol. Rep. 2018. V. 10. P. 611–625. https://doi.org/10.1111/1758-2229.12680
Mergaert J., Verhelst A., Cnockaert M.C., Tan T.L., Swings J. Characterization of facultative oligotrophic bacteria from polar seas by analysis of their fatty acids and 16S rDNA sequences // Syst. Appl. Microbiol. 2001. V. 24. P. 98–107. https://doi.org/10.1078/0723-2020-00012
Merkel A.Y., Tarnovetskii I.Y., Podosokorskaya O.A., Toshchakov S.V. Analysis of 16S rRNA primer systems for profiling of thermophilic microbial communities // Microbiology (Moscow). 2019. V. 88. P. 671–680. https://doi.org/10.1134/S0026261719060110
Naoum J.O. Study of bacterial populations from oligotrophic soil ecosystems using high throughput sequencing technologies // Biodiversity and Ecology. Université Paris-Saclay. 2016. English (NNT: 2016SACLS196).
Naseri M., Barabadi A., Barabady J. Bioremediation treatment of hydrocarbon-contaminated Arctic soils: influencing parameters // Environ. Sci. Pollut. Res. Int. 2014. V. 21. P. 11250–11265. https://doi.org/10.1007/s11356-014-3122-2
Rike A., Haugen K.B., Engene B. In situ biodegradation of hydrocarbons in arctic soil at sub-zero temperatures‒Field monitoring and theoretical simulation of the microbial activation temperature at a Spitsbergen contaminated site // Cold. Reg. Sci. Technol. 2005. V. 41. P. 189–209. https://doi.org/10.1016/j.coldregions.2004.10.005
Rivkina E.M., Friedmann E.I., Mckay C.P., Gilichinsky D.A. Metabolic activity of permafrost bacteria below the freezing point // App. Environ. Microb. 2000. V. 66. P. 3230–3233.
Rizzo C., Malavenda R., Gerçe B., Papale M., Syldatk Ch., Hausmann R., Bruni V., Michaud L., Giudice A.L., Amalfitano S. Effects of a simulated acute oil spillage on bacterial communities from Arctic and Antarctic marine sediments // Microorganisms. 2019. V. 7. Art. 632. https://doi.org/10.3390/microorganisms7120632
Steven B., Léveillé R., Pollard W.H., Whyte L.G. Microbial ecology and biodiversity in permafrost // Extremophiles. 2006. V. 10. P. 259–267. https://doi.org/10.1007/s00792-006-0506-3
Thomassin-Lacroix E.J.M., Eriksson M., Reimer K.J., Mohn W.W. Biostimulation and bioaugmentation for on-site treatment of weathered diesel fuel in Arctic soil // Appl. Microbiol. Biotechnol. 2002. V. 59. P. 551–556. https://doi.org/10.1007/s00253-002-1038-0
Van Trappen S., Tan T.L., Yang J., Mergaert J., Swings J. Alteromonas stellipolaris sp. nov., a novel, budding, prosthecate bacterium from Antarctic seas, and emended description of the genus Alteromonas // Int. J. Syst. Evol. Microbiol. 2004. V. 54. P. 1157–1163. https://doi.org/10.1099/ijs.0.02862-0
Tytgat B., Verleyen E., Obbels D., Peeters K., De Wever A., D’hondt S., De Meyer T., Van Criekinge W., Vyverman W., Willems A. Bacterial diversity assessment in Antarctic terrestrial and aquatic microbial mats: a comparison between bidirectional pyrosequencing and cultivation // PLoS One. 2014. V. 9. https://doi.org/10.1371/journal.pone.0097564
Yakimov M.M., Gentile G., Bruni V., Cappello S., D’Auria G., Golyshin P.N., Giuliano L. Crude oil-induced structural shift of coastal bacterial communities of rod bay (Terra Nova Bay, Ross Sea, Antarctica) and characterization of cultured cold-adapted hydrocarbonoclastic bacteria // FEMS Microbiol. Ecol. 2004. V. 49. P. 419–432. https://doi.org/10.1016/j.femsec.2004.04.018
Verasoundarapandian G., Wong C.Y., Shaharuddin N.A., Gomez-Fuentes C., Zulkharnain A., Ahmad S.A. A review and bibliometric analysis on applications of microbial degradation of hydrocarbon contaminants in Arctic marine environment at metagenomic and enzymatic levels // Int. J. Environ. Res. Public. Health. 2021. V. 18. P. 1671. https://doi.org/10.3390/ijerph18041671
Yap H.S., Zakaria N.N., Zulkharnain A., Sabri S., Gomez-Fuentes C., Ahmad S.A. Bibliometric analysis of hydrocarbon bioremediation in cold regions and a review on enhanced soil bioremediation // Biology (Basel). 2021. V. 10. P. 354. https://doi.org/10.3390/biology10050354
Zhang Y.J., Zhang X.Y., Mi Z.H., Chen C.X., Gao Z.M., Chen X.L., Yu Y., Chen B., Zhang Y.Z. Glaciecola arctica sp. nov., isolated from Arctic marine sediment // Int. J. Syst. Evol. Microbiol. 2011. V. 61. P. 2338–2341. https://doi.org/10.1099/ijs.0.027326-0
Дополнительные материалы
- скачать ESM_Page_1_1.tif
- Рис. S1. – Дендрограмма, показывающая ключевые микроорганизмы и их филогенетические линии, участвующие в метаболизме бензоата (а), нафталина (б).
- скачать ESM_Page_1_2.tif
- Рис. S1. – Дендрограмма, показывающая ключевые микроорганизмы и их филогенетические линии, участвующие в метаболизме полициклических ароматических соединений (в) в сообществах.
- скачать ESM_Page_2.tif
- Рис. S2. Численность аэробных органотрофных (АОБ), олиготрофных (ОЛ) и углеводородокисляющих (УОБ) бактерий при 5°С (а) и 15°С (б) в пробах арктических грунтов.
- скачать ESM_Page_3.tif
- Рис. S3. Состав алифатической фракции дизельного топлива после культивирования накопительных культур УОБ 432/M (а), ПК337 (б), 409/M (в), 336/1 (г).


