Микробиология, 2021, T. 90, № 6, стр. 692-705
Новые биокомпозитные материалы, включающие углеводородокисляющие микроорганизмы, и их потенциал для деградации нефтепродуктов
Ю. А. Николаев a, *, И. А. Борзенков a, Е. В. Дёмкина a, Н. Г. Лойко a, Т. А. Канапацкий a, И. В. Перминова b, А. Н. Хрептугова b, Н. В. Григорьева a, И. В. Близнец d, Н. А. Манучарова c, В. В. Сорокин a, М. А. Коваленко c, Г. И. Эль-Регистан a
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Московский государственный университет им. М.В. Ломоносова, химический факультет
119191 Москва, Россия
c Московский государственный университет имени М.В. Ломоносова,
факультет почвоведения
119191 Москва, Россия
d ООО “Компания “БНТ” (Технопарк МГУ)
Москва, Россия
* E-mail: NikolaevYA@mail.ru
Поступила в редакцию 07.07.2021
После доработки 18.07.2021
Принята к публикации 21.07.2021
Аннотация
Повышение стабильности биопрепаратов углеводородокисляющих микроорганизмов (УОМ), используемых для биоремедиации объектов окружающей среды, загрязненных нефтепродуктами, является актуальной задачей. В настоящем исследовании разработаны новые биокомпозитные материалы для иммобилизации УОМ на поверхности микрокапсул (МК) из: полимочевины чистой или модифицированной хитозаном или желатином; из полимолочной или полигликолевой кислот; а также включения в гели из силанольных производных гуминовых кислот. В качестве УОМ использовали грамотрицательные бактерии Acinetobacter seifertii WS1, Pseudomonas extremaustralis WS-1, P. aeruginosa OIS 4.8.1, грамположительные бактерии Rhodococcus qingshengii 367-6, Dietzia maris 367-2, а также дрожжи Yarrowia lipolytica 367-2. Выращивание УОМ в жидких средах совместно с МК на основе полимочевины с хитозаном (но не чистой полимочевины или с желатином) повышало численность жизнеспособных клеток (КОЕ/мл) в 2‒5 раз по сравнению с контрольными вариантами (без МК), как в свежевыращенных культурах, так и культурах, длительно (до 7 мес.) хранящихся при комнатной температуре и доступе воздуха. Культивирование УОМ совместно с МК, полученными из полимолочной кислоты, приводило к активному их обрастанию. В вариантах с МК из полигликолевой кислоты обрастание было менее заметным, что фиксировалось микроскопически. При краткосрочном хранении (1 мес.) при комнатной температуре варианта с МК из полимолочной кислоты выживало на 3 порядка больше клеток R. qingshengii, чем в контроле (без МК). Наиболее эффективным было включение УОБ в гели из силанольных производных гуматов: в таких препаратах после 7‒12 мес. хранения титр КОЕ был выше, чем в контрольном варианте до 100 раз, скорость дыхания также выше, чем в контрольном варианте. Биопрепараты на основе новых биокомпозитных материалов с иммобилизованными УОМ обладали высокой функциональной активностью в жидких средах и почвенных микрокосмах, загрязненных нефтью. Через 4 мес. хранения при комнатной температуре скорость окисления нефти такими биопрепаратами была в 2‒4 раза выше, чем в контрольных вариантах. Важными для практического применения свойствами новых биокомпозитных материалов являются: пролонгирование жизнеспособности клеток УОМ при длительном (до 12 мес.) хранении; гомогенность культур в период их применения; наличие дополнительных субстратов роста, также используемых для соокисления углеводородов.
Восстановление экосистем, загрязненных нефтью и (или) нефтепродуктами, является актуальной задачей (Sihag et al., 2014). Как правило, проведение ремедиационных мероприятий сопровождается использованием биопрепаратов на основе углеводородокисляющих микроорганизмов (УОМ) (Das, Chandran, 2011). Одним из серьезных недостатков использования биопрепаратов является гибель значительной части популяции микроорганизмов при получении их товарных форм на этапах сгущения и сушки, а также при хранении и транспортировке. Особенно остро стоит проблема сохранения жизнеспособности микроорганизмов в жидких формах биопрепаратов, которые привлекательны для применения в природоохранных биотехнологиях. Преимущество жидкой формы состоит в том, что она проще и дешевле в производстве и не требует предварительной активации при использовании.
При любом из известных способов стабилизации биопрепаратов (понимаемой как продление сроков поддержания высокого/технологически приемлемого титра жизнеспособных клеток), в его состав входят дополнительные компоненты разной функциональной направленности. На этом основании стабилизированные биопрепараты являются биокомпозитными материалами (БКМ), определяемыми как материалы, состоящие из двух или более различных компонентов, один из которых природного происхождения, при комбинировании которых у нового материала усиливаются свойства исходных материалов (Rudin, Choi, 2013). Этот термин в настоящее время используется для определения двух или более различных понятий. В инженерных науках и материаловедении “БКМ” – это материал, включающий натуральные компоненты (смолы и волокна) (Pilla, 2011; Rudin, Choi, 2013). В биомедицине и смежных областях под биокомпозитами понимают биосовместимые материалы, например, для имплантов в стоматологии (Iqba, Keshavarz, 2017; Tayebi, Moharamzadeh, 2018). Однако, строго говоря, дефиниции биокомпозитов более соответствуют материалы, включающие в свой состав живые системы или их компоненты, в результате чего усиливаются их свойства (Rudin, Choi, 2013). Такими материалам являются биосенсоры (Lupu et al., 2015), “живые функциональные материалы” (Living Functional Materials, LFM) (Chen et al., 2015; Liu, Xu, 2020), к которым относят биопленки и живые организмы, иммобилизованные в гидрогелях.
Эффективным подходом к стабилизации клеток микроорганизмов является их иммобилизация одним из трех известных типов: связывание/адгезия на твердом носителе, включение в пространственную структуру носителя (геля) и включение в объем, ограниченный полупроницаемой мембраной (Mitropoulouet et al., 2013). В медицине, фармакологии и для стабилизации пробиотиков применяются такие конструкции, как микрокапсулы (МК) (Benita, 2005; Opara, 2017) – полые тонкостенные сферы диаметром до 1000 мкм, внутри которых заключен биологический или химический материал (Opara, 2017). Применение МК в природоохранных биотехнологиях не распространено, хотя представляет интерес испытать их в качестве твердых синтетических носителей прикрепленного биоценоза, поскольку МК практически не влияют на реологию жидкости, и их удобно транспортировать и применять. Можно ожидать, что адсорбция на поверхности МК будет повышать защищенность микроорганизмов, переходящих в биопленочный фенотип. Технологически привлекательными свойствами МК являются высокая площадь поверхности для прикрепления микроорганизмов, возможность модифицировать состав материала, в том числе – делать его биодеградируемым. Применение биодеградируемых материалов одновременно имеет два положительных момента: они безопасны для окружающей среды и являются дополнительным субстратом для микрофлоры.
Одним из популярных биодеградируемых материалов являются полиоксикислоты (полимолочная, полигликолевая) (Sakurai et al., 2013), которые в естественных условиях быстро разрушаются (Qi et al., 2017). Другой перспективный биодеградируемый материал – полимочевина (в чистом виде весьма инертная), модифицированная разрушаемыми биополимерами углеводной или белковой природы (Martens, Domsch, 1981; Sears et al., 2016; Tang et al., 2016).
Другим распространенным подходом к иммобилизации живых биокатализаторов является их помещение в гели из различных веществ (Dzionek et al., 2016), наиболее распространенными из которых являются ПВС (поливиниловый спирт), альгинат кальция и ряд других. С учетом обнаруженных нами свойств гуматов выступать эффективными стабилизаторами культур УОМ при длительном хранении (Николаев и соавт., 2019, 2020), в рамках настоящей работы было интересно испытать новый тип биосовместимого геля на основе органосиланов, модифицированных гуматами (Volikov et al., 2016a, 2016b). Эти гели разработаны как безопасные барьеры для адсорбции тяжелых металлов и других поллютантов. Для включения микроорганизмов они не использовались. Такие гели обладают дополнительными полезными и уникальными свойствами – легко растворимы в воде, содержат гуматы, которые являются почвенными мелиорантами и применяются для биоремедиации нефтезагрязненных почв (Дагуров и соавт., 2005; Park et al., 2011; Kuráň et al., 2014).
Целью работы было разработать и испытать новые биокомпозитные материалы на основе биодеградируемых синтетических сорбентов – носителей прикрепленного биоценоза УОМ, и геля на основе силанольных производных гуминовых веществ. В работе были исследованы свойства новых биокомпозитов ‒ выживаемость включенных в них УОМ разных видов при длительном хранении в провокационных условиях, т.е. условиях, провоцирующих быструю гибель клеток (комнатная температура 18‒24°С, доступ воздуха), эффективность деструкции нефти.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования. В работе были использованы бактерии из коллекции культур лаборатории нефтяной микробиологии Института микробиологии им. С.Н. Виноградского ФИЦ Биотехнологии РАН, способные к окислению углеводородов: грамотрицательные Acinetobacter seifertii WS1, Pseudomonas extremaustralis WS-1, P. aeruginosa OIS 4.8.1, грамположительные Rhodococcus qingshengii 367-6 (бывший R. еrytropolis), Dietzia maris 367-2, а также дрожжи Yarrowia lipolytica 367-2.
Условия культивирования. Культуры выращивали на среде LB (Miller) (“Sigma-Aldrich”) в колбах объемом 250 мл с 50 мл среды при 28‒30°С на орбитальной качалке (100 об./мин) в течение 24‒40 ч до стационарной фазы роста.
Микрокапсулы из полимочевины синтезированы по технологии, описанной ранее (Lia et al., 2015) с модификациями (Заявка на изобретение РФ № 2020136378). Синтез основан на межфазной реакции преполимера полимочевины, полиизоцианата (Wannate PM-200, “Вирареактив”, Россия), растворенного в смеси дихлорметана/дихлорфторэтана (2 : 1) и полиаминов триэтилентетрамина/этилендиамина (3 : 1). Процесс получения микрокапсулированного препарата включает этапы: 1) подготовка раствора преполимера полимочевины – полиизоцианата; 2) подготовка водного раствора эмульгатора (TWIN 80‒поливиниловый спирт‒лаурилсульфат натрия 1 : 1 : 0.2); 3) приготовление эмульсии МК; 4) отверждение полимера; 5) удаление галогенуглерода.
Для получения биоразлагаемых МК на стадии 4 в смесь вводили химически совместимые с технологией межфазной полимеризации природные биоразлагаемые полимеры ‒ белок желатин и полисахарид хитозан. Эти соединения содержат свободные аминогруппы, позволяющие вводить их в состав полимера. Использовали хитозан (низкомолекулярный хитозан с молекулярной массой в диапазоне 1‒30 кДа, степень дезацетилирования 75‒95%) ‒ 25% от массы отвердителя (ЗАО “Биопрогресс”, Россия) и желатин (свиной желатин кислотной выделки, прочность студня 180 bloom (“Weishardt Int.”, Франция)), в количестве 20% от массы отвердителя (полиаминов).
Полученные МК имели диаметр 40‒200 мкм, в среднем 80‒100 мкм. Средняя площадь поверхности оболочек микрокапсул составляла 0.054 м2/г. Определение осуществляли с применением электронного сканирующего микроскопа.
Микрокапсулы из полимолочной кислоты (ПМК) или полигликолевой кислоты (ПГК) получали по модифицированной методике (Daiguji et al., 2009) в четыре стадии. 1 ‒ приготовление 5% раствора одного из полимеров в дихлорметане и эмульгатора (Твин-80 и поливиниловый спирт, 1 : 1) в воде; 2 ‒ механическое эмульгирование растворов ПМК или ПГК в водном растворе эмульгаторов в течение 10 мин с перемешиванием при 3000 об./мин, основная реакция ‒ в течение 4 ч при 35°С до получения размера микрокапель 0.05‒0.5 мм; 3 ‒ создание повышенного давления воздуха над микроэмульсией (более 300 кПа). Воздух при этом растворяется в каплях и растворе. Последующее уменьшение давления в сосуде до атмосферного давления, приводит к появлению микропузырьков в каплях, и в растворе. 4 ‒ после перехода хлористого метилена в водный раствор поливинилового спирта происходит сжатие капель и формирование полых микрокапсул из ПМК или ПГК.
Полученный препарат МК представляет собой 10‒15%-ю водную суспензию капсул диаметром 25‒100 мкм, в среднем 80 мкм.
Гель из силанольных производных гуминовых веществ (СПГВ) получали из гумата калия и натрия Powhumus (“Humintech”, Германия) и органосилана 3-аминопропилтриэтоксисилан (АП-ТЭС) (“АГМ-9”, ООО “Пента 91”, Россия) по описанной ранее методике с модификациями (Volikov et al., 2016b). К раствору гуматов (15%) добавляли 5% (об./об.) АПТЭС при интенсивном перемешивании на магнитной мешалке, после чего титровали раствором ледяной уксусной кислоты до рН 6‒7. Полученную смесь оставляли при комнатной температуре. В течение 2‒12 ч происходило загустевание (желирование) реакционной смеси. В итоге формировалась силсесквиоксановая трехмерная структура, матрица, к которой присоединялись полианионы гумата посредством ионных связей. Полученный гель был однородным, обладал умеренными прочностными свойствами – не вытекал из пробирок при их переворачивании, сохранял свои свойства в течение нескольких месяцев, при добавлении воды и интенсивном перемешивании растворялся.
Иммобилизация микроорганизмов. Для иммобилизации микроорганизмов использовали два подхода: 1) микрокапсулы вносили вместе с инокулятом микроорганизмов в количестве 1.5‒3 г/л и инкубировали вместе с растущими бактериями, как описано выше, до стационарной фазы роста, после чего оставляли стоять при комнатной температуре на несколько месяцев в стационарном режиме. 2) Для иммобилизации в толще геля суспензию клеток смешивали с композицией гуматов и АПТЭС после ее нейтрализации в отношении 0.4‒0.5 : 1, разливали по пробиркам типа Эппендорф (1.5 мл) или Фалькон (15 мл) и оставляли до формирования геля, после чего хранили в течение нескольких месяцев при комнатной температуре (18‒24°С) и доступе воздуха, т.е. в условиях, неоптимальных для хранения культур (“провокационных” для отмирания, моделирующих одни из реальные условиях хранения культур, часто встречающиеся в практике).
Оценка жизнеспособности микроорганизмов. О жизнеспособности микроорганизмов судили по двум критериям: 1) по титру жизнеспособных клеток (КОЕ/мл), определяемому микрометодом – путем высева десятичных разведений культур на плотную среду LB, а также 2) по дыхательной активности культуры, определяемой по скорости накопления СО2 в герметически закрытом флаконе. В этом случае скорость генерации СО2 прямо пропорциональна количеству выживших клеток. Для определения эмиссии СО2 инокулят – культуру стационарной фазы роста, или культуры, хранившиеся в течение определенного времени, вносили вo флакон объемом 500 мл с 40 мл стерильной среды Раймонда (г/л): CaCl2 ⋅ 6H2O – 0.01; MnSO4 ⋅ ⋅ 5H2O – 0.02; FeSO4 ⋅ 7H2O – 0.01; Na2HPO4 – 1.5; KH2PO4 – 1.0; MgSO4 ⋅ 7H2O – 0.2; NH4NO3 – 1.0; NaCl – 5.0; pH 6.8‒7.2. Объем инокулята ‒ 3% от объема среды. После стабилизации уровня СО2 в газовой фазе (через 4 ч инкубации) во флакон вносили раствор 0.5 мл 10% раствора глюкозы. Концентрацию СО2 в газовой фазе определяли в течение нескольких суток на газовом хроматографе Хроматэк-Кристалл 5000 (ЗАО СКБ “Хроматэк”, Россия).
О способности бактерий разлагать углеводороды нефти также судили по накоплению СО2 в двух системах: в жидкой среде и в почвенных микрокосмах.
В закрытые флаконы объемом 120 мл, содержащие 10 мл жидкой среды Раймонда добавляли источник углерода ‒ нефть Черемуховского месторождения (Республика Татарстан) плотностью 0.9 г/см3 в количестве 2 об. % и инокулят микроорганизмов в объеме 200 мкл (600 мкл для культур в СПГВ-геле, т.к. при его приготовлении культура разбавлялась в 3 раза). Флаконы инкубировали при температуре 30°С на качалке (100 об./мин) в течение 10 сут. Объем среды и количество вносимого субстрата рассчитаны таким образом, чтобы в замкнутом пространстве не создавалось условий лимитирования для окисления нефтепродукта. Периодически из флаконов с помощью шприца отбирали пробы воздуха (0.4 мл), в которых определяли концентрацию СО2 на газовом хроматографе Хроматэк-Кристалл 5000 (ЗАО СКБ “Хроматэк”, Россия). Для расчета эмиссии СО2, образовавшегося при деструкции нефтепродуктов, из суммарного объема СО2 вычитали концентрацию углекислого газа, образовавшегося в вариантах без внесения нефти, только за счет субстратов, вносимых с инокулятом (материал микрокапсул, геля, автолизаты клеток, остатки среды).
Почвенные микрокосмы создавали во флаконах объемом 15 мл с завинчивающейся крышкой. Во флаконы вносили 5 г почвы, чернозема типичного, верхнего, темно-гумусового горизонта (AU1), отобранного летом 2019 г. в Воронежской области, (заказник “Каменная степь”, Россия). В почву добавляли 10% (по весу) нефти. Почву увлажняли, добавляя 1 мл стерильной дистиллированной воды. Испытуемые биопрепараты на основе R. qingshengii 367-6 добавляли в количестве 100 мкл: свежевыращенная культура на среде LB как положительный контроль, такая же культура, хранившаяся в течение 4 мес. (предположительно – отрицательный контроль), такая же культура, стабилизированная добавлением МК из ПМХ, ПМК, или стабилизированная включением в СГГ. В последнем случае добавляли 300 мкл биопрепарата, т.к. при приготовлении этого БКМ культура была разбавлена в 3 раза. Флаконы оставляли при комнатной температуре на 30 сут под ватной пробкой, периодически увлажняя почву дистиллированной водой и встряхивая. Через 30 сут инкубации флаконы продували воздухом, герметично закрывали крышкой и определяли накопление СО2 в течение 24 ч. Для расчета эмиссии СО2, образовавшегося при деструкции нефтепродуктов, из суммарного объема СО2 вычитали газ, образовавшийся на почве без внесения нефтепродукта. Концентрацию СО2 определяли на газовом хроматографе Хроматэк-Кристалл 5000 (ЗАО СКБ “Хроматэк”, Россия). Время инкубации 30 сут было выбрано на основании предварительно проведенных исследований, показавших, что в микрокосмах наиболее активное окисление нефти проходит на 14‒30 сут инкубации, а количество клеток УОБ максимально на 20‒30 сут инкубации (данные не приводятся).
Об уровне адгезии микроорганизмов на поверхности МК судили при микроскопировании образцов с применением сканирующего электронного микроскопа. Образцы центрифугировали 5 мин при 7000 g, образовавшийся осадок дважды промывали 0.05 М фосфатным буфером (рН 7.0), поэтапно обезвоживали в растворах этилового спирта с возрастающей концентрацией (от 30 до 100%). Затем препараты дважды отмывали в 100% ацетоне и высушивали в критической точке. Полученные препараты просматривали в сканирующем электронном микроскопе ТМ-3000 (“Hitachi”, Япония) при ускоряющем напряжении 15 кВ. Биопленки A. sefertii исследовали на растровом электронном микроскопе JSM-IT200 (“JEOL”, Япония).
Статистическая обработка результатов. Все исследования выполнены в двух‒трех биологических повторностях, по два параллельных эксперимента в каждом. При расчете титра КОЕ определяли среднее арифметическое и экспериментальную ошибку (функция “среднее отклонение экспериментальных значений от среднего”) из 5‒7 параллельных проб с использованием программы Microsoft Office Excell 2007. Различия между вариантами считали значимыми, если они превышали экспериментальную ошибку, обычно не превышающую 30% для экспериментов по определению КОЕ и 1.5% для экспериментов по определению концентрации СО2. На рисунках представлены данные типичных экспериментов, в таблицах – средние значения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В рамках задачи по стабилизации жидких препаратов УОМ мы исходили из того, что стабилизированные биопрепараты должны обладать совокупностью свойств, благоприятных для их применения при биоремедиации от нефтезагрязнений: высоким титром живых клеток, хорошими реологическими свойствами, нетребовательностью к условиям хранения, обусловливать высокую дисперсность биокатализатора (клеток) при внесении в природный объект. Эти качества учитывали при выборе способов формирования стабилизированных биопрепаратов УОМ.
Геометрические свойства микрокапсул. Микрокапсулы из немодифицированной и модифицированной полимочевины имели сферическую форму диаметром 40‒100 мкм. В зависимости от условий получения МК из немодифицированной полимочевины представлены двумя морфотипами – полусферами с гладкой поверхностью (рис. 1а), сморщенными сферами, с соотношением “глубина/поперечник углублений” ≥1 (рис. 1б). Если полимочевина была модифицирована желатином, МК имели округлую форму с волнистой поверхностью, отношение “глубина/диаметр” углублений было меньше 0.5 (рис. 1в). МК из полимочевины, модифицированной хитозаном, представлены сморщенными сферами, отношение “глубина/поперечник углублений” ≥1 (рис. 1г).
Рис. 1.
Микрофотографии микрокапсул из немодифицированной полимочевины (а, б), полимочевины, модифицированной желатином (в), полимочевины, модифицированной хитозаном (г), полимолочной кислоты (д), полигликолевой кислоты (е).

МК из полимолочной кислоты (ПМК) представлены слегка сморщенными тонкостенными сферами, сформированными из микросфер полимера, имеют размер 25‒100 мкм (рис. 1д). Инвагинации стенок МК выражены слабо. Поверхность МК сформирована мелкими шариками ПМК. Эти МК являются умеренно гидрофобными, т.к. легко и полностью диспергируются в масле, и медленно – в воде, при этом эмульсия стабильна в течение длительного времени. МК из полигликолевой кислоты (ПГК) представлены сморщенными сферами, поверхность бугристая, сформирована из мелких слипшихся микросфер полимера, много капсул с трещинами (рис. 1е).
Иммобилизация клеток на/в новые носители. Выращивание культур УОМ с микрокапсулами всех типов выявило различную степень адгезии клеток на поверхности МК. УОМ в минимальной степени сорбировались на МК из немодифицированной и модифицированной желатином полимочевины, а также на МК из ПГК (данные не приведены). Адгезия всех испытанных УОМ была максимально выражена на МК из полимочевины, модифицированной хитозаном (МК ПМХ) (рис. 2) и на МК из ПМК (рис. 3).
Рис. 2.
Микрофотографии микрокапсул из полимочевины, модифицированной хитозаном, инкубированных в течение 48 ч (а, б) с культурами бактерий R. qingshengii (а, в) и A. seifertii (б, г), и хранившихся в течение 3 мес. (в, г).
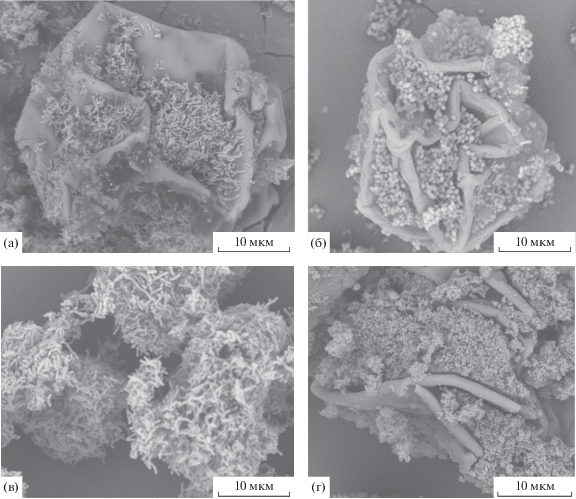
Рис. 3.
Электронные микрофотографии МК из ПМК после инкубации в течение 2 сут (а) и 2 недель (б) с культурой R. qingshengii.

На рис. 2 представлены микрофотографии МК ПМХ после 48 ч культивирования с культурами R. qingshengii (а) и A. seifertii (б). Для остальных УОМ адгезия аналогично обильная. Основная часть прикрепленных клеток располагалась в складках МК ПМХ, что свидетельствует о невысокой прочности прикрепления. Невысокая прочность прикрепления клеток также подтверждается тем, что при интенсивном встряхивании (Вортекс, 1 мин) клетки смываются с поверхности, что позволяет определять титр КОЕ методом десятичных разведений. На приведенных фото видно, что большая часть прикрепленных клеток объединена в агрегаты, соответствующие стадии начала формирования биопленкок. Морфологически клетки соответствуют клеткам стационарной фазы роста.
Добавление МК ПМХ к растущим культурам не изменяло скорости дыхания популяции в целом, о чем свидетельствует отсутствие влияния МК на накопление СО2 по сравнению с культурами без МК (данные не приведены). При этом в присутствии МК урожай клеток был в 2‒5 раз больше (по КОЕ), чем в контроле, что объясняется переходом клеток в биопленочное состояние, при котором клетки находятся в состоянии с пониженной скоростью роста и не подвергаются автолизу. Это позволяет на исходно одинаковом количестве субстрата нарасти большему количеству клеток.
Через 3 мес. хранения культур УОМ, выросших с МК ПМХ, микроскопическая картина существенно не изменилась. Все МК были покрыты клетками УОМ, и даже в большей степени, чем двухсуточные культуры. При этом клетки стали более короткими, что соответствует старым культурам, отдельные клетки в их скоплениях просматриваются хуже, что указывает на развитие матрикса, что особенно выражено для А. seifertii (рис. 2г).
Выведение части клеток из состояния планктонного роста и их переход в состояние биопленочного роста обусловило нарастание большего количества клеток ‒ в 2‒5 раз, чем в отсутствие МК (табл. 1). Переход в состояние биопленки приводит к замедлению скорости роста, и на одном и том же количестве исходного субстрата может нарасти большее количество биомассы (Dorofeev, Panikov, 1998; Lipson, 2015). Способствовать накоплению большего количества микроорганизмов также могли еще два фактора – сорбция метаболитов, ингибирующих рост культур в стационарной фазе, а также использование хитозана как дополнительного источника углерода (Beier, Bertilsson, 2013; Sawaguchi et al., 2015). Аналогичный эффект наращивания большей биомассы микроорганизмов в присутствии сорбентов описан в работе Ларионова и соавт. (2011).
Адгезия R. еrytropolis на МК из ПМК также весьма обильна (рис. 3). Клетки 2-сут культуры имеют укороченную палочковидную или коккоидную форму, что характерно для стационарной культуры. Вне МК присутствуют агрегаты клеток родококка. Через 2 недели целых МК практически не наблюдается, фрагменты МК полностью покрыты толстым слоем клеток микроорганизмов. Морфология клеток (длинные палочки) соответствует растущим клеткам. Такая картина объясняется активным гидролизом материала МК, ПМК, гидролазами микроорганизмов, разрушением МК и пролиферацией клеток культуры. Типичную картину биопленочного роста можно наблюдать для грамотрицательных бактерий A. seifertii и P. aeruginosa (рис. 4а и 4б соответственно). Клетки погружены в обильный матрикс, едва различимы, при этом видно, что они имеют укороченную форму, соответствующую медленно растущей или стационарной культуре.
Рис. 4.
Электронная микрофотография МК из ПМК после инкубации в течение 9 мес. с культурой A. seifertii (а) и в течение 4 мес. с культурой P. aeruginosa (б).

Таким образом, можно заключить, что МК ПМК являются дополнительным источником углерода и энергии для микроорганизмов, и, таким образом, могут быть использованы для их стабилизации при хранении.
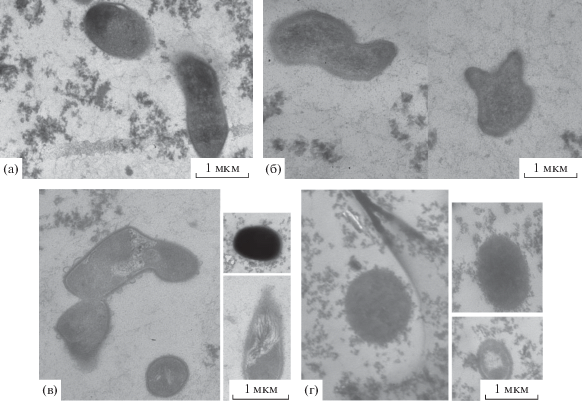
Для иммобилизации клеток УОБ в гель из СПГВ выращенные до стационарной фазы культуры смешивали со свежеприготовленным гелем и оставляли до застывания. Включение клеток в гель приводило к снижению их титра КОЕ в 2‒8 раз (рис. 8) по причине токсичности одного из компонентов геля, АПТЭС, пока он не полимеризовался. Однако микроскопически все клетки выглядели как клетки культур стационарной фазы роста, лизированных клеток обнаружено не было (рис. 5). После 4 мес. пребывания в геле картина существенно менялась: наряду с вегетативными клетками появлялись покоящиеся клетки, выявляемые по наличию утолщенных клеточных стенок и/или наличию кристаллизованного компактизованного нуклеоида (рис. 5). Вокруг некоторых вегетативных клеток можно видеть полимерный матрикс (рис. 5г) или микровезикулы (рис. 5в), что характерно для биопленочного фенотипа.
Рис. 5.
Электронно-микроскопические фотографии клеток R. qingshengii (а, в) и A. seifertii (б, г) сразу после включения в гель из СПГВ (а, б) и после хранения в течение 4 мес. (в, г). На рис. (в) и (г) слева – вегетативные клетки, справа – разные типы покоящихся форм: с уплотненной цитоплазмой и утолщенной клеточной стенкой (верх) и кристаллизованным компактизованным нуклеоидом (низ).
Жизнеспособность УОМ при длительном хранении. Иммобилизация клеток УОМ на поверхности МК из ПМХ существенно сказалась на количестве и жизнеспособности клеток при хранении при комнатной температуре в стационарных условиях (табл. 1). Культуры, выращенные в присутствии МК из ПМХ, содержали в 2‒4.5 раза больше клеток, чем в контроле (табл. 1). Возрастание титра КОЕ произошло из-за того, что переход в состояние биопленки приводит к замедлению скорости роста, что сделало возможным нарастание большего количества биомассы на одном и том же количестве субстрата. Во всех вариантах экспериментов, включая контрольные, с течением времени хранения культур происходило снижение численности микроорганизмов на один (R. qingshengii) – три порядка (остальные культуры) за 200 сут. Однако численность микроорганизмов конце указанного срока хранения в вариантах с МК из ПМХ была выше, чем в контроле, в несколько раз. Очевидно, что иммобилизация на МК повышала количество клеток УОМ относительно контрольного варианта при неблагоприятных условиях хранения.
Таблица 1.
Титр жизнеспособных клеток (КОЕ/мл) культур УОМ, выращенных в присутствии МК из ПМХ на среде LB через разные промежутки времени (сут) относительно нестабилизированного контроля в процентах
| Время хранения (сут) | ||||
|---|---|---|---|---|
| 0 | 60 | 90 | 200 | |
| P. aeruginosa | 209 | 338 | 238 | 232 |
| R. qingshengii | 185 | 436 | 579 | 182 |
| A. seifertii | 476 | 212 | 293 | 6250 |
| D. maris | 165 | 264 | 304 | 178 |
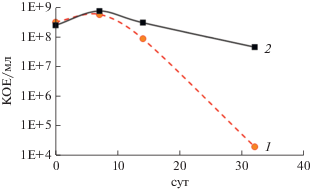
Определять число жизнеспособных клеток на поверхности МК ПМК методом десятикратных разведений сложно, т.к. клетки образуют агрегаты из десятков и сотен клеток, часто включенных в густой матрикс. В варианте с R. qingshengii, который хорошо диспергируется, после хранения в течение 30 сут титр КОЕ культуры, выращенной в присутствии МК, был на 3 порядка выше относительно контроля (рис. 6). Для P. aeruginosa эффект МК ПМК методом десятикратных разведений не выявляется из-за формирования обильного матрикса (рис. 3).
Рис. 6.
Динамика КОЕ R. qingshengii в присутствии МК ПМК. 1 – нестабилизированный контроль. 2 – в присутствии МК ПМК.
Поэтому количество метаболически активных клеток было оценено косвенно ‒ по скорости дыхания культур, хранившихся в течение одинакового времени с или без добавления МК из ПМК. В этом случае скорость генерации СО2 прямо пропорциональна количеству выживших клеток.
На рис. 7 представлены данные по скорости дыхания культур R. qingshengii и P. aeruginosa в ответ на добавление глюкозы. Тест на физиологическую активность культур после 30 сут хранения подтвердил высокую эффективность применения МК из ПМК, более выраженную для родококка. Для R. qingshengii дыхательная активность культуры, хранившейся 30 сут в присутствии МК ПМК, всего лишь в 2 раза ниже, чем свежевыращенной культуры, и в 8 раз выше, чем контрольной культуры. Для P. aeruginosa наличие МК ПМК привело к 5-кратному превышению дыхательной активности 30-суточной культуры по сравнению с контрольной без МК.
Рис. 7.
Дыхательная активность R. qingshengii (а) и P. aeruginosa (б), выращенных в присутствии МК ПМК и через 30 сут хранения.
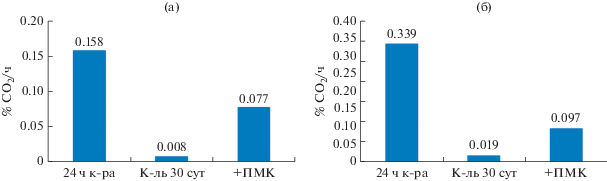
Рис. 8.
Влияние иммобилизации клеток УОМ и дрожжей в гель из СПГВ на их выживание при хранении: (а) – R. qingshengii; (б) – A. seifertii; (в) – P. aeruginosa; (г) – Y. lypolytica.

Сопоставление результатов определения титра жизнеспособных клеток, их дыхательной активности и микрофотографий культур R. qingshengii и P. aeruginosa, позволяет заключить, что делать выводы о влиянии того или иного фактора на сохранение жизнеспособности культур необходимо с учетом всей совокупности данных. Так, в случае биопленочного развития культур метод десятикратных разведений дает заниженные результаты (P. aeruginosa), и для оценки количества метаболически активных клеток необходимо оценивать потенциальную дыхательную активность. При этом дыхательная активность дает заниженную оценку количества жизнеспособных клеток, как в случае R. qingshengii. Этот феномен имеет место вследствие гетерогенности длительно хранящихся культур. В то время как часть клеток имеет неглубокую степень покоя, и они сразу начинают дышать, другие клетки оживают только через несколько часов нахождения на богатой среде, и метод традиционного определения КОЕ дает большее количество жизнеспособных клеток.
Включение четырех видов УОМ (R. qingshengii, A. seifertii, P. aeruginosa, P. extremaustralis) и одного дрожжевого организма (Y. lipolytica) в гель на основе СПГВ приводило к существенному повышению титра КОЕ при длительном хранении культур относительно контроля (рис. 8). При этом было выявлено, что компоненты геля (очевидно, свободный АПТЭС до полимеризации) могут быть токсичными для микроорганизмов. Для R. qingshengii и Y. lypolytica сразу после формирования геля титр КОЕ был ниже контрольного в 5 раз, для P. aeruginosa – в 2 раза, для A. seifertii – на 10%. Однако выжившие клетки не отмирали в течение нескольких месяцев, в отличие от контрольных вариантов. Наблюдали рост культур УОМ и увеличение численности КОЕ до 4-х раз в течение первых двух месяцев. После двух месяцев хранения Y. lypolytica наблюдали увеличение численности популяции – более, чем на 1 порядок за 4 мес. Во всех случаях микроорганизмы, бактерии и дрожжи, сохранялись лучше в геле, чем в контрольном варианте. Через 2‒12 мес. хранения в геле количество клеток было выше, чем в контроле, на 1‒2 порядка. Такое необычное для культур отсутствие отмирания будет исследовано отдельно, однако можно предположить, что росту и длительному выживанию культур способствовало наличие в среде источников питания – ацетата и этанола (который образуется в результате полимеризации АПТС с гуматами).
Деструкция нефти новыми биокомпозитными материалами в жидкой среде и почве. На последнем этапе работы было необходимо оценить, насколько пригодны разработанные подходы к стабилизации культур УОМ (поддержанию титра жизнеспособных клеток при длительном хранении), для использования в прикладном аспекте – в технологиях биоремедиации природных объектов (вод и почв) от нефтепродуктов.
На рис. 9 представлены динамики накопления СО2 культурой R. qingshengii при росте на жидкой среде с нефтью в качестве единственного источника углерода.
Рис. 9.
Динамика накопления СО2 культурами R. qingshengii, хранившимися в течении 4 мес., на среде с нефтью. Цифрами обозначены: 1 – культура возрастом 24 ч; 2 – культура без добавок, хранившаяся 4 мес.; 3 ‒ культура, хранившаяся 4 мес. в присутствии СПГВ; 4 ‒ культура, хранившаяся 4 мес. в присутствии МК ПМХ; 5 ‒ культура, хранившаяся 4 мес. в присутствии 1.5% гумата Powhumus.
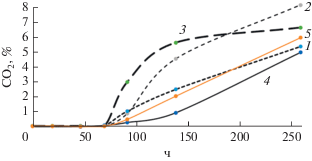
Все культуры R. qingshengii начинали окислять углеводороды нефти с задержкой на 3 сут, что связано с необходимостью подготовки их метаболического аппарата (индукции ферментов окисления углеводородов), поскольку они были выращены на среде LB. В присутствии СПГВГ скорость эмиссии СО2 (пропорциональная скорости деструкции нефтепродуктов) начиналась с максимальной скоростью 0.134% СО2/ч (рис. 9). Скорость деструкции нефтепродуктов 24-часовыми и 4-месячными культурами была в 3 раза ниже (0.04% СО2/ч). Интересно отметить, что в случае 4-месячной культуры наблюдали увеличение скорости деструкции нефтепродукта относительно молодой культуры, что обусловлено большей фенотипической гетерогенностью популяции, вырастающей из покоящихся клеток, и появлению клонов, способных к деструкции углеводородов более успешно, чем доминировавший в исходной популяции вариант, как это было продемонстрировано ранее (Solyanikova et al., 2011; Ivshina et al., 2015; Соляникова и соавт., 2017; Егозарьян и соавт., 2017). Неожиданно низкой оказалась эффективность окисления нефти культурой в присутствии МК из полимочевины и хитозана, поскольку выше было продемонстрировано более высокое содержание жизнеспособных клеток в таких препаратах относительно контроля (табл. 1). Очевидно, для эффективной деструкции нерастворимого субстрата важна степень дисперсности биокатализатора, микроорганизмов. В данном эксперименте специальной десорбции клеток с поверхности МК не проводили, в итоге окисление нефти происходило в гетерофазной (трехфазной) системе “нефть‒жидкость‒микрокапсулы”, и затрудненный контакт нефти и клеток обусловил низкую скорость процесса. При использовании препарата с СПГВ, напротив, создавались условия, благоприятные для окисления нефти: вследствие растворения геля все клетки находились в суспендированном состоянии, их титр был высок, доступ к каплям нефти был максимален. Кроме того, гуматы, входящие в состав СПГВ обладают свойствами поверхностно-активных веществ (Дагуров и соавт., 2005; Park et al., 2011; Kuráň et al., 2014). В их присутствии нефть легче образовывала эмульсию, что также способствовало повышению скорости деструкции углеводородов. Подтверждением является активность еще одного варианта сравнения ‒ культура R. qingshengii, выращенная в тех же условиях (среда LB) и хранившаяся в присутствии гумата Powhumus, что приводит к повышению титра КОЕ культур относительно контроля в ходе длительного хранения, как это описано ранее (Николаев и соавт., 2019) (кривая 5 на рис. 9). Скорость деструкции нефти этим препаратом сопоставима с таковой у молодой культуры.
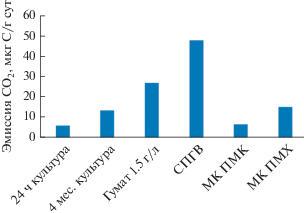
Финальной проверкой эффективности биопрепаратов, стабилизированных с применением новых подходов, была проверка ускорять деструкцию нефти на нестерильной почве, что наиболее близко к реальным условиям биоремедиации. На рис. 10 представлена скорость эмиссии СО2 из микрокосмов чернозема, содержащего 10% нефти, образующегося за счет окисления нефти. Величины эмиссии СО2 для каждого варианта получены путем вычитания скорости эмиссии СО2 почвой без нефти из величины эмиссии этого газа в варианте, где почва загрязнена нефтью, т.е. где окисляется как органическое вещество почвы, так и нефть. Наибольшую активность, как и на жидкой среде, обнаружила культура, стабилизированная с применением СПГВ – скорость эмиссии СО2 была в 3.5 раза выше, чем в контрольной культуре того же возраста, в 8 раз выше, чем 24-ч культурой. Скорость деструкции нефти контрольной культурой 4-месячного возраста была выше, чем свежевыращенной культурой почти в 2 раза. Добавление гумата (1.5 г/л) обусловило большую сохранность клеток (Николаев и соавт., 2019) и, поэтому, – повышение скорости окисления нефтепродуктов. Как и при росте на жидкой среде, агрегация клеток в хранившихся биопрепаратах, даже при условии их большей выживаемости, не обеспечивала более высоких скоростей деструкции нефти относительно контрольного варианта, хранившегося то же время. При этом препарат, в котором клетки находились в составе более плотной биопленки, сформированной на МК из полимолочной кислоты, обнаружил минимальную активность по деструкции нефти.
Рис. 10.
Суточная эмиссия СО2 культурой R. qingshengii, хранившейся в течении 4 мес. в разных условиях, в почвенных микрокосмах с нефтью после 30 сут инкубации.
На основании полученных результатов можно заключить, что созданы новые биокомпозитные материалы, микрокапсулы из полимочевины с хитозаном, микрокапсулы из полимолочной кислоты, силанольно-гуминовый гель, которые повышают выживаемость клеток, иммобилизованных с их применением в 2‒1000 раз относительно контроля. Однако функциональные свойства новых биокомпозитов определяются не только содержанием жизнеспособных клеток, но также способностью клеток к диспергированию в условиях применения, расширенным диссоциативным фенотипическим спектром популяции, вырастающей из биопрепарата, а также наличием дополнительных функций – способностью служить источником углерода и энергии для микроорганизмов, обладать поверхностно-активными и сорбционными свойствами. Наилучшей комбинацией таких свойств обладают биокомпозиты на основе силанольных производных гуминовых веществ и УОМ.
Список литературы
Дагуров А.В. Стом Д.И., Вятчина О.Ф., Балаян А.Э., Кушнарев Д.Ф. О механизме антидотного действия гуматов по отношению к нефтепродуктам. // Aсta Biomedica Scientifica. 2005. Т. 6. № 44. С. 143‒145.
Егозарьян Н.С., Соляникова И.П., Сузина Н.Е., Емельянова Е.В., Поливцева В.Н., Мулюкин А.Л., Эль-Регистан Г.И., Головлёва Л.А. Покоящиеся клетки актинобактерий как основа стабильных препаратов для биоремедиации // IX Международный конгресс “Биотехнология: состояние и перспективы развития”. Москва, 2017. С. 434‒436.
Заявка на изобретение. Россия. 2020. № 2020136378. Николаев Ю.А., Борзенков И.А., Близнец И.В., Лойко Н.Г., Демкина Е.В., Иванова А.Е., Канапацкий Т.А., Эль-Регистан Г.И. Способ получения биопрепаратов живых микроорганизмов с продленным сроком сохранения высокого титра жизнеспособных клеток.
Ларионов И.В., Рыбальченко О.В., Орлова О.Г., Потокин И.Л., Сушко Т.П., Хрущева Т.А., Болдырев А.Г. Адсорбция пробиотических бактерий на целлюлозных сорбентах // Сорбционные и хроматографические процессы. 2011. Т. 11. С. 792‒798.
Николаев Ю.А., Демкина Е.В., Перминова И.В., Лойко Н.Г., Борзенков И.А., Иванова А.Е., Константинов А.И., Эль-Регистан Г.И. Роль гуминовых веществ в пролонгировании жизнеспособности клеток углеводородокисляющих бактерий // Микробиология. 2019. Т. 88. С. 725–729.https://doi.org/10.1134/S0026365619060120
Nikolaev Y.A., Demkina E.V., Loiko N.G., Borzenkov I.A., Ivanona A.E., El’-Registan G.I., Perminova I.V., Konstantinov A.I. Role of humic compounds in viability prolongation of the cells of hydrocarbon-oxidizing bacteria // Microbiology (Moscow). 2019. V. 88. P. 764‒768.
Николаев Ю.А., Лойко Н.Г., Демкина Е.В., Атрощик Е.А., Константинов А.И., Перминова И.В., Эль-Регистан Г.И. Функциональная активность гуминовых веществ в пролонгировании выживания популяции углеводородокисляющей бактерии Acinetobacter junii // Микробиология. 2020. Т. 89. № 1. С. 74‒87.
Nikolaev Y.A., Loiko N.G., Demkina E.V., El’-Registan G.I., Konstantinov A.I., Perminova I.V., Atroshchik E.A. Functional activity of humic substances in survival prolongation of populations of hydrocarbon-oxidizing bacteria Acinetobacter junii // Microbiology (Moscow). 2020. V. 89. P. 74‒85.
Соляникова И.П., Сузина Н.Е., Егозарьян Н.С., Поливцева В.Н., Мулюкин А.Л., Егорова Д.О., Эль-Регистан Г.И., Головлёва Л.А. Особенности структурно-функциональных перестроек клеток актинобактерий BN52 при переходе от вегетативного роста в состояние покоя и при прорастании покоящихся форм // Микробиология. 2017. Т. 86. С. 463‒475.
Solyanikova I.P., Suzina N.E., Egozarjan N.S., Polivtseva V.N., Golovleva L.A., Mulyukin A.L., El-Registan G.I., Egorova D.O. Structural and functional rearrangements in the cells of actinobacteria Microbacterium foliorum BN52 during transition from vegetative growth to a dormant state and during germination of dormant forms // Microbiology (Moscow). 2017. V. 86. P. 476‒486.
Benita S. Microencapsulation. Methods and Industrial Application. 2nd ed. CRC Press, 2005.
Beier S., Bertilsson S. Bacterial chitin degradation-mechanisms and ecophysiological strategies // Fron. Microbiol. 2013. V. 4. Art. 149. https://doi.org/10.3389/fmicb.2013.00149
Biomaterials for Oral and Dental Tissue Engineering / Eds. Tayebi L., Moharamzadeh K. Woodhead Publ., 2018. P. 542.
Chen A.Y., Zhong C., Lu T.K. Engineering living functional materials // ACS Synth. Biol. 2015. V. 4. P. 8‒11. https://doi.org/10.1021/sb500113b
Daiguji H., Takada S., Jay J., Cornejo M., Takemura F. Fabrication of hollow poly(lactic acid) microcapsules from microbubble templates // J. Phys. Chem. 2009. V. 113. P. 15002–15009. https://doi.org/10.1021/jp9053956
Das N., Chandran P. Microbial degradation of petroleum hydrocarbon contaminants // Biotechnol. Res. Int. 2011. V. 2011. Art. 941810. https://doi.org/10.4061/2011/941810
Dorofeev A.G., Panikov N.S. Growth effectivity of microorganisms of different ecological strategies at steady-state conditions // Microbiology. 1988. V. 57. Iss. 4. P. 963−973. Dzionek A., Wojcieszyńska D., Guzik U. Natural carriers in bioremediation // Electr. J. Biotechnol. 2016. V. 23. P. 28–36.
Iqba H.M.N., Keshavarz T. The challenge of biocompatibility evaluation of biocomposites // Biomed. Composit. (2nd ed.). Woodhead Publishing Series in Biomaterials. 2017. P. 303–334.
Ivshina I.B., Mukhutdinova A.N., Tyumina H.A., Vikhareva H.V., Suzina N.E., El’-Registan G.I., Mulyukin A.L. Drotaverine hydrochloride degradation using cyst-like dormant cells of Rhodococcus ruber // Curr. Microbiol. 2015. V. 70. P. 307–314.
Qi X., Ren Y., Wang X. New advances in the biodegradation of poly(lactic) acid // Int. Biodeterior. Biodegrad. 2017. V. 117. P. 215–223. https://doi.org/10.1016/j.ibiod.2017.01.010
Kuran P., Trögl J., Nováková J., Pilařová V., Dáňová P., Pavlorková J., Kozler J., Novák F., Popelka J. Biodegradation of spilled diesel fuel in agricultural soil. Effect of humates, zeolite, and bioaugmentation // Sci. World J. 2014. V. 2014. Art. 642427. https://doi.org/10.1155/2014/642427
Lipson D.A. The complex relationship between microbial growth rate and yield and its implications for ecosystem processes // Frontiers in Microbiology. 2015. V. 6. P. 615. DOI=10.3389/fmicb.2015.00615 Liu S., Xu W. Engineered living materials-based sensing and actuation // Front. Sens. 2020. 1:586300. https://doi.org/10.3389/fsens.2020.586300
Lupu S., Balaure P.C., Lete C., Mihailciuc C. Biocomposite nanomaterials for electrochemical biosensors // Handbook of Nanoelectrochemistry / Eds. Aliofkhazraei M., Makhlouf A. Springer, Cham. 2015. https://doi.org/10.1007/978-3-319-15207-3_39-1
Martens R., Domsch K.H. Microbial degradation of polyurethane foams and isocyanate based polyureas in different media // Water Air Soil Pollut. 1981. V. 15. P. 503–509. https://doi.org/10.1007/BF00279430
Mitropoulouet G., Nedovic V., Goyal A., Kourkoutas Y. Immobilization technologies in probiotic food production // J. Nutrit. Metabolism. 2013. V. 2013. Art. 716861. https://doi.org/10.1155/2013/716861
Opara E.C. Cell Microencapsulation. Methods and Protocol. Springer Science + Business Media. New York, 2017.
Park S., Kim K.S., Kim J.-T., Kang D., Sung K. Effects of humic acid on phytodegradation of petroleum hydrocarbons in soil simultaneously contaminated with heavy metals // J. Environ. Sci. 2011. V. 23. P. 2034‒2041.
Pilla S. Handbook of Bioplastics and Biocomposites Engineering Applications. John Wiley and Sons, 2011. P. 620.
Rudin A., Choi Ph. Biopolymers. The Elements of Polymer Science & Engineering. 3rd ed. Academic Press, 2013. Ch. 13. P. 521‒535.
Sakurai D., Cornejo J.J.M., Daiguji H., Takemura F. Hollow polylactic acid microcapsules fabricated by gas/oil/water and bubble template methods // J. Mater. Chem. A. 2013. V. 46. P. 14562‒14568.
Sihag S., Pathak H., Jaroli D. Factors affecting the rate of biodegradation of polyaromatic hydrocarbons // Int. J. Pure App. Biosci. 2014. V. 2. P. 185‒202.
Sears N.A., Pena-Galea G., Cereceres S.N., Cosgriff-Hernandez E. Hybrid polyurea elastomers with enzymatic degradation and tunable mechanical properties // J. Tissue Eng. 2016. V. 7. Art. 2041731416679363. https://doi.org/10.1177/2041731416679363
Lia Sh.-Sh., Hana H., Zhua X.-L., Jianga X.-B., Konga X.Zh. Preparation and formation mechanism of porous polyurea by reaction of toluene diisocyanate with water and its application as adsorbent for anionic dye removal chinese // J. Polym. Sci. 2015. V. 33. P. 1196–1210.
Sawaguchi A., Ono S., Oomura M., Inami K., Kumeta Y., Honda K., Sameshima-Saito R., Sakamoto K., Ando A., Saito A. Chitosan degradation and associated changes in bacterial community structures in two contrasting soils // Soil Sci. Plant Nutrit. 2015. V. 61. P. 471‒480. https://doi.org/10.1080/00380768.2014.1003965
Solyanikova I.P., Suzina N.E., Golovleva L.A., Mulyukin A.L., El-Registan G.I. Improved xenobiotic-degrading activity of Rhodococcus opacus strain 1cp after dormancy // J. Environ. Sci. Health. Part B: Pesticides. Food Contaminants and Agricultural Wastes. 2011. V. 46. P. 638‒647.
Tang D., Chen Z., Correa-Netto F., Macosko C.W., Hillmyer M.A., Zhang G. Poly(urea ester): A family of biodegradable polymers with high melting temperatures // J. Polym. Sci. Part A: Polymer Chemistry. 2016. V. 54. P. 3795–3799. https://doi.org/10.1002/pola.28355
Volikov A.B., Ponomarenko S.A., Konstantinov A.I., Hatfield K., Perminova I.V. Silanized humic substances act as hydrophobic modifiers of soil separates inducing formation of water-stable aggregates in soils // Catena. 2016a. V. 137. P. 229–236.
Volikov A.B., Ponomarenko S.A., Gutsche A., Nirschl H., Hatfield K., Perminova. I.V. Targeted design of water-based humic substances-silsesquioxane soft materials for nature-inspired remedial // RSC Advances. 2016b. V. 6. P. 48222–48230.
Дополнительные материалы отсутствуют.


