Микробиология, 2022, T. 91, № 1, стр. 75-85
Видовое разнообразие фототрофного пикопланктона морей Карского и Лаптевых
Т. А. Белевич a, b, *, И. А. Милютина b
a Биологический факультет, Московский государственный университет им. М.В. Ломоносова
119992 Москва, Россия
b Научно-исследовательский институт физико-химической биологии им. А.Н. Белозерского,
Московский государственный университет им. М.В. Ломоносова
119992 Москва, Россия
* E-mail: belevich@mail.bio.msu.ru
Поступила в редакцию 12.08.2021
После доработки 30.08.2021
Принята к публикации 31.08.2021
- EDN: VTUUGE
- DOI: 10.31857/S0026365622010025
Аннотация
В работе дана оценка видового состава фототрофных эукариот (ФЭ) с размером клеток менее 3 мкм в осеннем фитопланктоне Карского моря и моря Лаптевых. Метагеномное секвенирование области V4 гена 18S рРНК выявило присутствие в пикофракции планктона исследуемых морей представителей 15 классов водорослей из пяти отделов: Haptophyta, Cryptophyta, Chlorophyta, Ochrophyta и Dinoflagellata. Основной вклад в общее число прочтений ФЭ вносили динофлагелляты и зеленые водоросли класса Mamiellophyceae. Наибольшим таксономическим разнообразием характеризовался отдел Сhlorophyta, в его составе выявлены представители семи классов: Mamiellophyceae, Trebouxiophyceae, Nephroselmidophyceae, Palmophyllophyceae, Pyramimonadophyceae, Chlorodendrophyceae и Chlorophyceae. Такие представители Bolidophyceaea, как Triparma strigata и T. laevis, а также диатомея Skeletonema marinoi впервые выявлены, соответственно, в морях Карском и Лаптевых. Разнообразие таксонов ФЭ определялось гидрологическими условиями районов расположения станций. Индексы видового разнообразия на станциях, расположенных в верхней части эстуария р. Хатанга и в районах обоих морей, прилегающих к эстуариям рек Хатанга и Обь, были выше, чем на самой северной станции моря Лаптевых. Полученные данные показали, что таксономический состав самой мелкой фракции фитопланктона двух шельфовых морей российской Арктики был сходен с выявленным для других арктических районов.
К пикопланктону относятся фототрофные и гетеротрофные организмы с размером клеток менее 3 мкм (Moon-van der Staay et al., 2001; Vaulot et al., 2008). Фототрофные эукариоты (ФЭ) пикоразмера являются одним из ключевых компонентов планктона, дающим существенный вклад в биомассу фитопланктона и первичную продукцию в арктических районах Мирового океана (Tremblay et al., 2009; Demidov et al., 2021). В то же время таксономический состав этой фракции фитопланктона до сегодняшнего дня остается слабоизученным. Идентификация ФЭ пикоразмера традиционными методами микроскопического анализа затруднено из-за отсутствия у многих таксонов выраженных морфологических признаков и разрушения нежных форм при фиксации. В настоящее время для определения видового богатства ФЭ с размером клеток менее 3 мкм с успехом применяются молекулярно-генетические методы, например, флуоресцентная гибридизация in situ (FISH) и метод высокопроизводительного секвенирования (HTS). Генетическое разнообразие ФЭ исследовано во многих районах Мирового океана, включая Арктику (Kirkham et al., 2013; Kilias et al., 2014; Metfies et al., 2016), однако сведения о составе этой размерной фракции фитопланктона в Карском море и море Лаптевых ограничены двумя работами, в которых данные представлены одной пробой из моря Лаптевых и двумя пробами из Карского моря (Metfies et al., 2016; Белевич и соавт., 2020). Наиболее подробно в морях российской Арктики исследовано разнообразие и пространственное распределение пиководорослей класса Mamiellophyceae (Chlorophyta) (Belevich et al., 2021а). В то же время видовой состав ФЭ пикофракции планктона намного разнообразнее и насчитывает представителей более 10 классов водорослей (Vaulot et al., 2008).
Моря Карское и Лаптевых относятся к эпиконтинентальным арктическим водоемам и находятся под влиянием мощного пресноводного стока рек Оби и Енисея, Лены и Хатанги соответственно (Gordeev et al., 1996; Stain, 2000). Гидрофизические и гидрохимические условия в Карском и Лаптевых морях, складывающиеся под влиянием речного стока, во многом определяют структуру и видовой состав микро- и нанофракций фитопланктона (Суханова и соавт., 2010, 2012, 2019). Можно предположить, что таксономический состав и структура сообществ ФЭ пикоразмера также будет зависеть от биотопических условий среды.
Цель настоящей работы состояла в оценке таксономического состава и структуры сообществ фототрофных эукариот пикофракции планктона морей Карского и Лаптевых в конце августа–начале сентября 2017 г.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Отбор проб. Материалом для работы послужили пробы, отобранные в ходе 69-го рейса НИС “Академик Мстислав Келдыш” в конце августа–начале сентября 2017 г. на трех станциях Карского моря и пяти станциях моря Лаптевых между 73°06′–77°32′ с.ш. и 61°18′–130°29′ в.д. (рис. 1).
Для оценки таксономического состава фотоавтотрофных пикоэукариот пробы воды объемом 3–5 л были отобраны с глубины максимума флуоресценции хлорофилла на основании данных вертикального зондирования CTD-зондом SeaBird-911, оснащенного флуориметром (Белевич и соавт., 2019) (табл. 1). Для удаления нано- и микропланктона пробу воды пропускали через камеру обратной фильтрации (диаметр пор фильтра 3 мкм), фильтрат осаждали на картридж Sterivex (“Millipore”, США) с диаметром пор 0.2 мкм, заполняли его лизирующим раствором (50 мM Tris-HCl, 0.75 M сахарозы и 40 мM EDTA; pH 8.3), замораживали и хранили в жидком азоте до дальнейшего анализа.
Таблица 1.
Характеристики станций и молекулярно-генетического разнообразия ФЭ
| Станции | Н | Широта, с.ш. долгота, в.д. |
Rобщ | r | rФЭ | ASVsФЭ | Nтакс | Индекс разнообразия | ||
|---|---|---|---|---|---|---|---|---|---|---|
| Simpson | Shannon | Chao | ||||||||
| 5586 | 45 | 73°06.2′ 61°18.9′ |
75 746 | 67 052 | 8887 | 219 | 49 | 0.79 | 2.21 | 49 |
| 5587 | 0 | 74°47.7′ 66°34.9′ |
92 663 | 60 766 | 14 486 | 282 | 45 | 0.72 | 1.83 | 45 |
| 5588 | 5 | 73°54.4′ 72°59.2′ |
86 444 | 74 581 | 15 116 | 309 | 54 | 0.89 | 2.75 | 54 |
| 5590 | 15 | 77°10.2ʹ 114°40.0ʹ |
111 868 | 105 083 | 11 771 | 234 | 50 | 0.77 | 2.06 | 50 |
| 5591_2 | 0 | 75°24.7ʹ 115°26.6ʹ |
73 164 | 67 372 | 25 010 | 243 | 50 | 0.36 | 1.10 | 50 |
| 5592 | 0 | 75°48.5ʹ 130°29.7ʹ |
76 713 | 70 748 | 11 868 | 267 | 42 | 0.78 | 2.04 | 42 |
| 5627 | 0 | 73°29.6ʹ 108°10.9ʹ |
125 185 | 112 731 | 52 829 | 399 | 71 | 0.89 | 2.74 | 71 |
| 5634 | 5 | 77°38.7ʹ 115°35.6ʹ |
68 897 | 62 646 | 33 275 | 248 | 35 | 0.38 | 0.94 | 35 |
Выделение, амплификация и секвенирование ДНК. Для выделения ДНК использовали набор Nucleospin Plant (“Macherey-Nagel”, Германия), амплификацию проводили с праймерами на область V4 гена 18S рРНК: прямой – EuF-V4 и обратный – picoR2 (Belevich et al., 2018). Для амплификации использовали набор Encyclo Plus PCR Kit (ЗАО “Евроген”, Россия). Условия амплификации следующие: начальная денатурация 94°C – 3 мин; 28 циклов: 94°C – 15 с, отжиг праймеров 64°C – 15 с, элонгация 72°C – 30 с; заключительная элонгация 5 мин. Продукты амплификации были отделены от праймеров препаративным электрофорезом в 1%-ном агарозном гелe c последующим выделением из агарозы с помощью набора MinElute Gel Extraction Kit (“Qiagen”, США). Секвенирование ПЦР продуктов осуществлялось ООО “БиоСпарк” (http://biospark.pro) на платформе “Illumina MiSeq” (США), результаты депонированы в SRA NCBI (http://www.ncbi.nlm.nih.gov), биопроект № PRJNA636255.
Биоинформационный анализ. Анализ полученных по результатам секвенирования нуклеотидных последовательностей, длина которых составляла около 250 н.о., был проведен с использованием алгоритма DADA2 в R (v3.5.2) (Callahan et al., 2016). Биоинформационная обработка включала фильтрацию по качеству и длине, объединение прямых и обратных прочтений, учет одинаковых последовательностей, исключение синглетонов, удаление химерных последовательностей и их классификация с использованием метода варианта последовательности ампликона (ASV). Биоинформационная обработка проводилась согласно протоколу (Vaulot 2018; Tutorial R Dada2 metabarcode analysis https://vaulot.github. io/tutorials/R_dada2_tutorial.html#load-the-necessary-libraries). Для таксономического анализа классификацию полученных ASVs проводили по базе Protist Ribosomal Reference database (PR2 version 4.12.0 https://github.com/pr2database/pr2database/ releases/). Уровень сходства для всех таксономических уровней превышал 97%. Результаты анализа представлены в дополнительных материалах, находящихся в открытом доступе на платформе Figshare (https://figshare.com/articles/ dataset/ Table_S1_The_abundance_of_protists_ASVs_in_each_ sample_and_their_taxonomy_against_PR2_/ 15152178).
Статистический анализ. Анализ данных проводили с помощью программы PRIMER Version 6 (Clarke, Gorley, 2006) Сходство между пробами рассчитывали на основе индекса Брея–Кёртиса. На основании полученных матриц сходства проводили ординацию проб методом многомерного шкалирования (MDS). Ординация выполнялась для данных, трансформированных путем извлечения квадратного корня из величин относительного числа прочтений каждого таксона водорослей для уменьшения влияния на оценки сходства прочтений доминирующих таксонов. Достоверность различий групп проб по структуре сообществ фитопланктона оценивали методом AN-OSIM. Оценку вклада отдельных видов в сходство внутри группы проб и различий между группами проб проводили с помощью процедуры SIMPER. Для расчета индексов разнообразия использовали PAST v.3 (Hammer et al., 2001).
РЕЗУЛЬТАТЫ
Общий состав пикофракции планктона. Общее число качественных прочтений при секвенировании проб составило 710 680, доля последовательностей, относившихся к простейшим, колебалась от 66 до 94% (табл. 1). Основной вклад вносили представители супергруппы SAR (Stramenopiles, Alveolata, Rhizaria), включающей последовательности Ochrophyta, Pseudofungi, Opalozoa, Sagenista, Ciliophora, Dinoflagellata, Perkinsea, Radiolaria и Cercozoa (рис. 2). Также выявлены представители супергрупп Archaeplastida (Chlorophyta), Hacrobia (Cryptophyta, Haptophyta, Picozoa, Telonemia, Centroheliozoa, Katablepharidophyta), Opisthokonta (Choanoflagellida), Amoebozoa (Lobosa) и Apusozoa (Apusomonadidae) (рис. 2).
Рис. 2.
Вклад прочтений, относящихся к разных таксономическим группам в пробах Карского и Лаптевых морей. Группа “Остальные” включает представителей Radiolaria, Lobosa, Apusomonadidae, Centroheliozoa и Katablepharidophyta.
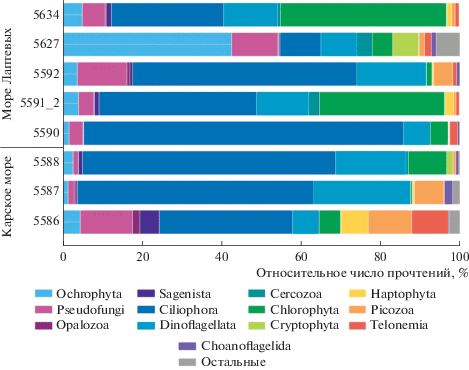
Простейшие, относящиеся к Rhizaria и Opisthokonta, являются исключительно гетеротрофными формами, в то время как представители Alveolata, Hacrobia и Stramenopiles включают в себя фотоавтотрофные, миксотрофные и гетеротрофные организмы. Относительное обилие прочтений Radiolaria, Lobosa, Apusomonadidae, Centroheliozoa и Katablepharidophyta не превышало 1% в каждой пробе. Число выявленных ASVs, принадлежавших к таксонам разного ранга, варьировало от 219 до 399 (табл. 1). При уровне сходства выше 97% до уровня класса и порядка были идентифицированы 80 и 27% всех ASVs соответственно, до уровня рода – 10%, большинство родов были представлены несколькими ASVs.
Поскольку целью наших исследований являются фотоавтотрофные планктонные организмы, то из последующего анализа нами были исключены группы, состоящие исключительно из гетеротрофных форм, а также ASVs из групп, включающих организмы разной трофности, определенные до вида, с гетеротрофным типом питания.
Видовой состав фототрофных эукариот. Число последовательностей ФЭ существенно варьировало между пробами, составляя в среднем 28% от общего числа прочтений простейших (табл. 1). Выявленные ASVs соответствовали таксонам, относящимся к пяти филогенетическим группам, включающим 15 классов водорослей (рис. 3). Всего идентифицировано 126 таксонов, из которых до уровня вида – 43, до уровня рода – 22, остальные относились к группам более высокого ранга – семействам, порядкам и классам водорослей (дополнительные материалы).
Рис. 3.
Относительное обилие прочтений разных таксономических групп ФЭ (<3 мкм) в пробах морей Карского и Лаптевых.
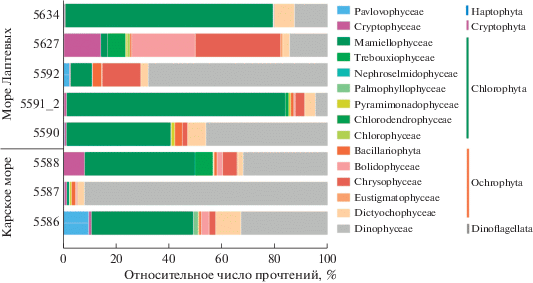
Основной вклад в общее число последовательностей фототрофных организмов исследуемой фракции вносили динофлагелляты и зеленые водоросли класса Mamiellophyceae. Доля последовательностей Dinophyceae и Mamiellophyceae варьировала от 5 до 92% и от 1 до 83% соответственно (рис. 3). Таксоны, чей вклад в общее число прочтений фототрофных эукариот превышал 1%, при дальнейшем изложении будут называться доминирующими.
Среди динофлагеллят доминирующими были роды и виды Gymnodinium sp., Heterocapsa sp., H. pygmaea и Prorocentrum sp. (рис. 4). Большая часть последовательностей динофитовых водорослей была идентифицирована до более высокого уровня – класса (Dinophyceae) и семейства (Gymnodiniaceae), вклад этих групп в общее число прочтений фототрофных организмов колебался от 2 до 50% и от 1 до 36% соответственно (рис. 4).
Рис. 4.
Основные виды и таксономические группы (вклад >1%) и их относительный вклад в общее число прочтений фототрофных эукариот в пикофракции планктона морей Карского и Лаптевых.
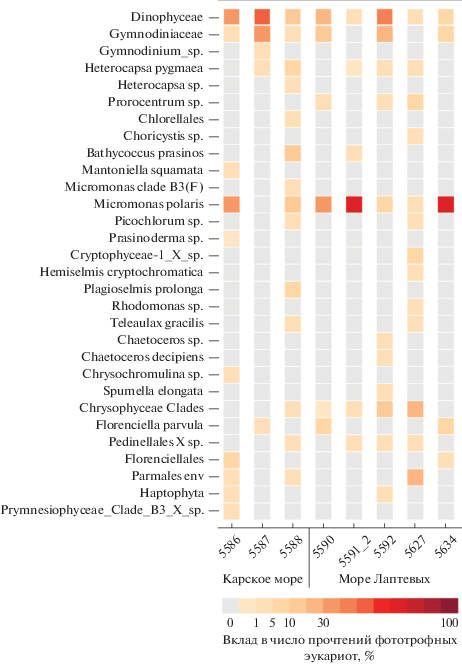
Наибольшим таксономическим разнообразием характеризовался отдел Сhlorophyta, в его составе выявлены представители семи классов: Mamiellophyceae, Trebouxiophyceae, Nephroselmidophyceae, Palmophyllophyceae, Pyramimonadophyceae, Chlorodendrophyceae и Chlorophyceae (рис. 3). Mamiellophyceae доминировали по числу прочтений и были представлены наиболее широко – идентифицированы Bathycoccus prasinos, Mantoniella beaufortii, Mantoniella squamata, Ostreococcus tauri, Micromonas polaris, Micromonas commodа и Micromonas клада B3 согласно Tragin и Vaulot (2019) или клада F согласно Belevich et al. (2018). Последовательности M. polaris были выявлены почти во всех пробах, его вклад варьировал от 2 до 78% от общего числа прочтений фототрофных эукариот (рис. 4). Также в состав доминирующих таксонов вошли B. prasinos, M. squamata и Micromonas клада B3 (F) (рис. 4). Trebouxiophyceae были наиболее широко представлены на станциях 5588, 5627 и 5591_2, расположенных в районах эстуариев Оби и Хатанги. Представители Chlorodendrophyceae и Chlorophyceae были выявлены только на ст. 5627; их доля в общем числе прочтений ФЭ составила 0.1 и 1.1%. Остальные классы Сhlorophyta также были представлены большим числом видов и более крупными таксономическими группами, однако вклад каждого в общее число прочтений не превышал 1% (доп. материалы). Исключение составили два рода – Picochlorum sp. (Trebouxiophyceae) и Prasinoderma sp. (Palmophyllophyceae), их доля в Карском море составила 4% (ст. 5588) и 1% (ст. 5586) соответственно (рис. 4).
Криптофитовые водоросли Hemiselmis cryptochromatica, Plagioselmis prolonga, Teleaulax gracilis, Rhodomonas sp. и крупная таксономическая группа Cryptophyceae-1 X sp. также вошли в состав доминирующих таксонов (рис. 4). Наибольшее обилие Cryptophyta было выявлено на ст. 5627 и в сумме достигало 14% от общего числа прочтений.
Среди диатомовых водорослей представители рода Chaetoceros – Ch. decipiens и Chaetoceros sp., входили в состав доминирующих видов на ст. 5992 моря Лаптевых. Остальные диатомовые, определенные до вида/рода Actinocyclus curvatulus, Attheya sp., Ch. cinctus, Ch. contortus, Ch. neogracilis, Cyclotella sp., Cylindrotheca closterium, Fragilariopsis cylindrus, Nitzschia sp., Porosira glacialis, Skeletonema sp., S. marinoi, Thalassiosira sp., Th. guillardii и Th. nordenskioeldii, а также более крупные группы, такие как Polar-centric-Mediophyceae, Raphid-pennate, Naviculales и Bacillariophyta, были представлены малым числом последовательностей, и вклад каждой не превышал 1%.
Chrysophyceae были представлены двумя родами – Spumella elongata и Dinobryon faculiferum, а также несколькими крупными кладами Chrysophyceae – C, F, I, H, G и E. В состав доминирующих видов Chrysophyceae вошла S. elongata, ее вклад составил 2%. Максимальный вклад Chrysophyceae был выявлен на ст. 5627 (рис. 3).
Также следует отметить присутствие водорослей, относящихся к Bolidophyceae и Dictyochophyceae, и представителей Haptophyta. Из последних двух упомянутых крупных таксономических групп в состав доминирующих вошли Florenciella parvula и Chrysochromulina sp., их вклад превышал 5 и 2% соответственно. Также выявлены гаптофитовые водоросли Phaeocystis pouchetii и Phaeocystis sp., диктиохофитовые Apedinella radians, Pseudochattonella sp., Pseudopedinella sp. и Pseudopedinella elastica, болидофитовые водоросли клады Triparma laevis и Tr. pacifica, вклад каждого из них не достигал 1% (см. доп. материалы). Bolidophyceae доминировали по числу прочтений в составе сообществ ФЭ на ст. 5627 (рис. 3).
Структура и разнообразие сообществ ФЭ. Анализ видового богатства с использованием как классических, широко распространенных в экологии индексов разнообразия Шеннона и Симпсона, так и довольно специфических, предложенных относительно недавно – Chao1, показал, что наиболее разнообразным было сообщество фототрофных эукариот на ст. 5627, расположенной в эстуарии р. Хатанга, в то время как видовой состав пикофракции планктона на самой северной станции 5634, расположенной в море Лаптевых выше 77° с.ш., был наименее богатым (табл. 1).
Анализ структуры сообществ ФЭ, проведенный на основе сходства индекса Брея–Кертиса, выявил две группы станций – I и II (рис. 5). Первая группа (I) включила 3 станции (5588, 5591_2 и 5627), расположенные в устье рек Хатанга и Обь и, следовательно, подверженные влиянию речного стока. Сходство сообществ ФЭ в группе I составило 45%, наибольший вклад вносили M. polaris и H. pygmaea. Группа II объединила остальные станции, расположенные на шельфе обоих исследуемых морей. Сходство ФЭ составило 50% и было обусловлено вкладом Dinophyceae (22%) – крупной группы, включающей неопределенные до уровня рода/семейства ASVs. Проверка методом AN-OSIM показала, что разделение на группы неслучайно, значение R-статистики высоко (R = 0.7), однако уровень значимости относительно низок и составляет 0.5%. Различие между группами I и II составило 64%.
ОБСУЖДЕНИЕ
В настоящей работе охарактеризован таксономический состав фототрофных эукариот во фракции менее 3 мкм осеннего планктона Карского и Лаптевых морей. При использовании фракционной фильтрации в фильтратах помимо пикоформ регистрируются организмы нано- и микропланктона, что обусловлено разрушением нежных форм даже при самой мягкой фильтрации, прохождением через поры фильтра простейших с эластичной клеточной оболочкой, а также присутствием в воде пула растворенной ДНК организмов разных размерных групп (Vaulot et al., 2008; Sørensen et al., 2013). Хотя фракционная фильтрация не дает полного отделения пикофракции от нано- и микроорганизмов, при метагеномном секвенировании она способствует снижению риска недоучета пикоформ из-за малого числа копий их генов (Zhu et al., 2005).
Гидрофизические и гидрохимические условия в районах исследования подробно описаны в работах Белевич и соавт. (2019а, 2019б, 2021), поэтому в данной работе хотелось бы подчеркнуть только основные моменты. На станции 5627, расположенной в эстуарии р. Хатанга, а также на станциях 5591_2 и 5588, находящихся в районах, прилегающих к эстуариям рек Хатанга и Обь, соленость поверхностного слоя воды составила 3.5, 20 и 22‰ соответственно, концентрация кремния – одного из основных параметров, показывающих речное происхождение вод, превышала 25.5 мкмоль/л. В то же время на остальных исследуемых станциях соленость изменялась от 26 до 32‰, а концентрация кремния варьировала от 0.3 до 12.1 мкмоль/л.
Согласно ранее опубликованным работам, параметры обилия, концентрация хлорофилла “а” пикофитопланктона, а также его вклад в концентрацию общего хлорофилла “а” существенно варьировали по акватории исследованных морей (Белевич и соавт., 2019а, 2019б; Belevich et al., 2021b). Так, в Карском море средние значения биомассы и концентрации хлорофилла “а” ФЭ в фотическом слое составили 2.2 ± 1.75 мг С/м3 и 0.5 ± 0.27 мг/м3 соответственно. В море Лаптевых эти показатели составили по биомассе – 4.1 ± 3.0 мг С/м3, по содержанию хлорофилла “а” – 0.1 ± ± 0.05 мг/м3. Вклад пикофракции в общий хлорофилл “а” в Карском море варьировал от 17 до 45%, в море Лаптевых – от 8 до 56%; минимальные значения были приурочены к зонам эстуариев. Полученные оценки биомассы планктонных фотосинтезирующих пикоформ и их вклада в содержание хлорофилла “a” свидетельствуют о существенной роли пикофитопланктона в пелагических сообществах западных частей Карского и Лаптевых морей, тогда как в водах эстуариев Оби и Хатанги вклад пикоформ был невысоким.
Относительно высокая доля последовательностей Dinophyceae в пикофракции осеннего планктона согласуется с сезонной сукцессией развития фитопланктона в арктических морях (Makarevich et al., 2012; Суханова и соавт., 2015; Сергеева и соавт., 2020). Метагеномные исследования, проведенные в море Бофорта, показали, что во фракции менее 5 мкм доля последовательностей динофлагеллят достигает 40% (Joli et al., 2018). Ранее показано, что в сентябре 2012 г. в северной части моря Лаптевых Dinophyceae составляли около 15% от общего количества прочтений (Metfies et al., 2016). Динофитовые водоросли относят к нано- и микропланктону, на сегодняшний день не обнаружено ни одного представителя фототрофных динофлагеллят с размером клетки менее 3 мкм. В тоже время ряд авторов предполагает, что пикодинофлагелляты присутствуют как в океанических, так и в неритических водах, и наиболее вероятно могут относиться к роду Symbiodinium (LaJeunesse et al., 2005; Lin et al., 2006), однако в исследуемых пробах представители этого рода не обнаружены.
Как и во многих арктических районах на большинстве исследованных станций выявлен высокий вклад Chlorophyta (Kilias et al., 2014; Zhang et al., 2015; Metfies et al., 2016). Наибольшее число прочтений принадлежало M. polaris, который относится к арктическим видам, максимальное его обилие выявлено в районах с температурой воды около 0°C. Доминирование M. polaris ранее было отмечено в пикофракции летнего планктона моря Бофорта (Balzano et al., 2012), в проливе Фрама его вклад в число последовательностей класса Mamiellophyceae достигал 66% (Tragin, Vaulot, 2019).
Относительно высокий вклад Trebouxiophyceae выявлен на станциях, расположенных в эстуарии р. Хатанга (ст. 5627), и в районах, примыкающих к эстуариям рек Оби и Хатанги (ст. 5588 и 5691_2). Только на этих станциях присутствовали Nephroselmidophyceae, Chlorodendrophyceae и Chlorophyceae. Представители этих классов относятся как к пресноводным, так и солоноватоводным и морским видам. Учитывая, что на станциях, расположенных на шельфе исследуемых морей, представители этих трех классов водорослей практически отсутствовали, можно предположить, что выявленные филотипы относятся к пресноводным или солоноватоводным видам, и речной сток является основным источником этих водорослей в пикофракции фитопланктона.
Все определенные до рода и вида Cryptophyceae относятся к нано- и микроформам. Среди криптофитовых водорослей не известны виды, имеющие размеры клеток <3 мкм, за исключением водоросли Hillea marina (Vaulot et al., 2008), однако в генбанке NCBI (https://www.ncbi.nlm.nih.gov) последовательность данного вида отсутствует. Ранее Cryptophyceae регистрировались в пикофракции планктона при использовании фракционной фильтрации (Vaulot et al., 2008; Majaneva et al., 2012; Белевич и соавт., 2020). Однако уверенно утверждать, что выявленные ASVs относятся к пикофракции, а также являются фототрофными криптофитовыми водорослями, возможно только после выделения этих таксонов в культуру и их описания. Выявленное высокое обилие криптофитовых водорослей в эстуарии р. Хатанга обусловлено вкладом крупной таксономической группы Cryptophyceae-1. Это позволяет предположить, что представители этой группы относятся к пресноводным и/или солоноватоводным формам.
Диатомовые водоросли присутствовали в составе фитопланктона на всех исследованных станциях. Большинство филотипов были представлены малым количеством прочтений, что подтверждает эффективность использования фракционной фильтрации для клеток с жестким панцирем. Видовой состав пикофракции морских Bacillariophyta насчитывает не более 20 видов (Vaulot et al., 2008). Из всех выявленных таксонов Bacillariophyta к пикоформам можно отнести представителей рода Chaetoceros, который включает виды с размерами клеток <3 мкм, представленные как колониальными формами, так и видами с одиночными клетками. Это дает основание полагать, что обнаруженные в планктоне морей Российской Арктики виды этого рода могут быть представлены в пикофракции отдельными клетками. Например, присутствие колоний Chaetoceros socialis нано- и микроразмеров неоднократно регистрировалось в планктоне Карского моря и моря Лаптевых, что может быть обусловлено наличием в пикофракции отдельных клеток этой водоросли. К пикодиатомеям можно отнести S. marinoi, минимальные размеры отдельных клеток которой соответствуют пикофракции, последовательности этой водоросли выявлены на трех из семи исследуемых станциях. Ранее S. marinoi уже была зарегистрирована в пикофракции планктона северо-западной части Карского моря (Белевич и соавт., 2020), в то время как для моря Лаптевых этот вид определен впервые.
Среди Bolidophyceae в составе пикофракции планктона доминировали представители порядка Parmales. Метагеномный анализ мелкоклеточной (<5 мкм) фракции природных сообществ водорослей в разных районах Мирового океана выявил значительное число филотипов Bolidophyceaе (Kilias et al., 2014; Ichinomiya et al., 2016), при этом большинство из них не было идентифицировано до уровня рода и даже порядка из-за ограниченного числа описанных (культивируемых) организмов этого класса. Сведения о составе Bolidophyceaе морей российской Арктики до настоящего времени было ограничено одной пробой, отобранной в северо-западной части Карского моря, которая показала присутствие в пикофракции фитопланктона Triparma strigata (Белевич и соавт., 2020). Последовательности T. pacifica и клады T. laevis впервые выявлены в Карском море. В море Лаптевых эти виды не обнаружены, все последовательности болидофициевых водорослей относились к различным некультивируемым кладам порядка Parmales, максимальное обилие которых было приурочено к эстуарию р. Хатанга.
Проведенное исследование позволило оценить таксономический состав ФЭ пикоразмера в море Лаптевых и дополнило ранее полученные данные по видовому разнообразию самой мелкой фракции планктона Карского моря. Метагеномный анализ проб, отобранных в Карском море и профильтрованных через фильтр с диаметром пор 3 мкм, выявил представителей 13 классов водорослей, относящихся к 38 родам, в море Лаптевых разнообразие было выше – обнаружено 15 классов и 48 родов водорослей. В связи с методологическими трудностями, связанными с фракционированием, в составе сообществ присутствовали как пикопланктонные формы, так и виды, клеточные размеры которых относятся к нано- и микрофракциям. В то же время нельзя исключать, что крупные фототрофные таксономические группы, определенные, например, на уровне семейств или отрядов, могут включать в себя пока еще не описанные организмы пикоразмера. Таким образом, включение таких групп в анализ оправданно. Состав исследуемых сообществ определялся гидрологическими условиями районов расположения станций. На станциях, расположенных в верхней части эстуария р. Хатанга, а также в прилегающих к эстуариям районах обоих морей, видовое разнообразие было шире за счет присутствия солоноватоводных и пресноводных форм водорослей. Число таксонов на самой северной станции (море Лаптевых) было наименьшим. В целом видовой состав пикофракции фитопланктона шельфовых районов обоих морей был сходен и соответствовал выявленному для других арктических районов. Полученные данные охватывают осенний период и только западные части обоих морей. Для планктонных пикоавтотрофов характерна выраженная пространственно-временнáя изменчивость состава и обилия (Worden 2006; Majaneva et al., 2012; Terrado et al., 2013; Kilias et al., 2013). Для полной оценки таксономического состава ФЭ необходимы исследования с применением метагеномного подхода в другие сезоны и в других районах морей.
Список литературы
Белевич Т.А., Ильяш Л.В., Арашкевич Е.Г., Флинт М.В. Пикофитопланктон моря Лаптевых в осенний период // ДАН. 2019а. Т. 48. № 5. С. 619–623.
Белевич Т.А., Ильяш Л.В., Демидов А.Б., Флинт М.В. Распределение пикофитопланктона на Обском разрезе и в западной части Карского моря // Океанология. 2019б. Т. 59. С. 964–973.
Belevich T.A., Ilyash L.V., Demidov A.B., Flint M.V. Picophytoplankton distribution at the Ob River section and in the western part of the Kara Sea // Oceanology. 2019. V. 59. P. 871–880.
Белевич Т.А., Милютина И.А., Троицкий А.В., Флинт М.В. Пикофитопланктон залива Благополучия (Архипелаг Новая Земля) и прилегающего района Карского моря // Океанология. 2020. Т. 60. С. 545–555.
Belevich T.A., Milyutina I.A., Troitsky A.V., Flint M.V. Picophytoplankton in Blagopoluchia bay (Novaya Zemlya Archipelago) and adjacent part of the Kara Sea // Oceanology. 2020. V. 60. P. 473–482.
Сергеева В.М., Суханова И.Н., Флинт М.В., Полухин А.А., Кременецкий В.В., Федоров А.В., Сахарова Е.Г., Георгиева Е.Ю., Ланге Е.К., Щука С.А. Фитопланктон желоба Св. Анны: влияние абиотических факторов // Океанология. 2020. Т. 60. С. 528–544.
Sergeeva V.M., Sukhanova I.N., Flint M.V., Poluhin A.A., Kremenetskiy V.V., Fedorov A.V., Lange E.K., Shchuka S.A., Sakharova E.G., Georgieva E.U. Phytoplankton of the St. Anna Trough: influence of abiotic factors // Oceanology. 2020. V. 60. P. 458–472.
Суханова И.Н., Флинт М.В., Мошаров С.А., Сергеева В.М. Структура сообществ фитопланктона и первичная продукция в Обском эстуарии и на прилежащем Карском шельфе // Океанология. 2010. Т. 50. № 5. С. 785–800.
Sukhanova I.N., Flint M.V., Mosharov S.A., Sergeeva V.M. Structure of the phytoplankton communities and primary production in the Ob River estuary and over the adjacent Kara Sea Shelf // Oceanology. 2010. V. 50. P. 743–758.
Суханова И.Н., Флинт М.В., Сергеева В.М. Фитопланктон поверхностной опресненной линзы Карского моря // Океанология. 2012. Т. 52. № 5. С. 688–699.
Sukhanova I.N., Flint M.V., Sergeeva V.M. Phytoplankton of the surface desalted lens of the Kara Sea // Oceanology. 2012. V. 52. P. 635–645.
Суханова И.Н., Флинт М.В., Дружкова Е.И., Сажин А.Ф., Сергеева В.М. Фитопланктон северо-западной части Карского моря // Океанология. 2015. Т. 55. С. 605–619.
Sukhanova I.N., Flint M.V., Sazhin A.F., Sergeeva V.M., Druzhkova E.I. Phytoplankton in the northwestern Kara Sea // Oceanology. 2015. V. 55. P. 547–560.
Суханова И.Н., Флинт М.В., Фёдоров А.В., Сахарова Е.Г., Артемьев В.А., Маккавеев П.Н., Недоспасов А.А. Фитопланктон Хатангского залива, шельфа и континентального склона западной части моря Лаптевых // Океанология. 2019. Т. 59. С. 724–733.
Sukhanova I.N., Flint M.V., Artemyev V.A., Makkaveev P.N., Nedospasov A.A., Fedorov A.V., Sakharova E.G. Phytoplankton of the Khatanga Bay, shelf and continental slope of the western Laptev Sea // Oceanology. 2019. V. 59. P. 648–657.
Balzano S., Marie D., Gourvil P., Vaulot D. Composition of the summer photosynthetic pico and nanoplankton communities in the Beaufort Sea assessed by T-RFLP and sequences of the 18S rRNA gene from flow cytometry sorted samples // ISME J. 2012. V. 6. P. 1480–1498.
Belevich T.A., Milyutina I.A., Abyzova G.A., Troitsky A.V. The pico-sized Mamiellophyceae and a novel Bathycoccus clade from the summer plankton of Russian Arctic Seas and adjacent waters // FEMS Microbiol. Ecol. 2021a. V. 97. Art. fiaa251.
Belevich T.A., Demidov A.B., Makkaveev P.N., Shchuka S.A., Flint M.V. Picophytoplankton distribution along Khatanga Bay-shelf-continental slope environment gradients in the western Laptev Sea // Heliyon. 2021b. V. 7. e06224. P. 1–9.
Belevich T.A., Ilyash L.V., Milyutina I.A., Logacheva M.D., Goryunov D.V., Troitsky A.V. Photosynthetic picoeukaryotes in the land-fast ice of the White Sea, Russia // Microb. Ecol. 2018. V. 75. P. 582–597.
Callahan B.J., McMurdie P.J., Rosen M.J., McMurdie P.J., Holmes S.P. Bioconductor Workflow for Microbiome Data Analysis: from raw reads to community analyses [version 2; peer review: 3 approved] F1000Research. 2016. 5. P. 1492–1541.
Clarke K.R., Gorley R.N. PRIMER v6.: User Manual/Tutorial. PRIMER-E. Plymouth, 2006. 192 p.
Demidov A.B., Sukhanova I.N., Belevich T.A., Flint M.V., Gagarin V.I., Sergeeva V.M., Eremeeva E.V., Fedorov A.V. Size-fractionated surface phytoplankton in the Kara and Laptev seas: environmental control and spatial variability // Mar. Ecol. Progr. Ser. 2021. V. 664. P. 59–77.
Hammer Ø., Harper D.A.T., Ryan P.D. 2001. Past: Paleontological Statistics Software Package for Education and Data Analysis // Palaeontol. Electron. V. 4. Art. 4. P. 1–9.
Gordeev V.V., Martin J.M., Sidorov I.S., Sidorova M.V. A reassessment of the Eurasian river input of water, sediment, major elements, and nutrients to the Arctic Ocean // Amer. J. Sci. 1996. V. 296. P. 664–691.
Ichinomiya M., Lopes dos Santos A., Gourvil P., Yoshikawa S., Kamiya M., Ohki K., Audic S., de Vargas C., Noel M.-H., Vaulot D., Kuwata A. Diversity and oceanic distribution of the Parmales (Bolidophyceae), a picoplanktonic group closely related to diatoms // ISME J. 2016. V. 10. P. 2419–2434.
Joli N., Gosselin M., Ardyna M., Babin M., Onda D.F., Tremblay J.-É., Lovejoy C. Need for focus on microbial species following ice melt and changing freshwater regimes in a J-anus Arctic Gateway // Sci. Rep. 2018. V. 8. Art. 9405.
Kilias E., Wolf C., Nöthig E.-M., Peeken I., Metfies K. Protist distribution in the western Fram Strait in summer 2010 based on 454-pyrosequencing of 18S rDNA // J. Phycol. 2013. V. 49. P. 996–1010.
Kilias E.S., Nöthig E-M., Wolf C., Metfies K. Picoeukaryote plankton composition of West Spitsbergen at the entrance to the Arctic Ocean // J. Eukaryot. Microbiol. 2014. V. 61. P. 569–579.
Kirkham A.R., Lepère C., Jardillier L.E., Not F., Bouman H., Mead A., Scanlan D.J. A global perspective on marine photosynthetic picoeukaryote community structure // ISME J. 2013. V. 7. P. 922–936.
LaJeunesse T.C., Lambert G., Anderson R.A., Coffroth M.A., Galbraith D. W. Symbiodinium (Pyrrhophyta) genome sizes (DNA content) are smallest among dinoflagellates // J. Phycol. 2005. V. 41. P. 880–886.
Lin S., Zhang H., Hou Y., Miranda L., Bhattacharya D. Development of a dinoflagellate-oriented PCR primer set leads to detection of picoplanktonic dinoflagellates from Long Island sound // Appl. Environ. Microbiol. 2006. V. 72. P. 5626–5630.
Majaneva M., Rintala J.M., Piisila M., Fewer D.P., Blomster J. Comparison of wintertime eukaryotic community from sea ice and open water in the Baltic Sea, based on sequencing of the 18S rRNA gene // Polar Biol. 2012. V. 35. P. 875–889.
Makarevich P., Druzhkova E., Larionov V. Primary producers of the Barents Sea, diversity of ecosystems // Diversity of Ecosystems / Ed. Prof. Mahamane Ali. InTech, 2012. P. 367–392.
Metfies K., von Appen W.-J., Kilias E., Nicolaus A., Nöthig E.-M. Biogeography and photosynthetic biomass of Arctic marine pico-eukaroytes during summer of the record sea ice minimum 2012 // PLoS One. 2016. V. 11. e0148512. P. 1–20.
Moon-van der Staay S.Y., De Wachter R., Vaulot D. Oceanic 18S rDNA sequences from picoplankton reveal unsuspected eukaryotic diversity // Nature. 2001. V. 409. P. 607–610.
Sørensen N., Daugbjerg N., Richardson K. Choice of pore size can introduce artefacts when filtering Picoeukaryotes for molecular biodiversity studies // Microb. Ecol. 2013. V. 65. P. 964–968.
Stain R. Circum Arctic river discharge and its geological record // Int. J. Earth Sci. 2000. V. 89. P. 447–449.
Terrado R., Scarcella K., Thaler M., Vincent W.F., Lovejoy C. Small phytoplankton in Arctic seas: vulnerability to climate change // Biodiversity. 2013. V. 14. P. 2–18.
Tragin M., Vaulot D. Novel diversity within marine Mamiellophyceae (Chlorophyta) unveiled by metabarcoding // Sci. Rep. 2019. V. 9. Art. 5190.
Tremblay G., Belzile C., Gosselin M., Poulin M., Roy S., Tremblay J.-É. Late summer phytoplankton distribution along a 3500 km transect in Canadian Arctic waters: strong numerical dominance by picoeukaryotes // Aquat. Microb. Ecol. 2009. V. 54. P. 55–70.
Vaulot D., Eikrem W., Viprey M., Moreau H. The diversity of small eukaryotic phytoplankton (≤3 µm) in marine ecosystems // FEMS Microb. Rev. 2008. V. 32. P. 795–820.
Worden A.Z. Picoeukaryote diversity in coastal waters of the Pacific Ocean // Aquat. Microb. Ecol. 2006. V. 43. P. 165–175.
Zhang F., He J., Lin L., Jin H. Dominance of picophytoplankton in the newly open surface water of the central Arctic Ocean // Polar Biol. 2015. V. 38. P. 1081–1089.
Zhu F., Massana R., Not F., Marie D., Vaulot D. Mapping of picoeucaryotes in marine ecosystems with quantitative PCR of the 18S rRNA gene // FEMS Microbiol. Ecol. 2005. V. 52. P. 79–92.
Дополнительные материалы отсутствуют.




