Микробиология, 2022, T. 91, № 1, стр. 62-74
Характеристика микобиоты почв Земли Франца-Иосифа методами микробиологического посева и ПЦР в реальном времени
Д. А. Никитин a, *, М. В. Семенов a
a Почвенный институт имени В.В. Докучаева
119017 Москва, Россия
* E-mail: dimnik90@mail.ru
Поступила в редакцию 06.07.2021
После доработки 06.09.2021
Принята к публикации 22.09.2021
- EDN: RPLKJF
- DOI: 10.31857/S0026365622010098
Аннотация
При помощи методов микробиологического посева и ПЦР в реальном времени охарактеризована микобиота псаммоземов, пелоземов, криоземов, литоземов и серогумусовых почв архипелага Земля Франца-Иосифа (ЗФИ). Суммарная численность микроскопических грибов составляла от 3.10 × × 101 КОЕ/г почвы в глубоких минеральных горизонтах до 6.56 × 103 КОЕ/г почвы в поверхностных органогенных слоях. Выделено 47 видов микромицетов, относящихся к 32 родам из 3 отделов. Преобладали психротолерантные штаммы, растущие как при 5°С, так и при 25°С. Наибольшим видовым разнообразием характеризовались роды Penicillium (5 видов), Cadophora (4 вида), Cladosporium, Phoma и Thelebolus (по 3 вида). Наиболее многочисленными являлись характерные для холодных экосистем и сапротрофные роды Penicillium, Hyphozyma, Phoma, Antarctomyces и Pseudogymnoascus. В посевах чаще всего (более 40% встречаемости) были отмечены Pseudogymnoascus pannorum, Hyphozyma variabilis var. variabilis, Penicillium aurantiogriseum, Thelebolus microsporus и Goffeauzyma gilvescens. Значительная часть (30%) выявленных видов входит в базу данных BSL патогенных для человека и животных видов. Численность копий ITS рРНК грибов варьировала от 1.0 × 109 до 4.40 × 1010 копий генов/г почвы в минеральных и органогенных слоях соответственно. Пространственная неоднородность микобиоты в почвах архипелага ЗФИ выявлена в пределах верхнего 5-сантиметрового слоя, тогда как более глубокие горизонты характеризовались схожей структурой сообществ микромицетов.
Земля Франца-Иосифа (ЗФИ) – самый северный архипелаг восточного полушария (с юга на север простирается от 79° с.ш. до 82° с.ш.), в состав которого входит 192 острова (Мосеев и соавт., 2019). Большая часть островов покрыта покровными ледниками мощностью от 100 до 500 м, определяющими физико-географические условия местных ландшафтов (Горячкин и соавт., 2017). Климат ЗФИ морской арктический с продолжительной холодной (до –24.4°C) зимой, сильными ветрами (до 40–50 м/с) и существенными осадками (до 200–300 мм/год) (Дженюк, 2014). Почвенный покров ЗФИ представлен сложным чередованием псаммоземов, литоземов, криоземов, серогумусовых мерзлотных почв, а также криотурбированных пелоземов (Горячкин и соавт., 2017; Никитин и соавт., 2020).Одни геоботаники относят ЗФИ к зоне полярных пустынь (Александрова, 1981, 1983; Матвеева и соавт., 2015), а другие – к полярной подзоне тундры (Сафронова, Юрковская, 2015). Растительный покров архипелага сильно разрежен (Матвеева и соавт., 2015), что предопределяет главенствующую биогеоценотическую роль микро-организмов в местных экосистемах (Никитин и соавт., 2021а).
Почвенные микроорганизмы выполняют важные экологические функции (осуществление многих этапов циклов макроэлементов, трансформации органического вещества, выветривании горных пород и др.), поэтому их комплексное изучение является приоритетным направлением в понимании природы полярных регионов (Flocco et al., 2019). Большая часть микроорганизмов в тундровых почвах (до 90% от общей микробной биомассы) представлена грибами (He et al., 2020), которые играют важную роль для всех наземных экосистем – разлагают и трансформируют органическое вещество, преобразуют геологические породы, участвуют почвообразовании и питании растений (Добровольская и соавт., 2015). Изучение грибов высокоарктических территорий России ведeтся более 60 лет (Матвеева и соавт., 2015), но внимание микологов до сих пор преимущественно сконцентрировано на лишайниках (Журбенко, 2011) и макромицетах (Матвеева и соавт., 2015; Ежов и соавт., 2016). По микроскопическим грибам ЗФИ опубликовано лишь четыре работы (Bergero et al., 1999; Кирцидели, 2015, 2016; Никитин и соавт., 2019), и только одна выполнена с применением молекулярно-биологических методов (Никитин и соавт., 2017б). Первые данные о таксономическом разнообразии и экологии микромицетов ЗФИ были получены недавно по отдельным точкам островов Галля, Нортбрук, Кейна (Bergero et al., 1999) и Хейса (Кирцидели, 2015, 2016). В настоящее время признано, что видовое богатство микобиоты ЗФИ изучено фрагментарно (Матвеева и соавт., 2015).
Целью работы являлась оценка численности рибосомальных генов ITS рРНК грибов, а также количества КОЕ и таксономического разнообразия культивируемых микромицетов в псаммоземах, пелоземах, криоземах, литоземах и серогумусовых почвах архипелага Земля Франца-Иосифа.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Условия местных ландшафтов. Средняя температура воздуха в июле на исследуемой территории не превышает 0.7°C. Особенностью архипелага являются частые туманы и высокая относительная влажность воздуха в течение всего года 88–100% (Дженюк, 2014).
Рельеф ЗФИ низкогорен (от 600 до 670 м) и слабо расчленен эрозионно-денудационными равнинами (Мосеев и соавт., 2019). Большинство островов представляют собой останцы почти горизонтального базальтового плато (от 50 до 300 м), расчлененного тектоническими разломами, почти полностью погребенными под ледниковым покровом. Горные породы ЗФИ сложены алевро-пелитовыми отложениями, песчаниками и известняками, перекрытыми базальтами (Кирцидели, 2015).
На архипелаге произрастает более 50 видов сосудистых растений, в том числе полярный мак, камнеломки, крупки и другие (Мосеев, Сергеенко, 2017). Однако ведущее значение в формировании растительного покрова ЗФИ имеют мхи и лишайники, представленные 124 и 229 видами соответственно (Мосеев и соавт., 2019).
Почвенный покров ЗФИ представлен: псаммоземами глееватыми в пустошах о. Алджер; псаммоземами криотурбированными мерзлотными и серогумусовыми грубогумусированными мерзлотными почвами в тундрах о. Ферсмана; псаммоземами глеевыми, псаммоземами мерзлотными брюнифицированными и криоземами глееватыми в тундрах и пустошах о. Хейса; литоземами грубогумусированными и серогумусовыми почвами в тундрах о. Гукера; литоземами грубогумусовыми мерзлотными, серогумусовыми мерзлотными и серогумусовыми перегнойно-грубогумусированными почвами, пелоземами перегнойными криотурбированными в тундрах о. Земля Александры (Горячкин и соавт., 2017; Никитин и соавт., 2020).
Исследованные почвы расположены на островах ЗФИ – Земля Александры, Ферсмана, Хейса, Алджер и Гукера, ключевые точки которых представлены на рис. 1. На о. Алджер изучен профиль ZFI-A-01 псаммозема глееватого/TurbicCryosol (Arenic), расположенного в точке с координатами 80°21′34.5′′ с.ш., 56°13′20.2′′ в.д. На о. Ферсмана проанализирован профиль ZFI-F-02 серогумусовой грубогумусированной мерзлотной почвы/ Haplic Cryosol (Humic), расположенный в точке с координатами 80°37′43.4′′ с.ш., 57°58′42.4′′ в.д. Кроме того, на данном острове исследован профиль ZFI-F-03 псаммозема криотурбированного мерзлотного/Turbic Cryosol (Humiс) в 80°37′46.9′′ с.ш., 57°58′40.4′′ в.д. Изучен профиль ZFI-H-05 криозема глееватого Oxyaquic Cryosol (Arenic) мыса Зенит о. Хейса, расположенного в точке с координатами 80°36′47.4′′ с.ш., 57°29′38.4′′ в.д. На о. Гукера в районе бухты Тихой, в точке 80°20′18.1′′ с.ш., 52°47′07.9′′ в.д. проанализирован профиль литозема грубогумусированного/Eutric Leptosol (Loamic, Humic) ZFI-HK-08. Кроме того, на мысе Мелехова о. Земля Александры, в точке с координатами 80°42′59.9′′ с.ш., 47°53′33.8′′ в.д. исследован профиль ZFI-AX-10 литозема грубогумусованного мерзлотного/Skeletic Oxyaquic Cryosol (Loamic, Humic).
Условия отбора и хранения образцов, а также детальные описания почвенных разрезов приведены ранее (Никитин и соавт., 2021а). Координаты ключевых точек, классификационный статус почв и некоторые физико-химические свойства исследованных образцов представлены в таблице. Влажность образцов составляла около 45% и учитывалась при расчете количества копий генов ITS рРНК, а также КОЕ микромицетов на 1 г сухой почвы.
Количественную оценку содержания рибосомальных генов грибов осуществляли методом полимеразной цепной реакции (ПЦР) в реальном времени по стандартной методике для почвенных образцов (Никитин и соавт., 2020). Для учета грибов использовали праймеры на регион ITS. Реакцию проводили в амплификаторе Real-Time CFX96 Touch (“EvaGreen Supermix”). Реакционную смесь готовили из препарата EvaGreen Supermix (“Bio-Rad”). В качестве количественных стандартов концентрации генов ITS рРНК для грибов использовали растворы клонированных фрагментов рибосомального оперона штамма дрожжей Saccharomyces cerevisiae Meyen 1B-D1606. Для каждого образца реакцию проводили в 3-х повторностях. Концентрацию генов рассчитывали с помощью программного обеспечения CFX Manager, пересчитывая количество генов в ДНК на 1 г почвы с учетом разведений и массы навески. Формула пересчета концентрации генов такова:
где N – количество копий региона ITS2 грибов в 1 г сухой почвы; n – количество копий региона ITS2 грибов в 1 мкл ДНК; V – суммарный объем раствора ДНК (100 мкл); v – используемый объем раствора ДНК для РТ-ПЦР (1 мкл); m – масса навески почвы (0.5 г); W – влажность почвы.
Численность КОЕ и таксономический состав культивируемых микроскопических грибов определяли методом микробиологического посева (Звягинцев, 1991). Для этого почвенную суспензию перед посевом обрабатывали с помощью встряхивателя Vortex (Латвия) в течение 5 мин при 3500 об./мин. Аликвоту 100 мкл суспензии почвы с разведением 1 : 100 помещали на дно стерильных чашек Петри, в которые заливали расплавленную и охлажденную до 50°С среду Чапека (Domsch et al., 2007) с добавлением стрептомицина (100 мг/л) для предотвращения роста бактерий. Данную методику применяли, поскольку небольшой прогрев и равномерный контакт поверхности грибных спор и мицелия с питательной средой оказывают благоприятное воздействие на рост микроскопических грибов, рост которых не лимитируется низким содержанием кислорода (Литвинов, 1969). Инкубацию посевов проводили в термостатах при температуре 25°С в течение 2–3 нед., а также при 5°С в течение 3–4 нед., чтобы дополнительно выделить психротолерантные виды микромицетов и дрожжей (Hassan et al., 2016). Посев осуществляли в пятикратной повторности для каждого образца при каждой температуре инкубации. По прошествии выше указанного времени производили учет общего числа колоний мицелиальных грибов и дрожжей, а также их первичную идентификацию по макро- и микрокультуральным признакам (Domsch et al., 2007; Seifert, Gams, 2011) с помощью микроскопа Биомед-5 (“Биомед”, Россия).
Для изолятов неясного таксономического положения и стерильных мицелиев идентификацию проводили по молекулярно-биологическим признакам с анализом участков ITS1–ITS2 рДНК. Выделение ДНК из чистых культур проводили по методике Глушаковой и соавт. (2011): биомассу 5–6-суточной культуры переносили в 2 мл эппендорфы, добавляли 400 мкл стеклянных шариков (диаметром 300–500 мкм) и 500 мкл лизирующего буфера (TrisBase 50 мM, NaCl 250 мM, ЭДТА 50 мM, SDS 0.3%; pH 8). Приготовленную смесь взбалтывали на вортексе на скорости 3500 об./мин в течение 15 мин, затем инкубировали 1 ч при температуре 65°С, после снова встряхивали на вортексе 15 мин и центрифугировали (13.4 об./мин) 10 мин, отбирали надосадочную жидкость. Для амплификации региона рДНК, содержащего D1/D2 домен региона 26S рДНК, использовали праймеры ITS1f (5'-CTTGGTCATTTAGAGGAAGTA) и NL4 (5'-GGTCCGTGTTTCAAGACGG) и смеси для ПЦР ScreenMix (ЗАО “Евроген”, Москва). Амплификатор использовали по следующей программе: (начальная денатурация – 2 мин при температуре 96°С; затем 35 циклов: денатурация – 20 с при температуре 96°С, отжиг праймеров – 50 с при температуре 52°С, синтез ДНК – 1.5 мин при температуре 72°С; конечная достройка 7 мин при температуре 72°С). Очистку ПЦР-продукта проводили с использованием набора BigDye Terminator Purification Kit (“Applied Biosystems”, США). Для секвенирования использовали праймер NL4. Секвенирование ДНК проводили с помощью набора реактивов BigDye Terminator V3.1 Cycle Sequencing Kit (“Applied Biosystems”, США) с последующим анализом продуктов реакции на секвенаторе Applied Biosystems 3130xl Genetic Analyzer в Научно-производственной компании “Синтол” (Москва). Идентификацию по полученным хроматограммам проводили, используя данные генбанка NCBI и СABI Bioscience Database Index Fungorum.
Общее α-разнообразие грибных сообществ оценивали по индексу Шеннона; β-разнообразие сообществ микромицетов оценивали с использованием многомерного неметрического шкалирования (nMDS) по метрике Брэя–Кертиса (Семенов и соавт., 2019a, 2019б). Статистическую обработку данных проводили с помощью программ Microsoft Оffice Excel 2019 и Stаtistica 10.0.
РЕЗУЛЬТАТЫ
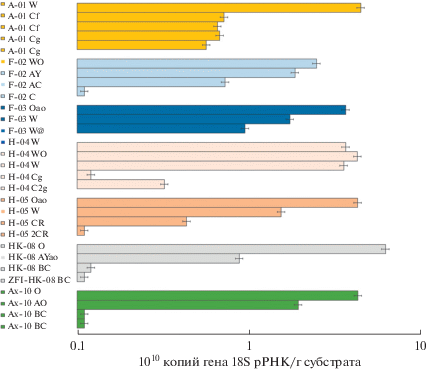
Количественная оценка содержания рибосомальных генов микобиоты. Численность копий генов ITS рРНК грибов в образцах почв ЗФИ варьировала от 1.00 × 109 до 4.40 × 1010 копий генов/г почвы. Наименьшие значения выявлены в минеральных горизонтах BC литозема грубогумусового мерзлотного о. Земля Александры (профиль ZFI-Ax-10) и ВС2 литозема грубогумусированного о. Гукера (профиль ZFI-HK-08) (рис. 2). Несколько больше грибов (от 1.11 × 109 до 1.12 × 109 копий генов/г почвы) обнаружено в глубинном 2CR и надмерзлотном горизонте Cg криозема глееватого о. Хейса (профиль ZFI-H-05) и в породе С серогумусовой грубогумусированной мерзлотной почве о. Ферсмана (профиль ZFI-F-02). Наибольшая численность копий генов ITS грибов определена для поверхностного горизонта W псаммозема глееватого о. Алджер (профиль ZFI-A-01). Также высокие значения (4.21–4.40 × 1010 копий генов/г почвы) отмечены в моховом очесе О литозема грубогумусового мерзлотного о. Земля Александры (профиль ZFI-Ax-10), в поверхностном горизонте Оао криозема глееватого о. Хейса (профиль ZFI-H-05) и в органогенном поверхностном горизонте WO псаммозема глеевого мерзлотного о. Хейса (профиль ZFI-H-04). В целом содержание копий рибосомальных генов грибов всех исследованных профилей резко сокращается от поверхностных к надмерзлотным горизонтам вниз по профилю. Наибольшая разница (почти 2 математических порядка) между численностью копий рибосомальных генов грибов в поверхностных и глубинных горизонтах характерна для литозема грубогумусированного о. Гукера (профиль ZFI-HK-08) и литозема грубогумусового мерзлотного о. Земля Александры (профиль ZFI-Ax-10). Суммарная доля грибов в органогенных горизонтах от их общего количества по всему профилю варьирует от 65% для литозема грубогумусового мерзлотного о. Земля Александры (профиль ZFI-Ax-10) до 84–95% в серогумусовой грубогумусированной мерзлотной почве о. Ферсмана (профиль ZFI-F-02). В то же время, для псаммозема глеевого мерзлотного о. Хейса (профиль ZFI-H-04) выявлен второй максимум значений содержания рибосомальных генов грибов в надмерзлотном горизонте Cg. Говоря обо всей толще почвенного профиля, наименьшее количество грибных генов (5.10 × × 1010 копий генов/г почвы) было обнаружено в серогумусовой грубогумусированной мерзлотной почве о. Ферсмана (профиль ZFI-F-02), а больше всего (1.18 × 1011 копий генов/г почвы) – в псаммоземе глеевом мерзлотном о. Хейса (профиль ZFI-H-04).
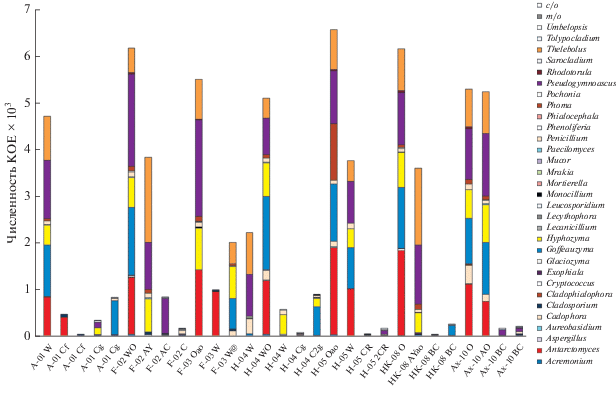
Численность КОЕ и таксономический состав сообществ культивируемых микромицетов. Численность колоний микромицетов в почвах ЗФИ варьировала от 3.10 × 101 до 6.56 × 103 КОЕ/г почвы (рис. 3). Наименьшие значения (порядка 30–70 КОЕ/г почвы) выявлены в надмерзлотном горизонте Cg псаммозема глеевого мерзлотного о. Хейса (профиль ZFI-H-04). Максимум микромицетов (от 2.21 × 103 до 6.56 × 103 КОЕ/г почвы) обнаружен в поверхностном горизонте W псаммозема глееватого о. Алджер (профиль ZFI-A-01), в моховом очесе О и подповерхностном AY литозема грубогумусированного о. Гукера (профиль ZFI-HK-08). Для 14% образцов количество микромицетов не превышало 101 КОЕ/г почвы; для 41% образцов – 102 КОЕ/г почвы; для 45% – 103 КОЕ/г почвы. В целом численность культивируемых микромицетов уменьшается вниз по почвенному профилю.
Выделено 47 видов микромицетов, относящихся к 32 родам из 3 отделов (табл. 1S), а также 2 типа (гиалиновый и меланизированный) стерильного мицелия. Отдел Mucoromycota представлен родами Mortierella, Mucor и Umbelopsis. Отдел Ascomycota – 3 телеоморфными (Antarctomyces, Pseudogymnoascus, Thelebolus) и 18 анаморфными родами. Отдел Basidiomycota представлен исключительно дрожжами родов Cryptococcus, Glaciozyma, Goffeauzyma, Leucosporidium, Mrakia, Phenoliferia и Rhodotorula. Наибольшее число родов (по 3) принадлежит к порядкам Eurotiales, Hypocreales и Mucorales.
Таблица 1.
Свойства исследованных почв Земли Франца-Иосифа (Никитин и соавт., 2021а)
| Горизонт | Глубина, см | C, % | N, % | Плотность, г/см3 |
|---|---|---|---|---|
| о. Алджер. Псаммозем глееватый/TurbicCryosol (Arenic) | ||||
| W, трещина | 0–1 | 1.54 | 0.08 | 0.8 |
| WCf, полигон | 0–2 | 0.19 | 0.02 | 0.8 |
| Сf, полигон | 2–13 | 0.08 | 0.01 | 1.3 |
| Cf, трещина | 20–22 | 1.03 | 0.03 | 1.3 |
| Cg, трещина | 13–45 | 0.08 | 0.01 | 1.4 |
| Cg, трещина | 13–45 | 0.06 | 0.01 | 1.4 |
| о. Ферсмана. Серогумусовая грубогумусированная мерзлотная/HaplicCryosol (Humic) | ||||
| Корка лишайника | 0.3–0 | 6.29 | 0.41 | 1.0 |
| AY | 0–5 | 1.04 | 0.07 | 0.7 |
| AC | 5–17 | 0.87 | 0.06 | 1.0 |
| С | 17–40 | 1.11 | 0.07 | 1.2 |
| о. Ферсмана. Псаммозем криотурбированный мерзлотный/TurbicCryosol (Humiс) | ||||
| Oao | 0–2 | 27.9 | 1.13 | 0.6 |
| Kорка | 0–5 | 3.18 | 0.28 | 1.0 |
| W | 2–5 | 1.29 | 0.13 | 1.0 |
| W@ | 2–5 (10) | 1.55 | 0.15 | 0.9 |
| [AO1]@ | 10–30 (35) | 3.76 | 0.35 | 0.9 |
| BC@, h | 5–35 (45) | 0.79 | 0.08 | 0.9 |
| [AO2]@ | 35–48 | 5.87 | 0.55 | 1.0 |
| D | 46–48 | 0.80 | 0.05 | 1.2 |
| о. Хейса, мыс Зенит. Псаммозем глеевый мерзлотный/ReductaquicCryosol (Arenic) | ||||
| W | 0–5 | 0.49 | 0.10 | 0.9 |
| Корка лишайника | 0–3 | 3.22 | 0.21 | 1.0 |
| W | 1–2 | 1.34 | 0.13 | 1.0 |
| Cg | 20–25 | 0.06 | 0.01 | 1.2 |
| C2g | 40–50 | 0.09 | 0.01 | 1.2 |
| о. Хейса, мыс Зенит. Криозем глееватый OxyaquicCryosol (Arenic) | ||||
| Oao | 3–0 | 3.07 | 0.21 | 0.6 |
| W | 0–5 | 0.44 | 0.05 | 0.9 |
| Bg | 5–15 | 0.13 | 0.04 | 1.2 |
| CR | 15–20 | 0.08 | 0.01 | 1.2 |
| 2CR | 20–50 | 0.09 | 0.01 | 1.1 |
| о. Гукера, бухта Тихая. Литозем грубогумусированный/EutricLeptosol (Loamic, Humic) | ||||
| O | 0–5 | 30.66 | 1.69 | 0.6 |
| AYao | 5–6 (10) | 3.69 | 0.36 | 0.9 |
| BC | 6 (10)–15 | 1.46 | 0.17 | 1.2 |
| BC2 | 15–30 | 1.27 | 0.12 | 1.3 |
| о. Земля Александры. Литозем грубогумусовый мерзлотный/SkeleticOxyaquicCryosol (Loamic) | ||||
| О | 0–2 | – | – | – |
| AO | 2–8 | 1.11 | 0.09 | 0.8 |
| BC | 8–15 | 0.63 | 0.06 | 1.2 |
| BC | 15–25 | 0.45 | 0.04 | 1.3 |
Таксономическое разнообразие микромицетов изученных почв различалось. Псаммозем глееватый о. Алджер (профиль ZFI-A-01) характеризовался минимальным числом видов – 16, в то время как в псаммоземе криотурбированном мерзлотном о. Ферсмана (профиль ZFI-F-03) обнаружено 20 видов; в криоземе глееватом о. Хейса (профиль ZFI-H-05) – 24 вида; в литоземе грубогумусированном о. Гукера (профиль ZFI-HK-08) – 26 видов; в литоземе грубогумусовом мерзлотном о. Земля Александры (профиль ZFI-Ax-10) – 28 видов; в серо-гумусовой грубогумусированной мерзлотной почве о. Ферсмана (профиль ZFI-F-02) – 31 вид; а в криоземе глееватом о. Хейса (профиль ZFI-H-05) – 32 вида.
Одни штаммы микромицетов (например, Antarctomyces psychrotrophicus и Goffeauzyma gilvescens) выявлены в посевах только при 5°С, что позволяет отнести их к психрофилам; другие (например, Aspergillus versicolor и Mucor hiemalis) – лишь при 25°С, то есть относились к мезофильной по отношению к температуре экологической группе; а большинство учтенных штаммов росло при обеих температурах инкубирования, являясь психротолерантами (табл. 1S).
Учтенные микромицеты также относились к различным эколого-трофическим группам (табл. 1S). Преобладали сапротрофы и характерные для холодных экосистем таксоны. Среди выделенных микромицетов практически не было видов, экологически связанных с растениями – эпифитов, эндофитов или эккрисотрофов. Относительно мало целлюлолитиков, фитопатогенов и видов, условно патогенных для человека и животных.
Наибольшим разнообразием характеризовался род Penicillium – 5 видов (табл. 1S). Род Cadophora содержал представителей 4 видов – C. finlandica, C. luteo-olivacea, C. malorum, C. novi-eboraci. По 3 вида у родов Cladosporium, Phoma и Thelebolus. Представителей 2 видов имели роды Aspergillus, Leucosporidium и Mortierella. Наиболее многочисленными были характерные для холодных экосистем и сапротрофные роды: Penicillium (до 1.20 × 102 КОЕ/г почвы и до 2%), Hyphozyma (до 9.00 × 102 КОЕ/г почвы и до 16%), Phoma (до 1.20 × 103 КОЕ/г почвы и до 18%), Antarctomyces (до 1.87 × 103 КОЕ/г почвы и до 29%) и Pseudogymnoascus (до 2.06 × 103 КОЕ/г почвы и до 38%) (рис. 2, табл. 1S). Доминанты отмечены исключительно для поверхностных органогенных горизонтов, в то время как в глубинных минеральных слоях все таксоны характеризовались равномерным распределением в составе сообществ. Некоторые обнаруженные таксоны можно считать индикаторными, поскольку они выявлены только в определенных субстратах или островах (табл. 1S, 2S ).
Характеристика α-разнообразия микромицетов. Для сообществ почвенных микромицетов изучаемых вариантов рассчитан индекс Шеннона (рис. 1S), по которому можно оценить α-разнообразие. Значения индекса Шеннона варьировали от 1.01 до 2.67. Минимальное α-разнообразие отмечено в надмерзлотном горизонте Cf псаммоземе глееватом о. Алджер (профиль ZFI-A-01). Максимальные значения индекса Шеннона для микромицетов выявлены в моховом очесе О литозема грубогумусового мерзлотного о. Земля Александры (профиль ZFI-Ax-10). Высокое α-разнообразие (до 2 по индексу Шеннона) также обнаруживалось в поверхностном горизонте всех исследованных профилей, кроме псаммозема глеевого мерзлотного о. Хейса (профиль ZFI-H-04), где наибольшее разнообразие (2.44 по индексу Шеннона) выявлено в подповерхностном слое.
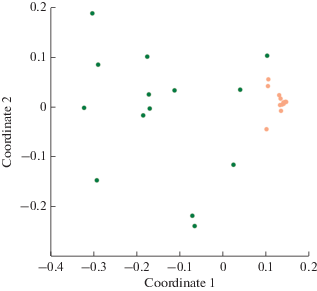
Характеристика β-разнообразия микромицетов. Оценка β-разнообразия показала, что сообщества микромицетов четко кластеризуются по фактору глубины обитания в профиле (рис. 4). Структура сообществ микромицетов рассматриваемых почв существенно различалась в пределах верхнего 5‑сантиметрового слоя, тогда как более глубокие горизонты вплоть до 50 см характеризовались схожей структурой сообществ микромицетов (рис. 4).
ОБСУЖДЕНИЕ
Количественная оценка содержания рибосомальных генов микобиоты. Схожие по порядку значения численности копий генов ITS рРНК грибов с полученными в настоящей работе, отмечены как для других почв ЗФИ (Никитин и соавт., 2017б), так и для северной части Кольского полуострова (Корнейкова, Никитин, 2021). В то же время количество рибосомальных генов микобиоты исследованных почв ЗФИ на два порядка выше по сравнению с отмеченным для почв более южного архипелага Новая Земля (НЗ) (Никитин и соавт., 2021а). Это может быть связано с иссушающим/охлаждающим действием самого большого покровного ледника в России на НЗ (Никитин и соавт., 2019, 2020). Широко известно лимитирующее влияние ледников на развитие почвенной биоты (Castle et al., 2016; Никитин и соавт., 2021а).
Закономерным кажется максимальное количество копий рибосомальных генов в поверхностных горизонтах и их резкое убывание вниз по почвенным профилям, поскольку с возрастанием глубины уменьшается содержание С и N (табл. 1). Схожую закономерность отмечали по распределению численности рибосомальных геном ITS рРНК грибов для почв Шпицбергена (Blaud et al., 2015).
Феномен второго максимума численности копий рибосомальных генов в подповерхностных слоях можно объяснить формированием горизонта ретинизации над мерзлотой, где могут скапливаться органика и клетки микроорганизмов (Лысак и соавт., 2018). Также есть сведения о подобном эффекте в Антарктиде, где почвенная биота развивается преимущественно в подповерхностных горизонтах, более защищенных от негативных абиотических факторов (резкие перепады температура, повышенный уровень ультрафиолетового излучения, сильные ветры и др.) (Марфенина и соавт., 2016; Никитин и соавт., 2018; Лысак и соавт., 2018).
Наибольшие значения численности копий генов грибов выявлены в биогенных корках W псаммозема глееватого о. Алджер, что может быть связано преобладанием в них лишайников, микобионты которых содержат ITS участки ДНК грибов (Arup, 2002). Вероятно, из почвы была экстрагирована ДНК не только свободноживущих грибов, но и лишайников (лихенезированных грибов), что привело к завышенным значениям численности копий рибосомальных генов микобиоты.
Микроскопические грибы изученных почв островов Алджер, Ферсмана, Хейса и Земля Александры имели такую же по порядку значений численность КОЕ, как и почвы о. Нортбрук, находящегося в пределах ЗФИ (Никитин и соавт., 2019), а также почвы Шпицбергена (Кирцидели и соавт., 2020). Количество КОЕ выявленных микромицетов также соответствует данным по почвам и грунтам о. Хейса, исследованным микологами ранее (Кирцидели, 2015, 2016). Однако полученные в данной статье значения численности КОЕ микроскопических грибов на порядок ниже по сравнению с обнаруженными для почв севера НЗ (Никитин и соавт., 2021б), почво-грунтов о. Визе (Кирцидели и соавт., 2018) и почво-грунтов Восточной Антарктиды (Марфенина и соавт., 2016; Никитин и соавт., 2017а; Лысак и соавт., 2018; Kochkina et al., 2019; Abirami et al., 2021), что можно объяснить географическим положением и климатом указанных территорий.
Таксономическое разнообразие микромицетов почв островов Алджер, Ферсмана, Хейса и Земля Александры во многом сходно с отмеченным как для других почв ЗФИ (Кирцидели, 2015; Никитин и соавт., 2019), так и для прочих территорий Арктики и Антарктики (Марфенина и соавт., 2016; Никитин и соавт., 2017а, 2017б; Лысак и соавт., 2018; Kochkina et al., 2019; Tsuji, Hoshino, 2019; Кирцидели и соавт., 2020; Никитин и соавт., 2021б; Abirami et al., 2021).
Ряд выделенных штаммов родов Antarctomyces, Cadophora, Cladophialophora humicola, Glaciozyma, Goffeauzyma, Hyphozyma, Mrakia frigida, Phenoliferia и Tolypocladium не росли при температуре 25°С и, следовательно, являются психрофилами, в то время как большинство изолятов были способны расти и при 5°С, и при 25°С (табл. 1S). Данное наблюдение подтверждает гипотезу о том, что большая часть полярных штаммов микроскопических грибов относится не к психрофильным, а к психротолерантным формам (Кирцидели, 2015; Wa-ng et al., 2015; Hassan et al., 2016).
Существенная часть выявленных родов микромицетов ранее была описана в иных холодных экосистемах: полярных регионах (Марфенина и соавт., 2016; Hassan et al., 2016; Лысак и соавт., 2018; Никитин и соавт., 2019; Kochkina et al., 2019), высокогорных областях (Wang et al., 2015), донных отложениях морей (Бубнова, Никитин, 2017; Khusnullina et al., 2018; Bubnova, Konovalova, 2019) и т.п. Это подтверждает правило Бейеринка “Везде есть все, но среда отбирает” (De Wit, Bouvier, 2006) и дает возможность предполагать большую схожесть сообществ микроорганизмов территорий с близкими экологическим условиями.
Значительная часть (30%) обнаруженных на ЗФИ видов входит в базу данных BSL патогенных для человека и животных видов (de Hoog et al., 2000). Данное явление свидетельствует о значительной антропогенной деятельности и не раз отмечалось микологами для полярных территорий (Кирцидели, 2015; Kirtsideli et al., 2017). Способность многих выявленных BSL видов к росту исключительно при повышенной температуре (25°С) говорит об инвазивном происхождении этих штаммов микромицетов (Власов и соавт., 2012; Кирцидели, 2015). Относительно низкое количество целлюлолитиков и фитопатогенов в исследованных почвах кажется закономерным ввиду крайней разреженности растительного покрова ЗФИ (Матвеева и соавт., 2015).
Наибольшим видовым разнообразием в проанализированных образцах обладал род Penicillium (табл. 1S). Представители данного таксона – типичные почвенные обитатели, которых обнаруживают во многих полярных регионах (Yadav et al., 2018; Abirami et al., 2021). Вторым по количеству видов являлся род Cadophora, многие представители которого выявляли как в Арктике (Никитин и соавт., 2019; Iliushin, 2020), так и в Антарктике (Никитин и соавт., 2017а; Лысак и соавт., 2018; Kochkina et al., 2019; Abirami et al., 2021).
Немаловажным представляется факт большого разнообразия дрожжей среди выявленных микромицетов ЗФИ. Обнаружено 8 родов дрожжей, 7 из которых представлены базидиомицетовым аффинитетом, а Aureobasidium – аскомицетовым аффинитетом (табл. 1S). Значительное разнообразие и численность дрожжевых грибов отмечено микологами для многих полярных регионов (Connell et al., 2014; Buzzini et al., 2017; Tsuji, Hoshino, 2019) и других холодных экосистем (Sannino et al., 2017). По-видимому, дрожжи имеют ряд адаптаций, которые позволяет им успешнее выживать в суровых климатических условиях Арктики и Антарктики по сравнению с мецелиальными микромицетами (Panikov, 2014).
Пространственная неоднородность микобиоты в почвах архипелага ЗФИ выявлена в пределах верхнего 5-сантиметрового слоя. Таким образом, разные типы почв (псаммозем, пелозем, криозем, литозем и серогумусовая), находящиеся на расстояниях десятков и сотен километров и характеризующиеся разным содержанием органического вещества, различались лишь в приповерхностных горизонтах и имели сходные характеристики микобиоты в нижележащих слоях. На основе полученных результатов можно сделать вывод, что основная биогеохимическая активность микобиоты почв ЗФИ происходит в верхней 5-сантиметровой толще.
Итак, впервые с помощью методов ПЦР в реальном времени и микробиологического посева охарактеризована почвенная микобиота островов Алджера, Ферсмана, Гукера и Земля Александры, входящих в архипелаг Земля Франца-Иосифа (ЗФИ). Многие микромицеты изученных территорий ЗФИ были представлены не мицелиальными, а дрожжеподобными формами, что, по-видимому, важно для адаптации микобиоты к экстремально холодному климату. Таксономический состав культивируемой микобиоты этих территорий существенно отличается от отмеченного для почв умеренного климата. Так, отдел Basidiomycota в исследованных почвах ЗФИ практически полностью представлен дрожжами, а представители отдела Zygomycota – отсутствуют. Характерной особенностью проанализированных образцов является относительная однородность таксономического состава микромицетов в глубинных горизонтах всех почвенных профилей. В тоже время, численность КОЕ микроскопических грибов может достигать существенных величин лишь в поверхностных горизонтах, богатых органическим веществом.
Количественные параметры (численность копий рибосомальных генов ITS рРНК грибов и КОЕ микромицетов), а таксономическое разнообразие выявленных микромицетов для почв островов Алджер, Ферсмана, Хейса и Земля Александры во многом сходно с показанным для других территорий Высокой Арктики и Антарктики. Поэтому можно предложить, что структура сообществ почвенной микобиоты экстремальных экосистем, в первую очередь, определяется основными лимитирующими факторами, основным из которых в данном случае является суровый арктический климат.
Список литературы
Александрова В.Д. Открытые растительные группировки полярной пустыни острова Земля Александры (Земля Франца-Иосифа) и их классификация // Бот. журн. 1981. Т. 66. № 5. С. 26–36.
Александрова В.Д. Растительность полярных пустынь СССР. Л., 1983. 148 с.
Бубнова Е.Н., Никитин Д.А. Грибы в донных грунтах удаленных от берега районов Баренцева и Карского морей // Биология моря. 2017. Т. 45. С. 366–372. https://doi.org/10.1134/S1063074017050029
Bubnova E.N., Nikitin D.A. Fungi in bottom soils of the Barents and Kara seas distant from the coast // Russian J. Mar. Biol. 2017. V. 45. P. 400–406.
Власов Д.Ю., Зеленская М.С., Кирцидели И.Ю., Абакумов Е.В., Крыленков В.А., Лукин В.В. Грибы на природных и антропогенных субстратах в западной Антарктике // Микология и фитопатология. 2012. Т. 46. С. 20–26.
Глушакова А.М., Качалкин А.В., Чернов И.Ю. Особенности динамики эпифитных и почвенных дрожжевых сообществ в зарослях недотроги железконосной на перегнойно-глеевой почве // Почвоведение. 2011. Т. 44. С. 966–972.
Glushakova A.M., Kachalkin A.V., Chernov I.Yu. Specific features of the dynamics of epiphytic and soil yeast communities in the thickets of Indian balsam on mucky gley soil // Euras. Soil Sci. 2011. V. 44. P. 886–892. https://doi.org/10.1134/S1064229311080059
Горячкин С.В., Долгих А.В., Мергелов Н.С. Почвы островов Земли Франца-Иосифа: география, морфогенетические особенности, классификация и роль в углеродном цикле // Комплексная научно-образовательная экспедиция “Арктический плавучий университет-2017”. [Электронный ресурс]: материалы экспедиции. Под ред. Поликина Д.Ю. Архангельск: КИРА, 2017. С. 15–36.
Goryachkin S.V., Dolgikh A.V., Mergelov N.S. Soils of the islands of Franz Josef Land: geography, morphogenetic features, classification and role in the carbon cycle // Complex scientific and educational expedition “Arctic Floating University-2017” [Electronic resource]: materials of the expedition. Arkhangelsk: KIRA, 2017. P. 15–36. (in Russian)
Дженюк С.Л. Климатообразующие факторы и климатические особенности Земли Франца-Иосифа // Тр. Кольского научного центра РАН. 2014. № 4(23). С. 61–69.
Добровольская Т.Г., Звягинцев Д.Г., Чернов И.Ю., Головченко А.В., Зенова Г.М., Лысак Л.В., Манучарова Н.А., Марфенина О.Е., Полянская Л.М., Степанов А.Л., Умаров М.М. Роль микроорганизмов в экологических функциях почв // Почвоведение. 2015. Т. 48. С. 1087–1096. https://doi.org/10.7868/S0032180X15090038
Dobrovol’skaya T.G., Zvyagintsev D.G., Chernov I.Y., Golovchenko A.V., Zenova G.M., Lysak L.V., Manucharova N.A., Marfenina O.E., Polyanskaya L.M., Stepanov A.L., Umarov M.M. The role of microorganisms in the ecological functions of soils // Euras. Soil Sci. 2015. V. 48. P. 959–967. https://doi.org/10.1134/S1064229315090033
Ежов О.Н., Ершов Р.В., Змитрович И.В. О находках базидиомицетов в условиях арктической пустыни (Земля Франца-Иосифа) // Бюлл. Моск. об-ва испытателей природы. Отделение биологии. 2012. Т 117. № 4. С. 81–83.
Ежов О.Н., Гаврило М.В., Змитрович М.В. Грибы архипелага Земля Франца-Иосифа // Тр. Кольского научного центра РАН. 2014. № 4(23). С. 288–299.
Ежов О.Н., Змитрович И.В., Ершов Р.В. Новые данные о макромицетах архипелага Земля Франца-Иосифа // Бюлл. Моск. об-ва испытателей природы. Отделение биологии. 2016. Т. 121. № 5. С. 65–71.
Журбенко М.П. Лихенофильная микобиота Российской Арктики: таксономический анализ // Микология и фитопатология. 2011. Т. 45. С. 387–396.
Звягинцев Д.Г. Методы почвенной микробиологии и биохимии. М.: Изд-во Моск. ун-та, 1991. С. 60.
Кирцидели И.Ю. Микроскопические грибы в почвах острова Хейса (Земля Франца-Иосифа) // Новости сист. низш. раст. 2015. Т. 49. С. 151–160.
Кирцидели И.Ю. Микроскопические грибы в почвах и грунтах арктических горных систем // Биосфера. 2016. Т. 8. С. 63–78.
Кирцидели И.Ю., Власов Д.Ю., Зеленская М.С., Баранцевич Е.П., Новожилов Ю.К., Крыленков В.А., Чуркина И.В., Соколов В.Т. Антропогенная модификация микобиоты на острове Визе в Карском море // Гигиена и санитария. 2018. Т. 97. С. 1058–1063. https://doi.org/10.18821/0016-9900-2018-97-11-1058-63
Kirtsideli I.Yu., Vlasov D.Yu., Zelenskaya M.S., Barantsevich E.P., Novozhilov Yu.K., Krylenkov V.A., Churkina I.V., Sokolov V.T. Anthropogenic modification of mycobiota on the Vize island in the Kara Sea // Gigiyena i sanitariya. 2018. V. 97. P. 1058–1063. (in Russian).
Кирцидели И.Ю., Власов Д.Ю., Зеленская М.С., Ильюшин В.А., Новожилов Ю.К., Чуркина И.В., Баранцевич Е.П. Оценка антропогенной инвазии микроскопических грибов в арктические экосистемы (архипелаг Шпицберген) // Гигиена и санитария. 2020. Т. 99. С. 145–151. https://doi.org/10.33029/0016-9900-2020-99-2-145-151
Kirtsideli I.Yu., VlasovD.Yu., Zelenskaya M.S., Ilyushin V.A., Novozhilov Yu.K., Churkina I.V., Barantsevich Ye.P. Assessment of anthropogenic invasion of microscopic fungi in arctic ecosystems (Svalbard archipelago) // Gigiyena i sanitariya. 2020. V. 99. P. 145–151. (in Russian).
Корнейкова М.В., Никитин Д.А. Качественные и количественные характеристики почвенного микробиома в зоне воздействия выбросов Кандалакшского алюминиевого завода // Почвоведение. 2021. Т. 54. С. 725–734. https://doi.org/10.31857/S0032180X21060083
Korneykova M.V., Nikitin D.A. Qualitative and quantitative characteristics of the soil microbiome in the impact zone of the Kandalaksha aluminum smelter // Euras. Soil Sci. 2021. V. 54. P. 897–906. https://doi.org/10.1134/S1064229321060089
Литвинов М.А. Методы изучения почвенных микроскопических грибов. Л.: Наука, 1969. 121 с.
Лысак Л.В., Максимова И.А., Никитин Д.А., Иванова А.Е., Кудинова А.Г., Соина В.С., Марфенина О.Е. Микробные сообщества почв Восточной Антарктиды // Вестн. Моск. ун-та. Сер. 16. Биология. 2018. Т. 73. С. 132–140.
Lysak L.V., Maksimova I.A., Nikitin D.A., Ivanova A.E., Kudinova A.G., Soina V.S., Marfenina O.E. Soil Microbial Communities of Eastern Antarctica // Moscow Univ. Biol. Sci. Bull. 2018. V. 73. P. 104–112.
Марфенина О.Е., Никитин Д.А., Иванова А.Е. Структура грибной биомассы и разнообразие культивируемых микромицетов в почвах Антарктиды (станции Прогресс и Русская) // Почвоведение. 2016. Т. 49. С. 991–999. https://doi.org/10.7868/S0032180X16080074
Marfenina O.E., Nikitin D.A., Ivanova A.E. The structure of fungal biomass and diversity of cultivated micromycetes in Antarctic soils (Progress and Russkaya stations) // Euras. Soil Sci. 2016. V. 49. P. 934–941. https://doi.org/10.1134/S106422931608007X
Мосеев Д.С., Сергиенко Л.А. К флоре островов архипелага Земля Франца-Иосифа и северной части архипелага Новая Земля (аннотированный список видов) // Ученые записки Петрозаводского гос. ун-та. 2017. № 4(165). С. 48–64.
Мосеев Д.С., Сергиенко Л.А., Кузьмина Е.Ю., Сонина А.В., Зорина А.А. Растительный покров морских террас архипелага Земля Франца-Иосифа // Бот. журн. 2019. № 104. С. 1355–1385. https://doi.org/10.1134/S0006813619090096
Moseev D.S., Sergienko L.A., Kuzmina E.Yu., Sonina A.V., Zorina A.A. Vegetation cover of sea terraces of the Franz J-osef Land archipelago // Botanicheskiy zhurnal. 2019. V. 104. P. 1355–1385. (in Russian).
Матвеева Н.В., Заноха Л.Л., Афонина О.М., Потемкин А.Д., Патова Е.Н., Давыдов Д.А., Андреева В.М., Журбенко М.П., Конорева Л.А., Змитрович И.В., Ежов О.Н., Ширяев А.Г., Кирцидели И.Ю. Растения и грибы полярных пустынь Северного полушария. Российская академия наук, Ботанический институт им. В.Л. Комарова. СПб.: Изд-во “Марафон”. 2015, 314 с.
Никитин Д.А., Марфенина О.Е., Максимова И.А. Использование сукцессионного подхода при изучении видового состава микроскопических грибов и содержания грибной биомассы в антарктических почвах // Микология и фитопатология. 2017а. Т. 51. С. 211–219.
Никитин Д.А., Семенов М.В., Тхакахова А.К., Железова А.Д., Бгажба Н.А., Кутовая О.В. Численность копий рибосомальных генов микобиоты в почвах и почвоподобных телах Земли Франца-Иосифа и Новой Земли // Комплексная научно-образовательная экспедиция “Арктический Плавучий Университет-2017”. 2017б. [Электронный ресурс]: материалы экспедиции. Под ред. Поликина Д.Ю. Архангельск: КИРА, 2017. С. 35–39.
Никитин Д.А., Семенов М.В., Семиколенных А.А., Максимова И.А., Качалкин А.В., Иванова А.Е. Биомасса грибов и видовое разнообразие культивируемой микобиоты почв и субстратов о. Нортбрук (Земля Франца-Иосифа) // Микология и фитопатология. 2019. Т. 53. С. 210–222. https://doi.org/10.1134/S002636481904010X
Никитин Д.А., Иванова Е.А., Железова А.Д., Семенов М.В., Гаджиумаров Р.Г., Тхакахова А.К., Чернов Т.И., Ксенофонтова Н.А., Кутовая О.В. Оценка влияния технологии no-till и вспашки на микробиом южных агрочерноземов // Почвоведение. 2020. Т. 53. С. 1508–1520. https://doi.org/10.31857/S0032180X20120084
Nikitin D.A., Ivanova E.A., Zhelezova A.D., Semenov M.V., Gadzhiumarov R.G., Tkhakakhova A.K., Chernov T.I., Ksenofontova N.A., Kutovaya O.V. Assessment of the impact of no-till and conventional tillage technologies on the microbiome of southern agrochernozems // Euras. Soil Sci. 2020. V. 53. P. 1782–1793. https://doi.org/10.1134/S106422932012008X
Никитин Д.А., Лысак Л.В., Бадмадашиев Д.В., Холод С.С., Мергелов Н.С., Долгих А.В., Горячкин С.В. Биологическая активность почв севера архипелага Новая Земля: влияние крупнейшего ледника России // Почвоведение. 2021. Т. 54. № 10. с. 1207–1230, https:// doi.org/10.31857/S0032180X21100087.
Nikitin D.A., Lysak L.V., Badmadashiev D.V., Kholod S.S., Mergelov N.S., Dolgikh A.V., Goryachkin S.V. Biological activity of soils in the north of the Novaya Zemlya archipelago: the influence of the largest glacier in Russia // Euras. Soil Sci. 2021. V. 54, pp. 1207–1230. doi 10.1134/ S1064229321100082
Никитин Д.А. Экологические особенности грибов Антарктиды // Микология и фитопатология. 2021. Т. 55. С. 79–104. https://doi.org/10.31857/S0026364821020070
Никитин Д.А., Лысак Л.В., Кутовая О.В., Грачева Т.А. Эколого-трофическая структура и таксономическая характеристика сообществ микроорганизмов почв северной части архипелага Новая Земля // Почвоведение. 2021. Т. 54. № 11. С. 1346–1362. https://doi.org/10.31857/S0032180X21110101
Nikitin D.A., Lysak L.V., Kutovaya O.V., Gracheva T.A. Ecological and trophic structure and taxonomic characteristics of communities of soil microorganisms in the northern part of the Novaya Zemlya archipelago // Euras. Soil Sci. 2021. V. 54. Р. 1346–1362. doi 10.1134/S1064229321110107
Сафронова И.Н., Юрковская Т.К. Зональные закономерности растительного покрова равнин Европейской России и их отображение на карте // Бот. журн. 2015. Т. 100. С. 1121– 141. https://doi.org/10.1134/S0006813615110010
Safronova I.N., Yurkovskaya T.K. Zonal patterns of the vegetation cover of the plains of European Russia and their display on the map // Bot. zhurn. 2015. V. 100. P. 1121–141. (in Russian).
Семенов М.В., Никитин Д.А., Степанов А.Л., Семенов В.М. Структура бактериальных и грибных сообществ ризосферного и внекорневого локусов серой лесной почвы // Почвоведение. 2019a. Т. 52. С. 355–369. https://doi.org/10.1134/S0032180X19010131
Semenov M.V., Nikitin D.A., Stepanov A.L., Semenov V.M. The structure of bacterial and fungal communities in the rhizosphere and root-free loci of gray forest soil // Euras. Soil Sci. 2019. V. 52. P. 319–332. https://doi.org/10.1134/S1064229319010137
Семенов М.В., Манучарова Н.А., Краснов Г.С., Никитин Д.А., Степанов А.Л. Биомасса и таксономическая структура микробных сообществ в почвах правобережья р. Оки // Почвоведение. 2019б. Т. 52. С. 974–985. https://doi.org/10.1134/S0032180X19080124
Semenov M.V., Manucharova N.A., Krasnov G.S., Nikitin D.A., Stepanov A.L. Biomass and taxonomic structure of microbial communities in soils of the right-bank basin of the Oka River // Euras. Soil Sci. 2019. V. 52. P. 971–981.
Abirami B., Manigundan K., Radhakrishnan M., Gopikrishnan V., Bhaskar P.V., Shanmugasundaram T., Dastager S.G. Diversity and bioprospecting potentials of antarctic (polar) microbes // Microbiome-Host Interactions / Eds. D. Dhanasekaran, Dhiraj Paul, N. Amaresan, A. Sankaranarayanan, Yogesh S. Shouche. Boca Raton: CRC Press, 2021. P. 349.
Arup U. PCR techniques and automated sequencing in lichens // Protocols in Lichenology: Culturing, Biochemistry, Ecophysiology and Use in Biomonitoring / Eds. Kranner I., Beckett R.P., Varma A.K. N.Y.: Springer-Verlag, 2002. P. 392–411. https://doi.org/10.1007/978-3-642-56359-1_24
Bergero R., Girlanda M., Varese G.C., Intili D., Luppi A.M. Psychrooligotrophic fungi from Arctic soils of Franz Joseph Land // Polar Biol. 1999. V. 21. P. 361–368. https://doi.org/10.1007/s003000050374
Blaud A., Phoenix G.K., Osborn A.M. Variation in bacterial, archaeal and fungal community structure and abundance in High Arctic tundra soil // Polar Biol. 2015. V. 38. P. 1009–1024. https://doi.org/10.1007/s00300-015-1661-8
Bubnova E.N., Konovalova O.P. Fungi in bottom sediments of the Chukchi Sea // Russian J. Mar. Biol. 2019. V. 45. P. 86–95. https://doi.org/10.1134/S1063074019020020
Buzzini P., Turk M., Perini L., Turchetti B., Gunde-Cimerman N. Yeasts in polar and subpolar habitats // Yeasts in natural ecosystems: diversity / Eds. Buzzini P., La-chance M.A., Yurkov A. Springer, Cham. 2017. P. 331–365. https://doi.org/10.1007/978-3-319-62683-3_11
Castle S.C., Lekberg Y., Affleck D., Cleveland C.C. Soil abiotic and biotic controls on plant performance during primary succession in a glacial landscape // J. Ecol. 2016. V. 104. P. 1555–1565. https://doi.org/10.1111/1365-2745.12615
Connell L.B., Rodriguez R.R., Redman R.S., Dalluge J.J. Cold-adapted yeasts in Antarctic deserts // Cold-Adapted Yeasts. Biodiversity, Adaptation Strategies and Biotechnological Significance / Eds. Buzzini P., Margesin R. Berlin, Heidelberg: Springer, 2014. P. 75–98. https://doi.org/10.1007/978-3-642-39681-6_4
de Hoog G.S., Guarro J., Gené J., Figueras M.J. Atlas of clinical fungi (No. Ed. 2). Centraalbureau voor Schimmelcultures (CBS). 2000. 1126 p.
de Wit R., Bouvier T. ‘Everything is everywhere but the environment selects’; what did Baas Becking and Beijerinck really say? // Environ. Microbiol. 2006. V. 8. P. 755–758. https://doi.org/10.1111/j.1462-2920.2006.01017.x
Domsch K.H., Gams W., Anderson T.H. Compendium of soil fungi / Ed. Gams W. 2nd taxonomically revised edn. Eching: IHW-Verlag, 2007. 627 p.
Flocco C.G., Mac Cormack W.P., Smalla K. Antarctic soil microbial communities in a changing environment: their contributions to the sustainability of Antarctic ecosystems and the bioremediation of anthropogenic pollution // The Ecological Role of Micro-Organisms in the Antarctic Environment / Ed. Castro-Sowinski S. Springer, Cham. 2019. P. 133–161. https://doi.org/10.1007/978-3-030-02786-5_7
Hassan N., Rafiq M., Hayat M., Shah A.A., Hasan F. Psychrophilic and psychrotrophic fungi: a comprehensive review // Rev. Environ. Sci. Biotechnol. 2016. V. 15. P. 147–172. https://doi.org/10.1007/s11157-016-9395-9
He L., Mazza Rodrigues J.L., Soudzilovskaiac N.A., Barceló M., Pål Axel Olsson, Song Ch., Tedersoo L., Fenghui Yuana, Fengming Yuan, Lipson D.A., Xu X. Global biogeography of fungal and bacterial biomass carbon in topsoil // Soil Biol. Biochem. 2020. V. 151. Art. 108024. https://doi.org/10.1016/j.soilbio.2020.108024
Iliushin V.A. First find of Cadophora Antarctica Rodr.-Andrade, Stchigel, Mac Cormack & Cano in the Arctic // Czech. Polar Rep. 2020. V. 10. P. 147–152. https://doi.org/10.5817/CPR2020-2-11
Khusnullina A.I., Bilanenko E.N., Kurakov A.V. Microscopic fungi of White Sea sediments // Contemp. Probl. Ecol. 2018. V. 11. P. 503–513. https://doi.org/10.1134/S1995425518050062
Kirtsideli I.Y., Vlasov D.Y., Abakumov E.V., Barantsevich E.P., Novozhilov Y.K., Krylenkov V.A., Sokolov V.T. Airborne fungi in arctic settlement Tiksi (Russian Arctic, coast of the Laptev Sea) // Czech Polar Rep. 2017. V. 7. P. 300–310. https://doi.org/10.5817/CPR2017-2-29
Kochkina G.A., Ivanushkina N.E., Lupachev A.V., Starodumova I.P., Vasilenko O.V., Ozerskaya S.M. Diversity of mycelial fungi in natural and human-affected Antarctic soils // Polar Biol. 2019. V. 42. P. 47–64. https://doi.org/10.1007/s00300-018-2398-y
Panikov N.S. Subzero Activity of Cold-Adapted Yeasts / Cold-adapted Yeasts. 2014. P. 295–323. https://doi.org/10.1007/978-3-642-39681-6_14
Sannino C., Tasselli G., Filippucci S., Turchetti B., Buzzini P. Yeasts in nonpolar cold habitats // Yeasts in natural ecosystems: Diversity / Eds. Buzzini P., Lachance M.A., Yurkov A. Springer, Cham., 2017. P. 367–396. https://doi.org/10.1007/978-3-319-62683-3_12
Seifert K.A., Gams W. The genera of Hyphomycetes – 2011 update // Persoonia. 2011. V. 27. P. 119. https://doi.org/10.3767/003158511X617435
Tsuji M., Hoshino T. Fungi in Polar Regions / Eds. Tsuji M., Hoshino T. CRC Press. Taylor and Francis Group. 2019.
Yadav A.N., Verma P., Kumar V., Sangwan P., Mishra S., Panjiar N., Gupta V.K., SaxenaA.K. Biodiversity of the genus Penicillium in different habitats // New and Future Developments in Microbial Biotechnology and Bioengineering / Ed. Vijai Kumar Gupta. Elsevier, 2018. P. 3–18. https://doi.org/10.1016/B978-0-444-63501-3.00001-6
Wang M., Jiang X., Wu W., Hao Y., Su Y., Cai L., Xiang M., Liu X. Psychrophilic fungi from the world’s roof / Molecular Phylogeny and Evolution of Fungi. 2015. V. 34. P. 100–112. https://doi.org/10.3767/003158515X685878
Дополнительные материалы
- скачать ESM.docx
- Таблица 1S. Таксономическая структура сообществ микроскопических грибов.
Таблица 2S. Индикаторные таксоны микроскопических грибов.
Рис. 1S. Индекс Шеннона.