Микробиология, 2022, T. 91, № 1, стр. 86-101
Разнообразие бактерий прикрепленных сообществ холодного высокосульфидного водоема Европейской части России
М. Ю. Горбунов a, *, Ю. А. Хлопко b, В. Я. Катаев b, М. В. Уманская a
a Самарский федеральный исследовательский центр РАН,
Институт экологии Волжского бассейна РАН
445003 Тольятти, Россия
b Институт клеточного и внутриклеточного симбиоза
Уральского отделения Российской академии наук
460000 Оренбург, Россия
* E-mail: myugor1960@gmail.com
Поступила в редакцию 19.08.2021
После доработки 29.09.2021
Принята к публикации 30.09.2021
- EDN: KDNMJM
- DOI: 10.31857/S0026365622010049
Аннотация
С помощью высокопроизводительного секвенирования вариабельных участков V3–V4 гена 16S рРНК исследовано разнообразие бактерий в прикрепленных сообществах анаэробной части ветланда Солодовка (Самарская обл., Россия), питающегося холодными карстовыми родниками с высоким содержанием сульфидов (>3 мМ). Полученные последовательности были сгруппированы в 370 операционных таксономических единиц (ОТЕ); в отдельных матах и обрастаниях количество ОТЕ варьировало в широких пределах, от 52 до 277; таксономическое разнообразие зависело от типа мата, температуры и концентрации сульфидов. Наибольшее разнообразие обнаружено в типичных мягких цианобактериальных матах; состав бактерий в жестких пленочных и пористых микробиолитах был беднее. Основу всех исследованных сообществ образуют фототрофные организмы. В составе матов преобладали цианобактерии, которым сопутствовали Chloroflexales, составляющие 7–13% общего числа последовательностей. Жесткие обрастания и мат, развивающийся при наибольшей концентрации сульфидов, характеризуются низкой представленностью этих таксонов, но высокой долей фототрофных протеобактерий и Chlorobiaceae. В нефототрофной части сообществ преобладали бактерии цикла серы, Desulfobacterota и Campylobacterota. Организмы с бродильным метаболизмом и факультативные хемолитотрофы представлены большим количеством ОТЕ, но минорны по численности; последовательности широко распространенных в аэробных водных экосистемах бактерий филумов Actinobacteria и Acidobacteria вообще не обнаружены. В целом, состав хемотрофных компонентов исследованных сообществ был близок таковому прикрепленных сообществ из пещерных водотоков и сообществ различных подземных водоносных горизонтов. Фототрофная часть сообществ формируется относительно независимо от хемотрофной части с участием окружающей поверхностной микробиоты. Последовательности, наиболее сходные с некоторыми из массовых ОТЕ, обнаруженных в ветланде, были выделены из зон хемоклина стратифицированных, в т.ч. меромиктических, озер.
Микробные маты являются одним из древнейших типов микробных сообществ (Hickman-Lewis et al., 2018). Появившись еще в архее, они продолжают существовать в самых различных современных природных биомах. Вероятно, существует единственное, но очень существенное в сегодняшних условиях, ограничение распространения матов: они очень неустойчивы к выеданию беспозвоночными и биотурбации (Farmer, 1992; Заварзин, 2004) и поэтому ограничены в своем распространении местообитаниями, в которых развитие Metazoa невозможно или сильно затруднено.
Ключевым признаком матов является их выраженная вертикальная гетерогенность. Сообщества матов – это “спрессованные” в интервал нескольких миллиметров или сантиметров градиентные ассоциации микроорганизмов, осуществляющие широкий спектр трансформаций разнообразных метаболических субстратов, как поступающих извне, так и синтезируемых другими организмами матов (Mendes Monteiro et al., 2020). Высокая сложность микробных, зачастую исключительно прокариотических, сообществ, а также их длительная геологическая история, позволяющая считать их аналогами древнейших экосистем, объясняют высокий исследовательский интерес к сообществам существующего сегодня многообразия микробных матов. Исторически, первыми были исследованы микробные маты экстремальных местообитаний – термальных водотоков вулканического происхождения в кальдере Йеллоустоун в США (Brock, 1969; Pierson, Castenholz, 1974) и на Камчатке в России (Orleanskiy et al., 1984), а также гиперсоленых лагун (Semikhatov et al., 1979; Javor, Castenholz, 1981).
Наряду с высокой температурой и высоким содержанием солей, фактором, ограничивающим развитие Metazoa и тем самым благоприятствующим формированию матов, является аноксия и присутствие токсичных для большинства эукариот восстановленных неорганических соединений, в первую очередь, сульфидов. Маты, развивающиеся в таких условиях, могут в определенной мере служить аналогами сообществ, существовавших на начальных этапах развития земной биосферы (архея и протерозоя), а также, возможно, сообществам внеземной жизни. В современных экосистемах они встречаются в источниках вулканического происхождения, а также во многих напорных карстовых источниках из глубоких водоносных горизонтов, в которых воды контактируют с глубоко залегающими осадочными породами, содержащими сульфаты и органические соединения (нефти, битумы, кероген и др.). В результате биогеохимической активности подземной микрофлоры, а также термохимических процессов в этих водоносных слоях накапливаются значительные концентрации сульфидов (Machel, 2001).
В отличие от термальных вод тектонического происхождения, источники карстового происхождения обычно имеют умеренную или низкую температуру. В образованных ими водотоках практически всегда развиваются цианобактериальные маты, а в тех случаях, когда такие воды изливаются в пещерах, в отсутствие света – специфические микробные сообщества, лишенные фототрофных компонентов и существующие исключительно за счет хемоавтотрофных биогеохимических процессов (Engel et al., 2004).
В Европейской части России микробные маты карстовых источников почти не исследованы, хотя имеются многочисленные естественные сульфидсодержащие источники, в частности, в Среднем Поволжье, на территории Соко-Шешминского поднятия (Дедков, 2001). Планктонные сообщества водных объектов, образованных этими источниками, крайне бедны и немногочисленны, метазоопланктон и зообентос в их анаэробной зоне почти полностью отсутствует, и основные процессы накопления и трансформации вещества и энергии происходят в микробных матах (Протисты и бактерии …, 2009).
Несмотря на имеющиеся метагеномные данные о хемоклинных сообществах высокосульфидных минерализованных водоемов Европейской части России (например, Savvichev et al., 2020), подобные данные о филогенетическом разнообразии микробных матов этого региона, насколько нам известно, отсутствовали. Поэтому целью нашей работы было изучение филогенетического разнообразия прикрепленных микробных сообществ в ветланде Солодовка (Самарская область) методом высокопроизводительного секвенирования фрагментов гена 16S рРНК.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Район исследования. Водно-болотный комплекс (ветланд) Солодовка (53°51′36′′ с.ш., 51°41′06′′ в.д.) расположен в Исаклинском районе Самарской области, в правобережной пойме реки Сургут в ее среднем течении. В целом, он представляет собой заболоченный участок с преимущественно луговой растительностью с комплексом сероводородных водотоков и бассейнов, ограниченный с севера склоном возвышенности, а с юга – руслом р. Сургут (рис. 1). Водоемы окружены поясами гелофитной растительности, состоящей, в основном, из тростника Phragmites australis и камыша озерного Schoenoplectus lacustris, а также древесным редколесьем из ольхи. В настоящее время минерализованная сероводородная вода поступает в Солодовку главным образом из двух крупных источников (№ I и II на рис. 1). Из этих источников, а также двух-трех других небольших родников, вытекают ручьи, которые образуют два озеровидных бассейна, иногда обозначаемых, соответственно, как озера Солодовка и Ярмохино. Глубина водоемов и водотоков у источников составляет 0.25–0.3 м, по мере удаления от источников глубина бассейна I увеличивается и может достигать 1 м. Донные отложения водоемов представляют собой мощные (не менее полуметра глубиной) черные илы с сильно восстановительными условиями, покрытые в мелководной части цианобактериальными матами.
Рис. 1.
Схема ветланда Солодовка и расположение мест отбора проб бактериальных матов. Римские цифры – источники-родники, арабские цифры – места отбора проб матов, горизонтальная штриховка – заболоченные участки с зарослями гелофитов.

Отбор проб и методы анализа факторов среды. Пробы микробных матов были отобраны в сентябре 2020 г. из шести точек ветланда с анаэробными условиями и содержанием сульфидов более 10 мг/л (рис. 1, табл. 1). Проба 2-0 была соскоблена стерильным шпателем с камня в источнике II в 200 мкл воды из источника; полученная суспензия была перенесена в стерильную пробирку, содержащую 0.5 мл консервирующего раствора DNA/RNA Shield (“Zymo Research”, США) и лизирующий матрикс. Остальные пробы массой 0.1–0.25 г отбирали обожженными в пламени стальными высечками, взвешивали в стерильной чашке Петри и переносили в такие же пробирки. Одновременно с отбором проб портативными приборами были определены основные физико-химические показатели и отобраны пробы воды. Состав воды определяли, как описано ранее (Горбунов, 2019).
Таблица 1.
Характеристика отобранных проб и физико-химические условия
| Проба | Расположение | Электро-проводность | T, °С | pH | Eh | S2–, мг л–1 | О2, мг л–1 | Описание |
|---|---|---|---|---|---|---|---|---|
| 2-0 | Источник 2 | 2.07 | 6.5 | 6.74 | –317 | 178.7 | 0 | Жесткая пленка на камне в источнике |
| 2-1 | Ручей из источника 2 | 2.09 | 11.2 | 6.74 | –315 | 165.0 | 0 | Слизистый мат |
| 2-2 | Центр бассейна 2 | 2.08 | 16.3 | 7.07 | –315 | 27.5 | 0.6 | Слизистый мат |
| 2-3 | Дальняя от источника точка бассейна 2 | 2.05 | 16.6 | 7.27 | –275 | 11.6 | 0.11 | Слизистый мат |
| 1-1 | Ручей из источника 1 | 1.85 | 9.2 | 6.9 | –290 | 44.6 | 0 | Пористая травертиновая подушка |
| 1-2 | Водоток 1 | 1.90 | 11.5 | 6.9 | –290 | 36.3 | 0 | Слизистый мат |
Выделение ДНК и высокопроизводительное секвенирование. Пробы с консервантом и лизирующим матриксом гомогенизировали на приборе TissueLyser LT (“Qiagen”, Германия) 10 мин, при 50 Гц. Из полученного лизата выделяли тотальную ДНК фенол-хлороформным методом, как описано ранее (Селиванова и соавт., 2018). Качество выделенной ДНК проверяли с помощью электрофореза в 1% агарозном геле и спектрофотометра NanoDrop 8000 (“Thermo Fisher”, США).
Для амплификации вариабельного участка V3–V4 гена 16S рРНК использовали праймеры S‑D-Bact-0341-b-S-17 и S-D-Bact-0785-a-A-21 (Селиванова и соавт., 2018). ДНК-библиотеки были созданы в соответствии с двустадийным протоколом Illumina 16S Metagenomic Sequencing Library Preparation (Part #15044223 Rev.B). Концентрацию ДНК в полученных библиотеках измеряли на флуориметре Qubit 4.0 (“Invitrogen”, США) с набором dsDNA HS Assay Kit. Секвенирование библиотек проводили на платформе Illumina MiSeq с использованием набора реактивов MiSeq Reagent Kit V3 2х300 bp (“Illumina”, США) в Центре коллективного пользования научным оборудованием “Персистенция микроорганизмов” Института клеточного и внутриклеточного симбиоза УрО РАН. Полученные последовательности депонировали в NCBI Sequence Read Archive (SRA) под номерами SRR14655875–SRR14655880.
Биоинформатический анализ. Контроль качества полученных последовательностей Illumina был проведен с помощью программы FastQC (v. 0.11.7) (Wingett, Andrews, 2018). Объединение парных последовательностей проводили с использованием программы PEAR (v. 0.9.10) (Zang et al., 2014) с параметрами: перекрытие ≥40 нукл. и p ≤ 0.0001. Удаление адаптеров Illumina было выполнено в программе Trimmomatic v. 0.36 (Bolger et al., 2014). Для фильтрации объединенных последовательностей использовали пакет Usearch v. 10.0.240 (Edgar, 2013) с параметрами -fastq_filter - minlen 420 -maxee 1.0. Дерепликация (определение уникальных последовательностей) была выполнена при помощи пакета Usearch. Полученные уникальные последовательности были кластеризованы на уровне 97% (алгоритм UPARSE пакета Usearch, параметр -cluster_OTUs). Химерные последовательности были удалены с использованием алгоритма UCHIME2 (Edgar, 2016).
Таксономическую принадлежность ОТЕ определяли с помощью элайнера SINA v1.2.11 (Pruesse et al., 2012) с использованием базы данных SILVA SSU v. 138.1 (Quast et al., 2013). Для уточнения классификации и поиска природных последовательностей из различных местообитаний, близких к выделенным ОТЕ, кроме того, использовали алгоритм BLAST на платформе NCBI (http:// blast.ncbi.nlm.nih.gov/Blast.cgi).
Филогенетические деревья были построены с использованием программы MEGA X (Kumar et al., 2018) с использованием референтных последовательностей 16S рРНК, полученных из базы данных NCBI. Матрицы расстояний рассчитывались в соответствии с двухпараметрической моделью Кимуры. Бутстрeп-анализ полученных кладограмм был проведен на основе 1000 пов-торов.
Последовательности двадцати доминирующих филотипов депонированы в GenBank под номерами OK166950–166969.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика отобранных проб
Большую часть дна покрывают слизистые маты, толщиной 3–6 мм, серовато-зеленого цвета на поверхности. Оттенки матов меняются от почти черного до зеленоватого и оливкового (пробы 2-3, 2-2, 1-2). Иногда мат имеет пурпурный нижний подслой и вкрапления пурпурных пятен на поверхности (проба 2-1). На камнях в устье источника 2 обнаруживаются жесткие пленочные обрастания от белого до оливково-зеленого цвета, толщиной менее 1 мм, с повышенным содержанием карбоната кальция (проба 2-0). По руслу ручья из источника 1, кроме слизистых матов, встречаются “жесткие” маты с высоким содержанием нерастворимого карбоната кальция (“травертиновая подушка”, проба 1-1).
В сентябре 2020 г. температура воды в источниках составляла 6.5–7.0°С, в проточных участках – 11–11.5°С, а в застойных зонах вода прогревалась до 16.6°С (табл. 1); pH воды был близок к нейтральному. Вода в ветланде сильноминерализованная (электропроводность 1.79–2.09 мСм/см), с преобладанием ионов сульфата и кальция и высоким содержанием сульфидов (11–179 мг/л). Жесткость воды на первом участке ветланда (пробы 1-1 и 1-2) изменялась в пределах 20–23 мэкв/л, а на втором (остальные пробы) – 23–26 мэкв/л. Растворенный кислород отсутствовал в воде источников и вытекающих из них ручьев, но в озеровидных расширениях обнаруживался в следовых концентрациях, не превышавших 0.6 мг/л. Несмотря на наличие следов кислорода, Eh на всех участках ветланда (от –275 до –315 мВ против хлорсеребряного электрода) соответствовал сильно восстановительным условиям (табл. 1).
Показатели разнообразия бактерий в микробных матах
После биоинформатической обработки метагеномных данных вся совокупность полученных последовательностей была классифицирована на отдельные операционные таксономические единицы, ОТЕ. Общее количество сформированных ОТЕ составило 370 (табл. 2).
Таблица 2.
Показатели разнообразия проб (по всем ОТЕ, включая синглеты и дублеты)
| Проба | Количество прочтений | Количество ОТЕ (N) | Chao1 | N/Chao1 | Оценка N по логнорм. распределению | Индексы разнообразия | ||
|---|---|---|---|---|---|---|---|---|
| Шеннона | Пиелоу | Симпсона | ||||||
| 2-0 | 25 820 | 53 | 75.8 | 0.712 | – | 1.48 | 0.259 | 0.413 |
| 2-1 | 28 661 | 311 | 328.5 | 0.956 | 318.6 | 5.82 | 0.703 | 0.942 |
| 2-2 | 19 762 | 278 | 302.6 | 0.929 | 312.0 | 4.98 | 0.614 | 0.920 |
| 2-3 | 20 988 | 277 | 320 | 0.875 | 323.5 | 4.80 | 0.591 | 0.886 |
| 1-1 | 23 425 | 150 | 179.1 | 0.854 | 211.1 | 2.84 | 0.394 | 0.740 |
| 1-2 | 23 885 | 177 | 206.4 | 0.877 | 229.7 | 3.30 | 0.442 | 0.807 |
| Всего | 370 | 370 | 1 | 358.7 | 5.12 | 0.600 | 0.923 | |
Потенциальное “полное” количество ОТЕ в библиотеках оценивали двумя способами: по индексу Chao1 и по величине интеграла логнормального распределения, построенного по данным октавного анализа. Оба подхода дали близкие оценки. Только в пробе 2-0 не удалось получить логнормальную оценку, т. к. распределение ОТЕ по логарифму численностей не имело максимума.
Полученные оценки (табл. 2) показывают, что общее количество ОТЕ в библиотеке исследованных проб было близко к реально полученному, и увеличение количества прочтений, видимо, не приведет к обнаружению новых ОТЕ. В то же время, в каждой из индивидуальных проб может оказаться недоучтенным от 15 до 45 ОТЕ, или от 5 до 30% их общего количества. Поскольку все они минорны, они не могут оказать существенного влияния на анализ функционирования сообществ.
Наибольшее количество ОТЕ, максимально возможное видовое богатство и наименее выраженное доминирование (табл. 2, рис. 2а, 2б) зарегистрировано в образце мата из ручья, вытекающего из второго источника (проба 2-1). В матах из второго бассейна эти показатели таксономического богатства незначительно снижались. В пробах из первого водотока, с менее минерализованной водой (табл. 1), разнообразие сообществ было заметно ниже; соответственно, было снижено и количество ОТЕ. Это не связано с недоучетом при секвенировании, т.к. оценки таксономического богатства по индексу Chao1 и прогнозируемому логнормальному распределению также дают пониженные результаты (табл. 2). Минимальное количество ОТЕ обнаружено в пленочном обрастании из 2 источника (проба 2-0), при этом для него характерно минимальное видовое богатство и максимально выраженное доминирование (рис. 2а). В отличие от остальных проб, все ОТЕ, обнаруженные в этом обрастании, присутствуют хотя бы в одной из остальных проб (рис. 2в).
Таксономический состав бактериального сообщества
Полученные ОТЕ принадлежали к 19 филумам (Armatimonadota, Bacteroidetes, Bdellovibrionota, Caldisericota, Campylobacterota, Chlorobi, Chloroflexi, Cyanobacteria, Desulfobacterota, Elusimicrobiota, Firmicutes, Fusobacteriota, Ca. Kapabacteria, LCP-89, Modulibacteria, Planctomycetota, Proteobacteria, Spirochaetota, Verrucomicrobiota) и суперфилуму Patescibacteria (Candidate Phyla Radiation, CPR). 25 ОТЕ остались неклассифицированными; суммарная доля их последовательностей в отдельных пробах составляла от 3 до 9.4%.
Наиболее представленным филумом в исследованных пробах является Bacteroidetes (81 ОТЕ); за ним следуют Patescibacteria (50 ОТЕ) и Proteobacteria (37 ОТЕ). Более 10 ОТЕ относится к филумам Firmicutes, Chloroflexi, Desulfobacterota, Campylobacterota и Cyanobacteria. Можно отметить, что Proteobacteria в широком смысле, включая Desulfobacterota, Campylobacterota и Bdellovibrionota, являлись бы второй группой по количеству ОТЕ (80). Семь минорных филумов, Armatimonadota, Caldisericota, Elusimicrobiota, Fusobacteriota, LCP-89, Modulibacteria и Planctomycetota были представлены 1–2 ОТЕ и даже в сумме составляли менее 1% обнаруженных последовательностей. Таксономический состав отдельных проб на уровне филумов в целом был мало изменчив, несмотря на значительную разницу количества ОТЕ (рис. 3).
Количественный состав прикрепленных сообществ
В пробе 2-0 из сульфидного источника преобладали бактерии филумов Chlorobi и Bacteroidetes (95.1% от общего количества последовательностей в библиотеке); бактерии филума Spirochaetota были минорной группой (1.2%). В остальных пробах доминировали представители 4–7 филумов, которые составляли 92–97% от общего количества последовательностей в библиотеках (рис. 4в). Основной вклад в бактериальное сообщество матов водоемов и водотоков Солодовки вносят, в порядке убывания значимости, представители следующих филумов: Cyanobacteria, Proteobacteria, Campylobacterota, Bacteroidetes, Chloroflexi, Desulfobacterota, Chlorobia, Spirochaetota, Patescibacteria, а также неклассифицируемые бактерии. Средний вклад остальных филумов не выше 1%, однако у трех, Firmicutes, Ignavibacteraeota и Ca. Kapabacteria, он превышает эту величину в отдельных пробах. Соотношение различных филумов в пробах закономерно изменялось по мере увеличения концентрации сульфидов и снижения температуры воды (рис. 4б, 4в). Аналогичным образом вдоль этого градиента условий изменялась и предполагаемая трофическая специализация организмов сообществ (рис. 4г). Наиболее заметно изменяется доля оксигенных и аноксигенных фототрофов, а доли бактерий с бродильным типом метаболизма и литоавтотрофов различаются в меньшей степени.
Рис. 4.
Изменения структуры матов вдоль градиентов концентрации сульфидов в воде и температуры: дендрограмма сходства таксономического состава матов (a); концентрация сульфидов (мг/л) в воде и температура (Т) воды в местах отбора проб (б); относительная численность последовательностей, принадлежащих к OTE различных филумов (в); то же, к ОТЕ с различными предполагаемыми типами метаболизма (г).
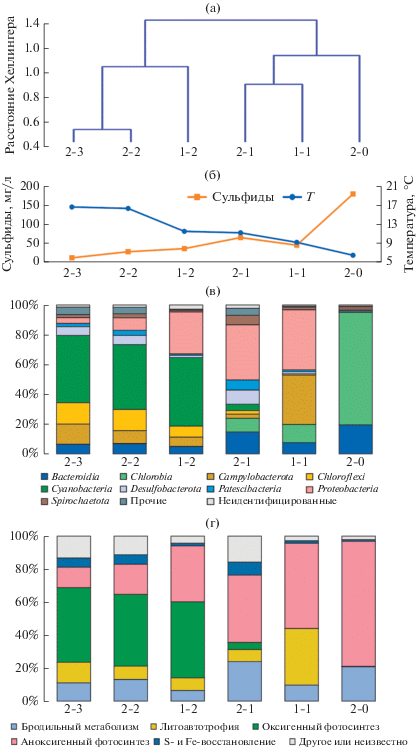
По количественному составу исследованные пробы делятся на две отчетливые группы (рис. 4а). В первую группу входят сообщества трех из четырех матов, в которых преобладают Cyanobacteria (более 40% всех прочтений) и Chloroflexales (8–14%). Температура воды, омывающей эти сообщества, превышает 11.5°С, а концентрация сульфидов – менее 40 мг/л.
Вторая группа сообществ объединяет две пробы жестких обрастаний (микробиалитов) 2-0 и 1-1, а также мат 2-1. Она менее однородна и, по сути, не имеет общих положительных признаков, кроме повышенной доли Chlorobiaceae. Кроме них, заметную часть библиотек, выделенных из проб 1-1 и 2-1, составляют фототрофные протеобактерии. Поэтому общая доля последовательностей, принадлежащих аноксигенным фототрофам в этих трех сообществах выше, чем в типичных цианобактериальных матах, в которых Chlorobiaceae и фототрофные представители Proteobacteria минорны (рис. 4в). Хотя входящий в эту группу цианобактериальный мат 2-1 по внешнему виду почти идентичен матам из первой группы, он представляет собой наиболее богатое видами и разнообразное сообщество как по индексам разнообразия (табл. 2), так и по составу таксонов высокого ранга и типам метаболизма.
Всего в пробах обнаружено 20 доминирующих филотипов (рис. 5, табл. 3, 4), доля прочтений которых хотя бы в одной библиотеке превышает 2% общей. Суммарно они формируют от 67 до 98% общего количества полученных последовательностей.
Рис. 5.
Филогенетическое дерево фрагментов гена 16S рРНК доминирующих риботипов (SLD) в библиотеках из проб ветланда Солодовка, построенное методом максимального правдоподобия. Числа показывают достоверность ветвления по результатам 1000 повторностей бутстреп-анализа. Шкала соответствует 0.05 заменам на нуклеотидную позицию.

Таблица 3.
Таксономическая принадлежность доминирующих филотипов и относительное количество принадлежащих к ним последовательностей в отдельных пробах
| ОТЕ | Филум | Класс | Отряд | Количество прочтений, % от общего в пробе | |||||
|---|---|---|---|---|---|---|---|---|---|
| 2-2 | 2-3 | 1-2 | 2-1 | 1-1 | 2-0 | ||||
| SLD-9 | Bacteroidota | Bacteroidia | Bacteroidales | 0.09 | 0 | 0.32 | 0.44 | 3.11 | 12.2 |
| SLD-15 | incertae sedis | 0.04 | 0 | 1.32 | 1.09 | 0.91 | 3.61 | ||
| SLD-7 | Campylobacterota | Campylobacteria | Campylobacterales | 0 | 0 | 0.18 | 0.41 | 30.6 | 0.17 |
| SLD-12 | incertae sedis | 7.55 | 11.7 | 3.63 | 0.06 | 0 | 0 | ||
| SLD-1 | Chlorobi | Chlorobia | Chlorobiales | 0.28 | 0.04 | 0.06 | 8.42 | 12.2 | 75.6 |
| SLD-10 | Chloroflexi | Chloroflexia | Chloroflexales | 7.62 | 2.32 | 7.09 | 1.08 | 0 | 0 |
| SLD-14 | 1.80 | 6.55 | 0 | 0.14 | 0 | 0 | |||
| SLD-16 | 2.01 | 3.89 | 0 | 0.16 | 0 | 0 | |||
| SLD-6 | Cyanobacteria | Cyanophyceae | Oscillatoriales | 19.0 | 28.9 | 0 | 1.55 | 0 | 0 |
| SLD-8 | 7.73 | 9.24 | 30.8 | 1.46 | 0 | 0.01 | |||
| SLD-25 | 0.81 | 2.28 | 0 | 0.13 | 0 | 0 | |||
| SLD-11 | Synechococcales | 14.7 | 1.87 | 15.2 | 0.70 | 0.07 | 0 | ||
| SLD-20 | Desulfobacterota | Syntrophia | Syntrophales | 0.09 | 0.12 | 0.13 | 2.97 | 1.08 | 0.89 |
| SLD-32 | Desulfobulbia | Desulfobulbales | 0.80 | 0.15 | 0.24 | 2.25 | 0.07 | 0 | |
| SLD-40 | Desulfuromonadia | Geobacterales | 0 | 0.04 | 0.10 | 2.20 | 0.11 | 0 | |
| SLD-4 | Proteobacteria | β-Proteobacteria | Burkholderiales | 5.06 | 1.47 | 26.2 | 19.9 | 38.9 | 0.22 |
| SLD-17 | γ-Proteobacteria | Chromatiales | 2.94 | 0.83 | 0.48 | 6.56 | 0 | 0 | |
| SLD-43 | 0.03 | 0 | 0 | 2.26 | 0 | 0 | |||
| SLD-18 | Spirochaetota | Spirochaetia | Spirochaetales | 0.52 | 0.58 | 0.37 | 2.93 | 0.69 | 0.55 |
| SLD-28 | 0.71 | 0.56 | 0.23 | 2.21 | 0.48 | 0.71 | |||
Таблица 4.
Культивируемые штаммы и природные последовательности, наиболее близкие к доминирующим филотипам микробных матов оз. Солодовка по 16S рРНК
| Филотип | Ближайший культивируемый штамм | Ближайшие природные последовательности | ||||
|---|---|---|---|---|---|---|
| сходство, % | название | № в GenBank | сходство, % | № в GenBank | место выделения* | |
| SLD-1 | 100 | Pelodictyon phaeoclathratiforme BU-1 | NR_104835 | 100 | FJ502275, HE616511, HE616468, HE616413 | LC, LAM (3)** |
| SLD-4 | 99.35 | Rhodoferax antarcticus DSM 24876 | CP019240 | 100 | HQ273555, KM410406, KT072378, KT072413, KX570687, KX570689, KX570691, KX570694, LR636041, MW497038 | WTS, ZKS (2), LC (4), FCS, MAP, SMS |
| SLD-6 | 98.42 | Planktothricoides raciborskii OR1-1 | AB045964 | 100 | AY327199, AY327202, AY327203 | ZS (3) |
| SLD-7 | 97.73 | Sulfurovum lithotrophicum 42BKT | NR_024802 | 99.77 | FJ967851, FJ967852, LR640378 | GSS (2), WTS |
| SLD-8 | 99.77 | Planktothrix paucivesiculata PCC 8926 | GQ351574 | 99.77 | JF747922 | FCS |
| SLD-9 | 91.54 | Puteibacter caeruleilacunae JC036 | MH746935 | 100 | EF467472, EU101284, JF747952, KM410569 | FCS (4) |
| SLD-10 | 93.21 | Ca. Chlorothrix halophila | AY395567 | 99.09 | AY327221 | ZS |
| SLD-11 | 99.77 | Pseudanabaena cinerea NIES-4063 | LC314122 | 99.77 | FJ204854 | LD |
| SLD_12 | 86.74 | Thiofractor thiocaminus 496Chim | NR_113568 | 100 | AB240464, DQ133928, DQ295696, EF467516, HQ603963, JN983679, KM410495, KM410560, KM410714, KT072404 | FRB, FCS (6), MC, ZPS, PS |
| SLD-14 | 89.39 | Ca. Viridilinea mediisalina Kir15-3F | KY611391 | 99.77 | FJ902467 | CC |
| SLD-15 | 90.95 | Fluviicola kyonggii strain CA-1 | KY117481 | 99.57 | EF467522, JF747858, KM410392, KM410445, KM410594, KM410662, KM410711, KM410802, KM410885 | FCS (9) |
| SLD-16 | 86.91 | Ca. Viridilinea halotolerans Chok-6 | MH077959 | 88.07 | AB784995 | CMM |
| SLD-17 | 95.70 | Thiocystis violascens DSM 198 | NR_102951 | 97.37 | AY327166 | ZS |
| SLD-18 | 95.48 | Treponema stenostreptum DSM 2028 | NR_104731 | 99.57 | KM410557 | FCS |
| SLD-20 | 92.34 | Syntrophus aciditrophicus SB | NR_102776 | 99.14 | FJ437854, FJ967873, KM410369, KM410715, KM410800 | FGL, GSS, FCS (3) |
| SLD-25 | 99.77 | Oxynema acuminatum PCC 6304 | NR_102463 | 99.77 | AM229494, HM273437 | MCM, HSM |
| SLD-28 | 96.56 | Treponema stenostreptum 3S-CHLI6-a | MG264272 | 99.35 | KM410600, KM410653, KM410817, KM410902 | FCS (4) |
| SLD-32 | 97.86 | Desulfocapsa thiozymogenes Bra2 | NR_029306 | 99.57 | DQ415775, EU662436, JF747811 | FCS (3) |
| SLD-40 | 97.00 | Geobacter psychrophilus P35 | NR_043075 | 99.79 | EU266817, EU266825, EU266833, JQ086897 | HCA (4) |
| SLD-43 | 99.14 | Chromatium okenii DSM 169 | NR_025315 | 99.57 | FJ546996, FJ546999, FJ547008, FJ547010 | LC (4) |
* Обозначения мест выделения: CC – карстовый провал Каракол, система Закатон (Мексика), CMM – прибрежные микробные маты (Нидерланды), FCS – пещерная система Фразасси (Италия), FGL – Озеро Файетевиль Грин (США), FRB – биопленка в ризосфере тростника (Япония), GSS – Большой Серный Источник (побережье оз. Эри, Мичиган, США), HCA – загрязненный углеводородами водоносный горизонт (Германия), HSM – микробиом кожи человека, LAM – озеро Алинен Мустаярви (Финляндия), LC – озеро Кадано (Швейцария), LD – Дойранское озеро (Греция/Сев. Македония), MAP – загрязненный субарктический торфяник (Финляндия), MC – пещера Мовиле (Румыния), MCM – загрязненный нефтью морской цианобактериальный мат (Франция), PS – загрязненная почва (Италия), SMS – грунт соленого марша (Мерилэнд, США), WTS – система очистки сточных вод (Дания), ZKS – карстовый источник Звепленица (Словения), ZS – источник Зодлтон (Оклахома, США). ** В скобках указано количество последовательностей из указанного местообитания.
Cyanobacteria. Все обнаруженные ОТЕ принадлежат к группам, объединяющим нитчатые безгетероцистные формы. Четыре доминирующие ОТЕ (SLD-6, 8, 25 и 11) имеют высокое сходство с генами нитчатых безгетероцистных цианобактерий Planktothricoides raciborskii, Planktothrix paucivesiculata, Oxynema acuminatum (Oscillatoriales: Microcoleaceae) и Pseudanabaena cinerea/galeata (Synechococcales: Pseudanabaenaceae) соответственно (рис. 5). Распространение ОТЕ SLD-6 и SLD-25 ограничено матами бассейна источника 2 (2-1, 2-2 и 2-3); ОТЕ SLD-8 и SLD-11 встречаются в бассейнах обоих источников (табл. 3). Эти ОТЕ близки некультивируемым цианобактериям матов из мезотрофного сульфидного источника Зодлтон (Zodleton Spring, США), фототрофных биопленок ручьев пещерной системы Фразасси (Италия), карстового сульфидного источника на побережье оз. Эри (Great Sulfur Spring, США), а также цианобактериям матов, планктона и нейстона континентальных пресных водоемов с различной географией (Elshahed et al., 2003; Chaudhary et al., 2009; Klatt et al., 2020) (табл. 4).
Chloroflexi. Обнаруженные ОТЕ принадлежат представителям классов Chloroflexia, Anaerolinea и Ktedonobacteria, однако все доминирующие ОТЕ относятся только к первому классу, объединяющему подавляющее большинство фототрофных организмов этого филума. Доминирующий филотип SLD-10, вероятно, принадлежат олигогалинной кладе, родственной полигалинному Ca. Chlorothrix halophila; ее представители присутствуют также в матах из источника Зодлтон (США) (Elshahed et al., 2003), в матах карстовых провалов системы Закатон (Мексика) (Sahl et al., 2011), а также, вероятно, в других мезогалинных водных местообитаниях (рис. 5, табл. 4). Последовательности ОТЕ SLD-16 и SLD-14 в разных вариантах классификации могут относиться либо к этой же кладе, либо к ветви Heliotrix, и, судя по низкому сходству с описанными видами, представляют собой как минимум самостоятельные рода.
Chlorobi. Хотя этот филум представлен в исследованных пробах лишь двумя ОТЕ, он составляет значительную часть последовательностей в матах вблизи источников (пробы 2-0, 2-1 и 1-1). В библиотеке из пробы 2-0 последовательности Chlorobi составляли 75.6%. Последовательность доминирующего филотипа, SLD-1, совпадает с последовательностью гена 16S рРНК типового штамма Pelodictyon phaeoclathratiforme BU-1 (рис. 5, табл. 4). Идентичные природные последовательности были обнаружены при исследовании эвксинного меромиктического оз. Кадано (Cadagno, Швейцария) и гумозного оз. Алинен Мустаярви (Alinen Mustajärvi, Финляндия). Однако обнаружение этой ОТЕ в качестве доминанта в пробах обрастаний и матов неожиданно, поскольку среди десятка ближайших по сходству ОТЕ в базе данных GenBank отсутствуют последовательности, выделенные из бентоса или из матов. Филотип SLD-93 принадлежит к широко распространенному виду Chlorobium limicola; он обнаружен во всех исследованных пробах слизистых цианобактериальных матов, но всюду являлся минорным.
Proteobacteria. В составе протеобактерий в полученных библиотеках преобладают бета- и гаммапротеобактерии. Доминирующий филотип, SLD-4, имеет 99.35% сходства с геном 16S рРНК типового штамма Rhodoferax antarcticus Madigan et al. 2001 (Commamonadaceae: Betaproteobacteria). Штамм с полностью идентичной последовательностью был обнаружен в хемоклине меромиктического оз. Cadagno, Швейцария.
Еще две доминирующие ОТЕ, SLD-17 и SLD-43, родственны бактериям родов Thiocystis и Chromatium (Chromatiaceae: Gammaproteobacteria). SLD-43, видимо, принадлежит к виду Chr. okenii (сходство 99.14%); ОТЕ SLD-17 является сестринской по отношению к кладе Chromatium/Thiocystis, и вероятно, относится к одному из этих родов или к новому роду (рис. 5, табл. 4).
Desulfobacterota. Три доминирующие ОТЕ, SLD-20, 32 и 40 принадлежат бактериям трех разных семейств (рис. 5, табл. 3, 4). SLD-20 относится к сем. Syntrophaceae. Ближайшие к нему виды, Syntrophus aciditrophicus и Smithella propionica, осуществляют синтрофную деградацию коротко- и длинноцепочечных жирных кислот и бензоата; вероятно, SLD-20 выполняет сходные функции. SLD-32 близок (97.86%) к Desulfocapsa thiozymogenes (Desulfobulbaceae), которая, наряду с сульфатредукцией, способна к диспропорционированию элементной серы и тиосульфата. Филотип SLD-40 родственен Geobacter psychrophilus (Geobacteraceae) и Pelobacter propionicus (Desulfuromonadaceae). В недавней ревизии (Waite et al., 2020) эти виды предлагается перенести в род Pseudopelobacter (Pseudopelobacteraceae); в отличие от р. Geobacter, они способны использовать в качестве акцепторов электронов разнообразные органические и неорганические соединения.
Campylobacterota. Свободноживущие представители этого филума в подавляющем большинстве анаэробные и микроаэробные организмы, участвующие в окислительно-восстановительных превращениях соединений серы. Классификаторы RDP и Silva относят все обнаруженные филотипы к порядку Campylobacterales класса Campylobacteria. Доминирующий SLD-7 близок (97.7%) к Sulfurovum lithotrophicum (сем. Sulfurovaceae); SLD-12 имеет низкое сходство (<87%) с культивируемыми кампилобактериями (табл. 4), и, вероятно, принадлежит к базальной некультивируемой ветви класса Campylobacteria (рис. 5).
Spirochaetes. Две доминирующих ОТЕ, SLD-18 и SLD-28, принадлежат к свободноживущим представителям семейства Treponemataceae (порядок Spirochaetales), и входят в состав ветви, включающей Treponema stenostreptum, T. caldarium и Rectinema cohabitans (рис. 5). Среди минорных ОТЕ шесть близки к перечисленным видам; еще два родственны Treponema zuelzerae, а семь ОТЕ принадлежат к группе MVP-15, которая в текущей таксономической схеме Silva также включается в состав Spirochaetes.
Bacteroidetes. Несмотря на то, что к этой группе принадлежит более 20% от общего количества выделенных ОТЕ, только две из них входят в число доминантов (рис. 5). Среди культивируемых штаммов с известной таксономической принадлежностью, ближайшими к SLD-9 являются представители сем. Marinilabiliaceae (Bacteroidales), а к SLD-15 – сем. Crocinitomicaceae (Flavobacteriales); однако сходство с культивируемыми штаммами в обоих случаях было низким (90–91%; табл. 4). Близкие последовательности (100 и 99.57%) обнаружены при анализе биопленок пещерной системы Фразасси (Италия). Филотипы SLD-9 и SLD-15 являются вторым и третьим доминантами по количеству последовательностей в библиотеке из пробы 2-0 и в заметных количествах присутствуют в пробе 1-1; в остальных пробах они минорны (табл. 3), и, видимо, предпочитают твердые травертиновые обрастания слизистым матам с доминированием цианобактерий.
Candidate Phyla Radiation (Ca. Patescibacteria). ОТЕ, принадлежащие к Patescibacteria, включают 0.4–6.9% последовательностей и 8.7–18% общего количества ОТЕ в полученных библиотеках. Среди них преобладают (68–100% всех Patescibacteria) представители Ca. Absconditabacteriales (Candidate division SR1) филума Ca. Gracilibacteria. Кроме того, обнаружено по 1–5 ОТЕ, принадлежащих бактериям филумов Falkowbacteria, Berkelbacteria, Dojkabacteria, Parcubacteria и Saccharimonadia. Наибольшее развитие этой группы наблюдается в мате 2-1, в котором бактерии двух ОТЕ, относящиеся к Ca. Gracilibacteria, превышают 1%. Ближайшие к ним последовательности обнаружены в наземных сульфидных источниках США (Headd, Engel, 2014), в пещерной системе Фразасси (Hamilton et al., 2015), богатых железом озерах Экспериментальной озерной области (Онтарио, Канада) и грунтах источника Зодлтон (Elshahed et al., 2003). Очевидно, эта группа принимает участие в функционировании матов, которое, возможно, связано с предполагаемым симбиотическим образом жизни этих прокариот.
Биогеография выделенных ОТЕ
По результатам поиска в GenBank и других базах данных, для 326 из 366 ОТЕ обнаруживаются коллекционные штаммы или природные последовательности с нуклеотидным сходством >95%, 207 из них – со сходством >98.7%. Для 21 филотипа в GenBank обнаружены полностью идентичные последовательности. Оставшиеся 40 ОТЕ можно считать эндемичными для исследованного ветланда или для группы сульфидных источников ближайшей территории. 11 ОТЕ не идентифицированы до филума с помощью SINA; оставшиеся шесть ОТЕ принадлежат бактериям филума Bacteroidetes, пять ОТЕ – Patescibacteria; три – Bdellovibrionota; по две ОТЕ – Campylobacterota, Chloroflexi, Desulfobacterota, Ca. Kapabacteria, Spirochaetes и Verrucomicrobia и по одному к Ignavibacteria, Proteobacteria и Firmicutes.
Поиск в BLAST с запросами, определяющими тип местообитания, показал, что наибольшее число последовательностей, близких к обнаруженным ОТЕ на видовом уровне, выделено из микробных матов (табл. 5). Наибольшее число близких последовательностей на уровне вида и рода выделено из матов и планктона озер, несколько меньше – из сообществ подземных водоносных горизонтов и донных осадков. Вероятно, результаты этих запросов пересекаются, однако, судя по результатам, не очень значительно (табл. 5). Большое количество последовательностей, близких обнаруженным ОТЕ, выделенное из бактериопланктона, в т.ч. зоны хемоклина, озер, указывает на возможный обмен видами между этими сообществами, однако направление колонизации, из планктона в маты или наоборот, остается неясным. Заметное сходство обнаруженных ОТЕ с последовательностями из подземных водоносных горизонтов, видимо, подтверждает существенную роль микробиоты подземных вод в формировании сообществ матов сульфидных источников (Headd, Engel, 2014), однако для сообществ, формирующихся в условиях полной солнечной освещенности, она, вероятно, несколько меньше, чем для сообществ пещерных биопленок.
Таблица 5.
Результаты поиска последовательностей, ближайших к выделенным ОТЕ, в базе данных GenBank в целом и в пробах из различных местообитаний
| Количество выделенных ОТЕ, имеющих максимальное сходство* | ||||||
|---|---|---|---|---|---|---|
| 100% | 98.7–100% | 97–98.7% | 95–97% | 90–95% | <90% | |
| GenBank в целом | 21 | 207 | 60 | 38 | 31 | 9 |
| Типы экосистем | ||||||
| Мат или биопленки | 6 | 83 | 73 | 40 | 105 | 59 |
| Озеро | 8 | 64 | 83 | 53 | 98 | 60 |
| Водоносный слой | 5 | 48 | 63 | 44 | 113 | 93 |
| Донные осадки | 1 | 27 | 53 | 37 | 122 | 126 |
| Отдельные водные объекты и их локальные группы | ||||||
| Озера Экспериментальной озерной области (Онтарио, Канада) | 5 | 30 | 66 | 48 | 127 | 90 |
| Пещерная система Фразасси (Италия) | 5 | 60 | 32 | 31 | 107 | 131 |
| Наземные серные источники (США) | 0 | 25 | 27 | 24 | 105 | 185 |
| Озеро Каданьо | 2 | 14 | 14 | 26 | 78 | 231 |
| Озеро Грин (Fayetteville Green Lake, Нью-Йорк, США) | 0 | 9 | 13 | 10 | 63 | 269 |
| Источник Зодлтон (Оклахома, США) | 1 | 8 | 8 | 22 | 92 | 235 |
| Большой серный источник (оз. Эри) (Мичиган, США) | 0 | 8 | 5 | 8 | 26 | 307 |
При анализе отдельных местообитаний (табл. 5) наибольшее количество сходных последовательностей на уровне рода было приурочено к набору ампликонов из озер 227 и 442 с железосодержащим гиполимнионом Экспериментальной озерной области (Онтарио, Канада) (Schiff et al., 2017), а на уровне вида – к пещерной системе Фразасси, Италия (Engel et al., 2004; Zerkle et al., 2016). Последовательности, близкие к обнаруженным в исследованном ветланде, выявлены также в хемоклине и донных осадках меромиктических озер Каданьо (Cadagno, Швейцария) и Грин (Fayetteville Green Lake, США), в прикрепленных сообществах сульфидных источников Среднего запада США (Headd, Engel, 2014) и подводном сульфидном источнике на побережье оз. Эри, США (Chaudhary et al., 2009). Как и ожидалось, полученная в нашей работе библиотека ОТЕ имеет заметное сходство с таковой источника Зодлтон (Оклахома, США), особенно в части ОТЕ из числа Patescibacteria, и вероятно, сходство было бы еще выше, если бы мы исследовали не только маты, но и грунты.
В настоящей работе представлены результаты исследования филогенетического разнообразия бактерий в бассейне холодноводного карстового источника с высоким содержанием сульфидов. Высокопроизводительное секвенирование фрагментов гена 16S рРНК позволило выделить 370 ОТЕ в матах и обрастаниях анаэробной части ветланда. По нашим оценкам, полученные результаты отражают реальное разнообразие прикрепленных бактериальных сообществ, но полнота таксономического покрытия в отдельных пробах составляла от ~50 до >95%. Количество обнаруженных ОТЕ в отдельных участках ветланда варьировало в широких пределах, от 52 до 277. Вероятно, таксономическое разнообразие зависит от типа мата, температуры и концентрации сульфидов. Наибольшее разнообразие обнаружено в типичных мягких цианобактериальных матах; состав бактерий в жестких пленочных и пористых обрастаниях значительно более беден. Обнаружено существенное различие в разнообразии бассейнов двух обследованных родников; его причины пока неясны.
Основу матов образуют цианобактерии; доля их последовательностей в матах 2-2, 2-3 и 1-2 составляет 43–46%. Им сопутствуют Chloroflexales, составляющие в этих матах 7–13% общего числа последовательностей. Несмотря на то, что мат 2-1 визуально очень сходен с вышеперечисленными, по составу он существенно от них отличается; высокая доля протеобактерий и Chlorobiaceae сближает его с пористым травертиновым матом 1-1 и жестким обрастанием 2-0 соответственно. В отличие от исследованных матов других местообитаний, в т.ч. сульфидсодержащих, в полученных нами библиотеках отсутствуют последовательности, принадлежащие бактериям филумов Actinobacteria и Acidobacteria. Эта особенность, вероятно, связана с высокой концентрацией сульфидов в воде исследованной части ветланда.
Хемотрофная часть сообществ матов близка к организмам различных подземных водоносных горизонтов и прикрепленным сообществам из пещерных водотоков; однако их фототрофная часть, по-видимому, формируется независимо от хемотрофной из окружающей поверхностной микробиоты. Интересным фактом является присутствие многих ОТЕ, ближайшие родственники которых обнаруживаются не в прикрепленных сообществах, а в зоне хемоклина стратифицированных, в т.ч. меромиктических, озер.
Представленные в настоящей работе первые данные об особенностях таксономического состава и разнообразия прикрепленных сообществ ветланда Солодовка (Самарская обл., Россия) расширяют наши представления об изменчивости структуры и функционировании бактериальных матов холодноводных высокосульфидных водных местообитаний.
Список литературы
Горбунов М.Ю. Гидрохимический состав и стратификация воды в пойменном озере Тахтарка // Вестник ВГУ. Серия: География. Геоэкология. 2019. № 1. С. 92–100.
Дедков А.П. Геолого-геоморфологические условия развития солоноватоводных карстовых озер Среднего Поволжья // Уникальные экосистемы солоноватоводных карстовых озер Среднего Поволжья / Под ред. Алимова А.Ф., Мингазовой Н.М. Казань: Изд-во Казанского ун-та. 2001. С. 9–17.
Заварзин Г.А. Лекции по природоведческой микробиологии. М.: Наука, 2004. 348 с.
Протисты и бактерии озер Самарской области / Под ред. Жарикова В.В. Тольятти: Кассандра, 2009.
Селиванова Е.А., Пошвина Д.В., Хлопко Ю.А., Гоголева Н.Е., Плотников А.О. Разнообразие прокариот в планктонных сообществах соленых Соль-Илецких озер (Оренбургская область) // Микробиология. 2018. V. 87. С. 432–447.
Selivanova E.A., Poshvina D.V., Khlopko Y.A., Plotnikov A.O., Gogoleva N.E. Diversity of prokaryotes in planktonic communities of saline Sol-Iletsk lakes (Orenburg oblast, Russia) // Microbiology (Moscow). 2018. V. 87. P. 569–582.
Bolger A.M., Lohse M., Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data // Bioinformatics. 2014. V. 30. № 15. P. 2114–2120.
Brock T.D. Vertical zonation in hot spring algal mats // Phycologia. 1969. V. 8. P. 201–205.
Chaudhary A., Haack S.K., Duris J.W., Marsh T.L. Bacterial and archaeal phylogenetic diversity of a cold sulfur-rich spring on the shoreline of Lake Erie, Michigan // Appl. Environ. Microbiol. 2009. V. 75. P. 5025–5036.
Edgar R. UPARSE: highly accurate OTU sequences from microbial amplicon reads // Nat. Methods. 2013. V. 10. P. 996–998. https://doi.org/10.1038/nmeth.2604
Edgar R.C. UCHIME2: improved chimera prediction for amplicon sequencing // BioRxiv. 2016. Art. 074252. https://doi.org/10.1101/074252
Elshahed M.S., Senko J.M., Najar F.Z., Kenton S.M., Roe B.A., Dewers T.A., Spear J.R., Krumhoz L.R. Bacterial diversity and sulfur cycling in a mesophilic sulfide-rich spring // A-ppl. Environ. Microbiol. 2003. V. 69. P. 5609–5621.
Engel A.S., Porter M.L., Stern L.A., Quinlan S., Bennett P.C. Bacterial diversity and ecosystem function of filamentous microbial mats from aphotic (cave) sulfidic springs dominated by chemolithoautotrophic “Epsilonproteobacteria” // FEMS Microbiol. Ecol. 2004. V. 51. P. 31–53.
Farmer J. Grazing and bioturbation in modem microbial mats // The Proterozoic Biosphere / Eds. Schopf J.W., Klein C. N.Y.: Cambridge Univ. Press, 1992. P. 295–297.
Hallbeck L., Pedersen K. Characterization of microbial processes in deep aquifers of the Fennoscandian Shield // A-ppl. Geochem. 2008. V. 23. P. 1796–1819.
Hamilton T.L., Jones D.S., Schaperdoth I., Macalady J.L. Metagenomic insights into S0 precipitation in a terrestrial subsurface lithoautotrophic ecosystem // Front. Microbiol. 2015. V. 5. Art. 756. https://doi.org/10.3389/fmicb.2014.00756
Headd B., Engel A.S. Biogeographic congruency among bacterial communities from terrestrial sulfidic springs // Front. Microbiol. 2014. V. 5. Art. 473. https://doi.org/10.3389/fmicb.2014.00473
Hickman-Lewis K., Cavalazzi B., Foucher F., Westall F. Most ancient evidence for life in the Barberton greenstone belt: Microbial mats and biofabrics of the ∼3.47 Ga Middle Marker horizon // Precambrian Res. 2018. V. 312. P. 45–67.
Javor B.J., Castenholz R.W. Laminated microbial mats, Laguna Guerrero Negro, Mexico // Geomicrobiol. J. 1981. V. 2. P. 237–273.
Klatt J.M., Gomez-Saez G.V., Meyer S., Ristova P.P., Yilmaz P., Granitsiotis M.S., Macalady J.L., Gaute Lavik G., Polerecky L., Bühring S.I. Versatile cyanobacteria control the timing and extent of sulfide production in a Proterozoic analog microbial mat // ISME J. 2020. V. 14. P. 3024–3037.
Kumar S., Stecher G., Li M., Knyaz C., Tamura K. MEGA X: Molecular Evolutionary Genetics Analysis across computing platforms // Mol. Biol. Evol. 2018. V. 35. P. 1547–1549.
Machel H.G. Bacterial and thermochemical sulfate reduction in diagenetic settings – old and new insights // Sediment. Geol. 2001. V. 140. P. 143–175.
Mendes Monteiro J., Vogwill R., Bischoff K., Gleeson D.B. Comparative metagenomics of microbial mats from hypersaline lakes at Rottnest Island (WA, Australia), advancing our understanding of the effect of mat community and functional genes on microbialite accretion // Limnol. Oceanogr. 2020. V. 65(S1). P. S293–S309.
Orleanskiy V.K., Yeroshchev-Shak V.A., Karpov G.A., Inkova T.A. Bedded bacterial-algal formation (mats) in the Kamchatka thermal fields // Int. Geol. Rev. 1984. V. 26. P. 298–302.
Pierson B.K., Castenholz R.W. A phototrophic gliding filamentous bacterium of hot springs, Chloroflexus aurantiacus, gen. and sp. nov. // Arch. Microbiol. 1974. V. 100. P. 5–24. https://doi.org/10.1007/BF00446302
Prieto-Barajas C.M., Valencia-Cantero E., Santoyo G. Microbial mat ecosystems: structure types, functional diversity, and biotechnological application // Electron. J. Biotechnol. 2018. V. 31. P. 48–56.
Pruesse E., Peplies J., Glöckner F.O. SINA: accurate high-throughput multiple sequence alignment of ribosomal RNA genes // Bioinformatics. 2012. V. 28. P. 1823–1829.
Quast C., Pruesse E., Yilmaz P., Gerken J., Schweer T., Yarza P., Peplies J., Glöckner F.O. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools // Nucl. Acids Res. 2013. V. 41(D1). P. D590–D596.
Sahl J.W., Gary M.O., Harris J.K., Spear J.R. A comparative molecular analysis of water-filled limestone sinkholes in north-eastern Mexico // Environ. Microbiol. 2011. V. 13. P. 226–240.
Savvichev A.S., Kadnikov V.V., Rusanov I.I., Beletsky A.V., Krasnova E.D., Voronov D.A., Kallistova A.Yu., Veslopolova E.F., Zakharova E.E., Kokryatskaya N.M., Losyuk G.N., Demidenko N.A., Belyaev N.A., Sigalevich P.A., Mardanov A.V., Ravin N.V., Pimenov N.V. Microbial processes and microbial communities in the water column of the polar meromictic Lake Bol’shie Khruslomeny at the White Sea coast // Front. Microbiol. 2020. V. 11. Art. 1945.
Schiff S.L., Tsuji J.M., Wu L., Venkiteswaran J.J., Molot L.A., Elgood R.J., Paterson M.J. Neufeld J.D. Millions of boreal shield lakes can be used to probe Archaean Ocean biogeochemistry // Sci. Rep. 2017. V. 7. P. 1–11.
Semikhatov M.A., Gebelein C.D., Cloud P., Awramik S.M., Benmore W.C. Stromatolite morphogenesis – progress and problems // Can. J. Earth Sci. 1979. V. 16. P. 992–1015.
Waite D.W., Chuvochina M., Pelikan C., Parks D.H., Yilmaz P., Wagner M., Loy A., Naganuma T., Nakai R., Whitman W.B., Hahn M.W. Proposal to reclassify the proteobacterial classes Deltaproteobacteria and Oligoflexia, and the phylum Thermodesulfobacteria into four phyla reflecting major functional capabilities // Int. J. Syst. Evol. Microbiol. 2020. V. 70. P. 5972–6016.
Whitman W.B., Coleman D.C., Wiebe W.J. Prokaryotes: the unseen majority // Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 6578–6583.
Wingett S.W., Andrews S. FastQ Screen: A tool for multi-genome mapping and quality control // F1000Research. 2018. V. 7. https://doi.org/10.12688/f1000research.15931.2
Zerkle A.L., Jones D.S., Farquhar J., Macalady J.L. Sulfur isotope values in the sulfidic Frasassi cave system, central Italy: a case study of a chemolithotrophic S-based ecosystem // Geochim. Cosmochim. Acta. 2016. V. 173. P. 373–386.
Zhang J., Kobert K., Flouri F., Stamatakis A. PEAR: a fast and accurate Illumina Paired-End reAd mergeR // Bioinformatics. 2014. V. 30. P. 614–620. https://doi.org/10.1093/ bio-informatics/btt593
Дополнительные материалы отсутствуют.




