Микробиология, 2022, T. 91, № 1, стр. 50-61
Морфология и филогения микроводоросли Coleochlamys apoda (Microthamniales, Chlorophyta)
В. В. Редькина a, *, А. Д. Темралеева a, Е. А. Портная a, Р. Р. Шалыгина b
a Институт физико-химических и биологических проблем почвоведения Российской академии наук –
обособленное подразделение ФИЦ ПНЦБИ РАН
142290 Пущино, Россия
b Институт проблем промышленной экологии Севера – обособленное подразделение ФИЦ КНЦ РАН
184209 Апатиты, Россия
* E-mail: kalmykova_v_v@mail.ru
Поступила в редакцию 14.09.2021
После доработки 24.09.2021
Принята к публикации 24.09.2021
- EDN: DCZGZG
- DOI: 10.31857/S0026365622010116
Аннотация
В статье приведены результаты морфологического и филогенетического анализа штамма Coleochlamys apoda ACSSI 377, выделенного из образца биологической почвенной корочки с поверхности песчаного субстрата на Севере России (Мурманская область). Подробно описана морфология штамма, отмечено наличие зрелых клеток S-образной формы, характерных для вида С. oleifera, впервые зафиксировано образование синзооспор. По данным анализа генов 18S рРНК и rbcL штамм является представителем рода Coleochlamys внутри порядка Microthamniales, относится к виду С. apoda и представляет собой первую находку вида на территории России, подтвержденную молекулярно-генетическими методами. Присутствие на филогенетическом дереве гена 18S рРНК клад, состоящих из некультивируемых клонов, свидетельствует о слабой изученности порядка и перспективах обнаружения и описания новых его представителей. На основе литературных данных и собственных наблюдений проанализированы экология и распространение Coleochlamys и сестринского рода Microthamnion. Представители Coleochlamys предпочитают холодные местообитания и имеют ограниченный ареал распространения, в отличие от Microthamnion, находки которого многочисленны и зафиксированы в различных регионах.
Род эукариотических водорослей Coleochlamys был впервые описан советским альгологом А.А. Коршиковым (1953) на основе штамма, выделенного из сфагнового болота на территории Украины, которому было дано название – Coleochlamys apoda Korschikov. Среди характерных признаков указывались следующие морфологические характеристики: клетки булавовидные, прямые или изогнутые, но в целом неправильной и очень изменчивой формы, на одном конце широко округлые, на втором – суженные. Хлоропласт пристенный, с одним (изредка двумя) пиреноидом. Размножение зооспорами, образующимися делением протопласта на 16–32–64 части. Одна часть протопласта, лежащая в узком конце клетки, не превращается в зооспору, а, оставаясь на своем месте, покрывается оболочкой и разрастаетсяв новуювегетативную клетку внутри старой оболочки. Зооспоры голые, сначала почти круглые, затем удлиненные, спереди заостренные, с двумя жгутиками и стигмой, освобождаются через глубокий поперечный разрыв оболочки у самой вершины зооспорангия. Позднее в род Coleochlamys были включены еще четыре вида: C. oleifera, C. cucumis, C. maxima, C. perforata, различающиеся по размеру и форме клеток, типу хлоропласта (Et-tl, Gärtner, 2013). Дальнейшая ревизия рода с использованием молекулярно-филогенетического анализа пяти штаммов, идентифицированных как Coleochlamys, дала возможность выделить только два четко дифференцированных вида: C. apoda, типовой вид рода, и C. oleifera (Barcytė et al., 2021). Они различаются формой клеток, наличием или отсутствием продолжения клеточной стенки, напоминающего сосочек, а также компенсаторными заменами во вторичной структуре ITS2. Кроме того, показано, что роды Rhopalocystis и Fusochloris являются более поздними синонимами Coleochlamys, а водоросли, первоначально описанные как Characium perforatum K.W. Lee & Bold и Rhopalocystis cucumis Reisigl являются аналогами C. apoda. Таксономический статус C. maxima остался нерешенным ввиду отсутствия аутентичного штамма и его нуклеотидных последовательностей. Таким образом, на данный момент таксономически признаны два вида рода Coleochlamys:
Coleochlamys apoda Korshikov (гетеротипные синонимы: Characium perforatum K.W. Lee & H.C. Bold; Fusochloris perforata (K.W. Lee & H.C. Bold) G.L. Floyd & Shin Watanabe; Rhopalocystis cucumis Reisigl; Coleochlamys cucumis (Reisigl) H. Ettl & G. Gärtner), морфология соответствует описанию А.А. Коршикова (1953), основные отличительные черты от вида C. oleifera – клетки большей частью широко эллипсоидные, часто с утолщением оболочки в виде сосочка на более узком конце;
Coleochlamys oleifera (Schussnig) Fott (базионим: Rhopalocystis oleifera Schussnig), характерная особенность – S-образная форма зрелых клеток, утолщение оболочки на более узком конце не столь выражено, присутствуют многочисленные бесцветные липидные гранулы.
Наиболее близким к Coleochlamys является род Microthamnion, включающий 5 таксономически признанных видов: M. curvatum, M. exiguum, M. strictissimum, M. vexator и голотип – M. kuetzingianum. В генетических базах данных имеются нуклеотидные последовательности только M. kuetzingianum. И хотя в целом представители рода имеют очень широкое распространение по всему миру, две линии внутри группы включают штаммы из экстремальных сред обитания (Reder, 2019), на основании чего для поиска новых представителей порядка Microthamniales предлагается делать акцент на исследовании необычных местообитаний. При этом экстремофилы часто обладают значительным биотехнологическим потенциалом (Varshney, 2015; Leya, 2020). Так, имеются сведения, что M. kuetzingianum проявляет устойчивость к повышенной кислотности среды, высоким концентрациям металлов, потенциально способен к извлечению токсикантов из субстрата (Foster, 1982; Lampkin, Sommerfeld, 1982; Vara Prasad, de Oliveira Freitas, 2003; Bray, 2007; Płachno et al., 2015). У Coleochlamys oleifera (SAG 6.90) обнаружены антибактериальные свойства против Bacillus subtilis (Mudimu, 2014). Кроме того, способность к накоплению липидов как продуктов ассимиляции, отмеченная у представителей Coleochlamys и Microthamnion (Printz, 1964), вызывает интерес с точки зрения производства биотоплива или нутрицевтиков.
В 2020 году из образца биологической почвенной корочки с поверхности песчаного субстрата нами был выделен штамм зеленой микроводоросли, морфологические признаки которого соответствовали описанию рода Coleochlamys. Поскольку находки таксона на территории России редки и никогда не были подтверждены молекулярно-генетическими методами, а чистые культуры на тот момент отсутствовали в отечественных альгологических коллекциях, целью работы стал морфологический анализ штамма ACSSI 377 и установление его филогенетического положения внутри порядка Microthamniales на основе анализа двух генов – 18S рРНК и rbcL.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Изоляция и культивирование штамма. Объектом исследования послужил штамм из рабочей коллекции QUA-11, изолированный авторами из образца биологической почвенной корочки, сформированной на поверхности песчаного карьера ОАО “Апатитыводоканал” (г. Апатиты, Мурманская обл.). Карьер заложен на флювиогляциальных отложениях, расположен в центральной части Мурманской области (67.600818 N, 33.498229 E), в предгорье Хибин в долине реки Белая, в подзоне северной тайги. Штамм был депонирован в Альгологическую коллекцию Института физико-химических и биологических проблем почвоведения РАН (Algal Collection of Soil Science Institute) под номером ACSSI 377. Культивирование проводили на агаризованной среде 3N BBM в климатостате (температура 23–25°С, свет 60–75 мкмоль фотонов м–2 с–1, фотопериод 12 ч).
Микроскопия. Морфологию и жизненный цикл штамма ACSSI 377 изучали методами световой микроскопии (светлое поле и интерференционный контраст) с помощью микроскопов Olympus CX41 (Япония) и Carl Zeiss Axio Scope A1 (Германия) в ЦКП ИФХиБПП. Результаты наблюдений документированы фотографиями, снятыми с помощью цветных цифровых камер ProgRes Jenoptik (Германия) и Carl Zeiss MRc 5 (Германия). Сроки наблюдения за штаммом составляли от 1.5 недель до 4 месяцев. Для стимуляции формирования зооспорангиев и выхода зооспор применяли модифицированный способ, описанный В.М. Андреевой (1998). Для этого водоросль из 4-недельной жидкой культуры переносили на агаризованную среду BBM, приготовленную в двух вариантах – содержащую тройное количество азота с добавлением 1.5% глюкозы и лишенную азота без внесения глюкозы. Через два дня водоросль переносили в каплю дистиллированной воды и проводили наблюдение под микроскопом.
Выделение, амплификация, очистка и секвенирование ДНК. ДНК выделяли из биомассы с помощью набора DNeasy Plant Mini Kit (“Qiagen”, США), следуя протоколу производителя. При амплификации использовали готовую смесь для ПЦР Screen Mix-HS (“Евроген”, Россия). Праймеры и условия для амплификации генов 18S рРНК (Katana et al., 2001) и rbcL (McManus, Lewis, 2011) указаны в табл. 1. Детекцию целевых ПЦР-продуктов проводили электрофоретически в 1%-ном агарозном геле (краситель SYBR Safe). Для дальнейшей очистки ампликонов из геля использовали набор Cleanup S-Cap (“Евроген”, Россия). Секвенирование нуклеотидных последовательностей осуществляли на базе ЗАО “Евроген” (Россия).
Таблица 1.
Праймеры и условия амплификации генов 18S рРНК и rbcL
| Ген | Праймер | Последовательность (5'–3') | Условия амплификации |
|---|---|---|---|
| 18S рРНК | 18SF | AACCTGGTTGATCCTGCCAGT | 95°C – 5 мин; 95°C – 1 мин; 55°C – 1 мин; 72°C – 2 мин, 35 циклов; 72°C – 5 мин |
| 18SR | TGATCCTTCTGCAGGTTCACCTACG | ||
| 416–37R* | ATTTGCGCGCCTGCTGCCTTC | ||
| 1323–44F* | CGAACGAGACCTCAGCCTGCTA | ||
| 898–919R* | TAAATCCAAGAATTTCACCTCT | ||
| rbcL | M28F | GGTGTTGGATTWAAAGCTGGTGT | 94°C – 5 мин; 94°C – 1 мин 15 с; 56°C – 2 мин; 72°C – 2 мин 15 с, 30 циклов; 72°C – 7 мин |
| M1390Ra | CTTTCCAAAYTTCACAAGCAGCAG | ||
| M633F* | CATGCGTTGGAGAGACCGT | ||
| M650R* | CGGTCTCTCCAACGCATGA |
Молекулярно-филогенетический анализ. Для уточнения филогенетического положения штамма ACSSI 377 был осуществлен поиск гомологии нуклеотидных последовательностей генов 18S рРНК и rbcL по алгоритму BLASTn в GenBank (https:// blast.ncbi.nlm.nih.gov). Для дальнейшего анализа была составлена выборка из 62 последовательностей ядерного гена 18S рРНК, принадлежащих некультивируемым образцам из природной среды, культивируемым штаммам рода Coleochlamys и штаммам других эукариотических водорослей с уровнем гомологии до 94% включительно (табл. S1 ; дополнительные материалы). Множественное выравнивание было выполнено в программе BioEdit по алгоритму ClustalW. Общая длина анализируемых последовательностей составила 1757 п.н. При выборе модели нуклеотидных замен использовали программу jModelTest и минимальное значение критерия AIC. Реконструкцию филогенетических взаимосвязей осуществляли с помощью метода максимального правдоподобия (Maximum Likelihood, ML) в программе PhyML. В качестве внешней группы, учитывая филогенетическую реконструкцию Barcytė et al. (2021), выбрали представителей класса Chlorophyceae (Chlorophyta) – Chloromonas rosae (AB624565) и Chlamydomonas reinhardtii (M32703). Статистическая поддержка топологии дерева была оценена с помощью бутстреп-анализа (1000 повторностей) и указана в узлах ветвей в виде процентов. Анализ последовательностей гена 18S рРНК методом Байеса (Bayesian Inference, BI) проводили с помощью программы BEAST v1.8.4. со следующими параметрами: 108 MCMC поколений, деревья и оцениваемые параметры записывались каждые 104 поколений. Сходимость результатов анализа оценивалась в Tracer 1.5 с помощью статистики ESS (эффективный размер выборки). Все параметры были оценены достаточно (значения ESS > 300). Первые 25% деревьев были отброшены, на основе остальных с помощью TreeAnnotator v1.8.4 получили консенсусное филогенетическое дерево и апостериорные вероятности его ветвления.
Для уточнения филогенетических отношений на видовом уровне использовали более вариабельный пластидный ген rbcL, при анализе которого в выборку вошли нуклеотидные последовательности 9 штаммов (табл. S1 ; дополнительные материалы), принадлежащих родам Coleochlamys, Microthamnion, и двух штаммов внешней группы – Chlamydomonas bilatus (AF517082) и Chloromonas rosae (AB022532). Общая длина анализируемых последовательностей составила 1322 п.н. При реконструкции филогенетических взаимосвязей с помощью метода ML статистическая поддержка топологии дерева была оценена с помощью бутстреп-анализа (1000 повторностей) и указана в узлах ветвей в виде процентов. BI анализ проводили с помощью программы BEAST v1.8.4. со следующими параметрами: 109 MCMC поколений, деревья и оцениваемые параметры записывались каждые 105 поколений. Сходимость результатов анализа оценивалась в Tracer 1.5 с помощью статистики ESS. Все параметры были оценены достаточно (значения ESS > 300). Первые 25% деревьев были отброшены, на основе остальных с помощью TreeAnnotator v1.8.4 получили консенсусное филогенетическое дерево и апостериорные вероятности его ветвления.
Топология деревьев, полученных методами ML и BI, существенно не различалась для обоих маркеров, поэтому в программе FigTree v. 1.3.1 были визуализированы BI-деревья, на которые в качестве статистической поддержки были нанесены бутстрэп-значения (в процентах) и апостериорные вероятности (в долях). Для сравнения топологии деревьев использовали данные статьи Barcytė et al. (2021). Генетические различия между нуклеотидными последовательностями охарактеризовали с помощью генетических дистанций, мерой которых являлся процент несовпадений нуклеотидов при попарном сравнении выравненных последовательностей, вычисленных в программе MEGA 6.0. Боксплот генетических дистанций построен в среде статистического программирования R 3.4.4 (https://www.R-project.org/). Вариабельный регион V9 гена 18S рРНК, предлагаемый в качестве ДНК-баркода для зеленых водорослей (Darienko et al., 2015; Pröschold, Darienko, 2020a), был обнаружен только в трех последовательностях, принадлежащих штамму ACSSI 377 (MZ562721), M. kuetzingianum (Z28974) и Characium perforatum (M62999), в соответствии с работами Van de Peer et al. (1997) и Pröschold, Darienko (2020b). Фолдинг вторичной структуры региона осуществлен с помощью веб-сервера RNAfold по принципу минимальной энергии и визуализирован в программе PseudoViewer3.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфология штамма ACSSI 377. Клетки широко эллипсоидные или вытянутые (рис. 1.1 ), каплевидные (рис. 1.2 ), грушевидные, в форме треугольника с притупленными углами, иногда S-образной формы (рис. 1.3 ) или изогнутые в форме бумеранга (рис. 1.8 ). В культуре присутствуют клетки, имеющие выпуклость оболочки в виде сосочка на одном из концов или сторон (рис. 1.2, 1.9 ), а также закругленные с обоих полюсов (рис. 1.1 ). Хлоропласт пристенный, с одним, реже двумя (рис. 1.4 ) пиреноидами. Пиреноид имеет крахмальную обвертку, состоящую из нескольких скорлупок. Единственное ядро достаточно крупное и хорошо различимо (рис. 1.1 ). Цитоплазма имеет зернистую структуру, содержит липидные капли. Зрелые клетки могут достигать 60 мкм в длину, 20 мкм – в ширину. Размножение автоспорами (рис. 1.5 ), апланоспорами и зооспорами (рис. 1.6 ). Автоспоры овальной, каплевидной или грушевидной формы, от 8 мкм в длину, иногда значительно увеличиваются в размерах прямо внутри оболочки спорангия, оставаясь некоторое время связанными друг с другом. Зооспоры сначала округлые, затем вытянутые с заостренным передним концом, с двумя жгутиками, по длине примерно равными длине зооспоры. Стигма расположена в переднем конце клетки или занимает почти срединное положение. Размер зооспор 5.3–6.8 × 2.2–3.6 мкм. Апланоспоры грушевидной формы, имеют стигму, занимающую срединное положение или расположенную ближе к переднему концу клетки, очень редко – в широком ее конце. Хлоропласт содержит пиреноид. Размер апланоспор 6.7–8.2 × × 2.9–3.6 мкм. Чаще всего мы наблюдали зоо- и апланоспорангии, содержащие 32 зоо- или апланоспоры, которые освобождаются путем разрыва материнской оболочки со стороны широкого конца. После выхода зооспор и апланоспор часть протопласта, лежащая в узком конце клетки, остается на месте, в дальнейшем разрастаясь в новую вегетативную клетку (рис. 1.7 ). Кроме того, в культуре присутствовали многожгутиковые зооспоры, так называемых синзооспоры, – комплексы из двух и более сросшихся зооспор, этот морфологический признак описан впервые.
Рис. 1.
Coleochlamys apoda ACSSI 377. 1 – зрелые вегетативные клетки, черным треугольником отмечено ядро; 2 – молодые клетки с выступом клеточной стенки в виде сосочка (отмечены черными треугольниками); 3 – S-образная форма зрелой клетки; 4 – клетка с двумя пиреноидами (отмечены черными треугольниками); 5 – автоспорангий с автоспорами; 6 – зооспорангий, стигма зооспор отмечена черным треугольником; 7 – оболочка зооспорангия с частью протопласта, не превратившегося в зооспору; 8–9 – зрелые клетки различной формы. Масштабная метка – 10 мкм.

В целом, штамм соответствует описанию вида C. apoda, однако присутствие в культуре клеток S‑образной формы, закругленных с обоих концов, сближает наш штамм с другим видом – С. oleifera. Кроме того, наши наблюдения и данные Barcytė et al. (2021) свидетельствуют о морфологической изменчивости в зависимости от физиологического состояния культуры и условий культивирования. Морфологическая пластичность в ответ на изменения условий ранее отмечена и для сестринского рода Microthamnion (John, Johnson, 1987). Представители этого рода, в отличие от Coleochlamys, образуют разветвленные нити, заканчивающиеся тупо закругленными клетками. Единственный париетальный хлоропласт не имеет пиреноида. Однако так же, как и у Coleochlamys oleifera, в цитоплазме клеток Microthamnion в качестве продукта ассимиляции обнаруживаются липидные капли (Printz, 1964), размножение происходит с помощью зооспор, развивающихся в вегетативных клетках, подвергшихся дифференцировке в зооспорангии (Watson & Arnott, 1973; Watson, 1975; John & Johnson, 1987; Bakker, 1995), половое воспроизводство неизвестно. В лабораторных экспериментах было замечено, что в диапазоне температур 10–28°C и интенсивности света 3–20 кЛк происходит быстрый рост клеток, в результате чего они становятся более длинными (морфотип M. strictissimum), тогда как температуры и интенсивность света ниже этих значений обеспечивают более медленный рост и меньшие размеры клеток (морфотип M. kuetzingianum) (John, Johnson, 1987). Таким образом, морфологическая изменчивость существенно усложняет разграничение видов порядка Microthamniales и доказывает необходимость использования молекулярно-генетического анализа для точного определения таксономической принадлежности представителей этой группы.
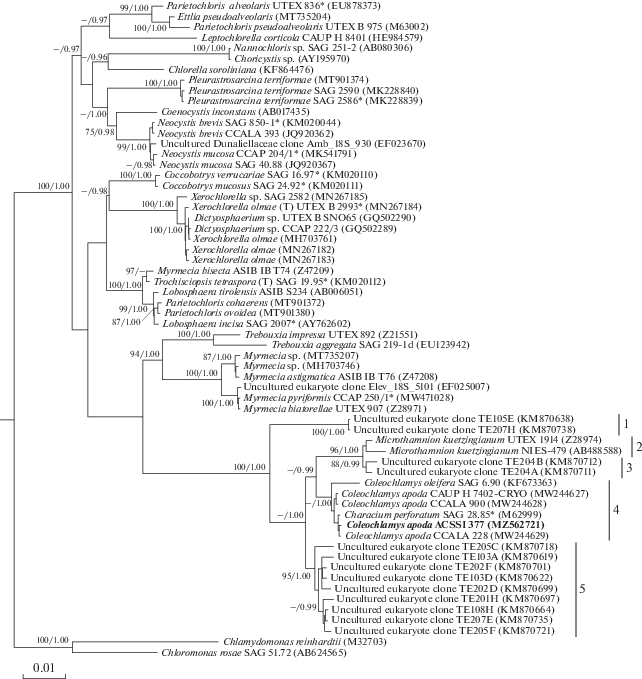
Филогенетический анализ. На дереве, построенном на основе последовательностей гена 18S рРНК (рис. 2), внутри порядка Microthamniales c высоким уровнем статистической поддержки обособлены 5 групп. Три из них (клады 1, 3, 5 на рис. 2) сформированы некультивируемыми эукариотическими клонами из образцов минеральных отложений на поверхности ледника Мидл-Форк-Токлат, расположенного в национальном парке Денали (Аляска, США) (Schmidt, Darcy, 2015). Клада 4 включает все штаммы рода Coleochlamys, в том числе, исследуемый нами штамм ACSSI 377. В кладу 2 вошли представители сестринского рода Microthamnion. Генетические различия между штаммом ACSSI 377 и штаммами вида Coleochlamys apoda, включая аутентичный штамм SAG 28.85, составили 0.1% (табл. S2 ; дополнительные материалы). В то же время генетические дистанции между штаммом другого вида рода Coleochlamys – C. oleifera и штаммами, отнесенными к C. apoda, включая ACSSI 377, составляли 0.8%. Генетические дистанции между представителями Coleochlamys и сестринским родом Microthamnion варьировали в пределах 1.4–1.9%. Судя по перекрывающимся диапазонам значений генетических дистанций, межвидовых внутри клады 4 (0.8%) и между кладами 4 и 5 (0.8–1.7%), группа клонов клады 5 либо включает представителей отдельного вида рода Coleochlamys, либо формирует еще один род внутри порядка Micro-thamniales. Для уточнения их таксономического положения необходим анализ живых культивируемых штаммов, принадлежащих этой группе.
Рис. 2.
Укорененное филогенетическое дерево, построенное методом Байеса и ML на основе последовательностей гена 18S рРНК. В качестве статистической поддержки узлов дерева над соответствующими ветвями указаны бутстреп-значения/апостериорные вероятности. Значения менее 70% и менее 0.95 не показаны. Модель нуклеотидных замен: GTR + I + G. Обозначения: жирным шрифтом выделен штамм ACSSI, (Т) – типовой вид, * – аутентичный штамм.
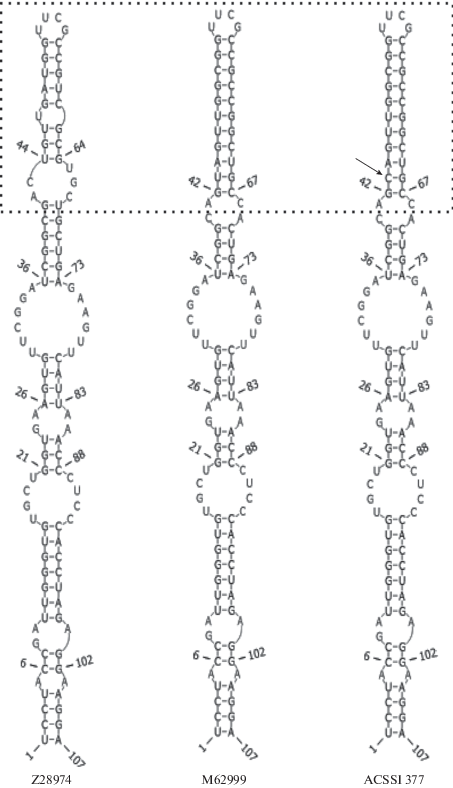
Кроме того, мы проанализировали вторичную структуру вариабельного региона V9 гена 18S рРНК у представителей порядка Microthamniales, который предлагается в качестве ДНК-баркода зеленых водорослей. Так как регион расположен в конце гена 18S рРНК, то его часто не секвенируют. Так, из всех изученных 62 нуклеотидных последовательностей он был обнаружен только в трех, включая исследуемый штамм. ACSSI 377 и C. apoda (=Characium perforatum M62999) имеют идентичный регион V9, за исключением единственной замены (рис. 3). Штаммы C. apoda отличаются от M. kuetzingianum (Z28974) верхней частью шпильки V9.
Рис. 3.
Вторичная структура вариабельного региона V9 гена 18S рРНК у представителей порядка Microthamniales. Стрелкой отмечена замена нуклеотида у штамма ACSSI 377 по сравнению со штаммом Characium perforatum (M62999). Пунктирным прямоугольником отмечена верхняя часть шпильки V9, отличающаяся у Microthamnion kuetzingianum и двух представителей вида Coleochlamys apoda.
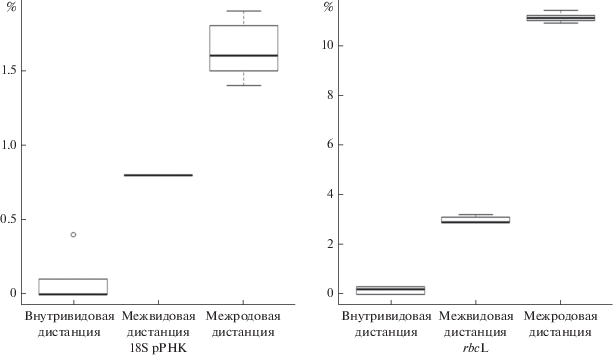
Так как с помощью анализа ядерного гена 18S pPHK мы не получили достаточную поддержку группы C. apoda (значение апостериорной вероятности для этого узла – 0.72, а на дереве ML он и вовсе отсутствует), то для усиления филогенетического сигнала был проведен анализ более вариабельного пластидного гена rbcL. На rbcL-дереве (рис. 4), штамм ACSSI 377 с максимальным уровнем статистической поддержки (100/1.00) группировался с представителями рода Coleochlamys. Внутри группы произошла четкое разделение (уровень поддержки 94/1.00) на два вида – C. apoda, включая ACSSI 377, и C. oleifera. Внутривидовые генетические дистанции составили 0–0.3%, межвидовые – 2.9–3.2%, межродовые дистанции варьировали в пределах 10.9–11.4% (рис. 5), все диапазоны не перекрывались между собой.
Рис. 4.
Укорененное филогенетическое дерево, построенное методом Байеса и ML на основе последовательностей гена rbcL. В качестве статистической поддержки узлов дерева над соответствующими ветвями указаны бутстреп-значения/апостериорные вероятности. Модель нуклеотидных замен: GTR + G. Обозначения: жирным шрифтом выделен штамм ACSSI, * – аутентичный штамм.
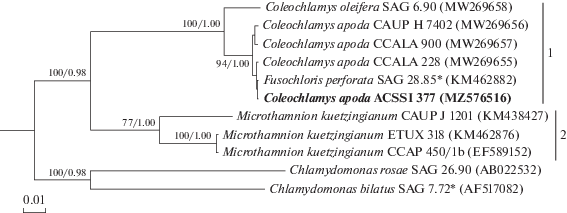
Рис. 5.
Боксплоты, построенные на основе значений генетических дистанций у представителей порядка Microthamniales – Coleochlamys и Microthamnion.
Следует отметить, что в генетической базе GenBank кроме последовательностей 18S рРНК и rbcL имеются последовательности высоковариабельного спейсера ITS2 пяти штаммов Coleochlamys. В работе Barcytė et al. (2021) проведено сравнение вторичных структур ITS2, на основе чего сделан вывод о конспецифичности четырех штаммов Coleochlamys apoda (CAUP H 7402-CRYO, SAG 28.85, CCALA 228 и CCALA 900) и о существенном их отличии от штамма Coleochlamys oleifera (SAG 6.90).
Таким образом, и анализ спейсера ITS2, и анализ гена rbcL способны разрешить филогенетические отношения внутри рода Coleochlamys. К схожему выводу пришел Reder (2019), применив различные комбинации молекулярных маркеров для определения границ видов в пределах сестринского рода Microthamnion. Деревья, учитывающие последовательности rbcL, имели лучшую топологию и уровни статистической поддержки, чем построенные на основе какого-либо одного маркера (гены 18S рРНК, 5.8S рРНК, 28S рРНК, спейсер ITS2). Таким образом, пластидный ген rbcL рекомендован в качестве молекулярного маркера для быстрого скрининга новых изолятов Microthamnion и для идентификации новых генетических разновидностей (Reder, 2019).
Итак, по данным анализа генов 18S рРНК и rbcL штамм ACSSI 377 является представителем рода Coleochlamys внутри порядка Microthamniales и относится к виду С. apoda. Кроме того, на дереве, построенном на основе анализа 18S рРНК, с высоким уровнем статистической поддержки обособлены 3 группы последовательностей некультивируемых эукариотических клонов из образцов минеральных отложений на поверхности ледника (Аляска, США), которые, судя по величинам генетических дистанций, соответствуют новым неописанным видам и (или) родам порядка Microthamniales.
Экология и распространение. Представители рода Coleochlamys населяют как пресноводные, так и наземные биотопы. Изученные молекулярно-филогенетическими методами штаммы Coleochlamys (Barcytė et al., 2021) были изолированы из холодных местообитаний Арктики (пресная вода, почва), Антарктики (пресная вода) и регионов с умеренным климатом (Словакия, снежный покров в горах). Коллекция культур водорослей Киевского национального университета имени Тараса Шевченко включает 4 штамма Coleochlamys cf. oleifera, выделенных из мохового покрова на о. Галиндез (Архипелаг Аргентинские о-ва, территория Украинской антарктической станции “Академик Вернадский”) (Костиков и соавт., 2009), однако их нуклеотидные последовательности отсутствуют в генетических базах данных. По результатам флористических исследований, проведенных на архипелаге Шпицберген, сообщается о находках Coleochlamys в криоконитовых норах, подледниковых и бесплодных почвах (Kaštovská et al., 2005; Stibal et al., 2006; Kim et al., 2011) и на субстратах антропогенного происхождения, таких как поверхность зданий (Raabová et al., 2016). Имеются сведения о флористических находках Coleochlamys в пещерах Ойцовского национального парка Польши (Czerwik-Marcinkowska et al., 2015) и в почве вершин Эцтальских Альп (Австрия) (Gärtner, 2013).
Приведенные данные свидетельствуют о том, что зеленые водоросли рода Coleochlamys являются психротолерантными микроорганизмами и, вероятно, предпочитают более низкие температуры. Однако в коллекции водорослей университета Коимбры в Португалии (Coimbra Collection of Algae, http://acoi.ci.uc.pt/) имеется 3 штамма Coleochlamys, два из которых выделены из пресной воды на территории страны. В этой же коллекции мы нашли сведения о штамме, отнесенном к роду Hydrianum (ACOI 2070, озеро в Португалии), морфология которого, судя по имеющимся на сайте коллекции фотографиям, очень схожа с морфотипом Coleochlamys. Это в очередной раз свидетельствует о сложности определения представителей рода и необходимости использования молекулярно-генетических методов идентификации. Кроме того, представители Coleochlamys приводятся в списках водорослей, найденных в тропических водоемах с бромелиями в Мексиканском штате Веракрус (Hernández-Rodríguez et al., 2014), а также в пресноводных местообитаниях и на скалах, омываемых водой, в бразильском штате Сан-Паулу (Fernandes, 2008).
Российскими почвенными альгологами ранее сообщалось о флористических находках представителей рода Coleochlamys в грунте (мелкозем и щебень) скальной полки в окрестностях российской антарктической станции Новолазаревская (Андреева, 2012), на каменистом субстрате горных тундр Полярного Урала (Андреева, 2004; Андреева, Чаплыгина, 2007) и в почве на территории Печорской низменности (Зимонина, 1998). Во всех случаях идентификацию производили в накопительных культурах, при этом подробное описание морфологических признаков приведено лишь в одном источнике (Андреева, 2012). Обнаруженная водоросль отнесена Андреевой к Coleochlamys oleifera, а в качестве отличий отмечалось меньшее разнообразие формы клеток и шаровидная форма спорангиев.
На территории Мурманской области находки Coleochlamys до недавнего времени не фиксировались. В 2020 г. в образцах почвы из гольцовых пустынь Хибин (гора Вудъяврчорр) нами была обнаружена водоросль с морфотипом, очень схожим со штаммом ACSSI 377 (данные не опубликованы); находка задокументирована с помощью микрофотографий. Представители сестринского рода Microthamnion, в частности, M. kuetzingianum, приводятся в списке водорослей, найденных в почве горно-тундрового пояса горы Вудъяврчорр (Штина, Ройзин, 1966). Этот вид был обнаружен нами в почве, загрязненной тяжелыми металлами, вблизи поселка Никель (данные не опубликованы), а также в дренажной воде месторождения Терраса близ г. Мончегорск (штамм поддерживается в рабочей коллекции). В целом, представители рода имеют очень широкое распространение по всему миру и обнаруживаются как в стоячей воде, так и в проточных водоемах, в почве, временных и экстремальных местообитаниях (Reder, 2019; Microthamnion …, 2021).
В результате проведенных исследований можно заключить, что морфология штамма ACSSI 377, выделенного в 2020 г. из образца биологической почвенной корочки с поверхности песчаного субстрата на Севере России (Мурманская область), соответствует описанию вида C. apoda, за исключением присутствия в культуре клеток S-образной формы, закругленных с обоих концов, что сближает наш штамм с другим видом – С. oleifera. На наш взгляд, наличие S-образной формы зрелых клеток не может служить диакритическим признаком, различающим виды Coleochlamys.
Анализ литературных данных и собственные наблюдения свидетельствуют о том, что водоросли рода Coleochlamys предпочитают холодные местообитания и не имеют широкого распространения, в отличие от сестринского рода Microthamnion, находки которого фиксируются по всему миру, в том числе, в экстремальных средах.
Проведенный филогенетический анализ подтвердил принадлежность штамма ACSSI 377 к виду Coleochlamys apoda. При этом кластеризация рода Coleochlamys на основе ядерного гена 18S pPHK была недостаточная, разрешить межвидовые филогенетические отношения позволил анализ более изменчивого пластидного гена rbcL. Несмотря на обнаруженные различия во вторичной структуре верхней части шпильки вариабельного региона V9 гена 18S рРНК между M. kuetzingianum и C. apoda, использовать его в качестве потенциального ДНК-баркода затруднительно, т.к. регион не секвенирован у большинства представителей группы. Внутривидовые генетические дистанции составили 0–0.1 и 0–0.3%, межвидовые – 0.8 и 2.9–3.2%, межродовые – 1.4–1.9 и 10.9–11.4% для ядерного гена 18S рРНК и пластидного гена rbcL соответственно. Таким образом, штамм ACSSI 377 представляет собой первую находку вида на территории России, подтвержденную молекулярно-генетическими методами. Кроме того, три независимые клады, состоящие из некультивируемых клонов и являющиеся новыми видами или родами, демонстрируют то, что порядок Micro-thamniales все еще слабо изучен, и многих его членов только предстоит обнаружить и описать.
Список литературы
Андреева В.М. Почвенные неподвижные зеленые водоросли (Chlorophyta) Воркутинской тундры (Республика Коми) // Новости систематики низших растений. 2004. Т. 37. С. 3–8.
Андреева В.М. Неподвижные зеленые микроводоросли (Chlorophyta) из грунтов оазиса Ширмахера (окрестности станции Новолазаревская, Земля Королевы Мод, Антарктида) // Новости систематики низших растений. 2012. Т. 46. С. 4–17.
Андреева В.М. Почвенные неподвижные зеленые микроводоросли (Chlorophyta) Европейского севера России // Новости систематики низших растений. 2007. Т. 41. С. 3–14.
Андреева В.М., Чаплыгина О.Я. Почвенные неподвижные зеленые микроводоросли (Chlorophyta) Полярного Урала // Новости систематики низших растений. 2007. Т. 41. С. 15–18.
Зимонина Н.М. Почвенные водоросли нефтезагрязненных земель. Киров, 1998. 171 с.
Костиков И.Ю., Демченко Э.Н., Березовская М.А. Коллекция культур водорослей Киевского национального университета имени Тараса Шевченко. Каталог штаммов (2008 г.) // Черноморск. бот. журн. 2009. Т. 5. № 1. С. 37–79.
Штина Э.А., Ройзин М.Б. Водоросли подзолистых почв Хибин // Бот. журнал. 1966. Т. 51. С. 509–519.
Bakker M.E. A deviating pattern of cell division in the green alga Microthamnion: ultrastructure of vegetative cell division and zoosporogenesis // Arch. Protistenkunde. 1995. V. 146. P. 117–136.
Barcytė D., Hodač L., Eliáš M. Settling the identity and phylogenetic position of the psychrotolerant green algal genus Coleochlamys (Trebouxiophyceae) // Phycologia. 2021. V. 60. P. 135–147.
Bray J.P. The ecology of algal assemblages across a gradient of acid mine drainage stress on the West Coast, South Island, New Zealand // A thesis of Master of Science in Biology, 06.2007. Christchurch: University of Canterbury, 2007. 106 p.
Czerwik-Marcinkowska J., Wojciechowska A., Massalski A. Biodiversity of limestone caves: aggregations of aerophytic algae and cyanobacteria in relation to site factors // Pol. J. Ecol. 2015. V. 63. P. 481–499.
Darienko T., Gustavs L., Eggert A., Wolf W., Pröschlod T. Evaluating the species boundaries of green microalgae (Coccomyxa, Trebouxiophyceae, Chlorophyta) using integrative taxonomy and DNA barcoding with further implications for the species identification in environmental samples // PLoS One. 2015. V. 10. e0127838.
Ettl H., Gärtner G. Syllabus der Boden-, Luft und Flechtenalgen/2, ergänzte Auflage. Berlin, Heidelberg: Springer Spektrum, 2014. 773 p. https://doi.org/10.1007/978-3-642-39462-1
Fernandes S. As famílias Chlorococcaceae e Coccomyxaceae no estado de São Paulo: levantamento florístico. Tese de Doutorado, 2008. São Paulo: Instituto de Botanica, 2008. 160 p.
Foster P.L. Species associations and metal contents of algae from rivers polluted by heavy metals // Freshwater Biol. 1982. V. 12. P. 17–39.
Gärtner G. Vorarbeiten zu einer Kryptogamenflora von Obergurgl (Ötztal, Tirol) // Ber. Nat.-Med. Verein Innsbruck. 2013. V. 98. P. 47–114.
Hernández-Rodríguez B., Estrada-Vargas L., Novelo E. Las microalgas de Tillandsia multicaulis Steud. (Bromeliaceae) de la Reserva Ecológica “La Martinica”, Veracruz // TIP Revista especializada en ciencias químico-biológicas. 2014. V. 17. P. 117–125.
John D.M., Johnson L.R. Observations on the developmental morphology, growth rate, and reproduction of Microthamnion kuetzingianum Naegeli (Pleurastraceae, Pleurastrales) in culture and a taxonomic assessment of the genus // Nova Hedwigia. 1987. V. 44. P. 25–53.
Kaštovská K., Elster J., Stibal M., Šantrůčková H. Microbial assemblages in soil microbial succession after glacial retreat in Svalbard (High Arctic) // Microb. Ecol. 2005. V. 50. P. 396–407.
Katana A., Kwiatowski J., Spalik K., Zakryś B., Szalacha E., Szymańska H. Phylogenetic position of Koliella (Chlorophyta) as inferred from nuclear and chloroplast small subunit rDNA // J. Phycol. 2001. V. 37. P. 443–451.
Kim G.H., Klochkova T.A., Han J.W., Kang S.H., Choi H.G., Chung K.W., Kim S.J. Freshwater and terrestrial algae from Ny-Ålesund and Blomstrandhalvøya island (Svalbard) // Arctic. 2011. V. 64. P. 25–31.
Korshikov A.A. Viznachnik prisnovodnihk vodorostey Ukrainsykoi RSR [Vyp] V. Pidklas Protokokovi (Protococcineae). Bakuol’ni (Vacuolales) ta Protokokovi (Protococcales) [The Freshwater Algae of the Ukrainian SSR. V. Sub-Class Protococcineae. Vacuolales and Protococcales]. AN. URSR, Kiev, 1953. 439 p.
Lampkin A.J., Sommerfeld M.R. Algal distribution in a small, intermittent stream receiving acid mine-drainage // J. Phycol. 1982. V. 18. P. 196–199.
Leya T. The CCCryo Culture Collection of Cryophilic Algae as a valuable bioresource for algal biodiversity and for novel, industrially marketable metabolites // Appl. Phycol. 2020. P. 1–22. https://doi.org/10.1080/26388081.2020.1753572
McManus H.A., Lewis L.A. Molecular phylogenetic relationships in the freshwater family Hydrodictyaceae (Sphaeropleales, Chlorophyceae), with an emphasis on Pediastrum duplex // J. Phycol. 2011. V. 47. P. 152–163.
Microthamnion Nägeli, 1849 in GBIF Secretariat (2021). GBIF Backbone Taxonomy. Checklist dataset accessed via GBIF.org on 2021-09-02.https://doi.org/10.15468/39omei
Mudimu O., Rybalka N., Bauersachs T., Born J., Friedl T., Schulz R. Biotechnological screening of microalgal and cyanobacterial strains for biogas production and antibacterial and antifungal effects // Metabolites. 2014. V. 4. P. 373–393.
Płachno B.J., Wołowski K., Augustynowicz J., Łukaszek M. Diversity of algae in a thallium and other heavy metals-polluted environment // Ann. Limnol. – Int. J. Lim. 2015. V. 51. P. 139–146.
Printz H. Die Chaetophoralen der Binnengewässer // Hydrobiologia. 1964. V. 24. P. 1–376.
Pröschold T., Darienko T. The green puzzle Stichococcus (Trebouxiophyceae, Chlorophyta): New generic and species concept among this widely distributed genus // Phytotaxa. 2020. V. 441. P. 113–142.
Pröschold T., Darienko T. Choricystis and Lewiniosphaera gen. nov. (Trebouxiophyceae Chlorophyta), two different green algal endosymbionts in freshwater sponges // Symbiosis. 2020 V. 82. P. 175–188. https://doi.org/10.1007/s13199-020-00711-x
Raabová L., Elster J., Kováčik Ľ. Phototrophic microflora colonizing substrates of man-made origin in Billefjorden Region, Central Svalbard // Czech. Polar Rep. 2016. V. 6. P. 21–30.
Reder T. A case study of species delimitation with molecular methods: the algal genus Microthamnion (Microthamniales, Trebouxiophyceae). Dissertation des Doktorgrades, 30.10.2019. Köln: Universität zu Köln, 2019. 123 p.
Schmidt S.K., Darcy J.L. Phylogeny of ulotrichalean algae from extreme high-altitude and high-latitude ecosystems // Polar Biol. 2015. V. 38. P. 689–697.
Stibal M., Šabacká M., Kaštovská K. Microbial communities on glacier surfaces in Svalbard: impact of physical and chemical properties on abundance and structure of cyanobacteria and algae // Microb. Ecol. 2006. V. 52. P. 644–654.
Vara Prasad M.N., de Oliveira Freitas H.M. Metal hyperaccumulation in plants: biodiversity prospecting for phytoremediation technology // Electron. J. Biotechnol. 2003. V. 6. P. 285–321. https://doi.org/10.4067/S0717-34582003000300012
Varshney P., Mikulic P., Vonshak A., Beardall J., Wangikar P.P. Extremophilic micro-algae and their potential contribution in biotechnology // Bioresour. Technol. 2015. V. 184. P. 363–372.
Watson M.W. Flagellar apparatus, eyespot and behaviour of Microthamnion kuetzingianum (Chlorophyceae) zoospores // J. Phycol. 1975. V. 11. P. 439–448.
Watson M.W., Arnott H.J. Ultrastructural morphology of Microthamnion zoospores // J. Phycol. 1973. V. 9. P. 15–29.
Van de Peer Y., Jansen J., De Rijk P., De Wachter R. Database on the structure of small ribosomal subunit RNA // Nucleic Acids Res. 1997. V. 25. P. 111–116. https://doi.org/10.1093/nar/25.1.111
Дополнительные материалы
- скачать ESM.docx
- Таблица S1. Список штаммов и некультивируемых клонов, использованных в филогенетическом анализе.
Таблица S2. Генетические дистанции, рассчитанные на основе последовательностей гена 18S рРНК у штаммов внутри порядка Microthamniales.


