Микробиология, 2022, T. 91, № 2, стр. 243-253
Продигиозин штамма Serratia marcescens D1, выделенного из грибов, ингибирует образование биопленок грамположительными бактериями
Д. Дж. Хазарика a, b, М. Какоти a, Р. Калита a, Т. Гаутом a, Г. Госвами b, М. Баруах a, Р. С. Боро a, *
a Факультет сельскохозяйственной биотехнологии,
Сельскохозяйственный университет Ассама
785013 Ассам, Джорхат, Индия
b DBT-Северо-Восточный центр сельскохозяйственной биотехнологии,
Сельскохозяйственный университет Ассама
785013 Ассам, Джорхат, Индия
* E-mail: robin.boro@aau.ac.in
Поступила в редакцию 19.01.2021
После доработки 06.09.2021
Принята к публикации 07.09.2021
- EDN: WNUOJQ
- DOI: 10.31857/S0026365622010050
Аннотация
Известно, что продигиозин, красно-розовый пигмент, синтезируемый почвенными штаммами Serratia marcescens и рядом морских изолятов, обладает биологической активностью. В настоящей работе описан биосинтез продигиозина штаммом Serratia marcescens D1, изолированным из грибов. Были подобраны оптимальные условия для роста и продукции продигиозина в жидкой культуре. Изолят хорошо рос при температурах до 35°C, с пиком образования пигмента при 25–30°C и pH 5. Пигмент был выделен из культуры, очищен при помощи тонкослойной хроматографии и идентифицирован с помощью комбинации жидкостной хроматографии, ионизации электрораспылением и масс-спектрометрии (LC-ESI-MS). Была изучена активность продигиозина в отношении грамположительных и грамотрицательных бактерий. Наблюдали выраженную антибактериальную активность в отношении грамположительных бактерий и слабую активность против изученных штаммов грамотрицательных бактерий. Минимальные ингибирующие концентрации (МИК) продигиозина для Staphylococcus aureus, Bacillus subtilis и B. cereus составляли 3, 5 и 4 мкг/мл. Пигмент повреждал клеточную мембрану Bacillus subtilis и препятствовал образованию биопленок B. subtilis и B. cereus, что может свидетельствовать о его применимости для борьбы с резистентными биопленочными формами микроорганизмов.
Вторичные метаболиты микроорганизмов, обладающие антибактериальной и цитотоксической активностью, крайне важны для фармацевтической промышленности. Начиная с открытия пенициллина, ряд антибиотиков революционизировал клиническую биологию. Продуцентами большей части природных антибиотиков являются грибы и актинобактерии (Grasso et al., 2016). Так, представители рода Streptomyces производят такие широко известные антибиотики, как стрептомицин (S. griseus), неомицин (S. fradiae), линкомицин(S. lincolnensis), хлорамфеникол (S. venezuelae) и т.д. (Ahmed, Vining, 1983; Pissowotzki et al., 1991; Peschke et al., 1995; de Lima Procópio et al., 2012; Meng et al., 2017). Тем не менее, представители таких родов эубактерий, как Bacillus, Lactobacillus и Pseudomonas, тоже синтезируют антибиотики.
Serratia marcescens, грамотрицательная бактерия из семейства Enterobacteriaceae, известна как продуцент ряда ферментов: ДНКазы, липазы, желатиназы, хитиназы, протеазы и т.д. (Hejazi, Falkiner, 1997; Giri et al., 2004). Ряд штаммов Serratia marcescens производят красный пигмент продигиозин, алкалоид, молекула которого содержит три пиррольных кольца (Giri et al., 2004). К синтезу продигиозина и продигиозин-подобных пигментов способны и некоторые другие виды рода Serratia, так же как морские и почвенные штаммы Pseudoalteromonas sp., Pseudomonas sp., Vibrio sp. и Streptomyces coelicor (Blake et al., 1990). У Serratia marcescens продукция продигиозина варьирует от штамма к штамму и зависит от ряда факторов, включая температуру и время инкубации. Клинические изоляты обычно не синтезируют продигиозин (Gargallo-Viola, 1989). Пигментация в аэробных условиях отмечалась лишь для малой части культур (Khanafari et al., 2006). Большая часть продигиозин-образующих штаммов была изолирована из почвы (Cang et al., 2000; Giri et al., 2004). Эндофитный штамм S. marcescens, выделенный из Beta vulgaris L., также известен как продуцент красного пигмента продигиозина (Khanam, Chandra, 2018).
Исследователи продигиозина описали его активность против микроорганизмов (Lapenda et al., 2015), насекомых (Wang et al., 2012) и их личинок (Patil et al., 2011), а также иммуносупрессорное (Han et al., 1998) и противораковое действие (Montaner et al., 2000). В нашей недавней работе был охарактеризован штамм S. marcescens, выделенный из гриба Mucor irregularis и продуцирующий красный пигмент на среде с пептоном. Пигмент, возможно, был также способен образовывать поры в клеточной мембране грибов (Hazarika et al., 2020).
Целью данной работы была очистка и характеристика красного пигмента, образуемого выделенным из грибов штаммом S. marcescens D1, а также изучение антимикробной активности этого пигмента в отношении ряда грамположительных и грамотрицательных бактерий.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Микроорганизмы и условия культивирования. Бактериальный штамм Serratia marcescens D1 (номер доступа в GenBank MF893336.1) был первоначально выделен из культуры зигомицетового гриба Mucor irregularis SS7 (Hazarika et al., 2020). Использованные в работе тест-организмы, Bacillus subtilis SCB-1 (номер доступа в GenBank MF893336.1), Bacillus cereus S6 (номер доступа в GenBank MF187565.1), Staphylococcus aureus ATCC 12600, Escherichia coli K-12 и Xanthomonas oryzae ISX11 (номер доступа в GenBank MG757618.1), были получены из коллекции факультета сельскохозяйственной биотехнологии Сельскохозяйственного университета, Ассам, Индия. Все культуры поддерживали на питательном агаре (NA, “Himedia”, Индия).
Оптимизация условий культивирования штамма S. marcescens D1. Оптимальные значения температуры и pH для культивирования определяли на питательном бульоне (NB). Serratia marcescens выращивали до OD600, равной 1.0, и полученную культуру (100 мкл) использовали для инокуляции среды NB, разлитой в конические колбы. Колбы инкубировали при температурах 20, 25, 30, 35, 40 и 45°C с перемешиванием (180 об./мин). Для определения оптимального pH колбы со средой NB (100 мл) и различными значениями pH (3.5, 4.0, 4.5, 5.0, 6.0, 7.0, 8.0 и 9.0) инокулировали 100 мкл культуры с OD600 = 1.0. Среды приготовляли с использованием трех буферных систем: 0.1 M цитратный буфер (для pH 3.5–5.0), 0.1 M фосфатный буфер (для pH 6.0 и 7.0) и 0.1 M Tris-HCl буфер (для pH 8.0 и 9.0). Колбы инкубировали при 30°C с перемешиванием (180 об./мин). Оптическую плотность культур измеряли в течение 120 ч с 24-ч интервалами, используя UV-Visible spectrophotometer (“Thermo Scientific”, США). Для этой цели отбирали 1 мл культуры и измеряли OD600 против стерильного бульона. Использовали разность между результатами за данный временной интервал и начальной величиной (OD600 непосредственно после инокуляции).
Оптимизация условий для синтеза пигмента. Спустя 48 ч после посева на твердую среду бактерии накапливали красный пигмент. Оптимальные значения pH и температуры для синтеза пигмента определяли, как описано выше. После 48 ч инкубации пигменты экстрагировали из аликвоты жидкой культуры (5 мл), как описано ниже. Экстракт высушивали и растворяли в 1 мл метанола. Оптическую плотность измеряли при 535 нм против метанола. Концентрацию пигмента определяли с помощью калибровочной кривой, построенной для известных концентраций продигиозина.
Экстракция пигментов. Штамм Serratia marcescens D1 высевали штрихом на твердую среду и инкубировали 48 ч при 25°C. Клетки смывали с агара при помощи стерильного шпателя и переносили в 50-мл пробирку. Экстракцию осуществляли смесью 1 мМ HCl–ацетон–этилацетат (1 : 2 : 3) в течение 4 ч, после чего отбирали верхнюю (органическую) фракцию. Клетки, выращенные в жидкой культуре, собирали центрифугированием (10 мин при 3380 g), после чего пигменты экстрагировали, как описано выше. Органические фракции для каждого из экспериментальных вариантов концентрировали под вакуумом, а затем, в зависимости от задач последующего эксперимента, растворяли в хлороформе, метаноле или диметилсульфоксиде (ДМСО) и хранили до использования при 4°C.
Очистка и характеризация пигмента. Сырой экстракт очищали тонкослойной хроматографией (ТСХ) на силикагелевых пластинах, со смесью хлороформа и метанола (9 : 1) в качестве подвижной фазы. После сепарации красную фракцию растворяли в хлороформе или метаноле и использовали для дальнейших анализов. Спектр поглощения очищенной фракции получили с использованием спектрофотометра Evolution 202 UV-Vis (“Thermo Scientific”, США).
Идентификация пигмента. Сырой экстракт из бактерий и очищенные фракции идентифицировали с помощью LC-ESI-MS. Экстракты растворяли в метаноле и фильтровали (0.45 мкм). Компоненты экстракта разделяли на колонке ZORBAX C18 с использованием системы Agilent 1260 Infinity для высокоэффективной жидкостной хроматографии (ВЭЖХ) (“Agilent Technologies”, США) со смесью метанола и воды (9 : 1) в качестве подвижной фазы и скорости протока 0.1 мл/мин. Фракции ионизировали и детектировали с использованием системы Agilent 6410 Triple Quad MS/MS (“Agilent Technologies”, США), сопряженной с установкой для ВЭЖХ.
Антибактериальная активность пигмента. Была изучена антибактериальная активность сырого пигмента против пяти бактериальных штаммов: Bacillus subtilis SCB-1, Bacillus cereus S6, Staphylococcus aureus, Escherichia coli K-12 и Xanthomonas oryzae ISX11. Использовали метод диффузии в агаре. Жидкие культуры выращивали до OD600 = 1.0 и использовали для посева газоном на агар Мюллера–Хинтона. В агаре высверливали колодцы диаметром 6 мм. Сухой экстракт растворяли в ДМСО до концентрации 25 или 50 мкг/мл и вносили в колодцы (100 мкл). Такой же объем ДМСО использовали в качестве отрицательного контроля. Диаметр зоны подавления роста определяли после 16 ч инкубации при 30°C.
Определение минимальной ингибирующей концентрации (МИК) и минимальной бактерицидной концентрации (МБК). Минимальную ингибирующую концентрацию продигиозина определяли в жидкой среде Луриа–Бертани (LB). Суточную культуру в среде LB использовали для получения инокулята концентрацией 0.5 по шкале Мак-Фарланда. В среды, инокулированные Staphylococcus a-ureus, Bacillus subtilis и B. cereus, вносили различные концентрации продигиозина. Жидкая среда (5 мл) содержала 4 мл LB, 0.5 мл стандартизованной бактериальной суспензии и 0.5 мл продигиозина (финальные концентрации 0.5–1000 мкг/мл). В начале эксперимента и спустя 18 ч инкубации при 37°C и перемешивании (180 об./мин) измеряли OD600. МИК определяли как наивысшее разведение продигиозина, при котором не наблюдалось роста тест-организмов. Для определения МБК материал из разведений рассевали штрихом на агаризованную среду и инкубировали 16 ч при 30°C. Наивысшее разведение, при котором не наблюдалось образование колоний, принимали за МБК.
Повреждение клеточных мембран. Очищенный препарат продигиозина растворяли в ДМСО. К культуре Bacillus subtilis (4.9 мл), выращенной в среде NB до OD600 = 0.6, добавляли 100 мкл раствора продигиозина (до конечной концентрации 50 мкг/мл). В качестве контроля использовали бактериальную культуру с добавлением 100 мкл ДМСО. Культуры инкубировали 60 мин при 30°C со встряхиванием. По окончании инкубации отбирали аликвоту (100 мкл) и проводили окрашивание с помощью LIVE/DEAD® BacLightTM Bacterial Viability Kit (“Life Technologies”, США). Препарат содержит два флуорохрома: SYTO9 и йодистый пропидий. После добавления краски материал инкубировали 10 мин в темноте, а затем исследовали под микроскопом Olympus BX51 (“Olympus Corporation”, Япония) с масляно-иммерсионным объективом 100× при возбуждении синим светом и зеленом запирающем фильтре.
Ингибирование образования биопленок. Эффект продигиозина на образование биопленок изучали с использованием культур Bacillus subtilis и B. cereus. В ячейки планшета вносили 40 мкл суточной бактериальной культуры (дорощенной до ~1.0 OD600 при встряхивании), 100 мкл свежей среды и 10 мкл раствора продигиозина в ДМСО с финальными концентрациями 0, 1, 5, 10, 50 и 100 мкг/мл. Планшет инкубировали 48 ч при 37°C со встряхиванием (150 об./мин). После инкубации культуры сливали, а ячейки планшетов дважды промывали натрий-фосфатным буфером для удаления планктонных клеток. Образование биопленок измеряли, окрашивая их кристаллическим фиолетовым (O’Toole, 2011). Поглощение при 595 нм измеряли на считывающем устройстве (“Thermo Scientific”, США).
Эффект продигиозина на сформированные биопленки Bacillus subtilis и B. cereus изучали аналогичным образом. В ячейки планшета вносили 40 мкл суточной бактериальной культуры (дорощенной до ~1.0 OD600 при встряхивании) и 100 мкл свежей среды. После инкубации в течение 24 ч, удаляли планктонные клетки и дважды промывали ячейки планшета натрий-фосфатным буфером. Затем в ячейки вносили по 190 мкл свежей среды LB и 10 мкл раствора продигиозина в ДМСО до конечной концентрации 50 мкг/мл. В контрольных ячейках к среде добавляли 10 мкл ДМСО. После 24-ч инкубации биопленочный рост оценивали с помощью окрашивания кристаллическим фиолетовым (O’Toole, 2011).
Статистическая обработка данных. Если не указано иначе, все эксперименты проводили в трех повторностях. Значимость результатов вычисляли с помощью однофакторного дисперсионного анализа и теста Дункана. Для попарного сравнения использовали критерий Стьюдента. Анализ проводили с использованием IBM SPSS v25. Результаты считали значимыми при p ≤ 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Регуляция роста и синтеза пигмента у штамма Serratia marcescens D1. Оптимальные значения pH и температуры для роста изолята определяли в жидкой среде. В исследованном диапазоне температур наивысшая концентрация клеток была отмечена при 30°C (рис. 1а). При температурах ниже 25 и выше 35°C скорость роста резко понижалась. Наилучший рост был отмечен при pH 5.0, хотя изолят был способен к росту и при pH 4.5 (рис. 1б). При pH выше 9 роста не происходило.
Рис. 1.
Эффект pH и температуры на плотность бактериальных клеток и образование продигиозина: влияние температуры на рост S. marcescens D1 (а); влияние pH на рост S. marcescens D1 (б); влияние температуры на продукцию розово-красного пигмента S. marcescens D1 (в); и влияние pH на продукцию розово-красного пигмента S. marcescens D1 (г).
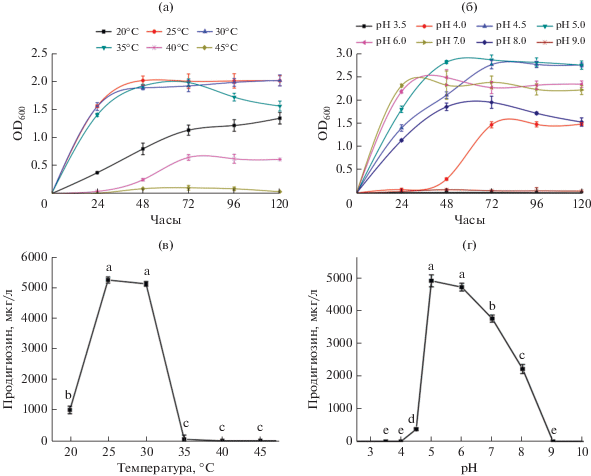
Рост Serratia marcescens и биосинтез пигмента зависят от ряда факторов. Экспрессия генов, участвующих в биосинтезе продигиозина, зависит, в частности, от состава среды культивирования, температуры и pH (Slater et al., 2003; Romanowski et al., 2019). Питательный агар/бульон широко используется для получения больших количеств биомассы, поскольку он содержит питательные вещества, необходимые для роста многих (не всех) бактерий. Пептон животного происхождения содержит почти все аминокислоты, необходимые для биосинтеза продигиозина (Kurbanoglu et al., 2015). Хлористый натрий, также входящий в состав этой среды, тоже играет важную роль в биосинтезе продигиозина (Hejazi, Falkiner, 1997). Критический анализ влияния состава среды и прочих факторов на биосинтез продигиозина был проведен Han et al. (2021). В данной работе была изучена продукция пигмента при различных значениях температуры и pH. Образование пигмента отслеживали по изменению цвета культуры. Более высокие уровни пигмента приводили к темно-красной окраске жидкой культуры, что было заметно при визуальном исследовании. Кроме того, пигмент экстрагировали из культур и регистрировали его поглощение при 535 нм. Продукция пигмента при 20°C была невысока, а самая высокая продукция (от 243.4 ± 99.8 до 5119.4 ± 77.2 мг/л) наблюдалась при 25–30°C (рис. 1в). Ранее также сообщалось о высокой продукции продигиозина клетками S. marcescens при аналогичных условиях культивирования (Naik et al., 2012; Lin et al., 2019). Недавно было показано, что продукция продигиозина в культурах S. marcescens прямо пропорциональна бактериальной биомассе (Haddix, Shanks, 2018). Мы показали, однако, критическую роль температуры в этом процессе даже при сходных концентрациях клеток. Так, несмотря на то, что после 48 ч инкубации при 30 и 35°C различия в концентрации клеток были незначительны, накопления продигиозина при более высокой температуре не происходило. Эти результаты свидетельствуют об ингибирующем эффекте высокой температуры на синтез пигмента, о котором сообщалось ранее (Pryce, Terry, 2000; Giri et al., 2004). Максимальную продукцию пигмента отмечали при pH 5.0 и 30°C (рис. 1г). Ранее сообщалось о благоприятном эффекте слабокислых условий на рост клеток и образование пигмента (Giri et al., 2004). Поскольку при pH ниже 4.5 роста не наблюдалось, продукция пигмента при этих условиях также резко снижалась. Лишь минимальный рост наблюдался при pH выше 8.0; продукция пигмента при этих условиях также была низкой.
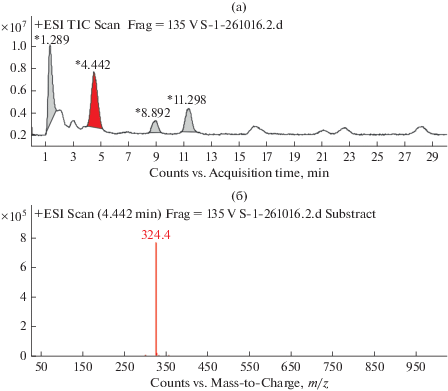
Выделение и характеристика красного пигмента, образуемого штаммом Serratia marcescens D1. Розово-красный пигмент был экстрагирован из клеток штамма Serratia marcescens D1 и идентифицирован с использованием различных аналитических методов. С помощью тонкослойной хроматографии была выделена красно-розовая фракция с Rf = 0.89 (рис. 2а). Поскольку пигмент был гидрофобным, он перемещался по пластине с неполярной подвижной фазой. Эту фракцию затем элюировали с пластин для ТСХ для последующего спектрофотометрического анализа. Спектры поглощения сырого экстракта и очищенной фракции показаны на рис. 2б. Как максимумы поглощения, так и значения Rf свидетельствовали о присутствии продигиозина в сыром экстракте и в очищенной фракции (Song et al., 2006; Lapenda et al., 2015). Сырой экстракт и очищенные фракции исследовали также с помощью LC-ESI-MS. Розово-красную фракцию элюировали со временем удержания 4.4–4.6 мин. Масс-спектры соответствующей фракции имели значение m/z 324.4 [(M + H)+], что свидетельствовало о молекулярной массе 323.4 Да (рис. 3), что соответствует значению для продигиозина (молекулярная формула C20H25N3O) (Montaner, Pérez-Tomás, 2001; Song et al., 2006). Этот результат соответствовал данным для стандартного продигиозина (дополнительные материалы, рис. S1 и S2 ).
Рис. 2.
Характеризация выделенных пигментов при помощи тонкослойной хроматографии и UV-Visible спектроскопии: ТСХ разделение сырой и очищенной фракций красно-розового пигмента (а) и спектры поглощения сырого и очищенного экстрактов (б).

Рис. 3.
Идентификация сырого и очищенного экстрактов с помощью LC-ESI-MS: Total Ion Chromatogram (TIC) сырого экстракта (а) и масс-спектр продигиозина со значением m/z = 324.4 [(M + H)+] (б).
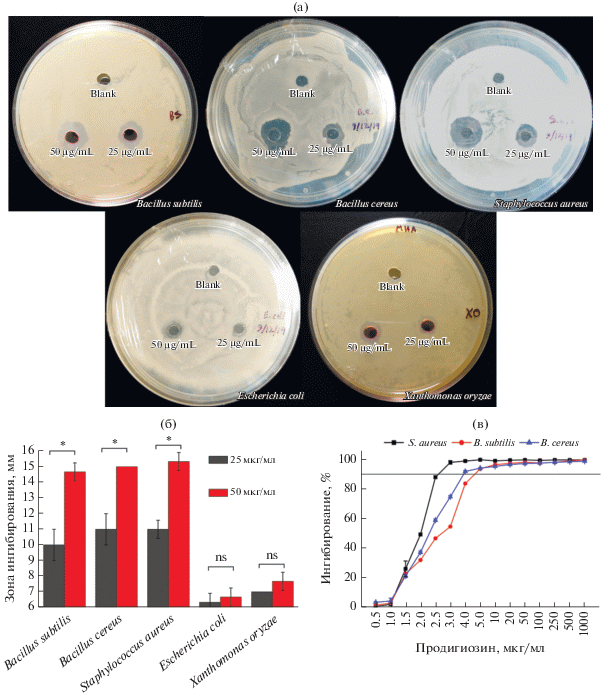
Антибактериальная активность. Антимикробную активность продигиозина против пяти тест-организмов определяли методом диффузии в агаре. Продигиозин обнаружил высокую активность против грамположительных бактерий и слабую активность против грамотрицательных. Зоны подавления роста пяти изученных штаммов при двух использованных концентрациях продигиозина показаны на рис. 4а. Самой высокой была активность против Staphylococcus aureus, а самой низкой – против Escherichia coli (рис. 4б). МИК по отношению к Staphylococcus aureus, Bacillus subtilis и B. cereus составляли 3.0, 5 и 4 мкг/мл соответственно (рис. 4в). МБК для S. aureus и B. cereus составляла 20 мкг/мл, а для B. subtilis – 50 мкг/мл (дополнительные материалы, рис. S3 ). Ранее сообщалось об антибактериальной активности продигиозина, образуемого различными видами Serratia (Lapenda et al., 2015; Gondil et al., 2017; Ji, Kim, 2019; Clements et al., 2021), а также о более высокой активности продигиозина против грамположительных бактерий, включая клинические изоляты Staphylococcus aureus (Lapenda et al., 2015). Кроме продигиозина, Serratia marcescens производит другие метаболиты с антибактериальной активностью, включая серратамолид A-C и производное глюкозамина А. Ингибирующий потенциал этих соединений ниже, чем у продигиозина (Clements et al., 2021). Большинство грамотрицательных бактерий устойчивы к распространенным антибиотикам, поскольку их внешняя мембрана непроницаема для гидрофильных антибиотиков (Delcour, 2009). Несмотря на гидрофобность продигиозина, его эффект на рост Escherichia coli был невысок, поскольку липополисахаридный слой препятствует проникновению продигиозина и иных ингибиторов внутрь клетки (Suryawanshi et al., 2017).
Рис. 4.
Антибактериальная активность продигиозина против изученных тест-организмов. Антибактериальная активность двух концентраций продигиозина (25 и 50 мкг/мл) (а); диаметр зон подавления роста тест-организмов, мм (б); минимальные ингибирующие концентрации, выраженные в процентах ингибирования роста в жидких культурах Staphylococcus aureus, Bacillus subtilis и B. cereus, при возрастающих концентрациях продигиозина (в). Указаны среднеквадратичные отклонения для трех независимых повторностей. Звездочки (*) означают значимые различия между результатами (p < 0.05); не значимые различия обозначаются (ns).
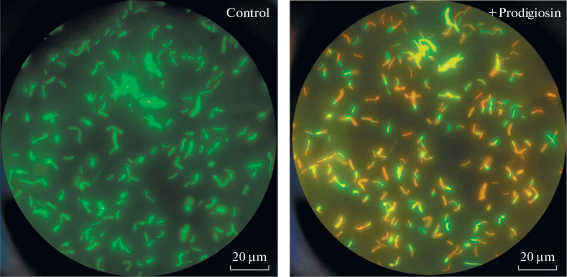
Продигиозин повреждает клеточную мембрану грамположительных бактерий, в результате чего из клетки выходят ионы калия (K+), а также сахара, белки и аминокислоты (Suryawanshi et al., 2017). В данной работе для изучения проникновения йодистого пропидия в контрольные и обработанные продигиозином клетки Bacillus subtilis использовали окрашивание с помощью LIVE/DEAD® BacLightTM Bacterial viability Kit. Йодистый пропидий не проникает через мембраны и может попасть внутрь клеток с поврежденной или дефектной мембраной; там он связывается с ДНК и испускает красную флуоресценцию при возбуждении синим или зеленым светом. Второй компонент, SYTO9, способен проникать через мембраны и флуоресцирует зеленым при возбуждении синим светом (Stocks, 2004). При окраске обработанных продигиозином клеток, как SYTO9, так и йодистый пропидий проникали внутрь, и большая часть клеток светилась оранжевым (рис. 5). В контрольных образцах клетки флуоресцировали зеленым, поскольку йодистый пропидий не мог проникнуть внутрь. Эти наблюдения указывали на то, что клеточная мембрана является мишенью повреждающего действия продигиозина. Благодаря амфифильной природе продигиозина, он может встраиваться в мембрану (Díaz et al., 2007); целостность мембран, включающих продигиозин, возможно, нарушается, что приводит к утечке клеточных компонентов, а также к проникновению в клетку внеклеточных молекул. Ранее сообщалось, что применение теста на цитоплазматическую β-галактозидазу с использованием ОНПГ (o-нитрофенил-β-галактозида) к микроорганизмам, обработанным продигиозином в низкой концентрации, показало повышенную проницаемость мембран, что было видно по повышенному поглощению ОНПГ клетками, обработанными продигиозином (Danevčič et al., 2016).
Рис. 5.
Повреждение мембран в культуре Bacillus subtilis. Клетки с зеленой флуоресценцией здоровы, а мембраны клеток с оранжевой флуоресценцией из обработанной продигиозином культуры повреждены.
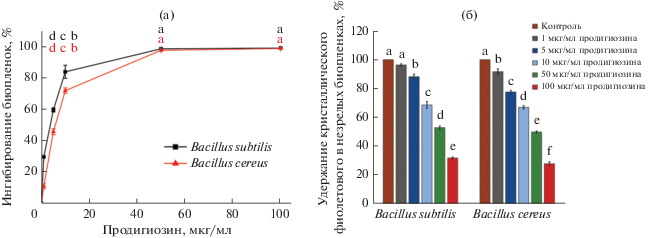
Ингибирование образования биопленок бациллами. Многие виды бактерий формируют биопленки в качестве механизма защиты от антибиотиков, и бактерии в биопленках оказываются более устойчивыми, чем свободноживущие клетки. Образование биопленок включает пять этапов: первоначальная адсорбция клеток на границе раздела фаз; обратимая адгезия клеток к поверхности; необратимая адгезия клеток к поверхности и между клетками; созревание биопленки; дисперсия с высвобождением клеток в среду (Plakunov et al., 2017; Lianou et al., 2020). При ингибировании одной из этих стадий клетки оказываются восприимчивы к воздействию классических антибиотиков (Somma, 2020). В данной работе способность продигиозина препятствовать образованию биопленок проверяли с использованием культур Bacillus subilis и B. cereus. На первоначальной стадии продигиозин (50 мкг/мл) ингибировал образование биопленок обоими видами более чем на 90% (рис. 6а). Кроме того, продигиозин также воздействовал на незрелые биопленки, приводя к снижению способности биопленок удерживать кристаллический фиолетовый на 45–50 и 68–74% в присутствии 50 и 100 мкг/мл продигиозина соответственно (рис. 6б). В ранней работе была описана активность продигиозина в ингибировании биопленкообразования у Pseudomonas aeroginosa благодаря окислительному повреждению нуклеиновых кислот (Kimyon et al., 2016). Ингибирование образования биопленок можно трактовать как эффект активных форм кислорода в комбинации с воздействием продигиозина на ДНК, РНК и мембраны (Díaz et al., 2007; Danevčič et al., 2016; Kimyon et al., 2016; Suryawanshi et al., 2017).
Рис. 6.
Ингибирование биопленочного роста Bacillus subtilis и B. cereus продигиозином. Ингибирование образования биопленок на стадии прикрепления к поверхности. Результаты выражены как процент ингибирования биопленкообразования в ячейках, содержащих возрастающие концентрации продигиозина, относительно необработанных ячеек (контроль) (а) и оценка антибиопленочной активности продигиозина на стадии незрелой биопленки (б). Результаты выражены в процентах удержания кристаллического фиолетового в присутствии продигиозина по сравнению с необработанным контролем. Указаны среднеквадратичные отклонения для трех независимых повторностей. Буквенные обозначения (a–f) указывают уровень значимости в нисходящем порядке на основании значений p (p < 0.05).
Итак, была охарактеризована способность нового изолята Serratia marcescens D1 синтезировать продигиозин. Было показано, что синтез продигиозина зависел от температуры и pH. Препарат проявлял выраженную активность в отношении ряда грамположительных бактерий. Он повреждал клеточную мембрану грамположительных бактерий и ингибировал образование биопленок. Активность этого пигмента может быть полезной для преодоления устойчивости к антибиотикам, связанной с образованием биопленок. Для лечения бактериальных инфекций потребуются эффективные комбинации с целью повышения активности и стабильности препарата.
Список литературы
Ahmed Z.U., Vining L.C. Evidence for a chromosomal location of the genes coding for chloramphenicol production in Streptomyces venezuelae // J. Bacteriol. 1983. V. 154. P. 239–244.
Blake A.J., Hunter G.A., McNab H. A short synthesis of prodigiosin analogues // J. Chem. Soc. Chem. Commun. 1990. V. 10. P. 734–736.
Cang S., Sanada M., Johdo O., Ohta S., Nagamatsu Y., Yoshimoto A. High production of prodigiosin by Serratia marcescens grown on ethanol // Biotechnol. Lett. 2000. V. 22. P. 1761–1765.
Clements T., Rautenbach M., Ndlovu T., Khan S., Khan W. A metabolomics and molecular networking approach to elucidate the structures of secondary metabolites produced by Serratia marcescens strains // Front. Chem. 2021. V. 9. Art. 633870. https://doi.org/10.3389/fchem.2021.633870
Danevčič T., Borić Vezjak M., Tabor M., Zorec M., Stopar D. Prodigiosin induces autolysins in actively grown Bacillus subtilis cells // Front. Microbiol. 2016. V. 7. Art. 27. https://doi.org/10.3389/fmicb.2016.00027
de Lima Procópio R.E., da Silva I.R., Martins M.K., de Azevedo J.L., de Araújo J.M. Antibiotics produced by Streptomyces // Brazilian J. Infect. Dis. 2012. V. 16. P. 466–471.
Delcour A.H. Outer membrane permeability and antibiotic resistance // Biochim. Biophys. Acta – Proteins Proteomics. 2009. V. 1794. P. 808–816.
Díaz R.I.S., Regourd J., Santacroce P.V., Davis J.T., Jakeman D.L., Thompson A. Chloride anion transport and copper-mediated DNA cleavage by C-ring functionalized prodigiosenes // Chem. Commun. 2007. V. 26. P. 2701–2703. https://doi.org/10.1039/b701919j
Gargallo-Viola D. Enzyme polymorphism, prodigiosin production, and plasmid fingerprints in clinical and naturally occurring isolates of Serratia marcescens // J. Clin. Microbiol. 1989. V. 27. P. 860–868.
Giri A., Anandkumar N., Muthukumaran G., Pennathur G. A novel medium for the enhanced cell growth and production of prodigiosin from Serratia marcescens isolated from soil // BMC Microbiol. 2004. V. 4. P. 11.
Gondil V.S., Asif M., Bhalla T.C. Optimization of physicochemical parameters influencing the production of prodigiosin from Serratia nematodiphila RL2 and exploring its antibacterial activity // 3 Biotech. 2017. V. 7. P. 338.
Grasso L.L., Martino D.C., Alduina R. Production of antibacterial compounds from Actinomycetes // Actinobacteria – Basics and Biotechnological Applications / Ed. Martino D.C. Rijeka: IntechOpen, 2016. P. 177–198.
Haddix P.L., Shanks R.M.Q. Prodigiosin pigment of Serratia marcescens is associated with increased biomass production // Arch. Microbiol. 2018. V. 200. P. 989–999. https://doi.org/10.1007/s00203-018-1508-0
Han R., Xiang R., Li J., Wang F., Wang C. High-level production of microbial prodigiosin: A review // J. Basic Microbiol. 2021. V. 61. P. 506–523. https://doi.org/10.1002/jobm.202100101
Han S.B., Kim H.M., Kim Y.H., Lee C.W., Jang E.-S., Son K.H., Kim S.U., Kim Y.K. T-cell specific immunosuppression by prodigiosin isolated from Serratia marcescens // Int. J. Immunopharmacol. 1998. V. 20. P. 1–13.
Hazarika D.J., Gautom T., Parveen A., Goswami G., Barooah M., Modi M.K., Boro R.C. Mechanism of interaction of an endofungal bacterium Serratia marcescens D1 with its host and non-host fungi // PLoS One. 2020. V. 15. P. 1–19. https://doi.org/10.1371/journal.pone.0224051
Hejazi A., Falkiner F.R. Serratia marcescens // J. Med. Microbiol. 1997. V. 46. P. 903–912.
Ji K., Kim Y.T. Antimicrobial activity of prodigiosin from Serratia sp. PDGS120915 against intestinal pathogenic bacteria // Microbiol. Biotechnol. Lett. 2019. V. 47. P. 459–464. https://doi.org/10.4014/mbl.1901.01006
Khanafari A., Assadi M.M., Fakhr F.A. Review of prodigiosin, pigmentation in Serratia marcescens // Online J. Biol. Sci. 2006. V. 6. P. 22700103.
Khanam B., Chandra R. Comparative analysis of prodigiosin isolated from endophyte Serratia marcescens // Lett. Appl. Microbiol. 2018. V. 66. P. 194–201.
Kimyon Ö., Das T., Ibugo A.I., Kutty S.K., Ho K.K., Tebben J., Kumar N., Manefield M. Serratia secondary metabolite prodigiosin inhibits Pseudomonas aeruginosa biofilm development by producing reactive oxygen species that damage biological molecules // Front. Microbiol. 2016. V. 7. Art. 972.
Kurbanoglu E.B., Ozdal M., Ozdal O.G., Algur O.F., Kurbanoglu E.B., Ozdal M., Ozdal O.G., Algur O.F. Enhanced production of prodigiosin by Serratia marcescens MO-1 using ram horn peptone // Brazilian J. Microbiol. 2015. V. 46. P. 631–637.
Lapenda J.C., Silva P.A., Vicalvi M.C., Sena K.X.F.R., Nascimento S.C. Antimicrobial activity of prodigiosin isolated from Serratia marcescens UFPEDA 398 // World J. Microbiol. Biotechnol. 2015. V. 31. P. 399–406.
Lianou A., Nychas G.-J.E., Koutsoumanis K.P. Strain variability in biofilm formation: a food safety and quality perspective // Food Res. Int. 2020. V. 137. Art. 109424. https://doi.org/10.1016/j.foodres.2020.109424
Lin C., Jia X., Fang Y., Chen L., Zhang H., Lin R., Chen J. Enhanced production of prodigiosin by Serratia marcescens FZSF02 in the form of pigment pellets // Electron. J. Biotechnol. 2019. V. 40. P. 58–64. https://doi.org/10.1016/j.ejbt.2019.04.007
Meng X., Wang W., Xie Z., Li P., Li Y., Guo Z., Lu Y., Yang J., Guan K., Lu Z., Tan H., Chen Y. Neomycin biosynthesis is regulated positively by AfsA-g and NeoR in Streptomyces fradiae CGMCC 4.7387 // Sci. China Life Sci. 2017. V. 60. P. 980–991.
Montaner B., Navarro S., Piqué M., Vilaseca M., Martinell M., Giralt E., Gil J., Pérez-Tomás R. Prodigiosin from the supernatant of Serratia marcescens induces apoptosis in haematopoietic cancer cell lines // Br. J. Pharmacol. 2000. V. 131. P. 585–593.
Montaner B., Pérez-Tomás R. Prodigiosin-induced apoptosis in human colon cancer cells // Life Sci. 2001. V. 68. P. 2025–2036.
Naik C., Srisevita J.M., Shushma K.N., Noorin F., Shilpa A.C., Muttanna C.D., Darshan N., Sannadurgappa D. Peanut oil cake: a novel substrate for enhanced cell growth and prodigiosin production from Serratia marcescens CF-53 // J. Res. Biol. 2012. V. 2. P. 549–557.
O’Toole G.A. Microtiter dish biofilm formation assay // J. Vis. Exp. 2011. V. 47. e2437.
Patil C.D., Patil S.V., Salunke B.K., Salunkhe R.B. Prodigiosin produced by Serratia marcescens NMCC46 as a mosquito larvicidal agent against Aedes aegypti and Anopheles stephensi // Parasitol. Res. 2011. V. 109. P. 1179–1187.
Peschke U., Schmidt H., Zhang H.-Z., Piepersberg W. Molecular characterization of the lincomycin-production gene cluster of Streptomyces lincolnensis 78-11 // Mol. Microbiol. 1995. V. 16. P. 1137–1156.
Pissowotzki K., Mansouri K., Piepersberg W. Genetics of streptomycin production in Streptomyces griseus: molecular structure and putative function of genes strELMB2N // Mol. Gen. Genet. 1991. V. 231. P. 113–123.
Plakunov V.K., Mart’yanov S.V., Teteneva N.A., Zhurina M.V. Controlling of microbial biofilms formation: anti- and probiofilm agents // Microbiol. 2017. V. 86. P. 423–438. https://doi.org/10.1134/S0026261717040129
Pryce L.H., Terry F.W. Spectrophotometric assay of gene expression: Serratia marcescens pigmentation // Bioscene. 2000. V. 26. P. 3–13.
Romanowski E.G., Lehner K.M., Martin N.C., Patel K.R., Callaghan J.D., Stella N.A., Shanks R.M. Thermoregulation of prodigiosin biosynthesis by Serratia marcescens is controlled at the transcriptional level and requires HexS // Polish J. Microbiol. 2019. V. 68. P. 43.
Slater H., Crow M., Everson L., Salmond G.P. Phosphate availability regulates biosynthesis of two antibiotics, prodigiosin and carbapenem, in Serratia via both quorum-sensing-dependent and-independent pathways // Mol. Microbiol. 2003. V. 47. P. 303–320.
Somma A.D., Moretta A., Canè C., Cirillo A., Duilio A. Inhibition of bacterial biofilm formation // Bact. Biofilms. 2020. https://doi.org/10.5772/intechopen.90614
Song M.-J., Bae J., Lee D.-S., Kim C.-H., Kim J.-S., Kim S.-W., Hong S.-I. Purification and characterization of prodigiosin produced by integrated bioreactor from Serratia sp. KH-95 // J. Biosci. Bioeng. 2006. V. 101. P. 157–161.
Stocks S.M. Mechanism and use of the commercially available viability stain, BacLight // Cytom. Part A. 2004. V. 61. P. 189–195.
Suryawanshi R.K., Patil C.D., Koli S.H., Hallsworth J.E., Patil S.V. Antimicrobial activity of prodigiosin is attributable to plasma-membrane damage // Nat. Prod. Res. 2017. V. 31. P. 572–577.
Wang S.-L., Wang C.-Y., Yen Y.-H., Liang T.-W., Chen S.-Y., Chen C.-H. Enhanced production of insecticidal prodigiosin from Serratia marcescens TKU011 in media containing squid pen // Process Biochem. 2012. V. 47. P. 1684–1690.
Дополнительные материалы
- скачать ESM.docx
- Fig. S1 - Fig. S3


