Микробиология, 2022, T. 91, № 2, стр. 234-242
Количественный анализ сериновых протеиназ Bacillus pumilus у рекомбинантных штаммов бацилл
А. О. Корягина a, *, Ф. Р. Османова a, А. А. Тойменцева a, А. В. Лайков a, М. Р. Шарипова a
a ФГАОУ ВПО “Казанский (Приволжский) федеральный университет”
420008 Казань, Республика Татарстан, Россия
* E-mail: tihonovaao93@gmail.com
Поступила в редакцию 06.10.2021
После доработки 26.10.2021
Принята к публикации 27.10.2021
- EDN: POUUCV
- DOI: 10.31857/S0026365622020082
Аннотация
Проведено сравнительное исследование экспрессии внеклеточных сериновых протеиназ Bacillus pumilus (субтилизиноподобной протеиназы и глутамилэндопептидазы) под контролем разных промоторов и сигнальных пептидов на основе LIKE-системы экспрессии у различных реципиентных штаммов Bacillus subtilis с помощью масс-спектрометрического анализа в режиме мониторинга множественных реакций (МРМ). Максимальная экспрессия субтилизиноподобной протеиназы установлена под контролем смоделированного сигнального пептида (SPAsp) и индуцибельного промотора PLiaI LIKE-системы экспрессии в протеазодефицитном штамме B. subtilis 20-36, количество секретируемого белка составило 1.6 мкг/мкл культуральной жидкости. Оптимальная экспрессия глутамилэндопептидазы установлена под контролем сигнального пептида гена гликозидгидролазы Bacillus megaterium (SPYngk) и индуцибельного промотора PLiaI в протеазодефицитном штамме B. subtilis 20-36, максимальное количество белка составило 0.06 мкг/мкл. Сделано заключение о значимости подбора всех компонентов системы экспрессии для индивидуальных секретируемых белков, включая подбор оптимального сигнального пептида.
Бактерии рода Bacillus широко известны как продуценты промышленно-ценных ферментов и функциональных белков. Для получения гетерологичных полипептидов проводят конструирование и оптимизацию экспрессионных систем Bacillus subtilis, содержащих контролируемые и высокоактивные промоторы (Cai et al., 2019). С другой стороны, необходимым элементом секреторной системы B. subtilis является сигнальный пептид (Cui et al., 2018). Во многих случаях промышленные белки успешно секретируются под управлением гетерологичных сигнальных пептидов (Armenteros et al., 2019; Zhang et al., 2020), причем показано, что способность к секреции у рекомбинантных штаммов бацилл во многом зависит от сигнального пептида и специфических белков-мишеней (Brockmeier et al., 2006; Chen et al., 2015; Zhang et al., 2017; Huang et al., 2018). Наряду с использованием гетерологичных сигнальных пептидов для повышения экспрессии сериновых протеиназ Bacillus pumilus (субтилизиноподобной протеиназы и глутамилэндопептидазы) в клетках B. subtilis мы тестировали различные промоторы: индуцибельный промотор LIKE-системы экспрессии (PLiaI) (Toymentseva et al., 2012) и конститутивный промотор гена degQ, в составе которого замена единственного нуклеотида в регионе “-10” позволила получить конститутивную активность промотора PdegQ36 (Msadek et al., 1991).
Подбор сигнальных пептидов проводили с применением LIKE-системы экспрессии (от нем. LIa-KontrollierteExpression) под контролем сильного индуцибельного промотора PLiaI двухкомпонентной системы LiaRS B. subtilis (индуктор – стрессовые факторы). Длина регуляторного региона составляет 101 п.о. и включает LiaR-связывающую последовательность для индукции промотора PLiaI; оптимизированную до канонической рибосом-связывающей последовательности (–taaggagg–), характерную для генов бациллярных белков, расстояние от этого бокса до стартового кодона составляет 7 нуклеотидов. Такое расположение генетических элементов в промоторе повышает эффективность трансляции (Toymentseva et al., 2012). С помощью LIKE экспрессионной системы нами тестированы разные сигнальные пептиды B. megaterium: SPPac – сигнальный пептид гена пенициллинамидазы, SPYngk ‒ сигнальный пептид гена гликозидгидролазы и SPAsp – смоделированный сигнальный пептид (Tikhonova et al., 2017). Установлено, что эффективными сигнальными пептидами в составе рекомбинантных конструкций с генами протеиназ B. pumilus (субтилизиноподобной протеиназы и глутамилэндопептидазы) в составе LIKE-системы экспрессии являлись сигнальный пептид SPYngk для продукции глутамилэндопептидазы и смоделированный сигнальный пептид SPAsp – для продукции субтилизиноподобной протеиназы (Tikhonova et al., 2017).
Важным этапом в оптимизации секреции белка является выбор реципиентного штамма (Gu et al., 2018, Contesini et al., 2018). Применение технологии рекомбинантной ДНК позволило изменять генетику штаммов-хозяев. Оказалось, что избыточное производство чужеродных белков у микроорганизмов приводит к сложным процессам в клетке, и подбор оптимальных штаммов для получения гетерологичных белков требует всестороннего изучения клеточной физиологии (Toya et al., 2014). Мы исследовали экспрессию протеиназ B. pumilus (субтилизиноподобной протеиназы и глутамилэндопептидазы) в различных штаммах B. subtilis: протеазодефицитном штамме 20-36 с делециями собственных внеклеточных протеиназ (Δapr-684, ΔnprE522) и штамме 27-31, в геноме которого методом направленного редактирования удалены гены, продукты которых ответственны за споруляцию, образование биопленок, антимикробных метаболитов и внеклеточных протеиназ (∆aprE, ∆aprX, ∆wprA, ∆epr, ∆bpr, ∆vpr, ∆mpr, ∆nprB).
Целью работы являлось сравнение экспрессии сериновых протеиназ B. pumilus под контролем разных промоторов и сигнальных пептидов у штаммов-реципиентов B. subtilis 20-36 и 27-31 на основе масс-спектрометрического анализа в режиме мониторинга множественных реакций (МРМ).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Штаммы и плазмиды. Штаммы, использованные и полученные в работе, представлены в табл. 1. Плазмидный вектор pGP382 предоставлен профессором T. Mascher (Мюнхенский университет Людвига-Максимилиана, г. Мюнхен, Германия). Вектор pLIKE, а также оптимизированные сигнальными пептидами вектора LIKE-системы ‒ из музея кафедры микробиологии КФУ (Toymentseva et al., 2012; Tikhonova et al., 2017).
Таблица 1.
Штаммы, использованные в работе
| Штамм | Генотип | Источник |
|---|---|---|
| B. pumilus 3-19 | StrR | Музей кафедры микробиологии, КФУ |
| B. subtilis: | ||
| 20-36 | ΔaprE-684, ΔnprE522 | Предоставлен проф. E. Феррари, Genencor Int. Inc., США |
| 27-31 | ∆aprE, ∆aprX, ∆wprA, ∆epr, ∆bpr, ∆vpr, ∆mpr, ∆nprB | Предоставлены проф. J. Altenbuchner (Гронингенский университет, г. Гронинген, Германия) |
| AT1 | ΔaprE-684, ΔnprE522, pLIKE | (Tikhonova et al., 2017) |
| B. subtilis 20-36: | ||
| MRB044 | pLIKE-rep + SPaprBp + aprBp | (Tikhonova et al., 2017) |
| MRB046 | pLIKE-rep + SPYngk + aprBp | (Tikhonova et al., 2017) |
| MRB083 | pLIKE + SPAsp + aprBp | (Tikhonova et al., 2017) |
| MRB072 | pGP382 + aprBp | Музей кафедры микробиологии, КФУ |
| MRB047 | pLIKE-rep + SPgseBp + gseBp | (Tikhonova et al., 2017) |
| MRB049 | pLIKE-rep + SPYngk + gseBp | (Tikhonova et al., 2017) |
| MRB084 | pLIKE + SPAsp + gseBp | (Tikhonova et al., 2017) |
| MRB073 | pGP382 + gseBp | Музей кафедры микробиологии, КФУ |
| B. subtilis 27-31: | ||
| MRB089 | pLIKE + aprBp | Музей кафедры микробиологии, КФУ |
| MRB090 | pLIKE + SPYngk + aprBp | |
| MRB091 | pLIKE + SPAsp + aprBp | |
| MRB080 | pGP382 + aprBp | |
| MRB085 | pLIKE + gseBp | |
| MRB087 | pLIKE + SPYngk + gseBp | |
| MRB088 | pLIKE + SPAsp + gseBp | |
| MRB081 | pGP382 + gseBp | |
Питательные среды и культивирование. Культивирование штаммов проводили на среде LB (Лурия‒Бертани) (Sambrook, Green, 2012) следующего состава (%): триптон – 1.0; дрожжевой экстракт – 0.5; NaCl – 0.5; pH 8.5. Агаризованная среда LB включала дополнительно 2% агара (LA). Среды стерилизовали при 1 атм. в течение 30 мин. Для приготовления сред использовали дистиллированную воду. Штаммы B. subtilis, содержащие рекомбинантные конструкции, выращивали на питательной среде при добавлении эритромицина в концентрации 10 мкг/мл. Для индукции LIKE-системы использовали антибиотик бацитрацин в концентрации 50 мкг/мл (Toymentseva et al., 2012). Для определения активности в культуральной жидкости рекомбинантных штаммов анализировали динамику роста бактерий с интервалом в 2 ч. Рост бактерий оценивали по изменению оптической плотности (ОП) культуры на спектрофотометре xMark (“BioRad”, США) при длине волны излучения λ = 600 нм.
Определение протеолитической активности. Протеолитическую активность определяли по расщеплению ферментом азоказеина. За единицу активности принимали количество фермента, гидролизующее в условиях эксперимента 1 мкг субстрата за 1 мин (Demidyuk et al., 2004).
Количественный масс-спектрометрический анализ в режиме мониторинга множественных реакций (LC–MRM–MS). Для количественной оценки протеиназ 50 мл культуры выращивали в среде LB в течение 24 ч. Бацитрацин, 50 мкг/мл, добавляли в качестве индуктора к культуральной жидкости B. subtilis, содержащих LIKE-систему экспрессии, при достижении ОП600 = 0.4‒0.5. Для получения фракции внеклеточного белка клетки удаляли центрифугированием в течение 20 мин при 11 000 g, а супернатант фильтровали через полиэфирсульфоновый фильтр (d = 90 мм, 0.22 мкм, “Merck”, “Millipore”). Супернатант осаждали в течение 30 мин на ледяной бане путем добавления 100% трихлоруксусной кислоты (ТХУ, w/v) в соотношении 1 : 10 к 50 мл отфильтрованного конечного раствора. Далее центрифугировали при 37 000 g в течение 15 мин. Внеклеточные белки в полученном осадке растворяли в RapiGest SF 0.1% (“Waters”, США). Концентрацию общего белка измеряли в осажденных образцах с помощью набора BCA ProteinAssayKit (“Novagen”, США) в соответствии с инструкцией по применению. Для трипсинолиза использовали 300 мкг белка. К образцам добавляли трипсин (#V5111, “Promega”, США) в соответствии с инструкцией производителя. Детекцию пептидов осуществляли методом мониторинга множественных реакций (МРМ) на масс-спектрометре Q-TRAP 6500 (“AB Sciex”, США), комбинированном с жидкостным хроматографом Infinity 1290 (“Agilent”, США). Количественное определение белков проводили с помощью построения калибровочных кривых с протеотипическими пептидами (Toymentseva et al., 2020). Пептид NAVDTANNR был использован для количественного определения субтилизиноподобной протеиназы, для глутамилэндопептидазы был подобран пептид TDTNIGNTVGYR (чистота пептидов >98%) (“Сервис Ген”, Россия). Протеотипические пептиды для каждого их белков подбирали с помощью программного обеспечения Skyline (версия 20.1).
Математическая обработка результатов. Для количественной оценки сериновых протеаз B. pumilus методом МРМ нами подобраны уникальные пептиды для субтилизиноподобной протеиназы и глутамилэндопептидазы с использованием программного обеспечения Skyline (версия 20.1, Сиэтл, Вашингтон, США). За измерение каждого белка принимали среднее арифметическое значение, рассчитанное на основании результатов МРМ- анализа в трех технических повторах. Статистический анализ и отображение полученных результатов было выполнено с применением пакета MS Excel (2016 г.).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучение динамики роста и активности рекомбинантных штаммов. B. subtilis широко применяется как продуцент белков и ферментов для масштабного производства. Выбор промотора и сигнального пептида может существенно повлиять на уровень секреции белков у бацилл. Используя этот подход, мы провели сравнительную оценку экспрессии генов различных протеиназ в рекомбинантных штаммах B. subtilis под контролем разных промоторов и сигнальных пептидов. Изучали динамику роста рекомбинантных штаммов B. subtilis 20-36, секретирующих субтилизиноподобную протеиназу и глутамилэндопептидазу B. pumilus под контролем разных промоторов и сигнальных пептидов (рис. 1).
Рис. 1.
Динамика роста и активности протеиназ рекомбинантных штаммов B. subtilis 20-36 с конструкциями генов ферментов с разными промоторами и сигнальными пептидами: а – B. subtilis MRB047 ‒ ген глутамилэндопептидазы B. pumilus под контролем собственного сигнального пептида и индуцибельного промотора PLiaI; б – B. subtilis MRB049 – ген глутамилэндопептидазы B. pumilus под контролем сигнального пептида гена гликозидгидролазы B. megaterium (SPYngk) и индуцибельного промотора PLiaI; в – B. subtilis MRB084 – ген глутамилэндопептидазы B. pumilus под контролем смоделированного сигнального пептида (SPAsp) и индуцибельного промотора PLiaI; г – B. subtilis MRB044 – ген субтилизиноподобной протеиназы B. pumilus под контролем собственного сигнального пептида и индуцибельного промотора PLiaI; д – B. subtilis MRB046 – ген субтилизиноподобной протеиназы B. pumilus под контролем сигнального пептида гена гликозидгидролазы B. megaterium (SPYngk) и индуцибельного промотора PLiaI; е – B. subtilis MRB083 – ген субтилизиноподобной протеиназы B. pumilus под контролем смоделированного сигнального пептида (SPAsp) и индуцибельного промотора PLiaI; ж – B. subtilis MRB073 – ген глутамилэндопептидазы B. pumilus под контролем собственного сигнального пептида и конститутивного промотора PDegQ36; з – B. subtilis MRB072 – ген субтилизиноподобной протеиназы B. pumilus под контролем собственного сигнального пептида и конститутивного промотора PDegQ36. Серыми столбцами обозначена протеолитическая активность в отсутствие индуктора, красными столбцами – протеолитическая активность с индуктором (бацитрацин).
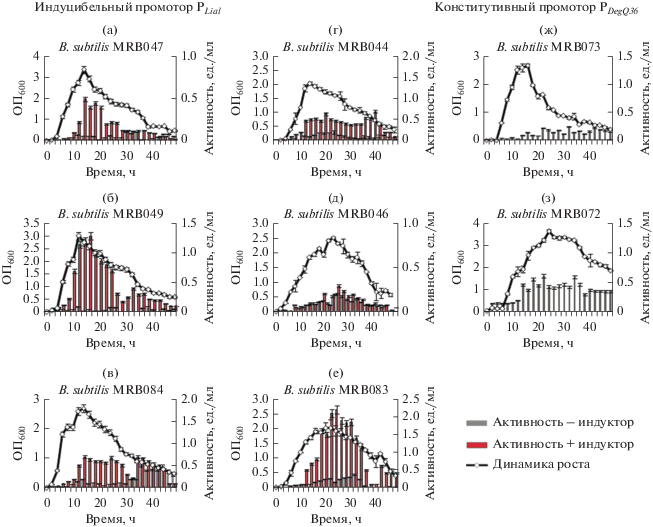
Сравнивали активность протеиназ под контролем собственного сигнального пептида и разных промоторов: индуцибельного промотора PLiaI и конститутивного промотора PDegQ36. Показано, что максимальная протеолитическая активность субтилизиноподобной протеиназы B. pumilus в штамме B. subtilis MRB044 (pLIKE + SPAprBp + aprBp) после индукции промотора составляла 0.64 ед./мл на 20 ч роста, активность в штамме под контролем конститутивного промотора B. subtilis MRB072 (pGP382 + aprBp) составляла 0.62 ед./мл на 22 ч роста. Максимальная протеолитическая активность глутамилэндопептидазы в штамме под контролем собственного сигнального пептида и индуцибельного промотора B. subtilis MRB047 (pLIKE + + SPGseBp + gseBp) после индукции составляла 0.47 ед./мл на 18 ч роста, активность в штамме под контролем конститутивного промотора B. subtilis MRB073 (pGP382 + gseBp) составляла 0.23 ед./мл на 22 ч роста. Таким образом, активность субтилизиноподобной протеиназы практически не отличалась под контролем разных промоторов, активность глутамилэндопептидазы была выше под контролем индуцибельного промотора PLiaI.
Изучали активность субтилизиноподобной протеиназы под контролем собственного сигнального пептида (SPAprBp) и рекомбинантных сигнальных пептидов B. megaterium (SPYngk, SPAsp) в составе LIKE экспрессионной системы. Немецкие исследователи показали, что сигнальный пептид гена гликозидгидролазы B. megaterium (SPYngk), а также смоделированный in silico сигнальный пептид SPAsp обеспечивали высокую эффективность секреции гетерологичной гликозидгидролазы Thermobifida fusca (в 6 раз выше, чем ее собственный сигнальный пептид) (Stammen et al., 2010). При тестировании этих сигнальных пептидов нами установлено, что максимальная протеолитическая активность субтилизиноподобной протеиназы под управлением сигнального пептида SPYngk в штамме B. subtilis MRB046 (pLIKE + SPYngk + aprBp) после индукции промотора составляла 0.3 ед./мл на 28 ч роста, а в штамме B. subtilis MRB083 под контролем сигнального пептида SPAsp (pLIKE + SPAsp + + aprBp) ‒ 2.2 ед./мл на 24 ч роста, что указывает на большую эффективность смоделированного сигнально пептида (рис. 1д, 1е).
Изучали активность глутамилэндопептидазы под контролем собственного сигнального пептида (SPGseBp) и рекомбинантных сигнальных пептидов B. megaterium (SPYngk, SPAsp) в составе LIKE экспрессионной системы. Показали, что максимальная активность глутамилэндопептидазы в штамме B. subtilis MRB049 под управлением сигнального пептида SPYngk (pLIKE + SPYngk + gseBp) после индукции промотора составила 1.3 ед./мл на 16 ч роста, в штамме B. subtilis MRB084 под контролем сигнального пептида SPAsp (pLIKE + SPAsp + gseBp) составила 0.75 ед./мл на 16 ч роста (рис. 1б, 1в).
Таким образом, замена собственного сигнального пептида субтилизиноподобной протеиназы (SPAprBp) на смоделированный сигнальный пептид SPAsp в сочетании с сильным индуцибельным промотором PLiaI позволила повысить активность фермента в 4 раза, а замена собственного сигнального пептида глутамилэндопептидазы (SPGseBp) на рекомбинантный сигнальный пептид SPYngk позволила повысить активность фермента в 9 раз.
Изучали экспрессию протеиназ B. pumilus в штамме B. subtilis 27-31, в геноме которого методом направленного редактирования удалены гены, продукты которых ответственны за споруляцию, образование биопленок, антимикробных метаболитов и внеклеточных протеиназ. Динамика роста рекомбинантных штаммов B. subtilis 27-31, секретирующих субтилизиноподобную протеиназу и глутамилэндопептидазу, была схожей: к 12‒14 ч роста рекомбинантные культуры достигали максимальной оптической плотности и переходили в фазу отмирания культуры, стационарная фаза практически отсутствовала (рис. 2). Проводили сравнительный анализ активности субтилизиноподобной протеиназы под контролем собственного сигнального пептида и разных промоторов: индуцибельного промотора PLiaI и конститутивного промотора PDegQ36. Показано, что максимальная протеолитическая активность субтилизиноподобной протеиназы в культуральной жидкости рекомбинантного штамма B. subtilis MRB089 под контролем индуцибельного промотора (pLIKE + SPAprBp + + aprBp) после индукции составляла 0.8 ед./мл на 14 ч роста, активность протеиназы в культуральной жидкости штамма под контролем конститутивного промотора B. subtilis MRB080 (pGP382 + aprBp) составляла 0.85 ед./мл на 16 ч роста (рис. 2г, 2з). Таким образом, полученные данные по активности субтилизиноподобной протеиназы в штамме B. subtilis 27-31 коррелируют с активностью протеиназы в штамме B. subtilis 20-36, активность протеиназы под контролем собственного сигнального пептида и разных промоторов практически не различалась.
Рис. 2.
Динамика роста и активности протеиназ рекомбинантных штаммов B. subtilis 27-31 с конструкциями генов ферментов с разными промоторами и сигнальными пептидами: а – B. subtilis MRB085 – ген глутамилэндопептидазы B. pumilus под контролем собственного сигнального пептида и индуцибельного промотора PLiaI; б – B. subtilis MRB087 – ген глутамилэндопептидазы B. pumilus под контролем рекомбинантного сигнального пептида гена гликозидгидролазы B. megaterium (SPYngk) и индуцибельного промотора PLiaI; в – B. subtilis MRB088 – ген глутамилэндопептидазы B. pumilus под контролем смоделированного сигнального пептида (SPAsp) и индуцибельного промотора PLiaI; г – B. subtilis MRB 089 – ген субтилизиноподобной протеиназы B. pumilus под контролем собственного сигнального пептида и индуцибельного промотора PLiaI; д – B. subtilis MRB090 – ген субтилизиноподобной протеиназы B. pumilus под контролем рекомбинантного сигнального пептида гена гликозидгидролазы B. megaterium (SPYngk) и индуцибельного промотора PLiaI; е – B. subtilis MRB091 – ген субтилизиноподобной протеиназы B. pumilus под контролем смоделированного сигнального пептида (SPAsp) и индуцибельного промотора PLiaI; ж – B. subtilis MRB081 – ген глутамилэндопептидазы B. pumilus под контролем собственного сигнального пептида и конститутивного промотора PDegQ36; з – B. subtilis MRB080 – ген субтилизиноподобной протеиназы B. pumilus под контролем собственного сигнального пептида и конститутивного промотора PDegQ36. Серыми столбцами обозначена протеолитическая активность в отсутствие индуктора, красными столбцами – протеолитическая активность с индуктором (бацитрацин).
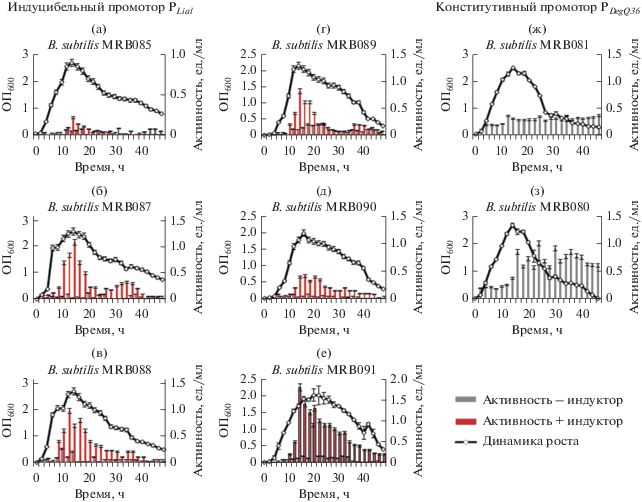
Оценивали активность субтилизиноподобной протеиназы в культуральной жидкости рекомбинантного штамма B. subtilis 27-31 под контролем индуцибельного промотора PLiaI и рекомбинантных сигнальных пептидов B. megaterium (SPYngk, SPAsp). Нами установлена максимальная протеолитическая активность в культуральной жидкости рекомбинантного штамма B. subtilis MRB091 под контролем смоделированного сигнального пептида SPAsp (pLIKE + SPAsp + aprBp) ‒ 1.8 ед./мл, в культуральной жидкости штамма B. subtilis MRB090 под контролем сигнального пептида SPYngk (pLIKE + SPYngk + aprBp) после индукции промотора активность составила 0.32 ед./мл (рис. 2д, 2е). Таким образом, для оптимальной экспрессии гена субтилизиноподобной протеиназы наиболее эффективным является гетерологичный смоделированный сигнальный пептид (SPAsp) в сочетании с сильным индуцибельным промотором PLiaI.
Сравнивали активность глутамилэндопептидазы под контролем собственного сигнального пептида и двух промоторов (PLiaI и PDegQ36) в штамме B. subtilis 27-31. Показано, что максимальная активность глутамилэндопептидазы в штамме под контролем собственного сигнального пептида и индуцибельного промотора B. subtilis MRB085 (pLIKE + SPGseBp + gseBp) после индукции составляла 0.18 ед./мл на 14 ч роста, активность в штамме под контролем конститутивного промотора B. subtilis MRB081 (pGP382 + gseBp) составляла 0.34 ед./мл на 12 ч роста (рис. 2а, 2ж). Таким образом, при экспрессии гена глутамилэндопептидазы под контролем собственного сигнального пептида более эффективным является конститутивный промотор.
Изучали активность глутамилэндопептидазы под контролем рекомбинантных сигнальных пептидов B. megaterium (SPYngk, SPAsp) в составе LIKE экспрессионной системы в штамме B. subtilis 27-31. Показано, что максимальная активность глутамилэндопептидазы в культуральной жидкости модифицированного штамма B. subtilis MRB087 под контролем сигнального пептида SPYngk (pLIKE + + SPYngk + gseBp) после индукции промотора составляла 1.1 ед./мл; в культуральной жидкости штамма B. subtilis MRB088 под контролем смоделированного сигнального пептида (pLIKE + SPAsp + + gseBp) активность глутамилэндопептидазы составила 0.98 ед./мл (рис. 2б, 2в). Таким образом, для получения внеклеточной глутамилэндопептидазы наиболее эффективными являются рекомбинантные сигнальные пептиды (SPYngk и SPAsp) в сочетании с сильным индуцибельным промотором PLiaI.
Масс-спектрометрический анализ культуральной жидкости исследуемых штаммов для количественного определения сериновых протеиназ. Для количественной оценки внеклеточных протеиназ рекомбинантных штаммов, а также оценки влияния оптимизации экспрессионной системы мы использовали подход на основе высокоэффективной жидкостной хроматографии/тандемной масс-спектрометрии в режиме мониторинга множественных реакций (МРМ). Эта технология позволяет с высокой чувствительностью определить количественное содержание целевого белка и при этом не требует наработки специфичных антител. Для количественной оценки сериновых протеиназ с применением программного обеспечения Skyline конструировали уникальные протеотипические пептиды для каждого фермента на основе их первичной структуры: NAVDTANNR для субтилизиноподобной протеиназы, TDTNIGNTVGYR для глутамилэндопептидазы (степень чистоты пептидов составляла >98%) (Toymentseva et al., 2020).
По результатам MРM-анализа нами показано, что оптимизация экспрессионной системы с использованием рекомбинантного сигнального пептида SPYngkB. megaterium в протеазодефицитном штамме B. subtilis 20-36 позволила увеличить секрецию глутамилэндопептидазы (после индукции промотора PLiaI) в 60 раз по сравнению со штаммом, где глутамилэндопептидаза находится под контролем собственного сигнального пептида SPGseBp. Штамм B. subtilis 20-36 с системой экспрессии для субтилизиноподобной протеиназы, содержащий смоделированный сигнальный пептид SPAsp под контролем индуцибельного промотора PLiaI, оказался более эффективным для продукции фермента: концентрация белка после индукции LIKE-системы увеличилась в 66 раз (табл. 2). Количественный анализ секретируемых протеиназ рекомбинантными штаммами показал, что более эффективным реципиентным штаммом является протеазодефицитный штамм B. subtilis 20-36 (табл. 2), максимальное количество субтилизиноподобной протеиназы и глутамилэндопептидазы составило 1.6 и 0.06 мкг/мкл соответственно. В штамме B. subtilis 27-31 с редактированным геномом максимальное количество субтилизиноподобной протеиназы и глутамилэндопептидазы составило 0.9 и 0.04 мкг/мкл. Отсутствие корреляции между активностью и количеством белка в штамме B. subtilis 27-31, по-видимому, связано с быстрым отмиранием культуры после достижения максимума роста (рис. 2).
Таблица 2.
Количественный анализ секретируемых протеиназ рекомбинантными штаммами
| Штамм | Целевой белок (мкг/мкл), индуктор “‒”/“+” | Штамм | Целевой белок (мкг/мкл), индуктор “‒”/“+” |
|---|---|---|---|
| субтилизиноподобная протеиназа (AprBp) | глутамилэндопептидаза (GseBp) | ||
| B. subtilis 20-36 | B. subtilis 20-36 | ||
| B. subtilis MRB044 (SPaprBp) | 0.024/1.5 | B. subtilis MRB047 (SPgseBp) | 0.00036/0.005 |
| B. subtilis MRB046 (SPYngk) | 0.005/0.03 | B. subtilis MRB049 (SPYngk) | 0.006/0.06 |
| B. subtilis MRB092 (SPAsp) | 0.032/1.6 | B. subtilis MRB093 (SPAsp) | 0.0042/0.04 |
| B. subtilis MRB072 (pGP382 + aprBp) | 0.08 | B. subtilis MRB073 (pGP382 + gseBp) | 0.038 |
| B. subtilis 27-31 | B. subtilis 27-31 | ||
| B. subtilis MRB089 (SPaprBp) | 0.02/0.7 | B. subtilis MRB085 (SPgseBp) | 0.0001/0.002 |
| B. subtilis MRB090 (SPYngk) | 0.0046/0.01 | B. subtilis MRB087 (SPYngk) | 0.002/0.04 |
| B. subtilis MRB091 (SPAsp) | 0.022/0.9 | B. subtilis MRB088 (SPAsp) | 0.0001/0.001 |
| B. subtilis MRB080 (pGP382 + aprBp) | 0.03 | B. subtilis MRB081 (pGP382 + gseBp) | 0.034 |
В настоящем исследовании нами изучена экспрессия сериновых протеиназ B. pumilus (субтилизиноподобной протеиназы и глутамилэндопептидазы) под контролем разных промоторов и сигнальных пептидов в реципиентных штаммах B. subtilis. Показано, что для продукции субтилизиноподобной протеиназы наиболее эффективной оказалась конструкция в протеазодефицитном штамме-реципиенте B. subtilis 20-36, содержащая LIKE-систему экспрессии и смоделированный сигнальный пептид SPAsp, количество белка составило 1.6 мкг/мкл, что в 66 раз больше по сравнению с секрецией под контролем собственного сигнального пептида. Для продукции глутамилэндопептидазы наиболее эффективным оказался сигнальный пептид гена гликозидгидролазы B. megaterium SPYngk, количество белка после индукции промотора составило 0.06 мкг/мкл. Таким образом, с применением количественных методов анализа нами установлено, что в процессе оптимизации экспрессионной системы у бацилл для каждой гетерологичной конструкции важно подбирать промоторы и сигнальные пептиды, чтобы обеспечить условия эффективной секреции, а также применять оптимальный штамм-продуцент.
Список литературы
Armenteros J.J.A., Tsirigos K.D., Sonderby C.K., Petersen T.N., Winther O., Brunak S., Nielsen H. SignalP 5.0 improves signal peptide predictions using deep neural networks // Nat. Biotechnol. 2019. V. 37. P. 420–423.
Brockmeier U., Caspers M., Freudl R., Jockwer A., Noll T., Eggert T. Systematic screening of all signal peptides from Bacillus subtilis: a powerful strategy in optimizing heterologous protein secretion in Gram-positive bacteria // J. Mol. Biol. 2006. V. 362. P. 393‒402.
Cai D., Rao Y., Zhan Y., Wang Q., Chen S. Engineering Bacillus for efficient production of heterologous protein: current progress, challenge and prospect // J. Appl. Microbiol. 2019. V. 126. P. 1632‒1642.
Chen J., Gai Y., Fu G., Zhou W., Zhang D., Wen J. Enhanced extracellular production of α-amylase in Bacillus subtilis by optimization of regulatory elements and over-expression of PrsA lipoprotein // Biotechnol. Lett. 2015. V. 37. P. 899‒906.
Contesini F.J., Melo R.R., Sato H.H. An overview of Bacillus proteases: from production to application // Crit. Rev. Biotechnol. 2018. V. 38. P. 321‒334.
Cui W., Han L., Suo F., Liu Z., Zhou L., Zhou Z. Exploitation of Bacillus subtilis as a robust workhorse for production of heterologous proteins and beyond // World J. Microbiol. Biotechnol. 2018. V. 34. Art. 145.
Demidyuk I.V., Romanova D.V., Nosovskaya E.A., Chestukhina G.G., Kuranova I.P., Kostrov S.V. Modification of substrate-binding site of glutamyl endopeptidase from Bacillus intermedius // Protein Eng. Des. Sel. 2004. V. 17. P. 411‒416.
Ferrari F.A., Capello J. Biosynthesis of protein polymers // Protein-Based Materials. Bioengineering of Materials / Eds. McGrath K., Kaplan D. Boston: Birkhäuser, 1997. P. 37‒60. https://doi.org/10.1007/978-1-4612-4094-5_2
Gu Y., Xu X., Wu Y., Niu T., Liu Y., Li J., Du G., Liu L. Advances and prospects of Bacillus subtilis cellular factories: From rational design to industrial applications // Metab. Eng. 2018. V. 50. P. 109‒121.
Huang X., Cao L., Qin Z., Li S., Kong W., Liu Y. Tat-independent secretion of polyethylene terephthalate hydrolase PETase in Bacillus subtilis 168 mediated by its native signal peptide // J. Agric. Food Chem. 2018. V. 66. P. 13217‒13227.
Msadek T., Kunst F., Henner D., Klier A., Rapoport G., Dedonder R. Signal transduction pathway controlling synthesis of a class of degradative enzymes in Bacillus subtilis: expression of the regulatory genes and analysis of mutations in degS and degU // J. Bacteriol. 1990. V. 172. P. 824‒834.
Sambrook J., Green M.R. Molecular Cloning: A Laboratory Manual. 4th edn. N.Y.: Cold Spring Harbor, 2012. P. 1885.
Stammen S., Müller B.K., Korneli C., Biedendieck R., Gamer M., Franco-Lara E., Jahn D. High-yield intra- and extracellular protein production using Bacillus megaterium // Appl. Environ. Microbiol. 2010. V. 76. P. 4037‒4046.
Tikhonova A., Toymentseva A., Sharipova M. Screening of heterologous signal peptides for optimization of the LIKE-expression system // BioNanoSci. 2017. V. 7. P. 408‒414.
Toya Y., Hirasawa T., Morimoto T., Masuda K., Kageyama Y., Ozaki K., Ogasawara N., Shimizu H. 13C-metabolic flux analysis in heterologous cellulase production by Bacillus subtilis genome-reduced strain // J. Biotechnol. 2014. V. 179. P. 42‒49.
Toymentseva A.A., Koryagina A.O., Laikov A.V., Sharipova M.R. Label-free multiple reaction monitoring, a promising method for quantification analyses of specific proteins in bacteria // Int. J. Mol. Sci. 2020. V. 21. Art. 4924.
Toymentseva A.A., Schrecke K., Sharipova M.R., Mascher T. The LIKE system, a novel protein expression toolbox for based on the promoter // Microb. Cell Fact. 2012. V. 11. P. 143‒156.
Zhang K., Su L., Duan X., Liu L., Wu J. High-level extracellular protein production in Bacillus subtilis using an optimized dual-promoter expression system // Microb. Cell Fact. 2017. V. 16. P. 1‒15. https://doi.org/10.1186/s12934-017-0649-1
Zhang K., Su L., Wu J. Recent advances in recombinant protein production by Bacillus subtilis // Annu. Rev. Food Sci. Technol. 2020. V. 11. P. 295‒318.
Дополнительные материалы отсутствуют.


