Микробиология, 2022, T. 91, № 2, стр. 160-170
Биоаументация активного ила анаммокс нитрифицирующим сообществом бактерий как способ повышения эффективности удаления азота
Н. В. Пименов a, Ю. А. Николаев a, *, А. Г. Дорофеев a, В. А. Грачёв a, А. Ю. Каллистова a, В. В. Миронов a, А. В. Вантеева a, Н. В. Григорьева a, Ю. Ю. Берестовская a, Е. В. Груздев b, Ш. А. Бегматов b, Н. В. Равин b, А. В. Марданов b
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Институт биоинженерии, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: nikolaevya@mail.ru
Поступила в редакцию 23.11.2021
После доработки 26.11.2021
Принята к публикации 27.11.2021
- EDN: PTCPOO
- DOI: 10.31857/S0026365622020124
Аннотация
Биоаугментация, как способ повышения содержания определенных микроорганизмов в сообществе путем их внесения извне или созданием специальных условий, способствующих их росту, широко применяется в природоохранных биотехнологиях. Ее применение для ускорения запуска биореакторов Анаммокс ограничивается, как правило, внесением бактерий анаммокс. Мы предположили, что внесение нитрификаторов при запуске биореактора будет стимулировать анаммокс-процесс за счет быстрого образования нитрита, используемого анаммокс-бактериями для окисления аммония. В настоящей работе исследовано влияние добавления нитрифицирующего сообщества на состав и активность микробного консорциума биореактора Анаммокс. Активное нитрифицирующее сообщество бактерий (возраст 5 сут), содержащее нитрификаторов первой группы, преимущественно рода Nitrosospira, было добавлено в соотношении 1 : 100 по массе сухого вещества к хранившемуся 1 мес. при 4°С и обладающему низкой метаболической активностью активному илу Анаммокс (АИА) в момент инокуляции лабораторного биореактора SBR-типа. Внесение биоаугментирующего активного ила (АИБ) повысило эффективность удаления азота. В контрольном реакторе заметное удаление азота (7%) было отмечено с 11-х сут инкубации, а в опытном – с 4-х сут и сразу же составило 20%. Через 30 сут инкубации в контрольном реакторе удалялось 20% азота, а в опытном – почти 60%. В присутствии АИБ скорость окисления аммония повышалась за счет активности бактерий-нитрификаторов (в первые 10 сут работы реактора) и анаммокс-бактерий р. Brоcadia, изначально присутствовавших в АИА (в течение всего периода работы реактора). Активность нитрификаторов второй группы родов Nitrobacter и Nitrococcus, присутствовавших в АИБ, предотвратила накопление в среде нитрита, токсичного в высоких дозах для нитрификаторов и анаммокс-бактерий. По-видимому, высокая активность внесенных с АИБ нитрификаторов рода Nitrosospira быстро обеспечила анаммокс-бактерии одним из субстратов (нитритом), что способствовало их быстрому росту. При последующей эксплуатации биореактора размножались преимущественно нитрификаторы рода Nitrosomonas из исходного сообщества АИА. Таким образом, биоаугментация АИА при запуске анаммокc-биореактора активным сообществом нитрификаторов значительно повысила эффективность удаления аммония за счет анаммокс-процесса и ускорила выход биореактора на рабочий режим.
Для очистки сточных вод от аммония в последние годы активно используются биотехнологические процессы, работающие по схеме “нитритация/анаммокс” (деаммонификация), экономически и экологически более привлекательные, чем традиционные,основанные на схеме “нитрификация/денитрификация” (Agraval et al., 2018; Кевбрина и соавт., 2019). Деаммонификация протекает в два этапа: 1) окисление около половины аммония до нитрита аммоний-окисляющими бактериями (АОБ) и 2) окисление аммония нитритом с образованием молекулярного азота анаммокс-бактериями (АНБ). Реализация процесса деаммонификации требует достаточно жесткого регулирования физико-химических условий для поддержания высокой активности и конкурентоспособности АОБ и АНБ (Каллистова и соавт., 2016; Cho et al., 2020). Особенно остро эта проблема ощущается в области обработки концентрированных возвратных потоков от сооружений обработки осадка сточных вод (их метанового сбраживания) (Zhang et al., 2018; Izadi et al., 2021; Ochs et al., 2021; Pedrouso et al., 2021). Центральная задача исследований в этой области – повысить активность и стрессоустойчивость основных участников деаммонификации ‒ АОБ и АНБ, повысить устойчивость процесса деаммонификации к неблагоприятным факторам (Shourjeh et al., 2021).
Один из путей увеличения эффективности, ускорения ввода в эксплуатацию и поддержания стабильности биохимических процессов очистки сточных вод – использование биоаугментации, добавления в биореактор штаммов или смешанных культур для ускорения трансформации загрязнителей (Herrero, Stuckey, 2015; Raper et al., 2018). Во многих работах было показано, что биоаугментация нитрификаторами (Tang, Chen, 2015; Stenström, la Cour Jansen, 2017) или анаммокс-бактериями (Jin et al., 2014; Zhang et al., 2018) повышает эффективность и устойчивость в неблагоприятных условиях, соответственно, нитрификации или анаммокс-процесса. Добавление в биореактор обогащенного АОБ активного ила позволяет ускорить запуск процесса нитритации и создать благоприятные условия для последующего развития АНБ (Zhang et al., 2012; Ma et al., 2013). Наиболее распространено применение нитрификаторов для биоаугментации традиционных процессов нитрификации/денитрификации. Существуют единичные работы, описывающие добавление нитрификаторов для интенсификации процессов Анаммокс. Было показано, что биоаугментация биореактора активным илом, обогащенным АОБ и АНБ, способствует стабилизации процесса деаммонификации и ускорения ввода биореакторов в эксплуатацию (Wett et al., 2013; Miao et al., 2017; Pedrouso et al., 2021). В работе (Ma et al., 2013) не было идентификации АОБ, активный ил добавляли ежедневно. В работе (Miao et al., 2017) обогащение биомассой анаммокс-бактерий достигалось за счет ее ежемесячного внесения в реактор.
При этом известно, что слабым местом процесса анаммокс является именно первое звено – нитритация аммония (Trojanowicz et al., 2021), т.к. нитрификаторы чувствительны к токсикантам, быстро отмирают при хранении или голодании (Salem et al., 2006). Анаммокс-бактерии существенно более устойчивы, быстро восстанавливаются после периодов присутствия токсикантов, например, кислорода, медленно отмирают (не более 1‒2% в сут) (Wang et al., 2018), тогда как скорость отмирания нитрификаторов ‒ до 20% в сут (Salem et al., 2006).
При планировании экспериментов исходили из двух предпосылок. Из двух основных типов биоаугментации – внешней (при которой в систему вводится целевой биологический агент) и внутренней (при которой создаются условия для обогащения системы нужными бактериями, т.е. селекции), была применена внешняя, как единственно возможная при запуске новых сооружений и при восстановлении активности биореакторов после срывов процесса по причине отравления активного ила. Кроме того, внутренняя биоаугментация давно разработана и широко применяется, часто без использования термина “биоаугментация”. По такому принципу работают скиммеры для обогащения активного ила фосфат-аккумуляторами (Lema, Suarez, 2017) или реакторы частичной нитрификации для обогащения ила аммоний-окисляющими бактериями (Tchobanoglous et al., 2014). Для обеспечения активности процесса анаммокс необходимы нитрификаторы первой группы, из которых в активных илах доминируют представители родов Nitrozomonas и Nitrozospira. Добавление именно этих бактерий и представляло интерес изучить.
Задачей исследования было исследовать возможность ускорения процесса анаммокс при запуске реактора за счет добавления извне физиологически активных бактерий-нитрификаторов первой группы.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Культивирование активного ила (сообщества бактерий) анаммокс проводили в реакторе, описанном в работе Каллистовой и соавт. (2020). Реактор объемом 4.5 л состоял из двух коаксиальных цилиндров из полиметилметакрилата. Пространство между внешним и внутренним цилиндром было герметично и использовалось для термостатирования реактора. Для удержания активного ила использовали цилиндрическую загрузку из волокнистого пластика, смеси полиэтилена и полипропилена (материал типа Поливом, ООО НПФ “ЭТЕК ЛТД , РФ”) с внутренним диаметром 85 мм, высотой 200 мм, общей площадью поверхности 11.6 дм2. Подача воздуха в реактор осуществлялась снизу с помощью компрессора SCHEGO SW2 (Германия). В период без аэрации перемешивание осуществлялось при помощи магнитной мешалки IKA C-MAG MS7 (Германия) в режиме 120‒150 об/мин. Среда подавалась в нижнюю часть реактора с помощью перистальтических насосов Masterflex L/S economy drive (США), вытесняя при этом очищенную воду через верхний штуцер. Температурный режим задавался при помощи термостата-бани ELMI TV 2.03 (Латвия), который был снабжен циркуляционным насосом для внешнего контура. Автоматизация осуществлялась с помощью программируемого таймера Siemens LOGO 6ED1 (Германия). Режим эксплуатации реактора, последовательно-периодического типа действия (SBR-реактор), включал стадию отстаивания, стадию подачи питательной среды с одновременным сливом очищенной воды и стадию аэрации. Время полного цикла составляло 6 ч, среднее гидравлическое время пребывания среды в реакторе ‒ 27 ч. Реактор работал при температуре 30°С, концентрации кислорода 0.4‒0.8 мг/л, чередовании фаз аэрации и ее отсутствия 20 мин и расходе воздуха 20 л/ч. В опыте было задействовано два идентичных реактора, контрольный и опытный. Концентрацию кислорода определяли с помощью кислородомера WTW INOLAB 7310, датчик Sellox (Германия).
В реактор подавали среду следующего состава (г/л): (NH4)2SO4 – 0.942; NaCH3COO · 3H2O – 0.04; KH2PO4 – 0.044; NaHCO3 – 2.1; рН 8.3 (Boeije et al., 1999). Среду получали разбавлением концентрата, который готовили на дистиллированной воде, с водопроводной водой в момент подачи питания в реактор. Инокулятом служил активный ил Анаммокс (АИА) из этого же реактора, ранее работавшего в аналогичном режиме, хранившийся при 4°С в течение 30 сут. Для запуска реактора добавляли на 3.5 л среды 1 л инокулята с содержанием взвешенных веществ 2 г/л. В опытный реактор была добавлена ассоциация нитрифицирующих бактерий, полученная, как описано ниже (содержащая 20 мг биомассы бактерий), что соответствовало массовому соотношению АИА и нитрифицирующего активного ила 100 : 1. В очищенной воде еженедельно определяли концентрацию ионов аммония, нитрита и нитрата стандартными методами (Rice, Bridgewater, 2012). Количество удаленного азота (dN мг/л) рассчитывали, как разность между концентрацией аммонийного азота (N-NH4) в поступающей среде и суммарной концентрацией минеральных форм азота в очищенной воде (N‑NH4, N-NO2, N-NO3). Эффективность удаления азота рассчитывали как долю удаленного азота от его содержания в поступающей воде (%).
Расчет активности аммоний-окисляющих бактерий (АОБ), анаммокс-бактерий (АНБ) и нитрит-окисляющих бактерий (НОБ) проводили исходя из количества удаленного азота (dN) и стехиометрии анаммокс-процесса (Lotti et al., 2014):
Удельная активность АНБ = dN/Т (мг/л/ч);
удельная активность АОБ = ((N-${\text{NH}}_{{4\,\,0}}^{ + }$ – N-${\text{NH}}_{4}^{ + }$) – (dN/1.99))/T (мг/л/ч);
удельная активность НОБ = (N-${\text{NO}}_{{3\,\,{\text{r}}}}^{ - }$ – ‒ 0.08dN)/Т (мг/л/ч);
где Т – гидравлическое время пребывания в биореакторе (ч).
N-${\text{NH}}_{{4\,\,0}}^{ + }$ и N-${\text{NH}}_{4}^{ + }$ ‒ концентрация аммонийного азота в подающейся и отводящейся среде соответственно (мг N/л).
N-${\text{NO}}_{{3\,\,{\text{r}}}}^{ - }$ – концентрация нитратного азота в отводящейся очищенной воде.
Вкладом денитрификации пренебрегали, т.к. за счет этого процесса могло удаляться не более 5% азота. Вклад в ассимиляцию на рост АНБ составлял менее 1%, поэтому им также пренебрегали. Коэффициенты взяты из работы Lotti et al. (2014).
Биоаугментирующий активный ил (АИБ) представлял собой накопительную культуру нитрификаторов, полученную из компостируемой смеси избыточного ила биологических очистных сооружений сточных вод молочного производства, овощных и древесных отходов в соотношении 3 : 3 : 4 (по объему). Пробы компоста были отобраны на стадии остывания при температуре смеси 45°С из промышленного бурта объемом 950 м3 с мембранным светонепроницаемым покрытием и активной аэрацией (“Грунт Эко”, Московская область, Россия). Содержание сухого вещества в компосте 27.5 ± 1.3% (по массе). Водную суспензию компоста готовили путем смешения 1 ч компоста и 9 ч стерильной среды для нитрификаторов (по массе), состава: (г/л водопроводной воды): (NH4)2SO4 – 2; K2HPO4 · 3H2O – 1; MgSO4 · 7H2O – 0.5; NaCl – 2; FeSO4 · 7H2O – 0.05; CaCO3 – 5; рН 7. Суспензию тщательно перемешивали на лабораторном встряхивателе Vortex V-1 plus (“Biosan”, Латвия) в течение 10 мин. Для получения накопительный культуры в 250 мл среды добавили 5 мл суспензии компоста. Культивировали при 30°С на шейкере-инкубаторе (Biosan OS-20, “Biosan”, Латвия) при 140 об./мин в течение 7 сут. Полученную культуру использовали как инокулят (20%) для получения биоаугментирующей культуры (2 л), которую выращивали в течение 5 сут в тех же условиях и использовали в качестве биоаугментирующего активного ила (АИБ) для внесения в биореактор Анаммокс. Титр клеток в АИБ составлял 2 × 108 кл./мл, что было определено с использованием светового эпифлуоресцентного микроскопа Axio Imager M2 (“Carl Zeiss Microscopy GmbH”, Германия).
Анализ состава микробных сообществ в активных илах (инокуляте, биоаугментирующем АИБ, и иммобилизованных на загрузке), проводили с помощью метода высокопроизводительного секвенирования фрагментов гена 16S рРНК. Активный ил отбирали в момент инокуляции, через 25, 45 и 60 сут инкубации.
Метагеномную ДНК из образцов выделяли с помощью набора DNeasy PowerSoil Kit (“Qiagen”, Германия) по протоколам производителя. Вариабельный V3‒V4 регион гена 16S рРНК амплифицировали с использованием универсальных праймеров 341F CCTAYGGGDBGCWSCAG и 806R GGACTACNVGGGTHTCTAAT (Frey et al., 2016). Полученные ПЦР фрагменты использовали для приготовления библиотек ампликонов с баркодами с помощью наборов Nextera XT Index Kit v2 (“Illumina”, San Diego, США) по протоколам производителя. ПЦР фрагменты секвенировали с использованием Illumina MiSeq в формате 2 × 300 нт.
Полученные парные чтения объединили с помощью программы FLASH v. 1.2.11 (Magoc, Salzberg, 2011). На следующем этапе из дальнейшего анализа были исключены низкокачественные чтения, синглетоны и химеры.
Оставшиеся чтения были кластеризованы в оперативные таксономические единицы (ОТЕ) с идентичностью последовательностей на уровне 97%. Для определения доли ОТЕ в каждом из образцов, на репрезентативные последовательности ОТЕ были наложены исходные чтения (включая низкокачественные и синглетоны) с помощью пакета программ USEARCH v. 11 (Edgar, 2010). Таксономическую идентификацию полученных ОТЕ проводили с использованием алгоритма VSEARCH v. 2.14.1 и базы данных Silva v. 138 (Rognes et al., 2016).
Взаимодействие различных групп микроорганизмов характеризовали с помощью сетевого анализа. Анализ совместного присутствия или взаимного исключения ОТЕ проводили на основе корреляционной матрицы Спермана (Langfelder et al., 2012) и построены с использованием только значимых значений корреляции (Barberan et al., 2014). Пороговое значение для коэффициентов корреляции было определено равным 0.6, а пороговое значение для скорректированных значений p – 0.001 (Luo, Bhattacharya, 2006). В анализ были включены только ОТЕ, относительное содержание которых составляло не менее 2.0% последовательностей 16S рРНК хотя бы в одном образце. Визуализацию полученных сетей проводили с использованием программы Cytoscape v. 3.8.2 (Shannon et al., 2003; Faust et al., 2016).
Полученные последовательности фрагментов гена 16S рРНК депонированы в базу NCBI и доступны в рамках проекта BioProject PRJNA556270.
Статистическая обработка данных. В экспериментах по культивированию анаммокс-сообщества и оценке активностей разных физиологических групп бактерий проводили по 3 определения каждого показателя (концентрации форм азота, кислорода). Для каждой точки определяли среднее арифметическое и среднее абсолютных значений отклонений точек данных от среднего. Эта величина соответствовала экспериментальному разбросу и составляла не более 3%. На графиках представлены значения в виде “среднее ± среднее отклонение”.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Показатели работы биореакторов. Добавление АИБ существенно повысило эффективность удаления аммонийного и суммарного минерального азота из биореактора (рис. 1, 2). На 4 сут концентрация аммонийного азота в очищенной воде в биореакторе с биоаугментацией АИБ снизилась на 40% по сравнению с поступающей на очистку водой (содержание N-NH4 ‒ 200 мг/л), против снижения на 14% в контрольном биореакторе.
Рис. 1.
Динамика концентраций аммония (а), нитритов (б) и нитратов (в) в очищенной воде в ходе функционирования контрольного анаммокс биореакто-ра (1) и биореактора с дополнительно внесенным АИБ (2).

Рис. 2.
Изменение количества удаленного минерального азота в ходе работы биореакторов: 1 – контроль; 2 – опыт.
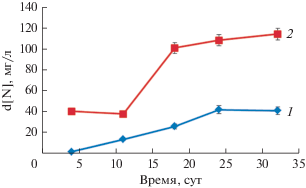
В контрольном реакторе заметное удаление азота было отмечено с 11 сут (7%), а в опытном – с 4-х сут, составив 20%. К концу эксперимента в контрольном реакторе удалялось 20% азота, а в опытном – почти 60%. Концентрация нитритов в контрольном и опытном биореакторах в первые 10 сут различалась незначительно, но затем в контрольном варианте она возросла до 70‒75 мг/л, тогда как в биореакторе с биоаугментацией упала до 10‒15 мг/л. Падение концентрации аммония и нитритов в сочетании с незначительной концентрацией нитратов (и отсутствии условий для денитрификации) свидетельствует об определяющей роли в балансе азота процесса первой стадии нитрификации и анаммокс-реакции.
Расчетные значения удельной активности анаммокс-бактерий, АОБ и НОБ приведены на рис. 3. Биоаугментация привела к возрастанию активности нитрификации в начале эксперимента. На 4 сут удельная активность АОБ в опытном варианте в 1.8 раза превышала активность в контроле. При этом активность анаммокс-бактерий в варианте с биоаугментацией на 4 сут была выше, чем в контроле, в 25 раз. Затем активность АНМ в биореакторах повышалась, однако даже на 32 сут удельная активность анаммокс-бактерий в опытном биореакторе в 2.7 раза превышала активность в контрольном биореакторе. Активность нитрификаторов второй группы, НОБ, в обоих реакторах была на порядок ниже, чем активность АОБ. В присутствии АИБ активность НОБ была выше, чем в контроле, в 5 раз на 4 сут работы реактора, после чего она быстро снизилась почти до нуля за 2.5 недели культивирования. В контрольном варианте активность этой группы бактерий достигла максимума на 11 сут культивирования, после чего также к 18 сут снизилась до нуля.
Рис. 3.
Удельная активность анаммокс-бактерий (АНБ) (а), аммоний-окисляющих бактерий (АОБ) (б) и нитрит-окисляющих бактерий (НОБ) (в) в биореакторе Анаммокс: 1 – контроль; 2 – опыт.

Состав микробных сообществ. Для описания состава микробных сообществ активных илах всего было определено 153 698 последовательностей вариабельных V3‒V4 фрагментов гена 16S рРНК. В результате кластеризации было получено 1383 ОТЕ (табл. S1 ). Индексы альфа-разнообразия указывают на высокое разнообразие микробных сообществ в исходных образцах активного ила (табл. 1). При этом в ходе работы биореакторов биоразнообразие как в контрольном биореакторе, так и в биореакторе с добавлением АИБ, снижалось и выравнивалось (табл. 1), что указывает на селекцию микробного сообщества в ходе работы биореакторов.
Таблица 1.
Индексы разнообразия микробных сообществ в анализированных образцах активного ила
| Длительность культивирования, сут | Образцы | Индексы разнообразия | |
|---|---|---|---|
| Chao1 | Shannon_e | ||
| 0 | АИА | 346 | 3.48 |
| АИБ | 839 | 4.49 | |
| 25 | АИ контрольного биореактора | 180.5 | 3.32 |
| АИ опытного биореактора | 213.6 | 3.43 | |
| 45 | АИ контрольного биореактора | 147.3 | 3.27 |
| АИ опытного биореактора | 194.3 | 3.25 | |
| 60 | АИ контрольного биореактора | 141.6 | 3.34 |
| АИ опытного биореактора | 168.4 | 3.34 | |
В исследуемых микробных сообществах были обнаружены ОТЕ относящиеся к 22 бактериальным филумам, определяемым в геномной таксономической системе GTDB (genome taxonomy database; Parks et al., 2018). Только семь из них являлись доминирующими и были представлены не менее чем 1% от всех последовательностей 16S рРНК хотя бы в одном из образцов активного ила (рис. 4). Доминирующими группами являлись представители филумов Proteobacteria, Chloroflexi, Bacteroidota, Actinobacteriota, Planctomycetota, Verrucomicrobiota, Spirochaetota, их суммарная доля в микробных сообществах составляла более 92%. В минорных количествах были детектированы представители Acidobacteriota, Armatimonadota, Bdellovibrionota, Cyanobacteria, Deinococcota, Dependentiae, Desulfobacterota, Firmicutes, Gemmatimonadota, Hydrogenedentes, Myxococcota, Patescibacteria, Sumerlaeota, Synergistota и WPS-2, при этом в процессе развития микробного сообщества их численность существенно не изменилась. Археи относились к филуму Halobacterota и были найдены только в АИБ, где их доля составляла менее 0.01%.
Рис. 4.
Относительная численность филумов бактерий в исследуемых образцах активного ила. АИА – активный ил контрольного анаммокс биореактора; АИ_Б – активный ил, содержащий нитрификаторы; АБ – активный ил “опытного” биореактора, в который был внесен АИ_Б. Число после названия образца указывает продолжительность работы биореактора в сутках.

По составу сообществ на уровне филумов существенно отличался АИБ, в котором доминировали представители Proteobacteria, к которому относятся нитрификаторы, а доли Chloroflexi и Planctomycetota были низкими. В остальных образцах активного ила составы микробных сообществ на уровне филумов были сходны (рис. 4).
Микроорганизмы, участвующих в удалении азота. В анализируемых образцах активного ила были выявлены нитрификаторы, относящиеся к родам Nitrosomonas (Otu8, Otu25, Otu359, Otu31 и др.) и Nitrosospira (в основном Otu2) филума Proteobacteria. Численность представителей Nitrosomonas в контрольных образцах АИА снижалась по ходу культивирования с 7 до 4.5%, а в биореакторе с добавлением АИБ, наоборот, выросла с 5 до 10%. Интересно отметить, что в самом АИБ среди нитрификаторов доминировали Nitrosospira (15.4%), которые отсутствовали в исходном АИА (рис. 5). После добавления АИБ в опытный биореактор в пропорции 1 : 100, доля представителей Nitrosospira (Otu2) в активном иле снизилась в 100 раз до 0.15%, а в ходе дальнейшего культивирования почти не изменялась (табл. S1 ).
Рис. 5.
Изменение долей нитрификаторов и анаммокс-бактерии в образцах активного ила. АИА – активный ил анаммокс биореактора; АИ_Б – биоагументирующий активный ил с нитрификаторами; АБ – активный ил анаммокс биореактора с добавлением биоагументирующего АИ. Цифрами под осью абсцисс указаны сутки культивирования.

Среди анаммокс-бактерий были обнаружены представител родов Ca. Brocadia (Otu48 и Otu67) и Ca. Jettenia (Otu371). Доля бактерий рода Ca. Brocadia была значительно выше и составляла 7.8%, при этом в ходе работы биореактора без добавления нитрификаторов она снижалась до 1.7%. В то же время в биореакторе с добавлением нитрификторов доля Ca. Brocadia сохранялась на прежнем уровне около 6.5%. Доля представителей Ca. Jettenia снизилась с 0.37 до 0.1% во всех образцах активного ила. Таким образом, процесс удаления азота в анаммокс-реакции, по-видимому, осуществляют бактерия рода Ca. Brocadia (Otu67), доля которой в биореакторе с добавлением нитрификаторов возросла до 5.5%. Otu67 относится к Ca. Brocadia fulgida (98.93% идентичности последовательности 16S рРНК), которые широко распространены в анаммокс-биореакторах. Второй основной филотип рода Ca. Brocadia, Otu48, относился к другому виду, Ca. Brocadia caroliensis, и его доля в ходе эксплуатации биореакторов снижалась.
Совместное присутствие и взаимное исключение ОТЕ. Различные функциональные характеристики микроорганизмов тесно связаны с их местообитаниями. Анализ присутствия основных групп организмов в разных микробных сообществах позволяет выявить закономерности взаимодействия между разными группами микроорганизмов. Мы провели сетевой анализ исследуемых микробных сообществ для выявления групп микроорганизмов, на которые внесение нитрифицирующих бактерий оказало наибольший эффект. Такой анализ был проведен для ОТЕ, доли которых составляли более 2% хотя бы в одном образце. Результаты сетевого анализа представлены на рис. 6. Видно, что Otu2, относящаяся к Nitrospira, присутствует вместе с Otu17 (Pedobacter) и Otu5 (некультивируемая Micavibrionales), которые доминирует в АИБ. Однако положительных связей Otu2 с микроорганизмами из АИА не обнаружено.
Рис. 6.
Сетевой анализ микробных взаимодействий, основанный на корреляционном анализе. Зеленым отмечена положительная корреляция, красным – взаимное исключение ОТЕ.

Стоит отметить, что присутствие анаммокс-бактерий Otu48 (Ca. Brocadia) коррелирует с наличием нитрификаторов Nitrosomonas (Otu8) и планктомицентов семейства Phycisphaeraceae (Otu50). В ходе эксплуатации анаммокс-биореактора их доля снижалась.
Таким образом, внесенный в микробное сообщество АИБ существенно повлиял на эффективность анаммокс-процесса, при этом присутствовавшие в АИБ нитрификаторы не смогли адаптироваться к условиям биореактора. Возможно, роль микроорганизмов-стимуляторов анаммокс-процесса играли бактерии-спутники, внесенные в составе АИБ.
Повышение эффективности удаления азота коррелировало с увеличением долей бактерий филумов Chloroflexi, Bacteroidetes, Leptospiraceae и Planctomycetes (табл. S1 ). Отрицательная корреляция наблюдалась с численностью Comamonas, Kapabacteria, Desulfuromonadia, Sorangiineae, Bdellovibrionia, Hyphomicrobium, Chitinophagales. Причина отрицательной корреляции может быть объяснена только для Bdellovibrionia, “хищных” бактерий, способных лизировать клетки других микроорганизмов. Для других бактерий функциональная связь не просматривается.
Еще одна группа микроорганизмов, внесение которых могло стимулировать удаление аммония, ‒ это бактерии АИБ, которые после внесения в биореактор сохранили или увеличили свою относительную численность. При этом в исходном АИА они отсутствовали или их доля была минимальной. Это Otu31 (Nitrosomonas), Otu125 Lacunisphaera, Otu118 (некультивированный планктомицет), Otu959 (Castellaniella_hirudinis), Otu66 (Castellaniella_ginsengisoli), Otu247 (Pedomicrobium), Otu383 (Sphingopyxis_sp.), Otu80 (Bordetella petrii), Otu1147 (Rhizobiales), Otu732 (Lacunisphaera), и Otu810 (Micavibrionales).
Отметим, что во всех проанализированных образцах активных илов доля нитрификаторов второй ступени, окисляющих нитрит, была низкой. Так, в АИБ содержалось по 0.01‒0.04% нитрификаторов этого типа ‒ Otu611 и Otu623 (Nitrobacter alkalicus), а также Otu853 (Nitrococcus sp.). Это согласуется с их низкой активностью (рис. 3). Таким образом, балансовый анализ минерального азота в биореакторах и молекулярно-биологические исследования позволяют заключить, что в исследованных микробных сообществах превращение соединений азота происходило главным образом по пути “первая стадия нитрификации‒Анаммокс-процесс”. Нитрификация второй стадии и гетеротрофная денитрификация были незначительными.
Биоаугментация обогащенным Nitrosospira микробным сообществом АИБ привела к быстрому (в течение нескольких часов‒суток) увеличению нитрификационной активности и анаммокс-активности, причем анаммокс-активность поддерживалась в дальнейшем на уровне, многократно превышающем уровень анаммокс-активности не биоаугментированного сообщества в контрольном биореакторе. Рост анаммокс-активности коррелировал с увеличением относительной численности Ca. Brocadia fulgida (Otu67).
Полученные нами результаты в целом подтвердили положительную мировую практику использования биоаугментации нитрификаторами. Однако обычно при биоаугментации биореакторов очистки сточных вод используют материал, полученный “на месте” и обогащенный микроорганизмами, характерными для активного ила данных очистных сооружений. В частности, среди нитрификаторов первой стадии в активных илах промышленных очистных сооружений доминирует Nitrosomonas (Agraval et al., 2018; Кевбрина и соавт., 2019), как группа, более активно окисляющая аммоний по сравнению со второй по распространенности группой, Nitrosospira (Dytczak et al., 2007). В настоящее время биоаугментация полученным “на месте” биоматериалом нашла применение на нескольких крупномасштабных сооружениях. На основе биоаугментации нитрифицирующими микроорганизмами активного ила основан процесс BABE, повышающий скорость нитрификации при очистке обогащенных аммонием сточных вод (Каллистова и соавт., 2016), реализован полномасштабный процесс деаммонификации в основном потоке на крупных очистных сооружениях Strass Waste Water Treatment Plant (Штрас, Австрия) (Cho et al., 2020).
В наших исследованиях для биоаугментации использовали сообщество, обогащенное менее распространенными в очистных сооружениях бактериями Nitrosospira, что привело к неожиданным результатам. Несмотря на скачок нитрификационной и анаммокс-активности, после биоаугментации в ходе последующей эксплуатации биореактора размножались преимущественно не Nitrosospira, а представители исходного сообщества, Nitrosomonas (Otu25 и Otu359). Возможной причиной этого явления служит исходно высокая активность внесенных нитрификаторов Nitrosospira, сразу обеспечившая анаммокс-бактерии субстратом (нитритом) и способствовавшая быстрому росту анаммокс-активности. Впоследствии Nitrosospira постепенно стала вытесняться более конкурентоспособными автохтонными нитрификаторами.
Список литературы
Каллистова А.Ю., Дорофеев А.Г., Николаев Ю.А., Козлов М.Н., Кевбрина М.В., Пименов Н.В. Роль анаммокс-бактерий в очистке сточных вод от соединений азота // Микробиология. 2016. Т. 85. С. 126–144.
Kallistova A.Y., Nikolaev Y.A., Pimenov N.V., Dorofeev A.G., Kozlov M.N., Kevbrina M.V. Role of anammox bacteria in removal of nitrogen compounds from wastewater // Microbiology (Moscow). 2016. V. 85. P. 140‒156.
Каллистова А.Ю., Николаев Ю.А., Марданов А.В., Берестовская Ю.Ю., Грачев В.А., Кострикина Н.А., Пелевина А.В., Равин Н.В., Пименов Н.В. Исследование формирования и развития АНАММОКС-биопленок методами световой, эпифлуоресцентной и электронной микроскопии // Микробиология. 2020. Т. 89. № 6. С. 700‒713.
Kallistova A.Y., Nikolaev Y.A., Berestovskaya Y.Y., Grachev V.A., Kostrikina N.A., Pelevina A.V., Pimenov N.V., Mardanov A.V., Ravin N.V. Investigation of formation and development of anammox biofilms by light, epifluorescence, and electron microscopy // Microbiology (Moscow). 2020. V. 89. P. 708‒719.
Кевбрина М.В., Дорофеев А.Г., Агарёв А.М., Козлов М.Н., Николаев Ю.А., Асеева В.Г. Анаммокс – перспективная технология удаления азота из сточных вод // Водоснабжение и санитарная техника. 2019. № 5. С. 28–35.
Agrawal S., Seuntjens D., Cocker P. D., Lackner S., Vlaeminck S. Success of mainstream partial nitritation/anammox demands integration of engineering, microbiome and modeling insights // Curr. Opin. Biotechnol. 2018. V. 50. P. 214–221.
Barberán A., Ramirez K.S., Leff J.W., Bradford M.A., Wall D.H., Fierer N. Why are some microbes more ubiquitous than others? Predicting the habitat breadth of soil bacteria // Ecol. Lett. 2014. V. 17. P. 794–802. https://doi.org/10.1111/ele.12282
Cho S., Kambey C., Nguyen V.K. Performance of anammox processes for wastewater treatment: a critical review on effects of operational conditions and environmental stresses // Water. 2020. V. 12. Art. 20. https://doi.org/10.3390/w12010020
Dosta J., Vila J., Sancho I., Basset N., Grifoll M., Mata-Álvarez J. Two-step partial nitritation/Anammox process in granulation reactors: start-up operation and microbial characterization // J. Environ. Manag. 2015. V. 164. P. 196–205.
Dytczak M.A., Londry K.L., Oleszkiewicz J.A. Activated sludge operational regime has significant impact on the type of nitrifying community and its nitrification rates // Water Res. 2008. V. 42. P. 2320–2328. https://doi.org/10.1016/j.watres.2007.12.018
Edgar R.C. Search and clustering orders of magnitude faster than BLAST // Bioinform. 2010. V. 26. P. 2460–2461.
Faust K., Raes J. CoNet app: inference of biological association networks using Cytoscape // F1000Res. 2016. V. 5. P. 1519. https://doi.org/10.12688/f1000research.9050.2
Frey B., Rime T., Phillips M., Stierli B., Hajdas I., Widmer F., Hartmann M. Microbial diversity in European alpine permafrost and active layers // FEMS Microbiol. Ecol. 2016. V. 92. Art. fiw018. https://doi.org/10.1093/femsec/fiw018
Herrero M., Stuckey D.C. Bioaugmentation and its application in wastewater treatment: a review // Chemosphere. 2015. V. 140. P. 119–128. https://doi.org/10.1016/j.chemosphere.2014.10.033
Izadi Parin, Izadi Parnian, Eldyasti A. Towards mainstream deammonification: comprehensive review on potential mainstream applications and developed sidestream technologies // J. Environ. Manag. 2021. V. 279. Art. 111615. https://doi.org/10.1016/j.jenvman.2020.111615
Jin R.C., Zhang Q.Q., Zhang Z.Z., Liu J.H., Yang B.E., Guo L.X., Wang H.Z. Bio-augmentation for mitigating the impact of transient oxytetracycline shock on anaerobic ammonium oxidation (ANAMMOX) performance // Bioresour. Technol. 2014. V. 192. P. 756–764.
Langfelder P., Horvath S. Fast R functions for robust correlations and hierarchical clustering // J. Stat. Softw. 2012. V. 46. Art. i11.
Lema J.M., Suarez S. (eds.). Innovative Wastewater Treatment and Resource Recovery Technologies: Impacts on Energy, Economy and Environment, IWA Publishing, 2017. https://doi.org/10.2166/9781780407876
Lotti T., Kleerebezem R., Lubello C., van Loosdrecht M.C.M. Physiological and kinetic characterization of a suspended cell anammox culture // Water Res. 2014. V. 60. P. 1–14.
Luo X., Bhattacharya C.B. Corporate social responsibility, customer satisfaction, and market value // J. Mark. 2006. V. 70. P. 1–18.
Ma B., Wang S., Zhang S., Li X., Bao P., Peng Y. Achieving nitritation and phosphorus removal in a continuous-flow anaerobic/oxic reactor through bio-augmentation // Bioresour. Technol. 2013. V. 139. P. 375‒378. https://doi.org/10.1016/j.biortech.2013.02.077
Magoc T., Salzberg S. FLASH: Fast length adjustment of short reads to improve genome assemblies // Bioinform. 2011. V. 27. P. 2957–2963.
Miao Y., Zhang L., Li B., Zhang Q., Wang S., Peng Y. Enhancing ammonium oxidizing bacteria activity was key to single-stage partial nitrification-anammox system treating low-strength sewage under intermittent aeration condition // Bioresour. Technol. 2017. V. 231. P. 36–44. https://doi.org/10.1016/j.biortech.2017.01.045
Ochs P., Martin B.D., Germain E., Stephenson T., van Loosdrecht M., Soares A. Ammonia removal from thermal hydrolysis dewatering liquors via three different deammonification technologies // Sci. Total. Environ. 2021. V. 755. Part 1. Art. 142684.
Parks D.H., Chuvochina M., Waite D.W., Rinke C., Skarshewski A., Chaumeil P.A., Hugenholtz P. A standardized bacterial taxonomy based on genome phylogeny substantially revises the tree of life // Nat. Biotechnol. 2018. V. 36. P. 996–1004.
Pedrouso A., Vázquez-Padín J.R., Crutchik D., Campos J.L. Application of Anammox-based processes in urban WWTPs: are we on the right track? // Processes. 2021. V. 9. Art. 1334. https://doi.org/10.3390/pr9081334
Raper E., Stephenson T., Anderson D.R., Fisherb R., Soares A. Industrial wastewater treatment through bioaugmentation // Proc. Saf. Environ. Prot. 2018. V. 118. P. 178–187. https://doi.org/10.1016/j.psep.2018.06.035
Rice E.W., Bridgewater L. (eds). Standard Methods for the Examination of Water and Wastewater. Washington, DC: American Public Health Association, American Water Works Association, Water Environment Federation, 2012. 724 p.
Rognes T., Flouri T., Nichols B., Quince C., Mahé F. VSEARCH: a versatile open source tool for metagenomics // PeerJ. 2016. October 18, e2584.
Salem S., Berends D.H.J.G., van der Roest H.F., van der Kuji R.J., van Loosdrecht M.C.M. Full-scale application of the BABE technology // Wat. Sci. Tech. 2003. V. 50. P. 87–96.
Salem S., Moussa M.S., van Loosdrecht M.C.M. Determination of the decay rate of nitrifying bacteria // Biotechnol. Bioeng. 2006. V. 94. P. 252–262. https://doi.org/10.1002/bit.20822
Shannon P., Markiel A., Ozier O., Baliga N.S., Wang J.T., Ramage D., Amin N., Schwikowski B., Ideker T. Cytoscape: a software environment for integrated models of biomolecular interaction networks // Genome Res. 2003. V. 13. P. 2498‒2504. https://doi.org/10.1101/gr.1239303
Shourjeh S.M., Kowal P., Lu X., Xie L., Drewnowski J. Development of strategies for AOB and NOB competition supported by mathematical modeling in terms of successful deammonification implementation for energy-efficient WWTPs // Processes. 2021. V. 9. Art. 562. https://doi.org/10.3390/pr9030562
Stenström F., la Cour Jansen J. Impact on nitrifiers of full-scale bioaugmentation // Water Sci. Technol. 2017. V. 76. P. 3079–3085. https://doi.org/10.2166/wst.2017.480
Tang H.L., Chen H. Nitrification at full-scale municipal wastewater treatment plants: evaluation of inhibition and bioaugmentation of nitrifiers // Bioresour. Technol. 2015. V. 190. P. 76–81.
Tchobanoglous G., Burton F.L., Stensel H.D. Wastewater Engineering: Treatment and Reuse / Metcalf and Eddy, M-cGraw Hill, N.Y., USA, 2014. 2044 p.
Trojanowicz K., Trela J., Plaza E. Possible mechanism of efficient mainstream partial nitritation/anammox (PN/A) in hybrid bioreactors (IFAS) // Environ. Technol. 2021. V. 42. P. 1023‒1037. https://doi.org/10.1080/09593330.2019.1650834
Wang Q., Song K., Hao X., Wei J., Pijuan M., van Loosdrecht M.C.M., Zhao H. Evaluating death and activity decay of Anammox bacteria during anaerobic and aerobic starvation // Chemosphere. 2018. V. 201. P. 25–31. https://doi.org/10.1016/j.chemosphere.2018.02
Wett B., Omari A., Podmirseg S., Han M., Akintayo O., Brandon M.G., Murthy S., Bott C., Hell M., Takacs I. Going for mainstream deammonification from bench to full scale for maximized resource efficiency // Water Sci. Technol. 2013. V. 68. P. 283–289.
Wett B., Podmirseg S.M., Gomez-Brandon M., Hell M., Nyhuis G., Bott C., Murthy S. Expanding DEMON sidestream deammonification technology towards mainstream application // Water Environ. Res. 2014. V. 87. P. 2084–2089.
Yang Y., Zhang L., Cheng J., Zhang S., Li X., Peng Y. Microbial community evolution in partial nitritation/anammox process: from sidestream to mainstream // Bioresour. Technol. 2018. V. 251. P. 327–333.
Zhang L., Zhang S.J., Gan Y.P., Peng Y.Z. Bio-augmentation to rapid realize partial nitrification of real sewage // Chemosphere. 2012. V. 88. P. 1097–1102.
Zhang Q., Vlaeminck S.E., DeBarbadillo C., Su C., Al-Omari A., Wett B., Pümpel T., Shaw A., Chandran K., Murthy S., De Clippeleira H. Supernatant organics from anaerobic digestion after thermal hydrolysis cause direct and/or diffusional activity loss for nitritation and anammox // Water Res. 2018. V. 143. P. 270–281.
Zhang Q.-Q., Yang G.-F., Sun K.-K., Tian G.-M., Jin R.-C. Insights into the effects of bio-augmentation on the granule-based anammox process under continuous oxytetracycline stress: performance and microflora structure // Chem. Engin. J. 2018. V. 348. P. 503–513. https://doi.org/10.1016/j.cej.2018.04.204
Дополнительные материалы
- скачать ESM.docx
- Таблица S1. Таксономический состав активных илов — Анаммокс, биоаугментирующего и составного (в опытном варианте)


