Микробиология, 2022, T. 91, № 2, стр. 217-225
Механизм антибактериального действия лантибиотика варнерина
В. П. Коробов a, Л. М. Лемкина a, Т. В. Полюдова a, *
a Институт экологии и генетики микроорганизмов УрО РАН ‒
филиал Пермского федерального исследовательского центра УрО РАН
614081 Пермь, Россия
* E-mail: poludova76@mail.ru
Поступила в редакцию 14.11.2021
После доработки 20.11.2021
Принята к публикации 21.11.2021
- EDN: VKOXAE
- DOI: 10.31857/S0026365622020070
Аннотация
Получены доказательства мембранотропной активности лантибиотика варнерина в отношении чувствительных к нему бактерий Staphylococcus cohnii ВКМ-3165. Атака варнерином приводит к усилению дыхательной активности бактерий и накоплению активных форм кислорода, способствующих гибели стафилококков. Под действием варнерина происходит диссипация трансмембранного электрохимического потенциала клеток, выход из них ионов калия и молекул АТФ. Рассеяние потенциала приводит к активации автолиза бактерий, зависимого от уровня электрической компоненты мембранного потенциала. Диссипация ΔΨ в присутствии калиевого переносчика валиномицина практически нивелирует активацию варнерином комплекса пептидогликангидролаз. Электронно-микроскопическое изучение нарушений внутренней структуры бактерий и сканирование поверхности атакованных варнерином клеток S. cohnii ВКМ-3165 подтверждают глубину и необратимость его поражающего действия.
Синтез антибактериальных соединений микроорганизмами является проявлением конкуренции и микробного антагонизма, как при межвидовых, так и внутривидовых взаимодействиях микробов при перекрывании их экологических ниш. Такие соединения могут способствовать передаче сигналов между микробными клетками и выполнять регуляторную роль в поддержании гомеостаза сообществ микроорганизмов (Abrudan et al., 2015; Heilbronner et al., 2021). Особый практический интерес представляют пептидные факторы микробного антагонизма, обладающие специфичностью выбора своих мишеней. Антимикробные пептиды состоят из 10‒50 аминокислотных остатков и способны подавлять развитие бактерий после успешного взаимодействия с их клеточными стенками и мембранами (Simons et al., 2020). Многочисленными исследованиями показана высокая перспектива использования антимикробных пептидов в качестве средств антибактериальной терапии. Действительно, низкомолекулярные пептиды являются потенциальными и перспективными кандидатами для создания эффективных антибактериальных препаратов, обладающих широким спектром антагонистической активности, включая бактерий антибиотикорезистентных штаммов (Кононова и соавт., 2017; Meade et al., 2020).
Пептиды класса лантибиотиков, продуцируемые грамположительными бактериями, обладают выраженной мембранотропной активностью (Bierbaum, Sahl, 2009). Первым охарактеризованным лантибиотиком является низин (Kaletta, Entian, 1989). Антибактериальная активность низина основана на подавлении синтеза пептидогликана посредством связывания с предшественником липида II клеточной стенки, а также на формировании пор в цитоплазматической мембране атакуемых клеток. Лантибиотики, продуцируемые стафилококками, ‒ галлидермин и эпидермин, также ингибируют синтез клеточной стенки, связываясь с липидом II, и рассеивают мембранный потенциал, подобно низину (Bonelli et al., 2006). Особым механизмом антибактериальной активности обладает нукацин ISK-1, который не формирует пор с рассеиванием мембранного потенциала клеток-мишеней, не влияет на их морфологию и состав цитоплазмы, однако останавливает рост планктонных клеток. При действии нукацина ISK-1 происходит значительное уменьшение толщины клеточной стенки, и нарушается синтез перегородки между двумя дочерними клетками (Asaduzzaman et al., 2009).
Лантибиотик варнерин, продуцируемый в среду роста бактериями Staphylococcus warneri KL-1 (DSM 16081) (Коробов и соавт., 2010), содержит в составе молекулы один остаток лантионина, два ‒ метиллантионина, семь остатков лизина, восемь гидрофобных и семь гидроксиаминокислот (Petersen et al., 2009). В результате посттрансляционных модификаций в зрелой молекуле варнерина появляются три внутримолекулярных лантиониновых кольца. В его структуре четко прослеживаются гидрофобные и положительно заряженные области, свидетельствующие о его амфифильной природе, характерной для пептидов класса лантибиотиков (Полюдова и соавт., 2017). Подобная структура антибактериальных пептидов, синтезируемых стафилококками, характерна для лантибиотиков типа А, в частности, для эпидермина и галлидермина (Götz et al., 2014), Рер 5 (Bierbaum et al., 1996), нукацинов ISK-1 и KQU-131 (Asaduzzaman et al., 2009). Лантибиотики типа А проявляют свою активность путем нарушения барьерной функции цитоплазматической мембраны чувствительных к ним бактерий, что приводит к быстрому вытеканию из клетки низкомолекулярных соединений, таких как ионы, аминокислоты и АТФ, падению мембранного потенциала и полному прекращению биосинтеза ДНК и РНК (Bierbaum, Sahl, 2009).
Целью данной работы явилось комплексное изучение антибактериальных эффектов лантибиотика варнерина, молекулы которого проявляют различные механизмы антибактериального действия на бактерии высокочувствительного к нему штамма коагулазонегативных стафилококков S. cohnii ВКМ-3165.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В работе использовали бактерии S. cohnii ВКМ-3165. Тест-культуру выращивали до середины лог-фазы на жидкой среде Luria Bertani (LB), содержащей (г/л): триптон – 10; дрожжевой экстракт – 5; KCl – 6.4. Для определения антибактериальной активности варнерина использовали жидкую среду Muller-Hinton (МН).
Варнерин был выделен из среды роста бактерий S. warneri KL-1 (DSM 16081) (Коробов и соавт., 2010). В экспериментах использовали растворы варнерина, содержащие 1 мг/мл в 10 мМ фосфатном буфере, рН 7.2 (PBS).
Минимальную подавляющую концентрацию (МПК) варнерина определяли методом двукратных разведений в среде МН в стерильных полистироловых планшетах (“Медполимер”, Россия). В качестве инокулума использовали суспензии бактерий S. cohnii ВКМ-3165 логарифмической стадии роста, содержащие 106 КОЕ/мл. Планшеты инкубировали при 37°С в течение 16‒18 ч. За МПК варнерина принимали его минимальную концентрацию, при которой не обнаруживалось заметного невооруженным глазом роста тест-бактерий.
Интенсивность дыхания бактерий S. cohnii ВКМ-3165 в присутствии варнерина исследовали на 6-канальном респирометре Micro-Oxymax® (“Columbus Instruments”, США). Скорость потребляемого О2 (нМ/мин) регистрировали автоматически каждые 5 мин и пересчитывали на количество колониеобразующих единиц (КОЕ), которое определяли методом десятичных разведений с их высевом на LB агар.
Чувствительность компонентов мембранного потенциала к варнерину оценивали на бактериях S. cohnii, предварительно проинкубированных в 5 мкМ растворе потенциал-зависимого индикатора 3,3'-дипропилтиадикарбоцианин-йодида (DiSC3(5)) (“Sigma”, США) в течение 60 мин при 37°С. Инкубацию бактерий проводили в 96-луночных светонепроницаемых планшетах для флуорометрических исследований (Fluotrac 200, “Greiner Bio-One”, Германия). Для этого к 100 мкл бактериальной суспензии в PBS добавляли по 10 мкл растворов варнерина различной концентрации (1, 2.5 и 5 мг/мл), валиномицина (0.1 мкМ) или нигерицина (0.1 мкМ); флуоресценцию детектировали каждые 5 мин при 690 нм (возбуждение 622 нм) на флуориметре (“Tecan”, Австрия).
Выход ионов калия из клеток стафилококков под действием варнерина определяли в образцах бесклеточной среды инкубации бактерий, полученной после воздействия варнерина и центрифугирования при 12 000 g в течение 3 мин (Centrifuge 5415 R, “Eppendorf”, Германия). Концентрацию ионов калия определяли на атомно-абсорбционном спектрометре AA-6300 (“Shimadzu”, Япония).
Выход АТФ из бактерий при действии варнерина исследовали с использованием набора Lucifer-HS ATP (“Sigma-Aldrich”, США). Для этого 2 мл водного раствора варнерина добавляли в пробирки с 2 мл стандартизированной культуры S. cohnii ВКМ-3165 (108 КОЕ/мл). Ежеминутно отбирали аликвоты по 200 мкл, к которым добавляли 10 мкл раствора люциферин-люциферазы. Биолюминесценцию измеряли с помощью флуориметра Qubit (“Invitrogen”, США).
Для детекции образования гидроксильных радикалов в суспензию отмытых тест-бактерий (108 КОЕ/мл) вносили раствор п-гидроксифенил-флуоресцеина (Hydroxyphenyl fluorescein, HPF) (“Sigma-Aldrich”, США) до концентрации 5 мкМ и инкубировали на шейкере при 37°С в течение 4 ч. Затем клетки дважды отмывали PBS от люминофора и восстанавливали в исходном объеме PBS. Суспензию подготовленных бактерий вносили в светонепроницаемые планшеты по 100 мкл в лунку и добавляли 10 мкл раствора варнерина до концентрации 0.1 мг/мл. Динамику флуоресценции детектировали каждые 5 мин при 530 нм (длина волны возбуждения 495 нм) на флуориметре (“Tecan”, Австрия).
Подавление реакции Фентона достигали введением в среду MH 1 мМ хелатора ионов железа 2,2'-дипиридила (“Sigma-Aldrich”, США), который вносили по 50 мкл в лунки планшета, содержащие по 50 мкл среды МН с двукратными разведениями варнерина. Затем в лунки добавляли по 10 мкл суспензии клеток S. cohnii ВКМ-3165 (106 КОЕ/мл). Инкубацию проводили при 37°С в течение 16‒18 ч. Аналогично исследовали влияние “тушения” внутриклеточных гидроксильных радикалов растворами тиомочевины при концентрациях 75‒600 мМ. По окончании инкубации оценивали МПК варнерина в присутствии указанных соединений.
Активацию бактериолизиса S. cohnii ВКМ-3165 варнерином оценивали по изменению оптической плотности бактериальной суспензии при λ = 600 нм (ОП600) на фотометре PD-303 (“Apel”, Япония) PBS. Для изучения спектра аутолизинов в бесклеточной среде инкубации бактерий проводили ренатурируемый электрофорез в ПААГ (Коробов и соавт., 2010).
Для проведения микроскопии клетки S. cohnii ВКМ-3165 после инкубации с варнерином стабилизировали 2.5% глутаровым альдегидом в течение 2 ч при 4°С, затем осаждали при 12 000 g в течение 5 мин. Осадки дважды промывали деионизованной водой и суспендировали в ней. Суспензии наносили на поверхность покровного стекла (24 × 50 × × 0.18 мм; “МиниМед”, Россия), высушивали на воздухе и исследовали на атомно-силовом микроскопе Dimension Icon (“Veeco”, США). Использовали зонды NSG01 (“NT-MDT”, Россия) с номинальным радиусом острия 10 нм и жесткостью кантилевера ~7 Н/м. Оценку результатов экспериментов проводили в режиме наномеханического картирования с наноиндентацией поверхности в каждой точке рельефа с частотой 2 кГц. Для каждой поверхности получали по три изображения размером 20 × 20 мкм с разрешением 512 × 512 точек в плоскости XY. Обработку полученных изображений и данных проводили с помощью программного обеспечения Nanoscope (“Bruker”, США).
Для получения ультратонких срезов бактерии после фиксации в глутаровом альдегиде и промывки фиксировали в 1.5% растворе OsO4, приготовленном в 0.1 М фосфатном буфере (pH 7.2‒7.4) в течение 10 ч при 4°С. Затем обезвоживали этанолом в восходящих концентрациях: 30, 50, 70, 96% и дважды в абсолютном ацетоне. В каждом из растворов объекты выдерживали в течение 15 мин, затем центрифугировали, осадок заливали следующим раствором. Заливочную смесь готовили из эпоксидных смол: аралдит М (20 мл) + DDSA (додеценилянтарный ангидрид) (22 мл). Образцы обезвоженного материала суспендировали в абсолютном ацетоне и заливочной смоле по схеме: ацетон‒заливочная смесь (3 : 1) в течение 5 ч; ацетон‒заливочная смесь (2 : 1) следующие 5 ч; ацетон‒заливочная смесь (1 : 1) в течение 1 ч. После испарения ацетона взвесь клеток центрифугировали, а надосадочную смолу удаляли. К 1 мл ранее приготовленной заливочной смеси добавляли 18 мкл катализатора DMP-30 и заливали этим раствором осадок подготовленных бактерий. Полимеризацию образцов осуществляли при 60°С в течение трех суток. Срезы получали на ультрамикротоме EM UC7 (“Leica”, Австрия). Микроскопию срезов проводили на просвечивающем электронном микроскопе BS 700 (“TESLA”, Чехословакия).
Все исследования были проведены в 3‒5-кратной повторности. Результаты представлены средними значениями величин. Статистический анализ проводили с использованием пакета анализа Microsoft Exсel 2010, доверительные интервалы рассчитывали с критерием вероятности р = 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее было показано, что варнерин имеет высокое сродство к поверхностям чувствительных к нему клеток стафилококков, связываясь с ними в первые секунды взаимодействия (Коробов и соавт., 2010). Катионные области молекулы варнерина, обусловленные остатками лизина, электростатически связываются с анионными сайтами тейхоевых кислот клеточной стенки стафилококков. При этом гибель атакованных бактериальных клеток происходила уже в первые минуты действия варнерина, и одновременно снижалось общее количество потребляемого бактериальной суспензией кислорода (рис. 1а). Однако расчет удельного потребления кислорода для оставшейся части живых бактерий свидетельствует о резком усилении их дыхательной активности (рис. 1б). Вместе с тем активация дыхания, вероятнее всего, не была связана с синтезом АТФ, поскольку его уровень в клетках стремительно падал (рис. 2). Дыхание бактерий в присутствии варнерина представляет собой бесполезный протонный цикл, который может способствовать накоплению активных форм кислорода (АФК) в клетках (Lobritz et al., 2015). Интересно, что ингибирование АТФазы у эукариот действительно приводит к увеличению продукции АФК (Formentini et al., 2012), что может иметь место и у бактерий. Также известно, что аэробный метаболизм является фактором, усиливающим летальное действие бактерицидных антибиотиков, тогда как строго анаэробные условия снижают гибель бактерий от бактерицидно действующих антибиотиков (Dwyer et al., 2014; Lobritz et al., 2015).
Рис. 1.
Изменение количества бактерий S. cohnii ВКМ-3165 и суммарного потребления кислорода под действием варнерина: 1 – потребление О2; 2 – количество КОЕ/мл.

При развитии эффектов варнерина, также наблюдалось увеличение внутриклеточной концентрации гидроксильных радикалов, регистрируемое активацией флуоресценции гидроксифенилфлуоресцеина (HPF) – специфического индикатора активных форм кислорода. Так, при внесении варнерина к клеткам S. cohnii, предварительно насыщенным HPF, интенсивность флуоресценции увеличивалась примерно в 10 раз по сравнению с контролем, начиная с первой минуты взаимодействия (рис. 3). Известно, что появление радикала гидроксила в живых системах происходит в результате реакции Фентона. Этот короткоживущий радикал, нарушая структуру биополимеров, способствует гибели клеток, усиливая антибактериальный эффект варнерина. Так, при подавлении реакции Фентона путем добавления хелатора двухвалентных ионов железа 5',5'-дипиридила происходит существенное увеличение МПК варнерина для атакуемых бактерий (табл. 1). Косвенное подтверждение эффектов гидроксильных радикалов получено и при внесении в среду действия варнерина тиомочевины – гасителя свободных радикалов (Wasil et al., 1987), наличие которой также приводило к возрастанию МПК на три порядка. Таким образом, формирование и токсическое действие свободных радикалов играет существенную роль в реализации антибактериального эффекта варнерина.
Рис. 3.
Изменение флуоресценции HPF при действии варнерина на клетки S. cohnii ВКМ-3165: 1 – в присутствии варнерина; 2 – клетки без варнерина.

Таблица 1.
Минимальная подавляющая концентрация (МПК) варнерина для бактерий S. cohnii ВКМ-3165 в присутствии соединений, ингибирующих формирование свободных радикалов
| Среда инкубации | МПК, мкг/мл |
|---|---|
| МН | 0.25 |
| МН с 0.5 мМ 5',5'-дипиридила | 256.00 |
| МН с 75 мМ тиомочевины | 128.00 |
| МН с 150 мМ тиомочевины | 256.00 |
Мембранотропная активность варнерина на бактерии S. cohnii была показана и в экспериментах с чувствительным к потенциалу флуоресцентным красителем (DiSC3(5)). При внесении варнерина в суспензию стафилококков, клетки которых были предварительно насыщены DiSC3(5), происходило резкое возрастание флуоресценции, усиливающееся в течение 5 мин, а далее наблюдалась ее стабилизация (рис. 4). Добавление ионофоров (валиномицина и нигерицина) в среду инкубации стафилококков с максимальным количеством варнерина не вызывало дополнительного свечения красителя, что свидетельствовало о полном рассеянии как электрической, так и протонной составляющих мембранного потенциала клеток при действии варнерина (данные не показаны). Одновременно наблюдался интенсивный выход калия из атакованных клеток S. cohnii. Максимальное количество ионов K+ в среде наблюдалось уже через 2 мин действия варнерина (рис. 5). Таким образом, атака S. cohnii варнерином приводит к быстрой гибели бактерий за счет рассеяния трансмембранного потенциала и формирования нерегулируемых каналов, через которые происходит утечка ионов и молекул АТФ. Усиление удельного базального дыхания оставшейся части популяции стимулирует выработку АФК, усиливающих бактерицидный эффект лантибиотика.
Рис. 4.
Выход DiSC3(5) из клеток S. cohnii ВКМ-3165 под действием варнерина. Стрелкой указан момент внесения варнерина. Концентрации варнерина (мг/мл): 1 – 0.1; 2 – 0.25; 3 – 0.5.
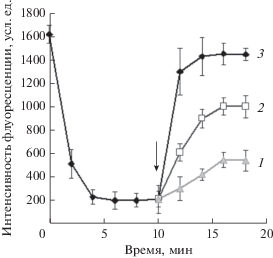
Рис. 5.
Выход ионов калия из клеток S. cohnii ВКМ-3165: 1 – под действием варнерина; 2 – контроль (без варнерина).

Выявленные механизмы развития бактерицидного действия варнерина приводят к лизису атакуемых бактерий. Так, при инкубации тест-бактерий в PSB с добавлением варнерина наблюдалось резкое снижение оптической плотности бактериальных суспензий (рис. 6). Вместе с тем, внесение варнерина к убитым нагреванием клеткам S. cohnii не приводило к их разрушению, что свидетельствует об отсутствии у варнерина пептидогликангидролазной активности. Энзимографические исследования среды инкубации клеток после действия варнерина показали, что он способствовал выходу автолизинов из клеточных стенок бактерий (рис. 7).
Рис. 6.
Изменение оптической плотности суспензии S. сohnii ВКМ-3165 в присутствии варнерина: 1 ‒ живые бактерии; 2 – действие варнерина на бактерии, убитые нагреванием; 3 – действие варнерина на живые бактерии.

Рис. 7.
Энзимограмма лизатов S. сohnii ВКМ-3165: 1 ‒ полученных после действия варнерина; 2 – после одновременного воздействия варнерина и валиномицина; 3 – после действия валиномицина.

В работе Kemper et al. (1993) показано, что диссипация мембранного электрохимического потенциала оказывает влияние на проявление активности бактериальных автолизинов. Электрофизиологическое состояние клеточной мембраны бактерий является важным фактором в регуляции автолиза клеточной стенки. Показано, что разобщители окислительного фосфорилирования и ингибиторы дыхания индуцируют быстрый лизис Bacillus subtilis (Penyige et al., 2002). Однако одной деполяризации ΔΨ недостаточно для активации массивного автолиза. Диссипация ΔΨ трансмембранного потенциала внесением в среду инкубации клеток валиномицина приводит к ингибированию автолиза в присутствии варнерина и активации лишь незначительного спектра автолизинов. Так, из представленных на рис. 7 данных видно, что активность и гетерогенность пептидогликангидролаз S. сohnii ВКМ-3165, активированных в присутствии калиевого ионофора валиномицина, выражены в значительно меньшей степени.
Ранее нами было показано, что бактерии стационарной фазы роста и при пониженной температуре характеризуются большей устойчивостью к действию варнерина (Коробов и соавт., 2005), что, вероятно, связано со снижением трансмембранного потенциала из-за ослабления энергогенерирующих и респираторных процессов в указанных условиях (Shimoda et al., 1995). Кроме того, предварительная экспозиция клеток-мишеней с ионофорами приводит к существенному снижению их чувствительности к варнерину, особенно после снятия электрической компоненты трансмембранного потенциала (ΔΨ) валиномицином (Коробов и соавт., 2005).
Известно, что основным фактором сдерживания аутолитических процессов клеток стафилококков является “иммобилизация” автолизинов анионными молекулами тейхоевых и липотейхоевых кислот (Biswas et al., 2012). Диссоциация таких комплексов приводит к индукции литического расщепления полимеров бактериальных стенок (Коробов и соавт., 2010). Связь автолизинов с тейхоевыми кислотами регулируется протонным трансмембранным градиентом, который вызывает локальное закисление, ингибирующее активность автолизинов (Biswas et al., 2012). Эти данные позволяют считать, что бактериолитическое действие варнерина не связано непосредственно с активацией лантибиотиком автолизинов, несмотря на схожесть его действия с детергентом Тритоном X-100 (Коробов и соавт., 2010). Вероятно, лизис стафилококков в присутствии варнерина является следствием резкого снижения электрохимического градиента. Нарушение транспорта протонов в цитоплазматической мембране может приводить к локальным изменениям значения рН, регулирующего активность автолизинов (Biswas et al., 2012). Активация автолиза бактерий посредством нарушения трансмембранного потенциала показана для многих антимикробных пептидов, лантибиотиков и антибиотиков (Bierbaum, Sahl, 1985, Penyige et al., 2002; Lacriola et al., 2013; Danevсiс et al., 2016; Yasir et al., 2019).
Комбинированный эффект деполяризации мембранного потенциала, накопление АФК, формирование крупных нерегулируемых каналов, способствующих выходу АТФ из клетки, позволяют варнерину быть мощным бактерицидным антибиотиком, фатальное действие которого наглядно демонстрируют изображения, полученные при электронной микроскопии (рис. 8). Так, действие варнерина уже через 30 мин приводило к заметным изменениям в структуре клеток, нарушая мембраны, преимущественно в местах закладки и роста перегородок (рис. 8а). Внутриклеточное содержимое характеризовалось появлением гомогенных областей неправильной формы, имеющих примембранное расположение и отличающихся от остальной части клеток своей плотностью. При этом наблюдалось заметное уменьшение толщины клеточных стенок. Через 2 ч действия варнерина в препаратах обнаруживались связанные с мембраной крупные везикулы, занимающие до одной трети среза клеток – зоны клазматоза, а также многочисленные участки нарушения целостности мембраны. Важно отметить, что все обнаруженные к этому времени структуры, по существу, напоминали фантомы клеток с полным отсутствием клеточных оболочек.
Рис. 8.
Электронная (а) и атомно-силовая (б) микроскопия клеток S. сohnii ВКМ-3165. 1 – контроль; 2 – действие варнерина 30 мин; 3 – действие варнерина 60 мин; 4 – действие варнерина 120 мин. Масштабная метка: а ‒ 1 мкм; б ‒ 0.5 мкм.

Картина структурных нарушений бактерий, подвергнутых атаке варнерином, дополнена профилометрией их поверхности (рис. 8б). При возрастании времени действия варнерина обнаруживается явная тенденция “сглаживания” поверхности клеток, что отражает тотальный лизис пептидогликанового слоя клеточных стенок.
Результаты настоящего исследования демонстрируют выраженную бактерицидную активность варнерина в отношении бактерий S сohnii ВКМ-3165. Лантибиотик нарушает функции цитоплазматической мембраны и увеличивает ее проницаемость. Полученные результаты свидетельствуют о том, что бактериолитическая активность варнерина во многом обусловлена индукцией автолизинов, сравнимой по своей активности с Тритоном X-100. Поскольку варнерин действует как активатор образования АФК, разобщитель протонного транспорта и синтеза АТФ, он идеально подходит для подавления нежелательной грамположительной микрофлоры.
Список литературы
Кононова Л.И., Филатова Л.Б., Ерошенко Д.В., Коробов В.П. Подавление развития резистентных к ванкомицину бактерий Staphylococcus epidermidis низкомолекулярными катионными пептидами семейства лантибиотиков // Микробиология. 2017. Т. 86. С. 564‒577.
Kononova L.I., Filatova L.B., Eroshenko D.V., Korobov V.P. Suppression of development of vancomicin-resistant Staphylococcus epidermidis by low-molecular-weight cationic peptides of the lantibiotic family // Microbiology (Moscow). 2017. V. 86. P. 571‒582.
Коробов В.П., Титова А.В., Лемкина Л.М., Полюдова Т.В. Зависимость антибактериального эффекта поликатионного пептида варнерина от энергетического состояния клетки-мишени // Микробиология. 2005. Т. 74. С. 166‒171.
Korobov V.P., Titova A.V., Lemkina L.M., Polyudova T.V., Pan’kova N.V. The dependence of the antibacterial effect of the polycationic peptide warnerin on the energy state target cells // Microbiology (Moscow). 2005. V. 74. P. 136‒140.
Коробов В.П., Полюдова Т.В., Филатова Л.Б., Лемкина Л.М., Панькова Н.В. Активация аутолитической активности бактерий Staphylococcus epidermidis 33 низкомолекулярным катионным пептидом варнерином // Микробиология. 2010. Т. 79. С. 133‒135.
Korobov V.P., Polyudova T.V., Filatova L.B., Lemkina L.M., Pan’kova N.V. Activation of autolytic activity of Staphylococcus epidermidis 33 by a low-molecular-weight cationic peptides warnerin // Microbiology (Moscow). 2010. V. 79. P. 125‒127.
Коробов В.П., Лемкина Л.М., Полюдова Т.В., Акименко В.К. Выделение и характеристика нового низкомолекулярного антибактериального пептида семейства лантибиотиков // Микробиология. 2010. Т. 79. С. 228‒238.
Korobov V.P., Lemkina L.M., Polyudova T.V., Akimenko V.K. Isolation and characterization of a new low-molecular antibacterial peptide of the lantibiotics family // Microbiology (Moscow). 2010. V. 79. P. 206‒215.
Полюдова Т.В., Коробов В.П., Лихацкая Г.Н., Лемкина Л.М. Оптимизация условий получения и моделирование 3D-cтруктуры нового антибактериального пептида семейства лантибиотиков // Прикл. биохимия и микробиология. 2017. Т. 53. С. 47‒54.
Polyudova T.V., Lemkina L.M., Korobov V.P., Likhatskaya G.N. Optimization of production conditions and 3D-structure modeling of novel antibacterial peptide of lantibiotic family // Appl. Biochem. Microbiol. 2017. V. 53. P. 40‒46.
Abrudan M.I., Smakman F., Grimbergen A.J., Westhoff S., Miller E.L., Wezel G.P., Rozen D.E. Socially mediated induction and suppression of antibiosis during bacterial coexistence // Proc. Natl. Acad. Sci. USA. 2015. V. 112. P. 11054‒11059.
Asaduzzaman S.M., Nagao J., Iida H., Zendo T., Nakayama J., Sonomoto K. Nukacin ISK-1, a bacteriostatic lantibiotic // Antimicrob. Agents Chemother. 2009. V. 53. P. 3595–3598.
Bierbaum G., Sahl H.G. Induction of autolysis of staphylococci by the basic peptide antibiotics Pep 5 and nisin and their influence on the activity of autolytic enzymes // Arch. Microbiol. 1985. V. 141. P. 249‒254.
Bierbaum G., Szekat C., Josten M., Heidrich C., Kempter C., Jung G., Sahl H.G. Engineering of a novel thioether bridge and role of modified residues in the lantibiotic Pep5 // Ap-pl. Environ. Microbiol. 1996. V. 62. P. 385‒392.
Bierbaum G., Sahl H.G. Lantibiotics: mode of action, biosynthesis and bio-engineering // Curr. Pharm. Biotechnol. 2009. V. 10. P. 2‒18.
Biswas R., Martinez R.E., Göhring N., Schlag M., Josten M., Xia G., Hegler F., Gekeler C., Gleske A.K., Götz F., Sahl H.G., Kappler A., Peschel A. Proton-binding capacity of Staphylococcus aureus wall teichoic acid and its role in controlling autolysin activity // PLoS One. 2012. V. 7. Art. e41415.
Bonelli R.R., Schneider T., Sahl H.G., Wiedemann I. Insights into in vivo activities of lantibiotics from gallidermin and epidermin mode-of-action studies // Antimicrob. Agents Chemother. 2006. V. 50. P. 1449‒1457.
Dwyer D.J., Belenky P.A., Yang J.H., MacDonald I.C., Martell J.D., Takahashi N., Chan C.T.Y., Lobritz M.A., Braff D., Schwarz E.G., Ye J.D., Pati M., Vercruysse M., Ralifo P.S., Allison K.R., Khalil A.S., Ting A.Y., Walker G.C., Collins J.J. Antibiotics induce redox-related physiological alterations as part of their lethality // Proc. Natl. Acad. Sci. USA. 2014. V. 111. P. 2100‒2109.
Danevcic T., Boric Vezjak M., Tabor M., Zorec M., Stopar D. Prodigiosin induces autolysins in actively grown Bacillus subtilis cells // Front. Microbiol. 2016. V. 7. Art. 27.
Formentini L., Sanchez-Arago M., Sanchez-Cenizo L., Cuezva J.M. The mitochondrial ATPase inhibitory factor 1 triggers a ROS-mediated retrograde prosurvival and proliferative response // Mol. Cell. 2012. V. 45. P. 731‒742.
Götz F., Perconti S., Popella P., Werner R., Schlag M. Epidermin and gallidermin: Staphylococcal lantibiotics // Int. J. Med. Microbiol. 2014. V. 304. P. 63‒71.
Heilbronner S., Krismer B., Brötz-Oesterhelt H., Peschel A. The microbiome-shaping roles of bacteriocins // Nat. Rev. Microbiol. 2021. V. 19. P. 726‒739.
Kaletta C., Entian K.D. Nisin, a peptide antibiotic: cloning and sequencing of the nisA gene and posttranslational processing of its peptide product // J. Bacteriol. 1989. V. 171. P. 1597‒1601.
Kemper M.A., Urrutia M.M., Beveridge T.J., Koch A.L., Doyle R.J. Proton motive force may regulate cell wall-associated enzymes of Bacillus subtilis // J. Bacteriol. 1993. V. 175. P. 5690‒5696.
Lacriola C.J., Falk S.P., Weisblum B. Screen for agents that induce autolysis in Bacillus subtilis // Antimicrob. Agents Chemother. 2013. V. 57. P. 229‒234.
Lobritz M.A., Belenky P., Porter C.B., Gutierrez A., Yang J.H., Schwarz E.G., Dwyer D.J., Khalil A.S., Collins J.J. Antibiotic efficacy is linked to bacterial cellular respiration // Proc. Natl. Acad. Sci. USA. 2015. V. 112. P. 8173‒8180.
Meade E., Slattery M.A., Garvey M. Bacteriocins, potent antimicrobial peptides and the fight against multi drug resistant species: resistance is futile? // Antibiotics (Basel). 2020. V. 9. Art. 32.
Penyige A., Matkó J., Deák E., Bodnár A., Barabás G. Depolarization of the membrane potential by β-Lactams as a signal to induce autolysis // Biochem. Biophys. Res. Com. 2002. V. 290. P. 1169‒1175.
Petersen J., Boysen A., Fogh L., Tabermann K., Kofoed T., King A., Schrotz-King P., Hansen C.M. Identification and characterization of a bioactive lantibiotic produced by Staphylococcus warneri // Biol. Chem. 2009. V. 390. P. 437‒444.
Shimoda M., Ohk K., Shimamoto Y., Kohashi O. Morphology of defensin-treated Staphylococcus aureus // Infect. Immun. 1995. V. 63. P. 2886‒2891.
Simons A., Alhanout K., Duval R.E. Bacteriocins, antimicrobial peptides from bacterial origin: overview of their biology and their impact against multidrug-resistant bacteria // Microorganisms. 2020. V. 8. Art. 639.
Wasil M., Halliwell B., Grootveld M., Moorhouse C.P., Hutchison D.C., Baum H. The specificity of thiourea, dimethylthiourea and dimethyl sulphoxide as scavengers of hydroxyl radicals. Their protection of alpha 1-antiproteinase against inactivation by hypochlorous acid // Biochem. J. 1987. V. 243. P. 867‒870.
Yasir M., Dutta D., Willcox M.D.P. Mode of action of the antimicrobial peptide Mel4 is independent of Staphylococcus aureus cell membrane permeability // PLoS One. 2019. V. 14. Art. e0215703.
Дополнительные материалы отсутствуют.



