Микробиология, 2022, T. 91, № 2, стр. 204-216
Характеристика нового ростостимулирующего штамма Advenella kashmirensis IB-K1 и оценка эффективности его применения в условиях засоления почвы
Л. Ю. Кузьмина a, *, Е. А. Гильванова a, Н. Ф. Галимзянова a, Т. Н. Архипова a, А. С. Рябова a, Г. Э. Актуганов a, Л. В. Сидорова a, Г. Р. Кудоярова a, А. И. Мелентьев a
a Уфимский Институт биологии – обособленное структурное подразделение
Федерального государственного бюджетного научного учреждения Уфимского федерального
исследовательского центра Российской академии наук
450054 Уфа, Россия
* E-mail: ljkuz@anrb.ru
Поступила в редакцию 28.09.2021
После доработки 22.11.2021
Принята к публикации 23.11.2021
- EDN: PRKGPK
- DOI: 10.31857/S0026365622020094
Аннотация
Из грунта афотической зоны пещеры Киндерлинская (Южный Урал, Россия) выделен штамм IB-K1 факультативных хемолитотрофных бактерий, отнесенный к виду Advenella kashmirensis на основе оценки комплекса фенотипических свойств и анализа фрагмента гена 16S рРНК (последовательность гена 16S рРНК (1446 п.о.) штамма IB-K1 депонирована в GenBank NCBI под номером OK336511). Новый изолят обнаруживал сходство с типовым штаммом вида A. kashmirensis WT 001 по способности использовать тиосульфат в качестве источника энергии и расти в присутствии 7% NaCl. В экспериментах in vitro штамм IB-K1 активно растворял труднодоступные органические и минеральные формы фосфора (индексы солюбилизации фитина и ортофосфата кальция 7 и 5 соответственно). Штамм A. kashmirensis IB-K1 проявлял высокую активность щелочной и кислой фосфатазы. СЭМ-анализ корневой системы бактеризованной пшеницы на стадии 4-сут проростков выявил колонизацию клетками A. kashmirensis IB-К1 поверхности ризопланы в зоне всасывания. Основной механизм ростостимулирующего действия штамма IB-K1 связан, по-видимому, с его фосфат-мобилизующей активностью и способностью к продукции (до 220 ± 42 нг/мл) индолилуксусной кислоты (ИУК). Предпосевная обработка семян пшеницы Triticum durum Desf. штаммом A. kashmirensis IB-K1 достоверно снижала негативное влияние солевого стресса на развитие растений при среднем уровне засоления пахотной почвы (содержание водорастворимых солей 0.33 ± 0.06%), что выражалось в улучшении некоторых показателей структуры урожая и повышении продуктивности. Полученные результаты впервые демонстрируют возможность применения представителей рода Advenella для защиты и стимуляции роста сельскохозяйственных растений в условиях солевого стресса.
В настоящее время в сельском хозяйстве из-за поливного земледелия и аридизации климата обострилась проблема засоления пахотных почв. Применение ростостимулирующих микроорганизмов (PGPR) позволяет увеличить устойчивость растений к солевому стрессу (Емцев и соавт., 2010; Numan et al., 2018; Chu et al., 2019). В качестве основного механизма защитного и ростостимулирующего действия PGP-бактерий в условиях солевого стресса рассматривается индукция повышенного синтеза различных групп фитогормонов, ферментов актиоксидантной системы, пирролохинолинхинола (PQQ) и специфических протекторных молекул (Alavi et al., 2013; Egamberdieva et al., 2017; Numan et al., 2018). Защитный эффект PGPR может проявляться через активацию процессов фотосинтеза и поддержания ионного гомеостаза за счет усиления поглощения ионов K+, Ca2+, Mg2+, Na+ и др. (Pan et al., 2019). Эффективность ростостимулирующего и защитного влияния бактеризации растений в условиях засоления почв может повышаться при использовании галотолерантных PGP-бактерий, что было успешно продемонстрировано для представителей Azospirillum, Bacillus, Burkholderia, Pseudomonas, Rhizobium и др. (Numan et al., 2018; Chu et al., 2019). В этом аспекте поиск и выделение новых групп галотолерантных бактерий, проявляющих PGP-свойства, остается актуальной задачей.
Бактерии рода Advenella семейства Alcaligenaceae (класс β-протеобактерий), несмотря на небольшое количество описанных видов, характеризуются значительным эколого-физиологическим разнообразием и довольно широко распространены в природных экосистемах. Род Advenella первоначально был предложен Coenye и соавт. (2005) для описания грамотрицательных оксидазоположительных бактерий палочковидной или кокковидной формы, выделяемых из разнообразных клинических материалов человека и животных. Так, типовой представитель рода, A. incenata, был выделен из мокроты человека (Coenye et al., 2005). В 2009 г., на основе данных фенотипического и филогенетического анализа к роду Advenella был присоединен род Tetrathiobacter, предложенный Ghosh и соавт. (2005), включающий виды T. kashmirensis и T. mimigardefordensis (Gibello et al., 2009). Однако первый из них, по-видимому, остается единственным представителем рода, проявляющим хемолитотрофные свойства. Позднее были охарактеризованы виды Advenella из образцов грунта, активного ила, перепревшего компоста, ризосферы культурных и дикорастущих растений, шлама из установки получения биогаза и др. (Ghosh et al., 2005; Wűbbeler et al., 2006; Matsuoka et al., 2012; Порошина и соавт., 2015; Wang et al., 2016; Добровольская и соавт., 2017). Среди депонированных в базе данных GenBank последовательностей гена 16S рРНК A. kashmirensis и неидентифицированных до вида штаммов Advenella около 18 представлено изолятами из различных подземных местообитаний и 10 – последовательностями эндофитных и ризосферных бактерий. Естественным резервуаром подземных изолятов Advenella spp. являются экосистемы грязевых вулканов, подземных вод, шахт и пещер, включая воздушную среду, минеральные отложения и некоторых представителей пещерной фауны.
Несмотря на то, что многие изоляты Advenella обнаружены в составе микробных сообществ ризосферы различных растений, ростостимулирующая активность этих бактерий остается малоизученной. PGP-свойства частично выявлены у ряда штаммов, таких как A. incenata VA2S3 и Advenella sp. РВ-06, способных к солюбилизации малодоступных соединений фосфора и продуцирующих ауксины (Shahi et al., 2011; Singh et al., 2014), а также у штамма A. kashmirensis subsp. methylica PK1T, продуцирующего индол-производные предшественники ауксина в среде с триптофаном (Порошина и соавт., 2015). Устойчивые к повышенным концентрациям селена представители рода Advenella со свойствами PGPR описаны в составе эндофитных микробных сообществ растений-гипераккумуляторов селена (Sura-de Jong et al., 2015). Вид A. incenata, выделенный из ризосферы табака вместе с 33 видами других бактерий, проявлял антагонистическую активность против фитопатогена Phytopthora nicotianae (Jin et al., 2011). Эти данные свидетельствуют о потенциале рода Advenella как источника новых представителей PGPR-бактерий для разработки полифункциональных микробных препаратов в области растениеводства.
Цель настоящей работы ‒ идентификация и характеристика нового бактериального изолята рода Advenella, способного к солюбилизации малодоступных для растений минеральных и органических форм фосфора, а также оценка его влияния на развитие растений пшеницы в условиях умеренного засоления почвы.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования и его выделение. Микробный изолят IB-K1 был выделен из грунта, отобранного в афотической зоне (зал Бороды, 312 м от входа) пещеры Киндерлинская (им. 30-летия Победы, Южный Урал). Грунт (0‒5 см) отбирали стерильно, помещали в полиэтиленовые пакеты и далее хранили при 4°С. Выделение осуществляли высевом суспензии грунта на среду Эндо с инкубацией в течение 72 ч при 28°С. Выросшие на среде однотипные колонии бордового цвета с металлическим блеском поверхности пересевали методом серийных разведений на мясопептонный агар (МПА) для оценки чистоты культуры. В дальнейшем чистую культуру IB-K1 поддерживали культивированием на МПА при 28°С.
Фенотипическая и генотипическая характеристика исследуемого штамма. Культурально-морфологические свойства нового изолята изучали при его выращивании на МПА и на жидкой питательной среде G1G следующего состава (г/л): глюкоза ‒ 10; дрожжевой экстракт ‒ 5; пептон ‒ 4; кукурузный экстракт ‒ 1; NaH2PO4 · 2H2O ‒ 1; K2HPO4 · 3H2O ‒ 1; дистиллированная вода ‒ 1 л; рН 7.6‒7.8.
Физиолого-биохимические свойства штамма изучали, руководствуясь методическими рекомендациями по идентификации микроорганизмов (Герхардт и соавт., 1984). Утилизацию штаммом ряда органических соединений (сахаров, аминокислот, солей органических кислот) в качестве единственного источника углерода изучали при его выращивании на минеральной основе жидкой среды Козера, содержащей 0.1 мас. % соответствующего источника углерода и 0.06 мас. % индикатора бромтимолового синего. Метилотрофные свойства штамма оценивали по способности развиваться в жидкой среде с метанолом (0.5%; об./об.) в качестве единственного источника углерода (Doronina et al., 2000).
Присутствие у штамма кислой и щелочной фосфатаз определяли, инкубируя суспензию клеток, отобранных целиком с одной колонии 24-ч культуры, в физиологическом растворе с равным объемом 10 мМ раствора динатрий-п-нитрофенилфосфата (“Sigma”, США) в фосфатно-цитратном (100 мМ; рН 4.8) или глициновом (40 мМ; рН 10.5) буфере соответственно (Герхардт и соавт., 1984). Культуру инкубировали в течение 6 ч при 37°С, центрифугировали и измеряли поглощение супернатанта при 405 нм. Степень разведения надосадочной жидкости подбирали таким образом, чтобы значения оптической плотности находились в интервале Δ0.1‒0.3 ед. Относительный уровень активности кислой и щелочной фосфатазы выражали в значениях средней скорости накопления свободного п-нитрофенола (п-НФ), мкМ/мл мин, с учетом коэффициента разведения. Концентрацию красителя рассчитывали по калибровочной кривой, построенной с коммерческим п-нитрофенолом (“Sigma”, США), на участке линейной зависимости в диапазоне 10‒50 мкМ/мл.
Температурный диапазон роста IB-K1 изучали на МПА при 4, 20, 28 и 37°С. Для оценки влияния рН на рост штамма его культивировали в жидкой среде Козера при 28°С в интервале рН 4‒9. Галотолерантность исследуемой культуры оценивали по росту в жидкой среде Хотингера, содержащей от 1 до 9 мас. % NaCl.
Филогенетическое положение штамма IB-K1 устанавливали на основе анализа гена 16S рРНК. Секвенирование целевого фрагмента проводили с применением набора реактивов “Big Dye Terminator” на автоматическом секвенаторе Genetic Analyser 3500XL (“Applied Biosystems”, США). Поиск гомологичных последовательностей 16S рРНК в базе данных GenBank осуществляли с помощью программы BLAST. Множественное выравнивание нуклеотидных последовательностей и построение дендрограммы филогенетического сходства методом присоединения соседей с использованием модели Jukes-Cantor осуществляли с помощью программы Mega X 10.0.4. Достоверность ветвления оценивали с помощью бутстреп-анализа из заданных 500 альтернативных филогенетических деревьев.
Хемолитотрофный рост изолята IB-K1. Способность штамма использовать восстановленные соединения серы изучали, выращивая культуру на среде с тиосульфатом (среда MST; Davidson, Summers, 1983) согласно Ghosh и соавт. (2005). Культивирование штамма осуществляли в колбах Эрленмейера (250 мл) на шейкере-инкубаторе Innova 40R при 28°С и 250 об./мин в течение 6 сут. В качестве инокулята использовали отмытую стерильным физраствором биомассу 12-ч культуры, выращенной в жидкой среде G1G при тех же условиях. В периодической культуре рН среды поддерживали на уровне 7.4 внесением стерильного 2 М раствора Na2CO3. Для поддержки хемолитотрофного роста в течение культивирования после 48 ч инкубации в среду вносили стерильный раствор тиосульфата натрия в количестве, эквивалентном исходной концентрации (20 мМ). Мониторинг бактериального роста и рН культуральной среды (КЖ) проводили каждые 24 ч в течение цикла культивирования. Интенсивность роста бактерий оценивали по оптической плотности КЖ при 600 нм.
Способность изолята IB-K1 к хемолитотрофному росту оценивали также на агаризованном варианте среды MST, добавляя в нее 0.01% фенолового красного для контроля закисления среды при накоплении продуктов окисления серы (Ghosh et al., 2005).
Определение фосфат-мобилизующей активности изолята IB-K1. Интенсивность роста исследуемого штамма и его способность к солюбилизации труднорастворимых ортофосфатов кальция, алюминия и железа, а также кальциево-магниевой соли инозитфосфорной (фитиновой) кислоты изучали при его культивировании на агаризованных средах Муромцева и Менкиной, руководствуясь методическими рекомендациями (Сэги, 1983). Культуру инокулировали уколом на поверхность питательной среды и инкубировали в течение 14 сут при 28°С, после чего измеряли диаметр бактериальных колоний и зон просветления вокруг них, свидетельствующих о растворении фосфатов. Индекс солюбилизации фосфатов (solubilization index, SI) рассчитывали по формуле SI = (Dколонии + + Dзоны)/Dколонии (Moawad, Vleck, 1996). Эксперимент проводили в 4-кратной повторности.
Способность штамма IB-K1 растворять ортофосфат кальция оценивали при его глубинном культивировании в жидкой среде Муромцева в течение 10 сут, при 28°С и 250 об./мин. Интенсивность мобилизации фосфатов оценивали по изменению рН среды, уровню накопления растворимых фосфат-анионов в культуральной среде, а также по степени конверсии (%) навески нерастворимых фосфатов. Концентрацию фосфат-анионов определяли методом Фиске‒Суббароу (Лурье, 1971).
Анализ продукции ауксинов (ИУК) в глубинной культуре IB-K1. Для оценки уровня синтеза ИУК штамм выращивали в течение 7 сут в жидкой среде G1G при 28°С и 250 об./мин. Титр жизнеспособных клеток в КЖ определяли методом серийных разведений после двух и шести суток культивирования. Отбор проб для анализа продукции ИУК осуществляли через первые, третьи и седьмые сутки. Отобранные образцы центрифугировали 30 мин при 3260 g для удаления бактериальной биомассы; осветленную КЖ подкисляли 1 н раствором HCl до рН 2‒3 и затем подвергали двойной экстракции диэтиловым эфиром в объемном соотношении органической и водной фазы 1 : 3. Из объединенной органической фазы ИУК реэкстрагировали 1%-ным раствором NaHCO3 в соотношении 1 : 3 (водная фаза : органическая фаза). Органическую фазу отделяли и отбрасывали, а из водной фазы после подкисления до рН 2‒3 фитогормоны вновь дважды экстрагировали диэтиловым эфиром (1 : 3) и метилировали диазометаном (Veselov et al., 1992). Содержание ИУК определяли с помощью иммуноферментного анализа в соответствующей тест-системе (Veselov et al., 1992).
Оценка влияния бактеризации семян штаммом IB-K1 на продуктивность пшеницы в условиях умеренного засоления почвы. Влияние бактеризации семян на развитие и продуктивность пшеницы в присутствии NaCl в почве изучали на твердой яровой пшенице Triticum durum Desf. (сорт Башкирская 27). Семена обрабатывали бактериальной биомассой, полученной после 48 ч глубинного культивирования штамма IB-K1 в питательной среде G1G при тех же условиях. Клетки отделяли центрифугированием при 2486 g в течение 20 мин и суспендировали в стерильной водопроводной воде, создавая плотность инокулята при обработке растений 104–106 КОЕ/семя. В качестве прилипателя использовали 0.4%-ный раствор Na-КМЦ средней вязкости (“Sigma”, США). Полевой эксперимент проводили в 2018 г. на территории Уфимского района Республики Башкортостан по общепринятой методике (Доспехов, 1985). Почва опыта – агрочернозем глинисто-иллювиальный, со средней гумусированностью (6.29%), слабокислой реакцией среды, высоким содержанием поглощенных оснований с преобладанием кальция и магния (Ca2+ – 350 смоль/(экв)/кг, Mg2+ – 120 смоль/(экв)/кг), средней обеспеченностью подвижным фосфором и щелочногидролизуемым азотом (175 мг/кг). Опытные делянки площадью 1 м2 располагали в одну полосу в четырехкратной повторности. Перед посевом на каждую делянку вносили 1000 г NaCl в виде водного раствора методом дождевания. Содержание водорастворимых солей в почве определяли по стандартной методике (Агрохимические методы, 1975). Оценку проводили на основе интегрального образца, отобранного с разных точек делянки, на глубине слоя почвы до 10 см, после уборки урожая. Анализ структуры урожая проводили по стандартной схеме (Доспехов, 1985).
Сканирующая электронная микроскопия (СЭМ). Оценку колонизации ризопланы растений пшеницы исследуемым штаммом в модельном эксперименте осуществляли с помощью сканирующей электронной микроскопии (СЭМ). Семена T. durum Desf. (сорт Башкирская 27) обрабатывали бактериальным препаратом, как описано выше, за исключением того, что их предварительно стерилизовали в 1%-ном растворе мертиолята (1 мин) и затем дважды (по 5 мин) промывали стерильной дистиллированной водой. В качестве контроля использовали стерилизованные проростки пшеницы, не подвергшиеся бактеризации. Обработанные семена проращивали в течение 4 сут при температуре 22°С на влажной фильтровальной бумаге в чашках Петри в темноте. Проросшие корни промывали стерильным натрий-фосфатным буфером (100 мМ; рН 7.3) и фиксировали в 5%-ном (об./об.) растворе глутаральдегида (“PanReac AppliChem”, Испания) в течение 5 ч. Далее образцы обезвоживали последовательной обработкой водными растворами этанола возрастающей концентрации (10‒96%), затем смесью этанола и ацетона в соотношениях (об./об.) 3 : 1, 1 : 1 и 1 : 3 и, наконец, чистым ацетоном. После высушивания образцы напыляли золотом в камере вакуумного напыления и микроскопировали. Сканирующую электронную микроскопию производили на микроскопе TES-CAN Vega 3 (Чехия) в Институте проблем сверхпластичности металлов РАН (Уфа, Россия).
Статистическая обработка результатов. Статистическую обработку данных проводили с помощью стандартного пакета анализа MS Office Excel 2007 (12.0.6611.1000). В качестве данных представляли значения средней арифметической и стандартное отклонение (SD). Достоверность различий оценивали по t-критерию Стьюдента при p = 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изолят IB-K1 был выделен на среде Эндо при оценке содержания колиформных бактерий (БГКП) в грунте пещеры Киндерлинская (им. 30-летия Победы, Южный Урал). Формируя колонии, сходные по типовому признаку с БГКП (наличие металлического блеска), выделенный штамм не рос при 37°С, как это свойственно для данной группы. Изолят обнаруживался как основной морфотип бактерий, выделяемых на среде Эндо из образца грунта, отобранного вдоль стены зала Бороды. При общем титре 5.3 × 106 КОЕ/г копиотрофных бактерий, выделенных на МПА, титр колоний, соответствующих по морфологии изоляту IB-K1, составлял не менее 1.7 × 103 КОЕ/г. На богатых питательных средах штамм IB-K1 формировал круглые, непрозрачные, блестящие, бледно-розовато-желтоватые, выпуклые колонии однородной структуры, с гладкой поверхностью и ровным краем. На среде Эндо колонии изолята приобретали плоский профиль, красную пигментацию и металлический блеск поверхности при идентичности остальных признаков. Клетки штамма IB-K1 представляли собой грамотрицательные неподвижные короткие палочки (1.75–2.5 × 0.6–0.75 мкм), не образующие капсул и спор. Выделенный штамм проверяли на чистоту несколькими пересевами на МПА и далее идентифицировали на основе анализа гена 16S рРНК и сравнительной оценки ключевых физиолого-биохимических свойств.
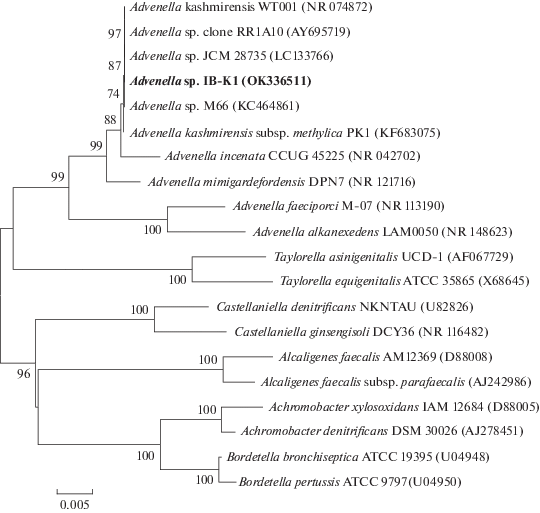
Анализ гена 16S рРНК выявил принадлежность штамма IB-K1 к представителям группы β‑протеобактерий, а именно к роду Advenella. Кроме валидированных представителей A. kashmirensis, в анализ были включены близкие к этому виду штаммы, выделенные из разных экологических ниш, в том числе с каменных поверхностей (Sugiyama et al., 2017), железомарганцевых пещерных отложений и из ризосферы высших растений. Филогенетические связи штамма IB-K1 внутри рода Advenella и ближайшего его окружения в системе Alcaligenaceae представлены на древе (рис. 1), где адвинеллы формируют кладу с уровнем сходства 94–99.9% и высоким показателем бутстреп-анализа. Максимальное сходство (99.9%) последовательности гена 16S рРНК у штамма IB-K1 обнаружено с видом A. kashmirensis (NR 074872) и меньшее генетическое сходство ‒ с A. kashmirensis subsp. methylica (99.8%). Филогенетическая близость штамма IB-K1 к типовому виду A. kashmirensis WT 001 (Ghosh et al., 2005), а также штаммам JCM 28735 (LC133766), clone RR1A10 (AY695719) и М66 (KC464861) подтверждается высоким сходством последовательностей гена 16S рРНК (99.9‒100%) и проявляется в кластеризации с высокими показателями бутстрепа. Последовательность гена 16S рРНК (1446 п.о.) штамма IB-K1 депонирована в GenBank NCBI под номером OK336511 (https:// www.ncbi.nlm.nih.gov/nuccore/OK336511). Сам штамм IB-K1 депонирован во Всероссийской коллекции микроорганизмов (ВКМ) под номером В-3251.
Рис. 1.
Дендрограмма филогенетического положения штамма A. kashmirensis IB-K1 среди представителей рода Advenella, построенная методом “neighbor-joining”. Цифрами показана статистическая достоверность ветвления 500 альтернативных деревьев определенная с помощью бутстреп-анализа (приведены значения выше 50%). Масштаб показывает эволюционное расстояние, соответствующее 5 нуклеотидным заменам на каждые 1000 нуклеотидов.
Выделенный штамм являлся оксидазо- и каталазоположительным факультативным анаэробом, в отсутствие кислорода воздуха был способен осуществлять нитратное дыхание и сбраживать глюкозу. Температурный и рН-диапазон роста штамма составляли 4–28°С и рН 5–9 соответственно. В отличие от других представителей A. kashmirensis, штамм IB-K1 демонстрировал также хороший рост при концентрации в среде NaCl не менее 7 мас. % (табл. 1). Умеренная галотолерантность A. kashmirensis IB-K1 может косвенно характеризовать его жизнеспособность при повышении ионной силы почвенного раствора в условиях засоления почв. В качестве единственного источника азота штамм мог использовать соли аммония и мочевину; другой его особенностью являлась способность к росту в присутствии серосодержащих соединений – тиосульфата и таурина. Некоторые морфологические и физиолого-биохимические свойства изолята IB-K1, отличающие его от ранее охарактеризованных представителей A. kashmirensis, суммированы в табл. 1; по остальным свойствам он был сходен с наиболее изученными штаммами этого вида (данные не представлены).
Таблица 1.
Морфологические и физиолого-биохимические характеристики штамма IB-K1 в сравнении с ранее описанными штаммами A. kashmirensis
| Характеристика | A. kashmirensis IB-K1 | A. kashmirensis WT 001 (Ghosh et al., 2005; Gibello et al., 2009) | A. kashmirensis subsp. methylica PK1 (Порошина и соавт., 2015) |
|---|---|---|---|
| Форма клеток | Палочки, отдельные и в парах | Овальные или кокковидные, отдельные и в парах; цепи | Палочки, отдельные и в парах |
| Размер клеток, мкм | 2‒2.5 × 0.6‒0.7 | 1.0–1.8 × 0.6–1.5 | 0.3–0.35 × 0.4–0.45 |
| Оксидаза | + | + | + |
| Каталаза | + | + | + |
| Денитрификация ${\text{NO}}_{3}^{ - }$ до ${\text{NO}}_{2}^{ - }$ | + | + | ‒ |
| Денитрификация ${\text{NO}}_{2}^{ - }$ до N2 | + | ‒ | ‒ |
| Уреазная активность | + | + | ‒ |
| Кислая фосфатаза | + | + | Нд |
| Щелочная фосфатаза | + | + | Нд |
| Гидролиз крахмала | ‒ | ‒ | + |
| Ассимиляция субстратов: | |||
| D-глюкоза | + | + | + |
| D-лактоза | + | + | Нд |
| Рамноза | + | + | + |
| D-раффиноза | ‒ | ‒ | ± |
| Мелибиоза | + | ‒ | + |
| DL-аланин | ‒ | Нд | + |
| L-аргинин | + | ‒ | Нд |
| L-изолейцин | + | ‒ | Нд |
| L-триптофан | ‒ | + | Нд |
| Tаурин | + | Нд | Нд |
| DL-лактат | ++ | ‒ | + |
| Метанол | + | ‒ | + |
| Тиосульфат | + | + | ‒ |
| Тетратионат | Нд | + | ‒ |
| Рост при температуре, °С | 4‒28 | 10‒42 | 16‒37, опт. 29 |
| Рост в присутствии NaCl, % | ≤7 | ≤6 | ≤ 2; опт. 0.5 |
| Рост при рН | 4.0‒9.0 | 4.5‒8.5 | 6.5‒9.0; опт. 8.0‒8.5 |
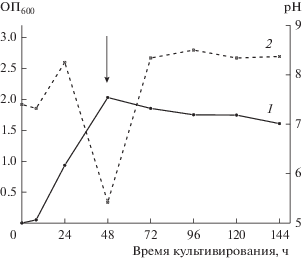
Изолят IB-K1, подобно типовому штамму A. kashmirensis WT 001, был способен расти в присутствии восстановленных соединений серы, в частности, в жидкой среде с тиосульфатом натрия (MST). В первые 24 ч глубинного культивирования бактерий отмечалось защелачивание среды до рН 8.6 с последующим закислением до рН 5.5 к 48 ч, совпадающим с достижением максимума роста. К 48 ч кривая роста выходила на стабильное плато (рис. 2). В присутствии тиосульфата штамм IB-K1 характеризовался довольно быстрой динамикой и значительной интенсивностью роста. Начальный титр бактерий (106 КОЕ/мл) в среде MST достигал 109 КОЕ/мл после 120 ч культивирования. Хотя падение рН среды MST ко 2-м сут культивирования (рис. 2) вследствие окисления тиосульфата происходило по сходному со штаммом WT 001 сценарию, дополнительное внесение тиосульфата в среду после выхода на плато (48 ч) не приводило к дальнейшему увеличению роста культуры, как описано ранее для A. kashmirensis WT 001 (Ghosh et al., 2005). Аналогичный эксперимент в условиях агаризованной среды MST с 0.01% фенолового красного, при посеве уколом, через 24 ч показал наличие роста бактерий, сопровождающегося закислением среды после 48 ч культивирования (изменение окраски индикатора в интервале снижения рН 8.4‒6.8; данные не представлены). Полученные результаты подтверждают способность штамма IB-K1 к миксотрофному типу питания и позволяют отнести его к факультативным хемолитотрофам, использующим тиосульфат в качестве источника энергии.
Рис. 2.
Динамика роста (1) штамма A. kashmirensis IB-K1 и изменения рН КЖ (2) в присутствии 20 мМ тиосульфата натрия как единственного источника энергии (среда MST, 28°С, 250 об./мин). Вертикальной стрелкой отмечено время культивирования (48 ч), когда в культуральную среду вносили раствор тиосульфата натрия в количестве, эквивалентном его первоначальной концентрации (20 мМ), и 2 М раствор Na2-CO3 для нейтрализации рН КЖ до 7.4.-
Таким образом, по хемолитотрофным свойствам изолят IB-K1 показывал сходство с типовым штаммом A. kashmirensis WT 001, в геноме которого представлен полный набор генов окисления неорганической серы (soxCDYZAXWB, Ghosh et al., 2011), и который осуществляет окисление тиосульфата до сульфата с образованием тетратионата в качестве основного интермедиата, в дальнейшем окислении которого ключевую роль играет глутатион (Pyne et al., 2017). Источником выделения хемолитотрофного штамма WT 001 являлся интегральный образец садовой почвы неризосферного происхождения в умеренно-климатической зоне союзной территории Джамму и Кашмир (Индия) (Ghosh et al., 2005). В отличие от него, штамм IB-K1 был выделен из грунтов карбонатной пещеры с включениями гипсов, изотопный состав которых свидетельствует об их бактериальном происхождении и указывает на наличие условий для жизнедеятельности бактерий цикла серы (Червяцова и соавт., 2016). В то же время, штамм A. kashmirensis subsp. methylica PK1, не способный окислять соединения серы, был выделен из ризосферы осоки, растущей на кальцитовых травертинах (Порошина и соавт., 2015), т.е. на минеральном субстрате.
Как и штамм A. kashmirensis subsp. methylica PK1 (Порошина и соавт., 2015), изолят IB-K1 был способен использовать метанол в качестве единственного источника углерода, увеличивая свой титр на два порядка (с 106 до 108 КОЕ/мл) после 6 сут культивирования в среде с 0.5% (об./об.) метанола. Метилотрофность A. kashmirensis IB-K1 свидетельствует о его потенциальной способности к симбиозу с растениями, поскольку метанол является естественным продуктом метаболизма растений (Galbally, Kirstine, 2011; Порошина и соавт., 2015; Доронина и соавт., 2015). Как известно, многие метилотрофные бактерии демонстрируют ростостимулирующую активность в отношении одно- и двудольных растений при их колонизации, подавляют развитие фитопатогенов, снижая поражение растений бактериальными и грибными заболеваниями, нематодами и т.д. (Доронина и соавт., 2015). Ростостимулирующий эффект метилобактерий связывают, главным образом, с синтезом фитогормонов, витамина B12, азотфиксирующей и фосфатсолюбилизирующей активностью (Доронина и соавт., 2015). В связи с этим, штамм A. kashmirensis IB-K1 был изучен по таким показателям ростостимулирующего действия, как фосфат-мобилизующая активность и синтез ИУК.
Штамм A. kashmirensis IB-K1 демонстрировал высокий уровень синтеза кислой и, в особенности, щелочной фосфатазы, что свидетельствует о его активном участии в минерализации органического фосфора (табл. 2). По данным оценки влияния некоторых PGPR-штаммов родов Bacillus и Pseudomonas на растения томата, их ростостимулирующий эффект обусловлен главным образом повышенной продукцией фосфатаз в ризосфере растений (Nassal et al., 2018). При культивировании на агаризованных средах, содержащих труднодоступные минеральные и органические формы фосфора, штамм более активно растворял ортофосфат кальция и фитин по сравнению с фосфатами железа и алюминия (табл. 2). Высокое значение индекса солюбилизации фитина на агаризованной среде Менкиной может свидетельствовать, что продуктивность штамма IB-K1, по меньшей мере, сравнима с максимальными значениями (0.174 ед./мл), отмеченными ранее для представителей Advenella (Singh et al., 2014). Индекс солюбилизации ортофосфата кальция составлял 5 баллов, что превосходит этот показатель (равный 2‒4) у ранее описанных PGP-штаммов Advenella spp. (Singh et al., 2014). В бульонной культуре бактерий происходило полное растворение ортофосфата кальция и частичное растворение фосфата алюминия; в этих условиях отмечалось подкисление культуральной среды от первоначального рН 7 до значений рН 4.4‒4.5, стабильно поддерживаемых на протяжении всего цикла культивирования с 1 по 10 сут (табл. 2). Образование органических кислот микроорганизмами рассматривается как один из основных механизмов их фосфат-солюбилизирующей активности, хотя предлагаются также альтернативные метаболические основы этого процесса, связанные с освобождением протонов H+ при усвоении аммонийного азота, либо с образованием H2CO3 при дыхании (Goldstein, Krishnaraj, 2007; Khan et al., 2009). Невысокий индекс солюбилизации фосфатов алюминия и железа штаммом IB-K1 может свидетельствовать о преобладании в среде его культивирования органических кислот, характеризующихся низкой константой стабильности образуемого комплекса с ионами этих металлов, например, глюконовой кислоты (Khan et al., 2009). Полученные данные позволяют предположить, что штамм IB-K1 должен быть более эффективен как фосфат-мобилизатор в условиях щелочных или нейтральных почв, в которых преобладают кальций-связанные формы фосфора, чем в кислых почвах, содержащих преимущественно фосфаты железа и алюминия (Hu et al., 2005).
Таблица 2.
Продукция фосфатаз и показатели фосфатсолюбилизирующей активности штамма A. kashmirensis IB-K1
| Плотная среда (индексы солюбилизации) |
Активность фосфатазы, мкМ-экв п-НФ/мин |
||||
|---|---|---|---|---|---|
| фитин (C6H6Ca5MgO24P6) | Ca3(PO4)2 | FePO4 ∙ 2H2O | AlPO4 ∙ 3H2O | кислая | щелочная |
| 7 | 5 | 1 | 1 | 60.8 ± 6.4 | 663.3 ± 69.8 |
| Жидкая среда | |||||
| Ca3(PO4)2 | AlPO4 ∙ 3H2O | ||||
| накопление P2O5 (мг/л), 11 сут | высвобождение фосфора, % | рН среды, 1 и 11 сут | накопление P2O5 (мг/л), 11 сут | высвобождение фосфора, % | рН среды, 11 сут |
| 916 ± 23 | 100 | ~4.85 ± 0.07/ 4.45 ± 0.07 | 356 ± 47 | 76 ± 6 | 5.75 ± 0.35 |
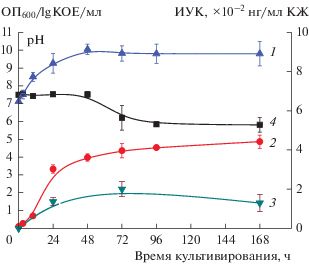
Штамм A. kashmirensis IB-К1 характеризовался относительно высоким уровнем синтеза ИУК; максимальная продукция ауксина (220 ± 42 нг/мл) регистрировалась через 72 ч от начала глубинного культивирования в среде с 1% глюкозы (рис. 3). Способность к продукции значительных концентраций ауксина штаммами рода Advenella (12–35 мг/мл) была показана ранее в работе Singh и соавт. (2014). Следует отметить, что питательная среда, использованная этими авторами для культивирования, содержала высокую концентрацию триптофана (0.05 мас. %), который является основным предшественником синтеза ИУК. Концентрацию гормона в КЖ исследователи определяли с помощью реакции Сальковского на индольные соединения. Хотя этот метод относительно прост, его специфичность невысока, что может приводить к получению завышенных результатов (Glickman, Dessaux, 1995). В отличие от других штаммов Advenella, продуцирующих гетероауксины, исследуемый нами штамм не был способен утилизировать экзогенный L-триптофан (табл. 1), являющийся предшественником биосинтеза ИУК, реализуемого у бактерий в пяти известных в настоящее время путях (Bungsangiam et al., 2019). Данный факт свидетельствует о наличии у штамма A. kashmirensis IB-К1 триптофан-независимого механизма синтеза ИУК (Prinsen et al., 1993). Продукция ИУК бактериями, как правило, включает одновременно несколько путей, при этом триптофан-независимый синтез протекает обычно в условиях дефицита экзогенного предшественника. Комбинированный синтез ИУК, включающий несколько путей, наиболее часто отмечается у ризосферных бактерий, что позволяет им продуцировать это соединение в более значительных количествах по сравнению с представителями микробных сообществ из других экосистем (Zhang et al., 2019).
Рис. 3.
Динамика бактериального роста (1 – lg КОЕ/мл, 2 – ОП600), накопления ИУК (3) и рН (4) в культуральной среде штамма A. kashmirensis IB-K1 при глубинном периодическом культивировании (7 сут, 28°С, 250 об./мин).
Способность к изменению эндогенного содержания абсцизовой кислоты (АБК) под влиянием изолята IB-К1 была показана нами ранее в полевых экспериментах в условиях незасоленной почвы. Оценка гормонального статуса бактеризованных растений выявила 2-кратное увеличение содержания АБК в побегах на стадии 2-го листа. Структурный анализ урожая показал увеличение длины главного колоса и количества продуктивных побегов. Штамм A. kashmirensis IB-К1 успешно колонизовал ризосферу пшеницы, численность культуры на стадии 2-го листа составляла до 7.5 × × 106 КОЕ/г корней и в дальнейшем снижалась на стадии кущения до 2.5 × 105 КОЕ/г (Галимзянова и соавт., 2018).
Анализ поверхности корней бактеризованной пшеницы методом СЭМ на стадии 4-сут проростков подтвердил активную колонизацию их корневой системы клетками A. kashmirensis IB-К1 в зоне всасывания (рис. 4). В контрольных вариантах проростков пшеницы клетки бактерий не обнаруживались (данные не представлены).
Рис. 4.
Сканирующая электронная микроскопия (СЭМ) корневой системы 4-сут проростков пшеницы Triticum durum Desf. (сорт Башкирская 27), полученных после бактеризации семян 48-ч культурой A. kashmirensis IB-K1 при плотности инокулята 106 КОЕ/семя. Увеличение: ×1000 (а), ×10 000 (б) и ×18 100 (в). Область приближения на микрофотографиях (б) и (в) соответствует выделенному фрагменту на микрофотографии (а).

В полевом эксперименте по оценке влияния штамма A. kashmirensis IB-К1 на развитие и урожайность яровой пшеницы в условиях солевого стресса содержание водорастворимых солей в верхнем слое (10 см) почвы опытных делянок при внесении NaCl (1000 г/м2) составляло 0.33 ± 0.06%, что соответствует пограничному значению между средним и сильным уровнем засоления (Кирюшин, 1996). В целом, при умеренном засолении наблюдалось снижение показателей структуры урожая пшеницы на 20‒35% по сравнению с растениями, выросшими в нормальных условиях (табл. 3). При обработке семян штаммом A. kashmirensis IB-К1 продуктивность пшеницы (по показателю массы зерен с одного растения) увеличилась в сравнении с контрольным вариантом на 19% (табл. 3). Отмечалось также возрастание количества и массы зерен в главном колосе, тогда как различия по остальным показателям были несущественны на стадии сбора урожая. Положительный эффект бактеризации может быть обусловлен как продукцией ИУК штаммом A. kashmirensis IB-К1, так и его способностью к снижению воздействия на растения оксидативного стресса, развивающегося в условиях повышенного содержания солей, что было показано ранее (Архипова и соавт., 2018).
Таблица 3.
Влияние обработки семян штаммом A. kashmirensis IB-K1 на продуктивность твердой яровой пшеницы Triticum durum Desf. (сорт Башкирская 27) на фоне искусственного засоления в полевых условиях
| Показатели | Естественный фон (отсутствие засоления) |
Засоление почвы NaCl | ||||
|---|---|---|---|---|---|---|
| контроль | обработка IB-K1 | прибавка, % | контроль | обработка IB-K1 | прибавка, % | |
| Содержание водорастворимых солей в почве после сбора урожая, % | 0.07 ± 0.01 | 0.07 ± 0.01 | ‒ | 0.31 ± 0.06 | 0.33 ± 0.06 | ‒ |
| Элементы структуры урожая: | ||||||
| Длина растения, см | 75.00 ± 0.73 | 79.15 ± 0.90* | 5.5 | 60.39 ± 0.96 | 61.18 ± 0.79 | ‒ |
| Продуктивная кустистость, шт. | 1.05 ± 0.03 | 1.35 ± 0.06* | 28.6 | 1.05 ± 0.01 | 1.05 ± 0.01 | ‒ |
| Длина главного колоса, см | 4.80 ± 0.07 | 5.22 ± 0.06* | 8.7 | 3.73 ± 0.07 | 3.86 ± 0.06 | ‒ |
| Количество колосков в главном колосе, шт. | 12.39 ± 0.16 | 13.67 ± 0.11* | 10.3 | 9.79 ± 0.15 | 10.02 ± 0.11 | ‒ |
| Число зерен в главном колосе, шт. | 20.66 ± 0.42 | 21.73 ± 0.51 | ‒ | 14.22 ± 0.45 | 16.23 ± 0.36* | 14.2 |
| Масса зерен в главном колосе, г | 0.80 ± 0.02 | 0.90 ± 0.03* | 11.8 | 0.52 ± 0.02 | 0.63 ± 0.02* | 21.3 |
| Масса зерен с одного растения, г | 0.82 ± 0.03 | 1.05 ± 0.04* | 27.9 | 0.54 ± 0.02 | 0.65 ± 0.02* | 19.8 |
Таким образом, штамм IB-К1 может быть охарактеризован как первый представитель факультативно хемолитотрофного вида A. kashmirensis, выделенный из пещерной экосистемы, проявляющий PGP-свойства. Ростостимулирующее влияние A. kashmirensis IB-К1, очевидно, обусловлено его метилотрофными свойствами, высоким фосфат-мобилизующим потенциалом, способностью синтезировать ИУК и колонизовать ризосферу пшеницы. Результаты полевого эксперимента свидетельствуют о возможности эффективного использования данного штамма для стимулирования роста и развития сельскохозяйственных растений, в том числе, в условиях повышенного содержания солей в почве.
Авторы выражают благодарность И.И. Мусабирову (Институт проблем сверхпластичности металлов РАН, г. Уфа) за содействие в проведении СЭМ исследований.
Список литературы
Агрохимические методы исследований почв / Под ред. Соколова А.В. М.: Наука, 1975. 656 с.
Архипова Т.Н., Кузьмина Л.Ю., Кудоярова Г.Р. Гормонпродуцирующие и рост-стимулирующие микроорганизмы снижают уровень оксидативного стресса у растений пшеницы на фоне засоления // Биомика. 2018. Т. 10. С. 365‒371. https://doi.org/10.31301/2221-6197.bmcs.2018-47
Галимзянова Н.Ф., Кузьмина Л.Ю., Кудоярова Г.Р., Высоцкая Л.Б., Архипова Т.Н., Сидорова Л.В., Гуватова З.Г., Рябова А.С., Ионина В.И., Габбасова И.М., Мелентьев А.И. Влияние предпосевной бактеризации семян фосфатмобилизующими и ауксинпродуцирующими микроорганизмами на продуктивность пшеницы и подвижность почвенного фосфора в ризосфере // Агрохимия. 2018. № 4. С. 50–58. https://doi.org/10.7868/S0002188118040075
Герхардт Ф. Методы общей бактериологии. М.: Мир, 1984. Т. 3. 264 с.
Добровольская Т.Г., Хуснетдинова К.А., Манучарова Н.А., Головченко А.В. Структура эпифитных бактериальных сообществ сорных растений // Микробиология. 2017. Т. 86. С. 247‒254. https://doi.org/10.7868/S0026365617020070
Dobrovol’skaya T.G., Khusnetdinova K.A., Manucharova N.A., Golovchenko A.V. Structure of epiphytic bacterial communities of weeds // Microbiology (Moscow). 2017. V. 86. P. 257‒263. https://doi.org/10.1134/S0026261717020072
Доронина Н.В., Торгонская М.Л., Федоров Д.Н., Троценко Ю.А. Аэробные метилобактерии – перспективные объекты современной биотехнологии (обзор) // Пр-икл. биохимия и микробиология. 2015. Т. 51. С. 111‒121. https://doi.org/10.7868/S0555109915020051
Doronina N.V., Torgonskaya M.L., Fedorov D.N., Trotsenko Yu.A. Aerobic methylobacteria as promising objects of modern biotechnology // Appl. Biochem. Microbiol. 2015. V. 51. P. 125–134. https://doi.org/10.1134/S0003683815020052
Доспехов Б.А. Методика полевого опыта. М.: Агропромиздат, 1985. 252 с.
Емцев В.Т., Соколова А.Я., Селицкая О.В. Защитное действие бактерий рода Кlebsiella на газонные травы в условиях засоления почвы // Почвоведение. 2010. Т. 43. С. 825‒830. https://doi.org/10.1134/S1064229310070070
Emtsev V.T., Sokolova A.Y., Selitskaya O.V. Protective effect of Klebsiella bacteria on lawn grasses under conditions of soil salinization // Euras. Soil Sci. 2010. V. 43. P. 771‒776.
Кирюшин В.И. Экологические основы земледелия. М.: Колос, 1996. 367 с.
Лурье Ю.Ю. Унифицированные методы анализа вод. М.: Химия, 1973. 376 с.
Порошина М.Н., Доронина Н.В., Капаруллина Е.Н., Троценко Ю.А. Advenella kashmirensis subspecies methylica PK 1 – факультативный метилотроф из ризосферы осоки // Микробиология. 2015. Т. 84. С. 90‒97. https://doi.org/10.7868/S0026365615010115
Poroshina M.N., Doronina N.V., Kaparullina E.N., Trotsenko Iu.A. Advenella kashmirensis subsp. methylica PK1, a facultative methylotroph from carex rhizosphere // Microbiology (Moscow). 2015. V. 84. P. 73–79. https://doi.org/10.1134/S0026261715010117
Сэги Й. Методы почвенной микробиологии. М.: Колос, 1983. 296 с.
Червяцова О.Я., Потапов С.С., Садыков С.А. Изотопный состав серы сульфатных отложений карстовых пещер Урала // Известия УГГУ. 2016. Т. 42. № 2. С. 32–36. https://doi.org/10.21440/2307-2091-2016-2-32-41
Alavi P., Starcher M., Zachow C., Müller H., Berg G. Root-microbe systems: the effect and mode of interaction of stress protecting agent (SPA) Stenotrophomonas rhizophila DSM14405T // Front. Plant Sci. 2013. V. 4. Art. 141. P. 1–10. https://doi.org/10.3389/fpls.2013.00141
Bunsangiam S., Sakpuntoon V., Srisuk N., Ohashi T., Fujiyama K., Limtong S. Biosynthetic pathway of indole-3-acetic acid in Basidiomycetous yeast Rhodosporidiobolus fluvialis // Mycobiol. 2019. V. 47. P. 292–300. https://doi.org/10.1080/12298093.2019.1638672
Chu T.N., Tran H.B.T., Bui L.V., Hoang M.T.T. Plant growth-promoting rhizobacterium Pseudomonas PS01 induces salt tolerance in Arabidopsis thaliana // BMC Res. Notes. 2019. V. 12. Art. 11. P. 1–7. https://doi.org/10.1186/s13104-019-4046-1
Coenye T., Vanlaere E., Samyn E., Falsen E., Larsson P., Vandamme P. Advenella incenata gen. nov., sp. nov., a novel member of the Alcaligenaceae, isolated from various clinical samples // Int. J. Syst. Evol. Microbiol. 2005. V. 55. P. 251–256. https://doi.org/10.1099/ijs.0.63267-0
Egamberdieva D., Davranov K., Wirth S., Hashem A., A-bd_Allah E.F. Impact of soil salinity on the plant-growth – promoting and biological control abilities of root associated bacteria // Saudi J. Biol. Sci. 2017. V. 24. P. 1601‒1608. https://doi.org/10.1016/j.sjbs.2017.07.004
Galbally I.E., Kirstine W. The production of methanol by flowering plants and the global cycle of methanol // J. Atmosph. Chem. 2002. V. 43. P. 195–229. https://doi.org/10.1023/A:1020684815474
Ghosh W., Bagchi A., Mandal S., Dam B., Roy P. Tetrathiobacter kashmirensis gen. nov., sp. nov., a novel mesophilic, neutrophilic, tetrathionate-oxidizing, facultatively chemolithotrophic betaproteobacterium isolated from soil from a temperate orchard in Jammu and Kashmir, India // Int. J. Syst. Evol. Microbiol. 2005. V. 55. P. 1779–1787. https://doi.org/10.1099/ijs.0.63595-0
Ghosh W., George A., Agarwal A., Raj P., Alam M., Pyne P., Das Gupta S.K. Whole-genome shotgun sequencing of the sulfur-oxidizing chemoautotroph Tetrathiobacter kashmirensis // J. Bacteriol. 2011. V. 193. P. 5553–5554. https://doi.org/10.1128/JB.05781-11
Gibello A., Velo A.I., Martin M., Barra-Caracciolo A., Grenni P., Fernandez-Garayzabal J.F. Reclassification of the members of the genus Tetratiobacter Ghosh et al. 2005 to the genus Advenella Coenye et al. 2005 // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 1914–1918. https://doi.org/10.1099/ijs.0.007443-0
Glickman E., Dessaux Y. A critical examination of the specificity of the Salkowski reagent for indolic compounds produced by phytopathogenic bacteria // Appl. Environ. Microbiol. 1995. V. 61. P. 793‒796. https://doi.org/10.1128/aem.61.2.793-796.1995
Goldstein A.H., Krishnaraj P.U. Phosphate solubilizing microorganisms vs. phosphate mobilizing microorganisms: What separates a phenotype from a trait? // Developments in Plant and Soil Sciences. First Int. Meeting on Microbial Phosphate Solubilization / Eds. Velazquez E., Rodriguez-Barrueco C. Springer, 2007. V. 102. P. 203–213. https://doi.org/10.1007/978-1-4020-5765-6_31
Hu H., Tang C., Rengel Z. Influence of phenolic acids on phosphorus mobilization in acidic and calcareous soils // Plant Soil. 2005. V. 268. P. 173–180. https://doi.org/10.1007/s11104-004-0280-x
Jin F., Ding Y., Reddi M.S., Dilantha Fernando W.G., Du B. Genetic diversity and phylogeny of antagonistic bacteria against Phytophthora nicotianae isolated from tobacco rhizosphere // Int. J. Mol. Sci. 2011. V. 12. P. 3055–3071. https://doi.org/10.3390/ijms12053055
Khan A.A., Jilani G., Akhtar M.S., Naqvi S.M.S., Rasheed M. Phosphorus solubilizing bacteria: occurrence, mechanisms and their role in crop production // J. Agric. Biol. Sci. 2009. V. 1. P. 48–58.
Matsuoka M., Park S., An S.Y., Miyahara M., Rim S.M., Kamino K., Fushinobu S., Yokota A., Wakagi T., Shoun H. Advenella faeciporci sp. nov., a nitrite-denitritfying bacterium isolated from nitrifying-enitritfying activated sludge collected from a laboratory-scale bioreactor treating piggery wastewater // Int. J. Syst. Evol. Microbiol. 2012. V. 62. P. 2986–2990. https://doi.org/10.1099/ijs.0.037440-0
Moawad M.E.P., Vleck P.L.G. Effect of phosphate solubilizing Pseudomonas putida on the growth of maize and its survival in the rhizosphere // Indones. J. Crop Sci. 1996. V. 11. P. 13–23.
Nassal D., Spohn M., Eltlbany N., Jacquiod S., Smalla K., Marhan S., Kandeler E. Effects of phosphorus-mobilizing bacteria on tomato growth and soil microbial activity // Plant Soil. 2018. V. 427. P. 17–37. https://doi.org/10.1007/s11104-017-3528-y
Numan M., Bashir S., Khan Y., Mumtaza R., Shinwar Z.K., Khan A.L., Khan A., AL-Harrasi A. Plant growth promoting bacteria as an alternative strategy for salt tolerance in plants: A review // Microbiol. Res. 2018. V. 209. P. 21–32. https://doi.org/10.1016/j.micres.2018.02.003
Pan J., Peng F., Xue X., You Q., Zhang W., Wang T., Huang C. The growth promotion of two salt-tolerant plant groups with PGPR inoculation: a meta-analysis // Sustainability. 2019. V. 11. Art. 378. P. 1–14. https://doi.org/10.3390/su11020378
Prinsen E., Costacurta A., Michiels K., Vanderleyden J., Van Onckelen H. Azospirillum brazilence indole-3-acetic acid biosynthesis: evidence for a non-tryptophan dependent pathway // MPMI. 1993. V. 6. P. 609–615. https://doi.org/10.1094/MPMI-6-609
Pyne P., Alam M., Ghosh W. A novel soxO gene, encoding a glutathione disulfide reductase, is essential for tetrathionate oxidation in Advenella kashmirensis // Microbiol. Res. 2017. V. 205. P. 1–7. https://doi.org/10.1016/j.micres.2017.08.002
Shahi S.K., Rai A.K., Tyagi M.B., Sinha R.P., Kumar A. Rhizosphere of rice plants harbor bacteria with multiple plant growth promoting features // Afr. J. Biotechnol. 2011. V. 10. P. 8296–8305. https://doi.org/10.5897/AJB11.602
Singh P., Kumar V., Agrawal S. Evaluation of phytase producing bacteria for their plant growth promoting activities // Int. J. Microbiol. 2014. Art. 426483. P. 1–7. https://doi.org/10.1155/2014/426483
Sugiyama J., Kiyuna T., Nishijima M., An K.-D., Nagatsuka Y. Tazato N., Handa Y., Hata-Tomita J., Sato Y., Kigawa R., Sano C. Polyphasic insights into the microbiomes of the Takamatsuzuka Tumulus and Kitora Tumulus // J. Gen. Appl. Microbiol. 2017. V. 63. P. 63–113. https://doi.org/10.2323/jgam.2017.01.007
Sura-de Jong M., Reynolds R.J.B., Richterova K., Musilova L., Staicu L.C., Chocholata I., Cappa J.J., Taghavi S., van der Lelie D., Frantik T., Dolinova I., Strejcek M., Cochran A.T., Lovecka P., Pilon-Smits E.A.H. Selenium hyperaccumulators harbor a diverse endophytic bacterial community characterized by high selenium resistance and plant growth promoting properties // Front. Plant Sci. 2015. V. 6. Art. 113. P. 1‒17. https://doi.org/10.3389/fpls.2015.00113
Veselov S.Yu., Kudoyarova G.R., Egutkin N.L., Guili-Zade V.Z., Mustafina A.R., Kof E.M. Modified solvent partitioning scheme providing increased specificity and rapidity of immunoassay for indole 3-acetic acid // Physiol. Plant. 1992. V. 86. P. 93‒96. https://doi.org/10.1111/j.1399-3054.1992.tb01316.x
Wang H., Zhou S., Wang Y., Kong D., Guo X., Zhu J., Dong W., Ruan Z. Advenella alkanexedens sp. nov., an alkane-degrading bacterium isolated from biogas slurry samples // Int. J. Syst. Evol. Microbiol. 2016. V. 66. P. 906‒911. https://doi.org/10.1099/ijsem.0.000811
Wűbbeler J.H., Lűtke-Eversloh T., Van Trappen S., Vandamme P., Steinbűchel A. Tetratiobacter mimigardefordensis sp. nov., isolated from compost, a betaproteobacterium capable of utilizing the organic disulfide 3,3-dithiodipropionic acid // Int. J. Syst. Evol. Microbiol. 2006. V. 56. P. 1305‒1310. https://doi.org/10.1099/ijs.0.64126-0
Zhang P., Jin T., Sahu S.K., Xu J., Shi Q., Liu H., Wang Y. The distribution of tryptophan-dependent indole-3-acetic acid synthesis pathways in bacteria unraveled by large-scale genomic analysis // Molecules. 2019. V. 24. Art. 1411. P. 1–14.https://doi.org/10.3390/molecules24071411
Дополнительные материалы отсутствуют.


