Микробиология, 2022, T. 91, № 2, стр. 171-190
Deferrivibrio essentukiensis sp. nov., gen. nov. – представитель нового семейства Deferrivibrionaceae fam. nov., выделенный из подземного водоносного горизонта кавказских минеральных вод
Д. Г. Заварзина a, *, М. И. Прокофьева a, В. А. Пихтерева b, А. А. Клюкина a, А. А. Маслов c, А. Ю. Меркель a, С. Н. Гаврилов a
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b МГУ им. М.В. Ломоносова, Биологический факультет
119234 Москва, Россия
c МГУ им. М.В. Ломоносова, Геологический факультет
119991 Москва, Россия
* E-mail: zavarzinatwo@mail.ru
Поступила в редакцию 25.11.2021
После доработки 01.12.2021
Принята к публикации 01.12.2021
- EDN: NVJSMS
- DOI: 10.31857/S0026365622020136
Аннотация
Ессентукское месторождение Кавказских минеральных вод содержит запасы бальнеологически ценной питьевой минеральной воды, которая добывается из верхнемелового подземного водоносного горизонта, залегающего на глубине до 1 км, и остается практически неисследованной с микробиологической точки зрения. В ходе работы мы отобрали пробы этой воды через эксплуатационные скважины, работающие в непрерывном режиме, охарактеризовали филогенетическое разнообразие ее микробного сообщества и получили накопительные культуры термофильных железоредукторов из водоносного горизонта. Из накопительных культур была выделена новая анаэробная термофильная бактерия, восстанавливающая Fe(III) в составе минерала ферригидрита с ацетатом в качестве донора электронов. Новый изолят, обозначенный как штамм Es71-Z0220T, и отнесенный к порядку Deferribacterales, является термофильным, нейтрофильным, галотолерантным подвижным вибрионом. Он использует синтезированный ферригидрит, фумарат, нитрат или элементную серу в качестве акцепторов электронов с органическими кислотами в качестве доноров электронов. Штамм не способен к восстановлению растворимых комплексов Fe(III) и к брожению. В результате сборки генома штамма Es71-Z0220T было получено 65 контигов общей длиной 2.3 млн п.о. На основе полногеномной филогенетической реконструкции и физиологических свойств новый изолят был отнесен к новому семейству, роду и виду Deferrivibrio essentukiensis gen. nov., sp. nov. Геномный анализ выявил ключевые детерминанты известных путей анаэробного дыхания и углеродного метаболизма и характерные особенности предполагаемых путей переноса электронов на Fe(III). С учетом выявленных метаболических особенностей Deferrivibrio essentukiensis, мы предполагаем, что этот организм в его подземном местообитании участвует в биогеохимическом цикле углерода, сопрягая окисление органического вещества с восстановлением минералов Fe(III).
Питьевые минеральные воды представляют собой один из наиболее значимых природных ресурсов. Официально, к этому типу вод относятся только микробиологически неизмененные воды. Самоизливающиеся природные источники или каптируемые скважинами подземные минеральные воды являются объектами тщательной защиты от загрязнения, гарантирующей сохранение их первоначальногохимического и микробного состава при эксплуатации месторождений (Loy et al., 2005). Это неудивительно, учитывая, что предположения о значительном влиянии метаболической активности микроорганизмов на генезис минеральных вод были выдвинуты уже довольно давно (Leclerc et al., 2005). Однако филогенетическое и метаболическое разнообразие микробных сообществ и отдельных микроорганизмов, населяющих подземные водоносные горизонты, до сих пор остается недостаточно изученным. В этой связи следует упомянуть недавние работы, описывающие филогенетический состав сообществ нескольких европейских бутилированных минеральных вод и их источников (Lesaulnier et al., 2017; Krauze et al., 2017; Sala-Comorera et al., 2020). Эти исследования показали преобладание Gammaproteobacteria в большинстве проанализированных микробных сообществ и значительные различия в их филогенетических профилях на уровне порядков и семейств. В то же время, участие микробиоты минеральных вод в формировании их состава осталось практически неизученным. Микробиологические исследования по этому вопросу могут стать важным инструментом оценки ресурсов минеральных вод, необходимым для их правильной эксплуатации. Применительно к подземным месторождениям минеральных вод, работы по оценке микробного разнообразия предоставляют микробиологам уникальную возможность изучить автохтонную микрофлору подземных водоносных горизонтов, недоступных для прямого отбора проб, и оценить ее геохимическую активность и экологическую роль.
Объектом нашего исследования стало Ессентукское месторождение минеральных вод (ЕММВ), расположенное в Кисловодско-Кумагорской тектонической зоне повышенной трещиноватости (Предкавказье) и имеющее сложные гидрогеологические условия, обусловленные геологическим строением. Основной гидрогеохимической особенностью ЕММВ является газогидрогеохимическая аномалия (инверсия) минеральных вод. Ее формированию способствовали своеобразный палеогидрогеодинамический режим в горизонтах разного возраста и процессы альпийского цикла геологического развития Кавказского региона, которые привели к образованию сложной системы разнонаправленных субширотных и субмеридиональных линейных и кольцевых зон разломов в осадочных породах. Считается, что сложность геологического строения региона обусловливает большое разнообразие минеральных вод ЕММВ с минерализацией от практически пресных (0.5‒0.9 г/л) до высокоминерализованных вод (10.0‒14.0 г/л), температурой от 10 до ~70°С и изменчивостью преобладающих анионов (карбонатные, бикарбонатные, хлоридные или сульфатные) (Абрамов, Вавичкин, 2010; Lavrushin et al., 2020; Filimonova et al., 2020). Система разломных зон в регионе служит каналом для ювенильных газов, прежде всего, СО2 и Н2 (Filimonova et al., 2020), которые могут обеспечивать хемотрофную часть микробного сообщества источниками углерода и энергии, например, в процессах метано- или ацетогенеза. Наличие этих газов в сочетании с неорганическими акцепторами электронов, в первую очередь с минералами Fe(III) и соединениями серы, присутствующими в водовмещающих породах, созадает потенциал для развития большого разнообразия метаболических процессов, обеспечивающих развитие и поддержание микробной жизни в водоносных горизонтах ЕММВ. Микробные сообщества этих подземных экосистем привлекали внимание исследователей в течение нескольких десятилетий, но, в основном, в центре внимания предыдущих микробиологических исследований в регионе были культивируемые сульфатредукторы или условно-патогенные микроорганизмы, способные к деградации рассеянного органического вещества (см. Потапов и соавт., 2014, 2017 и ссылки в них).
В 2018 г. на ЕММВ была начата масштабная программа по переоценке запасов подземных минеральных вод. В рамках программы многие эксплуатационные скважины работали с максимальной производительностью в течение длительного периода, что позволило отбирать пробы подземных минеральных вод, добываемых из водоносных горизонтов глубиной до 1 км, непосредственно из устья скважины, избегая погрешностей, связанных с застоем воды в ее стволе. В рамках этой программы был произведен отбор проб воды из 2-х скважин для микробиологических исследований. Обе скважины вскрывают один и тот же верхнемеловой водоносный горизонт, из которого добывается одна из наиболее бальнеологически ценных минеральных вод ЕММВ (тип “Ессентуки № 4”).
Целью настоящей работы было описание физиологических и геномных особенностей диссимиляционной железоредуцирующей бактерии, выделенной из отобранных проб подземных минеральных вод ЕММВ и представляющей новые вид, род и семейство в порядке Deferribacterales филума Deferribacterota.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Пробы и накопительные культуры. Пробы минеральных вод отбирали из скважины 71 в сентябре 2020 года и из скважины 71Н в июле 2021 года. Обе скважины (E 42°56′30′′ N 44°11′20′′) расположены в 14 м друг от друга и имеют глубину 999 м с открытым стволом в интервале 676.0‒998.9 м. Минеральные подземные питьевые воды добываются из верхнемелового сеноман-маастрихтского водоносного горизонта (K2s-m), простирающегося по всей площади ЕММВ. Общая мощность водоносного горизонта, сложенного известняками, переслаивающимися пачками мергелей и песчаников, и характеризующегося сложными гидродинамическими условиями, колеблется от 300 до 350 м. Скважина 71 используется для промышленной добычи минеральной воды типа “Ессентуки № 4”, а скважина 71Н используется как резервная для скважины 71. Образцы воды из обеих скважин использовали в качестве посевного материала для выделения железоредуцирующих микроорганизмов, которые могут развиваться в осадочных породах водоносного горизонта. Образцы из основной добывающей скважины 71 использовали также для выделения ДНК и дальнейшего филогенетического профилирования микробного сообщества этой минеральной воды. Для оценки филогенетического разнообразия микробного сообщества исследуемой минеральной воды образцы для последующего выделения ДНК отбирали из добывающей скважины 71 с помощью мембранных фильтрационных установок ФМ02-1000 объемом 1 л (Институт аналитического приборостроения РАН, Санкт-Петербург, Россия) с трековыми мембранными фильтрами с размером пор 0.2 мкм (ОИЯИ, Дубна, Россия). Предварительно стерилизованные фильтрационные установки собирали на месте, подключали к устьевой арматуре через стерильные штуцеры и шланги и пропускали по 100 л воды на каждый образец через фильтры под естественным избыточным давлением скважин (4‒6 атм. на устье). По окончании фильтрации остатки воды полностью продавливали через фильтры выходящими из скважин газами, фильтры замачивали в буфере А (100 мМ Трис-HCl, pH 8.0; 100 мМ ЭДТА; 150 мМ NaCl), перевозили в лабораторию в стерильных 15-мл пробирках Falcon на льду и замораживали при ‒20°C для хранения до последующего выделения ДНК.
Для получения накопительных культур использовали стерильные пробирки Хангейта объемом 17 мл для анаэробного культивирования, предварительно заполненные 100% CO2 и субстратами, необходимыми для развития целевых метаболических групп микроорганизмов. Пробы воды, отобранной из скважины, объемом 10 мл вносились в пробирки стерильными шприцами, после чего пробирки инкубировали в темноте при температуре 47°C – средней температуре, наблюдаемой при эксплуатации скважины в непрерывном режиме. Таким образом, образцы воды служили как основой минеральной среды, так и посевным материалом для накопления целевой группы микроорганизмов.
Профилирование сообщества путем секвенирования фрагментов генов 16S рРНК. Для профилирования микробного сообщества минеральной воды по фрагментам гена 16S рРНК ДНК выделяли непосредственно из замороженных фильтров с помощью набора реагентов FastDNA Spin Kit for Soil (“MP Bio”, США) в соответствии с инструкциями производителя. Библиотеки ампликонов V4-участка гена 16S рРНК получали, как описано ранее (Gohl et al., 2016), используя праймеры 515F (5'-GTGBCAGCMGCCGCGGCGGTAA-3' (Hugerth et al., 2014)) ‒ Pro-mod-805R (5'-GACTACNVGGGTMTCTAATCC-3' (Меркель и соавт., 2019)). Библиотеки были получены в двух повторностях и секвенированы на системе MiSeq (“Illumina”, Калифорния, США) с использованием картриджа парного чтения длиной 150 нуклеотидов. Биоинформационный анализ профилей генов 16S рРНК проводили в соответствии с (Merkel et al., 2021). Все результаты секвенирования генов 16S рРНК были депонированы в NCBI BioProject PRJNA760784.
Секвенирование генома, сборка, аннотация и филогенетический анализ. ДНК штамма Es71-Z0220T для секвенирования генома выделяли с помощью набора реагентов FastDNA Spin Kit (“MP Bio”, США). Геном секвенировали на системе NextSeq (“Illumina”, Калифорния, США) с использованием набора реагентов, обеспечивающего считывание 2 × 100 п.о. В результате сборки прочтений генома с помощью программы Unicycler v0.4.8 (Wick et al., 2017) было получено 65 контигов общим размером 2 362 387 п.о. (значение N50 – 77 140 п.о.). Окончательное покрытие сборки генома составило 1207 раз. Автоматическая аннотация была выполнена с помощью программы PGAP 2021-07-01 (Tatusova et al., 2016). Сборка генома была депонирована как Whole Genome Shotgun project в базу данных DDBJ/ENA/GenBank под номером JAJAFU000000000.
Уточнение автоаннотаций и других предсказаний функций генов проводили вручную, как описано ранее (Toshchakov et al., 2018). Мультигемовые цитохромы были предсказаны с использованием аминокислотных последовательностей цитохромов, участвующих во внеклеточном переносе электронов (ВПЭ) у Geobacter sulfurreducens (Butler et al., 2010; Aklujkar et al., 2013), Shewanella oneidensis (Coursolle et al., 2010; Schicklberger et al., 2013), “Thermincola potens” (Carlson et al., 2012; Costa et al., 2019) и Carboxydothermus ferrireducens (Gavrilov et al., 2021), в качестве запросов. Гем-связывающие мотивы предсказывали, как описано ранее (Mardanov et al., 2015). Внутриклеточную локализацию мультигемовых цитохромов предсказывали на основе консенсусных результатов предсказаний онлайн-сервисов TMHMM 2.0 (на базе CBS Prediction Servers, http://www.cbs.dtu.dk/services) и Phobius (http://phobius.sbc.su.se/). Консервативные домены предсказывали с помощью онлайн-сервиса HMMSCAN (https://www.ebi.ac.uk/Tools/hmmer/ search/hmmscan) с учетом баз данных белковых семейств Pfam, TIGRFAM, Gene3D, Superfamily, PIRSF и TreeFam.
Для полногеномной филогенетической реконструкции использовали 120 консервативных маркерных однокопийных генов бактерий, как описано ранее (Parks et al., 2020). Филогенетические деревья были построены с помощью программы IQ-TREE 2 (Nguyen et al., 2015) с быстрым выбором модели посредством ModelFinder (Kalyaanamoorthy et al., 2017) и сверхбыстрой аппроксимацией для филогенетического бутстрeп-теста (Hoang et al., 2018), а также тестом приблизительного отношения правдоподобия для ветвлений (Anisimova, Gascuel, 2006).
Физиологические исследования. Базовая среда (A) для выделения чистой культуры, содержала (г/л): NH4Cl ‒ 0.33; KCl ‒ 0.33; KH2PO4 ‒ 0.33; Ca-Cl2 · 2H2O ‒ 0.33; MgCl2 · 6H2O ‒ 0.33; NaCl ‒ 2.0; NaHCO3 ‒ 6.0; Na2S · 9H2O ‒ 0.5; 1 мл/л раствора микроэлементов (Кевбрин, Заварзин, 1992); 1 мл/л раствора витаминов (Wolin et al., 1963). Ацетат натрия (20 мМ) использовали в качестве донора электронов и основного источника углерода, а синтезированный ферригидрит (СФ) служил целевым акцептором электронов для микроорганизмов, восстанавливающих Fe(III). СФ готовили, как описано ранее (Заварзина и соавт., 2006), и добавляли в среду перед стерилизацией до конечного содержания Fe(III) 50 мМ. Среду готовили анаэробно, охлаждали под CO2 (100%), разливали по 10 мл в пробирки Хангейта под током CO2 и автоклавировали при 121°C в течение 20 мин; pH среды (A) после стерилизации равен 6.7. Чистая культура была протестирована на способность ростa с растворимым акцептором электронов фумаратом (20 мМ). После успешного тестирования были определены оптимальные концентрации NaCl и NaHCO3 для роста нового изолята, и среда была оптимизирована путем добавления 7.0 г/л NaCl, 6.0 г/л NaHCO3 и 0.3 г/л Na2S · 9H2O в качестве восстановителя; рН среды после автоклавирования 7.1. Оптимизированная среда (Б) была использована для дальнейшей физиологической характеристики изолята. Для определения спектра акцепторов электронов, используемых изолятом, с ацетатом в качестве донора электронов были использованы: кротонат (10 мМ); антрахинондисульфонат (АХ-ДС/AQDS, 10 мМ); элементная сера (1 мас. %); сульфат (20 мМ); сульфит (2 мМ); тиосульфат (10 мМ); диметилсульфоксид (10 мМ); селенит (5 мМ); нитрат (10 мМ); растворимые формы Fe(III) (цитрат или Fe(III)-ЭДТА, по 10 мМ). Из состава сред, содержащих нитрат и соединения железа, сульфид был исключен. Для рутинных пересевов, тестов на устойчивость к антибиотикам, определения оптимума температуры и pH использовали среду (Б) с фумаратом и ацетатом натрия, восстановленную Na2S · 9H2O. Инкубацию проводили при 47°C, если не указано иное. Все физиологические тесты проводились в двух повторностях.
Морфологию клеток исследовали с помощью фазово-контрастной и флуоресцентной микроскопии с использованием микроскопа Axio Lab.A1 (“Zeiss”, Германия), ультраструктуру клеток – с помощью электронного микроскопа JEM-100 (“JEOL”, Япония), как описано ранее (Заварзина и соавт., 2006). Рост культуры отслеживали прямым подсчетом клеток с помощью фазово-контрастной микроскопии. Для отслеживания роста культуры с СФ, клетки окрашивали ДНК-связывающим красителем (акридиновым оранжевым) и визуализировали с помощью флуоресцентной микроскопии.
Для определения оптимальных условий роста на среде (Б) были протестированы температуры от 24 до 65°C, концентрации NaCl до 25 г/л, NaH-CO3 до 20 г/л и pH от 6.0 до 8.15. Подсчет клеток проводили на протяжении 2‒14 дней инкубирования. Оптимальные для роста концентрации NaCl определяли на модифицированной среде (Б), в которой все хлориды были заменены эквимолярными концентрациями нитратов или сульфатов. Значения pH всех использованных сред регулировали с помощью 6 М раствора HCl или 12 М раствора NaOH, щелочные среды готовили с использованием газовой смеси N2/CO2 (80/20 об. %).
Аэробный и микроаэробный рост проверяли с использованием среды (Б), не содержащей восстановителя, при 2, 4, 10% O2 или 100% воздуха в газовой фазе. Активность каталазы проверяли по образованию пузырьков при обработке биомассы 3% H2O2, активность оксидазы определяли с 1%-м раствором тетраметилпарафенилендиамина (Cappuccino et al., 2002).
Помимо ацетата был протестирован набор следующих субстратов и доноров электронов: лактат, пируват, сукцинат, метанол, этанол, н‑пропанол, бутанол, формиат, малат, цитрат, N‑ацетил-D-глюкозамин, глюкоза, сахароза, целлобиоза, микрокристаллическая и карбоксиметилцеллюлоза, пептон, дрожжевой и мясной экстракты, триптон. Также, в качестве донора электронов в отсутствие органических соединений был протестирован молекулярный водород (100% в газовой фазе). Рост считался положительным, если в течение трех последовательных пересевов на одну и ту же среду с одним и тем же субстратом не наблюдали снижения численности клеток, и если количество клеток в три раза превышало таковое в контрольном эксперименте без субстрата. Все органические субстраты (пептиды, углеводы, спирты и органические кислоты) были простерилизованы с помощью шприцевых фильтров с размером пор 0.2 мкм (“Millipore”) и добавлены до их конечной концентрации 0.3 мас. %. Использование несбраживаемых субстратов тестировали с использованием СФ в качестве акцептора электронов. Способность к анаэробному дыханию исследовали на оптимизированной среде (Б) с ацетатом в качестве субстрата. Чувствительность к антибиотикам проверяли на среде (Б) с фумаратом и ацетатом. Концентрированные растворы отдельных антибиотиков стерилизовали с помощью шприцевых фильтров и вносили в пробирки со стерильной средой.
Потребление ацетата определяли на газовом хроматографе Кристалл 5000.2 (“Хроматэк”, Россия), оснащенном детектором катарометром и колонкой с молекулярным ситом 5А (1 м), с аргоном в качестве газа-носителя. Образцы для хроматографии получали центрифугированием (при 12 000 g в течение 3 мин) выросшей культуры с последующим подкислением отобранного супернатанта особо чистой муравьиной кислотой до рН 2.0.
Образование сульфида при росте с соединениями серы определяли по Трюперу и Шлегелю (Trüper, Schlegel, 1964). Образование Fe(II) при росте на соединениях Fe(III) контролировали с помощью феррозина (Stookey, 1970) с предварительной экстракцией Fe(II) из СФ и магнетита 0.6 н HCl; восстановление АХДС контролировали по изменению цвета среды.
При ростe на нитрате продукцию нитритов оценивали с помощью нитритных тест-полосок (MerckQuant, “Merck”, Германия), а концентрацию аммония определяли с помощью индофенола, как описано ранее (Scheiner, 1976).
Для анализа жирных кислот изолят выращивали в оптимальных физико-химических условиях. Биомассу собирали в поздней экспоненциальной фазе роста. Профили клеточных жирных кислот определяли методом ГХ-МС (на установке Thermo Scientific Trace GC Ultra DSQ II с колонкой HP-5MS, EI70 eV) метиловых эфиров, приготовленных из 5 мг сублимированной биомассы, обработанной безводной смесью HCl/метанол, по времени удерживания (с использованием стандартов “Supelco”, “Merck”, Германия), эталонным значениям эквивалентной длины цепи (Härtig, 2008) и масс-спектрам (программа NIST MS Search 2.0, поставляемая с установкой ГХ-МС). Содержание жирных кислот в клетках определяли в процентах от общей площади пика ионного тока.
Изопреноидные хиноны выделяли по методу Коллинзa (Collins, Jones, 1981; Collins, 1985) и анализировали с помощью масс-спектрометра тандемного типа LCQ ADVANTAGE MAX и ионизационного масс-спектрометра Finnigan Mat 8430.
Спектрофотометрическое определение цитохромов c-типа проводили на основе быстрого сканирования спектра поглощения УФ-видимого света микробными клетками или их фракциями, позволяющего определить редокс-состояние цитохромов по специфическим пикам поглощения, как описано ранее (Mardanov et al., 2015). В настоящем исследовании анализ был модифицирован: цитохромы определяли непосредственно в суспензии целых клеток, выращенных на фумарате, а реокисление суспензии, восстановленной дитионитом, проверяли с помощью 1 мМ растворимого цитрата железа(III). Температура инкубации (47°C) соответствовала оптимуму роста изолята.
РЕЗУЛЬТАТЫ
Характеристика места отбора проб. Отобранная минеральная вода относится к минеральным лечебно-питьевым водам типа “Ессентуки № 4”. Основные физико-химические характеристики воды из скважин 71 и 71Н на момент отбора проб представлены в табл. 1. Эти данные позволяют охарактеризовать ее как термальную, слабощелочную, углекислую минеральную воду.
Таблица 1.
Основные физико-химические характеристики проб минеральной воды из скважин 71 и 71Н, полученных на устьях скважин в сентябре 2020 и июле 2021 г. соответственно
| Скважина | pH | T, °C | Eh, мВ | TDS, г/л | ОУ, г/л | ООУ г/л | Газовый фактор, м3/м3 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 71 | 6.8 | 40.5 | +205 | 9.0 | 884.0 | 23.4 | 1.26 | |||||
| 71Н | 7.2 | 43.0 | Н.о. | 8.92 | Н.о. | Н.о. | 1.23 | |||||
| Основные катионы и анионы, мг/л | ||||||||||||
| Na+ | K+ | Ca2+ | Mg2+ | ${\text{HCO}}_{3}^{ - }$ | ${\text{SO}}_{4}^{{2 - }}$ | Cl– | F – | Br– | B | Li+ | ${\text{NO}}_{3}^{ - }$ | |
| 71 | 2616.0 | 37.4 | 30.9 | 25.5 | 4382.0 | <0.1 | 1943.0 | <0.3 | 6.1 | 5.0 | 0.6 | <0.1 |
| 71Н | 2690.0 | 21.0 | 48.0 | 23.0 | 4296.0 | 9.0 | 1816.0 | 4.1 | 7.0 | 9.6 | 0.9 | 0.2 |
| Состав свободного газа, об. % | ||||||||||||
| H2 | N2 | CH4 | CO2 | |||||||||
| 71 | 0.015 | 26 | 9 | 67 | ||||||||
| 71Н | НО | НО | 23 | 76 | ||||||||
Филогенетический профиль микробного сообщества минеральной воды, отобранной из устья скважины 71. Анализ минеральной воды, отобранной из устья скважины 71, методом профилирования по гену 16S рРНК выявил преобладание в ней гидрогенотрофных метаногенных архей рода Methanothermobacter (37%). Эти археи вместе с филотипами, принадлежащими к роду Methanobacterium и семейству Methanomicrobiaceae, представляли собой наиболее многочисленную группу микробного сообщества и составили 41% всех прочтений генов 16S рРНК (рис. S1 ). Вторая по численности группа микробного сообщества была представлена филотипами, относящимися к сульфатредуцирующим гидрогенотрофным видам рода Thermodesulfovibrio (19%). 12% прочтений были представлены неклассифицированными филотипами филума “Spirochaetota”, 9% – неидентифицированными бактериальными филотипами. Глубокая филогенетическая линия некультивируемых актинобактерий (класс Coriobacteriia, группа уровня порядка OPB41) составила 6% всех прочтений. Неклассифицированные филотипы семейства Rhodocyclaceae и различные некультивируемые фирмикуты составляли 3 и 5% всех прочтений гена 16S рРНК соответственно.
Среди малочисленных групп сообщества, каждая из которых составляла менее 1% прочтений, было зафиксировано несколько таксонов, содержащих известные железовосстанавливающие микроорганизмы, один из которых, относящийся к порядку Deferribacterales, был представлен одной последовательностью гена 16S рРНК.
Накопительные и чистые культуры. Активный рост железоредуцирующих микроорганизмов наблюдался после четырех суток инкубации первичной накопительной культуры, содержащей минеральную воду скважины 71, СФ и ацетат. Рост сопровождался трансформацией СФ в черный магнитный минерал, предположительно магнетит. Микроскопия препаратов, окрашенных акридиновым оранжевым, показала наличие в них вибрионов и очень мелких палочек, ассоциированных с минеральными частицами, а также планктонных коккоидных клеток различного диаметра.
Профилирование первичной накопительной культуры по гену 16S рРНК выявило преобладание новых представителей порядка Deferribacterales (представленность 79%), которые имели низкий уровень сходства с ближайшим культивируемым организмом этого порядка Petrothermobacter organivorans (93.63% сходства фрагмента гена 16S рРНК). Помимо этого филотипа в сообществе присутствовали представители некультивируемого порядка актинобактерий OPB41 (3% относительной численности), спирохеты вида Rectinema cohabitans (13%) и представители рода Caldicoprobacter (5%) (рис. S2 ). Доминирующая бактерия была выделена в чистую культуру методом последовательных десятикратных разведений. В последнем положительном разведении (10–7) развивались морфологически однородные подвижные вибрионы. Чистота культуры, обозначенной как штамм Es71-Z0220T (=VKM B-3557 = JCM 39245), была подтверждена секвенированием гена 16S рРНК.
Применение тех же условий культивирования к пробе воды скважины 71Н, отобранному через 9 мес. после выделения штамма Es71-Z0220T, привело к выделению еще одного представителя порядка Deferribacterales. Анализ полной последовательности генов 16S рРНК показал, что этот представитель, обозначенный как штамм Es71N, принадлежит к тому же виду, что и штамм Es71-Z0220T (сходство полной последовательности генов 16S рРНК 99.67%).
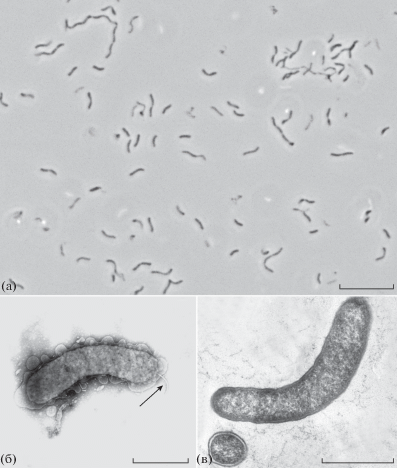
Фенотипическая и хемотаксономическая характеристика. Клетки штамма Es71-Z0220T представляли собой вибрионы толщиной 0.4‒0.5 мкм и длиной 1‒3 мкм, встречающиеся поодиночке, парами или длинными цепочками. Цепочки наблюдались только в неоптимальных условиях роста (рис. 1a). В поздней экспоненциальной фазе роста клетки образовывали сферопласты и часто скапливались в плотные клубки длинных цепочек. Спорообразования не наблюдалось. Подвижность клеток обеспечивалась одним полярно расположенным жгутиком (рис. 1б). Ультратонкий срез выявил грамотрицательный тип клеточной стенки (рис. 1в).
Рис. 1.
Морфология клеток штамма Es71-Z0220T: a ‒ фазово-контрастная фотография культуры, выращенной с фумаратом и ацетатом, в стационарной фазе роста; б ‒ просвечивающая электронная микрофотография клетки со жгутиком; в ‒ просвечивающая электронная микрофотография ультратонкого среза клетки, демонстрирующая грамотрицательную структуру клеточной стенки. Масштабные линейки: а ‒ 10 мкм; б, в ‒ 0.5 мкм.
Штамм Es71-Z0220T являлся облигатным анаэробом. Рост не наблюдался в аэробной среде или при 2% или более высоком содержании O2 в газовой фазе. Более того, клетки быстро лизировались на воздухе, а их количество в открытой пробирке Хангейта уменьшалось вдвое за 45 мин. Штамм оказался каталазо- и оксидазоположительным. Это умеренный термофил, растущий в диапазоне температур от 30 до 54°C, с оптимумом при 47°C. При 24 и 60°C роста не наблюдалось. рН-диапазон роста при 47°C составлял 6.2‒7.9, с оптимумом при pH 7.1. При pH ниже 6.0 или выше 8.15 рост не наблюдался. Штамм Es71-Z0220T рос при концентрациях NaCl от 0 до 18 г/л с оптимумом при 6‒8 г/л, т.е. являлся галотолерантным. При 20 г/л NaCl рост не наблюдался (рис. S3 ). Рост наблюдался при концентрации бикарбоната натрия от 0 до 20 г/л с оптимумом при 7‒8 г/л (рис. S3 ). Минимальное время удвоения составило 3 ч при оптимальных условиях роста (47°C, рН 7.1; 10 мМ фумарата и ацетата; 0.3 г/л Na2S · 9H2O; 7 г/л NaHCO3; 6.0 г/л NaCl).
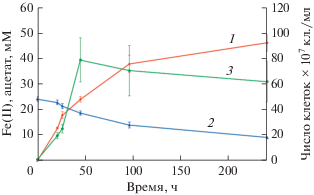
Штамм Es71-Z0220T был способен к окислению ацетата, лактата, пирувата, сукцината (табл. 2), в то время как молекулярный водород, метанол, этанол, н-пропанол, бутанол, формиат, малат, цитрат, N-ацетил-D-глюкозамин, карбоксиметил- и микрокристаллическая целлюлоза не окислялись организмом и не поддерживали его рост в присутствии СФ как акцептора электронов. Штамм Es71-Z0220T был неспособен к сбраживанию пептона, дрожжевого или мясного экстрактов, триптона, глюкозы, сахарозы или целлобиозы. В качестве акцепторов электронов организм использовал СФ, фумарат, нитрат и элементную серу с ацетатом как донором электронов. АХДС, сульфат, сульфит, тиосульфат, диметилсульфоксид, селенит, кротонат, а также растворимые формы Fe(III), цитрат железа и Fe(III)-ЭДТА, не поддерживали рост организма. Штамм Es71-Z0220T восстанавливал СФ до черного магнитного осадка (рис. 2а), образуя 46 мМ Fe(II) одновременно окисляя 15 мМ ацетата (рис. 3). Рост на нитрате сопровождался образованием примерно 0.2‒0.4 мМ нитрита в качестве промежуточного продукта и приводил в итоге к образованию 3.95 ± 0.25 мМ аммония в стационарной фазе роста. Рост на элементной сере с ацетатом был слабее, чем на СФ, фумарате или нитрате (табл. 2). Тем не менее, по достижении стационарной фазы роста на сере была детектирована продукция 2.76 ± 0.24 мМ сульфида.
Таблица 2.
Сравнительные характеристики штамма Es71-Z0220T и типовых видов родов, относящихся к порядку Deferribacterales
| Штамм Es71-Z0220T | Petrothermobacter organivorans, штамм ANAT [Tamazawa et al., 2017] | Calditerrivibrio nitroreducens, штамм Yu37-1T [Merkel et al., 2021] | Flexistipes sinusarabici штамм MAS 10T [Slobodkin et al., 2019] | Deferribacter thermophilus, штамм BMAT [Sohm et al., 2011] | Denitrovibrio acetiphilus штамм N2460T [Starwalt-Lee et al., 2021] | Geovibrio ferrireducens, штамм PAl-1T [Stookey, 1970] | Mucispirillum schaedleri, штамм HRI I17T [Tatusova et al., 2016] | |
|---|---|---|---|---|---|---|---|---|
| Морфология | Вибрионы | Слегка изогнутые палочки | Вибрионы | От прямых до сильно изогнутых, гибких палочек | Прямые или изогнутые палочки | Вибрионы | Вибрионы | Изогнутые или спиральные палочки |
| Длина клеток, мкм | 3‒5 | 1.5–5.0 | 2 | 5–50 | 1–5 | 2 | 2−6 | 4 |
| Температурный диапазон роста (оптимум), °C | 25‒54 (45‒50) | 25–60 (55) | 30‒65 (55) | 30‒53 (45‒50) | 50‒65 (60) | 4‒40 (35‒37) | Up to 50 (35) | Up to 47 (37) |
| pH-диапазон роста (оптимум) | 6‒8.2 (7.1) | 6.0–8.0 (7.0) | 5.5‒8.0 (7.0‒7.5) | 6.0–8.0 | 5.0‒8.0 (6.5) | 6.5‒8.6 | Н.о. | Н.о. |
| NaCl, конц. пределы роста (оптимум), % | 0‒1.8 (0.7) | 0‒6.0 (2.5) | 0‒0.5 (0) | 3‒18 | 0‒5.0 | 0‒6 (3‒4) | 0‒2 (0.5) | 0 |
| Толерантность к кислороду | ‒ | Н.о. | ‒ | ‒ | +* | ‒ | ‒ | ‒ |
| Акцепторы электронов: | ||||||||
| Fe(III) гидроксид*** | + | + | ‒ | Н.о. | + | Н.о. | + | Н.о. |
| Mn(IV) оксид | (+) | + | ‒ | Н.о. | + | Н.о. | ‒ | Н.о. |
| элементная сера | (+) | ‒ | ‒ | (+) | ‒ | ‒ | + | Н.о. |
| ${\text{SO}}_{4}^{{2 - }}$ | ‒ | + | ‒ | Н.о. | ‒ | ‒ | ‒ | Н.о. |
| ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$ | ‒ | ‒ | ‒ | Н.о. | ‒ | ‒ | ‒ | Н.о. |
| ${\text{NO}}_{3}^{ - }$ | + | + | + | Н.о. | + | + | ‒ | ‒ |
| O2 | ‒ | ‒ | ‒ | ‒ | ‒ | ‒ | ‒ | Н.о. |
| фумарат | + | Н.о. | ‒ | Н.о. | ‒ | Н.о. | ‒ | Н.о. |
| Доноры электронов: | ||||||||
| формиат | ‒ | ‒ | ‒ | Н.о. | ‒ | ‒ | ‒ | Н.о. |
| ацетат | + | + | + | (+) | + | + | + | Н.о. |
| лактат | + | + | + | Н.о. | + | ‒ | + | Н.о. |
| сукцинат | + | ‒ | + | Н.о. | + | Н о. | + | Н.о. |
| пируват | + | + | + | Н.о. | + | ‒ | + | Н.о. |
| этанол | ‒ | ‒ | ‒ | Н.о. | ‒ | ‒ | ‒ | Н.о. |
| дрожжевой экстракт | ‒ | + | + | + | + | ‒ | + | Н.о. |
| пептон | ‒ | ‒ | + | + | + | ‒ | Н.о. | |
| казаминовые кислоты | ‒ | ‒ | + | (+) | + | ‒ | + | Н.о. |
| H2 | ‒ | ‒ | ‒ | Н.о. | + | ‒ | + | Н.о. |
| Хемолитоавтотрофный рост | ‒ | ‒ | ‒ | ‒ | + | ‒ | + | Н.о. |
| Брожение | ‒ | + | ‒ | + | ‒ | + | ‒ | +** |
| Минимальное время удвоения, ч | 3 | Н.о. | NT | Н.о. | Н.о. | 8 | Н.о. | |
| Содержание ГЦ ДНК, мол. % | 34.0 | 34.3 | 35.1 | 38.6 | 34.0 | 42.6 | 42.8 | |
| Основные жирные кислоты (≥5%) | 9С-С14:0, C16:0, C18:0, изо-C14:0, 14С-15:0 | C18:0, изо-C18:0, C16:0, 10-метил C18:0, антеизо-C15:0, антеизо-C17:0, изо-C16:0 | изо-C14:0, антеизо-C15:0, C16:0, C18:0, изо-C13:0, антеизо-C13:0, изо-C16:0 |
C18:0, C16:0, C17:0, изо-C14:0, антеизо- C15:0 | Н.о. | C16:0, C16:1ω9, C18:1ω7 | Н.о. | Н.о. |
| Основные хиноны | MK-8 | MK-7(H8) MK-8 | MK-8 | Н.о. | Н.о. | Н.о. | Н.о. | Н.о. |
| Источник выделения | Thermal subsurface mineral water of Yessentuki deposit, Russia | High-temperature deep subsurface oil reservoir in Yabase oil field, Japan | Hot spring water from Yumata, Nagano, Japan | Brine water samples of the Atlantis II Deep basin of the Red Sea at a depth of 2000 m | Produced water from the Beatrice petroleum reservoir in the North Sea | H2S-producing oil reservoir model column flooded by nitrate-enriched synthetic seawater | Surface sediments of a ditch in Norman, Oklahoma, USA | Gastrointestinal mucus of rodents |
Рис. 2.
Культура штамма Es71-Z0220T, выращенная на синтезированном ферригидрите: a ‒ флаконы с культурой, флакон со стерильной средой и СФ (слева) и инкубированный флакон с СФ, преобразованным в черный магнитный осадок (справа), часть осадка собрана на стенке флакона из-за прикрепленного снаружи флакона неодимового магнита; б ‒ флуоресцентная фотография окрашенной акридиновым оранжевым колонии, выросшей на частице СФ. Масштабная линейка ‒ 10 мкм.
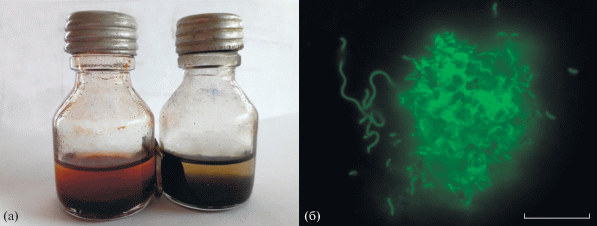
Рис. 3.
Рост, образование Fe(II) и потребление ацетата культурой штамма Es71-Z0220T на среде с синтезированным ферригидритом: 1 ‒ образование Fe(II); 2 ‒ потребление ацетата; 3 ‒ рост культуры.
Штамм Es71-Z0220T был устойчив к ингибитору рибосомального биосинтеза белка канамицину (100 мг/л) и чувствителен к нескольким другим типам антибиотиков. Его рост прекращался под действием ингибитора рибосомального биосинтеза белка неомицина (10 мг/л), ингибиторов биосинтеза клеточной стенки ванкомицина (80 мг/л) и ампициллина (100 мг/л), а также ингибитора ДНК-зависимой РНК-полимеразы рифампицина (0.1 мг/л).
Состав жирных кислот, полярных липидов и хинонов, окислительно-восстановительный спектр цитохромов. Преобладающими жирными кислотами липидной мембраны штамма Es71-Z0220T были следующие насыщенные жирные кислоты с длинной и/или разветвленной цепью: 9С-С14:0, С16:0, С18:0, изо-С14:0, 14С-С15:0 (табл. 2 и S1 ). Основным изопреноидным менахиноном, обнаруженным у штамма Es71-Z0220T, был МК-8, детектированный ранее у представителeй Deferribacterales Calditerrivibrio nitroreducens и Petrothermobacter organivorans (Iino et al., 2008; Tamazawa et. al., 2017). Биомасса штамма Es71-Z0220T, выращенная на фумарате или нитрате, или отмытая от крупных частиц магнетита, имела розовато-коричневатый цвет, что указывает на активную продукцию цитохромов. Суспензия клеток, выращенных на фумарате, на анаэробной среде (Б), имела пик светопоглощения при 405 нм, характерный для окисленных цитохромов c-типа (рис. 4). Добавление дитионита к суспензии вызывало появление пиков при 419, 522 и 552 нм на дифференциальном спектре восстановленного препарата против исходного, окисленного, что выявляет наличие в препарате восстановленных цитохромов c-типа. При дальнейшем добавлении растворимого цитрата железа(III) повторного окисления цитохромов не наблюдалось, и в контрольной стерильной среде не было обнаружено никаких выраженных пиков светопоглощения.
Рис. 4.
Спектрофотометрическая характеристика цитохромов c-типа в суспензии целых клеток D. essentukiensis ES71-Z0220T. Представлены спектры нативных (окисленных) цитохромов c-типа и тех же цитохромов после их восстановления дитионитом натрия, а также дифференциальный (восстановленный против окисленного) спектр. Отмечены характерные пики поглощения окисленных (при 405 нм) и восстановленных (при 419, 522 и 552 нм) цитохромов c-типа. Пунктирная линия показывает фоновый спектр поглощения неинокулированной культуральной среды, инкубированной то же время, что и выросшая культура. Все спектры даны с коррекцией относительно фона. Спектры окисленных и восстановленных цитохромов, а также фонового контроля приведены к одному масштабу, а дифференциальный, восстановленный против окисленного, спектр (зеленая линия) дан в отдельном масштабе против вспомогательной оси Y. AU – единицы светопоглощения.

Секвенирование генома и филогенетический анализ. Первичная сборка генома штамма Es71-Z0220T состояла из 65 контигов общим размером 2 362 387 п.о. с ГЦ-составом 34.04%. С помощью программного пакета NCBI PGAP в геноме было предсказано 2363 гена: 2293 белок-кодирующих последовательности, 47 генов РНК, включая 3 рРНК и 40 тРНК, и 23 псевдогена. Мы проанализировали геном на предмет филогенетического положения штамма Es71-Z0220T, его центрального углеродного и энергетического метаболизма, а также подвижности и предполагаемого хемотаксиса.
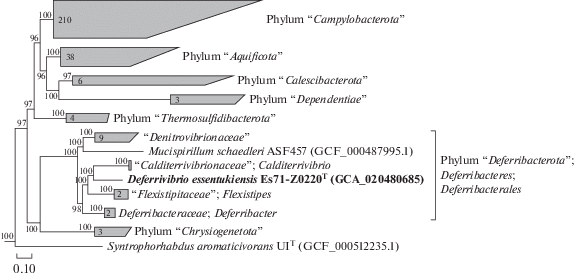
Штамм Es71-Z0220T имеет один оперон рРНК. Сравнение полной последовательности 16S рРНК с таковыми из базы данных GenBank (Benson et al., 1999) показало, что штамм Es71-Z0220T имеет отдаленное родство с семейством Deferribacteraceae и максимальную попарную идентичность с Petrothermobacter organivorans ANAT (94.05% сходства), а также с Calditerrivibrio nitroreducens DSM 19672T (89.64%) и Deferribacter thermophilus BMA1T (88.08%). Средняя идентичность аминокислотных последовательностей (AAI) D. essentukiensis и других секвенированных представителей Deferri-bacterales составила от 48 до 59% (рис. S4 ). Для прояснения таксономического положения штамма Es71-Z0220T была выполнена филогенетическая реконструкция на основе анализа конкатенированных частичных аминокислотных последовательностей 120-ти консервативных бактериальных белков (рис. 5). Этот анализ выявил, что штамм Es71-Z0220T четко обособлен от других известных родов и семейств класса Deferribacteres и образует отдельную филогенетическую ветвь уровня семейства в порядке Deferribacterales. Учитывая эти результаты и основываясь на полногеномной таксономии GTDB (Parks et al., 2020), мы предлагаем новые вид и род для штамма Es71-Z0220T с названием Deferrivibrio essentukiensis gen. nov., sp. nov. в новом семействе. С учетом сравнительно высокой попарной идентичности последовательностей гена 16S рРНК штамма Es71-Z0220T и Petrothermobacter organivorans ANAT (94.05% сходства), мы предполагаем, что эти два микроорганизма могут принадлежать к одной филогенетической группе уровня семейства в порядке Deferribacterales, но, к сожалению, геном P. organivorans ANAT пока недоступен, что не позволяет проверить наше предположение.
Рис. 5.
Таксономическое положение D. essentukiensis ES71-Z0220T внутри порядка Deferribacterales по результатам филогенетического анализа конкатенированных частичных аминокислотных последовательностей 120-ти консервативных бактериальных белков (Parks et al., 2020) методом максимального правдоподобия. Значения бутстрапов выше 90% указаны в узлах ветвлений. Масштабная линейка ‒ 0.10-й аминокислотной замене в позиции. Названия таксонов приведены по базе GTDB (Parks et al., 2021).
Геномный анализ
Центральный метаболизм. Протон-транслоцирующая НАДН-дегидрогеназа I типа (комплекс I дыхательной цепи) кодируется в генном локусе LF845_01775-01845 в следующем порядке: nuoN-MLKJIHGFEDCBA. Дыхательный комплекс II (сукцинатдегидрогеназа/фумаратредуктаза) кодируется в локусе LF845_01775-01845. Окислительное фосфорилирование у штамма ES71-Z0220T детерминируется генами типичной АТФ-синтетазы F0F1-типа, субъединицы которой кодируются двумя взаимно удаленными генными кластерами. Гены цитоплазматических субъединиц ε, β, γ, α, δ и B локализованы в кластере LF845_01490-01520, а гены субъединицы А мембранного статора и ба-зового блока мембранного ротора (субъединицы С) входят в генный кластер LF845_08945-08950 вместе с геном регуляторной субъединицы AtpZ, которая, предположительно, ингибирует дефосфорилирующую активность АТФ-азы в пользу синтеза АТФ (Mendoza-Hoffmann et al., 2018). Геном штамма ES71-Z0220T содержит ключевые гены метаболизма ацетата и пирувата – ацетил-КоА-синтазы (LF845_04900) и пируваткарбоксилазы (LF845_11100). Сукцинат и лактат, вероятно, метаболизируются у D. essentukiensis малат/L-лактатдегидрогеназой (LF845_02525) и сукцинатдегидрогеназой (LF845_02470-02490), входящих в пул ферментов ЦТК. Все остальные ключевые ферменты этого цикла кодируются рядом с этими дегидрогеназами в локусе LF845_02495-02540, за исключением цитратсинтазы, кодируемой геном LF845_10495. Транспорт углеродных субстратов в клетки D. essentukiensis детерминируется генами транспортеров пирувата и лактата семейства TRAP. LF845_04590-04600 и LF845_03890-03910, а также предполагаемыми симпортерами сукцината/ацетата и протонов LF845_07175 и LF845_06765.
“Железное дыхание” (Fe(III) как акцептор электронов). Скрининг генома D. essentukiensis выявил 18 генов, кодирующих разнообразные мультигемовые цитохромы c-типа с количеством гем-связывающих мотивов от 2 до 28 на одну белковую последовательность. Для всех этих мультигемовых белков предсказаны секреция через цитоматическую мембрану или заякоривание на ее периплазматической стороне. Соответственно, любой из этих мультигемов может участвовать в процессе внеклеточного переноса электронов на нерастворимый акцептор, например, ферригидрит или другие минералы Fe(III). Десять из этих мультигемовых белков гомологичны компонентам путей ВПЭ, ранее охарактеризованным у железовосстанавливающих бактерий (Shi et al., 2016; Costa et al., 2019; Gavrilov et al., 2021) (табл. S2 ). Цитохромы LF845_03595 и LF845_05585 гомологичны филогенетически родственным между собой предполагаемым терминальным железоредуктазам OcwA из “T. potens” и OmhA из Carboxydothermus ferrireducens (Costa et al., 2019; Gavrilov et al., 2021). Цитохромы LF845_01595 и LF845_09875 гомологичны октагемовому SmhA из C. ferrireducens, а LF845_05580 гомологичен гептагемовому цитохрому Ga0395992_02_30996_31874 из того же организма. Экспрессия обоих гомологов из C. ferrireducens повышается при росте с нерастворимыми акцепторами электронов (Gavrilov et al., 2021). Цитохромы LF845_05495 и LF845_05525, предположительно заякоренные на мембране D. essentukiensis, имеют схожий невысокий уровень гомологии с внешнемембранным цитохромом OmcE G. sulfurreducens (Shi et al., 2016). Цитохром LF845_05545 гомологичен периплазматическому переносчику электронов DmsE из S. oneidensis, а наиболее крупные цитохромы D. essentukiensis (15-гемовый LF845_05555 и 28-гемовый LF845_05560) гомологичны периплазматическому декагему MtrA, являющемуся частью порин-цитохромового комплекса S. oneidensis, обеспечивающего ВПЭ у данного организма (Schickberger et al., 2013). Восемь из вышеупомянутых мультигемовых цитохромов D. essentukiensis, предположительно имеющих отношение к ВПЭ, кодированы ко-локализованными генами в локусе LF845_05495-05585 вместе с ещe двумя цитохромами. Пять цитохромов, кодированных в локусе LF845_05495-05585, содержат предполагаемые гематит-связывающие мотивы TPT, SPT и TVTPS (Lower et al., 2008). В аминокислотных последовательностях белков LF845_05585 и LF845_05545 такие мотивы фланкированы гем-связывающими сайтами. Детальные характеристики идентифицированных мультигемовых цитохромов приведены в табл. S2 . “Цитохромовый локус” D. essentukiensis кодирует также предполагаемый менахинол-окисляющий белок, содержащий домен цитохрома b/b6, LF845_05575, и белок, содержащий NHL-повторы, LF845_05565. Blast-анализ идентифицированных нами генов D. essentukiensis, имеющих отношение к ВПЭ, против таковых, ранее описанных у Deferribacter autotrophicus и D. desulfuricans (Slobodkin et al., 2019), выявил значимую гомологию между мультигемовыми цитохромами всех этих трех микроорганизмов порядка Deferribacterales. Более того, мы обнаружили, что локализация генов в “цитохромовом локусе” Deferrivibrio essentukiensis практически идентична локализации их гомологов в “цитохромовых” генных кластерах Deferribacter autotrophicus и D. desulfuricans (Slobodkin et al., 2019). Интересно, что только у железоредуцирующих микроорганизмов Deferri-vibrio essentukiensis и Deferribacter autotrophicus были обнаружены гомологи цитохрома SmhA C. ferrireducens (LF845_01595 и LF845_09875 у D. essentukiensis). Мы не обнаружили значимой гомологии какого-либо из этих белков, или ShmA, с каким-либо мультигемовым цитохромом Deferribacter desulfuricans, не способного к железоредукции.
Нитратное и серное дыхание. Deferrivibrio essentukiensis обладает генным кластером, кодирующим белки нитрат-восстанавливающей системы Nap в последовательности NapHGDA (LF845_02950-02965). Предполагаемый редокс-партнер периплазматической молибдоптериновой нитратредуктазы NapA, тетрагемовый цитохром NapM, кодируется рядом с этим кластером (LF845_02970), а гомолог менахинон-окисляющего мембраносвязанного цитохрома семейства NapC/NrfH кодируется отдельно локализованным геном (LF845_08935). В геноме D. essentukiensis отсутствуют гены аммоний-образующего нитритредуктазного комплекса NrfAH, однако присутствует ген гидроксиламиноксидоредуктазы группы εHao с восемью гемами типа с (Simon, Klotz, 2013), локализованный по соседству с “Nap-локусом” (LF845_02975). Штамм ES71-Z0220T обладает также генами нескольких каталитических субъединиц каталитических субъединиц молибдоптериновых оксидоредуктазных комплексов, один из которых имеет наибольшее сходство с белками подсемейства полисульфид/тиосульфатредуктаз и кодируется в локусе LF845_11445-11455 рядом с типичными железосерной и мембранно-связанной субъединицами оксидоредуктаз семейства CISM (Rothery et al., 2008).
Гены, детерминирующие кислородное дыхание или устойчивость к кислороду. D. essentukiensis обладает опероном, кодирующим медную цитохром c-оксидазу cbb3-типа (LF845_03180-03210). Однако гены каких-либо редокс-партнеров терминальных цитохром c -оксидаз, в частности, канонического или альтернативного комплексов III, отсутствуют в геноме D. essentukiensis. Также в геноме не были детектированы гены каталазы.
Подвижность и хемотаксис. D. essentukiensis обладает полным набором генов, детерминирующим жгутиковый аппарат и хемотаксис. Гены жгутикового аппарата локализованы в нескольких кластерах: локус LF845_00175-00225 кодирует основные белки базального тела, оси и крюка жгутика, локус LF845_02070-02105 кодирует белки системы секреции III типа и некоторые другие биосинтеза жгутика, локус LF845_07640-07685 также кодирует белки биосинтеза жгутика, включая протон-зависимый статор MotAB и переключатель направления вращения FliM. Интересно, что гены филамента жгутика fliCDST удалены в геноме от вышеупомянутых локусов, в том числе, основной флагеллин FliC кодирован отдельно локализованным геном (LF845_07440). Гены, обусловливающие таксис, гомологичные ранее описанным детерминантам предполагаемого редокс-зависимого хемотаксиса железовосстанавливающих видов рода Shewanella (Starwalt-Lee et al., 2021), сгруппированы в локусе LF845_06375-06460 генома D. essentukiensis. Этот набор генов кодирует гистидинкиназу CheA (LF845_06410) и регуляторные белки CheBRYZ, которые, как предполагается, передают сигнал от активированных метилируемых белков хемотаксиса (MCP-рецепторов) на переключатель направления вращения жгутика FliM (LF845_06430). Кроме того, в этом локусе кодируется сигма-фактор FliA, контролирующий экспрессию генов жгутикового аппарата. Несколько белков MCP-рецепторов и белок CheW (LF845_04070), поддерживающий структуру олигомеров этих рецепторов, кодируются генами, удаленными от “локуса хемотаксиса”.
ОБСУЖДЕНИЕ
Порядок Deferribacterales (Huber et al., 2001) филума Deferribacterota (Whitman et al., 2018) в настоящее время включает в себя одно валидно описанное семейство Deferribacteraceae, состоящее из восьми родов: Calditerrivibrio (Iino et al., 2008), Flexistipes (Fiala et al., 1990), Deferribacter (Greene et al., 1997), Denitrovibrio (Myhr, Torsvik, 2000), Petrothermobacter (Tamazawa et al., 2017), Geovibrio (Caccavo et al., 1996), Seleniivibrio (Rauschenbach et al., 2013) и Mucispirillum (Robertson et al., 2005). Однако согласно филогении GTDB, основанной на анализе полногеномных последовательностей, порядок включает 4 семейства, в которые не входит род Mucispirillum, образующий ветвь, отдельную от других известных родов данного порядка (рис. 5). За исключением M. schaedleri, который был выделен из желудочно-кишечной слизи мышей, все представители этого порядка являются свободноживущими бактериями, выделенными из природных термальных вод, нефтяных месторождений, глубоководных морских осадков. Большинство этих бактерий является строго анаэробными, галотолерантными, умеренно термофильными и нейтрофильными грамотрицательными вибрионами с дыхательным типом метаболизма. Все представители порядка Deferribacterales, за исключением бродильщика F. sinusarabici, могут использовать ацетат и широкий спектр других органических кислот, а также пептиды, аминокислоты и спирты в качестве доноров электронов. Типичными акцепторами электронов для этих бактерий являются Fe(III) в растворимой или нерастворимой форме, Mn(IV), элементная сера, или нитрат. Среди представителей порядка только P. organivorans способен восстанавливать сульфат (Tamazawa et al., 2017). Представители родов Deferribacter и Geovibrio могут окислять молекулярный водород при росте без органического углерода, являясь, таким образом, хемолитоавтотрофами. Фенотипические характеристики штамма Es71-Z0220T в целом соответствуют описанным у большинства культивируемых Deferribacterales (табл. 2). Новый штамм Es71-Z0220T является строго анаэробным, умеренно термофильным, нейтрофильным галотолерантным грамотрицательным вибрионом, способным к диссимиляционному восстановлению ферригидрита, нитрата, фумарата и элементной серы с ацетатом или другими органическими кислотами в качестве доноров электронов. Оптимальные физико-химические условия его роста полностью соответствуют характеристикам минеральной воды типа “Ессентуки № 4”. Особенностью штамма Es71-Z0220T является его неспособность восстанавливать растворимые соединения Fe(III), что коррелирует с отсутствием окислительно-восстановительного взаимодействия между его цитохромами c-типа и цитратным комплексом Fe(III) (рис. 4). Такая физиологическая особенность может отражать адаптацию этого железоредуцирующего микроорганизма к жизни в порах и трещинах водовмещающих осадочных пород водоносного горизонта, в котором растворимость железа чрезвычайно низка, а нерастворимые минералы представляют собой наиболее распространенную форму Fe(III), доступную для анаэробного дыхания. Мультигемовые цитохромы c-типа являются наиболее вероятными детерминантами железовосстанавливающей активности штамма Es71-Z0220T, аналогично большинству описанных в настоящее время железоредуцирующих прокариот (Faustino et al., 2021; Gavrilov et al., 2021). Организм обладает набором генов 18 мультигемовых цитохромов c-типа, 11 из которых ко-локализованы в геноме. Семь белков, кодируемых в этом “цитохромовом локусе”, предположительно являются секретируемыми или мембранно-связанными цитохромами, ориентированными в периплазму, и имеют значимую гомологию с ранее описанными детерминантами путей ВПЭ. Аминокислотные последовательности пяти из этих цитохромов содержат предполагаемые гематит-связывающие мотивы, некоторые из которых фланкированы гем-связывающими сайтами, как во внешнемембранном цитохроме MtrC, обеспечивающем восстановление Fe(III) у S. oneidensis (Lower et al., 2008). Мультигемовые белки с такими мотивами являются наиболее вероятными терминальными железоредуктазами. “Цитохромовый локус” D. essentukiensis также кодирует предполагаемый менахинол-окисляющий цитохром b/b6 и белок, содержащий NHL-повторы, который может связывать нанокристаллы минералов переходных металлов (Voet et al., 2015). Соответственно, локус LF845_05495-05585, вероятно, является важной детерминантой пути переноса электронов от хинонового пула к внеклеточным акцепторам электронов у D. essentukiensis. Предполагаемые терминальные редуктазы этого пути, вероятно, имеют высокое сродство к нерастворимым формам Fe(III), аналогично ранее описанным цитохромам облигатного железоредуктора Geoglobus acetivorans (Mardanov et al., 2015). Однако следует отметить, что “цитохромовый локус” сам по себе не определяет способность D. essentukiensis к ВПЭ. Генные кластеры, содержащие гомологи всех вышеописанных белков этого локуса, с подобной ему организацией генов были ранее обнаружены у двух, различных по своей физиологии, представителей порядка Deferribacterales – у железоредуктора Deferribacter autotrophicus и у D. desulfuricans, не способного к восстановлению Fe(III) (Slobodkin et al., 2019). Наш сравнительный анализ наборов мультигемовых цитохромов этих двух организмов и Deferrivibrio essentukiensis выявил, что только железоредукторы D. autotrophicus и Deferrivibrio essentukiensis обладают гомологами восьмигемового цитохрома SmhA C. ferrireducens. Ранее нами было показано существенное увеличение экспрессии этого цитохрома в присутствии нерастворимых акцепторов электронов у C. ferrireducens, а также его филогенетическое родство с восьмигемовым цитохромом FHQ18_RS08740 (WP_149266789.1) Deferribacter autotrophicus (Gavrilov et al., 2021). Таким образом, именно гомологи SmhA могут являться ключевыми детерминантами железоредукции у различных представителей Deferribacterales.
Путь нитратредукции у Deferrivibrio essentukiensis схож с выявленными ранее у нескольких аммонифицирующих бактерий филума Deferribacteres (Slobodkin et al., 2019). В геноме D. essentukiensis присутствуют гены нитратредуцирующего комплекса Nap. Однако вместо архетипического комплекса аммонифицирующей нитритредуктазы NrfAH, D. essentukiensis обладает восьмигемовой гидроксиламиноксидоредуктазой из филогенетической группы εHao. Ранее для цитохромов этой группы уже предполагалась ключевая роль в восстановлении нитрита в аммоний в отсутствие Nr-fAH у эпсилонпротеобактерий (Simon, Klotz, 2013) и бактерий филума Calditrichaeota (Kublanov et al., 2017).
Геномные детерминанты центрального углеродного и энергетического метаболизма, а также пути утилизации органических субстратов у D. essentukiensis довольно типичны для строго анаэробных хемоорганогетеротрофов. Организм обладает протон-транслоцирующим комплексом I и комплексом II фумаратредуктазы дыхательной цепи переноса электронов, архетипической АТФ-синтетазой типа F0F1, несколькими трансмембранными хинол-окисляющими Fe-S- и гем-содержащими белками, такими, как цитохром b/b6, субъединица PsrC предполагаемого полисульфидредуктазного комплекса, белки NapC и NapH, которые могут сопрягать генерацию протон-движущей силы с восстановлением Fe(III), серы и нитрата соответственно. В геноме D. essentukiensis закодированы все необходимые транспортеры ключевых углеродных субстратов и доноров электронов (ацетата, пирувата, сукцината и лактата), а также ферменты, необходимые для окисления этих субстратов и их использования в качестве источников энергии через ЦТК.
Интересно, что геном этого организма кодирует цитохромоксидазу cbb3-типа, которая, как предполагается, обеспечивает кислородное дыхание в условиях микроаэробного роста (Pitcher et al., 2002). В этой связи, неспособность D. essentukiensis к микроаэробному или аэробному росту может быть объяснена отсутствием генов дыхательного комплекса III, которые необходимы для кислородного дыхания.
Суммируя метаболические особенности D. essentukiensis, можно предположить его экологическую роль в подземной экосистеме водовмещающих пород исследуемого водоносного горизонта как микроорганизма, сопрягающего окисление органических веществ с восстановительной трансформацией минералов Fe(III). С другой стороны, если учесть крайне низкую представленность филотипов, связанных с Deferribacterales, в исследованных образцах минеральной воды, экологическая значимость D. essentukiensis представляется сомнительной. С этой точки зрения, новый вид, скорее, можно отнести к так называемой “редкой биосфере”. Феномен “редкой биосферы” объединяет небольшие субпопуляции прокариот, каждая из которых составляет менее 1% библиотеки генов 16S рРНК микробного сообщества, в единую экологически значимую единицу (Скопина и соавт., 2016; Jousset et al., 2017). На сегодняшний день считается, что такие минорные группы микроорганизмов служат источником генетического материала для микробного сообщества, активизирующегося при резких изменениях условий окружающей среды (Jousset et al., 2017), являются первыми обитателями вновь возникших или полностью измененных экологических ниш (Скопина и соавт., 2016), а также поддерживают содержание важных факторов роста, таких как витамины или органический азот, на низком, но критически необходимом уровне (Sohm et al., 2011; Zhang et al., 2019).
Альтернативное объяснение низкой представленности D. essentukiensis в микробном сообществе заключается в возможном неравномерном вымывании микроорганизмов из пор водовмещающих пород при бурении и добыче минеральной воды. Это особенно существенно при изучении организмов, которые зависят от нерастворимых субстратов, таких как минералы Fe(III), и, вероятно, образуют биопленки на минеральных поверхностях. Мы действительно наблюдали плотные колонии клеток D. essentukiensis, выращенных с использованием СФ (рис. 2б). С этой точки зрения, подвижность организма, обеспечиваемая жгутиком, может отражать его способность к редокс-чувствительному хемотаксису, включая возможную миграцию к нерастворимым акцепторам электронов, которая широко изучается в последнее десятилетие у диссимиляционных металлоредукторов и электрогенных бактерий (Starwalt-Lee et al., 2021). Гипотетическая способность D. essentukiensis ориентироваться по направлению движения к нерастворимым акцепторам электронов коррелирует с тем фактом, что его гены, связанные с хемотаксисом и сгруппированные в локусе LF845_06375-06460, гомологичны генам, недавно идентифицированными у железовосстанавливающих и электрогенных бактерий рода Shewanella (Starwalt-Lee et al., 2021). Выделение нами второго железоредуцирующего штамма D. essentukiensis Es71N из воды того же водоносного горизонта, отобранной через резервную скважину 71Н после девятимесячного перерыва, указывает на устойчивость этого вида в исследуемой экосистеме. Этот факт делает равновероятными оба упомянутых предположения: 1) гипотезу о широком распространении D. essentukiensis в верхнемеловом водоносном горизонте и его неравномерном вымывании из биопленок, покрывающих водовмещающие породы, и 2) предположение о принадлежности D. essentukiensis к “редкой биосфере”, представители которой могут быстро наращивать свою численность, опережая других членов микробного сообщества, при благоприятных изменениях физико-химических условий. Очевидно, что необходимы дальнейшие исследования для выяснения экологической роли нового изолята в природной среде и определения точного влияния его метаболической активности на формирование состава минеральных вод ЕММВ.
На основании физиологических свойств и филогенетического анализа мы предлагаем штамм ES71-Z0220T в качестве типового штамма нового вида и рода под названием Deferrivibrio essentukiensis gen. nov., sp. nov., являющегося первым представителем нового семейства Deferrivibrionaceae fam. nov.
Описание Deferrivibrionaceae fam. nov.
Deferrivibrionaceae (De.fer.ri.vi.bri.o.na.ce’ae, нео-лат., от сущ. муж. р. Deferrivibrio – типовой род семейства; лат. суфф. множ. ч. жен. р. -aceae, окончание для обозначения семейства), нео-лат., сущ. множ. ч. жен. р. Deferrivibrionaceae, семейство Deferrivibrio.
Семейство образовано на основе филогенетического анализа 120-ти консервативных бактериальных маркерных генов, а также морфо-физиологических характеристик. Клетки представителя семейства являются грамотрицательными вибрионами, не образующими спор. Семейство включает в себя анаэробные хемоорганотрофные виды. Типовой род – Deferrivibrio gen. nov.
Описание Deferrivibrio gen. nov.
Deferrivibrio (De.fer.ri.vi’bri.o., лат. прист. de от лат. сущ. ср. р. ferrum, железо; лат. гл. vibrare, вибрировать; нео-лат. сущ. муж. р. vibrio), название бактерий, имеющих изогнутую форму клетки; нео-лат. сущ. муж. р. Deferrivibrio, вибрион, восстанавливающий железо.
Клетки представляют собой подвижные неспорообразующие грамотрицательные вибрионы. Анаэробы, каталазо- и оксидазо-положительные. Нейтрофилы и термофилы. Хемоорганотрофные организмы, преимущественно окисляющие органические кислоты. Способны к восстановлению окисного железа, нитратов и серы. Клеточные жирные кислоты являются, в основном, 14-18-углеродсодержащими, насыщенными, с длинной и (или) разветвленной цепью. Основным изопреноидным менахиноном является МК-8.
Типовой вид – Deferrivibrio essentukiensis sp. nov.
Описание Deferrivibrio essentukiensis sp. nov.
essentukiensis (es.sen.tu.ki.en’sis., нео-лат. прил. муж. р. essentukiensis, от “Ессентуки”), назван по названию места происхождения – Ессентукского месторождения минеральных вод, Россия.
Клетки неспорообразующие, подвижные посредством одного полярного жгутика, вибрионы, 0.4‒0.5 мкм в толщину и 1‒3 мкм в длину. Клеточная стенка грамотрицательного типа. Умеренный термофил, температура роста в пределах от 30 до 54°C, с оптимумом при 47°C. Нейтрофил, рН роста варьирует в пределах от 6.2 до 7.9, с оптимумом при рН 7.1. Галотолерантый организм, растущий при концентрации NaCl от 0 до 18 г/л, с оптимумом при 7 г/л. Каталазо- и оксидазо-положительный анаэроб. Хемоорганотроф, способен расти, используя ацетат, лактат, пируват или сукцинат в качестве доноров электронов с ферригидритом в качестве акцептора электронов. Не способен окислять молекулярный водород, метанол, этанол, н‑пропанол, бутанол, формиат, малат, цитрат, микрокристаллическую и карбоксиметилцеллюлозу, крахмал, пектин, дрожжевой или мясной экстракты, триптон, казаминовые кислоты с ферригидритом в качестве акцептора электронов. Не способен к сбраживанию пептона, дрожжевого или мясного экстрактов, триптона, целлобиозы, глюкозы или сахарозы. С ацетатом в качестве донора электронов восстанавливает фумарат, нитрат и элементную серу, но не АХДС, Fe(III)-цитрат, Fe(III)-ЭДТА, тиосульфат, сульфат, сульфит, диметилсульфоксид, нитрит, селенат или кротонат. Основными жирными кислотами являются 9С-С14:0, С16:0, С18:0, изо-С14:0, 14С-С15:0. Основным изопреноидным менахиноном является МК-8. Устойчив к канамицину, выскочувствителен к рифампицину, ингибирующему ДНК-зависимую РНК-полимеразу, менее чувствителен к ингибиторам рибосомального биосинтеза белка и биосинтеза клеточной стенки. Типовым штаммом является Es71-Z0220T (=VKM B-3557 = JCM 39245), выделенный из подземной минеральной воды верхнемелового водоносного горизонта Ессентукского месторождения минеральных вод.
Все результаты секвенирования депонированы в NCBI BioProject PRJNA753547.
Статья содержит дополнительные материалы: табл. S1 и S2 , рис. S1, S2, S3 .
Список литературы
Абрамов В.Ю., Вавичкин А.Ю. Особенности формирования термогазохимического состава минеральных вод Ессентукского месторождения // Разведка и охрана недр. 2010. № 10. С. 27‒32.
Заварзина Д.Г., Колганова Т.В., Булыгина Е.С., Кострикина Н.А., Турова Т.Н., Заварзин Г.А. Geolkalibacter ferrihydriticus gen. nov., sp. nov., первый алкалофильный представитель семейства Geobacteraceae, выделенный из содового озера // Микробиология. 2006. Т. 75. С. 775–785.
Zavarzina D.G., Kolganova T.V., Boulygina E.S., Kostrikina N.A., Tourova T.P., Zavarzin G.A. Geoalkalibacter ferrihydriticus gen. nov. sp. nov., the first alkaliphilic representative of the family Geobacteraceae, isolated from a soda lake // Microbiology (Moscow). 2006. V. 75. P. 673–682.
Кевбрин В.В., Заварзин Г.А. Влияние соединений серы на рост галофилной гомоацетатной бактерии Acetohalobium arabaticum // Микробиология. 1992. Т. 61. С. 812–817.
Kevbrin V.V., Zavarzin G.A. The influence of sulfur compounds on the growth of halophilic homoacetic bacterium Acetohalobium arabaticum // Microbiology (Moscow). 1992. V. 61. P. 563–571.
Меркель А.Ю., Тарновецкий И.Ю., Подосокорская О.А., Тощаков С.В. Анализ систем праймеров на ген 16S рРНК для профилирования термофильных микробных сообществ // Микробиология. 2019. Т. 88. С. 655–664.
Merkel A.Y., Tarnovetskii I.Y., Podosokorskaya O.A., Toshchakov S.V. Analysis of 16S rRNA primer systems for profiling of thermophilic microbial communities // Microbiology (Moscow). 2019. V. 88. P. 671–680.
Потапов Е.Г., Дубинина Г.А., Данилов С.Р., Гаджиханова С.У., Щелкунов А.В., Грабович М.Ю. Физико-химические и микробиологические исследования подземных минеральных вод района КМВ // Курортная медицина. 2014. № 4. С. 14–20.
Потапов Е.Г., Данилов С.Р., Гаджиханова С.У. Генезис углекисло-сероводородных минеральных вод Ессентукского месторождения по данным гидрохимических, микробиологических и изотопных исследований // Курортная медицина. 2017. № 1. С. 11–16.
Скопина М.Ю., Васильева А.А., Першина Е.В., Пиневич А.В. Разнообразие малочисленности: феномен “Разреженной бактериальной биосферы” // Микробиология. 2016. Т. 85. С. 248–260.
Skopina M.Yu., Vasileva A.A., Pershina E.V., Pinevich A.V. Diversity at low abundance: the phenomenon of the Rare Bacterial Biosphere // Microbiology (Moscow). 2016. V. 85. P. 272–282.
Aklujkar M., Coppi M.V., Leang C., Kim B.C., Chavan M.A., Perpetua L., Giloteaux L., Liu A., Holmes D.E. Proteins involved in electron transfer to Fe(III) and Mn(IV) oxides by Geobacter sulfurreducens and Geobacter uraniireducens // Microbiology (SGM). 2013. V. 159. P. 515–535.
Anisimova M., Gascuel O. Approximate likelihood-ratio test for branches: a fast, accurate, and powerful alternative // Syst. Biol. 2006. V. 55. P. 539–552.
Benson D., Boguski M., Lipman D., Ostell J., Ouellette B., Rapp B.A., Wheeler D.L. GenBank // Nucl. Acids Res. 1999. V. 27. P. 38–43.
Butler J.E., Young N.D., Lovley D.R. Evolution of electron transfer out of the cell: comparative genomics of six Geobacter genomes // BMC Genomics. 2010. V. 11. P. 40.
Caccavo F.J., Coates J.D., Rossello-Mora R.A., Ludwig W., Schleifer K.H., Lovley D.R., McInerney M.J. Geovibrio ferrireducens, a phylogenetically distinct dissimilatory Fe(III)-reducing bacterium // Arch. Microbiol. 1996. V. 165. P. 370–376.
Cappuccino J.G., Sherman N. Microbiology: A Laboratory Manual, 6th ed. San Francisco: Benjamin 302 Cummings Pearson Education, 2002.
Carlson H.K., Iavarone A.T., Gorur A., Yeo B.S., Tran R., Melnyk R.A., Mathies R.A., Auer M., Coates J.D. Surface multiheme c-type cytochromes from Thermincola potens and implications for respiratory metal reduction by Gram-positive bacteria // Proc. Natl. Acad. Sci. USA. 2012. V. 109. P. 1702–1707.
Collins M.D., Jones D. Distribution of isoprenoid quinone structural types in bacteria and their taxonomic implications // Microbiol. Rev. 1981. V. 15. P. 316–354.
Collins M.D. Analysis of isoprenoid quinones // Methods Microbiol. 1985. V. 18. P. 329–363.
Costa N.L., Hermann B., Fourmond V., Faustino M.M., Teixeira M., Einsle O., Paquete C.M., Louro R.O. How thermophilic Gram-positive organisms perform extracellular electron transfer: characterization of the cell surface terminal reductase OcwA // mBio. 2019. V. 10. e01210-19.
Coursolle D., Gralnick J.A. Modularity of the Mtr respiratory pathway of Shewanella oneidensis strain MR-1 // Mol. Microbiol. 2010. V. 77. P. 995–1008.
Faustino M.M., Fonseca B.M., Costa N.L., Lousa D., Louro R.O., Paquete C.M. Crossing the wall: characterization of the multiheme cytochromes involved in the extracellular electron transfer pathway of Thermincola ferriacetica // Microorganisms. 2021. V. 9. Art. 293.
Fiala G., Woese C.R., Langworthy T.A., Stetter K.O. Flexistipes sinusarabici, a novel genus and species of eubacteria occurring in the Atlantis II Deep brines of the Red Sea // Arch. Microbiol. 1990. V. 154. P. 120–126.
Filimonova E., Kharitonova N., Sartykov A., Maximova E., Baranovskaya E., Korzun A., Maslov A., Baidariko E., Lavrushin V. Hydrogeology and hydrogeochemistry of mineral sparkling groundwater within Yessentuki area (Caucasian mineral water region) // Environ. Earth Sci. 2020. V. 79. P. 15.
Gavrilov S.N., Zavarzina D.G., Elizarov I.M., Tikhonova T.V., Dergousova N.I., Popov O., Lloyd J.R., Knight D., El-Naggar M.Y., Pirbadian S., Leung K.M., Robb F.T., Zakhartsev M.V., Bretschger O., Bonch-Osmolovskaya E.A. Novel extracellular electron transfer channels in a Gram-positive thermophilic bacterium // Front. Microbiol. 2021. V. 11. Art. 3349.
Gohl D.M., MacLean A., Hauge A., Becker A., Walek D., Beckman K.B. An optimized protocol for high-throughput amplicon-based microbiome profiling // Protoc. Exch. 2016. https://doi.org/10.1038/protex.2016.030
Greene A.C., Patel B.K., Sheehy A.J. Deferribacter thermophiles gen. nov., sp. nov., a novel thermophilic manganese- and iron-reducing bacterium isolated from a petroleum reservoir // Int. J. Syst. Bacteriol. 1997. V. 47. P. 505–509.
Härtig C. Rapid identification of fatty acid methyl esters using a multidimensional gas chromatography-mass spectrometry database // J. Chromatogr. 2008. V. 1177. P. 159–169.
Hoang D.T., Chernomor O., von Haeseler A., Minh B.Q., Vinh L.S. UFBoot2: Improving the ultrafast bootstrap approximation // Mol. Biol. Evol. 2018. V. 35. P. 518–522.
Huber H., Stetter K.O. Order, I. Deferribacterales ord. nov. // Bergey’s Manual of Systematic Bacteriology. 2nd ed. V. 1. The Archaea and the Deeply Branching and Phototrophic Bacteria / Eds. Boone D.R., Castenholz R.W., Garrity G.M. Springer: New York, 2001. V. 1. P. 465–471.
Hugerth L.W., Wefer H.A., Lundin S., Jakobsson H.E., Lindberg M., Rodin S., Engstrand L., Andersson A.F. DegePrime, a program for degenerate primer design for broad-taxonomic-range pcr in microbial ecology studies // Appl. Environ. Microbiol. 2014. V. 80. P. 5116–5123.
Iino T., Nakagawa T., Mori K., Harayama S., Suzuki K. Calditerrivibrio nitroreducens gen. nov., sp. nov., a thermophilic, nitrate-reducing bacterium isolated from a terrestrial hot spring in Japan // Int. J. Syst. Evol. Microbiol. 2008. V. 58. P. 1675−1679.
Jousset A., Bienhold C., Chatzinotas A., Gallien L., Gobet A., Kurm V., Küsel K., Rillig M.C. Rivett D.W. Where less may be more: how the rare biosphere pulls ecosystems strings // ISME J. 2017. V. 11. P. 853–862.
Kalyaanamoorthy S., Minh B.Q., Wong T.K.F., von Haeseler A., Jermiin L.S. ModelFinder: fast model selection for accurate phylogenetic estimates // Nat. Methods. 2017. V. 14. P. 587–589.
Krauze P., Kämpf H., Horn F., Liu Q., Voropaev A., Wagner D., Alawi M. Microbiological and geochemical survey of CO2-dominated mofette and mineral waters of the Cheb Basin, Czech Republic // Front. Microbiol. 2017. V. 8. Art. 2446.
Kublanov I.V., Sigalova O.M., Gavrilov S.N., Lebedinsky A.V., Rinke C., Kovaleva O., Chernyh N.A., Ivanova N., Daum C., Reddy T.B.K., Klenk H.-P., Spring S., Göker M., Reva O.N., Miroshnichenko M.L., Kyrpides N.C., Woyke T., Gelfand M.S., Bonch-Osmolovskaya E.A. Genomic analysis of Caldithrix abyssi, the thermophilic anaerobic bacterium of the novel bacterial phylum Calditrichaeota // Front. Microbiol. 2017. V. 8. Art. 195.
Lavrushin V.Y., Lisenkov A.B., Aidarkozhina A.S. Genesis of the Yessentuki deposit of carbonated waters, North Caucasus // Geochem. Int. 2020. V. 58. P. 77–90.
Leclerc H., da Costa M.S. Microbiology of natural mineral waters // Technology of Bottled Water, 2nd edn. / Eds. Senior D., Dege N. Blackwell Publishing Ltd., 2005. P. 325–387.
Lesaulnier C.C., Herbold C.W., Pelikan C., Berry D., Gérard C., Le Coz X., Gagnot S., Niggemann J., Dittmar T., Singer G.A., Loy A. Bottled aqua incognita: microbiota assembly and dissolved organic matter diversity in natural mineral waters // Microbiome. 2017. V. 5. Art. 126.
Lower B.H., Lins R.D., Oestreicher Z., Straatsma T.P., Hochella M.F., Shi L., Lower S.K. In vitro evolution of a peptide with a hematite binding motif that may constitute a natural metal-oxide binding archetype // Environ. Sci. Technol. 2008. V. 42. P. 3821–3827.
Loy A., Beisker W., Meier H. Diversity of bacteria growing in natural mineral water after bottling // Appl. Environ. Microbiol. 2005. V. 71. P. 3624–3632.
Mardanov A.V., Slododkina G.B., Slobodkin A.I., Beletsky A.V., Gavrilov S.N., Kublanov I.V., Bonch-Osmolovskaya E.A., Skryabin K.G., Ravin N. The Geoglobus acetivorans genome: Fe(III) reduction, acetate utilization, autotrophic growth, and degradation of aromatic compounds in a hyperthermophilic archaeon // Appl. Environ. Microbiol. 2015. V. 81. P. 1003–1012.
Mendoza-Hoffmann F., Pérez-Oseguera A., Cevallos M.A., Zarco-Zavala M., Ortega R., Peña-Segura C., Espinoza-Simón E., Uribe-Carvajal S. García-Trejo J.J. The biological role of the ζ subunit as unidirectional inhibitor of the F1F0-ATPase of Paracoccus denitrificans // Cell Reports. 2018. V. 22. P. 1067–1078.
Merkel A.Y., Chernyh N.A., Pimenov N.V., Bonch-Osmolovskaya E.A., Slobodkin A.I. Diversity and metabolic potential of the terrestrial mud volcano microbial community with a high abundance of archaea mediating the anaerobic oxidation of methane // Life. 2021. V. 11. Art. 953.
Myhr S., Torsvik T. Denitrovibrio acetiphilus, a novel genus and species of dissimilatory nitrate-reducing bacterium isolated from an oil reservoir model column // Int. J. Syst. Evol. Microbiol. 2000. V. 50. P. 1611–1619.
Nguyen L.T., Schmidt H.A., von Haeseler A., Minh B.Q. IQ-TREE: a fast and effective stochastic algorithm for estimating maximum-likelihood phylogenies // Mol. Biol. Evol. 2015. V. 32. P 268–274.
Parks D.H., Chuvochina M., Chaumeil P.A., Rinke C., Mussig A.J., Hugenholtz P.A. Complete domain-to-species taxonomy for Bacteria and Archaea // Nat. Biotechnol. 2020. V. 38. P. 1079–1086.
Pitcher R.S., Brittain T., Watmough N.J. Cytochrome cbb3 oxidase and bacterial microaerobic metabolism // Biochem. Soc. Trans. 2002. V. 30. P. 653–658.
Rauschenbach I., Posternak V., Cantarella P., McConnell J., Starovoytov V., Häggblom M.M. Seleniivibrio woodruffii gen. nov., sp. nov., a selenate- and arsenate-respiring bacterium in the Deferribacteraceae // Int. J. Syst. Evol. Microbiol. 2013. V. 63. P. 3659–3665.
Robertson B.R., O’Rourke J.L., Neilan B.A., Vandamme P., On S.L.W., Fox J.G., Lee A. Mucispirillum schaedleri gen. nov., sp. nov., a spiral-shaped bacterium colonizing the mucus layer of the gastrointestinal tract of laboratory rodents // Int. J. Syst. Evol. Microbiol. 2005. V. 55. P. 1199–1204.
Rothery R.A., Gregory J., Workun G.J., Weiner J.H. The prokaryotic complex iron–sulfur molybdoenzyme family // Biochim. Biophys. Acta. 2008. V. 1778. P. 1897–1929.
Sala-Comorera L., Caudet-Segarra L., Galofréc B., Lucena F., Blanch A.R., García-Aljaro C. Unravelling the composition of tap and mineral water microbiota: divergences between next-generation sequencing techniques and culture based methods // Int. J. Food Microbiol. 2020. V. 334. Art. 108850.
Scheiner D. Determination of ammonia and Kjeldahl nitrogen by indophenol method // Water Res. 1976. V. 10. P. 31‒36.
Schicklberger M., Sturm G., Gescher J. Genomic plasticity enables a secondary electron transport pathway in Shewanella oneidensis // Appl. Environ. Microbiol. 2013. V. 79. P. 1150–1159.
Shi L., Dong H., Reguera G., Beyenal H., Lu A., Liu J., Yu H.-Q., Fredrickson J.K. Extracellular electron transfer mechanisms between microorganisms and minerals // Nat. Rev. Microbiol. 2016. V. 14. P. 651–652.
Simon J., Klotz M.G. Diversity and evolution of bioenergetic systems involved in microbial nitrogen compound transformations // Biochim. Biophys. Acta. 2013. V. 1827. P. 114–135.
Slobodkin A., Slobodkina G., Allioux M., Alain K., Jebbar M., Shadrin V., Kublanov I., Toshchakov S., Bonch-Osmolovs-ka-ya E. Genomic insights into the carbon and energy metabolism of a thermophilic deep-sea bacterium Deferribacter autotrophicus revealed new metabolic traits in the phylum Deferribacteres // Genes. 2019. V. 10. Art. 849.
Sohm J.A., Webb E.A., Capone D.G. Emerging patterns of marine nitrogen fixation // Nat. Rev. Microbiol. 2011. V. 9. P. 499–508.
Starwalt-Lee R., El-Naggar M.Y., Bond D.R., Gralnick J.A. Electrolocation? The evidence for redox-mediated taxis in Shewanella oneidensis // Mol. Microbiol. 2021. V. 115. P. 1069–1079.
Stookey L.L. Ferrozine – a new spectrophotometric reagent for iron // Anal. Chem. 1970. V. 42. P. 779–781.
Tamazawa S., Mayumi D., Mochimaru H., Sakata S., Maeda H., Wakayama T., Ikarashi M., Kamagata Y., Tamaki H. Petrothermobacter organivorans gen. nov., sp. nov., a thermophilic, strictly anaerobic bacterium of the phylum Deferribacteres isolated from a deep subsurface oil reservoir // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 3982–3986.
Tatusova T., DiCuccio M., Badretdin A., Chetvernin V., Nawrocki E.P., Zaslavsky L., Lomsadze A., Pruitt K.D., Borodovsky M., Ostell J. NCBI prokaryotic genome annotation pipeline // Nucl. Acids Res. 2016. V. 44. P. 6614–6624.
Toshchakov S.V., Lebedinsky A.V., Sokolova T.G., Zavarzina D.G., Korzhenkov A.A., Teplyuk A.V., Chistyakova N.I., Rusakov V.S., Bonch-Osmolovskaya E.A., Kublanov I.V., Gavrilov S.N. Genomic insights into energy metabolism of Carboxydocella thermautotrophica coupling hydrogenogenic CO oxidation with the reduction of Fe(III) minerals // Front. Microbiol. 2018. V. 9. Art. 1759.
Trüper H.G., Schlegel H.G. Sulphur metabolism in Thiorhodaceae I. Quantitative measurements on growing cells of Chromatium okenii // Ant. van Leeuwenhoek. 1964. V. 30. P. 225–238.
Voet A.R., Noguchi H., Addy C., Zhang K.Y., Tame J.R. Biomineralization of a cadmium chloride nanocrystal by a designed symmetrical protein // Angew. Chem. Int. Ed. 2015. V. 54. P. 9857–9860.
Whitman W.B., Oren A., Chuvochina M., da Costa M.S., Garrity G.M., Rainey F.A., Rossello-Mora R., Schink B., Sutcliffe I., Trujillo M.E., Ventura S. Proposal of the suffix -ota to denote phyla. Addendum to “Proposal to include the rank of phylum in the International Code of Nomenclature of Prokaryotes” // Int. J. Syst. Evol. Microbiol. 2018. V. 68. P. 967–969.
Wick R.R., Judd L.M., Gorrie C.L., Holt K.E. Unicycler: Resolving bacterial genome assemblies from short and long sequencing reads // PLoS Comput. Biol. 2017. V. 13. e1005595.
Wolin E.A., Wolin M.J., Wolfe R.S. Formation of methane by bacterial extracts // J. Biol. Chem. 1963. V. 238. P. 2882–2888.
Zhang Y., Shuikui D., Qingzhu G., Ganjurjav H., Xuexia W., Wei G. “Rare biosphere” plays important roles in regulating soil available nitrogen and plant biomass in alpine grassland ecosystems under climate changes // Agric. Ecosyst. Environ. 2019. V. 279. P. 187–193.
Дополнительные материалы
- скачать ESM.docx
- Таблица S1. - Таблица S2.
Рис. S1. - Рис. S4.


