Микробиология, 2022, T. 91, № 4, стр. 410-418
Внесение экзогенного активного ила как способ повышения эффективности удаления азота в процессе анаммокс
Н. В. Пименов a, Ю. А. Николаев a, *, А. Г. Дорофеев a, В. А. Грачев a, А. Ю. Каллистова a, Т. А. Канапацкий a, Ю. В. Литти a, Е. В. Груздев b, Ш. А. Бегматов b, Н. В. Равин b, А. В. Марданов b
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Институт биоинженерии, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: nikolaevya@mail.ru
Поступила в редакцию 25.03.2022
После доработки 29.03.2022
Принята к публикации 30.03.2022
- EDN: ORZCIM
- DOI: 10.31857/S0026365622300176
Аннотация
Исследовано влияние внесения экзогенного активного ила (биоаугментации) на активность и состав микробного консорциума, реализующего процесс нитритации‒анаммокс в биореакторе SBR-типа. Использовали 2 стратегии биоаугментации: экзогенный ил добавляли в момент запуска реактора сразу после внесения инокулята – активного ила анаммокс или после его выхода на стабильный режим удаления азота. Доля внесенного ила составляла 28‒35% от общей массы активных илов (по сухому беззольному веществу). Условия выращивания и состав анаммокс-бактерий активных илов существенно различались: в аборигенном иле доминировали представители родов “Candidatus Brocadia” и “Ca. Jettenia”, в экзогенном – “Ca. Kuenenia” и “Ca. Jettenia”. При биоаугментации в момент запуска эффективность удаления азота повышалась на 15%, положительный эффект был краткосрочным (к 46-м сут культивирования эффективность удаления азота в контрольном и опытном реакторах сравнялись). Внесение экзогенного активного ила после выхода реактора на стабильный режим удаления азота (53-и сут) увеличивало эффективность удаления азота на 21‒35%, эта разница сохранялась до конца эксперимента (90 сут). Интродуцированные анаммокс-бактерии не приживались в микробном сообществе SBR-реактора; их численность снижалась до минимальных значений вне зависимости от способа внесения. Полученные данные свидетельствуют о возможности повышения эффективности удаления азота в процессе нитритации‒анаммокс при внесении активных илов, значительно отличающихся по составу и условиям выращивания от аборигенных, как при запуске реактора, так и в активно функционирующий биореактор.
В связи с возрастающим дефицитом чистой воды и загрязнением водоемов, в последние годы происходит модификация существующих и разработка новых экологически чистых, энергоэффективных технологий очистки сточных вод от биогенных элементов, в том числе от азота (Hasan et al., 2021). Среди таких технологий наиболее перспективными считаются технологии с использованием биохимического процесса “анаммокс”, работающие по схеме “нитритация/анаммокс” (Н/А) (деаммонификация), экономически более выгодные, чем традиционные, основанные на схеме “нитрификация/денитрификация” (Agrawal et al., 2018; Кевбрина и соавт., 2018; Izadi et al., 2021; Pedrouso et al., 2021).Процесс Н/А состоит из двух последовательных этапов: 1) окисление части аммония до нитрита аммоний-окисляющими бактериями и 2) окисление оставшейся части аммония образовавшимся на первом этапе нитритом до молекулярного азота анаммокс-бактериями. Технологический процесс Н/А проводится в биореакторах микробным консорциумом, развивающимся, как правило, в виде взвешенных агрегатов активного ила или биопленки, прикрепленной к носителю. Консорциум включает не только аммоний-окисляющие и анаммокс-бактерии, но также и широкий спектр гетеротрофных и автотрофных микроорганизмов. Поэтому для эффективного управления процессом Н/А требуется достаточно жесткое регулирование физико-химических условий для поддержания высокой активности и конкурентоспособности аммоний-окисляющих и анаммокс-бактерий (Каллистова и соавт., 2016; Cho et al., 2020).
Низкие скорости роста анаммокс-бактерий и чувствительность к ингибиторам, присутствующим в богатых азотом сточных водах, обусловливают длительный период запуска биореакторов. Кроме того, в процессе эксплуатации нередко возникают ситуации, приводящие к нестабильности процесса и снижению его эффективности, вызванные временными колебаниями состава и расхода поступающей сточной воды, изменением температурного режима, эксплуатационными проблемами (Ali, Okabe, 2015; Talan et al., 2021). Одним из перспективных путей повышения стабильности работы биореакторов и снижения продолжительности периода запуска считается биоаугментация ‒ добавление чистых или смешанных микробных культур с целью интенсифицировать биодеградацию загрязнителей и повысить эффективность процесса биологической очистки (Herrero, Stuckey, 2015; Zhang et al., 2017; Raper et al., 2018). В ряде исследований было показано, что при неблагоприятных условиях биоаугментация анаммокс-бактериями поддерживает стабильность и повышает эффективность собственно анаммокс-процесса, например, после шокового действия антибиотика окситетрациклина (Jin et al., 2014; Zhang et al., 2018). На основе регулярной биоаугментации гранулами с высокой анаммокс-активностью был разработан процесс SBA-ANAMMOX, позволяющий очищать токсичные сточные воды фармацевтической промышленности, губительно действующие на анаммокс-бактерии (Tang et al., 2011).
Учитывая двухэтапность процесса Н/А, следует ожидать, что наиболее эффективными организмами для биоаугментации будут аммоний-окисляющие и/или анаммокс-бактерии. Действительно, в ряде работ показано, что биоаугментация биореактора обогащенным аммоний-окисляющими бактериями активным илом ускоряет запуск процесса нитритации и создает благоприятные условия для последующего развития анаммокс-бактерий (Zhang et al., 2012; Ma et al., 2013; Miao et al., 2017; Пименов и соавт., 2022). Определенные успехи получены при постоянной (регулярной) биоаугментации основного (mainstream) биореактора Н/А активным илом, обогащенным аммоний-окисляющими и анаммокс-бактериями. Однако для реализации такой технологии необходима постоянно работающая дополнительная (sidestream) установка по получению обогащенного активного ила (Wett et al., 2013, 2015; Trinh et al., 2021). Для повышения активности Н/А в холодный период года предложено вносить активный ил, обогащенный аммоний-окисляющими и анаммокс-бактериями, полученный заранее в теплый период и хранившийся в анаэробных условиях при 20°С (Zhu et al., 2022a, 2022b). Учитывая, что при смене условий роста происходит постепенная смена структуры микробного сообщества и доминирующих видов, для ускорения процесса предложено использовать биоаугментацию биореактора заблаговременно адаптированными анаммокс-бактериями (Lin et al., 2021).
Вместе с тем, существуют высокие риски того, что внесение в сформированное сообщество бактерий извне может не оказать положительного влияния на процесс или даже ухудшить ситуацию. Это может быть связано с неоптимальностью физико-химических условий для роста вносимых микроорганизмов, их низкой конкурентоспособностью по сравнению с аборигенными микроорганизмами, быстрым выеданием хищниками, негативными изменениями физико-химических условий или структуры микробного сообщества в биореакторе после аугментации и т.п. (Zhang et al., 2017; Raper et al., 2018). Поэтому для снижения рисков и повышения эффективности биоаугментации гетерогенными активными илами нужны дальнейшие детальные исследования в этой области.
Ранее нами было показано, что биоаугментация обогащенным нитрификаторами Nitrosospira микробным сообществом способствует быстрому увеличению активности аммоний-окисляющих и анаммокс-бактериий и повышению эффективности удаления азота в реакторе Н/А (Пименов и соавт., 2022). Целью настоящей работы было изучение влияния на процесс Н/А внесения анаммокс-сообщества, кардинально отличающегося по составу и условиям выращивания от сообщества, развивающегося в биореакторе.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальная установка. Эксперименты проводили в трех одинаковых параллельно работающих лабораторных биореакторах SBR-типа с рабочим объемом 4.5 л, внутрь которых для развития биопленки была помещена цилиндрическая загрузка из волокнистых полиэтилена и полипропилена общей площадью поверхности 11.6 дм2 (Поливом, “Этек”, РФ). В биореакторы подавали синтетическую среду следующего состава (г/л): (NH4)2SO4 – 0.942 (200 мг N-NH4/л); NaCH3COO · · 3H2O – 0.04; KH2PO4 – 0.044; NaHCO3 – 2.1. Реакторы эксплуатировали в одинаковом режиме при температуре 32 ± 2°C; рН 8.3 ± 0.1.
Продолжительность каждого SBR-цикла составляла 6 ч. Цикл состоял из следующих фаз: фаза чередования аэрации и механического перемешивания – 310 мин; фаза отстаивания – 20 мин; фаза одновременной подачи 1 л свежей и слива 1 л отработанной среды – 30 мин. Свежая среда подавалась снизу, что обеспечивало одновременное “поршневое” вытеснение без перемешивания очищенной воды сверху реактора. Минимальная и максимальная концентрации растворенного кислорода в период без аэрации и в период аэрации (по 20 мин) составляли, соответственно, 0.2 и 2 (±10%) мг/л. Детальное описание биореакторов и методов анализа приведено ранее (Каллистова и соавт., 2020; Пименов и соавт., 2022).
Подготовка активных илов анаммокс. Основной (аборигенный) активный ил анаммокс (ИА) был выращен в описанной выше экспериментальной установке в течение 5 мес., собран путем механического удаления с загрузочного материла, и в течение 5 нед. хранился при температуре 4°С. Для запуска нового цикла работы биореактора ил суспендировали в свежей среде (1‒1.5 л) и вносили в реактор. В течение двух недель наблюдали прикрепление практически всего активного ила на загрузочном материале. В течение всего периода инкубации свободноплавающий ил в реакторе в виде взвешенных частиц присутствовал в минимальном количестве (его доля от внесенного не превышала 1‒2%).
Биоаугментирующий активный ил анаммокс (ИБ) выращивали при комнатной температуре (24°С) в течение двух лет в осуществляющем анаммокс-процесс проточном вертикальном реакторе в виде биопленки на ершовом носителе (Mardanov et al., 2019). Синтетическая минеральная среда, поступавшая в реактор, имела следующий состав (г/л): NaHCO3 – 0.9; MgSO4 · 7H2O – 0.12; CaCl2 · · 7H2O – 0.18; KH2PO4 – 0.027; 1 мл/л раствора микроэлементов (г/л): ЭДТА – 1.5; H3BO3 – 0.004; СоCl2 · 4H2O – 0.078; ZnSO4 – 0.128; MnCl2 · 4H2O – 0.324, CuCl2 – 0.051; Na2MoO4 – 0.009; NiCl2 · · 6H2O – 0.057; Na2SeO3 – 0.034. В качестве субстратов для анаммокс-процесса в среду добавляли NH4Cl (250 мг N-NH4/л) и NaNO2 (250 мг N-NO2/л). Реактор работал в режиме гидравлического времени пребывания 0.7 сут, эффективность удаления общего азота составляла около 90%.
Схема эксперимента. Реактор № 1 был контрольным, реакторы № 2 и 3 – опытными. Для запуска процесса Н/А в реакторы 1 и 3 добавили по 1.44 г ИА (по массе беззольного сухого веществ; СВ), в реактор № 2 – 1.04 г ИА (табл. 1). Одновременно с ИА в реактор № 2 был также добавлен ИБ в количестве 0.56 г по массе беззольного СВ (54% от массы аборигенного ИА). В течение первых 53 сут реактор № 3 работал в режиме, идентичном контрольному реактору № 1, затем, в реактор № 3 был внесен ИБ в количестве 39% от массы исходного ИА.
Таблица 1.
Масса активных илов ИА и ИБ (по массе беззольного сухого вещества, СВ, в г), внесeнных в каждый реактор
| Время внесения ИБ | Реактор № 1 | Реактор № 2 | Реактор № 3 | |||
|---|---|---|---|---|---|---|
| контроль | опыт 1. Инокуляция ИБ в момент запуска биореактора | опыт 2. Инокуляция ИБ в активный реактор | ||||
| ИА | ИБ | ИА | ИБ | ИА | ИБ | |
| День 0 | 1.44 | 0 | 1.04 | 0.56 | 1.44 | 0 |
| День 53 | 0 | 0 | 0 | 0 | 0 | 0.56 |
Определение эффективности удаления азота. Регулярно из биореакторов отбирали образцы отходящей воды для химического анализа и развивающейся на загрузке биопленки для молекулярного профилирования состава микробного сообщества.
Концентрацию удаленного азота рассчитывали, как разность между концентрацией аммонийного азота (N-NH4) в поступающей среде и суммарной концентрацией минеральных форм азота в очищенной воде (N-NH4, N-NO2, N-NO3). Эффективность удаления азота (%) рассчитывали, как долю удаленного азота от его содержания в поступающей среде.
Анализ состава микробных сообществ в активных илах (ИА и ИБ, или их смеси после выращивания в биореакторе), проводили методом высокопроизводительного секвенирования фрагментов гена 16S рРНК. Активный ил отбирали в момент инокуляции, через 53 и 70 сут инкубации.
Метагеномную ДНК из образцов выделяли с помощью набора DNeasy PowerSoil Kit (“Qiagen”, Германия) по протоколам производителя. Вариабельный V3‒V4 регион гена 16S рРНК амплифицировали с использованием универсальных праймеров 341F CCTAYGGGDBGCWSCAG и 806R GGACTACNVGGGTHTCTAAT (Frey et al., 2016). Полученные ПЦР фрагменты использовали для приготовления библиотек ампликонов с баркодами с помощью наборов Nextera XT Index Kit v2 (“Illumina”, San Diego, США) по протоколам производителя. ПЦР фрагменты секвенировали с использованием Illumina MiSeq в формате 2 × 300 нт.
Полученные парные чтения объединили с помощью программы FLASH v.1.2.11 (Magoc, Salzberg, 2011). На следующем этапе из дальнейшего анализа были исключены низкокачественные чтения, синглетоны и химеры.
Оставшиеся чтения были кластеризованы в оперативные таксономические единицы (ОТЕ) с идентичностью последовательностей на уровне 97%. Для определения доли ОТЕ в каждом из образцов, на репрезентативные последовательности ОТЕ были наложены исходные чтения (включая низкокачественные и синглетоны) с помощью пакета программ USEARCH v.11 (Edgar, 2010). Таксономическую идентификацию полученных ОТЕ проводили с использованием алгоритма VSEARCH v.2.14.1 и базы данных Silva v.138 (Rognes et al., 2016).
Полученные последовательности фрагментов гена 16S рРНК депонированы в базу NCBI и доступны в рамках проекта BioProject PRJNA556270.
Статистическая обработка результатов. В экспериментах по определению концентраций форм азота и кислорода проводили по 3 определения каждого показателя. Для каждой точки определяли среднее арифметическое и среднее абсолютных значений отклонений точек данных от среднего. Эта величина соответствовала экспериментальному разбросу и составляла не более 3%. Схема эксперимента позволила рассчитать экспериментальную ошибку при получении средних данных в контрольных опытах. Поскольку в реактор № 3 не вносили никаких добавок до 53 сут, то результаты по реакторам № 1 и 3 рассматривали как две независимые повторности, и они были усреднены. Средний экспериментальный разброс составил 9%. Эту величину откладывали как разброс данных на всех графиках.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Эффективность работы биореактора
В связи с длительным хранением ИА в неактивном состоянии при температуре 4°С, эффективность удаления азота в течение первой недели после запуска реактора была ожидаемо невысокой, независимо от внесения ИБ – не более 20% (рис. 1). В течение последующих 7 сут эффективность удаления выросла в 2 раза (до 34‒39%), а к 41 сут достигла максимума – 49 и 57%, соответственно, в контрольном и опытном вариантах. Удаление азота на 41 сут культивирования в опытном варианте было выше, чем в контрольном, на 15%. Затем эффективность удаления азота в опытном биореакторе снизилась, и с 46 сут реакторы работали с близкой эффективностью.
Рис. 1.
Изменение количества удаленного минерального азота в ходе работы биореакторов (в жидкости, выходящей из реактора): (1) – контроль;( 2) – опыт 1 (внесение ИБ одновременно с ИА при запуске биореакторов); (3) – опыт 2 (внесение ИБ на 53 сут работы биореакторов). (а) – Сравнение вариантов контрольного и опыт № 1; (б) ‒ сравнение вариантов контрольного и опыт № 2. Стрелками отмечено внесение ИБ в опытных вариантах. Контрольная кривая (1) получена усреднением данных по реакторам № 1 и 3 на участке 1‒53 сут и построена на основании данных только реактора № 1 на участке 53‒91 сут.
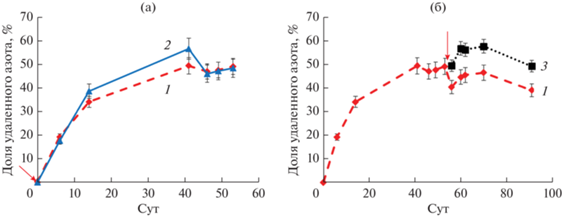
После внесения ИБ в опытный реактор № 3 скорость удаления азота по сравнению с контролем увеличилась на 23‒27% и на протяжении 56‒91 сут составила 100‒115 мг N/л/сут, против 83‒92 мг N/л/сут в контроле. Содержание соединений азота, аммония, нитритов и нитратов в очищенной в реакторах воде и эффективности удаления азота представлены на рисунках в приложении (рис. S1‒S4 ).
Несмотря на то, что в течение эксперимента происходило увеличение биомассы анаммокс-бактерий в биореакторе, можно оценочно сравнить активности ИА и ИБ, рассчитав удельные скорости удаления азота v илами ИА и ИБ, т.е. в расчете на 1 г внесенной биомассы.
Удельную скорость удаления азота аборигенным илом vИА определяли по эффективности удаления азота в контрольном биореакторе. На 41 сут культивирования в контрольном варианте (реактор 1) суммарная скорость удаления азота составила 99 мг N/л/сут. Учитывая, что было внесено 1.44 г ИА, рассчитывали vИА = 99 (мг N/л/сут)/1.44 г = 68.75 мг N/л/сут/г.
Для оценки активности ИБ было составлено уравнение для вычисления скорости удаления азота в реакторе № 2:
VNобщ на 41 сут составила 113 мг N/л/сут, МИА и МИБ – соответственно 1.04 г и 0.56 г (табл. 1, рис. S4 ).
Решив это уравнение, находили, что удельная активность ИБ составила 74.0 мг N/л/сут/г. С учетом экспериментального разброса данных можно считать активности обоих илов одинаковыми.
Аналогичный расчет для удельной активности илов на 56‒70 сут дал величины: vИА = 50‒66 мг N/л/сут/г, а vИБ = 41‒49 мг N/л/сут/г. Рассчитанная удельная активность экзогенного ИБ в среднем на 20% ниже, чем аборигенного активного ила. С учетом прироста исходного активного ила ИА и, соответственно, возрастания его массы на 53 сут культивирования, относительная доля вносимого ила будет ниже, и, соответственно, его расчетная удельная активность – выше.
Таким образом, можно считать удельные активности аборигенного и вносимого илов близкими или одинаковыми, как при биоаугментации в момент запуска биореактора, так и при биоаугментации зрелого анаммокс-сообщества, развивающегося в процессе Н/А.
Состав микробных сообществ активных илов
Исходный таксономический состав микробного собщества аборигенного, биоаугментирующего и синтетического илов. Микробное сообщество ИА содержало 16% (от общего количества последовательностей генов 16S рРНК) анаммокс-бактерий с соотношением последовательностей представителей родов “Ca. Jettenia” к “Ca. Brocadia” 1 : 1.5; 8% нитрификаторов I стадии рода Nitrosomonas (табл. S1 , рис. 2). ИБ содержал несколько больше анаммокс-бактерий (19.4%), из них “Ca. Jettenia” – 3.4%, “Ca. Brocadia” – 0.12% и “Ca. Kuenenia” ‒ 15.9%. Последовательности в ИБ, относящиеся к “Ca. Brocadia” (ОТЕ16 и ОТЕ52) были идентичны последовательностям в аборигенном анаммокс-сообществе. Из последовательностей “Ca. Jettenia” (ОТЕ13 ‒ 1.3% и ОТЕ559 ‒ 2.1%) идентичной аборигенному сообществу была только последовательность ОТЕ13 (в аборигенном сообществе ее доля достигала 6.5%) (рис. 2). Последовательность, относящаяся к “Ca. Kuenenia” (ОТЕ7) была уникальна и имела 98.9% сходства с “Ca. Kuenenia stuttgartiensis” (CP049055.1).
Рис. 2.
Содержание основных групп анаммокс-бактерий в исходных аборигенном активном иле (ИА) и биоаугментирующем иле (ИБ), а также в общих илах, сформированных в опытных реакторах на 53 и 70 сут. Обозначения: I – ИА; II – ИБ; III – контроль (53 сут); IV – опыт 1, с 1-го дня (53 сут); V – контроль (70 сут); VI – опыт 2, с 53 сут (70 сут); VII – опыт 1, с 1-го дня (70 сут). 1 ‒ ОТЕ559, 2 ‒ ОТЕ13, 3 ‒ ОТЕ7, 4 ‒ ОТЕ52, 5 ‒ ОТЕ16. ОТЕ559 ‒ “Ca. Jettenia” из ИБ; ОТЕ13 ‒ “Ca. Jettenia” из ИА; ОТЕ7 ‒ “Ca. Kuenenia” из ИБ; ОТЕ52 ‒ “Ca. Brocadia” из ИБ; ОТЕ16 ‒ “Ca. Brocadia” из ИА. Опыт 1 – вариант, когда ИБ вносили с первого дня работы реактора; опыт 2 – вариант, когда ИБ вносили на 53 сут работы реактора.

Следует отметить, что условия культивирования ИБ (Mardanov et al., 2019) отличались от культивирования аборигенного анаммокс-сообщества (Пименов и соавт., 2021), результатом чего явилась существенная разница в общем разнообразии и относительном обилии различных таксонов в ИБ по сравнению с аборигенным сообществом. Сообщество ИБ было менее разнообразно по составу, чем аборигенный ил. В ИБ детектировано 162 ОТЕ, принадлежащих разным бактериальным таксонам, в аборигенном иле – 213 ОТЕ. При этом только 70 ОТЕ были детектированы в обоих илах. Из этих 70 ОТЕ, подавляющее большинство с высокой долей в ИБ (>1%), в аборигенном иле имело низкую долю (<0.1%) и наоборот. Только 5 ОТЕ в обоих илах имели долю ≥1%: “Ca. Jettenia” (ОТЕ13), некультивируемые Chloroflexi (Anaerolineaceae, ОТЕ1), неидентифицированный представитель Bacteroidetes/Chlorobi group (ОТЕ3), Nitrosomonas europaea (ОТЕ6) и некультивируемые Bacteroidetes (ОТЕ14). Это может указывать на устойчивые межвидовые связи между представителями рода “Ca. Jettenia” (а возможно и другими анамокс-бактериями) и данными микроорганизмами, независимо от физико-химических условий культивирования и состава сообщества.
Эффект биоаугментации в момент запуска биореакторов. Анализ последовательностей генов 16S рРНК позволил проследить динамику развития анаммокс-бактерий в контрольном и опытных реакторах (таблица S1 , рис. 2). Внесение ИБ в момент запуска (реактор № 2) незначительно увеличило производительность реактора посредством увеличения общего количества анаммокс-бактерий, однако, привнесенные извне анаммокс-бактерии оказались недостаточно конкурентоспособными по отношению к аборигенным в условиях адаптации сообщества на этапе запуска (до выхода реактора на стабильный режим). Через 53 сут в реакторе № 3 детектировались лишь следы (0.07%) ОТЕ559, исходно преобладавшей в ИБ среди представителей рода “Ca. Jettenia”. При этом условия в реакторе № 2 были более благоприятными для другой анаммокс-бактерии рода “Ca. Jettenia”, соответствующей ОТЕ13, которая также была важной компонентой аборигенного сообщества. О вкладе ОТЕ13 из ИБ в аборигенное сообщество свидетельствует ее большая доля (3% vs 2.2%) в реакторе № 2 по сравнению с усредненным контролем (реакторы № 1 и № 3, как повторности). Кроме того, условия в реакторе № 2 в первые 53 сут с момента запуска оказались совсем неподходящими для размножения доминировавших в ИБ представителей рода “Ca. Kuenenia”. Последовательности представителей рода “Ca. Kuenenia” не были обнаружены в реакторе № 2 на 53 сут и были детектированы позднее (на 70 сут) в том же реакторе в минимальном количестве 0.04% вместе с ОТЕ559 (“Ca. Jettenia”, 0.03%). При этом, если на 53 сут как в контроле, так и в реакторе № 2 доминировали аборигенные “Ca. Brocadia” (6.58% в контроле и 6.22% в реакторе № 2), то на 70 сут в контроле их доля возросла до 7.45%, а в реакторе № 2, наоборот, снизилась до 4.5%. Доля “Ca. Jettenia” (ОТЕ13) в реакторе № 2, наоборот, незначительно увеличилась на 70 сут с 3 до 3.3%, тогда как в контроле ‒ снизилась с 2.2 до 1.3%.
Эффект биоаугментации зрелого микробного сообщества. Внесение новых анаммокс-бактерий в биореактор № 3 после выхода реакторов на стабильный режим оказалось более благоприятно для процесса Н/А, что привело к возрастанию доли и разнообразия анаммокс-бактерий и увеличению удаления азота на 23‒27%. Очевидно, в зрелом сообществе (после 40 сут инкубации) происходит лучшая адаптация новых анаммокс-бактерий, что приводит к увеличению скорости и эффективности процесса удаления азота, а также к увеличению доли и разнообразия анаммокс-бактерий. На 70 сут общая доля анаммокс-бактерий в реакторе № 3 была выше, чем в контроле (10.2% vs 8.7%), благодаря увеличению не только доли представителей “Ca. Jettenia” (ОТЕ13 и ОТЕ 559), но и доли представителей рода “Ca. Kuenenia” (1.8%). При этом в сообществе реактора № 3 по-прежнему доминировали представители рода “Ca. Brocadia” (5.2%). Как и в опыте 1, в котором бактерии “Ca. Kuenenia” не смогли закрепиться и после длительного инкубирования практически не обнаруживались, в опыте 2 их численность также снижалась. При содержании “Ca. Kuenenia” в ИБ 19% и “разбавлении” исходным илом в 5 раз, исходная доля в сообществе составляла около 4%. Через 17 сут их доля составляла 1.8%.
Таким образом, после внесения в биореакторы биоаугментирующего ила анаммокс наблюдалось постепенное изменение состава микробных сообществ. Во всех вариантах прослеживалась тенденция к установлению сообщества с соотношением анаммокс-бактерий, близким к аборигенному сообществу, характеризующемуся доминированием родов “Ca. Jettenia” и “Ca. Brocadia”. Нехарактерные для аборигенного сообщества “Ca. Kuenenia” с течением времени элиминировались. Причины, определяющие таксономический состав и соотношение видов в анаммокс-сообществах детально еще не выяснены. На структуру анаммокс-сообщества могут влиять множество факторов: температура, рН, концентрация кислорода, минеральных форм азота и органических веществ, соленость, наличие токсичных веществ, тип пространственной организации (например, рост в виде прикрепленных биопленок или суспензия клеток), а также режим работы биореактора или длительное голодание (Gonzalez-Martinez, 2018; Trinhg et al., 2021; Kallistova et al., 2022). Однако точно предсказать доминирующий вид и, тем более, структуру сообщества до сих пор не представляется возможным. Вместе с тем, установлена взаимосвязь известных родов анаммокс-бактерий (Brocadia, Kuenenia, Anammoxoglobus, Jettenia, Scalindua и Loosdrechtii) с их местообитанием: в активных илах промышленных очистных сооружений в основном встречаются представители Brocadia и Kuenenia и Loosdrechtii. Anammoxoglobus, Jettenia и Scalindua приурочены, главным образом, к анаэробным системам очистки, пресноводным и морским водоемам, реже встречаются и в активных илах промышленных и лабораторных биореакторов (Trinh et al., 2021, Yang et al., 2021).
В работе Zhang et al. (2017) исследовалось взаимодействие между тремя филогенетически отдаленными видами анаммокс-бактерий ‒ “Candidatus Brocadia sinica”, “Candidatus Jettenia caeni” and “Candidatus Kuenenia stuttgartiensis” в условиях лимита по одному из субстратов роста – нитриту. Было показано, что в зависимости от условий выращивания, преимущество получает либо “Ca. B. sinica” (высокие нагрузки по азоту), либо “Ca. J. caeni” (низкие нагрузки по азоту). В таких условиях “Ca. J. caeni” обнаруживались в ядре агрегатов, а “Ca. B. sinica” ‒ в наружном слое. Вместе с тем, “Ca. K. stuttgartiensis” не доминировала ни при каких условиях, что противоречило ее кинетическим характеристикам. Ожидалось, что, обладая высоким сродством к субстрату (нитриту), “Ca. K. stuttgartiensis” должна была выиграть конкуренцию при низких концентрациях субстрата и развиваться в ядре агрегатов. Авторы объясняют это противоречие низкой численностью этих бактерий в исходном инокуляте, неточностью определения кинетических констант и наличием неизвестных факторов (например, отсутствием какого-то микроэлемента), препятствующих развитию “Ca. K. stuttgartiensis”. Эта ситуация напоминает описанную в настоящей работе, когда внесение даже значительного количества бактерий рода “Са. Kuenenia” не обеспечило им закрепления в сообществе, и в течение короткого периода времени произошла их элиминация или сущетвенное сокращение численности.
В нашем случае, очевидно, имело место несколько факторов, влиявших на развитие анаммокс-бактерий. Стрессовыми факторами для бактерий экзогенного ила были двукратное снижение концентрации соединений азота и наличие конкурентов за субстраты. При внесении активных илов в момент инокуляции реакторов пористый загрузочный материал был не заселен, бактерии из ИА и ИБ проникали в него и располагались равномерно в одинаковых физико-химических условиях. Их близкое взаиморасположение обусловливало конкуренцию за субстраты. При этом привнесенные бактерии находились в активном состоянии, что было их преимуществом и обусловило некоторую стимуляцию протекания анаммокс-процесса.
Важным селективным фактором был высокий уровень концентрации кислорода, к которому аборигенное сообщество было адаптировано в течение нескольких лет, а интродуцируемое развивалось в условиях без активной аэрации. Влияние кислорода на анаммокс-бактерии изучено в настоящее время недостаточно для количественного предсказания его влияния на физиологическую активность и исход конкурентной борьбы. Считается, что устойчивость анаммокс-сообществ к кислороду видоспецифична и зависит от типа развития биомассы (в виде суспензии одиночных клеток или в виде агрегатов и биопленок). В наших экспериментах анаммокс-сообщество развивалось в виде биопленок. Вероятно, “Ca. Jettenia” и “Ca. Brocadia” образуют менее проницаемые для О2 микроагрегаты или биопленку по сравнению с “Са. Kuenenia”, что при переменной аэрации в течение длительного периода обеспечивает им более эффективный рост даже при высоких концентрациях кислорода. Так, при гранулированном росте биомассы процесс деаммонификации эффективно осуществлялся вплоть до концентраций растворенного кислорода 3 мг/л.
К нашему удивлению, анаммокс-бактерии, выращенные в условиях без активной аэрации, показывали сопоставимую скорость удаления азота по сравнению с аборигенными представителями. Учитывая увеличение анаммокс-активности после внесения ИБ в обоих вариантах опыта, можно сделать вывод, что доминирующая в ИБ “Са. Kuenenia” в условиях биореактора с переменной аэрацией (и концентрацией О2 в объеме жидкости 0.2‒2.0 мг/л) обладала активностью, сравнимой с активностями аборигенных анаммокс-бактерий (“Ca. Jettenia” и “Ca. Brocadia”). Одно из возможных объяснений этому связано с предысторией ИБ (Mardanov et al., 2019). Этот ил хотя и культивировали без аэрации, но конструкция биореактора не исключала попадания воздуха в среду культивирования, концентрация О2 составляла около 1 мг/л, и, таким образом, анаммокс-бактерии ИБ были адаптированы к присутствию кислорода. Кроме того, микробный консорциум ИБ в момент запуска биореактора находился в активном физиологическом состоянии, тогда как аборигенный ил длительное время хранился в неактивном состоянии при низкой температуре.
Другим важным моментом является необходимость различать текущую физиологическую активность бактерий, детектируемую по эффективности удаления азота, и их способность к размножению и конкуренции с другими видами. Наличие метаболической активности ИБ в обоих вариантах их внесения в реактор не обеспечило им высокой скорости размножения, и они проиграли в конкуренции с аборигенными анаммокс-бактериями при длительном культивировании.
Два варианта внесения экзогенного активного ила отражают две реальные ситуации в работе биореакторов Н/А: запуск и повышение активности уже работающего реактора. Полученные результаты показывают, что биоаугментация активно функционирующего реактора более эффективна, чем на этапе его запуска.
Таким образом, использование для биоаугментации процесса Н/А активного ила из местообитаний, сильно отличающихся по условиям от таковых в биореакторе, позволяет увеличить производительность реактора путем увеличения общего содержания анаммокс-бактерий, их активности и разнообразия. Биоаугментация оказывает положительное влияние как в момент запуска биореактора, так и после длительной эксплуатации, однако имеет ограниченный временной эффект и должна применяться с осторожностью.
Список литературы
Каллистова А.Ю., Дорофеев А.Г., Николаев Ю.А., Козлов М.Н., Кевбрина М.В., Пименов Н.В. Роль анаммокс-бактерий в очистке сточных вод от соединений азота // Микробиология. 2016. Т. 85. С. 126–144.
Kallistova A.Y., Nikolaev Y.A., Pimenov N.V., Dorofeev A.G., Kozlov M.N., Kevbrina M.V. Role of Anammox bacteria in removal of nitrogen compounds from wastewater // Microbiology (Moscow). 2016. V. 85. P. 140‒156.
Кевбрина М.В., Дорофеев А.Г., Агарёв А.М., Козлов М.Н., Николаев Ю.А., Асеева В.Г. Анаммокс – перспективная технология удаления азота из сточных вод // Водоснабжение и санитарная техника. 2019. № 5. С. 28‒35.
Пименов Н.В., Николаев Ю.А., Дорофеев А.Г., Грачёв В.А., Каллистова А.Ю., Миронов В.В., Вантеева А.В., Григорьева Н.В., Берестовская Ю.Ю., Груздев Е.В., Бегматов Ш.А., Равин Н.В., Марданов А.В. Биоаументация активного ила анаммокс нитрифицирующим сообществом бактерий как способ повышения эффективности удаления азота // Микробиология. 2022. Т. 91. С. 160–170.
Pimenov N.V., Nikolaev Yu.A., Dorofeev A.G., Grachev V.A., Kallistova A.Yu., Mironov V.V., Vanteeva A.V., Grigor’eva N.V., Berestovskaya Yu.Yu., Gruzdev E.V., Begmatov Sh.A., Ravin N.V., Mardanov A.V. Bioaugmentation of Anammox activated sludge with a nitrifying bacterial community as a way to increase the nitrogen removal efficiency // Microbiology (Moscow). 2022. V. 91. № 2. P. 126–135.
Agrawal S., Seuntjens D., Cocker P.D., Lackner S., Vlaeminck S. Success of mainstream partial nitritation/anammox demands integration of engineering, microbiome and modeling insights // Curr. Opin. Biotechnol. 2018. V. 50. P. 214–221.
Ali M., Okabe S. Anammox-based technologies for nitrogen removal: Advances in process start-up and remaining issues // Chemosphere. 2015. V. 141. P. 144‒153. https://doi.org/10.1016/j.chemosphere.2015.06.094
Cho S., Kambey C., Nguyen V.K. Performance of anammox processes for wastewater treatment: a critical review on effects of operational conditions and environmental stresses // Water. 2020. V. 12. Art. 20. https://doi.org/10.3390/w12010020
Gonzalez-Martinez A., Munoz-Palazon B., Rodriguez-Sanchez A., Gonzalez-Lopez J. New concepts in anammox processes for wastewater nitrogen removal: recent advances and future prospects // FEMS Microbiol. Lett. 2018. V. 365. fny031. https://doi.org/10.1093/femsle/fny031
Hasan M.N., Altaf M.M., Khan N.A., Khan A.H., Khan A.A., Ahmed S., Kumar P.S., Naushad Mu., Rajapaksha A.U., Iqbal J., Tirth V., Islam S. Recent technologies for nutrient removal and recovery from wastewaters: A review // Chemosphere. 2021. V. 277. Art. 130328. https://doi.org/10.1016/j.chemosphere.2021.130328
Herrero M., Stuckey D.C. Bioaugmentation and its application in wastewater treatment: A review // Chemosphere. 2015. V. 140. P. 119–128. https://doi.org/10.1016/j.chemosphere.2014.10.033
Izadi P., Izadi P., Eldyasti A. Towards mainstream deammonification: Comprehensive review on potential mainstream applications and developed sidestream technologies // J. Environ. Manag. 2021. V. 279. Art. 111615.
Jin R.-C., Zhang Q.-Q., Zhang Z.-Z., Liu J.-H., Yang B.-E., Guo L.-X., Wang H.-Z. Bio-augmentation for mitigating the impact of transient oxytetracycline shock on anaerobic ammonium oxidation (ANAMMOX) performance // Bioresour. Technol. 2014. V. 163. P. 244–253.
Lin L., Pratt S., Li Z., Ye L. Adaptation and evolution of freshwater Anammox communities treating saline/brackish wastewater // Water Research. 2021. V. 207. Art. 117815.
Ma B., Wang S., Zhang S., Li X., Bao P., Peng Y. Achieving nitritation and phosphorus removal in a continuous-flow anaerobic/oxic reactor through bio-augmentation // Bioresour. Technol. 2013. V. 139. P. 375‒378. https://doi.org/10.1016/j.biortech.2013.02.077
Mardanov A.V., Beletsky A.V., Ravin N.V., Botchkova E.A., Litti Y.V., Nozhevnikova A.N. Genome of a novel bacterium “Candidatus Jettenia ecosi” reconstructed from the metagenome of an anammox bioreactor // Front. Microbiol. 2019. V. 10. Art. 02442. https://doi.org/10.3389/fmicb.2019.02442
Miao Y., Zhang L., Li B., Zhang Q., Wang S., Peng Y. Enhancing ammonium oxidizing bacteria activity was key to single-stage partial nitrification-anammox system treating low-strength sewage under intermittent aeration condition // Bioresour. Technol. 2017. V. 231. P. 36‒44. https://doi.org/10.1016/j.biortech.2017.01.045
Morales N., Val Del Río A., Vázquez-Padín J.R. et al. Influence of dissolved oxygen concentration on the start-up of the anammox-based process: ELAN // Water Sci. Technol. 2015. V. 72. P. 520–527. https://doi.org/10.2166/wst.2015.233
Oshiki M., Satoh H., Okabe S. Ecology and physiology of anaerobic ammonium oxidizing bacteria // Environ. Microbiol. 2016. V. 18. P. 2784–2796.
Pedrouso A., Vázquez-Padín J.R., Crutchik D., Campos J.L., Application of anammox-based processes in urban WWTPs: are we on the right track? // Processes. 2021. P. 9. Art. 1334. https://doi.org/10.3390/pr9081334
Raper E., Stephenson T., Anderson D.R., Fisherb R., Soares A. Industrial wastewater treatment through bioaugmentation // Proc. Saf. Environ. Prot. 2018. V. 118. P. 178–187. https://doi.org/10.1016/j.psep.2018.06.035
Talan A., Tyagi R.D., Drogui P. Critical review on insight into the impacts of different inhibitors and performance inhibition of anammox process with control strategies // Environ. Technol. Innovat. 2021. V. 23. 101553.
Tang C.J., Zheng P., Chen T.T., Mahmood Q., Zhang J.Q., Chen X.G., Ding S., Chen J.W., Wu D.T. Enhanced nitrogen removal from pharmaceutical wastewater using SBA-AN-AMMOX process // Water Res. 2011. V. 45. P. 201–210.
Trinh H.P., Lee S.-H., Jeong G., Yoon H.-J., Park H.-D. Recent developments of the mainstream anammox processes: Challenges and opportunities // J. Environ. Chem. Engin. 2021. V. 9. Art. 105583.
Wett B., Podmirseg S.M., Gómez-Brandón M., Hell M., Nyhuis G., Bott C., Murthy S. Expanding DEMON sidestream deammonification technology towards mainstream application // Water Environ. Res. 2015. V. 87. 2084–2089. https://doi.org/10.2175/106143015x14362865227319
Wett B., Omari A., Podmirseg S., Han M., Akintayo O., Brandon M.G., Murthy S., Bott C., Hell M., Takacs I. Going for mainstream deammonification from bench to full scale for maximized resource efficiency // Water Sci. Technol. 2013. V. 68. P. 283–289.
Yang Y., Azari M., Herbold C.W., Meng L., Huaihai C., Xinghua D., Denecke M., Gu Ji-D. Activities and metabolic versatility of distinct anammox bacteria in a full-scale wastewater treatment system // Water Research. V. 206. 11776. https://doi.org/10.1016/j.watres.2021.117763
Zhang L., Narita Y., Gao L., Ali M., Oshiki M., Ishii S., Okabe S. Microbial competition among anammox bacteria in nitrite-limited bioreactors // Water Res. 2017. V. 125. P. 249–258.
Zhang L., Zhang S.J., Gan Y.P., Peng Y.Z. Bio-augmentation to rapid realize partial nitrification of real sewage // Chemosphere. 2012. V. 88. P. 1097–1102.
Zhang L., Okabe S. Ecological niche differentiation among anammox bacteria // Water Res. 2020. V. 171. https://doi.org/10.1016/j.watres.2020.115468
Zhang Q.-Q., Yang G.-F., Sun K.-K., Tian G.-M., Jin R.-C. Insights into the effects of bio-augmentation on the granule-based anammox process under continuous oxytetracycline stress: Performance and microflora structure // Chem. Engin. J. 2018. V. 348. P. 503–513. https://doi.org/10.1016/j.cej.2018.04.204
Zhang Q.-Q., Yang G.-F., Zhang L., Zhang Z.-Z., Tian G.-M., Jin R.-C. Bioaugmentation as a useful strategy for performance enhancement in biological wastewater treatment undergoing different stresses: application and mechanisms // Crit. Rev. Environ. Sci. Technol. 2017. V. 47. P. 1877–1899. https://doi.org/10.1080/10643389.2017.1400851
Zhu W., Van Tendeloo M., Alloul A., Vlaeminck S.E. Towards mainstream partial nitritation/anammox in four seasons: Feasibility of bioaugmentation with stored summer sludge for winter anammox assistance // Bioresour. Technol. 2022. V. 347. Art. 126619.
Zhu W., Van Tendeloo M., Xie Y., Timmer M.J., Peng L., Vlaeminck S.E. Storage without nitrite or nitrate enables the long-term preservation of full-scale partial nitritation/anammox sludge // Sci. Total Environ. 2022. V. 806. Art. 151330. https://doi.org/10.1016/j.scitotenv.2021.151330
Дополнительные материалы
- скачать ESM.doc
- Приложение 1.


