Микробиология, 2022, T. 91, № 4, стр. 419-432
Высокоэффективная биодеструкция экотоксичной дегидроабиетиновой кислоты нерастущими клетками Rhodococcus rhodochrous ИЭГМ 107
К. М. Иванова a, *, В. В. Гришко a, И. Б. Ившина a
a Пермский федеральный исследовательский центр Уральского отделения
Российской академии наук
614990 Пермь, Россия
* E-mail: kseniya.cheremnikh@gmail.com
Поступила в редакцию 03.03.2022
После доработки 11.03.2022
Принята к публикации 14.03.2022
- EDN: LQGZSL
- DOI: 10.31857/S002636562230022X
Аннотация
Экспериментально обоснована возможность полной биодеструкции токсичной дегидроабиетиновой кислоты (ДАК) в высокой (более 500 мг/л) концентрации с помощью нерастущих клеток Rhodococcus rhodochrous ИЭГМ 107 (ОП600 2.5) в фосфатно-щелочном буфере (pH 8.0). Получен стабильный биокатализатор, сохраняющий функциональную активность при повторном (до 3 циклов) использовании и длительном (до 84 сут, 4°С) хранении. Показано, что высокая устойчивость родококков к ДАК связана с повышенной растворимостью экотоксиканта в буфере с рН 8.0, что способствует усилению синтеза липидов (в том числе биосурфактантов), повышению сродства клеток к гидрофобному субстрату за счет увеличения гидрофобности клеточной поверхности и, как следствие, детоксикации и биоразложению поллютанта.
Перспективными способами утилизации токсичных соединений являются естественные процессы разложения поллютантов под действием ферментативной активности микроорганизмов, которая протекает при физиологических температурах, нормальном давлении и без применения агрессивных химических реагентов.
Дегидроабиетиновая кислота (ДАК), продуцируемая хвойными растениями семейства Pinaceae, является одним из токсичных (ЛД50 0.5–6.3 мг/л) компонентов сточных вод целлюлозно-бумажной промышленности (Luchnikova et al., 2019). ДАК обнаруживается в концентрациях 500 мг/л и выше в стоках целлюлозно-бумажных комбинатов, морской и речной воде (Volkman et al., 1993), донных отложениях и почве (Pérez-de-Mora et al., 2008), а также в живых организмах (Hernández et al., 2008). Известно, что многие микроорганизмы способны к биодеструкции ДАК. В основном они представлены мицелиальными грибами (представителями родов Aspergillus, Cephalosporium, Fusarium) или грамотрицательными бактериями (представителями родов Pseudomonas, Burkholderia, Sphingomonas и др.)(Luchnikova et al., 2019). Ферментные системы грибов обычно катализируют реакцию гидроксилирования ДАК (300 мг/л) и не способны полностью ее разлагать, что может привести к образованию производных с аналогичной или большей токсичностью. Кроме того, использование грибов сопряжено с определенными рисками из-за их посевного (спорового) материала и способности синтезировать микотоксины. По литературным данным, биодеградирующая активность бактериальных культур, как правило, проявляется при концентрации ДАК не выше 250 мг/л (Smith et al., 2008). В связи с этим актуален поиск новых биодеструкторов, способных эффективно утилизировать высокие (500 мг/л и выше) концентрации ДАК. Ранее нами было показано, что актинобактерии R. rhodochrous ИЭГМ 107 в условиях кометаболизма с н-гексадеканом (0.1 об. %) осуществляют биодеструкцию ДАК (500 мг/л) в течение 7 сут (Cheremnykh et al., 2018).
С целью усиления нативных свойств бактериальных клеток используются различные технологические приемы. Для биодеструкции и биотрансформации полициклических органических соединений наиболее распространенным является способ применения нерастущих клеток, т.е. отмытых от питательной среды бактериальных клеток (в поздней экспоненциальной или стационарной фазе роста) и перенесенных в среду без источников питания (буферный раствор) (Carvalho et al., 2009; Mutafova et al., 2016; Nawawi et al., 2016). Использование нерастущих клеток по сравнению с активно растущей культурой имеет ряд преимуществ: возможность осуществления строгого регулирования исходной клеточной суспензии; применение высокой плотности клеток, что способствует увеличению уровня биоконверсии и сокращению продолжительности процесса; затрачиваемая на рост энергия перенаправляется на преобразование субстрата; проведение процесса в нестерильных условиях (Julsing et al., 2012; Grishko et al., 2013; Nawawi et al., 2016). Показано (Gefen et al., 2014), что остановка роста бактериальной культуры в стационарной фазе (до 7 сут) не влияет на метаболическую активность клеток (экспрессию генов, синтез белка). Такой период голодания может даже способствовать повышению их каталитической активности в отношении труднодоступных соединений. Например, после двухдневного голодания протеобактерии Ralstonia eutropha сохраняли фенолдеструктирующую активность, при этом гидрофобность их клеточной поверхности и, как следствие, каталитическая активность увеличивались. Использование нерастущих клеток позволяет сократить период их адаптации к токсичному субстрату и повысить индукцию ферментов, ответственных за деградацию фенола (Watanabe et al., 2000).
Целью настоящей работы явилось изучение возможности использования нерастущих клеток R. rhodochrous ИЭГМ 107 для эффективной биодеструкции ДАК в высоких (500, 750, 1000 мг/л) концентрациях.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Микроорганизмы. В работе использовали штамм R. rhodochrous ИЭГМ 107 из Региональной профилированной коллекции алканотрофных микроорганизмов (акроним коллекции ИЭГМ, УНУ 73559, http://www.iegmcol.ru). Штамм выделен из воды реки Днепр (Днепропетровская область, Украина). Видоспецифичная ПЦР показала положительный результат R. rhodochrous ИЭГМ 107 с праймерами для R. rhodochrous. Секвенирован полный геном штамма (номер доступа GenBank WGS JAJNCP010000001-JAJNCP010000118).
Химические вещества. В экспериментах применяли ДАК производства “Mosinter Group Limited” (99.1%, Китай). Использованные в работе этилацетат, гексан, ацетонитрил имели квалификацию х. ч., ч. д. а. или о. с. ч. (“Merck”, “Sigma-Aldrich”). В качестве метилирующего агента использовали (триметилсилил)диазометан в диэтиловом эфире (2.0 M) производства “Sigma-Aldrich” (США).
Биодеструкция с использованием активно растущих клеток. Периодическое культивирование родококков проводили в колбах Эрленмейера объемом 250 мл, содержащих 100 мл минеральной среды (Cheremnykh et al., 2018), при температуре 28°C и постоянном перемешивании со скоростью 160 об./мин. Дополнительно в минеральную среду вносили н-гексадекан (0.1 об. %). В качестве инокулята использовали суспензию бактериальных клеток (ОП600 1.0), предварительно выращенных на мясопептонном агаре в течение 2 сут.
Биодеструкция с использованием нерастущих клеток. Родококки предварительно выращивали в среде LB (“Sigma-Aldrich”, США), а также в минеральной среде с н-гексадеканом (1.0 об. %) или глюкозой (1.0%) при постоянном перемешивании (160 об./мин) и температуре 28°C. В стационарной фазе роста (дополнительные материалы, рис. S1 ) бактериальные клетки осаждали центрифугированием (4000 об./мин, 10 мин, Hermle Z 200 A, Германия) и трижды промывали эквивалентным объемом фосфатно-щелочного буфера (pH 7.0) по Кларку‒Лабсу (Dawson et al., 1986). Отмытые клетки ресуспендировали в 50 мл фосфатно-щелочного буфера (pH 6.0, 7.0, 8.0 или 9.0) и доводили до значения оптической плотности (ОП600) 1.5, 2.0, 2.5 или 3.0. ДАК вносили в приготовленную суспензию в виде раствора в 96%-ном этаноле (1 мг/10 мкл) в концентрациях 500, 750 или 1000 мг/л. Процесс биодеструкции контролировали путем отбора проб каждые 24 ч.
Контроли. В экспериментах с растущими клетками использовали 1) минеральную среду, содержащую ДАК (для оценки абиотической стабильности ДАК); 2) минеральную среду без ДАК, содержащую н-гексадекан и бактериальные клетки (для дифференциации возможных метаболитов). Контролями в исследованиях с нерастущими клетками служили 1) стерильный раствор ДАК в фосфатно-щелочном буфере и 2) бактериальная суспензия без ДАК (биотический контроль).
Длительное хранение и повторное использование нерастущих клеток. Суспензии клеток (ОП600 2.5) в фосфатно-щелочном буфере (рН 8.0) хранили при температуре 4°С без воздействия солнечного света в течение 84 сут. В случае повторного использования суспензии нерастущих клеток ДАК добавляли троекратно непосредственно в одну и ту же клеточную суспензию по мере достижения 2% остаточной концентрации ДАК. В отдельных опытах суспензию повторно использовали после 3, 7, 14, 28, 56 или 84 сут хранения. Процесс биодеструкции контролировали путем отбора проб с 12‑часовыми интервалами.
Минимальная подавляющая концентрация (МПК) и концентрация полумаксимального ингибирования (IC50) ДАК. МПК ДАК определяли микрометодом серийных двукратных разведений с использованием 96-луночных круглодонных полистироловых планшетов. Для этого 100 мкл стерильной среды LB вносили в лунки микропланшета. В первую лунку каждого ряда добавляли 100 мкл растворенной в этаноле ДАК (исходный раствор с концентрацией 100 мг/мл) и тщательно перемешивали. Из полученной смеси отбирали 100 мкл и переносили в следующую лунку. Процедуру повторяли до образования ряда двукратных разведений. Диапазон концентрации ДАК в одном ряду составлял от 50.0 до 0.7 мг/л. В каждую лунку инокулировали 10 мкл бактериальных клеток (5 × 105 кл./мл), предварительно выращенных в LB. Планшеты инкубировали при температуре 28°С в течение 48 ч. Концентрацию полумаксимального ингибирования (IC50) определяли также микрометодом серийных двукратных разведений с аналогичным титрованием ДАК, однако вместо LB в данном случае в лунки микропланшета вносили 100 мкл суспензии нерастущих клеток (ОП600 2.5) в буфере (pH 6.0, 7.0, 8.0 или 9.0). Планшеты инкубировали при температуре 28°С в течение 48 ч. За значение IC50 принимали концентрацию, при которой оставалось 50% живых бактериальных клеток.
Оценка жизнеспособности. Для определения жизнеспособности бактериальных клеток применяли метод окрашивания йодонитротетразолиевым фиолетовым (INT). Для этого 100 мкл опытного образца и 50 мкл 0.2%-ного водного раствора INT вносили в 96-луночные круглодонные полистироловые микропланшеты (“Медполимер”, Россия). Для разрушения агрегатов смесь клеток с INT многократно пипетировали. Образцы инкубировали при температуре 28°С в течение 24 ч. Оптическую плотность окрашенной суспензии измеряли с помощью микропланшетного ридера Multiscan Ascent (“Thermo Electron Corporation”, Финляндия) при длине волны 630 нм.
Респираторная активность. Дыхательную активность бактериальных клеток измеряли с помощью 10-канального респирометра непрямого замкнутого цикла MicroOxymaxR (“Columbus Instruments”, США), подключенного к персональному компьютеру. Эксперименты проводили в стеклянных флаконах Micro-Oxymax вместимостью 300 мл при постоянном перемешивании (300 об./мин, 28 ± 2°С) на многоместной магнитной мешалке RT 10 (“Power IKAMAG”, Германия). Количество (мкл) и скорость (мкл/мин) потребляемого О2 и выделяемого СО2 регистрировали автоматически с 30-минутными интервалами в течение 7 сут.
Микроскопия. Изображения бактериальных клеток, полученные с помощью микроскопа Ax-iostar plus (“Carl Zeiss”, Германия) в фазово-контрастном режиме, визуализировали с использованием камеры PRO-150ES (“Pixera”, США). Размеры клеток и клеточных агрегатов определяли с помощью компьютерной программы Video TesT-Size 5.0 (Санкт-Петербург, Россия). Среднеквадратичную шероховатость поверхности живых клеток и силу адгезии измеряли с помощью комбинированной микроскопической системы, состоящей из атомно-силового микроскопа (АСМ) Asylum MFP-3D-BIO (“Asylum Research”, США) и конфокального лазерного сканирующего микроскопа (КЛСМ) Olympus FV1000 (“Olympus Corporation”, Япония). Внутриклеточные липидные включения анализировали с помощью микроскопа Axio Imager M2 (“Zeiss”, Германия), оснащенного флуоресцентным источником света HXP 120 В и камерой Axiocam 506 Color (“Zeiss”, Германия).
Окрашивание бактериальных клеток нильским красным. Для выявления внутриклеточных липидных включений родококки окрашивали 0.08% раствором нильского красного в диметилсульфоксиде (“Nanjing Dulai Biotechnology Co.”, Китай), как описано в работе (Mrunalini, Girisha, 2017). Суспензию клеток (1 мл) центрифугировали при 12 000 об./мин в течение 5 мин. Осажденные клетки ресуспендировали в 1 мл дистиллированной воды и добавляли 40 мкл рабочего раствора нильского красного (конечная концентрация 0.3 мкг/мл). Полученную суспензию инкубировали при температуре 28°С в течение 40 мин при постоянном перемешивании (160 об./мин). От реакционной среды клетки отделяли центрифугированием и ресуспендировали в 1 мл дистиллированной воды. Суспензию клеток (0.02 мл) наносили на чистое предметное стекло и регистрировали флуоресценцию при двух спектральных установках на микроскопе Axio Imager M2 (“Zeiss”, Германия): желто-золотистая флуоресценция с использованием узкополосного светофильтра 450–500 нм и красная флуоресценция с использованием узкополосного светофильтра 515–560 нм.
Выделение общих клеточных липидов и миколовых кислот. Для получения общих клеточных липидов сухую биомассу (0.05 г) суспендировали в 3.75 мл смеси хлороформ–метанол (2 : 1) (Hawthorne, 1988). Полученную клеточную суспензию интенсивно встряхивали и инкубировали при температуре 28°С в течение 2 ч. После центрифугирования при 3000 об./мин в течение 15 мин супернатант собирали в центрифужную пробирку, к осадку добавляли 5 мл смеси хлороформ–метанол–вода (2 : 1 : 0.8), встряхивали, центрифугировали и снова собирали супернатант. К объединенным супернатантам добавляли 2.5 мл хлороформа и 2.5 мл воды, перемешивали и центрифугировали. Слой хлороформа переносили в предварительно взвешенную круглодонную колбу, разбавляли равным объемом бензола и упаривали при температуре 60°С на роторном испарителе (“Heidolph”, Германия). Затем колбу взвешивали до постоянного веса на высокоточных аналитических весах AUW 120D (“Shimadzu”, Япония). Количество общих клеточных липидов выражали в мг/г абсолютно сухого веса (АСВ).
Миколовые кислоты анализировали методом тонкослойной хроматографии (ТСХ) их метиловых эфиров (Minnikin et al., 1975). Для этого готовили метанолизаты бактериальных клеток. Сухую биомассу (0.2 г) суспендировали в 10 мл смеси метанола и толуола (1 : 1), добавляли 0.2 мл H2SO4 и инкубировали при температуре 50°С не менее 12 ч. Затем метиловые эфиры миколовых кислот экстрагировали н-гексаном (2 мл). ТСХ проводили троекратно на пластинах с силикагелем (20 × 20 см, “Merck”) в системе растворителей петролейный эфир‒диэтиловый эфир (85 : 25). Метанолизаты цельных клеток R. ruber ИЭГМ 70T использовали в качестве контроля для определения метиловых эфиров миколовых кислот типа “ruber/rhodochrous”.
Выделение биосурфактантов. Клеточные суспензии, полученные после 72-часовой ферментации с 500, 750 или 1000 мг/л ДАК, обрабатывали с помощью ультразвукового дезинтегратора Soniprep 150 (“Sanyo”, Великобритания) в течение 30 минут при амплитуде 10 мкм и обязательном охлаждении. Биосурфактанты экстрагировали с использованием метил-трет-бутилового эфира, который добавляли к клеточному гомогенату в соотношении 2 : 1 (Kuyukina et al., 2001). Экстрагирование проводили на орбитальном шейкере (160 об./мин) при температуре 28°С в течение 3 ч. Растворитель удаляли с помощью роторного испарителя (“Heidolph”, Германия).
Степень гидрофобности клеточной поверхности измеряли методом Salt Aggregation Test (SAT) (Lindahl et al., 1981). Родококки суспендировали в фосфатном буфере (pH 6.0, 7.0, 8.0 и 9.0) с добавлением (NH4)2SO4. За условную величину гидрофобности клеточной поверхности принимали минимальную концентрацию раствора (NH4)2SO4, при которой наблюдалось формирование клеточных агрегатов. Оценку степени гидрофобности проводили по шкале: высокая гидрофобность – показатель солености раствора сульфата аммония от 0 до 0.8 М; умеренная – от 1.0 до 2.0 М; слабая – от 2.2 до 3.8 М.
Растворимость ДАК определяли микрометодом серийных двукратных разведений с использованием 96-луночных круглодонных полистироловых планшетов. В лунки микропланшета вносили 100 мкл буфера (pH 6.0, 7.0, 8.0 или 9.0). Растворимость определяли как концентрацию, при которой ОП630 экспериментального раствора ДАК и ОП630 контрольного буфера были сопоставимы (микропланшетный ридер Multiscan Ascent, “Thermo Electron Corporation”, Финляндия) (Singh et al., 2017).
Получение клеточных фракций. Родококки, предварительно выращенные в среде LB течение 48 ч, трижды отмывали и ресуспендировали в 100 мл фосфатно-щелочного буфера (pH 8.0). Суспензию клеток гомогенизировали с помощью ультразвукового дезинтегратора Soniprep 150 (“Sanyo”, Великобритания, амплитуда 10 мкм, 45 мин, обязательное охлаждение). В результате обработки ультразвуком менее 0.1% клеток оставалось интактными, что подтверждалось микроскопическими исследованиями и микрометодом точечных высевов (КОЕ/мл). Клеточный гомогенат центрифугировали (6000 об./мин, 4°С, 15 мин) для получения цитоплазматических ферментов (супернатант) (I) на центрифуге Mikro 22R (“Hettich Zentrifugen”, Германия). Солюбилизацию мембраносвязанных ферментов проводили путем ресуспендирования осадка в 100 мл 1% раствора Triton X-100 (“Sigma-Aldrich”) в фосфатно-щелочном буфере (pH 8.0) и перемешивания на орбитальном шейкере в течение 30 мин. С помощью центрифугирования (6000 об./мин, 4°С, 15 мин) получали супернатант с экстрагированными мембраносвязанными ферментами (II). Осадок клеточных соникатов с ферментами, прочно связанными с мембраной и неэкстрагируемыми детергентом (III), ресуспендировали в 100 мл фосфатно-щелочного буфера (рН 8.0). Подготовленные клеточные фракции включали (I) супернатант с цитоплазматическими ферментами; (II) супернатант с экстрагированными мембраносвязанными ферментами; (III) ресуспендированный клеточный соникат с неэкстрагируемыми ферментами. В качестве контроля использовали нерастущие клетки (ОП600 2.5) в фосфатно-щелочном буфере (рН 8.0).
Экстракция и идентификация остаточной ДАК и ее метаболитов. Для выделения остаточной ДАК и ее возможных метаболитов ферментационную среду подкисляли 10%-ным раствором HCl и трижды экстрагировали эквивалентным объемом этилацетата. Объединенные экстракты последовательно промывали 1%-ным водным раствором NaHCO3 и дистиллированной водой (до pH 7.0). Этилацетатный экстракт обезвоживали над безводным Na2SO4. Растворитель удаляли с помощью роторного испарителя (“Heidolph”, Германия). Качественный контроль проводили методом ТСХ в системе этилацетат‒н-гексан (3 : 7). Остаточную ДАК и продукты ее биотрансформации предварительно метилировали (триметилсилил)диазометаном и анализировали методом газовой хромато-масс-спектрометрии (ГХ-МС) на хроматографе Agilent 6890N/5975B (“Agilent Technologies”, США), оборудованном капиллярной колонкой HP-5ms (30 м × 0.25 мм, 0.25 мкм) и работающем в режиме ионизации электронным ударом (70 эВ). В качестве газа-носителя использовали гелий (1 мл/мин). Температуру колонки программировали от 120 до 320°С. Масс-спектры записывали в диапазоне m/z от 40 до 460 а.е.м. и подтверждали с использованием библиотеки NIST08. Количественный анализ убыли ДАК проводили методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на хроматографе LC Prominence 20AD (“Shimadzu”, Япония) с обращенно-фазовой колонкой SupelCosilTM LC-18 (150 × 4.5 мм, 5 мкм) и диоидно-матричным детектором (SPD-M20A). Подвижная фаза содержала 70%-ный раствор ацетонитрила; скорость потока подвижной фазы 1 мл/мин; температура колонки 40°С; длина волны детектирования ДАК составляла 190 нм. В описанных условиях время удерживания метилового эфира ДАК составляло 14.99 ± 0.02 мин. Данные регистрировали и обрабатывали с помощью программы LCSolution (v. 1.25).
Анализ экотоксичности и растворимости ДАК и ее метаболитов in silico. Экотоксичность, log Kow и растворимость в воде ДАК оценивали с помощью компьютеризированных систем ECOSAR (Ecological Structure Activity Relationship, v. 1.11), KOW-WIN (программа коэффициента распределения Log Octanol-Water, v. 1.68) и WSKOWWIN (v. 1.41), доступных в программном пакете EPI SuiteTM (The Estimation Programs Interface, EPA, США) соответственно. Программа ECOSAR позволяет проводить оценку потенциальной острой и хронической токсичности химических веществ для водных организмов с помощью компьютеризированных взаимосвязей между структурой и активностью (SAR). Экотоксичность соединений прогнозировали на основании имеющихся данных о токсическом действии органических соединений различных химических классов. С помощью программы KOWWIN оценивали логарифмические коэффициенты распределения октанол‒вода (log Kow) органических соединений на основе химической структуры с использованием методологии, описанной в (Meylan, Howard, 1995). Программное обеспечение WSKOWWIN использовали для оценки растворимости органического соединения в воде с использованием коэффициента log Kow соединения в соответствии с методологией (Meylan et al., 1996).
Эксперименты проводили в трехкратной повторности. Для статистического анализа данных использовали программу STATISTICA (StatSoft Россия, 2015).
РЕЗУЛЬТАТЫ
Биодеструкция ДАК клетками R. rhodochrous ИЭГМ 107. В работе использовали различные условия предварительного выращивания для получения каталитически активной биомассы клеток R. rhodochrous ИЭГМ 107. Ранее (Cheremnykh et al., 2018) была показана возможность эффективной биодеструкции ДАК в условиях роста в минеральной среде с н-гексадеканом. Однако использование гексадекансодержащей среды для приготовления суспензий нерастущих клеток малоэффективно: бактериальные клетки в присутствии н-гексадекана образуют агрегаты, которые трудно отделить от инкубационной среды и остаточного н-алкана. Использование глюкозы как альтернативного источника углерода не позволило получить клеточную биомассу в достаточном количестве (ОП600 < 1.0). Применение богатой питательной среды (LB) для предварительного выращивания R. rhodochrous ИЭГМ 107 позволило получить клеточную суспензию с высокой плотностью (ОП600 до 3.0). Для полного (более 99%) разложения 500 мг/л ДАК в течение 5 сут наиболее эффективным оказалось использование бактериальной суспензии с ОП600 2.5. Дальнейшее увеличение концентрации используемой биомассы до ОП600 3.0 (16 г/л сухой биомассы) сопровождалось снижением уровня биодеструкции ДАК (рис. 1а).
Рис. 1.
(а) ‒ Влияние ОП600 1.5 (1), 2.0 (2), 2.5 (3) или 3.0 (4) клеточной суспензии R. rhodochrous ИЭГМ 107 на биодеструкцию ДАК (500 мг/л): использовали фосфатно-щелочной буфер с рН 7.0. (б) ‒ Влияние значений рН 6.0 (1), 7.0 (2), 8.0 (3) и 9.0 (4) фосфатно-щелочного буфера на биодеструкцию ДАК (500 мг/л): использована суспензия нерастущих клеток (ОП600 2.5).

Согласно полученным данным, изменение рН от 6.0 до 9.0 не влияло на выживаемость родококков (ОП600 2.5, без ДАК). Тем не менее, показатели рН буфера влияли на устойчивость бактериальных клеток к токсическому действию поллютанта. Установлено, что значения IC50 ДАК для родококков в слабокислых (pH 6.0) и щелочных (pH 9.0) условиях среды составляли 3.0 и 1.0 г/л соответственно. В то время как в буферном растворе с нейтральным (рН 7.0) и слабощелочным (pH 7.0, 8.0) значением pH IC50 регистрировали на уровне 8 г/л. Кроме того, при изменении рН буфера с 6.0 до 9.0 было зафиксировано увеличение растворимости ДАК с 31 до 250 мг/л. Как показано на рис. 1б, из всех испытанных буферных растворов (рН 6.0, 7.0, 8.0 или 9.0) буфер с рН 8.0 оказался наиболее эффективным для сокращения продолжительности процесса биодеструкции ДАК до 3 сут. При этом остаточная концентрация ДАК составляла менее 1% (5 мг/л).
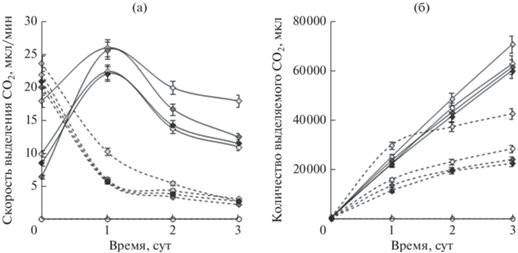
По результатам проведенных исследований респираторной активности бактериальных клеток, скорость потребления О2 (дополнительные материалы, рис. S2 ) и выделения СО2 также зависели от значений рН буферного раствора (рис. 2а, 2б). Максимальная скорость выделения СО2 нерастущими клетками до добавления ДАК выявлялась при рН 7.0, тогда как дыхательная активность клеток в буферах с рН 6.0, 8.0 и 9.0 была несколько ниже. Внесение ДАК в реакционную среду приводило к значительному увеличению скорости дыхания родококков. Наиболее выраженное изменение (от 6.46 до 25.60 мкл/мин) скорости выделения СО2 регистрировали через сутки после добавления ДАК в бактериальную суспензию в буфере c рН 8.0 (рис. 2а). В этих условиях достигался максимальный уровень биодеструкции ДАК – от 500 до 280 мг/л (см. рис. 1б). В целом, дыхательная активность клеток в присутствии ДАК была значительно выше, чем в биотическом контроле. В абиотическом контроле показатели дыхательной активности клеток и биодеструкции ДАК были нулевыми.
Рис. 2.
Влияние значений рН 6.0 ( ), 7.0 (
), 7.0 ( ), 8.0 (
), 8.0 ( ) и 9.0 (
) и 9.0 ( ) фосфатно-щелочного буфера на скорость (а) и количество (б) выделяемого СО2 в процессе биодеструкции ДАК (500 мг/л) клетками R. rhodochrous ИЭГМ 107 (―), биотический контроль (- - -), абиотический контроль (⚪).
) фосфатно-щелочного буфера на скорость (а) и количество (б) выделяемого СО2 в процессе биодеструкции ДАК (500 мг/л) клетками R. rhodochrous ИЭГМ 107 (―), биотический контроль (- - -), абиотический контроль (⚪).
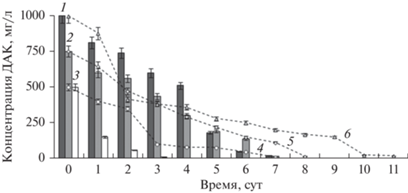
Биодеструкция ДАК в высоких концентрациях нерастущими клетками при их многократном использовании. Нерастущие клетки сохраняли каталитическую активность в слабощелочной среде при концентрации ДАК более 500 мг/л и практически полностью (98%) разлагали ДАК (до 1000 мг/л) в течение 7 сут. В сравнительных экспериментах с растущими клетками биодеструкция 750 и 1000 мг/л ДАК протекала в течение 8 и 11 сут соответственно (рис. 3).
Рис. 3.
Динамика биодеструкции ДАК нерастущими (столбцы; 500 (1), 750 (2) и 1000 (3) мг/л) и активно растущими клетками R. rhodochrous ИЭГМ 107 (пунктирные линии; 500 (4), 750 (5) и 1000 (6) мг/л ДАК).
Как видно из рис. 4, клетки R. rhodochrous ИЭГМ 107 сохраняли жизнеспособность и проявляли деструктирующую активность по отношению к ДАК даже после длительного хранения в течение 84 сут при температуре 4°C. Стабильность биодеструктора также подтверждалась возможностью многократного использования бактериальной суспензии. Как представлено на рис. 5, использование свежеприготовленной клеточной суспензии позволяло утилизировать три порции токсиканта подряд во всем диапазоне концентраций. Средняя продолжительность деструкции одной порции 500, 750 и 1000 мг/л ДАК составляла 3, 7 и 8 сут соответственно. Кроме того, такое многократное использование возможно и после длительного хранения бактериальных клеток при температуре 4°C.
Рис. 4.
Продолжительность процесса биодеструкции ДАК (500 (1), 750 (2) и 1000 (3) мг/л) с использованием свежеприготовленной суспензии (0 сут) и клеточными суспензиями R. rhodochrous ИЭГМ 107 после длительного хранения (3, 7, 14, 28, 56 и 84 сут). Представлены данные, полученные по мере достижения 2% остаточной концентрации ДАК.

Рис. 5.
Многократное использование свежеприготовленных суспензий нерастущих клеток R. rhodochrous ИЭГМ 107 для биодеструкции 500 (1), 750 (2) и 1000 (3) мг/л ДАК. Стрелками указано время внесения ДАК.

Биодеструкция ДАК с использованием клеточных фракций. Как видно из табл. 1, максимальную деградирующую активность по отношению к ДАК регистрировали у супернатантов, содержащих цитоплазматические ферменты. Важно отметить, что именно в этой фракции после метилирования обнаружены интермедиаты с m/z 328.1 и 362.2, масс-спектры которых соответствовали масс-спектрам метиловых эфиров 7-оксо-ДАК (соединение 2) и 11,12-дигидрокси-7-оксо-абиета-8,13-диен-18-овой кислоты (соединение 3).
Таблица 1.
Биодеструкция ДАК с использованием клеточных фракций
| Клеточная фракция | Продукты биодеструкции*, % | ||
|---|---|---|---|
| ДАК | Метаболит m/z 328.1 | Метаболит m/z 362.2 | |
| Целые клетки | 30.6 ± 0.5 | – | – |
| Супернатант с цитоплазматическими ферментами (I) | 33.5 ± 3.6 | 17.3 ± 3.7 | 13.5 ± 2.3 |
| Супернатант с тритон-экстрагированными мембранносвязанными ферментами (II) | 100.0 | – | – |
| Ресуспендированный клеточный соникат с неэкстрагированными ферментами (III) |
84.7 ± 3.4 | – | – |
В табл. 2 приведены результаты оценки растворимости и экотоксичности ДАК и ее метаболитов с помощью пакета программного обеспечения EPI SuiteTM. Значение log Kow использовали для оценки способности химических веществ накапливаться в жировых тканях организмов (биоаккумуляция). В соответствии со Стокгольмской конвенцией о стойких органических загрязнителях (СОЗ), соединения с log Kow более 5 считаются способными к биоаккумуляции (The United Nations Environment Programme, 2019). На основании расчетных данных, соединение 3 имеет значение log Kow 3.9, что в 1.2 и 1.4 раз меньше аналогичных значений ДАК и соединения 2, и, соответственно, обладает меньшей способностью к биоаккумуляции в тканях водных организмов. Соединение 3 характеризуется большей (7.5 мг/л) растворимостью в воде, чем исходная ДАК (6.6 мг/л) и соединение 2 (0.5 мг/л). Ранее нами было показано, что значение МПК смеси остаточной ДАК и ее метаболитов в отношении R. rhodochrous ИЭГМ 107 составляло 1500 мг/л по сравнению с таковым исходной ДАК (750 мг/л) (Cheremnykh et al., 2018).
Таблица 2.
Оценка растворимости и экотоксичности ДАК и ее метаболитов с использованием программного пакета EPI SuiteTM
| ДАК | Соединение 2 | Соединение 3 | |
|---|---|---|---|
| ECOSAR класс | Смолы – кислоты | Нейтральная органика – кислоты | Винил/аллилкетоны – кислоты |
| Log Kow | 4.8 | 5.5 | 3.9 |
| Растворимость в воде, мг/л | 6.6 | 0.5 | 7.5 |
| Острая токсичность, мг/л | |||
| Рыба LD50 (96 ч) | 1.152 | 1.833 | 128.231 |
| Дафния LD50 (48 ч) | 1.971 | 1.439 | 47.358 |
| Зеленые водоросли ED50 (96 ч) | 5.159 | 4.087 | 40.679 |
| Хроническая токсичность, мг/л | |||
| Рыба ED50 (30 сут) | 0.177 | 0.262 | 17.192 |
| Дафния ED50 (21 сут) | 0.303 | 0.345 | 10.815 |
| Зеленые водоросли ED50 (16 сут) | 1.753 | 2.201 | 29.098 |
| Категория экотоксичности* | II | II | III |
Реакция нерастущих клеток на токсическое действие ДАК. Нерастущие клетки в присутствии ДАК в концентрации 500 мг/л образовывали обособленные микроагрегаты (50–300 мкм) с гетерогенной структурой, представляющиe собой клетки, прикрепленные к поверхности мелких частиц ДАК (рис. 6). При этом адгезия бактерий имела неспецифический характер, поскольку инактивированные автоклавированием клетки образовывали аналогичные агрегаты (50–250 мкм) в присутствии 500 мг/л ДАК (данные не представлены). Внесение ДАК в концентрации 750 и 1000 мг/л приводило к достоверному увеличению размеров клеточных агрегатов (≤350 мкм). Поверхность крупных (200–350 мкм) агрегатов покрывали в основном мертвые клетки (дополнительные материалы, рис. S3 ). По результатам INT-окрашивания, а также подсчета КОЕ, количество (менее 10%) живых клеток существенно не менялось в процессе биодеструкции ДАК независимо от исходной концентрации токсиканта. На АСМ- и АСМ-КЛСМ-изображениях нерастущих клеток R. rhodochrous ИЭГМ 107 в присутствии ДАК отмечали образование внеклеточной жидкости (рис. 7). Окрашивание нильским красным клеток выявляло наличие множества мелких дискретных образований, распределенных по всей цитоплазме (рис. 8). В контрольных вариантах опытов таких включений не обнаруживалось. По мере повышения концентрации ДАК отмечали постепенное увеличение морфометрических показателей клеток и среднеквадратичной шероховатости клеточной поверхности (табл. 3). В целом, действие ДАК на родококки проявлялось в уменьшении (от 3.7 до 9.2%) относительной площади поверхности (S/V) бактериальных клеток в зависимости от концентрации ДАК.
Рис. 6.
Фазово-контрастная микроскопия ДАК (а), биотического контроля (б) и агрегации клеток R. rhodochrous ИЭГМ 107 в присутствии 500 мг/л ДАК (в) (×1000).

Рис. 7.
АСМ (а) и комбинированные АСМ-КЛСМ (б) изображения клеток R. rhodochrous ИЭГМ 107 в присутствии ДАК. Данные представлены через 3 сут инкубации родококков. Стрелками указана внеклеточная жидкость.

Рис. 8.
Образование внутриклеточных липидных включений родококками ((а) ‒ биотический контроль) в присутствии 500 (б), 750 (в) и 1000 (г) мг/л ДАК (×1000).

Таблица 3.
Влияние ДАК на морфометрические параметры и изменения клеточной поверхности
| Условия | Морфометрические параметры | Относительная площадь (S/V), мкм–1 | Шероховатость, нм | |||
|---|---|---|---|---|---|---|
| Длина, мкм | Ширина, мкм | Объем (V), мкм3 | Площадь (S), мкм2 | |||
| Клетки без ДАК (Контроль) | 1.2 ± 0.1 | 1.1 ± 0.2 | 1.14 ± 0.3 | 6.04 ± 0.2 | 5.38 ± 0.1 | 229.6 ± 14.1 |
| Клетки с ДАК 500 мг/л* | 1.3 ± 0.3 | 1.1 ± 0.3 | 1.23 ± 0.2 | 6.38 ± 0.3 | 5.18 ± 0.1 | 231.2 ± 11.3 |
| Клетки с ДАК 750 мг/л* | 1.4 ± 0.2 | 1.1 ± 0.3 | 1.33 ± 0.3 | 6.73 ± 0.4 | 5.06 ± 0.1 | 237.1 ± 15.3 |
| Клетки с ДАК 1000 мг/л* | 1.6 ± 0.2 | 1.1 ± 0.3 | 1.52 ± 0.4 | 7.42 ± 0.5 | 4.88 ± 0.1 | 249.6 ± 19.3 |
В присутствии 500, 750 и 1000 мг/л ДАК регистрировали значительное увеличение продукции биосурфактантов (6.9 ± 2.1, 27.3 ± 1.7 и 39.8 ± ± 4.3 мг/г соответственно) по сравнению с контрольными вариантами опыта (0.1 ± 0.02 мг/г). Помимо биосурфактантов клетки R. rhodochrous синтезировали и другие липидные вещества, что приводило к увеличению общих клеточных липидов с 48.6 ± 3.5 мг/г (контроль) до 64.0 ± 4.4, 64.2 ± 0.4 и 111.1 ± 5.6 мг/г (500, 750 и 1000 мг/л ДАК соответственно). ТСХ-анализ метанолизатов клеток выявлял также увеличение количества метиловых эфиров миколовых кислот (дополнительные материалы, рис. S4 ).
Повышение биосинтеза липофильных соединений в присутствии ДАК сопровождалось значительным увеличением степени гидрофобности родококков. По данным SAT, клетки после биодеструкции ДАК (500, 750 или 1000 мг/л) образовывали устойчивые микроагрегаты под действием относительно низких концентраций раствора (NH4)2SO4 (1.2, 0.8 и 0.6 М соответственно) за счет усиления гидрофобного межклеточного взаимодействия. В контроле (без ДАК) степень гидрофобности оценивалась как умеренная, поскольку устойчивые микроагрегаты образовывались в присутствии 1.6 М раствора (NH4)2SO4. Проведенное АСМ-сканирование и анализ карт адгезии зонда кантилевера к поверхности клеток выявили перераспределение адгезивных участков клеточной поверхности и появление высокоадгезивных (светлых) участков (дополнительные материалы, рис. S5 ). В целом, средние значения сил адгезии (30.82 ± 3.59, 34.83 ± ± 4.08, 37.56 ± 2.60 нН) в присутствии 500, 750 или 1000 мг/л ДАК по сравнению с контролем (15.63 ± ± 2.23 нН) увеличивались в 1.9, 2.0, 2.2 и 2.4 раза соответственно.
ОБСУЖДЕНИЕ
В ранних исследованиях по биоконверсии различных органических соединений с использованием нерастущих клеток Rhodococcus была уже показана взаимосвязь между каталитической активностью и высокой плотностью биомассы (Grishko et al., 2013; Nawawi et al., 2016; Mutafova et al., 2016). В настоящем исследовании обнаружена аналогичная зависимость при разложении ДАК (500 мг/л) клетками R. rhodochrous ИЭГМ 107. Однако, по нашим данным, увеличение количества биомассы ОП600 выше 2.5 (13 г/л сухой биомассы) приводило к снижению уровня биоконверсии ДАК. Наблюдаемый эффект, по-видимому, обусловлен снижением массопереноса при увеличении плотности биомассы клеток и перераспределении субстрата в буферной системе.
Известно, что родококки способны выживать при экстремальных значениях рН от 1.0 до 11.0, однако оптимальными для них являются нейтральные значения рН (Pátek et al., 2021). Согласно нашим результатам, величина рН оказывала существенное влияние на продолжительность процесса биодеструкции, устойчивость родококков к токсическому действию ДАК и их дыхательную активность.
Повышение скорости биодеструкции ДАК в слабощелочных условиях может быть связано с увеличением биодоступности (растворимостью) и снижением токсичности ДАК по отношению к бактериальным клеткам. Peng и Robert (2000) указывали на тенденцию к снижению токсичности при увеличении растворимости смоляных кислот. Кроме того, на примере дафний и рыб показано, что при увеличении величины рН с 6.5 до 10.0 токсичность ДАК снижалась, так как показатель ЛД50 смещался с 1–2 до 45–70 мг/л (Zanella, 1983). Поскольку биологическая очистка сточных вод целлюлозно-бумажной промышленности проводится при рН 7.8 (Kang et al., 2009), полученные нами данные свидетельствует о целесообразности использования нерастущих клеток R. rhodochrous ИЭГМ 107 в промышленных условиях.
В сточных водах целлюлозно-бумажной промышленности ДАК может присутствовать в концентрации до 1000 мг/л. Поэтому для оценки возможного использования родококков в качестве эффективных биокатализаторов были проведены исследования по биодеструкции ДАК в аналогичной концентрации. Более того, за счет повторного использования общая нагрузка ДАК на одну порцию суспензии нерастущих клеток была увеличена до 3000 мг/л. Такой подход является достаточно распространенным методом повышения эффективности биоконверсии трудноразлагаемых соединений (Pan et al., 2019). Важно отметить, что большинство известных бактериальных деструкторов ДАК способны утилизировать только до 300 мг/л токсиканта. Грибные культуры способны к неполной деструкции ДАК в более высоких концентрациях с образованием гидроксипроизводных (Luchnikova et al., 2019).
Известно, что ферменты, участвующие в биоокислении ксенобиотиков, как правило, локализованы в цитоплазме или связаны с клеточной мембраной (Janocha et al., 2013). По нашим данным, в процессе биодеструкции ДАК в основном принимали участие цитоплазматические ферменты клеток R. rhodochrous ИЭГМ 107, что косвенно свидетельствовало о наличии транспортной системы, обеспечивающей перенос ДАК через мембрану внутрь клетки. Биодеструкция ДАК клетками R. rhodochrous ИЭГМ 107, по-видимому, происходила аналогично, как в случае использования клеток P. abietaniphila BKME-9, путем окисления атома C-7 с последующим дигидроксилированием ароматического кольца и его мета-расщеплением (рис. 9), что коррелирует с предложенным ранее (Martin et al., 1999) “классическим” путем бактериальной деструкции смоляных кислот абиетанового типа.
Результаты моделирования и оценки растворимости и экотоксичности выявленных соединений с использованием пакета программ EPI SuiteTM показали, что соединение 3 является значительно менее гидрофобным (7.5 мг/л) по сравнению с ДАК (6.6 мг/л) и другим ее производным (соединение 2, 0.5 мг/л). Сравнительно низкая биоаккумуляция и высокая растворимость в воде соединения 3 свидетельствуют о его большей биодоступности. Кроме того, в отношении соединения 3 обнаружена значительно меньшая степень экотоксичности по отношению к водным организмам. В соответствии с принятой “Согласованной на глобальном уровне системой классификации и маркировки химических веществ, СГС”, соединение 3 относится к категории III, а ДАК и соединение 2 – II категории экотоксичности веществ, опасных для водной среды и представляющих наибольший экологический риск (The United Nations, 2011). Таким образом, на основании компьютерного анализа и результатов определения ингибирующей активности (данные МПК) можно предположить, что процесс биодеструкции ДАК с использованием нерастущих клеток R. rhodochrous ИЭГМ 107 протекает через менее токсичный интермедиат 3.
При изучении особенностей взаимодействия бактериальных клеток с ДАК установлено, что наиболее типичной адаптивной реакцией нерастущих клеток явилось формирование обособленных многоклеточных агрегатов. Биологический смысл агрегации состоит прежде всего в защите бактериальных клеток от токсического воздействия химических соединений. По нашим данным, агрегация усиливается по мере увеличения концентрации ДАК. Поверхность клеточных агрегатов в основном покрыта мертвыми клетками. Мертвые клетки в составе многоклеточных агрегатов, по-видимому, играют защитную роль от стресс-факторов внешней среды, снабжают живые клетки источниками питания, способствуют экономии энергии и тем самым обеспечивают реализацию адаптационных стратегий кон-сорциума для успешной биодеструкции токсического субстрата (Allocati et al., 2015). Аналогичные реакции адаптации описаны у биопленок Klebsiella pneumoniae к антибиотикам (Desai et al., 2019), представителей Rhodococcus spp. к фармполлютантам (Ivshina et al., 2019) и органическим растворителям (Коршунова и соавт., 2016).
Другой адаптивной реакцией на токсическое действие ДАК явилось изменение морфометрических параметров клеток. По мере увеличения концентрации ДАК действие токсиканта на родококки проявлялось в уменьшении соотношения площади и объема бактериальной клетки на 3.7–9.3%. Это защитная реакция, обеспечивающая постепенное поступление молекул токсиканта внутрь клеток. Полученные данные согласуются с ранними наблюдениями за реакциями родококков на присутствие таких токсичных веществ, как тиоанизол и диклофенак (Kylosova et al., 2016; Ivshina et al., 2019).
При АСМ- и АСМ-КЛСМ-сканировании не- растущих клеток R. rhodochrous ИЭГМ 107 в присутствии высоких концентраций ДАК зарегистрировано образование внеклеточной жидкости. Такое наблюдение может быть объяснено возможным формированием биопленки: клетки прикрепляются к субстрату и начинают секретировать внеклеточные полимерные вещества (полисахариды, белки, нуклеиновые кислоты, липиды) или внеклеточный матрикс, цементирующий клеточный консорциум в биопленку (Flemming, 2016). Возможен и другой характер формирования обнаруживаемой внеклеточной жидкости. Родококки при взаимодействии с гидрофобными соединениями, как правило, продуцируют биосурфактанты гликолипидной природы с высокой поверхностной активностью, которые способствуют солюбилизации субстрата и обеспечивают увеличение площади контакта клеток с субстратом (Ivshina et al., 1998). Можно предположить, что функция биосурфактантов заключается в постепенном растворении гидрофобного субстрата и запуске механизма его транспорта в клетку (Tarasova et al., 2017). Наблюдаемые на рис. 7 внеклеточные структуры (мицеллы, везикулы и пузырьки) аналогичны обнаруженным ранее при сканировании актинобактериальных сурфактантов, абсорбированных на стекле (Kuyukina et al., 2016). Подтверждением вывода о липидной природе внеклеточной жидкости являются полученные нами результаты по увеличению общего количества биосурфактантов, экстрагируемых из клеточной суспензии после биодеструкции ДАК.
Под воздействием высоких концентраций ДАК у родококков выявлено усиление биосинтеза общих липидов и их накопление в виде внутриклеточных включений. Известно, что внутриклеточные включения часто образуются в условиях дисбаланса питательных веществ и представляют собой идеальные запасы углерода и энергии, они участвуют в биосинтезе миколовых кислот и тем самым способствуют регуляции текучести мембран (Thomson et al., 2010). Результаты предварительного ТСХ-анализа метанолизатов нерастущих клеток R. rhodochrous ИЭГМ 107 позволили нам предположить увеличение содержания миколовых кислот, находящихся как в свободном состоянии, так и в составе сложных липидов клеточной стенки и Rhodococcus-биосурфактантов. По-видимому, усиление биосинтеза липидных соединений, в том числе миколовых кислот, может способствоать повышению гидрофобности и последующему перераспределению адгезивных участков клеточной поверхности (дополнительные материалы, рис. S5 ).
Таким образом, в присутствии ДАК в высоких (500, 750 или 1000 мг/л) концентрациях выявлены следующие адаптивные реакции родококков: агрегация клеток (рис. 6), увеличение морфометрических показателей (табл. 3), образование внеклеточной жидкости (биосурфактантов или внеклеточного матрикса) (рис. 7), увеличение биосинтеза липидов (биосурфактантов, общих липидов, миколовых кислот, липидных включений) (рис. 8; дополнительные материалы, рис. S4 ), а также изменение свойств клеточной поверхности (степени среднеквадратичной шероховатости, гидрофобности, появление областей высокой адгезии) (дополнительные материалы, рис. S5 ).
Несмотря на то, что изменение значений рН от 6.0 до 9.0 не влияло на выживаемость родококков (ОП600 2.5, без ДАК), эффективность биодеструкции ДАК зависела от уровня величины рН буфера. Поэтому мы попытались проанализировать факторы, обеспечивающие высокий уровень каталитической активности R. rhodochrous ИЭГМ 107. Установлено, что степень биодоступности ДАК напрямую зависит от рН буферного раствора: повышение рН буфера с 6.0 до 9.0 приводило к значительному увеличению растворимости ДАК с 31 до 250 мг/л. В то же время наблюдалась тенденция к повышению гидрофобности клеточной поверхности родококков (контроль, без ДАК). Однако максимальную устойчивость бактериальных клеток к ДАК (IC50) регистрировали при рН 7.0 и 8.0. Выявленные закономерности согласуются с данными (Zanella, 1983) о том, что ДАК полностью диссоциирует и становится менее токсичной при повышении рН. По нашим данным, при рН 8.0 уровень сродства родококков к гидрофобному субстрату (растворимость ДАК, гидрофобность клеточной поверхности) наиболее оптимально гармонирует с высокой устойчивостью бактериальных клеток к ДАК, что, по-видимому, обеспечивает максимальный уровень биоконверсии токсиканта (рис. 10). Изучение таких параметров, как IC50, растворимость и гидрофобность клеточной поверхности, может быть полезным для выбора условий биодеструкции родококками других органических кислот.
Рис. 10.
Зависимость показателей IC50 ДАК (1), растворимости ДАК (2) и гидрофобности клеточной поверхности R. rhodochrous ИЭГМ 107 (3) от рН буферной системы. На графике приведены данные о биодеструкции ДАК (500 мг/л) через 24 ч в зависимости от уровня рН (4).

В настоящей работе впервые показана возможность биодеструкции ДАК в высоких концентрациях (500–1000 мг/л) с использованием отмытых от питательных веществ нерастущих клеток R. rhodochrous ИЭГМ 107. За счет повторного применения клеточных суспензий общая нагрузка на одну порцию биокатализатора может быть увеличена до 3000 мг/л. Экспериментально обосновано, что нерастущие клетки R. rhodochrous сохраняли каталитическую активность в широком диапазоне концентраций ДАК (от 500 до 1000 мг/л) при повторном использовании (до 3 циклов) после длительного хранения (84 сут, 4°C). Подобранные условия (рН, общая плотность бактериальных клеток) способствовали увеличению степени биодоступности ДАК и, как следствие, ее эффективного разложения и детоксикации.
Список литературы
Коршунова И.О., Писцова О.Н., Куюкина М.С., Ившина И.Б. Влияние органических растворителей на жизнеспособность и морфофункциональные свойства родококков // Прикл. биохимия и микробиология. 2016. Т. 52. С. 53–61. https://doi.org/10.7868/S0555109916010074
Korshunova I.O., Kuyukina M.S., Ivshina I.B., Pistsova O.N. The effect of organic solvents on the viability and morphofunctional properties of Rhodococcus // Appl. Biochem. Microbiol. 2016. V. 52. P. 43‒50.
Allocati N., Masulli M., Di Ilio C., De Laurenzi V. Die for the community: An overview of programmed cell death in bacteria // Cell Death Dis. 2015. V. 6. P. 4050–4053.
Carvalho F., Marques M.P.C., de Carvalho C.C.C.R., Cabral J.M.S., Fernandes P. Sitosterol bioconversion with resting cells in liquid polymer based systems // Bioresour. Technol. 2009. V. 100. P. 4050–4053. https://doi.org/10.1016/j.biortech.2009.03.044
Cheremnykh K.M., Luchnikova N.A., Grishko V.V., Ivshina I.B. Bioconversion of ecotoxic dehydroabietic acid using Rhodococcus actinobacteria // J. Hazard. Mater. 2018. V. 346. P. 103–112. https://doi.org/10.1016/j.jhazmat.2017.12.025
Dawson R., Elliott D., Elliott W., Jones K. Data for Biochemical Research (3rd edn), Oxford Sci. London, 1986.
Desai S., Sanghrajka K., Gajjar D. High adhesion and increased cell death contribute to strong biofilm formation in Klebsiella pneumoniae // Pathogens. 2019. V. 8. Art. 277. P. 1–16. https://doi.org/10.3390/pathogens8040277
Flemming H.-C. EPS – Then and Now // Microorganisms. 2016. V. 4. P. 41. https://doi.org/10.3390/microorganisms4040041
Gefen O., Fridman O., Ronin I., Balaban N.Q. Direct observation of single stationary-phase bacteria reveals a surprisingly long period of constant protein production activity // Proc. Natl. Acad. Sci. USA. 2014. V. 111. P. 556–561. https://doi.org/10.1073/pnas.1314114111
Grishko V.V., Tarasova E.V., Ivshina I.B. Biotransformation of betulin to betulone by growing and resting cells of the actinobacterium Rhodococcus rhodochrous IEGM 66 // Process. Biochem. 2013. V. 48. P. 1640–1644. https://doi.org/10.1016/j.procbio.2013.08.012
Hawthorne J.N. Techniques of lipidology: isolation, analysis and identification of lipids (2nd revised edition) // Biochem. Soc. Trans. 1988. V. 16. P. 906. https://doi.org/10.1042/bst0160906
Hernández V., Silva M., Gavilán J., Jiménez B., Barra R., Becerra J. Resin acids in bile samples from fish inhabiting marine waters affected by pulp mill effluents // J. Chil. Chem. Soc. 2008. V. 53. P. 1718–1721.
Ivshina I.B., Kuyukina M.S., Philp J.C., Christofi N. Oil desorption from mineral and organic materials using biosurfactant complexes produced by Rhodococcus species // World J. Microbiol. Biotechnol. 1998. V. 14. P. 711–717. https://doi.org/10.1023/A:1008885309221
Ivshina I.B., Tyumina E.A., Kuzmina M.V., Vikhareva E.V. Features of diclofenac biodegradation by Rhodococcus ruber IEGM 346 // Sci. Rep. 2019. V. 9. P. 1–13. https://doi.org/10.1038/s41598-019-45732-9
Janocha S., Zapp J., Hutter M., Kleser M., Bohlmann J., Bernhardt R. Resin acid conversion with CYP105A1: An enzyme with potential for the production of pharmaceutically relevant diterpenoids // ChemBioChem. 2013. V. 14. P. 467–473. https://doi.org/10.1002/cbic.201200729
Julsing M.K., Kuhn D., Schmid A., Bühler B. Resting cells of recombinant E. coli show high epoxidation yields on energy source and high sensitivity to product inhibition // Biotechnol. Bioeng. 2012. V. 109. V. 1109–1019. https://doi.org/10.1002/bit.24404
Kang J., Wang M., Xiao Z. Modeling and control of pH in pulp and paper wastewater treatment process // J. Water Resourse Prot. 2009. V. 1. P. 122–127. https://doi.org/10.4236/jwarp.2009.12016
Kuyukina M.S., Ivshina I.B., Korshunova I.O., Stukova G.I., Krivoruchko A.V. Diverse effects of a biosurfactant from Rhodococcus ruber IEGM 231 on the adhesion of resting and growing bacteria to polystyrene // AMB Express. 2016. V. 6. P. 14. https://doi.org/10.1186/s13568-016-0186-z
Kuyukina M.S., Ivshina I.B., Philp J.C., Christofi N., Dunbar S.A., Ritchkova M.I. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction // J. Microbiol. Methods. 2001. V. 46. P. 149–156.
Kylosova T.I., Elkin A.A., Grishko V.V., Ivshina I.B. Biotransformation of prochiral sulfides into (R)-sulfoxides using immobilized Gordonia terrae IEGM 136 cells // J. Mol. Catal. B Enzym. 2016. V. 123. P. 8–13. https://doi.org/10.1016/j.molcatb.2015.10.014
Lindahl M., Faris A., Wadström T., Hjertén S. A new test based on “salting out” to measure relative hydrophobicity of bacterial cells // BBA. 1981. V. 677. P. 471–476. https://doi.org/10.1016/0304-4165(81)90261-0
Luchnikova N.A., Ivanova K.M., Tarasova E.V., Grishko V.V., Ivshina I.B. Microbial conversion of toxic resin acids // Molecules. 2019. V. 24. P. 4121. https://doi.org/10.3390/molecules24224121
Martin V.J.J., Yu Z., Mohn W.W. Recent advances in understanding resin acid biodegradation: Microbial diversity and metabolism // Arch. Microbiol. 1999. V. 172. P. 131–138. https://doi.org/10.1007/s002030050752
Meylan W.M., Howard P.H. Atom/fragment contribution method for estimating octanol–water partition coefficients // J. Pharm. Sci. 1995. V. 84. P. 83–92.
Meylan W.M., Howard P.H., Boethling R.S. Improved method for estimating water solubility from octanol/water partition coefficient // Environ. Toxicol. Chem. 1996. V. 15. P. 100–106. https://doi.org/10.1897/1551-5028(1996)015
Minnikin D.E., Alshamaony L., Goodfellow M. Differentiation of Mycobacterium, Nocardia, and related taxa by thin-layer chromatographic analysis of whole-organism methanolysates // J. Gen. Microbiol. 1975. V. 88. P. 200–204.
Mrunalini B.R., Girisha S.T. Screening and characterization of lipid inclusions in bacteria by fluorescence microscopy and mass spectrometry as a source for biofuel production // Indian J. Sci. Technol. 2017. V. 10. P. 1–10.
Mutafova B., Fernandes P., Mutafov S., Berkov S., Pavlov A. Microbial transformations of plant secondary metabolites // Bioprocess Plant. Vitr. Syst. 2016. P. 1–41.
Nawawi N.M., Ahmad S.A., Maniyam M.N., Ibrahim A.L. Biotransformation of phenol by the resting cells of Rhodococcus sp. NAM 81 // Indian J. Fundam. Appl. Life Sci. 2016. V. 6. P. 101–107.
Pan T., Wang R., Xiao K., Ye W., Dong W., Xu M. Continuous degradation of phenanthrene in cloud point system by reuse of Sphingomonas polyaromaticivorans cells // AMB Express. 2019. V. 9. P. 1–8. https://doi.org/10.1186/S13568-019-0736-2
Pátek M., Grulich M., Nešvera J. Stress response in Rhodococcus strains // Biotechnol. Adv. 2021. Article 107698. https://doi.org/10.1016/j.niotechadv.2021.107698
Peng G., Roberts J.C. Solubility and toxicity of resin acids // Wat. Res. 2000. V. 34. P. 2779–2785. https://doi.org/10.1016/S0043-1354(99)00406-6
Pérez-de-Mora A., Madejón E., Cabrera F., Buegger F., Fuß R., Pritsch K., Schloter M. Long-term impact of acid resin waste deposits on soil quality of forest areas I. Contaminants and abiotic properties // Sci. Total. Environ. 2008. V. 406. P. 88–98.
Singh N., Soukup O., Fisar Z., Kuca K. Method optimization for determination of drug solubility limit // Mil. Med. Sci. Lett. 2017. V. 86. P. 11–16.
Smith D.J., Patrauchan M.A., Florizone C., Eltis L.D., Mohn W.W. Distinct roles for two CYP226 family cytochromes P450 in abietane diterpenoid catabolism by Burkholderia xenovorans LB400 // J. Bacteriol. 2008. V. 190. P. 1575–1583.
Tarasova E.V., Grishko V.V., Ivshina I.B. Cell adaptations of Rhodococcus rhodochrous IEGM 66 to betulin biotransformation // Process Biochem. 2017. V. 52. P. 1–9.
The United Nations Environment Programme, Stockholm Convention on Persistent Organic Pollutants (POPS). SAGE Publications, Inc., 2455 Teller Road. Thousand Oaks California 91320 United States. 2019. P. 77.
The United Nations, Globally harmonized system of classification and labelling of chemicals (GHS). Fourth revised edition. 2011.
Thomson N., Summers D., Sivaniah E. Synthesis, properties and uses of bacterial storage lipid granules as naturally occurring nanoparticles // Soft Matter. 2010. V. 6. P. 4045–4057.
Volkman J.K., Holdsworth D.G., Richardson D.E. Determination of resin acids by gas chromatography and high-performance liquid chromatography in paper mill effluent, river waters and sediments from the upper Derwent Estuary, Tasmania // J. Chromatogr. A. 1993. V. 643. P. 209–219. https://doi.org/10.1016/0021-9673(93)80555-M
Watanabe K., Miyashita M., Harayama S. Starvation improves survival of bacteria introduced into activated sludge // Appl. Environ. Microbiol. 2000. V. 66. P. 3905–3910.
Zanella E. Effect of pH on acute toxicity of dehydroabietic acid and chlorinated dehydroabietic acid to fish and Daphnia // Bull. Environ. Contam. Toxicol. 1983. V. 30. P. 133–140.
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.



