Микробиология, 2022, T. 91, № 4, стр. 466-474
Каротиноиды в комплексах LH2 из Allochromatium vinosum способны при освещении генерировать синглетный кислород, который окисляет БХл850
З. К. Махнева a, А. А. Москаленко a, *
a Институт фундаментальных проблем биологии Российской академии наук – обособленное подразделение
ФИЦ ПНЦБИ РАН
142290 Московская обл., Пущино, Россия
* E-mail: andrey-moskalenko@rambler.ru
Поступила в редакцию 04.02.2022
После доработки 21.02.2022
Принята к публикации 22.02.2022
- EDN: TWSCHI
- DOI: 10.31857/S0026365622300218
Аннотация
Исследовали взаимодействие синглетного кислорода с бактериохлорофиллом (БХл) в мембранах, светособирающих комплексах LH2 и экстрактах пигментов из штамма Allochromatium (Alc.) vinosum МГУ (старое название Alc. minutissimum). Подтверждена способность каротиноидов при освещении светом в пределах их области поглощения генерировать синглетный кислород, который окисляет БХл, при этом сам БХл в данном процессе не активен и является мишенью для синглетного кислорода. Резкое снижение количества окисленного БХл в комплексе LH2 при освещении в каротиноидной области отмечено только при соотношении каротиноид/комплекс около 0.1, то есть когда на 10 комплексов LH2 приходится менее 1 молекулы каротиноида. Предполагается, что каротиноиды из ранних этапов биосинтеза (нейроспорин, ζ-каротин) более активны в выделении синглетного кислорода под действием света, чем более зрелые каротиноиды. Процесс фотоокисления БХл в комплексах LH2 происходит только в присутствии кислорода. Уменьшение концентрации кислорода в 7 и более раз приводит к замедлению процесса или полной его остановке. В модельных системах (экстракт пигментов комплекса LH2, сохраняющий соотношение БХл/каротиноиды) БХл при освещении становится и основным генератором синглетного кислорода, и мишенью для действия последнего. Каротиноиды в этих условиях не защищают БХл от окисления. Способность БХл850 в комплексе LH2 окисляться синглетным кислородом предполагает, что он может быть использован как природный сенсор этого агента.
У фотосинтезирующих бактерий процессы поглощения солнечной энергии и ее передача с помощью энергии электронных возбужденных состояний протекают при участии пигментов в бактериальных пигмент-белковых комплексах. Обычно выделяют три типа комплексов: периферийный светособирающий комплекс LH2, светособирающий прицентровый комплекс LH1, образующий с реакционным центром (РЦ) ансамбль LH1-RC, и РЦ, в котором происходит первичное разделение зарядов. Основным из этих комплексов (по количеству копий в клетке и содержанию пигментов) является комплекс LH2. Схематично он представляет собой полый внутри цилиндр, которыйпостроен из двух типов гидрофобных полипептидов (α и β), с которыми нековалентно связаны молекулы бактериохлорофилла (БХл) и каротиноидов. Обычно в этом комплексе в каждой субъединице на два полипептида приходится 3 молекулы БХл и один каротиноид. БХл в комплексе LH2 имеет полосы поглощения с максимумами при ~385 нм (полоса Соре), ~590 нм (Qx переход), а также при ~800 и ~850 нм в ближней ИК-области (Qy переходы БХл), а каротиноиды – в области ~400‒550 нм. Молекула каротиноида расположена между α- и β-полипептидами в так называемом “каротиноидном кармане”, так что его полиеновая цепь приобретает S-образную форму, проходит перпендикулярно мембране и взаимодействует как с молекулами БХл в соответствующих агрегатах (БХл800, БХл850), так и c аминокислотными остатками обоих полипептидов (Freer et al., 1996; Prince et al., 1997, 2003; Papiz et al., 2003; Gabrielsen et al., 2009; Lӧhner et al., 2015). Таким образом, пигменты пурпурных фотосинтезирующих бактерий (БХл и каротиноиды) имеют свои обособленные области поглощения, что делает возможным исследовать некоторые характеристики этих пигментов in vivo простыми спектральными методами.
Каротиноиды фотосинтезирующих пурпурных бактерий называются дополнительными пигментами и выполняют ряд функций in vivo, из которых, в данном случае, выделим защитную функцию. Она заключается в том, что система сопряженных двойных связей молекулы пигмента способна тушить триплеты БХл и рассеивать полученную энергию в виде тепла, препятствуя, таким образом, его взаимодействию с кислородом и образованию синглетного кислорода. Если при взаимодействии кислорода c триплетами БХл синглетный кислород все-таки образуется, то каротиноиды тушат и его (схема 1 ). Впервые гипотеза о подобной функции каротиноидов in vivo была предложена в работе (Griffiths et al., 1955) и в настоящее время является общепринятой (Cogdell, Frank, 1987; Frank, Cogdell, 1996; Cogdell et al., 2000; Britton, 2008; Polivka, Frank, 2010; Uragami et al., 2020).
Разные аспекты взаимодействия БХл с каротиноидами изучены достаточно хорошо, однако данных о генерации и дезактивации синглетного кислорода недостаточно. Согласно схеме 1 синглетный кислород должен образовываться при взаимодействии триплетов БХл и кислорода. Пока единственным прямым доказательством этого является способность бактериальных РЦ к выделению синглетного кислорода с квантовым выходом 0.03 ± 0.005 (Arellano et al., 2007; Uchoa et al., 2008). Для светособирающих комплексов таких измерений до сих пор не проведено, хотя, согласно общепринятой теории, синглетный кислород должен выделяться в бескаротиноидных образцах. Отметим, что существует и альтернативная гипотеза выделения синглетного кислорода, которая противоречит общепринятому мнению. Согласно этой гипотезе, каротиноиды в комплексах LH2 способны к генерации синглетного кислорода (схема 2 ) с последующим окислением БХл до 3-ацетил-хлорофилла (АцХл).
(2)
${\text{Кар}} + \left[ {h\nu \to \,{{\,}^{1}}{\text{Кар}}{\kern 1pt} * \to \,{{\,}^{3}}{\text{Кар}}{\kern 1pt} * + \,\,{{{\text{О}}}_{2}}~ \to \,{{\,}^{1}}{\text{О}}_{2}^{*}} \right] + {\text{БХл}} \to {\text{АцХл}}{\text{.}}$Эта гипотеза выдвинута нами на основании сравнительных данных по действию внешнего синглетного кислорода на БХл светособирающих комплексов LH2, по фотоокислению БХл850 в этих же комплексах при освещении светом, поглощаемым каротиноидами, а также по ингибированию указанных процессов ловушками синглетного кислорода (Махнева и соавт., 2019а, 2020; Makhneva et al., 2021).
В данной работе проведено дополнительное изучение взаимодействия синглетного кислорода с БХл как в светособирающих комплексах LH2 из Allochromatium (Alc.) vinosum штамм МГУ, так и в экстрактах пигментов. Полученные данные подтверждают нашу гипотезу о возможности выделения синглетного кислорода каротиноидами.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования. В качестве объекта исследования использовали мембраны и комплексы LH2, выделенные из серной фотосинтезирующей бактерии Alc. vinosum штамм МГУ (старое название Alc. minutissimum, получен из коллекции кафедры микробиологии МГУ, выделен проф. Е.Н. Кондратьевой). Методы выделения мембран и комплексов подробно описаны ранее (Moskalenko et al., 2005; Makhneva et al., 2008; Moskalenko, Makhneva, 2012). Для получения комплексов со сниженным содержанием каротиноидов использовали выращивание клеток в присутствии дифениламина (ДФА), как указано в работах (Moskalenko et al., 2005; Makhneva et al., 2008; Moskalenko, Makhneva, 2012; Ashikhmin et al., 2014).
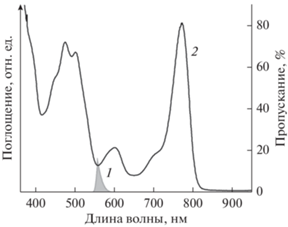
Освещение образцов. Все эксперименты с освещением образцов проводились при температуре 24°C в термостатируемой ячейке и осветителем ЛЭТИ с лампой КГМ 500 (500 Вт). Освещение комплексов во всей каротиноидной области проводили сине-зеленым светом (425‒580 нм, комбинация светофильтров СЗС-22 + ЖС-12), а в более узких диапазонах с помощью интерференционных фильтров (рис. 1). Источником внешнего синглетного кислорода был бенгальский розовый (БР). Образцы с БР освещали желто-зеленым светом с помощью комбинации светофильтров (СЗС-23 + ОС-13), которые выделяли узкую область ~545‒590 нм на длинноволновом склоне полосы поглощения БР и практически не затрагивали область поглощения каротиноидов (рис. 2). Интенсивность света измеряли с помощью пирометра, которая составляла для сине-зеленого света ‒ 50 Вт/м2, желто-зеленого света – 7 Вт/м2, а при использовании интерференционных светофильтров варьировала в пределах 2‒6 Вт/м2, Ошибка измерения во всех опытах не превышала 5‒10%.
Рис. 1.
Спектры пропускания интерференционных светофильтров. Цифрами указаны максимумы полос пропускания.

Рис. 2.
Суммарный спектр пропускания светофильтров СЗС-23 и ОС13 (1) и спектр поглощения общего экстракта пигментов из комплекса LH2 Alc. vinosum МГУ (2).
Биохимические и спектральные методы. Для удаления кислорода воздуха из образца использовали модификацию трубки Тунберга с 1-см кюветой, которую подключали к водоструйному насосу. Измерение концентрации кислорода в образце проводили с помощью электрода Кларка сразу после освещения и регистрации спектров поглощения. Получение пигментных экстрактов и ВЭЖХ-анализ описаны ранее (Ashikhmin et al., 2014). Пигментный анализ мембран, пигмент-белковых комплексов и изолированных каротиноидов проводили с помощью ВЭЖХ системы Shimadzu (“Shimadzu”, Япония), используя колонку с обращенной фазой Agilent Zorbax SB-C18 5 мкм 4.6 × 250 мм (“Agilent”, США). Каротиноиды, БХл и его продукты окисления идентифицировали по времени удержания на колонке и по спектру поглощения с помощью программного обеспечения LC solution (“Shimadzu”). Спектры поглощения регистрировали на спектрофотометре Cary 50 (“Agilent Technology”, США) (Ashikhmin et al., 2014).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
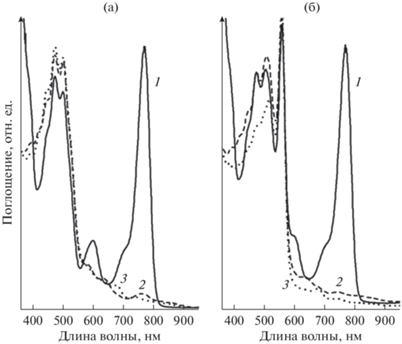
Изменения в спектре поглощения мембран Alc. vinosum при освещении с помощью интерференционных светофильтров, пропускающих в области основных полос поглощения каротиноидов (485 нм) и БХл (852 нм) показаны на рис. 3а. При освещении в каротиноидную область происходит уменьшение (окисление) полосы БХл850, а полоса БХл800 несколько увеличивается за счет смещения первой полосы в коротковолновую область. Одновременно появляется полоса в районе 700 нм, которая принадлежит продукту окисления БХл ‒ АцХл (рис. 3а). Такие же изменения в спектре поглощения комплекса LH2 были ранее обнаружены при освещении сине-зеленым светом (СЗС22-ЖС12), зеленым светом (лазер 532 нм) или с помощью полосовых светофильтров, а также при химическом окислении БХл (Махнева и соавт., 2016, 2020; Leiger et al., 2019; Makhneva et al., 2021). На свету с максимумом излучения при 852 нм зафиксировано только небольшое уменьшение полосы БХл850. Общая картина выцветания (окисления) БХл850 в контрольных мембранах Alc. vinosum при освещении светом с разной длиной волны (интерференционные светофильтры) представлена на рис. 3б. Хорошо видна активность каротиноидов (область 406‒530 нм) в окислении БХл850, а БХл в этом процессе не участвует. Отметим, что подобные изменения отражают цепочку событий, которая указана на схеме 2 . Ранее мы показали, что данный эффект ингибируется ловушками синглетного кислорода типа тролокса и аскорбата Na и предположили, что он связан с генерацией синглетного кислорода каротиноидами (Махнева и соавт., 2019б, 2020). Полученные результаты подтверждают это предположение. Основными каротиноидами в комплексе LH2 являются родопин (≈66%), спириллоксантин (≈17%) и 3,4-дидегидрородопин (≈14%), а также в небольших количествах присутствуют ликопин и родовибрин (≈2‒3%). Понятно, что при таком гетерогенном составе оценить, какой из каротиноидов является наиболее активным в окислении БХл850 (выделении синглетного кислорода), не представляется возможным, и требуется проведение дополнительных экспериментов с отдельными каротиноидами, что является целью дальнейшей работы.
Рис. 3.
а – Спектр поглощения контрольных мембран из Alc. vinosum до (1) и после освещения 30 мин с помощью интерференционных фильтров 485 нм (2) и 852 нм (3); б – трехмерный спектр поглощения контрольных мембран из Alc. vinosum до (контроль) и после освещения 30 мин с помощью соответствующих интерференционных фильтров. Максимум пропускания используемого фильтра указан в основании соответствующего спектра поглощения.

До настоящего времени было не совсем ясно, какое минимальное количество каротиноидов в комплексе LH2 из Alc. vinosum способно инициировать процесс окисления БХл850. Точные принципы организации этого комплекса были установлены относительно недавно, и было показано, что он состоит не из 8‒9 пар α/β полипептидов (гетеродимеров), как у несерных бактерий, а из 12 гетерогенных пар α/β полипептидов (Lӧhner, 2015). Это означает, что контрольный комплекс содержит 12 каротиноидов. Известно, что получить мутанты с пониженным содержанием каротиноидов в комплексе LH2 (1‒5% от контроля) методами генетики на сегодняшний день не представляется возможным. Известны только мутанты из несерных бактерий с измененным составом каротиноидов, при этом мутация прерывает синтез каротиноидов. Последний каротиноид в цепочке биосинтеза, ген которого не затронут мутацией, накапливается в клетках в полном объеме и его содержание составляет 100%. В бескаротиноидных мутантах пурпурных несерных бактерий (мутация по генам CrtI и CrtA) комплекс LH2 не собирается (Hunter, 1995). Наш подход с использованием ингибитора ДФА позволяет получить клетки (мембраны) серных фотосинтезирующих бактерий с разным содержанием каротиноидов (в пределах ≈0.05‒0.5% и более), но с сохранением обоих светособирающих комплексов (Makhneva et al., 2008; Moskalenko, Makhneva, 2012). В данной работе были использованы комплексы LH2 из Alc. vinosum, которые содержали 12 (100%), ≈0.4 (≈3‒5%) и ≈0.1 (≤1‒0.5%) молекулы каротиноида на 1 комплекс (по нашим примерным оценкам). Они обозначены, соответственно, как контроль, ДФА1 и ДФА2. Это означает, что из расчета на 10 комплексов LH2 в образце ДФА1 на 6 комплексов без каротиноидов приходится 4 с одной молекулой пигмента, а в образце ДФА2 – это отношение равно 9/1. Спектр поглощения образцов ДФА2 представлен на рис. 4а (спектр 1), а спектры поглощения образцов ДФА1 и ДФА2 в каротиноидной области – на рис. 4а (вставка). Следует отметить, что при ингибировании биосинтеза каротиноидов в клетках Alc. vinosum очень легко можно получить образцы типа ДФА1 (содержание каротиноидов около 3‒8%), а полного ингибирования каротиноидов (≤0.5%) добиться достаточно сложно. По качественному составу каротиноидов указанные образцы (ДФА1 и ДФА2) достаточно близки: в них содержатся нейроспорин и ζ-каротин, а также их гидрокси-производные и в небольшом количестве ‒ родопин, фитофлуин и фитоин (рис. 5). Два последних, которые иногда называют предшественниками каротиноидов, поглощают в ближней УФ-области. В данной работе мы использовали освещение в видимой и ближней ИК-области, и поэтому их участие в исследуемом процессе не принималось во внимание. В образцах в небольшом количестве также обнаружен АцХл (окисленный БХл). Он также присутствует в мембранах и его наличие может быть связано с окислением небольшой части БХл в процессе разрушения клеток или естественными причинами. В любом случае его количество крайне незначительно и не определяется спектрально.
Рис. 4.
а – Спектр поглощения бескаротиноидного комплекса LH2 ДФА2 из Alc. vinosum до (1) и после освещения 30 мин (2) сине-зеленым светом. Вставка: спектры поглощения бескаротиноидного комплекса LH2 ДФА2 (1) и комплекса LH2 ДФА1 с содержанием каротиноидов около 5% (2) в области 420‒520 нм, характерной для каротиноидов ранних этапов биосинтеза. б – Разностные спектры поглощения “30 мин сине-зеленым светом минус контроль” комплекса LH2 из Alc. vinosum: (1) – бескаротиноидный комплекс LH2 ДФА2; (2) – комплекс LH2 ДФА1 с содержанием каротиноидов около 5%; (3) – контрольный комплекс LH2. Вставка: спектры поглощения продукта окисления БХл – АцХл, обозначения спектров такие же, как на рис. 4б.

Рис. 5.
ВЭЖХ анализ пигментов комплекса LH2 ДФА. Идентификация пиков: (1–4) – БХл и его производные; (5) – АцХл; (6) – родопин; (7 ) – ОН-нейроспорин; (8) – ОН-ζ-каротин; (9) – нейроспорин; (10) – ζ-каротин; (11) – фитофлуин; (12) – фитоин.

При изучении влияния количества каротиноидов в комплексах LH2 из Alc. vinosum на фотоокисление в них БХл при освещении сине-зеленым светом установлено, что в контрольных комплексах LH2 окисление БХл проходило в ≈1.7 раза эффективнее, чем в комплексе LH2 ДФА1 (рис. 4б), хотя разница в содержании каротиноидов в образцах отличалась в ≈20 раз. Это может свидетельствовать о том, что каротиноиды из ранних стадий биосинтеза (нейроспорин и ζ-каротин) более эффективны в процессе образования синглетного кислорода и, как следствие, в окислении БХл, чем зрелые каротиноиды. Недавно при изучении мутанта Rb. sphaeroides с ζ-каротином было высказано предположение, что он способен генерировать синглетный кислород, так как уровень его триплета расположен выше триплета кислорода (Niedzwiedzki et al., 2020). Это предположение коррелирует с полученными нами результатами. При дальнейшем уменьшении количества каротиноидов в комплексе (образец ДФА2) резко снижается выцветание БХл и практически отсутствует полоса поглощения АцХл (рис. 4б, вставка). Таким образом, каротиноиды типа нейроспорина или ζ-каротина при содержании 1 каротиноид на один или два комплекса LH2 могут достаточно эффективно генерировать синглетный кислород под действием света и, как следствие, вызывать окисление БХл в этом комплексе.
Ранее мы показали, что тушители синглетного кислорода останавливают процесс окисления БХл в комплексах LH2 на сине-зеленом свету (Махнева и соавт., 2019б). Однако было не ясно, как этот процесс зависит от концентрации кислорода в образце. Результаты подобного эксперимента представлены на рис. 6, из которого следует, что окисление БХл уменьшается одновременно со снижением концентрации кислорода. Вопрос о том, почему при полном удалении кислорода из образца появляются положительные максимумы на разностном спектре комплекса LH2, остается открытым. Возможно, что этот эффект связан с разрушением (растворением) небольших агрегатов комплекса (они могли образоваться при его концентрировании) за счет эффекта кавитации при удалении кислорода. Из результатов этого опыта следует, что процесс окисления БХл у фотосинтезирующих бактерий при низких концентрациях кислорода (2‒4%) мог стимулировать процесс эволюции бактерий в сторону появления защиты от синглетного кислорода. У несерных фотосинтезирующих бактерий эта проблема в ходе эволюции была успешно решена, и они способны к росту в фото/гетеротрофных условиях в присутствии кислорода.
Рис. 6.
а – Разностные спектры поглощения “30 мин сине-зеленым светом минус контроль” контрольного комплекса LH2 из Alc. vinosum в присутствии 100% атмосферного кислорода (1), ≈50% (2), ≈14% (3) и ≥0% (4). Для лучшего восприятия спектры разнесены по шкале ординат относительно друг друга. б – Кривые выцветания БХл850 в контрольном комплексе LH2 из Alc. vinosum в присутствии разных концентраций атмосферного кислорода (см. рис. 6а).

Следует отметить, что способность БХл850 в комплексе LH2 из Alc. vinosum к окислению синглетным кислородом делает его природным сенсором этого агента. В качестве подобного сенсора его можно использовать с образцами, которые поглощают в области 650‒750 нм, где поглощение БХл очень низкое. Очевидно, что к таким образцам могут быть отнесены все хлорофилл-содержащие объекты из растений и водорослей, которые содержат РЦ фотосистемы 2.
Естественно, что возникает вопрос о механизме взаимодействия каротиноидов и кислорода. Выбор вариантов здесь не очень большой: после поглощения кванта света молекула пигмента переходит на синглетный короткоживущий уровень (1Кар*) и потом следует быстрый переход на долгоживущий триплетный уровень (3Кар*). Последний является базовым для взаимодействия с другими молекулами. Однако проблема состоит в том, что этот уровень у большинства каротиноидов, за исключением ζ-каротина и, возможно, нейроспорина, ниже, чем у кислорода, и такое взаимодействие весьма проблематично. Однако эффект фотоокисления БХл на свету, поглощаемом каротиноидами, имеет место быть, и он связан с образованием синглетного кислорода, который окисляет БХл. Квантовый выход этого процесса небольшой, и требуются дополнительные эксперименты для выяснения его точного механизма.
На заключительном этапе работы была проведена проверка действия синглетного кислорода на экстракт пигментов штамма Alc. vinosum МГУ. При освещении экстракта желто-зеленым светом наблюдается быстрое выцветание БХл (рис. 7). Также отмечено некоторое увеличение поглощения при 400‒550 нм, что связано с появлением продуктов окисления БХл, поглощающих в этой области. Известно, что в модельных системах БХл легко окисляется с образованием десятка окисленных продуктов, основными из которых являются хлорины (Limantara et al., 2006). Интересно отметить, что каротиноиды в этом опыте не выцветают (окисляются). Они, согласно схеме 1 , должны тушить триплеты БХл или синглетный кислород и предотвращать окисление БХл, однако в данной ситуации каротиноиды не способны остановить указанный процесс. Возможная генерация каротиноидами синглетного кислорода имеет низкий квантовый выход и не принималась во внимание. Добавление в среду БР, как дополнительного продуцента синглетного кислорода, существенно меняет процесс окисления (рис. 7б). Регистрируется уменьшение поглощения в каротиноидной области, которое, с одной стороны, свидетельствует об окислении самих каротиноидов, а с другой – о более глубоком окислении БХл.
Рис. 7.
(а) – Спектр поглощения общего экстракта пигментов из Alc. vinosum МГУ в смеси ацетон–метанол (7 : 2) до (1) и после освещения 5 мин (2) или 20 мин (3) желто-зеленым светом. (б) – Спектр поглощения общего экстракта пигментов из Alc. vinosum МГУ до (1) и после освещения 5 мин (2) или 20 мин (3) желто-зеленым светом в присутствии БР (конечная концентрация 10 мкМ).
Понятно, что при переходе от комплексов к экстрактам у нас нарушается пространственная организация пигментов, но сохраняется их соотношение (БХл/каротиноиды), и, в отдельных случаях, проявляются новые свойства пигментов. В частности, это касается БХл, который in vitro является эффективным фотосенсибилизатором синглетного кислорода (Redmond, Gamlin, 1999). Последний, в свою очередь, вызывает быстрое окисление самого БХл и уменьшение его концентрации, так что количество синглетного кислорода тоже падает. В этой связи остается непонятным поведение каротиноидов. Известно, что в модельных системах каротиноиды тушат синглетный кислород с эффективностью 90‒100% (Schmidt, 2004; Tamura, Ishikita, 2020). Тушение триплетов БХл это чисто физический процесс, который должен сохраняться in vitro. Очевидно, что в данных (модельных) условиях оба эти процесса работают неэффективно, и каротиноиды не способны защитить БХл от окисления синглетным кислородом, который он сам генерирует.
В данной работе, проведенной на мембранах и комплексах LH2 из штамма Alc. vinosum МГУ, было установлено, что каротиноиды под действием света могут генерировать синглетный кислород, который окисляет БХл. БХл в указанном процессе не активен и взаимодействует с синглетным кислородом, окисляясь до АцХл. Резкое снижение образования АцХл в образце отмечено только при соотношении каротиноид/комплекс около 0.1 (>1 каротиноида нa комплекс). В модельных системах (экстракт пигментов комплекса LH2, сохраняющий соотношение БХл/каротиноиды) БХл при освещении становится и основным генератором синглетного кислорода и мишенью для действия последнего. Каротиноиды в этих условиях не защищают БХл от окисления. Способность БХл850 в комплексе LH2 окисляться синглетным кислородом предполагает, что он может быть использован как природный сенсор этого агента.
Список литературы
Махнева З.К., Ашихмин А.А., Большаков М.А., Москаленко А.А. Взаимодействие бактериохлорофилла с синглетным кислородом в мембранах пурпурных фотосинтезирующих бактерий: существует ли защитная функция каротиноидов? // ДАН. 2019а. Т. 486. С. 504–508. https://doi.org/10.31857/S0869-56524864504-508
Makhneva Z.K., Ashikhmin A.A., Bolshakov M.A., Moskalenko A.A. Bacteriochlorophyll interaction with singlet oxygen in membranes of purple photosynthetic bacteria: does the protective function of carotenoids exist? // Proceed. RAS. 2019. V. 486. P. 504–508. https://doi.org/10.31857/S0869-56524864504-508
Махнева З.К., Ашихмин А.А., Большаков М.А., Москаленко А.А. Защита БХЛ850 от действия синглетного кислорода в мембранах серной фотосинтезирующей бактерии Allochromatium vinosum с помощью тушителей // Микробиология. 2019б. Т. 88. С. 91–99. https://doi.org/10.1134/S0026365619010129
Makhneva Z.K., Ashikhmin A.A., Bolshakov M.A., Moskalenko A.A. Quenchers protect BChl850 from action of singlet oxygen in the membranes of a sulfur photosynthetic bacterium Allochromatium vinosum strain MSU // Microbiology (Moscow). 2019. V. 88. P. 79–86.
Махнева З.К., Ашихмин А.А., Большаков М.А., Москаленко А.А. Выделение синглетного кислорода мембранами пурпурных фотосинтезирующих бактерий при облучении светом происходит при возможном участии каротиноидов // Микробиология. 2020. Т. 89. С. 169–179. https://doi.org/10.31857/S0026365620010097
Makhneva Z.K., Ashikhmin A.A., Bolshakov M.A., Moskalenko A.A. Carotenoids are probably involved in singlet oxygen generation in the membranes of purple photosynthetic bacteria under light irradiation // Microbiology (Moscow). 2020. V. 89. P. 164–173. https://doi.org/10.1134/S0026261720010099
Махнева З.К., Ашихмин А.А., Большаков М.А., Москаленко А.А. Образование 3-ацетил-хлорофилла в светособирающих комплексах пурпурных бактерий при химическом окислении // Биохимия. 2016. Т. 81. С. 282‒294.
Makhneva Z.K., Ashikhmin A.A., Bolshakov M.A., Moskalenko A.A. 3-Acetyl-chlorophyll formation in light-harvesting complexes of purple bacteria by chemical oxidation // Biochemistry (Moscow). 2016. V. 81. P. 176–186.
Arellano J.B., Yousef Y.A., Melø T.B., Mahamad S.B.B., Cogdell R.J., Naqvi K.R. Formation and geminate quenching of singlet oxygen in purple bacterial reaction center // J. Photochem. Photobiol. B Biol. 2007. V. 87. P. 105–112. https://doi.org/10.1016/j.jphotobiol.2007.03.004
Ashikhmin A.A., Makhneva Z.K., Moskalenko A.A. The LH2 complexes are assembled in the cells of purple sulfur bacterium Ectothiorhodospira haloalkaliphila with inhibition of carotenoid biosynthesis // Phot. Res. 2014. V. 119. P. 291–303. https://doi.org/10.1007/s11120-013-9947-6
Britton G. Functions of intact carotenoids // Carotenoids. Natural Functions / Eds. Britton G., Liaaen-Jensen S., Pfander H. Birkhauser Verlag, Switzerland, 2008. P. 265–308.
Cogdell R., Frank H. How carotenoids function in photosynthetic bacteria // Biochim. Biophys. Acta. 1987. V. 895. P. 63‒79.
Cogdell R.J., Howard T.D., Bittl R., Schlodder E., Geisenheimer I., Lubitz W. How carotenoids protect bacterial photosynthesis // Philosoph. Trans. Royal Soc. B: Biol. Sci. 2000. V. 355. P. 1345–1349. https://doi.org/10.1098/rstb.2000.0696
Frank H., Cogdell R. Carotenoids in photosynthesis // Photochem. Photobiol. 1996. V. 63. P. 257–264. https://doi.org/10.1111/j.1751-1097.1996.tb03022.x
Freer A., Prince S., Sauer K., Papiz M., Hawthornthwaite-Lawless A., McDermott G., Cogdell R., Isaacs N. Pigment-pigment interactions and energy transfer in the antenna complex of the photosynthetic bacterium Rhodopseudomonas acidophila // Structure. 1996. V. 4. P. 449–462. https://doi.org/10.1016/S0969-2126(96)00050-0
Gabrielsen M., Gardiner A., Cogdell R. Peripheral complexes of purple bacteria // Advances in Photosynthesis and Respiration. The Purple Phototrophic Bacteria / Eds. Hunter C.N., Daldal F., Thurnauer M.C., Beatty J.T. Dordrecht: Springer, 2009. V. 28. P. 135‒153.
Griffiths M., Sistrom W., Cohen-Bazire G., Stanier R. Functions of carotenoids in photosynthesis // Nature. 1955. V. 176. P. 1211–1215. https://doi.org/10.1038/1761211a0
Hunter C.N. Genetic manipulation of antenna complexes of purple bacteria // Anoxygenic Photosynthetic Bacteria / Eds. Blankenship R.E., Madigan M.T., Bauer C.E. Dordrecht, Netherlands: Kluwer, 1995. P. 473–501.
Leiger K., Linnanto J.M., Rätsep M., Timpmann K., Ashikhmin A.A., Moskalenko A.A., Fufina T., Gabdulkhakov A., Freiberg A. Controlling photosynthetic excitons by selective pigment photooxidation // J. Phys. Chem. B. 2019. V. 123. P. 29–38. https://doi.org/10.1021/acs.jpcb.8b08083
Limantara L., Koehler P., Wilhelm B., Porra R.J., Scheer H. Photostability of bacteriochlorophyll a and derivatives: potential sensitizers for photodynamic tumor therapy // Photochem. Photobiol. 2006. V. 82. P. 770–780. https://doi.org/10.1562/2005-09-07-RA-676
Lӧhner A., Carey A.M., Hacking K., Picken N., Kelly S., Cogdel R., Kohler J. The origin of the split B800 absorption peak in the LH2 complexes from Allochromatium vinosum // Photosynth. Res. 2015. V. 123. P. 23‒31. https://doi.org/10.1016/j.bbabio.2014.07.022
Makhneva Z., Bolshakov M., Moskalenko A. Heterogeneity of carotenoid content and composition in LH2 of the sulphur purple bacterium Allochromatium minutissimum grown under carotenoid-biosynthesis inhibition // Phot. Res. 2008. V. 98. P. 633–641. https://doi.org/10.1007/s11120-008-9384-0
Moskalenko A.A., Makhneva Z.K. Light-harvesting complexes from purple sulfur bacteria Allochromatium minutissimum assembled without carotenoids // J. Photochem. Photobiol. 2012. V. 108. P. 1‒7. https://doi.org/10.1016/j.jphotobiol.2011.11.006
Makhneva Z., Bolshakov M., Moskalenko A. Carotenoids do not protect bacteriochlorophylls in isolated light-harvesting LH2 complexes of photosynthetic bacteria from destructive interactions with singlet oxygen // Molecules. 2021. V. 26. P. 5120. https://doi.org/10.3390/molecules26175120
Makhneva Z., Bolshakov M., Moskalenko A. Heterogeneity of carotenoid content and composition in LH2 of the sulphur purple bacterium Allochromatium minutissimum grown under carotenoid-biosynthesis inhibition // Phot. Res. 2008. V. 98. P. 633–641. https://doi.org/10.1007/s11120-008-9384-0
Moskalenko A.A., Makhneva Z.K., Fiedor L., Scheer H. Effects of carotenoid inhibition on the photosynthetic RC–LH1 complex in purple sulphur bacterium Thiorhodospira sibirica // Phot. Res. 2005. V. 86. P. 71–80. https://doi.org/10.1007/s11120-005-4473-9
Niedzwiedzki D.M., Swainsbury D.J.K., Canniffe D.P., Hunter C.N., Hitchcock A.A. Photosynthetic antenna complex foregoes unity carotenoid-to-bacteriochlorophyll energy transfer efficiency to ensure photoprotection // Proc. Natl. Acad. Sci. USA. 2020. V. 117. P. 6502–6508. https://doi.org/10.1073/pnas.1920923117
Papiz M., Prince S., Howard T., Cogdell R., Isaacs N. The structure and thermal motion of the B800-850 LH2 complex from Rps. acidophila at 2.0 A resolution and 100 K: new structural features and functionally relevant motions // J. Mol. Biol. 2003. V. 326. P. 1523–1538. https://doi.org/10.1016/s0022-2836(03)00024-x
Polívka T., Frank H. Molecular factors controlling photosynthetic light harvesting by carotenoids // Acc. Chem. Res. 2010. V. 43. P. 1125–1134. https://doi.org/10.1021/ar100030m
Prince S., Howard T., Myles D., Wilkinson C., Papiz M., Freer A., Cogdell R., Isaacs N. Detergent structure in crystals of the integral membrane light-harvesting complex LH2 from Rhodopseudomonas acidophila Strain 10050 // J. Mol. Biol. 2003. V. 326. P. 307–315. https://doi.org/10.1016/s0022-2836(02)01361-x
Prince S., Papiz M., Freer A., McDermott G., Hawthornthwaite-Lawless A., Cogdell R., Isaacs N. Apoprotein structure in the LH2 complex from Rhodopseudomonas acidophila strain 10050: modular assembly and protein pigment interactions // J. Mol. Biol. 1997. V. 268. P. 412–423. https://doi.org/10.1006/jmbi.1997.0966
Redmond R.W., Gamlin J.N. A compilation of singlet oxygen yields from biologically relevant molecules // Photochem. Photobiol. 1999. V. 70. P. 391–475. https://doi.org/10.1111/j.1751-1097.1999.tb08240.x
Schmidt R. Deactivation of O2(1Δg) singlet oxygen by carotenoids: internal conversion of excited encounter complexes // J. Phys. Chem. A. 2004. V. 108. P. 5509–5513. https://doi.org/10.1021/jp048958u
Tamura H., Ishikita H. Quenching of singlet oxygen by carotenoids via ultrafast super-exchange dynamics // J. Phys. Chem. A. 2020. V. 124. P. 5081–5088. https://doi.org/10.1021/acs.jpca.0c02228
Uchoa A.F., Knox P.P., Turchielle R., Seifullina N.Kh., Baptista S.M. Singlet oxygen generation in the reaction centers of Rhodobacter sphaeroides // Eur. Biophys. J. 2008. V. 37. P. 843–850. https://doi.org/10.1007/s00249-008-0287-y
Uragami C., Sato H., Yukihira N., Fujiwara M., Kosumi D., Gardiner A., Cogdell R., Hashimoto H. Photoprotective mechanisms in the core LH1 antenna pigment-protein complex from the purple photosynthetic bacterium, Rhodospirillum rubrum // J. Photoch. Photobiol. A: Chemistry. 2020. V. 400. Art. 112628. https://doi.org/10.1016/j.jphotochem.2020.112628
Дополнительные материалы отсутствуют.



