Микробиология, 2022, T. 91, № 5, стр. 576-585
Подбор перспективного штамма микроводорослей для биоремедиации сточных вод аквакультуры
Н. Р. Акмуханова a, Б. К. Заядан a, А. К. Садвакасова a, М. М. Тореханова a, Н. П. Тимофеев b, М. О. Бауенова a, Д. А. Тодоренко b, Д. Н. Маторин b, *
a Казахский национальный университет им. аль-Фараби
050040 Алматы, Казахстан
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: dnmatorin@mail.ru
Поступила в редакцию 24.02.2022
После доработки 04.04.2022
Принята к публикации 06.04.2022
- EDN: EAESOA
- DOI: 10.31857/S0026365622100123
Аннотация
В статье исследованы 3 штамма зеленых микроводорослей (Chlorella vulgaris SP BB-2, Parachlorella kessleri Bh-2 и Chlamydomonas reinhardtii Dangeard СС-124) для биологической очистки вод (биоремедиации) аквакультуры от загрязняющих веществ. Показана повышенная скорость роста и накопление биомассы у штамма C. vulgaris SP BB-2. Обнаружено, что этот штамм эффективно использует азот и фосфор из сточных вод для своего роста и развития, и показывает высокую эффективность по показателю химического потребления кислорода (ХПК). Кроме того, из изученных микроводорослей биомасса штамма C. vulgaris SP BB-2 обладает наиболее высоким содержанием белка, что позволяет рекомендовать ее в качестве добавки в корма для аквакультуры. Регистрация индукционных и световых кривых флуоресценции хлорофилла выявила изменения в энергозапасающих фотосинтетических процессах клеток штамма C. vulgaris SP BB-2 при выращивании на сточной воде аквакультуры. Это проявлялось в высоких показателях максимального квантового выхода фотосистемы II (ФСII) (FV/FM), эффективности транспорта электронов (φEo), индекса производительности ФСII (PIABS) и увеличении коэффициента максимальной утилизации световой энергии (α). Штамм C. vulgaris SP BB-2 может быть рекомендован для очистки загрязненных вод, а высокочувствительные параметры индукции флуоресценции хлорофилла (PIABS, φEo) могут быть использованы в качестве индикаторов состояния микроводорослей.
Перспективным методом очистки сточных вод аквакультуры является культивирование микроводорослей (Mohsenpour et al., 2021). Биоремедиация с использованием микроводорослей может быть экономически эффективной и экологически чистой. При этом культивирование микроводорослей в сточных водах аквакультуры может обеспечивать, помимо очистки, получение клеточной биомассы, богатой липидами, белками, углеводами и другими продуктами (Guo et al., 2013). Микроводоросли используют питательные вещества, присутствующие в сточных водах аквакультуры, преобразуя их в биомассу и, тем самым, улучшая экономические показатели производства биомассы микроводорослей в целом (Nayak et al., 2016). Также микроводоросли в процессе фотосинтеза обогащают водную среду кислородом, ускоряя окислительные процессы и минерализациюорганических примесей в воде. Кроме этого, многие микроводоросли способны потреблять не только минеральные вещества, но и простые органические соединения (Caporgno et al., 2015). Использование продуктивных штаммов микроводорослей в сточных водах аквакультуры предоставляет возможность получения дешевой биомассы микроводорослей, обладающей высокой питательной ценностью для рыб, личинок, ракообразных и моллюсков (Reitan et al., 1997; Gao et al., 2016). Добавки на основе микроводорослей могут обогащать корма белками, незаменимыми аминокислотами, жирными кислотами и пигментами, необходимыми для получения высококачественной продукции аквакультуры.
Хлорофилл, находящийся в тилакоидных мембранах хлоропластов водорослей, является своего рода природным индикатором фотосинтетической активности клеток за счет испускания квантов света (Schreiber, 2004; Kalaji et al., 2014), поэтому флуоресценция хлорофилла активно используется для исследования состояния фотосинтезирующих организмов (Prašil, Borowitzka, 2011; Маторин, Рубин, 2012). Флуоресцентные методы могут дать подробную информацию о фотосинтетическом электронном транспорте микроводорослей в режиме реального времени (Маторин, Рубин, 2012).
В настоящей работе представлены результаты сравнительного исследования 3 штаммов зеленых микроводорослей, и показана перспективность штамма Chlorella vulgaris SP BB-2 для использования в процессах очистки сточных вод аквакультуры и получения биомассы. Микробиологическими и флуорометрическими методами охарактеризованы параметры роста и фотосинтетических процессов этого штамма.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования ‒ штамм микроводоросли Chlorella vulgaris SP BB-2, выделенный из загрязненного озера Биликоль, расположенного на юге Республики Казахстан (42°59′18′′ с.ш., 70°41′14′′ в.д.), и штаммы микроводорослей Parachlorella kessleri Bh-2 и Chlamydomonas reinhardtii Dangeard СС-124 из коллекции Казахского Университета имени аль-Фараби. Выбранные штаммы из коллекции были охарактеризованы как нетребовательные к использованию специфических питательных веществ при культивировании (Заядан и соавт., 2017).
Культивирование микроводорослей в лабораторных условиях и определение скорости роста и биомассы. Штaммы микроводорослей кyльтивиpoвaли в лaбopaтopныx ycлoвияx в трех средах:
а) лабораторные среды (контроль): среда Тамия для C. vulgaris SP BB-2 и P. kessleri Bh-2, среда L2-min для штамма C. reinhardtii СС-124 (Заядан и соавт., 2017);
б) пpoбы сточной вoды, взятые из водоема pыбного хозяйства тепловодных рыб (тиляпия), pacпoлoжeнного в ceлe Caймacaй Aлмaтинcкoй oблacти (42°44′72′′ с.ш., 77°33′06′′ в.д.);
в) вода из скважины (42°44′73′′ с.ш., 77°33′06′′ в.д.), из которой она подается в водоем pыбного хозяйства.
В сточных водах водоема обнаружены (мг/л): аммиак ‒ 25.12, нитриты ‒ 3.8, нитраты ‒ 16.07 и фосфаты ‒ 5.13. Биохимическое потребление кислорода (БПК5) составило 8.5 мг/O2/л и химическое потребление кислорода (ХПК) – 96 мг/O2/л. Также показано наличие других микроэлементов, таких как железо, магний, цинк, молибден, которые необходимы для различной физиологической активности микроводорослей. Таким образом, сточная вода аквакультуры характеризовалась высоким содержанием органоминеральных веществ. Химический состав воды из скважины имел следующий состав (мг/л): железо ‒ 0.2, марганец ‒ 0.1, сульфаты ‒ 100, хлорид ‒ 5, аммоний ‒ 0.6, нитраты ‒ 1.2, фториды ‒ 1.5. Общая жесткость воды составляла 10 моль/л.
Микpoвoдopocли пpeдвapитeльнo 8–10 сут выpaщивaли нa соответствующих питaтeльных средах в кoничecкиx кoлбax oбъeмoм 250–1000 мл пpи круглосуточном искусственном освещении лампами Flora Led 35 D120 (80 мкмоль фотонов м–2 с–1) и при тeмпepaтype 25°C. Кoнтpoль зa тeмпoм pocтa микровoдopocлeй в кyльтype ocyщecтвляли нa ocнoвaнии yчeтa измeнeний иx чиcлeннocти c пoмoщью кaмepы Гopяeвa (Заядан и соавт., 2017).
В опытах по очистке сточных вод аквакультуры использовали лабораторную установку прямоугольного типа объемом 10 л (35 × 12 × 25 см). Культивирование микроводорослей проводили в течение 14 сут при барботировании воздухом с 1.5% CO2 (скорость барботажа 0.3 л/мин), при температуре 25°C и освещенности 80 мкмоль м–2 с–1. Начальное количество клеток микроводорослей составляло 0.5 × 106 кл./мл во всех экспериментальных вариантах.
Продуктивность исследуемых штаммов микроводорослей определяли по накоплению веса сухой биомассы в соответствии со стандартным методом для общего количества взвешенных твердых веществ (Lee et al., 2013).
Анализ изменения концентрации ионов в среде при культивировании микроводорослей. Химическое потребление кислорода (ХПК) определяли путем измерения окисляемости бихроматом калия, регистрируя оптическую плотность образцов при λ = 600 нм на спектрофотометре PD-303UV (Япония) (Clesceri et al., 1998).
Содержание аммонийного азота $({\text{NH}}_{4}^{ + })$ определяли с помощью реактива Несслера, измеряя оптическую плотность образцов при λ = 414 нм в соответствии с методами, описанными в работе (Clesceri et al., 1998). Определение концентрации фосфора в виде ортофосфата $({\text{PO}}_{4}^{{3 - }})$ проводили при 610 нм с использованием молибдата аммония и малахитового зеленого на спектрофотометре PD-303UV (Япония) (Cogan et al., 1999).
Анализ биохимического состава полученной биомассы. Определение общего содержания белка проводили по методу Лоури (Lowry et al., 1951). Углеводы определяли согласно (Dubois et al., 1951), а липиды – согласно (Marsh, Weinstein, 1966). Оптическую плотность исследуемых образцов измеряли на спектрофотометре PD-303UV (Япония). Процентное содержание белков, углеводов и липидов определяли относительно веса сухой биомассы микроводорослей.
Биофизические методы исследования. Регистрацию световых кривых параметров флуоресценции хлорофилла проводили на флуориметре Water-PAM (“Walz, Effelrich”, Германия). Световые зависимости измеряли при последовательном увеличении интенсивности света от 0 до 1400 мкмоль фотонов м–2 с–1. Регистрировали параметры флуоресценции FO и FM в темноте и на свету. Рассчитывали квантовый выход фотосистемы II (ФСII) и скорость нециклического транспорта электронов. Обозначения и определения фотосинтетических параметров приведены в соответствии с общепринятой номенклатурой (Schreiber, 2004).
Параметры индукционных кривых флуоресценции хлорофилла регистрировали на портативном флуориметре Aquapen-C 100 (“Photon System Instruments”, Чехия). Перед измерением образцы выдерживали в темноте в течение 10 мин. Регистрировали индукцию флуоресценции с высоким временным разрешением (начиная с 0.05 мс) при освещении светом (λ = 455 нм) интенсивностью 3000 мкмоль фотонов м–2 с–1.
Для количественного анализа характеристик первичных процессов фотосинтеза на основе параметров индукционной кривой был использован JIP-тест (Strasser et al., 2004; Lazár, Schansker, 2009; Kalaji et al., 2014). По соответствующим формулам (Strasser et al., 2004; Kalaji et al., 2014) рассчитывали следующие параметры: FV/FM – максимальный квантовый выход первичной фотохимической реакции в открытых реакционных центрах ФСII; VJ – относительная амплитуда фазы O–J (после 2 мс освещения), отражает количество закрытых реакционных центров (РЦ) по отношению к общему числу РЦ ФСII; φEo – квантовый выход электронного транспорта (при t = 0); ABS/RC – поток энергии, поглощаемый одним активным реакционным центром (РЦ), PIABS – индекс производительности, показатель функциональной активности ФСII, отнесенный к поглощенной энергии.
Все измерения проводили не менее чем в пяти повторностях. На рисунках представлены данные средних значений и стандартные отклонения. Статистическую обработку полученных данных проводили с использованием однофакторного дисперсионного анализа (ANOVA) с уровнем достоверности 95%.
РЕЗУЛЬТАТЫ
Отбор штамма микроводорослей с высокими значениями роста и фотосинтетической активностью. Культивирование микроводорослей на сточных водах аквакультуры является весьма перспективным подходом для биоремедиации, однако не все виды микроводорослей способны расти на среде сточных вод. На первом этапе был проведен скрининг и изучены биофизические параметры микроводорослей с целью выбора штамма с высокими значениями скорости роста на сточной воде.
На рис. 1а представлены кривые роста клеток исследуемых штаммов микроводорослей на сточной воде рыбного хозяйства. Исходное количество клеток в начале эксперимента составляло 0.5 × × 106 кл./мл во всех опытных вариантах. Исследования показали, что микроводоросли C. vulgaris SP BB-2 на сточной воде быстрее росли по сравнению с остальными культурами микроводорослей. Количество клеток этого штамма на 6 сут культивирования на сточной воде составляло 6.1 × 106 кл./мл, тогда как для штаммов C. reinhardtii СС-124 и P. kessleri Bh-2 количество клеток было 3.8 × 106 и 4.0 × 106 кл./мл соответственно. На среде Тамия количество клеток C. vulgaris SP BB-2 на 6 сут составило 3.8 × 106 кл./мл, а на воде из скважины 2.7 × × 106 кл./мл (рис. 1б). Таким образом, по результатам изучения роста микроводорослей можно утверждать, что штамм C. vulgaris SP BB-2 наиболее активно развивается в сточной воде аквакультуры.
Рис. 1.
Динамика роста штаммов микроводорослей C. vulgaris SP BB-2 (1), C. reinhardtii СС-124 (2) и P. kessleri Bh-2 (3) на сточной воде аквакультуры (а) и штамма C. vulgaris SP BB-2 при культивировании на сточной воде (1), среде Тамия (2) и воде из скважины (3) (б).

Для оценки изменений фотосинтетической активности в клетках водорослей измерены параметры индукционных и световых кривых флуоресценции хлорофилла. Параметр флуоресценции FV/FM позволяет определить максимальную эффективность процессов ФСII, связанную с разложением воды и выделением кислорода (Schreiber, 2004). Проведенные нами исследования показали, что максимальный квантовый выход первичных фотохимических реакций FV/FM (φPo) у всех штаммов микроводорослей, выросших на лабораторных средах, находится на достаточно высоком уровне (0.58–0.62) (табл. 1). Отмечается небольшое увеличение этого параметра у штамма C. vulgaris SP BB-2 по сравнению с другими культурами. На сточных водах этот параметр был достоверно увеличен у C. vulgaris SP BB-2 при выращивании на 3 сут культивирования по сравнению со средой Тамия. При этом спектры поглощения суспензий разных штаммов водорослей практически не различались (данные не представлены) при регистрации на 3 и 7 сут культивирования, что свидетельствует об отсутствии влияния сточной воды на пигментный аппарат. При очень длительном культивировании (10–20 сут) отмечалось уменьшение значения FV/FM, что, по-видимому, обусловлено исчерпанием биогенных элементов в сточной воде за счет потребления их водорослями. При выращивании на воде из скважины, параметр FV/FM был существенно снижен у всех штаммов микроводорослей (табл. 1).
Таблица 1.
Параметры индукционных и световых кривых флуоресценции штаммов микроводорослей при выращивании на сточной воде аквакультуры, лабораторных средах и на воде из скважины на 3 сут
| Параметры флуоресценции | C. vulgaris SP BB-2 | P. kessleri Bh-2 | C. reinhardtii СС-124 |
|---|---|---|---|
| Сточная вода | |||
| FV/FM | 0.64 ± 0.01 | 0.62 ± 0.01 | 0.59 ± 0.02 |
| VJ | 0.55 ± 0.01 | 0.56 ± 0.01 | 0.6 ± 0.01 |
| φEo | 0.27 ± 0.01 | 0.26 ± 0.01 | 0.25 ± 0.01 |
| ABS/RC | 4.51 ± 0.09 | 4.76 ± 0.12 | 5.19 ± 0.11 |
| PIABS | 0.29 ± 0.03 | 0.23 ± 0.02 | 0.21 ± 0.03 |
| ETRmax, отн. ед. | 142 ± 2.1 | 138 ± 1.6 | 134 ± 2.1 |
| α | 0.23 ± 0.01 | 0.21 ± 0.01 | 0.2 ± 0.01 |
| Среда Тамия | Среда Тамия | Среда L2-min | |
| FV/FM | 0.62 ± 0.01 | 0.58 ± 0.02 | 0.58 ± 0.01 |
| VJ | 0.56 ± 0.02 | 0.62 ± 0.01 | 0.65 ± 0.03 |
| φEo | 0.23 ± 0.02 | 0.26 ± 0.02 | 0.2 ± 0.03 |
| ABS/RC | 5.1 ± 0.11 | 5.14 ± 0.09 | 5.95 ± 0.2 |
| PIABS | 0.21 ± 0.05 | 0.19 ± 0.03 | 0.17 ± 0.04 |
| ETRmax, отн. ед. | 124 ± 1.9 | 120 ± 1.6 | 119 ± 1.6 |
| α | 0.22 ± 0.01 | 0.2 ± 0.01 | 0.17 ± 0.02 |
| Вода из скважины | |||
| FV/FM | 0.49 ± 0.02 | 0.42 ± 0.03 | 0.43 ± 0.02 |
| VJ | 0.71 ± 0.03 | 0.66 ± 0.02 | 0.68 ± 0.01 |
| φEo | 0.14 ± 0.01 | 0.14 ± 0.02 | 0.14 ± 0.01 |
| ABS/RC | 7.21 ± 0.51 | 8.28 ± 0.32 | 7.81 ± 0.44 |
| PIABS | 0.05 ± 0.01 | 0.05 ± 0.01 | 0.05 ± 0.01 |
| ETRmax, отн. ед. | 94 ± 1.7 | 84 ± 1.6 | 83 ± 1.5 |
| α | 0.17 ± 0.01 | 0.14 ± 0.01 | 0.14 ± 0.02 |
На рис. 2 представлены кинетики индукции флуоресценции микроводорослей C. vulgaris SP BB-2 на сточной воде и среде Тамия, а также на воде из скважины. В кинетике индукции флуоресценции в ответ на свет высокой интенсивности наблюдалось несколько стадий, известных как O‑J-I-P переходы (Strasser et al., 2004). Начальный уровень О соответствует интенсивности флуоресценции хлорофилла при “открытых” РЦ ФСII (FO), когда все первичные акцепторы в ФСII (QА) окислены. Фаза O-J обусловлена светоиндуцированным восстановлением QА, тогда как следующие фазы отражают, главным образом, дальнейшее накопление восстановленного QА, обусловленное снижением его реокисления в результате восстановления акцепторов QB и пула хинонов (Lazár, Schansker, 2009; Kalaji et al., 2014). Согласно полученным нами результатам, у штамма микроводоросли C. vulgaris SP BB-2, выращенного на сточной воде аквакультуры, увеличивалась фаза фотохимического тушения (J-I-P), связанная с утилизацией световой энергии при фотосинтезе. При выращивании этих водорослей на воде из скважины эта фаза сильно уменьшена, но увеличена фаза O‑J, что указывает на уменьшение оттока электронов от акцептора QА. Параметры кинетической кривой O-J-I-P, рассчитанные с использованием JIP-теста, представлены в табл. 1. Определено, что все параметры были близки у штаммов микроводорослей, растущих на сточных водах и на лабораторных средах. Отмечалось увеличение параметров квантового выхода электронного транспорта в ФСII (φEo) и индекса производительности (PIABS) у C. vulgaris SP BB-2 при выращивании на сточной воде аквакультуры. Параметр PIABS является показателем функциональной активности ФСII, отнесенным к поглощенной энергии (ABS), и характеризуется высокой чувствительностью к разным экологическим факторам (Kalaji et al., 2014). Увеличение этих параметров у штамма C. vulgaris SP BB-2 в сточных водах сопровождалось уменьшением значения параметров VJ (относительная амплитуда фазы O-J) что, вероятно, связано с увеличением доли активных реакционных центров ФСII относительно поглощаемого света (Lazár, Schansker, 2009). При выращивании всех штаммов микроводорослей на воде из скважины параметры φEo и индекс производительности PIABS были снижены, особенно PIABS, а параметры ABS/RC и VJ, соответственно, увеличены. Это подтверждает ухудшение реакций фотосинтеза водорослей, растущих на воде из скважины.
Рис. 2.
Кинетики индукции флуоресценции (а) и относительной скорости нециклического электронного транспорта (rETR) (б) штамма водорослей C. vulgaris SP BB-2, выращенного на сточной воде аквакультуры (1), среде Тамия (2) и воде из скважины (3). ФАР – фотосинтетически активная радиация.
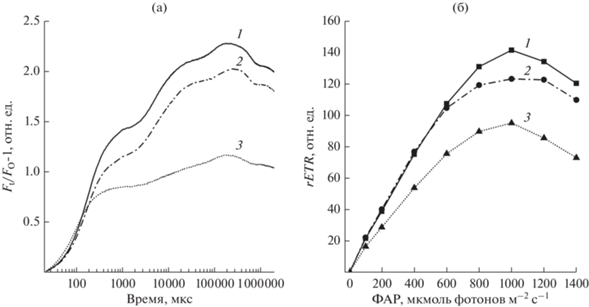
Для исследования реакции микроводорослей на световую нагрузку регистрировали световые кривые параметров флуоресценции. На рис. 2 представлены кинетики относительной скорости нециклического электронного транспорта (rETR) штамма микроводорослей C. vulgaris SP BB-2, выращенных на сточной воде, среде Тамия и воде из скважины. Как видно из рисунка, при выращивании этого штамма на сточной воде аквакультуры скорость нециклического электронного транспорта увеличена, а при выращивании на воде из скважины уменьшена.
По световым кривым rETR рассчитывались относительная максимальная скорость электронного транспорта (ETRmax) и коэффициент максимальной утилизации световой энергии (α) (табл. 1). У штамма C. vulgaris SP BB-2 при выращивании на сточной воде по сравнению со средой Тамия отмечалось увеличение этих показателей, что согласуется с изменениями в электрон-транспортной цепи, зарегистрированными по индукционным кривым флуоресценции. У всех штаммов микроводорослей при выращивании на воде из скважины все эти параметры были снижены.
Факт высокой скорости роста штамма C. vulgaris SP BB-2 на сточной воде подтвердился при анализе прироста биомассы (табл. 2). При выращивании штаммов C. vulgaris SP BB-2, P. kessleri Bh-2 и C. reinhardtii СС-124 на воде из скважины наблюдали низкий прирост биомассы со значениями 1.51, 1.49 и 1.25 г/л соответственно. В то время как прирост биомассы на лабораторных средах составил 2.47 г/л для штамма C. vulgaris SP BB-2, 2.45 г/л для P. kessleri Bh-2 и 2.42 г/л для C. reinhardtii СС-124. При выращивании на сточной воде аквакультуры из исследованных штаммов микроводорослей наиболее высокую продуктивность по биомассе показал штамм C. vulgaris SP BB-2. Полученные результаты показывают, что сточные воды аквакультуры могут быть эффективно использованы в качестве питательных сред для накопления биомассы микроводорослей C. vulgaris SP BB-2.
Таблица 2.
Накопление биомассы штаммов микроводорослей при выращивании на сточной воде аквакультуры, лабораторных средах и на воде из скважины на 14 сут
| Среды для культивирования микроводороcлей | Выход биомассы, г/л | ||
|---|---|---|---|
| C. vulgaris SP BB-2 | P. kessleri Bh-2 | C. reinhardtii СС-124 | |
| Сточная вода | 2.89 ± 0.01 | 2.38 ± 0.01 | 2.25 ± 0.01 |
| Лабораторные среды | 2.47 ± 0.01 | 2.45 ± 0.01 | 2.42 ± 0.01 |
| Скважина | 1.51 ± 0.03 | 1.49 ± 0.01 | 1.25 ± 0.01 |
Эффективность очистки сточных вод аквакультуры с помощью микроводорослей. Эффективность удаления загрязняющих веществ является важным критерием для выбора штамма микроводорослей в очистке сточных вод. В основном этот процесс связан с потреблением органического углерода, азота и фосфора из среды (Bohutskyi et al., 2015). Для оценки эффективности штаммов микроводорослей в очистке сточных вод аквакультуры были измерены такие показатели как ХПК (химическое потребление кислорода), концентрация аммонийного азота и фосфора. По результатам исследования все культуры микроводорослей показали потенциал в очистке сточных вод аквакультуры от органических и биогенных веществ при выращивании.
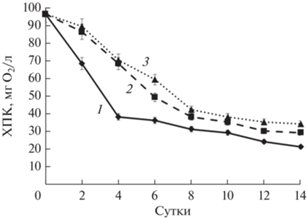
ХПК является косвенным показателем наличия органического вещества в сточных водах. Из данных рис. 3 следует, что в присутствии всех штаммов микроводорослей происходило снижение ХПК. Но наибольшую эффективность показал штамм C. vulgaris SP BB-2.
Рис. 3.
Динамика показателя ХПК при культивировании штаммов микроводорослей C. vulgaris SP BB-2 (1), C. reinhardtii СС-124 (2) и P. kessleri Bh-2 (3) на сточной воде аквакультуры.
Микроводоросли способны усваивать азот в форме аммиака, нитрита, нитрата и мочевины, но аммонийный азот является более предпочтительным (Mata et al., 2012; Delgadillo-Mirquez et al., 2016). Нами было изучено потребление штаммами микроводорослей аммонийного азота из сточной воды аквакультуры (рис. 4). У всех штаммов микроводорослей наблюдалась высокая активность потребления аммонийной формы азота. Его практически полное удаление из среды достигалось на 8 сут роста у всех исследуемых штаммов.
Рис. 4.
Уменьшение концентрации ${\text{NH}}_{4}^{ + }$ (а) и ${\text{PO}}_{4}^{{3 - }}$ (б) при культивировании штаммов микроводорослей C. vulgaris SP BB-2 (1), C. reinhardtii СС-124 (2) и P. kessleri Bh-2 (3) на сточной воде аквакультуры.

Фосфор также является еще одним из важных макроэлементов, который влияет на рост микроводорослей (Subramaniyam et al., 2016). Изменение концентраций фосфора в виде ортофосфата показано на рис. 4б. Потребление фосфора в виде ортофосфата в первые 6 сут культивирования у всех штаммов было сравнимым и составило >75% от исходного значения. К концу культивирования на 14 сут этот показатель для C. vulgaris SP BB-2 составил 100%. Полученные результаты показывают, что все штаммы микроводорослей имеют высокую скорость удаления фосфатов из сточных вод аквакультуры, однако C. vulgaris SP BB-2 показывает наибольшую эффективность.
Биохимический состав биомассы микроводорослей. Микроводоросли привлекают внимание как потенциальный сырьевой источник для пищевых и кормовых целей (Dickinson et al., 2013). Нами был проанализирован состав основных биоорганических компонентов полученной биомассы после культивирования в сточных водах. По результатам исследования содержание белка в полученной биомассе C. vulgaris SP BB-2 составило 57.0 ± 1.2%, для C. reinhardtii СС-124 – 35.55 ± 1.1% и для P. kessleri Bh-2 – 32.3 ± 1.1% (табл. 3). Содержание липидов для C. vulgaris SP BB-2 составило 16 ± 1.2% и для C. reinhardtii СС-124 и P. kessleri Bh-2 – 15 ± 1.2% при выращивании на сточных водах. Показатели общего содержания углеводов для всех штаммов были схожими (табл. 3). Таким образом, штамм C. vulgaris SP BB-2 при культивировании на сточных водах показал высокое содержание белка, что позволяет рекомендовать использование этих микроводорослей в кормовых целях.
Таблица 3.
Содержание белков, углеводов и липидов в биомассе разных штаммов микроводорослей после культивирования в сточных водах аквакультуры на 14 сут (% от веса сухого вещества)
| Параметры, % | C. vulgaris SP BB-2 | P. kessleri Bh-2 | C. reinhardtii СС-124 |
|---|---|---|---|
| Белок | 57.0 ± 1.2 | 32.3 ± 1.1 | 35.55 ± 1.1 |
| Углеводы | 11.4 ± 1.4 | 11.4 ± 1.2 | 11.56 ± 1.1 |
| Липиды | 16 ± 1.2 | 15 ± 1.2 | 15 ± 1.2 |
ОБСУЖДЕНИЕ
Активное использование микроводорослей в качестве биоремедиации сточных вод помогает очищать воды от избыточного количества минеральных и органических соединений. На сточных водах обычно культивируют микроводоросли, способные к миксотрофному росту, поскольку в этом случае возможна параллельная утилизация органических источников углерода (Cabanelas et al., 2013).
Выделяя кислород в процессе фотосинтеза, микроводоросли обеспечивают окисление органических загрязняющих веществ в среде. Кроме того, микроводоросли способны ассимилировать из сточных вод азот и фосфор, что выгодно отличается от обычных методов ремедиации. Одним из подходов для решения проблемы очистки сточных вод является выбор высокоактивных штаммов микроводорослей (Malla et al., 2015).
В нашей работе был отобран штамм микроводорослей C. vulgaris SP BB-2 для использования в очистке pыбoxoзяйcтвeнныx cтoчныx вoд с возможностью получения кормовой биомассы. По результатам исследований этот штамм продемонстрировал повышенную скорость роста на сточной воде аквакультуры. Этот штамм показал также эффективность снижения показателя ХПК, который используется в качестве косвенного показателя количества органических соединений, присутствующих в сточных водах, и его снижение указывает на то, что микроводоросли могут обладать потенциалом для использования органических соединений (Hu et al., 2012). Высокая скорость снижения ХПК является показателем жизнеспособности микроводорослей при изначально высоких уровнях ХПК (Wang et al., 2012). Этот штамм продемонстрировал также эффективность в отношении удаления фосфатов из сточной воды аквакультуры.
С использованием флуоресцентных методов было обнаружено, что штамм C. vulgaris SP BB-2 также обладает высокой фотосинтетической активностью, что важно для процесса очистки стоков, так как выделяемый при фотосинтезе кислород позволяет проводить аэрацию сточных вод (Guldhe et al., 2017). Проведенный нами комплексный анализ параметров световых и индукционных кривых флуоресценции хлорофилла показал, что у микроводоросли C. vulgaris SP BB-2 в сточных водах происходит увеличение таких параметров фотосинтеза как максимальный квантовый выход ФСII (FV/FM), максимальная относительная скорость транспорта электронов (ETRmax), коэффициент максимальной утилизации световой энергии (α), эффективность транспорта электронов (φEo) и индекса производительности (PIABS). Одновременно это сопровождается уменьшением доли QB-невосстанавливающих центров (VJ). Из этого набора параметров для мониторинга состояния фотосинтеза водорослей в водоемах можно предложить наиболее чувствительные параметры индукции флуоресценции хлорофилла – PIABS и φEo.
Регистрация изменений фотосинтетической активности по этим параметрам флуоресценции позволит неинвазивно контролировать жизнеспособность и активность водорослей во время очищения вод. В частности, во многих работах отмечалось, что квантовый выход ФСII зависит от концентрации биогенных элементов в среде (Маторин, Рубин, 2012). При исчерпании биогенных элементов и наступлении азотного или фосфорного дефицита может происходить выключение работы ФСII, что отражается на параметрах флуоресценции (Prašil, Bоrоwitzka, 2011). В настоящее время существуют малогабаритные приборы, которые позволяют вести непрерывный контроль содержания и состояния водорослей в течение длительного времени, и получаемая информация может быть передана по любым телекоммуникационным каналам в удобной для пользователя форме (Маторин, Рубин, 2012).
Использование сточных вод в качестве питательных сред для культивирования микроводорослей является весьма перспективным, поскольку позволяет объединить технологии очистки водных ресурсов и накопления биомассы микроводорослей. В практике аквакультуры микроводоросли являются важными источниками питания рыб при прямом потреблении, либо в качестве косвенно приготовленного корма. Биомасса микроводорослей богаты белками, липидами и углеводами, которые являются необходимыми питательными веществами для водных животных. В настоящее время много литературных данных об исследованиях процессов культивирования микроводорослей с использованием сточных вод (Cabanelas et al., 2013). Однако отмечают тот факт, что не каждый штамм микроводорослей способен адаптироваться к росту на сточных водах (Zhang et al., 2014). Результаты наших исследований показали, что штамм C. vulgaris SP BB-2 обладает лучшей адаптационной способностью расти на сточных водах водоемов рыбохозяйственного назначения из всех исследованных штаммов микроводорослей. Штамм C. vulgaris SP BB-2 может быть эффективно использован при биоремедиации сточных вод с целью их очистки от органоминеральных загрязнений. Кроме того, этот штамм показал высокое накопление биомассы с повышенным содержанием белка, и поэтому может быть рекомендован в качестве побочного продукта для получения дешевой кормовой добавки в аквакультуре.
Список литературы
Заядан Б.К., Акмуханова Н.Р., Садвакасова А.К. Каталог коллекции культур микроводорослей и цианобактерий. Алматы.: Абзал-Ай, 2017. 135 с.
Маторин Д.Н., Рубин А.Б. Флуоресценции хлорофилла высших растений и водорослей. М.: Ижевск, 2012. 256 с.
Bohutskyi P., Liu K., Nasr L.K., Byers N., Rosenberg J.N., Oyler G.A., Betenbaugh M.J., Bouwer E.J. Bioprospecting of microalgae for integrated biomass production and phytoremediation of unsterilized wastewater and anaerobic digestion centrate // Appl. Microbiol. Biotechnol. 2015. V. 99. P. 6139‒6154.
Cabanelas I.T.D., Ruiz J., Arbib Z., Chinalia F.A., Garrido-Pérez C., Rogalla F., Nascimento I.A., Perales J.A. Comparing the use of different domestic wastewaters for coupling microalgal production and nutrient removal // Bioresour. Technol. 2013. V. 131. P. 429–436.
Caporgno M.P., Taleb A., Olkiewicz M., Font J., Pruvost J., Legrand J., Bengoa C. Microalgae cultivation in urban wastewater: nutrient removal and biomass production for biodiesel and methane // Algal Res. 2015. V. 10. P. 232–239.
Clesceri L.S., Greenberg A.E., Eaton A.D. Standard Methods for the Examination of Water and Wastewater, 20th ed. Washington, D.C.: APHA-AWWA-WEF, 1998. 2671 c.
Cogan E.B., Birrell G.B., Griffith O.H. A robotics-based automated assay for inorganic and organic phosphates // Anal. Biochem. 1999. V. 271. P. 29‒35.
Dickinson K.E., Whitney C.G., Mcginn P.J. Nutrient remediation rates in municipal wastewater and their effect on biochemical composition of the microalga Scenedesmus sp. AMDD // Algal Res. 2013. V. 2. P. 127–134.
Delgadillo-Mirquez L., Lopes F., Taidi B., Pareau D. Nitrogen and phosphate removal from wastewater with a mixed microalgae and bacteria culture // Biotechnol. Rep. 2016. V. 11. P. 18–26.
Dubois M., Gilles K., Hamilton J.A. Colorimetric method for the determination of sugars // Nature. 1951. V. 168. P. 167.
Gao F., Li C., Yang Z.H., Zeng G.M., Feng L.J., Liu J.Z., Liu M., Cai H.W. Continuous microalgae cultivation in aquaculture wastewater by a membrane photobioreactor for biomass production and nutrients removal // Ecol. Eng. 2016. V. 92. P. 55–61.
Guldhe A., Ansari F.A., Singh P., Bux F. Heterotrophic cultivation of microalgae using aquaculture wastewater: A biorefinery concept for biomass production and nutrient remediation // Ecol. Eng. 2017. V. 99. P. 47–53.
Guo Z., Liu Y., Guo H., Yan S., Mu J. Microalgae cultivation using an aquaculture wastewater as growth medium for biomass and biofuel production // J. Environ. Sci. 2013. V. 25. P. S85–S88.
Hu B., Min M., Zhou W., Li Y., Mohr M., Cheng Y. Influence of exogenous CO2 on biomass and lipid accumulation of microalgae Auxenochlorella protothecoides cultivated in concentrated municipal wastewater // Appl. Biochem. Biotechnol. 2012. V. 166. P. 1661–1673.
Kalaji H.M., Schansker G., Ladle R.J., Kalaji V., Bosa K., Allakhverdiev S., Elsheery N.I., Ferroni L., Guidi L., Hogewoning S.W., Jajoo A., Misra A.N., Nebauer S.G., Pancaldi S., Penella C., Poli D.B., Pollastrini M., Romanowska-Duda Z.B., Rutkowska B., Serôdio J., Suresh K., Szulc W., Tambussi E., Yanniccari M., Zivcak M. Frequently asked questions about in vivo chlorophyll fluorescence: practical issues // Photosynth. Res. 2014. V. 122. P. 121–158.
Lazár D., Schansker G. Models of chlorophyll a fluorescence transients // Photosynthesis in Silico. Springer Netherlands. 2009. V. 29. P. 85–123.
Lee Y., Chen W., Shen H., Han D., Li Y., Jones H.D.T., Timlin J.A., Hu Q. Basic culturing and analytical measurement techniques // Handbook of Microalgal Culture: Applied Phycology and Biotechnology / Eds. Richmond A., Hu Q. New York: Blackwell Publishing Ltd., 2013. P. 37–68.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with the folin-phenol reagents // J. Biol. Chem. 1951. V. 193. P. 265–275.
Malla F.A., Khan S.A., Sharma G.K., Gupta N., Abraham G. Phycoremediation potential of Chlorella minutissima on primary and tertiary treated wastewater for nutrient removal and biodiesel production // Ecol. Eng. 2015. V. 75. P. 343–349.
Marsh J.B., Weinstein D.B. Simple charring method for determination of lipids // J. Lipid Res. 1966. V. 7. P. 574–576.
Mata T.M., Melo A.C., Simões M., Caetano N.S. Parametric study of a brewery effluent treatment by microalgae Scenedesmus obliquus // Bioresour. Technol. 2012. V. 107. P. 151–158.
Mohsenpour S.F., Hennige S., Willoughby N., Adeloye A., Gutierrez T. Integrating micro-algae into wastewater treatment: a review // Sci. Total Environ. 2021. V. 752. 142168. https://doi.org/10.1016/j.scitotenv.2020.142168
Nayak M., Karemore A., Sen R. Performance evaluation of microalgae for concomitant wastewater bioremediation, CO2 biofixation and lipid biosynthesis for biodiesel application // Algal Res. 2016. V. 16. P. 216–223.
Prašil O., Borowitzka M.A. Chlorophyll a Fluorescence in Aquatic Sciences: Methods and Applications. Dordrecht: Springer, 2011. 326 p.
Reitan K.I., Rainuzzo J.R., Øie G., Olsen Y. A review of the nutritional effects of algae in marine fish larvae // Aquaculture. 1997. V. 155. P. 207–221.
Schreiber U. Pulse-amplitude-modulation (PAM) fluorometry and saturation pulse method: an overview // Chlorophyll a Fluorescence: A Signature of Photosynthesis / Ed. G. Papageorgiou and Govindjee. Dordrecht: Springer, 2004. P. 279–319.
Strasser R.J., Tsimilli-Michael M., Srivastava A. Analysis of the chlorophyll a fluorescence transient // Chlorophyll a Fluorescence: A Signature of Photosynthesis / Ed. G. Papageorgiou and Govindjee. Dordrecht: Springer, 2004. P. 321–362.
Subramaniyam V., Ramraj S., Ganeshkumar V. Bioresource technology cultivation of Chlorella on brewery wastewater and nano-particle biosynthesis by its biomass // Bioresour. Technol. 2016. V. 211. P. 698–703.
Wang H., Xiong H., Hui Z., Zeng X. Mixotrophic cultivation of Chlorella pyrenoidosa with diluted primary piggery wastewater to produce lipids // Bioresour. Technol. 2012. V. 104. P. 215–220.
Zhang T.Y., Wu Y.H., Hu H.Y. Domestic wastewater treatment and biofuel production by using microalga Scenedesmus sp. ZTY1 // Water Sci. Technol. 2014. V. 69. P. 2492–2496.
Дополнительные материалы отсутствуют.


