Микробиология, 2022, T. 91, № 5, стр. 565-575
Функциональное состояние Coelastrella multistriata (Sphaeropleales, Chlorophyta) в накопительной культуре
С. Ю. Мальцева a, М. С. Куликовский a, Е. И. Мальцев a, *
a Институт физиологии растений им. К.А. Тимирязева Российской академии наук
127276 Москва, Россия
* E-mail: ye.maltsev@gmail.com
Поступила в редакцию 13.04.2022
После доработки 26.04.2022
Принята к публикации 10.05.2022
- EDN: GPUYTE
- DOI: 10.31857/S0026365622100299
Аннотация
Исследовано функциональное состояние накопительной культуры зеленой водоросли Coelastrella multistriata (Trenkwalder) Kalina et Puncochárová в течение 60-суточного культивирования. Установлено содержание хлорофиллов a, b и c, суммарных каротиноидов, протеина, витаминов А и Е. Дана оценка интенсивности процессов перекисного окисления липидов в клетках штамма C. multistriata MZ–Ch23 по содержанию продуктов пероксидации, реагирующих с 2-тиобарбитуровой кислотой. Определение этих продуктов проводили в биомассе микроводоросли на 15, 25 и 60 сут культивирования на среде BBM, а также после инициации перекисного окисления Fe2+. Среди фотосинтетических пигментов максимальное содержание показано для хлорофилла a во время экспоненциальной фазы роста – 14.82 мг/г сухой биомассы. Суммарное количество каротиноидов было сопоставимо с другими исследованными штаммами Coelastrella – в диапазоне 0.74–4.21% сухой массы. Для штамма MZ–Ch23 отмечена способность накапливать в высоких концентрациях ретинол (170.49–586.09 мкг/л культуры водоросли) и протеин (141.81–212.38 мг/л). Обнаружено, что во время всех фаз культивирования клетки C. multistriata характеризуются низкой концентрацией продуктов перекисного окисления липидов (0.005–0.015 нмоль/мг протеина), однако инициация перекисного окисления увеличивает количество ТБК-активных продуктов до 0.187 нмоль/мг протеина на 60 сут. Оптимальной стратегией для получения обогащенной вторичными метаболитами и устойчивой к перекисному окислению биомассы C. multistriata является культивирование на среде BBM в течении 25 сут. Это позволяет получать достаточное количество биомассы с высоким содержанием каротиноидов, протеина и витамина А.
Активное изучение возможности широкого использования водорослей в разных сферах биотехнологии (косметологии, сельском хозяйстве, производстве биотоплива) предполагает, что их биомасса станет очень ценным сырьем, т.к. водоросли не только способны накапливать значительные количества вторичных метаболитов, но и позволяют снизить площади задействованных сельскохозяйственных земель (Мокросноп, Золотарева, 2014; Maltsev et al., 2017; Jain et al., 2020). При этом разные таксономические группы водорослей могут решать различные биотехнологические задачи. Зеленые одноклеточные микроводоросли могут с успехом использоваться из-за быстрого роста вфотоавтотрофныхусловиях, высокого содержания насыщенных и мононенасыщенных жирных кислот, способности продуцировать большое количество триацилглицеринов (Hu et al., 2013; Maltsev et al., 2019, 2021c). Среди зеленых микроводорослей наиболее часто в качестве модельных объектов для определения биохимических характеристик и изучения продуктивности используются представители рода Coelastrella Chodat. Виды Coelastrella – это преимущественно одиночные, яйцевидной или эллипсоидной формы клетки с относительно толстой клеточной стенкой и многочисленными ребрами на ее поверхности, пристенным дольчатым хлоропластом и одним пиреноидом с крахмальной обверткой (Chodat, 1922). Среди основных биотехнологических преимуществ штаммов Coelastrella можно выделить: 1) способность одновременно накапливать большие концентрации липидов и каротиноидов (Abe et al., 2007; Minyuk et al., 2016, 2017); 2) высокое содержание витамина Е в биомассе (Mudimu et al., 2017); 3) растительный источник омега-3 полиненасыщенных жирных кислот с концентрацией более 50% (Lang et al., 2011; Maltsev et al., 2021a); 4) применение в очистке сточных вод сельского хозяйства (Li et al., 2018); 5) возможно получение из клеточных липидов высококачественного биодизеля, соответствующего стандарту EN14214 (Minyuk et al., 2017).
Клеточный метаболизм в нормальных и стрессовых условиях в различных клеточных компартментах производит АФК, которые могут повредить клеточные биомолекулы, включая липиды, белки и ДНК. В первую очередь АФК инициируют перекисное окисление полиненасыщенных жирных кислот с образованием перекисей липидов, которые могут негативно влиять на функциональное состояние клетки и снизить ее продуктивность в целом (Kaur et al., 2006). В связи с этим актуальным вопросом является поиск маркеров, которые позволят проводить оценку возможности длительного культивирования культур микроводорослей без потери целевых метаболитов в их биомассе. К таким маркерам можно отнести состав пигментов и его изменения в процессе выращивания (Pérez-Pérez et al., 2012). Содержание хлорофиллов является важным физиологическим параметром, который определяет активность фотосинтетического аппарата растений и их реакцию на неблагоприятные условия (Li et al., 2018). Каротиноиды, наряду с хлорофиллами, участвуют в фотосинтезе, а также обеспечивают фотозащиту и выступают в качестве низкомолекулярных антиоксидантов (Maltsev et al., 2021b). Индикаторами окислительного повреждения клеток водорослей, как следствия стрессовых условий, могут выступать продукты перекисного окисления липидов – малоновый диальдегид и другие цитотоксические соединения (ТБК-активные продукты) (Garg, Manchanda, 2009). В связи с этим концентрация ТБКаП используется в качестве одного из наиболее информативных маркеров оценки степени негативного воздействия на водоросли (Rijstenbil, 2002).
Во время изучения разнообразия микроводорослей отвалов гранитных карьеров был выделен и идентифицирован штамм C. multistriata MZ–Ch23. С этим штаммом проведен ряд экспериментов для оценки влияния продолжительности культивирования и состава питательной среды на накопление биомассы, содержание липидов и состав жирных кислот (Maltsev et al., 2021a). Установлено, что на стандартной среде BBM 25-суточное культивирование, которое соответствует началу стационарной фазы роста, позволяет получить высокие значения сухой биомассы (до 1.3 г/л) с максимальным содержанием полиненасыщенных жирных кислот (66.8% от общего количества жирных кислот) и омега-3 (57.9%), в частности. В спектре жирных кислот доминантными были 18:3n-3 α-линоленовая (38.12%), 16:3n-3 цис-7,10,13-гексадекатриеновая (19.61%) и 16:0 пальмитиновая (18.61%) кислоты. В то же время известно, что стационарная фаза роста у большинства микроорганизмов сопровождается снижением интенсивности метаболизма, переключением на катаболизм протеинов, а также экспрессию генов, отвечающих за биосинтез энзимов репарации, метаболизм антиоксидантов и транспорт нутриентов (Hecker, Völker, 2001).
Учитывая перспективные результаты по накоплению биомассы и составу жирных кислот штаммом C. multistriata MZ–Ch23 во время стационарной фазы роста, целью работы было проанализировать функциональное состояние клеток микроводоросли в накопительной культуре в течении 60 сут культивирования с помощью физиологических маркеров и определить оптимальное время, во время которого биомасса водоросли имеет наибольшую биотехнологическую ценность.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Для исследований был использован штамм зеленой водоросли Coelastrella multistriata (MZ–Ch23) из Коллекции культур водорослей и цианобактерий лаборатории молекулярной систематики водных растений Института физиологии растений им. К.А. Тимирязева РАН, выделенный из вскрышной породы молодого отвала на территории гранитного карьера Гурово (Тульская область, Россия).
Зрелые вегетативные клетки штамма имели эллипсоидную (10–12 × 6–8 мкм), реже шаровидную форму (диаметр 6–14 мкм). Клеточная стенка относительно толстая и бесцветная. Клетки с пристенным дольчатым хлоропластом и одним пиреноидом с крахмальной оберткой. Бесполое размножение осуществляется эллипсовидными или продолговато-яйцевидными автоспорами (6–8 × 4–6 мкм) (рис. 1).
Рис. 1.
Coelastrella multistriata MZ–Ch23: а – молодые вегетативные клетки; возраст культуры 15 сут; б – зрелая вегетативная клетка в окружении молодых клеток; возраст культуры 25 сут; стрелка указывает на спорангий; в – зрелые вегетативные клетки; возраст культуры 60 сут. Масштабная метка – 10 мкм.

Нуклеотидные последовательности представлены в GenBank: участок V4 18S рДНК – номер доступа MZ620281, участок ITS1–5.8S рДНК–ITS2 – номер доступа MZ620280 (Maltsev et al., 2021a).
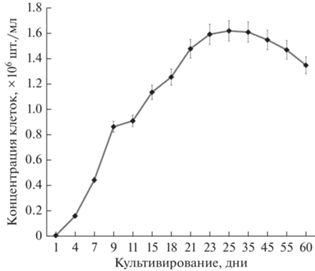
В ходе эксперимента штамм выращивали в колбах объемом 250 мл с 150 мл среды BBM (Bischoff, Bold, 1963) и 10 мл инокулята с концентрацией клеток 0.18 ± 0.01 × 106 шт./мл. После смешивания инокулята со средой концентрация клеток была 0.012 ± 0.001 × 106 шт./мл (рис. 2). Культивирование осуществляли в 15 колбах – 5 повторов для сбора биомассы во время трех фаз роста. Концентрацию клеток измеряли с помощью автоматического счетчика клеток Bio-Rad TC20™ (“Bio-Rad”, США); для каждого измерения отбирали 10 мкл суспензии согласно рекомендациям производителя. Микроводоросли культивировали с помощью орбитальных шейкеров ELMI Sky Line Shaker S-3L (Латвия) с постоянным перемешиванием при 150 об./мин в течение 60 сут; pH суспензии определяли с помощью настольного pH-метра Ohaus a-AB33PH (США). Изучение биохимических показателей проводили во время экспоненциальной фазы роста (15 сут культивирования), в начале стационарной фазы (25 сут) и после длительного выращивания (60 сут) (Mal-tsev et al., 2021a). Интенсивность света составляла 70 мкмоль фотонов/(м2 с) с режимом освещения (ч) 16 : 8 день/ночь. Перед определением биохимических характеристик клетки водорослей отмывали от среды дистиллированной водой, осаждали центрифугированием (4000 об./мин, 10 мин) и удаляли жидкость над осадком. Операцию повторяли три раза.
Рис. 2.
Кривая роста штамма Coelastrella multistriata MZ–Ch23. На панели указана стандартная ошибка среднего.
Содержание хлорофиллов a, b и c определяли экстрактно-фотометрическим методом (Jeffrey, Humphrey, 1974). Для этого 5 мг биомассы водорослей подвергали замораживанию-размораживаю для частичного разрушения клеток. Количество используемой в анализе биомассы обусловлено чувствительностью метода Jeffrey, Humphrey (1974), который позволяет достоверно определить концентрацию пигментов от 0.2 мкг/мл. После разрушения клеток биомассу гомогенизировали в 4 мл 90% ацетона (“PanReac AppliChem”, Испания) с кварцевым песком, и оставляли для экстракции на 24 ч в герметичной пробирке без доступа света при температуре 25°С. Далее экстракт отделяли от осадка центрифугированием (6000 об./мин, 10 мин) и проводили измерения на спектрофотометре Ulab 102 (“Ulab”, Китай) относительно ацетона при длинах волн 664, 647 и 630 нм, что соответствует максимуму поглощения для Хл a, b и c соответственно. Измерения выполняли с использованием программного обеспечения MetaSpec Pro v 2.2 в режиме “Multi-wavelength Analysis”. Вычисление содержания хлорофиллов проводили по формулам и выражали в мг/г сухой биомассы:
Содержание каротиноидов определяли экстрактно-фотометрическим методом (Dere et al., 1998). Для этого 5 мг биомассы подвергали замораживанию-размораживанию, после чего растирали с кварцевым песком в 4 мл 100% ацетона. Полученный гомогенат оставляли на 24 ч в темном месте в герметично закрытой посуде для полного извлечения каротиноидов. После этого экстракт отделяли от обломков клеток центрифугированием (6000 об./мин, 10 мин) и проводили измерения на спектрофотометре при длине волны 470 нм, что соответствует максимуму поглощения каротиноидов в 100% ацетоне. Расчет проводили по формуле и выражали в мг/г сухой биомассы:
Содержание витаминов определяли методом тонкослойной хроматографии (Hossu et al., 2006). Предварительно 30 мг биомассы водорослей подвергали омылению в 0.5 н. растворе КОН в этаноле (“Sigma-Aldrich”, США). Для этого биомассу помещали в виалу и добавляли 1 мл спиртового раствора КОН, 10 мг аскорбиновой кислоты (“Диаэм”, Россия) и омыляли при температуре 90°С в течение 30 мин. Далее из полученного гидролизата экстрагировали спиртовые формы ретинола и α-токоферола путем многостадийной экстракции гексаном (“Sigma-Aldrich”, США). Для этого экстракцию проводили 4 раза, добавляя по 1.0, 1.0, 1.0 и 0.5 мл гексана к гидролизату, после чего смесь отстаивали и декантировали гексановый экстракт. Объединенные экстракты промывали дистиллированной водой до нейтральной реакции по универсальной индикаторной бумаге. Далее экстракт упаривали в вакууме при температуре 55–60°С. Полученный сухой остаток растворяли в 100 мкл бензола (“PanReac AppliChem”, Испания) и наносили в объеме 10 мкл на линию старта пластины для тонкослойной хроматографии (силикагель 60; “Sigma-Aldrich”, США), и хроматографировали. В качестве подвижной фазы использовали хлороформ (“Sigma-Aldrich”, США), дистанция прохода растворителя 8.5 см, для детектирования положения пятен витаминов рядом с исследуемыми образцами наносили раствор стандартных веществ. Для проявления веществ использовали детектирующий 1%-раствор фосфорномолибденовой кислоты (“ЛенРеактив”, Россия) в этаноле, в который погружали пластины на 10 с, после чего просушивали от растворителя и прогревали в термостате 5 мин при 100°С. Витамины проявлялись в виде синих пятен на желтом фоне, обесцвечивание фона проводили путем выдерживания пластины в парах аммиака в течении 20 с. Далее пластины сканировали и измеряли площадь и высоту пиков в программе Sorbfil TLC Videodensitometr v2.3.0. Концентрацию определяли путем сравнения с калибровочным графиком, построенным с использованием стандартных растворов ретинола (“Sigma-Aldrich”, США) и α-токоферола (“Sigma-Aldrich”, США), которые разделяли и детектировали на пластине в аналогичных с исследуемыми пробами условиях.
Определение содержания протеинов проводили бицинхониновым методом (Jain et al., 2020). Для этого 10 мг биомассы подвергали замораживанию-размораживанию и гомогенизировали с кварцевым песком в среде 1 мл этанола для экстракции и удаления хлорофиллов и липофильных веществ. Далее экстракт отделяли от осадка центрифугированием (6000 об./мин, 10 мин), осадок ресуспендировали в 1 мл экстрагирующего фосфатного буфера (0.1 М, pH 7.5, SDS 0.5%; “Sigma-Aldrich”, США) и оставляли на 12 ч при температуре 25°С. Для построения калибровочного графика использовали стандартный раствор бычьего сывороточного альбумина (“Thermo Scientific”, США).
Содержание ТБК-активных продуктов определяли по их способности образовывать в кислой среде при нагревании окрашенный комплекс с 2‑тиобарбитуровой кислотой (Zeb, Ullah, 2016). Экстракцию ТБК-активных продуктов проводили 1.2% раствором хлорида калия (“PanReac AppliChem”, Испания). Для этого к 0.1 г биомассы водорослей добавляли 0.9 мл хлорида калия и гомогенизировали с кварцевым песком. Для отделения супернатанта от осадка гомогенат центрифугировали (9000 об./мин, 15 мин).
Для определения содержания ТБКаП в исходном гомогенате к 0.2 мл экстракта прибавляли 1.6 мл фосфатного буфера (0.5 М, pH 7.35) и 1 мл раствора 2-тиобарбитуровой кислоты (“Sigma-Aldrich”, США), приготовленной на ледяной уксусной кислоте. После этого смесь нагревали 60 мин при 95°С. Далее реакционную среду охлаждали до комнатной температуры и измеряли оптическую плотность при 532 нм.
Также определяли содержание ТБКаП при индукции процессов пероксидного окисления липидов (ТБКаПин). В реакционную среду, которая содержала 0.2 мл гомогената и 1.5 мл фосфатного буфера добавляли 0.1 мл 1% раствора сульфата железа ІІ (“ЛенРеактив”, Россия) и инкубировали 30 мин при температуре 37°С. Для определения ТБКаПин проводили аналогичные действия, описанные выше. Для расчета концентрации использовали следующую формулу:
где С – концентрация ТБКаП (нмоль/г); D – оптическая плотность; 28 и 31.2 – коэффициенты, учитывающие специфическое молярное поглощение триметинового комплекса ТБК с ТБК-активными продуктами и степень разведения (для объема инкубационной среды – 2.8 мл).
Все измерения были проведены в пяти повторностях, числа в табл. 1 и 2 показывают среднюю величину и ошибку средней. Статистические данные получены в программе Microsoft Excel (v. 1903).
Таблица 1.
Биохимические показатели сухой биомассы Coelastrella multistriata в зависимости от продолжительности культивирования (M ± m; n = 5)
| Параметр | Экспоненциальная фаза (15 сут) |
Стационарная фаза (25 сут) |
Длительное выращивание (60 сут) |
|||
|---|---|---|---|---|---|---|
| масса | % | масса | % | масса | % | |
| Хлорофилл a | 14.82 ± 0.74 мг/г | 1.48 | 6.83 ± 0.34 мг/г | 0.68 | 0.32 ± 0.14 мг/г | 0.03 |
| Хлорофилл b | 7.05 ± 0.34 мг/г | 0.71 | 1.52 ± 0.08 мг/г | 0.15 | 0.50 ± 0.16 мг/г | 0.05 |
| Хлорофилл c1 + c2 | 1.59 ± 0.07 мг/г | 0.16 | 2.74 ± 0.14 мг/г | 0.27 | 0.41 ± 0.15 мг/г | 0.04 |
| Каротиноиды | 7.42 ± 0.37 мг/г | 0.74 | 11.34 ± 3.26 мг/г | 1.14 | 42.11 ± 2.11 мг/г | 4.21 |
| Ретинол | 167.15 ± 8.34 мкг/г | – | 342.74 ± мкг/г | – | 219.82 ± 5.74 мкг/г | – |
| α-Токоферол | 15.81 ± 0.78 мкг/г | – | 22.70 ± 4.10 мкг/г | – | 58.36 ± 2.92 мкг/г | – |
| Протеин | 198.91 ± 9.93 мг/г | 19.89 | 122.20 ± 3.91 мг/г | 12.42 | 97.76 ± 4.89 мг/г | 9.78 |
| ТБКаП | 0.91 ± 0.04 нмоль/г 0.005 нмоль/мг протеина |
– | 1.27 ± 0.06 нмоль/г 0.011 нмоль/мг протеина |
– | 1.45 ± 0.63 нмоль/г 0.015 нмоль/мг протеина |
– |
| ТБКаПин | 1.32 ± 0.07 нмоль/г 0.007 нмоль/мг протеина |
– | 2.56 ± 0.12 нмоль/г 0.021 нмоль/мг протеина |
– | 18.28 ± 3.95 нмоль/г 0.187 нмоль/мг протеина |
– |
Таблица 2.
Биохимические показатели суспензии Coelastrella multistriata в зависимости от продолжительности культивирования (M ± m; n = 5)
| Параметр | Экспоненциальная фаза (15 сут) |
Стационарная фаза (25 сут) |
Длительное выращивание (60 сут) |
|---|---|---|---|
| Биомасса, г/л | 1.02 ± 0.05 | 1.71 ± 0.06 | 1.45 ± 0.06 |
| Количество клеток, ×106 шт./мл | 11.31 ± 0.45 | 16.15 ± 0.47 | 13.44 ± 0.57 |
| pH | 8.55 ± 0.45 | 9.22 ± 0.46 | 9.41 ± 0.57 |
| Хлорофилл a, мг/л | 15.1 ± 0.77 | 11.63 ± 0.58 | 0.44 ± 0.03 |
| Хлорофилл b, мг/л | 7.24 ± 0.36 | 2.57 ± 0.13 | 0.73 ± 0.04 |
| Хлорофилл c1 + c2, мг/л | 1.63 ± 0.08 | 4.62 ± 0.23 | 0.58 ± 0.03 |
| Каротиноиды, мг/л | 7.55 ± 0.38 | 19.49 ± 0.96 | 61.05 ± 3.05 |
| Ретинол, мкг/л | 170.49 ± 8.53 | 586.09 ± 29.31 | 318.74 ± 15.98 |
| α-Токоферол, мкг/л | 16.13 ± 0.82 | 38.82 ± 1.94 | 84.62 ± 4.25 |
| Протеин, мг/л | 202.88 ± 10.15 | 212.38 ± 10.62 | 141.81 ± 7.12 |
| ТБКаП, нмоль/л | 0.93 ± 0.05 | 2.17 ± 0.11 | 2.48 ± 0.12 |
| ТБКаПин, нмоль/л | 1.35 ± 0.07 | 4.38 ± 0.22 | 31.30 ± 1.57 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Хлорофиллы являются важными пигментами поглощения световой энергии для фотосинтеза, высокая интенсивность которого способствует увеличению биомассы клеток при благоприятных условиях роста. В результате исследований установлено, что штамм C. multistriata MZ–Ch23 продуцировал максимальное количество хлорофиллов в экспоненциальной (“зеленой”) фазе роста – 2.35% сухой массы (табл. 1), а наибольшая концентрация Хл а достигала 14.82 мг/г или 1.48%. После перехода культуры в стационарную (“красную”) фазу количество хлорофиллов снижалось до 1.1%, а к 60 сут опускалось до 0.12%. При этом после длительного культивирования происходило изменение состава хлорофиллов – на первое место по содержанию выходит Хл b, а далее с немного меньшим значением следует Хл c. Примечательно, что для штаммов Coelastrella и ранее было показано значительное снижение содержания Хл а, Хл b в стационарной фазе роста по сравнению с экспоненциальной (Abe et al., 2007; Minyuk et al., 2016, 2017). В частности, Abe et al. (2007) установили, что для штамма C. striolata var. multistriata (Trenkwalder) Kalina et Puncochárová в логарифмической фазе роста содержание Хл а варьировало от 0.75 до 15–18 мг/г сухой массы, а Хл b – до 6.0 мг/г. Отмечено, что кривая изменения концентрации Хл а зависела от объема реактора и времени инкубации, и максимальное содержание Хл а достигалось через 10‒20 сут от начала культивирования. После перехода культуры в стационарную фазу содержание Хл а и Хл b опускалось до 0.3 мг/г, что по значениям очень близко к полученным нами результатам на 60 сут (табл. 1). В то же время для штамма C. rubescens IPPAS H-350 установлено, что в начале культивирования содержание хлорофиллов находилось на уровне 5.8% сухой массы для Хл а и 2.2% для Хл b (Minyuk et al., 2016, 2017), а в стационарной фазе отмечено снижение количества пигментов до уровня 0.2–0.5 и 0.2–0.25% в зависимости от условий и времени инкубирования. Следовательно, полученные нами результаты по количеству хлорофилла в конце культивирования сопоставимы с данными по штамму Coelastrella striolata var. multistriata (Abe et al., 2007). При этом их содержание в экспоненциальной фазе было в 3 и более раз меньше по сравнению с показателями для C. rubescens (Vinatzer) Kaufnerová et Eliás (Minyuk et al., 2016, 2017). Значительные отличия по содержанию хлорофиллов могут быть связаны с различными условиями выращивания культуры и в первую очередь – с интенсивностью освещения. Abe et al. (2007) показали, что повышение интенсивности освещения с 13 до 40 мкмоль фотонов/(м2 с) сопровождалось увеличением количества Хл а в 1.8 раз. В нашем исследовании штамм C. multistriata MZ–Ch23 культивировали при интенсивности освещения 70 мкмоль фотонов/(м2 с), в работе Abe et al. (2007) интенсивность освещения составляла 65 мкмоль фотонов/(м2 с), в то время как штамм C. rubescens IPPAS H-350 выращивали под воздействием света большей интенсивности: 136–140 мкмоль фотонов/(м2 с) (Minyuk et al., 2016, 2017), что может обусловливать описанные отличия в результатах.
Показательной характеристикой культур микроводорослей является количество синтезируемых метаболитов в единице объема культивируемой суспензии. Культура штамма C. multistriata MZ–Ch23 содержала от 2.57 до 11.63 мг/л хлорофиллов через 25 сут культивирования (табл. 2). Эти данные значительно превосходят объемную концентрацию Хл а у штамма Coelastrella sp. после 16 сут выращивания в стрессовых условиях, вызванных введением в питательную среду ADSW ионов Сu2+ с концентрацией 1–3 мг/л (Li et al., 2018). Поддержание культур микроводорослей в стационарной фазе роста может оказывать схожее воздействие на физиологические процессы в клетке, как и стрессирование во время экспоненциальной фазы. В данном случае воздействие высоких доз меди частично моделирует процессы, происходящие в “красной” фазе роста, а именно, запуск процессов биосинтеза факторов репарации и метаболизма антиоксидантов, поскольку медь, накапливаясь в клетках, приводит к генерации АФК, которые вызывают антиоксидантный ответ (İşeri et al., 2011).
Так же нами впервые установлено накопление Хл c для представителей рода Coelastrella, о чем не сообщалось ранее. Хлорофилл с является дополнительным пигментом, присутствует у многих фотосинтезирующих организмов (Jeffrey et al., 2011) и выполняет функцию фотоконцентрации и передачи энергии в реакционный центр (Blankenship, 2002). Накопление Хл c штаммом C. multistriata MZ–Ch23 во время стационарной фазы роста в количестве 0.41–2.74 мг/г на фоне активации синтеза вторичных метаболитов (каротиноидов) может быть компенсаторной реакцией, направленной на поддержание фотосинтетических процессов при снижении содержания Хл а и Хл b (табл. 1). Поскольку Хл c не имеет изопреноидного хвоста (Blankenship, 2002; Jeffrey et al., 2011), его биосинтез, в отличие от Хл а, Хл b и каротиноидов, не требует вовлечения изопреноидных фрагментов. Соответственно, переключение на синтез Хл c при активации каротиногенеза может быть одним из механизмов адаптации к неблагоприятным условиям, которыми характеризуется стационарная фаза роста, поскольку наступает в результате нехватки питательных веществ или других стресс-факторов (Hecker, Völker, 2001).
Накопление каротиноидов является результатом активации метаболизма антиоксидантов (Hecker, Völker, 2001) и направлено на снижение негативного воздействия стрессорных факторов, поскольку каротиноиды обладают более сильными антиоксидантными свойствами, нежели другие внутриклеточные антиоксиданты, например, α‑токоферол и витамин С (Sies et al., 1992; Del Mondo et al., 2020). В частности, β-каротин играет важную роль в виолоксантиновом цикле светозащиты, является антиоксидантом, обеспечивающим нейтрализацию АФК и триплетного хлорофилла (Smerilli et al., 2016; Toti et al., 2018). Причем для некоторых высших растений установлен механизм прямого преобразования β-каротина в зеаксантин, который позволяет избежать фотоингибирования (Wright et al., 2011). Зачастую ответом на излишнее образование АФК, которое наблюдается в стационарной фазе роста, является снижение содержания ненасыщенных жирных кислот в клетке (Pamplona, 2008). Поскольку ранее в биомассе C. multistriata MZ–Ch23 было установлено высокое содержание ненасыщенных жирных кислот (78.84% от их общего количества; Maltsev et al., 2021a), можно предположить, что исследованный штамм имеет другой механизм повышения устойчивости к действию свободных радикалов, например, за счет накопления большого количества низкомолекулярных антиоксидантов (в том числе каротиноидов). В целом для штамма C. multistriata MZ–Ch23 установлено общее содержание каротиноидов на уровне 7.42–42.11 мг/г (0.74–4.21% сухой массы) и увеличение их содержания с возрастом культуры. Подобная тенденция установлена для штамма Coelastrella sp. F50, который показал возможность накопления каротиноидов до 4.08% сухой биомассы (Hu et al., 2013). Abe et al. (2007) сообщают, что штамм C. striolata var. multistriata характеризовался суммарным содержанием β-каротина, кантаксантина и астаксантина в количестве 0.84% сухой биомассы во время “зеленой” фазы роста и увеличением этого значения до 5.6% во время “красной”, что незначительно превышает полученный нами результат. При этом такие высокие результаты для C. striolata var. multistriata по накоплению каротиноидов удалось получить при освещении 65 мкмоль фотонов/(м2 с) и увеличении в 2 раза (до 500 мг/л) концентрации NaNO3 в среде BBM (Abe et al., 2007). В тоже время для штамма C. rubescens IPPAS H-350 отмечена противоположная тенденция, а именно уменьшение количества каротиноидов с возрастом культуры – с 1.8% во время экспоненциальной фазы и до 0.6% во время “красной” (Minyuk et al., 2016, 2017).
Витамин А (ретинол) является продуктом вторичного метаболизма микроводорослей, прекурсором которого выступают каротиноиды (Toti et al., 2018). Ретинол и его окисленные формы обеспечивают важные функции в организме человека и животных: способствуют дифференциации и росту тканей, выполняют репродуктивную, иммунную и рецепторную функцию, проявляют антиоксидантные свойства (Imdad et al., 2017). Для зеленых водорослей установлена способность синтезировать витамин А в широком диапазоне от 10 до 4280 мкг/г сухой биомассы (Santiago-Morales et al., 2018; Del Mondo et al., 2020). При этом исследованный штамм C. multistriata характеризовался способностью к накоплению витамина А в пределах 167.15–342.74 мкг/г с максимальным значением на 25 сут культивирования. Анализ объемного содержания, которое является более показательным выражением продуктивности штамма, показывает возможность получения ретинола до 586.09 мкг/л культуры водоросли после 25 сут культивирования (табл. 2).
Витамин Е (α-токоферол) играет очень важную функцию в клетках микроводорослей – является антиоксидантом и, наряду с β-каротином, препятствует возникновению фотоокислительного стресса (Del Mondo et al., 2020). Как и витамин А, α-токоферол в клетках зеленых водорослей продуцируется в разном количестве: известна способность некоторых видов Chlorophyta накапливать витамин Е до 785 мкг/г (Mudimu et al., 2017). В биомассе штамма MZ–Ch23 обнаружено небольшое количество α-токоферола: 15.81–58.36 мкг/г сухой массы. Данный показатель сопоставим с результатами, полученными для штаммов Enallax costatus SAG 46.88 (19.22 мкг/г), Scenedesmus vacuolatus SAG 211-11 m (43.65 мкг/г) и Tetradesmus obliquus SAG 276–1 (50.82 мкг/г) во время стационарной фазы при выращивании на среде BBM с утроенной концентрацией нитратов (Mudimu et al., 2017). При этом другие штаммы рода Coelastrella продуцируют значительно больше α-токоферола: 424.35 мкг/г (C. terrestris SAG 477a), 508.28 мкг/г (C. oocystiformis SAG 277–1) и 509.11 мкг/г (C. rubescens SAG 475a) (Mudimu et al., 2017). В целом отмечено, что значительное накопление α‑токоферола чаще наблюдается во время стационарной фазы роста по сравнению с логарифмической, что обусловливается активацией вторичного метаболизма антиоксидантных веществ в более стрессовых условиях “красной” фазы (Hecker, Völker, 2001; Mudimu et al., 2017). В то же время относительно низкое содержание α-токоферола у штамма MZ–Ch23 может быть связано с активацией биосинтеза каротиноидов, для образования которых используются изопреноидные фрагменты (DellaPenna, Pogson, 2006). Установлено, что изопреноидные фрагменты расходуются в первую очередь на биосинтез продуктов с большей антиоксидантной активностью – в данном случае это будут каротиноиды, а не витамин Е (Sies et al., 1992; Del Mondo et al., 2020). С другой стороны, как указано выше, у штамма MZ–Ch23 стационарная фаза роста характеризуется низким содержанием хлорофилла, что приводит к снижению интенсивности фотосинтетических процессов, и, соответственно, биосинтеза α-токоферола, поскольку он может синтезироваться только в условиях активного фотосинтеза (Мокросноп, Золотарева, 2014).
Ранее для штаммов Coelastrella было установлено содержание протеина в сухой биомассе на уровне 317.7 мг/г во время экспоненциальной фазы и снижение до 104.9 мг/г в стационарной (Minyuk et al., 2017). Считается, что такое снижение является типичным для стрессированных каротиногенных клеток микроводорослей, а в конкретном случае у штамма C. rubescens IPPAS H-350 вызвано 10-кратным уменьшением концентрации азота и фосфора в стандартной среде ВВМ. В таких условиях падение количества белка в клетке может быть связано с нехваткой азота и его перераспределением путем аутофагии, вызванной стрессом (Pérez-Pérez et al., 2012; Minyuk et al., 2017). Также для штамма Coelastrella sp. известно объемное содержание белка равное 180 мг/л во время стационарной фазы роста на среде ADSW (Li et al., 2018). Показатели, полученные нами для штамма MZ–Ch23 (табл. 1, 2), характеризуют его как более продуктивный в контексте накопления белка в стационарной фазе по сравнению со штаммом IPPAS H-350 (Minyuk et al., 2017). Исследуемый штамм C. multistriata имел более высокие показатели как в количестве белка в сухой биомассе (122.2 мг/г по сравнению с 104.9 у штамма C. rubescens), так и в объемном отношении (212.39 мг/л по сравнению с 83.4 в стационарной фазе, 202.88 и 54.8 мг/л в экспоненциальной фазе у штамма C. rubescens).
Содержание ТБК-активных продуктов может косвенно отражать интенсивность пероксидных процессов в клетке, а также указывать на состояние системы антиоксидантной защиты, поскольку генерируемые АФК атакуют жирные кислоты липидов и приводят к накоплению ТБК-активных продуктов и пероксидов липидов (Wang et al., 2017; Li et al., 2018). Исследуемый штамм C. multistriata MZ–Ch23 на всех фазах роста характеризовался низким исходным содержанием ТБКаП – 0.005–0.015 нмоль/мг протеина с наивысшим значением на 60-е сутки. Индукция пероксидного окисления липидов ионами Fe2+ привела к увеличению количества ТБКаПин в 1.4–12.5 раз (табл. 1). Небольшая разница между ТБКаП и ТБКаПин во время экспоненциальной и стационарной фаз указывает на функциональную стабильность клеток и устойчивость к стрессу. Наибольший эффект оказывает стимулирование пероксидного окисления в конце культивирования – ТБКаПин возросло до 0.187 нмоль/мг протеина. Такого рода изменения показывают низкую устойчивость штамма к оксидативному стрессу в это время, что может быть связано со значительным содержанием ненасыщенных жирных кислот в клетках (до 78.84%), которые, как известно, являются основным субстратом липопероксидации (Gamliel et al., 2008; Galván, 2017). В данном случае длительное воздействие факторов, запускающих процессы липопероксидации, постепенно приведут к истощению внутримолекулярных антиоксидантов, а в последствии и к гибели клетки. В то же время, если сравнить содержание ТБКаП в клетках других штаммов Coelastrella, то результат покажет перспективность использования в биотехнологии штамма MZ–Ch23. Так, концентрация ТБКаП в интактных клетках штамма Coelastrella sp. составила 0.705 нмоль/мг протеина, что более чем в 30 раз выше полученных нами результатов (Li et al., 2018). Последующее 16-сут инкубирование данного штамма в среде ADSW с добавлением Сu2+ приводило к значительному повышению концентрации ТБКаП до 3.3–6.5 нмоль/мг протеина, что свидетельствует о накоплении в клетках меди и, соответственно, активации пероксидных процессов. Результатом угнетения процессов антиоксидантной защиты стало значительное снижение содержания ненасыщенных жирных кислот в составе липидов клеток (Li et al., 2018).
Известно, что представители рода Coelastrella относятся к стенобионтным микроводорослям по отношению к кислотности среды при культивировании (Minyuk et al., 2016). На примере штамма C. rubescens IPPAS H-350 показано, что оптимум рН среды находится в диапазоне 6.0–7.0. В этих условиях скорость роста, содержание Хл а, суммарных каротиноидов и полиненасыщенных жирных кислот были самыми высокими (Minyuk et al., 2016). При выполнении эксперимента в накопительной культуре штамма MZ–Ch23 нами было отмечено быстрое защелачивание суспензии до рН 9.22 уже на 25 сут культивирования (табл. 2), в то время как в начале выращивания значение pH было 6.90. На 60 сут культивирования отмечено наибольшее смещение pH в сторону высоких значений (pH 9.41) Следует отметить, что культура C. multistriata показала меньшую способность к защелачиванию среды, чем с C. rubescens, в суспензии которой значение pH достигало 10.5 во время выращивания без обогащения культуры СО2 (Minyuk et al., 2016). В дальнейшем будет продолжена работа по изучению влияния изменения pH среды на функциональное состояние клеток C. multistriata.
В целом, предыдущие наши отчеты и настоящее исследование показывают, что биохимические характеристики биомассы штамма C. multistriata MZ–Ch23 являются ценными с точки зрения биотехнологического использования. Перспективным представляется его культивирование на стандартной среде BBM в течение ранней стационарной фазы. Именно 25-сут культивирование позволяет получить биомассу, с одной стороны, богатую биологически активными веществами (в первую очередь омега-3 жирными кислотами, каротиноидами, витамином А и протеином), а с другой – устойчивую к пероксидному окислению липидов. На основании вышеизложенного можно сделать общий вывод, что для штаммов Coelastrella стрессирование условий культивирования изменением состава питательной среды или добавлением тяжелых металлов является нерациональным подходом, поскольку приводит к ухудшению качества культуры, расходованию антиоксидантных субстратов на подавление усиливающихся процессов пероксидного окисления липидов, и как следствие – к перестройке метаболизма липидов на снижение количества ненасыщеных жирных кислот.
Список литературы
Мокросноп В.М., Золотарева Е.К. Микроводоросли как продуценты токоферолов // Biotechnol. Acta. 2014. V. 7. P. 26–33.
Abe K., Hattori H., Hirano M. Accumulation and antioxidant activity of secondary carotenoids in the aerial microalga Coelastrella striolata var. multistriata // Food Chem. 2007. V. 100. P. 656–661. https://doi.org/10.1016/j.foodchem.2005.10.026
Bischoff H.W., Bold H.C. Phycological studies IV. Some Soil Algae from Enchanted Rock and Related Algal Species. University of Texas Publication 6318, 1963. 95 p.
Blankenship R.E. Molecular Mechanisms of Photosynthesis. Hoboken: Wiley Blackwell, 2002. 321 p.
Chodat R. Matériaux pour l’histoire des algues de la Suisse // Bulletin de la Société Botanique de Geneve, série 2. 1922. V. 13. P. 66–114.
Del Mondo A., Smerilli A., Sané E., Sansone C., Brunet C. Challenging microalgal vitamins for human health // Microb. Cell Fact. 2020. V. 19. 201. https://doi.org/10.1186/s12934-020-01459-1
DellaPenna D., Pogson B.J. Vitamin synthesis in plants: tocopherols and carotenoids // Annu. Rev. Pl. Biol. 2006. V. 57. P. 711–738. https://doi.org/10.1146/annurev.arplant.56.032604.144301
Dere Ş., Güneş T., Sivaci R. Spectrophotometric determination of chlorophyll – A, B and total caretenoid contents of some algae species using different solvents // Tr. J. Botany. 1998. V. 22. P. 13–17.
Hecker M., Völker U. General stress response of Bacillus subtilis and other bacteria // Adv. Microbial Physiol. 2001. V. 44. P. 35–91. https://doi.org/10.1016/S0065-2911(01)44011-2
Hossu A.-M., Rădulescu C., Ilie M, Bălălău D., Magearu V. Qualitative and semiquantitative TLC analysis of vitamins A, D and E // Revista de Chimie. 2006. V. 57. P. 1188–1189.
Hu C.-W., Chuang L.-T., Yu P.C., Chen C.-N.N. Pigment production by a new thermotolerant microalga Coelastrella sp. F50 // Food Chem. 2013. V. 138. P. 2071–2078. https://doi.org/10.1016/j.foodchem.2012.11.133
Galván I. Evidence of evolutionary optimization of fatty acid length and unsaturation // J. Evol. Biol. 2017. V. 31. P. 172–176. https://doi.org/10.1111/jeb.13198
Gamliel A., Afri M., Frimer A.A. Determining radical penetration of lipid bilayers with new lipophilic spin traps // Free Rad. Biol. Med. 2008. V. 44. P. 1394–1405. https://doi.org/10.1016/j.freeradbiomed.2007.12.028
Garg N., Manchanda G. ROS generation in plants: boon or bane? // Plant Biosyst. 2009. V. 143. P. 81–96. https://doi.org/10.1080/11263500802633626
Imdad A., Mayo-Wilson E., Herzer K., Bhutta Z.A. Vitamin A supplementation for preventing morbidity and mortality in children from six months to five years of age // Cochrane Database Syst. Rev. 2017. CD008524. https://doi.org/10.1002/14651858.cd008524.pub3
İşeri Ö.D., Körpe D.A., Yurtcu E., Sahin F.I., Haberal M. Copper-induced oxidative damage, antioxidant response and genotoxicity in Lycopersicum esculentum Mill. and Cucumis sativus L. // Plant. Cell. Rep. 2011. V. 30. 1713. https://doi.org/10.1007/s00299-011-1079-x
Jain A., Jain R., Jain S. Basic Techniques in Biochemistry, Microbiology and Molecular Biology. N.Y.: Springer, 2020. 282 p. https://doi.org/10.1007/978-1-4939-9861-6
Jeffrey S.W., Humphrey G.F. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton // Biochem. Physiol. Pflanzen. 1974. V. 167. P. 191–194. https://doi.org/10.1016/S0015-3796(17)30778-3
Jeffrey S., Wright S., Zapata M. Microalgal classes and their signature pigments // Phytoplankton Pigments: Characterization, Chemotaxonomy and Applications in Oceanography (Cambridge Environmental Chemistry Series) / Eds. Roy S., Llewellyn C., Egeland E., Johnsen G. Cambridge: Cambridge University Press, 2011. P. 3.
Kaur G., Alam M.S., Jabbar Z., Javed K., Athar M. Evaluation of antioxidant activity of Cassia siamea flowers // J. Ethnopharmacol. 2006. V. 108. P. 340–348. https://doi.org/10.1016/j.jep.2006.05.021
Lang I., Hodac L., Friedl T., Feussner I. Fatty acid profiles and their distribution patterns in microalgae: a comprehensive analysis of more than 2000 strains from the SAG culture collection // BMC Pl. Biol. 2011. V. 11. 124. https://doi.org/10.1186/1471-2229-11-124
Li X., Yang W.L., He H., Wu S., Zhou Q., Yang C., Zeng G., Lou L., Lou W. Responses of microalgae Coelastrella sp. to stress of cupric ions in treatment of anaerobically digested swine wastewater // Bioresour. Technol. 2018. V. 251. P. 274–279. https://doi.org/10.1016/j.biortech.2017.12.058
Maltsev Y.I., Konovalenko T.V., Barantsova I.A., Maltseva I.A., Maltseva K.I. Prospects of using algae in biofuel production // Regul. Mech. Biosyst. 2017. V. 8. P. 455–460. https://doi.org/10.15421/021770
Maltsev Y., Krivova Z., Maltseva S., Maltseva K., Gorshkova E., Kulikovskiy M. Lipid accumulation by Coelastrella multistriata (Scenedesmaceae, Sphaeropleales) during nitrogen and phosphorus starvation // Sci. Rep. 2021a. V. 11. 19818. https://doi.org/10.1038/s41598-021-99376-9
Maltsev Y., Maltseva K., Kulikovskiy M., Maltseva S. Influence of light conditions on microalgae growth and content of lipids, carotenoids and fatty acid composition // Biology. 2021b. V. 10. 1060. https://doi.org/10.3390/biology10101060
Maltsev Y.I., Maltseva I.A., Kulikovskiy M.S., Maltseva S.Yu., Sidorov R.A. Analysis of a new strain of Pseudomuriella engadinensis (Sphaeropleales, Chlorophyta) for possible use in biotechnology // Russ. J. Plant Physiol. 2019. V. 66. P. 609–617. https://doi.org/10.1134/S1021443719040083
Maltsev Y., Maltseva I., Maltseva S., Kociolek J.P., Kulikovskiy M. A new species of freshwater algae Nephrochlamys yushanlensis sp. nov. (Selenastraceae, Sphaeropleales) and its lipid accumulation during nitrogen and phosphorus starvation // J. Phycol. 2021c. V. 57. P. 606–618. https://doi.org/10.1111/jpy.13116
Minyuk G., Chelebieva E., Chubchikova I., Dantsyuk N., Drobetskaya I., Sakhon E., Chekanov K., Solovchenko A. Stress-induced secondary carotenogenesis in Coelastrella rubescens (Scenedesmaceae, Chlorophyta), a producer of value-added keto-carotenoids // Algae. 2017. V. 32. P. 245–259. https://doi.org/10.4490/algae.2017.32.8.6
Minyuk G., Chelebieva E., Chubchikova I., Dantsyuk N., Drobetskaya I., Sakhon E., Chivkunova O., Chekanov K., Lobakova E., Sidorov R., Solovchenko A. pH and CO2 effects on Coelastrella (Scotiellopsis) rubescens growth and metabolism // Russ. J. Plant Physiol. 2016. V. 63. P. 566–574. https://doi.org/10.1134/S1021443716040105
Mudimu O., Koopmann I.K., Rybalka N., Friedl T., Schulz R., Bilger W. Screening of microalgae and cyanobacteria strains for α-tocopherol content at different growth phases and the influence of nitrate reduction on α-tocopherol production // J. Appl. Phycol. 2017. V. 29. P. 2867–2875. https://doi.org/10.1007/s10811-017-1188-1
Novakovskaya I.V., Egorova I.N., Kulakova N.V., Patova E.N., Shadrin D.M., Anissimova O.V. Morphological and phylogenetic relations of members of the genus Coelastrella (Scenedesmaceae, Chlorophyta) from the Ural and Khentii Mountains (Russia, Mongolia) // Phytotaxa. 2021. V. 527. P. 1–20. https://doi.org/10.11646/phytotaxa.527.1.1
Pamplona R. Membrane phospholipids, lipoxidative damage and molecular integrity: A causal role in aging and longevity // Biochim. Biophys. Acta – Bioenergetics. 2008. V. 1777. P. 1249–1262. https://doi.org/10.1016/j.bbabio.2008.07.003
Pérez-Pérez M.E., Lemaire S.D., Crespo J.L. Reactive oxygen species and autophagy in plants and algae // Plant Physiol. 2012. V. 160. P. 156–164. https://doi.org/10.1104/pp.112.199992
Rijstenbil J.W. Assessment of oxidative stress in the planktonic diatom Thalassiosira pseudonana in response to UVA and UVB radiation // J. Plankton Res. 2002. V. 24. P. 1277–1288.
Santiago-Morales I.S., Trujillo-Valle L., Márquez-Rocha F.J., Hernández J.F.L. Tocopherols, phycocyanin and superoxide dismutase from microalgae: as potential food antioxidants // Appl. Food Biotechnol. 2018. V. 5. P. 19–27. https://doi.org/10.22037/afb.v5i1.17884
Sies H., Stahl W., Sundquist A.R. Antioxidant functions of vitamins // Ann. New York Acad. Sci. 1992. V. 669. P. 7–20. https://doi.org/10.1111/j.1749-6632.1992.tb17085.x
Smerilli A., Orefice I., Corato F., Olea A.G., Ruban A.V., Brunet C. Photoprotective and antioxidant responses to light spectrum and intensity variations in the coastal diatom Skeletonema marinoi // Environ. Microbiol. 2016. V. 19. P. 611–627. https://doi.org/10.1111/1462-2920.13545
Toti E., Chen C.-Y.O., Palmery M., Valencia D.V., Peluso I. Non-provitamin a and provitamin a carotenoids as immunomodulators: recommended dietary allowance, therapeutic index, or personalized nutrition? // Oxidat. Med. Cell. Longevity. 2018. 4637861. https://doi.org/10.1155/2018/4637861
Wright A.H., DeLong J.M., Gunawardena A.H.L.A.N., Prange R.K. The interrelationship between the lower oxygen limit, chlorophyll fluorescence and the xanthophyll cycle in plants // Photosynth. Res. 2011. V. 107. P. 223–235. https://doi.org/10.1007/s11120-011-9621-9
Wang T.-Y., Libardo M.D.J., Angeles-Boza A.M., Pellois J.-P. Membrane oxidation in cell delivery and cell killing applications // ACS Chem. Biol. 2017. V. 12. P. 1170–1182. https://doi.org/10.1021/acschembio.7b00237
Zeb A., Ullah F. A simple spectrophotometric method for the determination of thiobarbituric acid reactive substances in fried fast foods // J. Anal. Meth. Chem. 2016. 9412767. https://doi.org/10.1155/2016/9412767
Дополнительные материалы отсутствуют.


