Микробиология, 2022, T. 91, № 5, стр. 586-596
Зависимость состава клубеньковых бактерий лядвенца рогатого (Lotus Corniculatus) от стадии вегетации растения-хозяина
Ан. Х. Баймиев a, *, Е. С. Акимова a, И. С. Коряков a, А. А. Владимирова a, Ал. Х. Баймиев a
a Институт биохимии и генетики УФИЦ РАН
450054 Уфа, Россия
* E-mail: baymiev@anrb.ru
Поступила в редакцию 17.03.2022
После доработки 11.04.2022
Принята к публикации 17.04.2022
- EDN: QYIBNU
- DOI: 10.31857/S0026365622100172
Аннотация
Бобово-ризобиальный симбиоз – уникальное природное явление, способное обеспечивать бобовое растение минеральным азотом, фиксированным из атмосферы. В зоне умеренного климата вследствие сезонности растения вынуждены в начале каждого раунда вегетации образовывать новые взаимодействия с ризобиями с формированием специализированных структур на корнях, называемых клубеньками, где, собственно, и происходит фиксация молекулярного азота. В разные периоды роста и развития потребность растения в минеральном азоте сильно различается, что может оказывать влияние на трофические связи с микросимбионтами. Нами в данной работе на примере многолетнего бобового растения лядвенца рогатого (Lotus corniculatus L.) была проведена оценка влияния стадии вегетации макросимбионта на состав его клубеньковых бактерий и их характеристики. Было обнаружено, что микроорганизмы, формирующие клубеньки на корнях лядвенца, в начале вегетации имели наибольший уровень генетического разнообразия. К середине же развития растения данный уровень снижался, а к концу вегетации снова повышался. Анализ азотфиксирующей активности бактерий показал, что наиболее активно фиксируют азот штаммы микроорганизмов, выделенные из клубеньков, собранных на начальных стадиях развития макросимбионта, в то время как у штаммов, выделенных из клубеньков в конце вегетации активность азотфиксации значительно ниже. Вероятно, бобовые растения на разных этапах развития используют различные стратегии при выборе своих микросимбионтов.
Азот является важнейшим элементом, оказывающим огромное влияние на плодородие почвы и урожайность сельскохозяйственных культур. Основная масса азота, содержащегося в населяющих нашу планету живых организмах, своим происхождением обязана деятельности микроорганизмов, способных ассимилировать молекулярный азот атмосферы, восстанавливая его до аммиака. Этот процесс называется биологической азотфиксацией (Ohyama, Sueyoshi, 2010). Наиболее эффективными азотфиксаторами являются клубеньковые бактерии (ризобии) – микроорганизмы, вступающие в симбиоз с бобовыми и образующие на корнях данных растений специализированные структуры – клубеньки, в которых и происходит процесс азотфиксации. Важным направлением исследований в этой области является изучение возможностей увеличения эффективности симбиотической азотфиксации. Несмотря на высокую специфичность взаимодействия бобовых растений с их клубеньковыми бактериями, в ризосфере формируется большое разнообразие генетических вариантов (штаммов) ризобий, отличающихся по своей эффективности симбиотической азотфиксации. Это приводит к тому, что не все клубеньки формируются эффективными микроорганизмами, что, в свою очередь, сказывается на продуктивности растения (Проворов и соавт., 2008).
Основным генетическим компонентом в бобово-ризобиальном взаимодействии являются симбиотические гены бактерий (sym-гены), которые определяют во многом специфичность и эффективность данного симбиоза. Sym-гены включают в себя ответственные за фиксацию азота nif-гены, которые кодируют синтез и регуляцию фермента нитрогеназы; nod-гены, кодирующие синтез Nod-факторов, отвечающих за инициацию и специфичность образуемого симбиоза; а также fix-гены, которые также необходимы для азотфиксации, часто сцепленные с nif-генами, но не гомологичные с ними (Проворов, 1996; Franche et al., 2009). На сегодняшний день проведено большое количество работ, свидетельствующих о высокой мобильности sym-генов и подверженности их горизонтальному переносу (ГПГ) (Fischer, 1994; Проворов, Воробьев, 2000; Nandasena et al., 2006; Andam et al., 2007; Barcellos et al., 2007; Zhao et al., 2008). Доказано, что данный процесс является неотъемлемой частью эволюции бобово-ризобиальных взаимоотношений (Freiberg et al., 1997; Bailly et al., 2007; Estrella et al., 2009; Marchetti et al., 2010) и зачастую приводит к появлению штаммов с измененной хозяйской специфичностью или к приобщению новых видов микроорганизмов к группе клубеньковых бактерий (Zaneveld et al., 2008). Участие ГПГ в эволюции ризобий подтверждается локализацией sym-генов на мобильных генетических элементах (плазмиды или интегрированные конъюгативные элементы ‒ ICESym), а также характерной для них панмиктической структурой популяций (Provorov, Vorobyev, 2008). Широкая экспансия sym-генов в ассоциированных с растениями бактериальных сообществах посредством ГПГ, как считается, является наиболее вероятным способом формирования современного разнообразия ризобий и проявляется в различиях филогении симбиотических генов и генов “домашнего хозяйства” (Bailly et al., 2007; Проворов, Воробьев, 2010). В последнее время появляется понимание того, что панмиктичность популяции, характерная для ризобиальных бактерий, которая приводит к высокой полиморфности, некоторым образом опосредована растительным компонентом и тому есть определенные подтверждения. Показано, что бобовые играют более важную роль в формировании популяционной структуры ризобий, чем эдафические факторы (Carelli et al., 2000; Andronov et al., 2003). В присутствии растений-хозяев происходит увеличение размеров ризобиальных популяций, которое сочетается с их повышенной гетерогенностью (Andrade et al., 2002). Более того, появились данные, что растения и вовсе способны индуцировать горизонтальный перенос симбиотических генов между ризосферными бактериями. Было показано, что частота горизонтального переноса sym-генов Azorhizobium caulinodans ‒ микросимбионта Sesbania rostrata – была значительно увеличена в ризосфере растения-хозяина. Утверждается, что транскрипционный регуляторный белок семейства LysR AhaR запускает процесс горизонтального переноса генов в ответ на растительные флавоноиды, которые индуцируют экспрессию генов нодуляции через другой белок типа LysR, NodD. Таким образом, ризобия способна получать сигналы в ризосфере и активировать перенос своих симбиотических генов в другие ризобии, изменяя их характеристики (Ling et al., 2016).
Целью данной работы являлось исследование изменения состава клубеньковых бактерий лядвенца рогатого (Lotus corniculatus) в зависимости от стадии его вегетации.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования являлись 284 штамма бактерий, выделенные из клубеньков многолетнего бобового растения лядвенца рогатого (Lotus corniculatus L.), собранных на разных стадиях его вегетации: во время набухания почек (апрель, май), в период формирования бутонов (июнь) и после закладки растениями почек на зиму с первыми заморозками (октябрь).
Изолирование микроорганизмов из клубеньков проводили методом получения пункций из зоны размножения бактерий и рассевом ее на питательной агаризованной среде YM (0.1% дрожжевой экстракт; 1% маннит; 0.05% К2НРО4; 0.05% MgSO4; 0.01% NaCl; 1.5% агар) до отдельных колоний (Баймиев и соавт., 2010). Из каждого клубенька получали по одной чистой культуре бактерий. Предварительную проверку изолятов на принадлежность их к группе клубеньковых бактерий проверяли методом ПЦР-анализа наличия гена nifH, характерного для всех видов ризобий.
Выделение тотальной ДНК из бактерий осуществляли методом термокоагуляции. Для этого в 1.5 мл пробирки со 100 мкл 1% Triton X100 и 1% суспензии смолы Chelex100 (“Bio-Rad”, США) помещали небольшое количество бактериальной массы и после суспендирования инкубировали при температуре 95°С 10 мин. Клеточный дебрис осаждали центрифугированием при 12 000 g в течение 3 мин. Надосадочную жидкость брали в качестве матрицы для ПЦР.
Молекулярно-генетический анализ штаммов бактерий. Генетическое разнообразие полученных штаммов исследовали с помощью RAPD-анализа (Random Amplified Polymorphic DNA) (Williams et al., 1990) с использованием следующих “случайных” праймеров: 1) LMBD 5'-gggcgctg-3'; 2) AFK-1 5'-acggtggacg-3'; 3) OPA 5'-gcgtccattc-3'.
Для амплификации гена 16S рРНК были использованы универсальные праймеры fD1 5'-cccgggatccaagcttaaggaggtgatccagcc-3', rD1 5'-ccgaattcgtcgacaacagagtttgatcctggctcag-3', фланкирующие его часть размером около 1500 п.н. (Weisburg et al., 1991). Для амплификации фрагмента гена recA были взяты праймеры RecAF 5'-ttcggcaagggmtcgrtsatg-3' и RecAR 5'-acatsacrccgatcttcatgc-3'. Для амплификации фрагментов sym-генов nifH и nodC были использованы праймеры NifHF 5'-ttctatggaaagggcggcattggcaagct-3'; NifHR 5'-atctcgccggacatgacgatataaatttc-3' и NodCF 5'-cgtttcgtcttatgcggtgctc-3'; NodCR 5'-cagctgcgtctcgtattgat-3' соответственно (Баймиев и соавт., 2015).
ПЦР-ПДРФ-анализ (полиморфизм длин рестрикционных фрагментов) (Laguerre, 1996) гена 16S рРНК проводили с использованием мелкощепящих эндонуклеаз рестрикции HpaII и RsaI.
Определение нуклеотидных последовательностей проводили на автоматическом секвенаторе Applied Biosystems 3500 (“Applied Biosystems, Inc.”, США) с использованием наборов “Big Dye Terminator v.3.1”.
Филогенетический анализ исследуемых штаммов проводили на основании множественного выравнивания (Clustal W) секвенированных фрагментов генов 16S рРНК, recA, nodC и nifH. Построение филогенетических деревьев осуществляли с помощью Megalign из пакета программ Lasergene c использованием метода neighbor-joining (NEIGHBOR). Нуклеотидные последовательности для сравнительного анализа были взяты из базы данных GenBank (www.ncbi.nlm.nih.gov). Статистическую достоверность ветвления (bootstrap-анализ) оценивали с использованием соответствующей функции программы Megalign на основе 1000 альтернативных деревьев.
Нуклеотидные последовательности взятых в анализ генов всех исследованных штаммов были зарегистрированы в базе данных GenBank под следующими номерами:
1) 16S рРНК: OL872300, OL872361, OL872741, OL884437, OM914882, OM914885, OM914886, OL884438, OL884442, OL884446, OL884457, OL884458, OL884630, OL884456, OL884611, OM914933.
2) recA: OM752311, OM752312, OM752310, OM888662, OM888663, OM913901, OM913902, OM942752, OM942753, OM942754, OM811973, OM811972, OM811974, OM811975, OM811976, OM811977.
3) nifH: OM327772, OM327773, OM417617, OM864668, OM864669, OM864670, OM864671, OM686847, OM686848, OM686846, OM650802, OM650801, OM650803, OM650804, OM675983, OM675984.
4) nodC: OM509456, OM519321, OM519322, OM519320, OM868043, OM868044, OM868045, OM615896, OM615898, OM615897, OM519323, OM519324, OM519325, OM519326, OM509455, OM615895.
Инокуляция семян лядвенца рогатого анализируемыми штаммами бактерий. Для проведения опытов брали семена, которые ранее нами были собраны с лядвенца рогатого (Lotus corniculatus). Поскольку они имеют твердую оболочку, то перед инокуляцией их сначала скарифицировали концентрированной серной кислотой 15 мин, а затем тщательно несколько раз промывали стерильной водой (метод химической скарификации). Далее семена проращивали в течение 36‒48 ч на влажной фильтровальной бумаге в стерильных чашках Петри. Полученные проростки в дальнейшем помещали в стерильные пробирки, каждая из которых содержала по 200 мкл суспензии анализируемых штаммов бактерий по отдельности, и выдерживали в них 20 мин при равномерном перемешивании (50 об./мин). Для приготовления суспензий использовали культуры микроорганизмов, выращенные в жидкой среде YM в течение 4 сут до 109 КОЕ/мл. Далее инокулированные пророщенные семена сажали по 6 штук в контейнер со стерильным влажным песком (400 г) и выращивали в течение месяца в условиях искусственного освещения (16 ч светопериод) при 24‒26°С. Для каждого штамма делали по 3 повтора.
Анализ азотфиксирующей активности клубеньковых бактерий осуществляли методом редукции ацетилена (Умаров, 1989). Для этого от побега отделяли корни, промывали их стерильной водой и помещали в стеклянные флаконы объемом 15 мл. Закрывали резиновыми пробками. Затем вносили ацетилен в объеме 10%. Помещали флаконы с образцами и контрольными пробами (флаконы с ацетиленом и без него) в темное место. Через 1 ч проводили анализ содержания ацетилена и этилена по времени выхода каждого газа в исследуемых образцах на газовом хроматографе с пламенным ионизационным детектором Shimadzu GC-2014 (“Shimadzu”, Япония). Количество ацетилена и этилена определяли по калибровочной кривой. Величину азотфиксирующей активности рассчитывали следующим образом:
Статистический анализ. Для оценки генотипического разнообразия штаммов использовали нормализованный коэффициент Шеннона: Hs = = –Σgi ln (gi)/ln N, где gi – частота i-го генотипа, а N – объем выборки (Śliwka et al., 2006). Данные по анализу азотфиксации были представлены как среднее значение ± стандартная ошибка (SEM). Статистически значимые различия между средними значениями оценивали с помощью дисперсионного анализа (ANOVA) с последующим тестом Тьюки (p < 0.05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Зона умеренного климата характеризуется ярко выраженной сезонностью, что, в свою очередь, привносит особенности в развитие растений, произрастающих в этой области. В ходе вегетации многолетних растений, в том числе и бобовых, начиная от всхода или набухания почки до созревания семени происходят изменения их потребности в минеральном питании, в частности, в азоте. Наиболее интенсивно растение нуждается в азоте в начале вегетации, в то время как на конечных этапах необходимость в нем снижается. Бобовые для обеспечения себя минеральным азотом имеют уникальную возможность вступать в симбиоз с клубеньковыми бактериями, которые, взамен на питательные вещества, предоставляют растениям азот, фиксируемый ими из атмосферы. Для того чтобы понять, как меняются взаимоотношения бактерий и растения в ходе его развития, нами было исследовано генетическое разнообразие и некоторые биохимические параметры ризобий, полученных из клубеньков, которые были сформированы на разных стадиях вегетации растений.
В качестве объекта исследования были выбраны микросимбионты многолетнего бобового растения лядвенца рогатого (Lotus corniculatus), выделенные из клубеньков, собранных на разных этапах его развития.
Анализ штаммов на генетический полиморфизм методом RAPD с использованием 3 коротких случайных олигонуклеотидных праймеров показал, что бактерии, полученные из клубеньков растений в разные периоды вегетации, имеют различную степень гетерогенности (рис. 1).
Рис. 1.
Примеры фореграмм RAPD-анализа ДНК ризобий, изолированных из клубеньков лядвенца рогатого: а ‒ штаммы, полученные из “весенних” клубеньков; б ‒ штаммы, выделенные из “летних” клубеньков. Цифрами обозначены номера генетически однородных групп. М – 100 п.н. маркер.

Был обнаружен интересный факт. Показано, что наибольший полиморфизм наблюдался у бактерий, полученных из клубеньков растений на начальной стадии вегетации, собранных в весенний период, где коэффициент разнообразия Шеннона (Hs) достигал значения 0.72. Далее в ходе развития это разнообразие значительно снижалось и к середине вегетационного периода Hs составляло 0.59. А при подготовке к зимнему покою растение опять начинало активно образовывать клубеньки, и они формировались снова более разнообразным пулом бактерий (Hs = 0.64). Также необходимо отметить, что в этот период в клубеньках кроме ризобий выявлялись микроорганизмы, не относящиеся к группе клубеньковых бактерий, в основном принадлежащие к роду Pseudomonas (табл. 1).
Таблица 1.
Количественный состав бактерий из клубеньков лядвенца рогатого, собранных на разной стадии вегетации растений
| Сезон сбора клубеньков | Количество изолятов относящихся к филогенетической группе | Количество гомогенных групп бактерий | Коэфф. разнообразия Шеннона, Hs | Представители филогенетически однородных групп |
|---|---|---|---|---|
| Весна | 14 | 9 | 0.74 | LotVes2.7 |
| 17 | 8 | LotVes3.15 | ||
| 10 | 5 | LotVes3 | ||
| Лето | 36 | 5 | 0.59 | LotLet2.12 |
| 38 | 4 | LotLet3.10 | ||
| 33 | 1 | LotLet4.5 | ||
| 17 | 7 | LotLetA1.1 | ||
| 1 | 1 | LotLetA3.1 | ||
| 24 | 6 | LotLetA4.1 | ||
| 1 | 1 | LotLetA4.3 | ||
| 39 | 15 | LotLetB1.1 | ||
| 5 | 1 | LotLetB4.1 | ||
| Осень | 8 | 5 | 0.64 | LotOs1.10 |
| 18 | 6 | LotOs2.2 | ||
| 8 | 2 | LotOs3.3 | ||
| 14 | 4 | LotOs5.12 | ||
| Общее количество изолятов 284 | ||||
При предварительном анализе родства методом 16S ПДРФ внутри полученных штаммов были обнаружены филогенетически однородные группы бактерий. У представителей данных групп далее были секвенированы гены 16S рРНК и recA, а также симбиотические гены nodC и nifH. Методом сравнительного анализа определенных нуклеотидных последовательностей с аналогичными последовательностями из базы данных GenBank были выявлены филогенетические положения исследуемых штаммов бактерий.
Установлено, что все изолированные штаммы ризобий из клубеньков лядвенца рогатого, как на основании сравнительного анализа гена 16S рРНК, так и recA, принадлежали к роду Mesorhizobium (рис. 2). При этом обнаружено, что исследуемые бактерии образуют две группы, одна из которых филогенетически родственна микроорганизмам M. loti/M. ciceri, а другая значительно отличается от известных видов данного рода. Наибольшую схожесть с образующими отдельную кладу бактериями имеет M. amorphae, но процент ее гомологии с ними менее 97%, что не позволяет их отнести к этому виду. Скорее всего, представители отмеченной группы микроорганизмов принадлежат к неописанному на сегодняшний день виду рода Mesorhizobium и требуют дальнейшего их исследования.
Рис. 2.
Филогенетические деревья клубеньковых бактерий, построенные на основании сравнительного анализа последовательностей гена 16S рРНК (а) и recA (б). Жирным шрифтом отмечены штаммы микроорганизмов, исследованные в данной работе.

Рис. 2.
Продолжение.

Несмотря на филогенетическое разнообразие бактерий, обнаруживаемых в клубеньках лядвенца, по консервативной части генома, оказалось, что они почти все содержат симбиотические гены, характерные для Mesorhizobium loti. Единственным исключением являются микроорганизмы из группы Mesorhizobium sp. LotOs1.10, полученные из клубеньков на поздних стадиях вегетации растений. У данных бактерий последовательности гена nodC показали очень высокую схожесть с аналогичными последовательностями, описанными у бактерий M. temperatum, хотя nifH имеет гомологию с соответствующим геном M. loti (рис. 3).
Рис. 3.
Филогенетические деревья клубеньковых бактерий, построенные на основании сравнительного анализа последовательностей генов: nodC (а) и nifH (б). Жирным шрифтом отмечены штаммы микроорганизмов, исследованные в данной работе.

Для выявления различий по степени эффективности штаммов клубеньковых бактерий, собранных на разных стадиях вегетации растений, нами был проведен анализ их азотфиксирующей активности. В ходе проделанной работы было выявлено, что наибольшую эффективность азотфиксации показывали штаммы ризобий, полученные из клубеньков лядвенца, собранных на начальной фазе его вегетации. Далее, к середине вегетационного периода азотфиксирующая активность ризобий начинала снижаться, а у бактерий, формирующих “осенние” клубеньки, она имела наименьшее значение (рис. 4).
Рис. 4.
Азотфиксирующая активность штаммов ризобий, полученных из клубеньков, собранных на разных стадиях вегетации растений. Показаны средние значения в пересчете на одно инокулированное растение. Контроль ‒ растение без обработки.
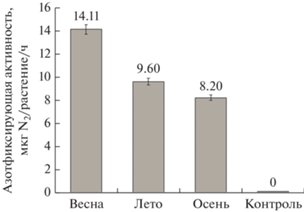
Очевидно, что у растения при взаимодействии со значительным разнообразием штаммов клубеньковых бактерий в начале вегетации появляется больше выбора в селекции наиболее подходящих вариантов ризобий.
Сезонность, характерная для умеренного климата, не может не сказаться на симбиотическом взаимодействии бактерий и растений, в том числе и на бобово-ризобиальном симбиозе. Состав бактерий, образующих клубеньки на корнях, имеет значительную зависимость от состояния растения и его трофических связей с клубеньками. Наибольшее разнообразие микроорганизмов в клубеньках бобовых растений, скорее всего, продиктовано тем, что в период высокой потребности в азоте макросимбионт максимально быстро пытается использовать симбиотическое взаимодействие с бактериями для обеспечения себя минеральным питанием. При этом клубеньки, образованные некоторыми штаммами, могут оказаться слишком “дорогими” в плане обеспечения их питанием. Это подтверждают также наши данные об азотфиксирующей активности бактерий, полученные из клубеньков в начале вегетации, которые показывают наибольшие значения. В дальнейшем в ходе развития у растения отмирают затратные варианты клубеньков, и остаются преимущественно наиболее оптимальные вариации с максимально выгодным соотношением N/C, поскольку снижается потребность в азотном питании. Это мы и обнаруживаем при анализе изолятов микроорганизмов, полученных из клубеньков, собранных в середине вегетации, где наблюдается наименьшая гетерогенность бактерий. Далее, в конце вегетации у растений начинают образовываться клубеньки, задача которых не столько в фиксации азота, о чем свидетельствуют данные снижения азотфиксирующей активности этих бактерий, сколько в амплификации микроорганизмов в ризосфере, несущих пригодный для данного растения набор симбиотических генов, которые в следующий сезон в начале вегетации могут оказаться их донорами при формировании новых штаммов. Таким образом, цикл может повторяться из раза в раз. Кроме того, на этой стадии развития растения редуцируются трофические связи между ним и клубеньком, что, вероятно, сильно сказывается на контроле со стороны макросимбионта состава бактерий в клубеньках. Как нами было обнаружено, это выражается в присутствии в клубеньках микроорганизмов, не относящихся к ризобиям, например, Pseudomonas sp., а также бактерий Mesorhizobium sp. (штамм LotOs1.10), содержащих ген nodC, характерный для M. temperatum, тогда как остальные микроорганизмы имели аналогичный ген, свойственный для бактерий M. loti, которые являются типичными микросимбионтами для данного вида растения. Упомянутый выше штамм представляет собой уникальное образование, содержащее химерный набор sym-генов. В данном случае этот пример является ярким показателем участия комбинаторных механизмов в формировании набора симбиотических генов у клубеньковых бактерий путем рекомбинационных процессов вследствие активной вовлеченности sym-генов в горизонтальный перенос. И обнаружение подобных штаммов более вероятно с нашей точки зрения именно в клубеньках на поздней стадии вегетации растения, поскольку на начальных этапах строгий контроль направлен на отбор эффективных вариантов бактерий (рис. 5).
Рис. 5.
Клубеньки лядвенца рогатого в начале (а) и в конце вегетации, образованные на стадии закладки почек на зиму (б) в разрезе.

На самом деле формирование штаммов – процесс постоянный, и перед растением всегда стоит выбор, каким бактериям отдавать предпочтение. Достаточно много доказательств того, что для растения наиболее важным является наличие у бактерии подходящего набора симбиотических генов, нежели ее видовая принадлежность (Carelli et al., 2000; Andronov et al., 2003). Еще одним подтверждением этого могут служить полученные нами данные, где было обнаружено, что с лядвенцем рогатым вступают в симбиоз, наряду с Mesorhizobium loti (обычный симбионт данного растения), также микроорганизмы предположительно другого вида, но имеющие симбиотические гены бактерий Mesorhizobium loti. Очевидно, что в данном случае при выборе микросимбионтов растение отбирает микроорганизмы с нужными симбиотическими генами, независимо от того, в какой бактерии они присутствуют и, вероятно, имеют возможность функционировать.
В заключение можно отметить, что участие растения в выборе своих микросимбионтов очевидно, и, поскольку это происходит постоянно в ходе всего вегетационного периода, когда растение претерпевает значительные физиолого-морфологические изменения, это непременно сказывается на специфичности образования симбиоза. В начале вегетации есть потребность в активном минеральном питании, и в этот период клубеньки образуются более активными с точки зрения азотфиксации штаммами. В середине жизненного цикла растению необходимо поддерживать баланс между минеральным питанием и обеспечением клубеньков питательными веществами. В конце же вегетации бобовые подготавливают на следующий сезон своих микросимбионтов путем амплификации их в клубеньках, которые при разрушении будут выделять в ризосферу потенциальных микросимбионтов и доноров симбиотических генов.
Список литературы
Баймиев Ан.Х., Иванова Е.С., Гуменко Р.С., Чубукова О.В., Баймиев Ал.Х. Анализ симбиотических генов клубеньковых бактерий бобовых растений Южного Урала // Генетика. 2015. Т. 51. С. 1359–1367.
Baymiev An.K., Ivanova E.S., Gumenko R.S., Chubukova O.V., Baymiev Al.K. Analysis of symbiotic genes of leguminous root nodule bacteria grown in the Southern Urals // Russ. J. Genet. 2015. V. 51. P. 1172‒1180.
Баймиев Ан.Х., Птицын К.Г., Баймиев Ал.Х. Влияние интродукции караганы древовидной на состав ее клубеньковых бактерий // Микробиология. 2010. Т. 79. С. 123–128.
Baymiev An.K., Ptitsyn K.G., Baimiev Al.K. Influence of the introduction of Caragana arborescens on the composition of its root nodule bacteria // Microbiology (Moscow). 2010. V. 79. P. 115‒120.
Проворов Н.А. Эволюция генетических систем симбиоза у клубеньковых бактерий // Генетика. 1996. Т. 32. С. 1029‒1040.
Provorov N.A. Evolution of symbiotic genetic systems in rhizobia // Russ. J. Genet. 1996. V. 32. P. 891‒900.
Проворов Н.А., Воробьев Н.И. Эволюционная генетика клубеньковых бактерий: молекулярные и популяционные аспекты // Генетика. 2000. Т. 36. С. 1573–1587.
Provorov N.A., Vorob’ev N.I. Evolutionary genetics of nodule bacteria: molecular and population aspects // Russ. J. Genet. 2000. V. 36. P. 1323‒1335.
Проворов Н.А., Воробьев Н.И, Андронов Е.Е. Макро- и микроэволюция бактерий в системах симбиоза // Генетика. 2008. Т. 44. С. 6‒20.
Provorov N.A., Vorobyov N.I., Andronov E.E. Macro- and microevolution of bacteria in symbiotic systems // Russ. J. Genet. 2008. V. 44. P. 6‒20.
Проворов Н.А., Воробьев Н.И. Роль горизонтального переноса генов в эволюции клубеньковых бактерий, направляемой растением-хозяином // Успехи современной биологии. 2010. Т. 130. № 4. С. 336–345.
Умаров М.М. Ассоциативная азотфиксация. М.: МГУ, 1989. 136 с.
Andam C.P., Mondo S.J., Parker M.A. Monophyly of nodA and nifH genes across Texan and Costa Rican populations of Cupriavidus nodule symbionts // Appl. Environ. Microbiol. 2007. V. 73. P. 4684‒4690.
Andrade D.S., Murphy P.J., Giller K.E. The diversity of Phaseolus-nodulating rhizobial populations is altered by liming of acid soils planted with Phaseolus vulgaris L. in Brazil // Appl. Environ. Microbiol. 2002. V. 68. P. 4025‒4034.
Andronov E.E., Terefework Z., Roumiantseva M.L., Dzyu-benko N.I., Onichtchouk O.P., Kurchak O.N., Dresler-Nurmi A., Young J.P.W., Simarov B.V., Lindstöm K. Symbiotic and genetic diversity of Rhizobium galegae isolates collected from the Galega orientalis gene centre in the Caucasus // Appl. Environ. Microbiol. 2003. V. 69. P. 1067‒1074.
Bailly X., Olivieri I., Brunel B., Cleyet-Marel J.C., Béna G. Horizontal gene transfer and homologous recombination drive the evolution of the nitrogen-fixing symbionts of Medicago species // J. Bacteriol. 2007. V. 189. P. 5223–5236.
Barcellos F.G., Menna P., Batista J.S., Hungria M. Evidence of horizontal transfer of symbiotic genes from a Bradyrhizobium japonicum inoculant strain to indigenous diazotrophs Sinorhizobium (Ensifer) fredii and Bradyrhizobium elkanii in a Brazilian Savannah Soil // Appl. Environ. Microbiol. 2007. V. 73. P. 2635‒2643.
Carelli M., Gnocchi S., Fancelli S., Mengoni A., Paffetti D., Scotti C., Bazzicalupo M. Genetic diversity and dinamics of Sinorhizobium meliloti populations nodulating different alfalfa cultivars in Italian soils // Appl. Environ. Microbiol. 2000. V. 66. P. 4785‒4789.
Estrella M.J., Munoz S., Soto M.J., Ruiz O., Sanjuán J. Genetic diversity and host range of rhizobia nodulating Lotus tenuis in typical soils of the Salado River Basin (Argentina) // Appl. Environ. Microbial. 2009. V. 75. P. 1088–1098.
Fischer H.M. Genetic regulation of nitrogen fixation in rhizobia // Microbiol. Rev. 1994. V. 58. P. 352–386.
Franche C., Lindström K., Elmerich C. Nitrogen-fixing bacteria associated with leguminous and non-leguminous plants // Plant Soil. 2009. V. 321. P. 35–59.
Freiberg C., Fellay R., Bairoch A., Broughton W.J., Rosenthal A., Perret X. Molecular basis of symbiosis between Rhizobium and legumes // Nature. 1997. V. 387. P. 394–401.
Laguerre G., Mavingui P., Allard M., Charnay M., Louvrier P., Mazurier S., Rigottier-Gois N., Amarger N. Typing of rhizobia by PCR DNA fingerprinting and PCR-restriction fragment length polymorphism analysis of chromosomal and symbiotic gene regions: application to Rhizobium leguminosarum and its different biovars // J. Appl. Environ. Microbiol. 1996. V. 62. P. 2029‒2036.
Ling J., Wang H., Wu P., Li T., Tang Y., Naseer N., Zheng H., Masson-Boivin C., Zhong Z., Zhu J. Plant nodulation inducers enhance horizontal gene transfer of Azorhizobium caulinodans symbiosis island // Proc. Natl. Acad. Sci. USA. 2016. V. 113. P. 13875‒13880.
Marchetti M., Capela D., Glew M., Cruveiller S., Chane-Woon-Ming B., Gris C., Timmers T., Poinsot V., Gilbert L.B., Heeb P., Medigue C., Batut J., Masson-Boivin C. Experimental evolution of a plant pathogen into a legume symbiont // PLoS Biol. 2010. V. 8. P. e1000280.
Nandasena K.G., O’Hara G.W., Tiwari R.P., Howieson J.G. Rapid in situ evolution of nodulating strains for Biserrula pelecinus L. through lateral transfer of a symbiosis island from the original mesorhizobial inoculant // Appl. Environ. Microbiol. 2006. V. 72. P. 7365–7367.
Ohyama T., Sueyoshi K. Nitrogen Assimilation in Plants. Research Singpot, Kerala, 2010. 378 p.
Provorov N.A., Vorobyov N.I. Evolution of symbiotic bacteria in “plant-soil” systems: interplay of molecular and population mechanisms // Progress in Environmental Microbiology / Ed. Kim M.-B. N.Y.: Nova Science Publishers, Inc., 2008. P. 11‒67.
Śliwka J., Sobkowiak S., Lebecka R., Avendaño-Córcoles J., Zimnoch-Guzowska E. Mating type, virulence, aggressiveness and metalaxyl resistance of isolates of Phytophthora infestans in Poland // Potato Research. 2006. V. 49. P. 155‒166.
Weisburg W.G., Barns S.M., Pelletier D.A., Lane D.J. 16S ribosomal DNA amplification for phylogenetic study // J. Bacteriol. 1991. V. 173. P. 697‒703.
Williams J.G., Kubelik A.R., Livak K.J., Rafalski J.A., Tingey S.V. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers // Nucl. Acids Res. 1990. V. 18. P. 6531‒6535.
Zaneveld J.R., Nemergut D.R., Knight R. Are all horizontal gene transfers created equal? Prospects for mechanism-based studies of HGT patterns // Microbiology (SGM). 2008. V. 154. P. 1–15.
Zhao C.T., Wang E.T., Chen W.F., Chen W.X. Diverse genomic species and evidences of symbiotic gene lateral transfer detected among the rhizobia associated with Astragalus species grown in the temperate regions of China // FEMS Microb. Lett. 2008. V. 286. P. 263‒273.
Дополнительные материалы отсутствуют.


