Микробиология, 2022, T. 91, № 5, стр. 597-612
Бинарные биопленки Staphylococcus aureus 209P и Kytococcus schroeteri H01: дуалистическая роль китококков и изменения клеточной адгезии в присутствии натрийуретического пептида А-типа
Е. В. Дювенжи a, Е. Д. Неволина a, С. В. Мартьянов a, М. В. Журина a, О. В. Калмантаева b, М. А. Макарова a, Е. А. Бочкова a, В. В. Фирстова b, В. К. Плакунов a, А. В. Ганнесен a, *
a Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
119071 Москва, Россия
b “Государственный научный центр прикладной микробиологии и биотехнологии”
Роспотребнадзора
142279 Оболенск, Московская обл., Россия
* E-mail: andrei.gannesen@gmail.com
Поступила в редакцию 06.04.2022
После доработки 19.04.2022
Принята к публикации 19.04.2022
- EDN: PJRMIZ
- DOI: 10.31857/S0026365622100251
Аннотация
В ходе изучения взаимоотношений между Staphylococcus aureus 209P и Kytococcus schroeteri H01 в составе бинарных биопленок было показано, что эти бактерии чувствительны к натрийуретическому пептиду А-типа (НУП-А) в концентрации 6.5 × 10–10 M. Способность клеток этих бактерий к коагрегации и агрегации к поверхности также изменялись в присутствии гормона, при этом основные изменения затрагивали начальную стадию адгезии при формировании биопленки. Изменения в процессе агрегации клеток обеих бактерий косвенно подтвердились с помощью метода микробной адгезии к растворителям (MATS), который выявил снижение сродства клеток к гексадекану – гидрофобному растворителю. Рассев на КОЕ бинарных сообществ показал доминирование КОЕ стафилококков, а клетки K. schroeteri составляли минорную часть биомассы. Однако их присутствие влияло на агрегацию и действие, оказываемое НУП-А на микробное сообщество. K. schroeteri играл в сообществе дуалистическую роль, с одной стороны, улучшая адгезию стафилококков, а с другой ‒ являясь их антагонистом в биопленке. Кроме того, K. schroeteri обеспечивал изменение в характере действия НУП-А на S. aureus с нейтрального/стимулирующего на ингибирующий в бинарных сообществах.
Микробиота кожи ‒ сложное сообщество микроорганизмов, включающее в себя сотни родов и видов, тесно взаимосвязанных друг с другом и с организмом хозяина (Grice et al., 2009). Несмотря на значительные успехи в изучении микробиоты человека, достигнутые в последние десятилетия, практически ничего не известно о том, каким образом микроорганизмы взаимодействуют друг с другом в сообществе. Также очень мало сведений о регуляторной роли различных соединений в отношении сообществ микроорганизмов.
Грамположительные кокки Staphylococcus aureus и Kytococcus schroeteri являются компонентами микробиоты кожи человека. S. aureus – это один из наиболее изучаемых видов микроорганизмов, поскольку он является условным патогеном, способным вызывать различные заболевания, от относительно легких кожных инфекций, таких как акне, фурункулез, флегмона, фолликулит, до тяжелых болезней, таких как пневмония, менингит, остеомиелит, эндокардит, инфекционно-токсический шок и сепсис (Tong et al., 2015; Parlet et al., 2019). При этом, у высокого процента населения золотистый стафилококк присутствует в качестве компонента микробиоты, не вызывая при этом заболеваний (Balasubramanian et al., 2017). K. schroeteri ‒ это слабо изученный компонент комменсальной микробиоты кожи. Ранее данный микроорганизм относили к микрококкам, однако по результатам молекулярно-генетических и биохимических исследований китококки были выделены в отдельное семейство (Becker et al., 2002). Несмотря на малоизученность и относительную безопасность данного микроорганизма, имеется достаточное количество сообщений об инфекциях, вызываемых K. schroeteri, в частности, о клинических случаях эндокардита в результате имплантации протеза клапана или шунтирования в сердце (Aepinus et al., 2008; Yousri et al., 2010; Schaumburg et al., 2013).
Оба вида бактерий способны к формированию биопленок в определенных микронишах на коже, таких как полости желез, поверхности слизистых. Биопленки представляют собой микробные сообщества, погруженные во внеклеточный полимерный матрикс, обеспечивающий находящимся в нем клеткам защиту от неблагоприятных факторов окружающей среды. Биопленки являются основной формой существования микроорганизмов в природе, в том числе и на коже человека (Ramasamy et al., 2019). Это особенно характерно для сообщества микробиоты кожи, где физико-химические условия просто не позволяют бактериям расти в планктонной форме.
Исследования последних лет показывают, что микробиота кожи играет важную роль в функционировании кожи, иммунной системы человека, тесно связана с системами гуморальной регуляции (Blennow et al., 2011). Недавно было показано, что гормоны, как компоненты систем гуморальной регуляции человека, способны оказывать влияние на микробиоту кожи. Это влияние может быть результатом длительной коэволюции тела человека и его микробных комменсалов (Lyte et al., 2004). Натрийуретические пептиды (НУП) представляют собой класс гормонов, регулирующих многие физиологические процессы в организме человека (обмен кальция, тонус сосудов и пр.; Potter et al., 2009). В последнее время появляется все больше данных о воздействии НУП и на некоторых представителей микробиоты человека (Gannesen et al., 2018a; Louis et al., 2022). Кроме того, как и в случае катехоламинов (Reading et al., 2006), микроорганизмы потенциально могут иметь собственные рецепторные комплексы, взаимодействующие с НУП (Rosay et al., 2015).
В настоящее время актуален поиск соединений, способных оказывать влияние на микроорганизмы без прямого антибактериального воздействия, а значит, не вызывающих развития резистентности. К примеру, в косметологии растет интерес к поиску новых соединений, которые можно было бы включить в состав косметических продуктов и способных поддерживать микробный баланс кожи человека. Такие соединения могут быть использованы в будущем в качестве компонентов новых антимикробных и антибиопленочных препаратов. В связи с этим, НУП привлекают особое внимание в качестве влияющих на развитие бактерий соединений. На сегодняшний день известны следующие НУП: предсердный натрийуретический пептид (пептид А-типа, НУП-А), натрийуретический пептид типа B, или мозговой (НУП-В), типа С (НУП-С), типа D (НУП-D), а также уродилатин.
Согласно уже опубликованным данным, НУП оказывают действие на рост, вирулентность некоторых бактерий и формирование биопленок (Veron et al., 2007; Rosay et al., 2015; Gannesen et al., 2018a; Bagelman, Zvigule-Neidere, 2021; Louis et al., 2022). Ряд исследований демонстрирует, что НУП оказывают наибольшее действие, главным образом, на биопленки, в меньшей степени ‒ на планктонные культуры, что можно объяснить тем, что внутри организма человека и на его поверхности микроорганизмы существуют, в основном, в виде мультивидовых биопленок (Ramasamy et al., 2019). Было показано ингибирующее действие НУП-А и НУП-С на моновидовые биопленки C. acnes и S. au-reus. Однако клетки C. acnes росли лучше в бинарной биопленке в присутствии обоих гормонов. На основании этого можно заключить, что НУП повышают конкурентные свойства C. acnes в отношении стафилококка (Gannesen et al., 2018a). По данным еще одного недавнего исследования, НУП-А предотвращает формирование биопленок Pseudomonas aeruginosa и значительно ускоряет дисперсию уже сформированных. Было также показано, что НУП-А усиливает антибиопленочное действие антибиотиков с разным механизмом действия, вызывая почти полную дисперсию биопленок (Louis et al., 2022). В другой работе был продемонстрирован эффект, оказываемый НУП-А и НУП-С на биопленки S. aureus и S. epidermidis (Ганнесен и соавт., 2018; Gannesen et al., 2018b). Полученные результаты свидетельствуют о том, что действие НУП зависит от условий культивирования. При температуре 37°C рост моновидовых биопленок S. epidermidis и S. aureus, соответственно, стимулировался и ингибировался. При температуре 33°C эффект на оба микроорганизмa менялся нa противоположный: НУП ингибировали рост моновидовых биопленок у S. epidermidis и стимулировали у S. aureus (Ганнесен и соавт., 2018; Gannesen et al., 2018b). Еще одно исследование показало эффект НУП-А на моновидовые и бинарные биопленки C. acnes и S. epidermidis. Показано, что НУП-А стимулируют агрегацию C. acnes и метаболическую активность клеток S. epidermidis. Также, НУП-А снижает скорость роста S. epidermidis и стимулирует рост биопленок C. acnes (Ovcharova et al., 2021).
Итак, НУП-А представляет значительный интерес как регуляторное соединение, которое может воздействовать на различные микробные сообщества, в особенности на сообщества, содержащие представителей аэробных актинобактерий, эффект данных соединений на которые практически не изучен. Этот интерес также основан на потенциальной возможности использования НУП в качестве регулятора или ингибитора микробных биопленок в качестве компонента комплексных антимикробных препаратов (Louis et al., 2022). Кроме того, малое количество данных о взаимодействии микроорганизмов друг с другом в сообществах, и, в частности, отсутствие таких данных о S. aureus и K. schroeteri – потенциальных болезнетворных агентах, делает такие исследования актуальными и востребованными.
Целью данной работы было изучение действия НУП-А на моновидовые и бинарные биопленки K. schroeteri и S. aureus.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Штаммы и культивирование. В работе были использованы штаммы S. aureus 209P и K. schroeteri H01. Штамм K. schroeteri H01 был выделен с кожи человека, охарактеризован и протипирован ранее (Журина и соавт., 2017; Boukerb et al., 2019). Культуры хранили в пробирках с 5 мл полужидкой среды LB (“Диа-М”, Россия), с добавлением 0.4% агара (“Диа-М”, Россия), под слоем стерильного минерального масла. Для экспериментальной работы образцы биомассы выращивали на обогащенной клостридиальной среде (RCM) с 1.5% агара при 33.5°C до образования колоний, как описано ранее (Данилова и соавт., 2021). Среда RCM была выбрана как наиболее подходящая для выращивания изучаемых микроорганизмов (Mart’yanov et al., 2021). Состав среды RCM, г/л: дрожжевой экстракт – 13, пептон – 10, глюкоза – 5, NaCl – 5, ацетат натрия – 3, крахмал – 1, гидрохлорид цистеина – 0.5; pH 6.8–7.0. Для получения посевного материала биомассу колонии помещали в 50-миллилитровую коническую пробирку с 15 мл среды LB и инкубировали в течение 24 ч при 33.5°C и 150 об./мин.
Натрийуретический пептид. В работе использовали НУП-А (“Alfa-Aesar”, США) с молекулярным весом 3080.47 г/моль. Для приготовления стокового раствора пептида 1 мг гормона растворяли в 1 мл стерильной MilliQ (MQ) воды до достижения концентрации 1.623 × 10–4 M, раствор хранили при ‒20°C, как описано ранее (Ovcharova et al., 2021). Затем готовили серию десятикратных разведений в стерильной воде MQ для использования в работе. Физиологическая концентрация в плазме крови 6.5 × 10–12 M была выбрана в качестве основной в данной работе ( Stepniakowski et al., 1992; Yoshimura et al., 1994).
Рост моновидовых биопленок на тефлоновых кубиках. Эксперименты проводили по методике, описанной ранее (Данилова и соавт., 2020, 2021). После стерилизации пробирок со средой и кубиками в пробирки вносили необходимое количество гормона для достижения физиологической концентрации 6.5 × 10–12 M (Ф), а также 6.5 × 10–11 M (10Ф), 6.5 × 10–10 M (100Ф) и 6.5 × 10–9 M (1000Ф) и по 50 мкл заранее подготовленной клеточной суспензии из посевного материала, имеющей оптическую плотность (ОП) 0.5 при 540 нм. После этого все пробирки, включая положительные и холостые контроли, инкубировали в течение 24 или 72 ч при 33°C и 150 об./мин для получения формирующихся и зрелых биопленок соответственно. Температура 33°C соответствует температуре участков кожи, на которых обитают данные виды микроорганизмов (Ariyaratnam, Rood, 1990). По завершении инкубации измеряли оптическую плотность планктонных культур и экстрактов КФ из биопленок.
Рост биопленок на стекловолоконных фильтрах. В работе со стекловолоконными фильтрами исследовали биопленки в двух модельных системах, различающихся по полноте стадии первичной адгезии (Kiseleva et al., 2022). В первой модельной системе биопленки получали на фильтрах (“Whatman”, Великобритания) класса GF/F диаметром 21 мм, помещенных на поверхность агаризованной среды RCM на чашках Петри. Следовательно, стадия первичной клеточной адгезии в данной системе редуцирована. В основе второй модельной системы лежал рост биопленок в пробирках с фильтрами, погруженными в жидкую среду RCM. Инокулят засевали в жидкую среду, таким образом, биопленки формировались из планктонной культуры, и стадия начальной адгезии не была редуцирована.
Бактериальные суспензии доводили до ОП540 = = 0.5 и 1 стерильным физиологическим раствором (0.9% NaCl в дистиллированной воде). Культуры с ОП = 0.5 использовали для изучения моновидовых биопленок, а культуры с ОП = 1 смешивали в равных пропорциях для получения бинарных сообществ. В первой модельной системе стерильные фильтры помещали на агаризованную среду RCM (20 мл) на чашки Петри с добавлением необходимого количества НУП-А (контроль ‒ без добавления). Затем 20 мкл бактериальной суспензии помещали в центр каждого фильтра. Чашки инкубировали в течение 24 ч (формирующиеся биопленки) и 72 ч (зрелые биопленки) при 33°C, что соответствует температуре участков кожи, на которых обитают данные виды микроорганизмов.
Во второй модельной системе 6 мл жидкой среды RCM добавляли в толстостенные широкогорлые пробирки и помещали внутрь фильтры вертикально таким образом, чтобы они находились на одном уровне, были полностью покрыты средой и не соприкасались друг с другом. Затем в пробирку вносили необходимое количество НУП-А и 100 мкл бактериальной суспензии (контроль ‒ без добавления). Моновидовые и бинарные биопленки выращивали в течение 24 и 72 ч при 33°C. По истечении инкубации один фильтр с биомассой биопленки использовали для определения метаболической активности ее клеток, а другой фильтр использовали для определения количества КОЕ и оценки клеточной агрегации, как было описано ранее (Kiseleva et al., 2022).
Оценка метаболической активности. Для оценки метаболической активности клеток применяли методику окраски биопленок на фильтрах с помощью 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2-тетразолия бромида (MTT), как было описано ранее (Плакунов и соавт., 2016; Ovcharova et al., 2021; Kiseleva et al., 2022). Фильтры с биомассой биопленок окрашивали в течение 30 мин 3 мл раствора 0.1% MTT в стерильной среде LB при комнатной температуре. Затем фильтры отмывали дистиллированной водой для удаления остатков красителя. Экстракцию формазана проводили в 3 мл диметилсульфоксида (ДМСО) на каждый фильтр. ОП раствора измеряли при λ = 540 нм.
Оценка количества КОЕ в биопленках. Фильтры с биомассой помещали в пробирки с 10 мл стерильного физраствора, перемешивали стеклянной палочкой и встряхивали в течение 1 мин для создания гомогенной суспензии, как описано ранее (Ovcharova et al., 2021; Kiseleva et al., 2022). Затем готовили серию разведений полученной суспензии и помещали их на чашки Петри с агаризованной средой RCM. Чашки инкубировали в течение 48 ч при 33°C, после чего подсчитывали число колоний и количество КОЕ в биопленке на фильтре.
Оценка агрегации клеток. Агрегацию клеток в биопленках оценивали микроскопическим методом, как описано ранее (Ovcharova et al., 2021; Kiseleva et al., 2022). Суспензию фильтров с биомассой, полученную в опытах с КОЕ, наносили на предметное стекло, фиксировали и окрашивали КФ. Анализ агрегации клеток проводили с помощью светового микроскопа Jena (“Zeiss”, Германия) при увеличении объектива 90×. Анализировали размер агрегатов в клетках и соотношение одиночных клеток и агрегатов. Таким образом, предполагали, сколько КОЕ потенциально произрастало из одиночных клеток или из клеточных агрегатов. Для каждого образца проводили визуальный контроль максимально возможного числа полей зрения, после чего делали не менее 5 фотографий наиболее репрезентативных участков препарата, на которых вели подсчеты.
Изучение свойств клеточной поверхности K. schroeteri и S. aureus. Для изучения потенциальных изменений в свойствах клеточной поверхности в присутствии НУП-А был использован метод микробной адгезии к растворителям (microbial adhesion to solvents, MATS; Bellon-Fontaine et al., 1996). Планктонные культуры выращивали в 25 мл жидкой среды RCM с добавлением или без добавления НУП-А в 250-миллилитровых конических колбах, в которые вносили по 417 мкл инокулята с ОП540 = 0.5 на колбу. Моновидовые бактериальные культуры инкубировали при 33°C и 150 об./мин в течение 24 ч. Затем суспензии дважды отмывали физраствором и разбавляли до ОП400 0.8. В экспериментах 2.6 мл суспензии переносили в химически чистые стеклянные пробирки с резиновыми пробками. Для определения преобладающих кислотно-основных взаимодействий неполярные растворители с одинаковыми ван-дер-ваальсовыми свойствами поверхности использовали в паре с полярными (хлороформ‒гексадекан и этилацетат‒декан). В пробирки вносили по 0.4 мл полярного акцептора электронов по Льюису (хлороформ) или донора электронов (этилацетат). В другие пробирки, соответственно, вносили гексадекан и декан. Использовали растворители производства “Merck” (Германия). Пробирки закрывали и аккуратно встряхивали на шейкере в течение 1 мин. Затем, после разделения фаз, измеряли ОП400 водной фазы. Сродство к растворителю определяли, используя формулу (1 ‒ A/A0) × 100, где A – ОП400 водной фазы после встряхивания, A0 – ОП400 суспензии перед встряхиванием. Эксперименты проводили не менее чем в трех повторностях.
Конфокальная микроскопия и флуоресцентная гибридизация in situ (FISH). Метод FISH использовали для детекции S. aureus 209P в бинарном сообществе. Перед экспериментами определяли вероятность ложноположительной гибридизации. Для S. aureus использовали зонд 5'-GAA-GCA-AGC-TTC-TCG-TCC-G-3' (“Синтол”, Россия), меченный родамином R6G (Lawson et al., 2011).
Моновидовые и бинарные биопленки выращивали в 24-луночных планшетах со стеклянным дном, как описано ранее (Данилова и соавт., 2021). В лунки планшетов вносили по 1 мл среды с добавлением гормона или без, после чего вносили суспензию и культивировали при 33°C и 150 об./мин в течение 24 или 72 ч. Выросшие биопленки фиксировали 1 мл 96% этанола в течение 20 мин. Затем этанол удаляли, биопленки, содержащие стафилококк, гибридизовали зондом по методике, описанной ранее (Ovcharova et al., 2021), с изменениями в составе гибридизационного буфера, необходимыми для использованного зонда (Lawson et al., 2011). После конечного отмывания все образцы дополнительно красили универсальным красителем SYTO9 Green (“Thermo”, США) в течение 15 мин, как описано ранее (Kiseleva et al., 2022). Отмытые от красителя образцы высушивали и покрывали фиксирующей смолой Рrolong Gold antifade mountant (“Thermo Fisher”, США) для защиты от быстрой потери свечения. Планшеты оборачивали алюминиевой фольгой и хранили в темноте при 4°C.
Визуализацию образцов проводили с помощью конфокального микроскопа OLYMPUS FV3000 (Япония) с масляной иммерсией при увеличении объектива 60× (объектив UPLXAPO60XO 60.0X/1.518 Oil, N/A 1,42, U-DIC60). Для визуализации использовали диодные лазеры 488 и 561 нм для окрашенных SYTO9 и R6G образцов соответственно. Мощность лазеров составляла 10% от максимальной. Анализ образцов слепым методом и получение трехмерных изображений проводили по принципу, описанному ранее (Kiseleva et al., 2022) с интервалом по оси Z 0.36 мкм. Анализ файлов с разрешением .oib осуществляли в программе ImageJ (NIH, США) с использованием плагинов Bio-formats и Comstat2 (Университет Копенгагена, Дания). Сначала файлы .oib конвертировали в формат OME-TIFF без сжатия и сохраняли в одном файле. Затем рассчитывали параметр “занятая поверхность в слоях” для каждого z-стека в каждом файле в Comstat2 с индивидуальным порогом 1 и без фильтрации объема. Для каждого образца проводили максимально возможный визуальный анализ, после чего собирали трехмерные изображения не менее чем пяти наиболее репрезентативных полей зрения.
Статистическая обработка. Все эксперименты проводили не менее чем в трех независимых повторностях. Визуализацию данных проводили с помощью пакета Microsoft EXCEL 2010. Статистическую проверку проводили с помощью непараметрического критерия Манна‒Уитни.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рост моновидовых биопленок на тефлоновых кубиках. Вначале для определения общего действия НУП-А на микроорганизмы проанализировали диапазон концентраций НУП-А и их влияние на моновидовые планктонные культуры и биопленки K. schroeteri и S. aureus. Использовали физиологическую концентрацию 6.5 × 10−12 M в качестве исходной, а также три десятикратно увеличенные концентрации для моделирования различных патологических состояний организма человека. Было показано, что после 72 ч инкубирования НУП-А не оказывал значительного эффекта на рост планктонной культуры и биопленок, как в случае с K. schroeteri, так и S. aureus (рис. 1). В случае К. schroeteri, НУП-А оказывал слабый ингибирующий эффект на планктонную культуру, проявлявшийся при повышении концентрации гормона: при концентрации НУП-А 6.5 × 10−9 M ОП540 составляла 84.3 ± ± 6.8% от контроля (рис. 1а).
Рис. 1.
Действие различных концентраций атриального натрийуретического пептида (НУП-А) на моновидовые планктонные культуры и биопленки K. schroeteri и S. aureus на тефлоновых кубиках: а – K. schroeteri 72 ч; б – S. aureus 72 ч. 1 – контроль; 2 – НУП-А 6.5 × 10–12 (Ф); 3 – НУП-А 6.5 × 10–11 (10Ф); 4 – НУП-А 6.5 × 10–10 (100Ф); 5 – НУП‑А 6.5 × 10–9 (1000Ф).

В случае S. aureus, физиологическая концентрация усиливала рост биопленок до 122.6 ± 21.2% от контроля, но эффект не был статистически значимым (рис. 1б). При повышении концентрации выше физиологической стимуляция не наблюдалась. Также не было обнаружено эффекта на планктонных культурах.
Тем не менее, ранее было показано, что НУП‑А оказывает различное действие на биопленки в разных моделях (Ovcharova et al., 2021; Mart’yanov et al., 2021; Gannesen et al., 2021). Так, НУП-А в концентрации 6.5 × 10–10 M оказывал значительный эффект на сообщество S. epidermidis и C. acnes (Ovcharova et al., 2021). Таким образом, несмотря на первичное отсутствие наблюдаемого эффекта, было решено использовать концентрацию НУП-А 6.5 × 10–10 M для более глубокого изучения вопроса о том, оказывает ли гормон действие на сообщество S. aureus и K. schroeteri в других системах.
Рост биопленок на стекловолоконных фильтрах. Биопленки выращивали на фильтрах в различных системах, чтобы выявить, влияет ли НУП-А в концентрации 6.5 × 10–10 M (100Ф) на биопленки S. aureus и K. schroetri, и имеются ли различия в формировании биопленок при наличии и в отсутствии первичной адгезии соответственно (рис. 2). Сначала в системе с редуцированной начальной адрезией на чашках в контрольных образцах наблюдали увеличение числа КОЕ в контрольных образцах с 8.1 × 108 ± 2.0 × 108 (24 ч) до 1.4 × 109 ± ± 8.3 × 108 КОЕ на фильтр (72 ч, рис. 2а). НУП-А оказывал значительный стимулирующий эффект на количество КОЕ после 24 ч инкубации (2.6 × × 109 ± 1.3 × 109 КОЕ на фильтр), однако после 72 ч эффект становился незначительным. Метаболическая активность клеток в моновидовых биопленках K. schroeteri не изменялась в зрелых биопленках (72 ч) в присутствии НУП-А. После 24 ч инкубации, при этом, обнаружили значительное увеличение ОП экстрактов формазана в присутствии гормона (от 3.5 ± 0.18 до 5.4 ± 0.9; рис. 2б).
Рис. 2.
Действие НУП-А на моновидовые и бинарные биопленки K. schroeteri и S. aureus, выращенные на агаризованной среде RCM: а – число КОЕ моновидовых биопленок K. schroeteri; б – метаболическая активность моновидовых биопленок K. schroeteri; в – число КОЕ моновидовых биопленок S. aureus; г – метаболическая активность моновидовых биопленок S. aureus; д – число КОЕ бинарных биопленок K. schroeteri и S. aureus; е – метаболическая активность бинарных биопленок K. schroeteri и S. aureus. I – инкубация 24 ч; II – инкубация 72 ч. 1 – контроль; 2 – НУП-А 6.5 × 10–10 (100Ф). * p < 0.05.

Присутствие гормона в среде не оказывало влияния на количество КОЕ в моновидовых биопленках S. aureus ни после 24, ни после 72 ч инкубации (рис. 2в). В целом, число КОЕ увеличивалось в зрелых биопленках (в контрольных образцах с 1.3 × 109 до 5.2 × 109 КОЕ на фильтр). В присутствии НУП-А после 24 ч инкубации наблюдали некоторое снижение числа КОЕ до 6 × × 107 ± 1.5 × 107 КОЕ на фильтр. Метаболическая активность в присутствии НУП-А также не менялась значительно ни после 24, ни после 72 ч инкубации по сравнению с контролем (рис. 2г). При этом в целом ОП540 экстрактов формазана была ниже, чем в образцах K. schroeteri (рис. 2г).
В бинарных биопленках при подсчете КОЕ выявляли только колонии S. aureus, что свидетельствовало, во-первых, об их конкурентном преимуществе перед K. schroeteri. После 24 ч инкубации количество КОЕ под влиянием гормона увеличилось до 1.3 × 109 ± 3.8 × 108 КОЕ на фильтр, при контрольном значении 3.6 × 109 ± 1.2 × × 109 КОЕ на фильтр. После 72 ч эти значения составляли 5.1 × 109 ± 2.2 × 109 и 4 × 109 ± 1.2 × 109 соответственно (рис. 2д). НУП-А не оказывал значительного эффекта на метаболическую активность бинарных биопленок, однако ОП540 была ближе к ее знасению у моновидовых биопленок K. schroeteri (рис. 2е).
Следовательно, несмотря на видимое отсутствие КОЕ китококков в бинарных биопленках, изменения в значении ОП540 свидетельствует о том, что потенциально китококки не были полностью подавлены, однако их количество было существенно ниже, что не позволило эффективно выявить их КОЕ.
Во второй модельной системе рост биопленки шел из формирующейся параллельно планктонной культуры и, соответственно, стадия первичной адгезии клеток не редуцировалась. Это сказалось на результатах. Показано, что число КОЕ в моновидовых биопленках K. schroeteri значительно увеличивалось после 72 ч инкубации по сравнению с 24 ч в контроле (с 5.2 × 107 ± 2 × 107 до 1.2 × 108 ± 3.3 × 107 КОЕ на фильтр) (рис. 3а). В присутствии НУП-А после 24 ч инкубации число КОЕ увеличивалось до 1.2 × 108 ± 6.4 × 107, а после 72 ч – до 3.0 × 108 ± 1.7 × 108 КОЕ на фильтр. Между тем метаболическая активность моновидовых биопленок K. schroeteri значительно не менялась, хотя в зрелых биопленках она была более чем вдвое выше, чем в формирующихся. Kytococcus растет медленнее, чем Staphylococcus, следовательно, присутствие стадии первичной адгезии потенциально могло увеличить время формирования биопленки, что привело к различию в значениях ОП в биопленках после 24 и 72 ч. Эти различия не наблюдались на чашках Петри (рис. 3б).
Рис. 3.
Действие НУП-А на моновидовые и бинарные биопленки K. schroeteri и S. aureus выращенные на жидкой среде: а – число КОЕ моновидовых биопленок K. schroeteri; б – метаболическая активность моновидовых биопленок K. schroetri; в – число КОЕ моновидовых биопленок S. aureus; г – метаболическая активность моновидовых биопленок S. a-reus; д – число КОЕ в бинарных биопленках; е – метаболическая активность бинарных биопленок. I – инкубация 24 ч; II – инкубация 72 ч. 1 – контроль; 2 – НУП-А 6.5 × 10–10 (100Ф). * p < 0.05.
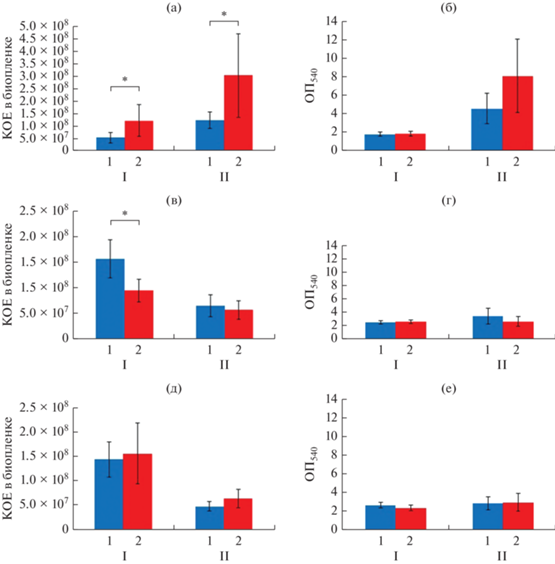
В моновидовых биопленках S. aureus число КОЕ снижалось после 72 ч инкубации по сравнению с формирующимися биопленками, а в контрольных образцах составляло 1.6 × 108 ± 3.8 × 107 и 6.5 × 107 ± 2.2 × 106 КОЕ на фильтр после 24 и 72 ч соответственно, что отличалось от данных для системы с редуцированной стадией адгезии. НУП-А оказывал подавляющий эффект на количество КОЕ в формирующихся биопленках и снижал это значение после 24 ч до 9.5 × 107 ± 2.2 × 107 КОЕ на фильтр (рис. 3в). Метаболическая активность биопленок S. aureus значительно не менялась, но в целом она была ниже, чем в первой системе вследствие меньшего количества биомассы (рис. 3г). Следовательно, можно предположить, что в формирующихся 24 ч биопленках клетки менее активны метаболически, или что каждая КОЕ содержит меньшее число клеток, что требует подтверждения.
В бинарных биопленках K. schroeteri и S. aureus с нередуцированной стадией первичной адгезии также наблюдали преимущество в росте S. aureus. Количество КОЕ S. aureus было на том же уровне, что и в моновидовых биопленках, однако в присутствии K. schroeteri ингибирующее действие НУП-А после 24 ч пропадало (рис. 3д). Метаболическая активность клеток в бинарной биопленке была несколько выше, чем в моновидовых биопленках S. aureus. Таким образом, можно предполагать, что и в данной системе китококки не были полностью вытеснены (рис. 3е).
Число КОЕ в исследованиях биопленок может быть не совсем точным параметром. Даже после разрушения биопленки значительное число клеток может оставаться в виде клеточных агрегатов, что может искажать результат подсчета КОЕ. Следовательно, метод подсчета КОЕ следует комбинировать с анализом агрегации. Поэтому для уточнения результатов подсчета КОЕ использовали анализ агрегации клеток с использованием световой микроскопии. Для этого исследовали агрегацию клеток в моновидовых и бинарных биопленках, подсчитывали число агрегатов отдельных клеток и количество клеток в агрегатах. Вначале проанализировали биопленки на агаризованной среде RCM. K. schroeteri продемонстрировал высокую степень агрегации в биопленках (70% и больше), после 24 ч инкубации средний размер агрегата в контрольных образцах был 6.8 ± 0.8 клеток, а после 72 ч он увеличился до 22.6 ± 8.4 клеток в контроле (рис. 4а, 4б, рис. S1, S2 ). Таким образом, большая часть КОЕ в биопленках китококков была представлена клеточными агрегатами, и можно говорить о том, что длительное культивирование K. schroeteri увеличивает число трудноразрушаемых клеточных агрегатов. НУП-А при этом не оказывал значительного влияния на агрегацию. Следовательно, в системе с редуцированной начальной адгезией на чашках Петри НУП-А стимулировал рост K. schroeteri в формирующихся 24-часовых биопленках. Это следует из одновременного отсутствия изменений в агрегации и увеличения числа КОЕ. На зрелые биопленки НУП-А не оказывал значимого эффекта, так как параметры были близки к значениям контрольных образцов. Таким образом, вероятно, присутствие гормона увеличивает рост биопленки в начале культивирования и, потенциально, дисперсию биопленки в стационарной фазе.
Рис. 4.
Анализ агрегации клеток в моновидовых и бинарных биопленках K. schroeteri и S. aureus, выращенных на плотной среде RCM: а – соотношение клеток и агрегатов в моновидовых биопленках K. schroeteri, %; б – размер клеточных агрегатов в моновидовых биопленках K. schroeteri; в – соотношение клеток и агрегатов в моновидовых биопленках S. aureus, %; г – размер клеточных агрегатов в моновидовых биопленках S. aureus; д – соотношение клеток и агрегатов в бинарных биопленках, %; е – размер клеточных агрегатов в бинарных биопленках. I – инкубация 24 ч; II – инкубация 72 ч. А – агрегаты клеток; Б – одиночные клетки. 1 – контроль; 2 – НУП-А 6.5 × 10–10 (100Ф). * p < 0.05.

В случае S. aureus наблюдали практически равный вклад отдельных клеток и клеточных агрегатов в подсчет КОЕ. Уровень отдельных клеток в контроле после 24 ч инкубации составлял 43.5% и после 72 ч – 44.8% (pис. 4б). Размер агрегатов был меньше, чем размер агрегатов, образованных K. schroeteri (4.9 ± 1.4 после 24 ч и 4.3 ± 1 после 72 ч в контроле; рис. 4г; рис. S1, S2 ). НУП-А незначительно влиял на уровень агрегации и размер агрегатов у стафилококков (pис. 4в, 4г; рис. S1, S2 ). Таким образом, в системе с редуцированной адгезией действия гормона на S. aureus не наблюдали.
В бинарных биопленках K. schroeteri и S. aureus соотношение между отдельными клетками и агрегатами в контроле после 24 ч инкубации было близко к равновесному, в то время как после 72 ч равновесие сместилось в сторону агрегатов (68%; pис. 4д). Размер агрегатов также значительно увеличился в контрольных образцах в течение времени созревания биопленки (с 3.3 ± 0.3 до 5 ± 1.5 клеток; pис. 4е). НУП-А увеличивал долю агрегатов в биопленке после 24 ч с 54.2 ± 6.7 до 68.8 ± 5.5% и средний размер с 3.2 ± 0.3 до 7.1 ± 1.8 клеток. Таким образом, увеличение агрегации в суточном микробном сообществе в системе с редуцированной стадией адгезии на чашках Петри может быть причиной уменьшения числа КОЕ. Кроме того, размер агрегатов в бинарных биопленках был схож с таковым в биопленках стафилококков. В зрелых биопленках эффекта гормона в данной системе не наблюдали. Также, увеличение агрегации в суточных бинарных биопленках позволяет предполагать, что потенциально НУП-А усиливал рост и деление клеток.
При изучении агрегации клеток в биопленках на жидкой среде RCM с полным циклом стадий адгезии были получены следующие результаты. В контрольных образцах биопленок возрастом 24 и 72 ч доля агрегатов и отдельных клеток была практически одинаковой ‒ примерно 50% (pис. 5а). Добавление НУП-А слегка сдвигало баланс в сторону агрегатов в биопленках возрастом 24 ч, а в зрелых биопленках эффекта не наблюдали. Размер агрегатов в моновидовых биопленках K. schroeteri после 24 ч увеличивался в присутствии гормона до 5.5 ± 0.7 клеток (в контроле 3.9 ± 0.4; рис. 5б), в то время как в зрелых биопленках возрастом 72 ч он не менялся в присутствии НУП-А (4‒4.5 клетки на агрегат). Эти результаты являлись статистически значимыми.
Рис. 5.
Анализ агрегации клеток в моновидовых и бинарных биопленках K. schroeteri и S. aureus, выращенных на жидкой среде: а – соотношение клеток и агрегатов в моновидовых биопленках K. schroeteri, %; б – размер клеточных агрегатов в моновидовых биопленках K. schroeteri; в – соотношение клеток и агрегатов в моновидовых биопленках S. aureus, %; г – размер клеточных агрегатов в моновидовых биопленках S. aureus; д – соотношение клеток и агрегатов в бинарных биопленках, %; е – размер клеточных агрегатов в бинарных биопленках. I – инкубация 24 ч; II – инкубация 72 ч. А – агрегаты клеток; Б – одиночные клетки. 1 – контроль; 2 – НУП-А 6.5 × 10–10 (100Ф). * p < 0.05.

В моновидовых биопленках S. aureus после 24 ч доли клеток и клеточных агрегатов были практически равными, а гормон не оказывал влияния на этот баланс (pис. 5г), однако в зрелых биопленках присутствовали по большей части только отдельные клетки как потенциальные КОЕ (62.4 ± 6.6%). Добавление НУП-А увеличивало эту долю до 76.7 ± ± 2.8%. Гормон также несколько стимулировал агрегацию в биопленках S. aureus после 72 ч инкубации (2.4 ± 0.3 – контроль; 3.0 ± 0.3 – в присутствии НУП-А). Таким образом, изменения в числе КОЕ (pис. 3в) в зрелых биопленках стафилококков не были связаны с несколько большими размерами клеточных агрегатов или большим количеством клеток. Следовательно, несмотря на отсутствие визуально наблюдаемых изменений в подсчете КОЕ, в реальности, судя по всему, имели место глубокие изменения в агрегации клеток в зрелых биопленках S. aureus.
В бинарных биопленках S. aureus также оказывал большее влияние на микробное сообщество. Наблюдалось преобладание отдельных клеток над агрегатами в течение времени инкубирования (63.4 и 67.5% в контроле), несмотря на тот факт, что доля агрегации в моновидовых биопленках была выше. Таким образом, агрегация клеток двух видов в системе с нередуцированной стадией первичной адгезии была слабой. Количество клеток под воздействием НУП-А увеличилось до 77 ± 6% после 24 ч и не менялось поле 72 ч. Размер агрегатов не менялся и был близок к таковому в моновидовых биопленках S. aureus.
В модели, где начальная стадия адгезии не редуцирована, НУП-А в суточных бинарных сообществах ведет себя как ингибитор агрегации. В то же время, если начальный этап агрегации отсутствует, в целом агрегация стимулируется. Следовательно, можно утверждать, что основной точкой действия НУП-А является процесс коагрегации клеток и потенциальные изменения свойств поверхности и деления клеток. Также НУП-А действует в качестве ингибитора роста S. aureus в моновидовых биопленках в системе с нередуцированной первичной адгезией. Таким образом, полученные данные также говорят о важности агдезии клеток к поверхностям и потенциальном действии на этот процесс НУП-А.
Изучение свойств клеточной поверхности K. schroeteri и S. aureus. Физико-химические характеристики клеточной поверхности микроорганизмов оказывают значительное влияние на их адгезию к субстратам и поверхностям. Результаты, полученные по методике MATS показали, что в контрольных образцах клетки K. schroeteri имеют невысокое сродство к декану и высокое к хлороформу: 28.6 ± ± 6.9 и 62.7 ± 7.5% соответственно (pис. 6а). Высокое сродство к хлороформу предполагает, что клеточная поверхность преимущественно электроотрицательная. Также клетки K. schroeteri обладали средними гидрофобными свойствами, что было видно по измерению афинности к гидрофобным растворителям. Сродство клеток K. schroeteri к гексадекану было наименьшим. Добавление НУП-А не оказывало значимого эффекта на сродство клеток китококков ко всем растворителям, кроме гексадекана, в случае которого наблюдали понижение и без того низкого сродства (с 12 ± 2.6 до 7.2 ± 2.5%).
Клетки S. aureus также обладали высоким сродством к хлороформу (69.2 ± 5.4%) и средним ‒ к декану (46.5 ± 1.8%) и гексадекану (47.1 ± 7.4%), что говорит об электроотрицательности клеточной поверхности стафилококка (по классификации кислот и оснований Льюиса) и средней гиброфобности (рис. 6б). Сродство клеток к этилацетату при этом было довольно низким. Добавление НУП-А к среде не оказывало значительного эффекта в случае хлороформа и этилацетата, но понижало сродство к декану и гексадекану до 43.4 ± 4.7 и 28.2 ± 6.1% соответственно. Это свидетельствует о снижении гидрофобности клеток S. aureus в присутствии НУП-А и, как следствие, о потенциально сниженной способности к адгезии к гидрофобным поверхностям, а также клеток друг к другу. Более того, изменения происходили в паре растворителей хлороформ‒гексадекан, что позволяет предположить изменение в структурах, обладающих определенным значением сил Ван-дер-Ваальса. Тем не менее, возникает вопрос о том, почему в присутствии гормона влияния на рост биопленок не отмечено в системе с тефлоновыми кубиками. Вероятное объяснение этого – наличие неких структур, которые дополнительно отвечают за адгезию к носителям вроде тефлона. Эта гипотеза спекулятивна и должна быть проверена в дальнейшем.
Рис. 6.
Изменения сродства к полярным и неполярным растворителям: а – K. schroeteri; б – S. aureus. 1 – контроль; 2 – НУП-А 6.5 × 10–10 (100Ф). CH – хлорофом; EA – этилацетат; DE – декан; HD – гексадекан. * p < 0.05.

Таким образом, поскольку по результатам работы S. aureus являлся доминирующим компонентом сообщества, снижение степени сродства к гексадекану в присутствии НУП-А именно у клеток стафилококка могло являться одной из основных причин изменений в росте бинарных биопленок.
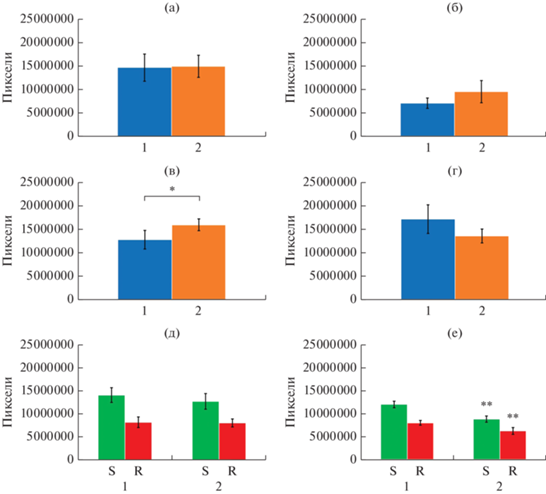
Конфокальная микроскопия бинарных биопленок. Ввиду специфичности использованного в данной работе конфокального микроскопа Olympus и расширения получающихся файлов, было проанализировано общее число пикселей в каждом файле формата OME-TIFF, полученном из образцов. В данной системе биопленки были образованы планктонными клетками на плоской и гладкой стеклянной поверхности 24-луночных культуральных планшетов. В моновидовых биопленках не было обнаружено значимого эффекта НУП-А на их рост ни после 24 ч, ни после 72 ч инкубации. В образцах S. aureus была обнаружена незначительная тенденция к стимуляции после 24 ч и к ингибированию после 72 ч, что позволяет предположить ускорение роста биопленки в присутствии НУП-А (рис. 7в), однако этот эффект был статистически незначимым. Визуализация биопленок приведена в приложении (рис. S3 и рис. S4 ). Несмотря на отсутствие значимых эффектов НУП-А на моновидовые биопленки, интересные данные для этой модельной системы были получены в бинарном сообществе (pис. 7д, 7е). Из анализа изображений видно, что S. aureus действительно являлся доминирующим компонентом сообщества, составляя не менее 60% биомассы. Это выглядит логичным ввиду более высокой скорости роста стафилококка, а также учитывая тот факт, что при проведении FISH зачастую детектируются не все клетки. В то время как в формирующихся биопленках возрастом 24 ч (рис. 7д) эффект гормона отсутствовал, в зрелых биопленках возрастом 72 ч (рис. 7е) под действием НУП-А значительно снижалось число пикселей в обоих каналах (в зеленом ‒ с 12 148 054.7 ± 698 390.7 до 8 906 087.8 ± 710 370.1; в красном ‒ с 8 070 882.8 ± 522 088 до 6 312 657.2 ± ± 767 297.9). Это можно объяснить, во-первых, особенностями модельной системы, а во-вторых, сниженной способностью S. aureus к агрегации после 72 ч (рис. 5в). Поскольку S. aureus, по-видимому, является доминирующим видом в сообществе, его способность к агрегации могла быть ключевой для стабильности всего сообщества. Таким образом, результаты КЛСМ, при сопоставлении их с другими данными, позволяют установить, что свойства клеточной поверхности и адгезия могут быть основными точками действия НУП-А на эти виды микроорганизмов.
Рис. 7.
Пиксельный объем биопленок, измеренный с помощью КЛСМ: а – моновидовые биопленки K. schroeteri 24 ч; б – моновидовые биопленки K. schroeteri 72 ч; в – моновидовые биопленки S. aureus 24 ч; г – моновидовые биопленки S. aureus 72 ч; д – бинарные биопленки 24 ч; е – бинарные биопленки 72 ч. 1 – контроль; 2 – НУП-А 6.5 × 10–10 (100Ф). S – окраска бинарных биопленок SYTO9; R – окраска бинарных биопленок R6G. * p < 0.05; ** p < 0.01.
В настоящее время известно, что натрийуретические пептиды являются аффекторами микробных сообществ. В предыдущих работах отмечено, что НУП способны выступать в качестве регуляторов различных процессов в клетках микроорганизмов, а также в качестве улучшителей роста для отдельных компонентов микробного сообщества (Rosay et al., 2015; Ганнесен и соавт., 2018; Ovcharova et al., 2021). Было показано, что НУП-А оказывает эффект на P. aeruginosa, действуя в качестве разрушающего биопленки агента и усиливая действие антибиотиков (Louis et al., 2022). Установлено, что в исследованных на сегодняшний день бинарных сообществах микроорганизмов НУП-А ускоряет рост более “безопасных” бактерий в противовес более “вредным”. Это касается улучшения роста C. acnes или S. epidermidis относительно золотистого стафилококка (Gannesen et al., 2018a, Ганнесен и соавт., 2018б). В случае C. acnes, рост данных бактерий в присутствии НУП-А также улучшался в сообществе с S. epidermidis (Ovcharova et al., 2021).
Во впервые исследованном сообществе K. schroeteri H01 и S. aureus 209P не наблюдали столь выраженного эффекта от гормона, какой наблюдался, например, для сообщества S. epidermidis и C. acnes (Ovcharova et al., 2021). По результатам предыдущих исследований, тем не менее, можно было предположить, что концентрация НУП-А 6.5 × 10–10 M может быть эффективной и в отношении других модельных сообществ микроорганизмов кожи. В данной работе было показано, что НУП-А не оказывает сильного действия на рост биопленок или планктонных культур в определенных модельных системах (например, на тефлоновых кубиках), но способен изменять свойства клеточной поверхности и процессы агрегации биопленок, что можно выявить лишь проведением более глубоких исследований с использованием других моделей. Снижение сродства к гексадекану в присутствии НУП-А привело к частичному снижению гидрофобности клеток обоих микроорганизмов и, как следствие, к потенциальному снижению сродства клеток данных штаммов к носителю и друг к другу в случае S. aureus. Это было показано в системах, где биопленки формировались из планктонных культур, и стадия первичной адгезии не была редуцирована. При этом добавление НУП-А стимулировало рост K. schroeteri, и способность к коадгезии у китококков не снижалась даже из-за более низкого сродства к гексадекану. Будучи микроорганизмом с изначально более низкой скоростью роста, K. schroeteri не мог оказать значимого вклада в общую биомассу биопленок. Тем не менее, присутствие китококков меняло эффект НУП-А на бинарные биопленки. Например, в системах с нередуцированной стадией первичной адгезии K. schroeteri снижал ингибирующий эффект НУП-А на S. aureus (потенциально из-за свойств его клеточной поверхности). Кроме того, в присутствии Kytococcus размер агрегатов в бинарных сообществах был выше, чем в моновидовых биопленках S. aureus. Однако в самой биопленке имел место антагонизм между двумя бактериями. НУП-А ингибировал рост стафилококков в присутствии китококков в сообществе, что было показано в модели со стекловолоконными фильтрами, в которой стадия первичной адгезии была редуцирована, а также с помощью конфокальной микроскопии.
Таким образом, в исследованном бинарном сообществе наблюдали амбивалентную роль K. schroeteri. С одной стороны, китококки положительно влияют на адгезию S. aureus, а с другой стороны, “переключают” действие НУП-А на сообщество со стимулирующего на ингибирующее. Таким образом, Kytococcus может рассматриваться в качестве потенциального пробиотика для кожи, усиливающего антибактериальные свойства разных соединений против оппортунистических патогенов, таких как S. aureus. Что касается НУП-А, несомненно, изменение свойств клеточной поверхности может быть одним из результатов комплексного молекулярного механизма действия НУП-А на клетки. Если у бактерий имеются рецепторы к НУП-А (что было недавно показано в работе Louis et al., 2022), то его действие на бактерии может быть построено на индуцировании целого каскада внутриклеточных реакций. В случае P. aeruginosa НУП-А является стимулятором дисперсии зрелых биопленок. В нашем случае можно предположить наличие такого же воздействия как минимум на S. aureus, в случае которого, в определенных ситуациях, меньшее количество биомассы и меньшее число клеточных агрегатов обнаруживалось в биопленках через 72 ч. Однако данные гипотезы требуют подтверждения более глубокими исследованиями в будущем.
Говоря о поверхностных свойствах клеток и их изменениях, вызванных добавлением гормона, необходимо отметить, что эти изменения, возможно, касаются только определенных поверхностных структур, поскольку в опытах с тефлоновыми кубиками изменений в окраске КФ, а, следовательно, в общем объеме биомассы, не наблюдали. Это может быть также объяснено гипотетическим изменением количества матрикса в биопленках, что, однако, требует подтверждения в будущем. Тем не менее, по результатам работы уместно поставить вопрос об эффективности окрашивания кристаллическим фиолетовым в качестве универсального метода скрининга первичных активных соединений.
Резюмируя, необходимо отметить, что в данной работе было впервые продемонстрировано действие НУП-А на сообщества S. ureus и K. schroeteri. Механизм действия НУП-А, по-видимому, связан преимущественно с изменениями адгезивных свойств клеток. Также необходимо подчеркнуть дуалистическую роль K. schroeteri. Можно предположить, что эти бактерии могут использоваться в качестве потенциального кожного пробиотика, усиливающего ингибирующее действие НУП-А на S. aureus. Эти свойства делают в будущем НУП-А и K. schroeteri перспективными агентами для лечения кожи и поддержания ее гомеостаза. Однако, в связи с относительно большим количеством отмеченных случаев воспалений имплантов, вызванных K. schroeteri, необходимо учитывать все свойства китококков для работы с ними в качестве пробиотиков в будущем.
Список литературы
Ганнесен А.В., Лезуатье О., Нетрусов А.И., Плакунов В.К., Фейоле М.Ж.Ж. Регуляция натрийуретическими пептидами формирования моновидовых и бинарных биопленок бактерий микробиоты кожи Staphylococcus epidermidis и Staphylococcus aureus // Микробиология. 2018. Т. 87. С. 469‒482.
Gannesen A.V., Lesouhaitier O., Netrusov A.I., Plakunov V.K., Feuilloley M.G.J. Regulation of formation of monospecies and binary biofilms by human skin microbiota components, Staphylococcus epidermidis and Staphylococcus aureus, by human natriuretic peptides // Microbiology (Moscow). 2018b. V. 87. P. 597–609.
Данилова Н.Д., Гераськина О.В., Дювенжи Е.В., Феофанов А.В., Плакунов В.К., Ганнесен А.В. Ингибирующее действие норадреналина на рост биопленок комменсала кожи человека Kytococcus schroeteri H01 // Микробиология. 2021. Т. 90. С. 618‒622.
Danilova N.D., Geras’kina O.V., Diuvenji E.V., Feofanov A.V., Plakunov V.K., Gannesen A.V. Inhibitory effect of norepinephrine on biofilm growth of the human skin commensal Kytococcus schroeteri H01 // Microbiology (Moscow). 2021. V. 90. P. 666‒669.
Данилова Н.Д., Соловьева Т.В., Мартьянов С.В., Журина М.В., Ганнесен А.В. Стимулирующий эффект адреналина на биопленки Micrococcus luteus C01 // Микробиология. 2020. Т. 89. С. 488‒492.
Danilova N.D., Solovyeva T.V., Mart’yanov S.V., Zhurina M.V., Gannesen A.V. Stimulatory effect of epinephrine on biofilms of Micrococcus luteus C01 // Microbiology (Moscow). 2020. V. 89. P. 493‒497.
Плакунов В.К., Мартьянов С.В., Тетенева Н.А., Журина М.В. Универсальный метод количественной характеристики роста и метаболической активности микробных биопленок в статических моделях // Микробиология. 2016. Т. 85. С. 484‒489.
Plakunov V.K., Mart’yanov S.V., Teteneva N.A., Zhurina M.V. A universal method for quantitative characterization of growth and metabolic activity of microbial biofilms in static models // Microbiology (Moscow). 2016. V. 85. P. 509‒513.
Aepinus C., Adolph E., von Eiff C., Podbielski A., Petzsch M. Kytococcus schroeteri: a probably underdiagnosed pathogen involved in prosthetic valve endocarditis // Wien. Klin. Wochenschr. 2008. V. 120. № 1‒2. P. 46–49.
Ariyaratnam S., Rood J.P. Measurement of facial skin temperature // J. Dentistry. 1990. V. 18. P. 250–253.
Bagelman S., Zvigule-Neidere G. Insight into Kytococcus schroeteri infection management: a case report and review // Infect. Dis. Rep. 2021. V. 13. P. 230–238.
Balasubramanian D., Harper L., Shopsin B., Torres V.J. Staphylococcus aureus pathogenesis in diverse host environments // Pathog. Disease. 2017. V. 75. ftx005.
Becker K., Schumann P., Wüllenweber J., Schulte M., Weil H.P., Stackebrandt E., Peters G., von Eiff C. Kytococcus schroeteri sp. nov., a novel Gram-positive actinobacterium isolated from a human clinical source // Int. J. Syst. Evol. Micro-biol. 2002. V. 52. P. 1609‒1614.
Bellon-Fontaine M.N., Rault J., van Oss C.J. Microbial adhesion to solvents: a novel method to determine the electron-donor/electron-acceptor or Lewis acid-base properties of microbial cells // Colloids Surf. B: Biointerfaces. 1996. V. 7. P. 47‒53.
Boukerb A.M., Robert M., Teteneva N.A., Danilova N.D., Zhurina M.V., Mart’yanov S.V., Plakunov V.K., Feuilloley M.G.J., Gannesen A.V. Draft genome sequence of Kytococcus schroeteri strain h01, isolated from human skin. Microbiol. Res. Ann., V. 8. № 40, e01081-19.
Blennow O., Westling K., Froding I., Ozenci V. Pneumonia and bacteremia due to Kytococcus schroeteri // J. Clin. Microbiol. 2011. V. 50. P. 522–524.
Gannesen A.V., Lesouhaitier O., Racine P.-J., Barreau M., Netrusov A.I., Plakunov V.K., Feuilloley M.G.J. Regulation of monospecies and mixed biofilms formation of skin Staphylococcus aureus and Cutibacterium acnes by human natriuretic peptides // Front. Microbiol. 2018a. V. 9. P. 2912.
Gannesen A.V., Schelkunov M.I., Geras’kina O.V., Makarova N.E., Sukhacheva M.V., Danilova N.D., Ovcharo-va M.A., Mart’yanov S.V., Pankratov T.A., Muzychen-ko D.S., Zhurina M.V., Feofanov A.V., Botchkova E.A., Plakunov V.K. Epinephrine affects gene expression levels and has a complex effect on biofilm formation in Micrococcus luteus strain C01 isolated from human skin // Biofilm. 2021. V. 3. 100058.
Grice E.A., Kong H.H., Conlan S., Deming C.B., Davis J., Young A.C. Topographical and temporal diversity of the human skin microbiome // Science. 2009. V. 324. P. 1190–1192.
Kiseleva A.A., Solovyeva T.V., Ovcharova M.A., Geras’kina O.V., Mart’yanov S.V., Cherdyntseva T.A., Danilova N.D., Zhurina M.V., Botchkova E.A., Feofanov A.V., Plakunov V.K., Gannesen A.V. Effect of β-estradiol on mono-and mixed-species biofilms of human commensal bacteria Lactobacillus paracasei AK508 and Micrococcus luteus C01 on different model surfaces // Coatings. 2022. V. 12. Art. 436.
Lawson T.S., Connally R.E., Iredell J.R., Vemulpad S., Piper J.A. Detection of Staphylococcus aureus with a fluorescence in situ hybridization that does not require lysostaphin // J. Clin. Lab. Anal. 2011. V. 25. P. 142‒147.
Louis M., Clamens T., Tahrioui A., Desriac F., Rodrigues S., Rosay T., Barreau M., Racine P.-J., Bouffartigues E., Cornelis P., Chevalier S., Feuilloley M.G.J., Lesouhaitier O. Pseudomonas aeruginosa biofilm dispersion by the human atrial natriuretic peptide // Adv. Sci. 2022. V. 9. e2103262.
Lyte M. Microbial endocrinology and infectious disease in the 21st century // Trend Microbiol. 2004. V. 12. P. 14‒20.
Mart’yanov S.V., Botchkova E.A., Plakunov V.K., Gannesen A.V. The impact of norepinephrine on mono-species and dual-species Staphylococcal biofilms // Microorganisms. 2021. V. 9. P. 820.
Ovcharova M.A., Geraskina O.V., Danilova N.D., Botchkova E.A., Martyanov S.V., Feofanov A.V., Plakunov V.K., Gannesen A.V. Atrial natriuretic peptide affects skin commensal Staphylococcus epidermidis and Cutibacterium acnes dual-species biofilms // Microorganisms. 2021. V. 9. P. 552.
Parlet C.P., Brown M.M., Horswill A.R. Commensal staphylococci influence Staphylococcus aureus skin colonization and disease // Trends Microbiol. 2019. V. 27. P. 497‒507.
Potter L.R., Yoder A.R., Flora D.R., Antos L.K. Dickey D.M. Natriuretic peptides: their structures, receptors, physiologic functions and therapeutic applications // cGMP: Generators, Effectors and Therapeutic Implications. Handbook of Experimental Pharmacology, vol. 191 / Eds. Schmidt H.H.H.W., Hofmann F., Stasch J.P. Berlin, Heidelberg: Springer, 2009. P. 341‒366.
Ramasamy S., Barnard E., Dawson T.L., Jr., Li H. The role of the skin microbiota in acne pathophysiology // Br. J. Dermatol. 2019. V. 181. P. 691‒699.
Rosay T., Bazire A., Diaz S., Clamens T., Blier A.S., Mijouin L., Hoffmann B., Sergent J.-A., Bouffartigues E., Booireau W., Vieillard J., Hulen C., Dufour A., Harmer N.J., Feuilloley M.G.J., Lesouhaitier O. Pseudomonas aeruginosa expresses a functional human natriuretic peptide receptor ortholog: involvement in biofilm formation // MBio. 2015. V. 6. e01033-15.
Schaumburg F., Schmalstieg C., Fiedler B., Brentrup A., Omran H., Becker K. A bumpy road to the diagnosis of a Kytococcus schroeteri shunt infection // J. Med. Microbiol. 2013. V. 62. P. 165–168.
Stepniakowski K., Januszewicz A., Lapinski M., Feltynowski T., Chodakowska J., Ignatowska-Świtalska H., Wocial B., J-anuszewicz W. Plasma atrial natriuretic peptide (ANP) concentration in patients with pheochromocytoma // Blood Press. 1992. V. 1. P. 157–161.
Tong S.Y.C., Davis J.S., Eichenberger E., Holland T.L., Fowler V.G. Staphylococcus aureus infections: epidemiology, pathophysiology, clinical manifestations, and management // Clin. Microbiol. Rev. 2015. V. 28. P. 603–661.
Veron W., Lesouhaitier O., Pennanec X., Rehel K., Leroux P., Orange N., Feuilloley M.G. Natriuretic peptides affect Pseudomonas aeruginosa and specifically modify lipopolysaccharide biosynthesis // FEBS J. 2007. V. 274. P. 5852‒5864.
Yoshimura T., Yoshimura M., Yasue H., Ito M., Okamura H., Mukoyama M., Nakao K. Plasma concentration of atrial natriuretic peptide and brain natriuretic peptide during normal human pregnancy and the postpartum period // J. Endocrinol. 1994. V. 140. P. 393–397.
Yousri T., Hawari M., Saad R., Langley S. Kytococcus schroeteri prosthetic valve endocarditis // BMJ Case Rep. 2010. bcr0620103064. https://doi.org/10.1136/bcr.06.2010.3064
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Pис. S1. - Pис. S4.


