Микробиология, 2022, T. 91, № 5, стр. 613-630
Сравнительное исследование состава и структуры микробных биопленок экониш мясоперерабатывающих комбинатов, различающихся источниками сырья
Ю. А. Николаев a, b, *, Е. Н. Тихонова b, Г. И. Эль-Регистан b, М. В. Журина b, В. К. Плакунов b, Е. В. Демкина b, Е. В. Зайко a, Д. С. Батаева a, Н. А. Насыров a, Ю. К. Юшина a
a Федеральный научный центр пищевых систем им. В.М. Горбатова РАН
109316 Москва, Россия
b Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: nikolaevya@mail.ru
Поступила в редакцию 12.05.2022
После доработки 25.05.2022
Принята к публикации 26.05.2022
- EDN: KPUVQI
- DOI: 10.31857/S0026365622600407
Аннотация
В настоящем исследовании впервые проведен сравнительный анализ локализации и структурной организации микробных биопленок, населяющих созданную человеком своеобразную экологическую нишу, возникшую на мясоперерабатывающих заводах, отличающихся сырьем (птица, свинина, смешанное сырье). Полноценные зрелые биопленки обнаружены как в обычных местах санитарного контроля (оборудование, канализационные трапы, стены), так и необычных (потолки, нижняя сторона мостков, колеса транспортных устройств, стены тоннеля при минусовой температуре), что свидетельствует о высокой адаптационной способности микробных сообществ, а с практической точки зрения делает необходимым пересмотр (дополнение) мест и протоколов санобработки. Использование трансмиссионной электронной микроскопии позволило получить информацию о составе и разнообразии микробных биопленок в этом экотопе, а также о физиологическом состоянии составляющих их микроорганизмов (активные клетки, покоящиеся клетки, клетки в стадии лизиса). Описаны также морфотипы, способствующие выживанию бактерий в этих биопленках (старые клетки, специализированные формы покоя нескольких типов).
Биопленочные загрязнения на предприятиях пищевой отрасли, включающие условно-патогенные и патогенные бактерии, представляют серьезную опасность. Это обусловливает необходимость исследования особенностей локализации и структуры биопленок (БП) с целью профилактики их формирования и борьбы со зрелыми биопленками.
Способ существования микроорганизмов в виде прикрепленных к биогенным или абиогенным поверхностям клеток, образующих полимерную матрицу и развивающихся в ней в виде моно- или мультивидового сообщества, известен как биопленочный (Satpathy et al., 2016; Плакунов и соавт., 2017; Muhammad et al., 2020). Высокая устойчивость биопленочных микроорганизмов к антибиотикам и дезинфектантам сделали биопленки центром внимания не только в медицине, но и во множестве отраслей пищевых производств, включая переработку мяса и птицы (Srey et al., 2013; Galié et al., 2018), где возникла своеобразная, созданная, благодаря деятельности человека, экологическая ниша со специфическим составом микробных сообществ. Известно, что до трети всех потерь в цепочке поставок пищевых продуктов составляет порча от микробных заражений, что обусловливает приоритет изучения и профилактики биопленкообразования в пищевых отраслях (Gonzales-Rivas et al., 2018; Sharahi et al., 2019; Yuan et al., 2020a). Выявление, ингибирование развития и удаление БП с пищевых продуктов, а также поверхностей оборудования предприятий пищевой промышленности стали огромной проблемой (Gonzales-Rivas et al., 2018; Alvarez-Ordóñez et al., 2019). Основное внимание в изучении БП уделяется выявлению причин их устойчивости к антибиотикам и дезинфектантам, среди которых рассматриваются поливидовой состав биопленочного населения; горизонтальный перенос генов устойчивости; химическая структура и защитные свойства внеклеточного полимерного матрикса (ВПМ) (Flemming et al., 2016; Yuan et al., 2018). Например, получены прямые доказательства защитной роли матрикса грамотрицательных бактерий при действии антибиотиков на грамположительные бактерии в бинарных биопленках (Журина и соавт., 2019; Плакунов и соавт., 2019). В последние годы сформировалось понимание роли в устойчивости БП не только видового разнообразия биопленочного населения, но и его возрастной гетерогенности (включающей чувствительные к стрессорным воздействиям молодые делящиеся клетки, более устойчивые клетки стационарной фазы и высоко устойчивые покоящиеся формы), а также фенотипической гетерогенности (включающей клетки-персистеры и мелкоколониальные варианты SCV) (Stewart, Franklin, 2008; Wimpenny et al., 2020).
Целью настоящего исследования был сравнительный анализ состава, локализации и структурной организации биопленок, отобранных с различного оборудования и поверхностей внутренних помещений трех мясоперерабатывающих заводов, различающихся сырьем и технологиями его переработки.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования. В работе исследовали материалы, собранные с поверхностей внутренних помещений и технологического оборудования в различных зонах трех мясоперерабатывающих предприятий: мясоперерабатывающие заводы (МПЗ) № 1, № 2 и птицеперерабатывающий комбинат (ППК) № 3. Образцы отбирали перед процедурой плановой дезинфекции (ежедневная обработка всех технологических поверхностей раствором гипохлорита натрия) путем соскабливания металлическим шпателем с технологического оборудования или поверхностей помещения (табл. 1).
Таблица 1.
Биопленки, отобранные для исследования
| № образца | Цех, условия | Объект (конкретное место) отбора пробы |
|---|---|---|
| Завод № 1 | ||
| 1 | Накопитель туш; температура 1.8°С | Стенка трапа (слива) в полу № 1 |
| 2 | » | Стенка трапа (слива) в полу № 2 |
| 3 | » | Основание колонны (крошащийся камень в луже из холодной воды со льдом) |
| 4 | Сырьевой цех, участок обвалки; температура 4°С | Конденсат с нижней поверхности отпуска ящиков (над ящиками с мясом) |
| 5 | » | Смазка конвейера |
| 6 | » | Стенка трапа (слива) в полу |
| 7 | » | Поверхность рамы для перевозки ящиков (внутренняя часть) |
| 8 | » | Колеса Рохли |
| 9 | Накопитель разделанного сырья | Лед с грязью с пола |
| 10 | » | Пятно на колонне сверху у швеллера |
| 11 | » | Потолок |
| 12 | » | “Сталактит” с потолка |
| Завод № 2 | ||
| 1 | Цех (обвалки и жиловки) | Канализационный люк № 1 |
| 2 | » | Раковина трубы сливной |
| 3 | Цех разделки | Канализационный люк № 2 |
| 4 | » | Чан для мытья полов |
| Завод № 3 | ||
| 1 | Цех потрошения | Трап |
| 2 | » | Потолок |
| 3 | Цех дезинфекции тушек | Жир с поверхности металлического шнека, вращающегося внутри ванны Морриса |
| 4 | » | Трап на полу под ванной Морриса |
| 5 | » | Нижняя сторона мостков (по которым можно подняться для контроля ванны Морриса) |
| 6 | » | Потолок около ванны Морриса (участок охлаждения) |
| 7 | Тоннель охлаждения | Стена в тоннеле охлаждения тушек; температура 0°С |
| 8 | Цех упаковки | Колеса тележки № 1 (тефлон) – начало цеха |
| 9 | » | Колеса тележки № 2 (тефлон) – линия упаковки готовой продукции (конец цеха) |
Микроскопические исследования. Структурную организацию образцов БП изучали с применением трансмиссионной (просвечивающей) электронной микроскопии их ультратонких срезов.
Образцы, взятые перед процедурой плановой дезинфекции, сразу помещали в 2.5% раствор глутарового альдегида в какодилатном буфере (0.05 М раствор какодилата натрия; рН 7.0‒7.5) и выдерживали в течение 1 сут при 4°С, затем трижды промывали тем же буферным раствором в течение 5 мин и фиксировали в растворе OsO4 (1% OsO4) и в 0.7% растворе рутениевого красного в какодилатном буфере в течение 1.5 ч при 4°С. После фиксации образцы заключали в 2% агар-агар и последовательно выдерживали в 3% растворе уранилацетата в 30% этиловом спирте в течение 4 ч, далее в 70% этаноле в течение 12 ч при 4°С. Материал обезвоживали в 96% этиловом спирте (2 раза по 15 мин), затем в абсолютном ацетоне (3 раза по 10 мин). Образцы пропитывали смолой ЭПОН-812 (Ероху Embedding Medium Эпон® 812, “Sigma-Aldrich”, США), далее выдерживали сначала в смеси смола–ацетон в соотношении 1 : 1 (1 ч), а затем в смеси смола–ацетон в соотношении 2 : 1 (1 ч). Полученный материал заливали в капсулы со смолой и проводили полимеризацию при температуре 37°С в течение 24 ч, затем при 60°С в течение 24 ч. Ультратонкие срезы получали на микротоме LKB-III (“LKB”, Швеция) и контрастировали в водном растворе 3% уранилацетата (30 мин), а затем в водном растворе 4% цитрата свинца (30 мин).
Для выявления кислых мукополисахаридов в составе биопленок использовали краситель рутениевый красный (“Sigma”, США) при его внесении в количестве 0.7% вместе с ОsO4. С помощью рутениевого красного показано наличие внеклеточных полисахаридов в матриксе биопленок ряда бактерий (Smirnova et al., 2010).
Полученные препараты анализировали с помощью электронного микроскопа JEM 100СХII (“Jeol”, Япония) при ускоряющем напряжении 80 кВ и рабочем увеличении 5000‒50 000. Фотодокументирование материалов проводили с помощью цифровой системы вывода оптических изображений Morada G2.
О наличии покоящихся форм судили по присутствию в образцах клеток, имеющих характерные признаки – утолщенную клеточную стенку, электронно-плотную цитоплазму (Мулюкин и соавт., 2009, 2014; Лойко и соавт., 2011, 2017; Соляникова и соавт., 2017), в некоторых случаях – компактизованный биокристаллизованный нуклеоид (Лойко и соавт., 2017).
РЕЗУЛЬТАТЫ
Биопленки с завода № 1. Для исследования были отобраны 12 образцов с поверхностей помещений и технологического оборудования на всех этапах обработки мяса (табл. 1).
Образцы № 1 и 2, отобранные со стенок двух разных сливных трапов цеха накопителя туш, были представлены скоплениями органического материала, в толще которого встречаются единичные клетки бактерий, что указывает на начальный этап образования БП (адсорбция органического материала и адгезия клеток бактерий).
В образце № 3, взятом у основания колонны цеха накопителя туш из лужи холодной воды со льдом, клеток микроорганизмов также не было обнаружено.
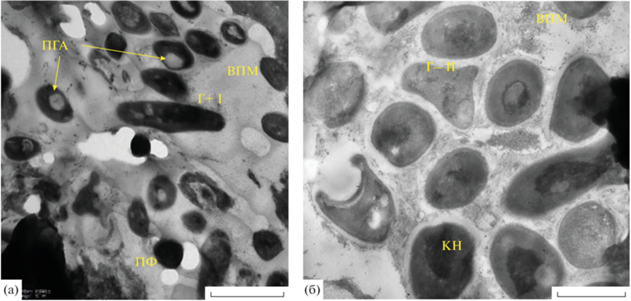
Образец № 4 – с нижней поверхности (с конденсатом) лифта ящиков с мясом сырьевого цеха, был представлен хорошо сформированной БП (рис. 1). Биопленка характеризовалась большим морфологическим разнообразием клеток и их возрастной гетерогенностью: старые клетки грамотрицательного типа с включением ПГА (I тип); молодые грамположительные “лохматые” клетки с многочисленными пилями (II тип); палочки с закругленными концами (III тип) (рис. 1); крупные (~2 мкм) грамотрицательные клетки с хорошо выраженным периплазматическим пространством (IV тип) (рис. 1б). Внеклеточный полимерный матрикс (ВПМ) хорошо сформирован, включает частицы органического вещества и множественные мембранные везикулы (МВ). Также хорошо видны покоящиеся формы (ПФ) двух типов – мелкие и крупные. Подобная гетерогенность ПФ была ранее неоднократно описана для широкого круга бактерий (Мулюкин и соавт., 2009, 2014; Лойко и соавт., 2011; Соляникова и соавт., 2017). МВ в биопленках обнаружены сравнительно недавно (Schooling, Beveridge, 2006; Smirnova et al., 2010; Журина и соавт., 2013), тем не менее, убедительно показано, что они являются обязательным компонентом всех биопленок, исследованных с помощью просвечивающей электронной микроскопии. МВ представляют собой наночастицы, состоящие из липидов разной природы, а также периплазматических и цитоплазматических белков. Они включают ДНК, РНК и низкомолекулярные органические соединения разной природы. К их образованию способны как грамположительные, так и грамотрицательные бактерии. Анализ методами липидомики и протеомики показал, что состав МВ зависит от условий роста микроорганизмов. Они способны осуществлять горизонтальный перенос генов, в том числе детерминант устойчивости к антибиотикам (Nagakubo et al., 2020).
Рис. 1.
Электронно-микроскопический снимок тонких срезов образца, взятого с нижней поверхности лифта для ящиков (над ящиками с мясом) (сырьевой цех, участок обвалки, завод № 1). Сформированная старая БП с клетками разных морфотипов: а – грамотрицательные (Г‒) и грамположительные (Г+) клетки I‒III морфотипов; б – клетки IV морфотипа. Хорошо видны мембранные везикулы (МВ), пили (П), покоящиеся клетки (ПФ) двух типов. Масштабная линейка – 1 мкм.

Образец № 5 – смазка конвейера. Образец представлен вязкой темной субстанцией. Биопленки не выявлено, в образце обнаружены частицы органического материала, отдельные клетки, капли жира.
Образец № 6 – со стенки сливного трапа в сырьевом цехе, представлен скоплениями органического материала с включением единичных клеток бактерий. БП нет, как в образцах № 1 и 2, взятых со стенок сливного трапа в цехе накопителя туш.
Образец № 7, взятый с поверхности рамы для перевозки ящиков с птицей, представлен неразложившимися мышечными волокнами, плотно уложенными в разных плоскостях. Бактериальных клеток не обнаружено.
Образец № 8, взятый с колес тележки с домкратом “Рохли” (рис. 2), представлен хорошо сформированной слоистой биопленкой, содержащей преимущественно старые клетки с включением полигидроксиалканоатов ПГА (рис. 2), двух морфотипов, различающихся размерами: грамположительных палочек ~0.5 × 1.5 мкм и кокковидных грамотрицателных клеток ~0.8 × 1.3 мкм, растущих микроколониально. Матрикс грамотрицательных бактерий содержит фибриллы полисахаридов.
Рис. 2.
Электронно-микроскопический снимок тонких срезов образца, взятого с колес тележки с домкратом “Рохли” (сырьевой цех, участок обвалки, завод № 1): а – старые грамположительные клетки первого типа с ПГА (Г+ I); б – старые грамотрицательные клетки (Г‒ II) с компактизованным нуклеоидом (КН), полисахаридным матриксом (ВПМ). Масштабная линейка – 1 мкм.
Образец № 9, отобранный с пола (лед с грязью) в цехе накопления разделанного сырья, представлял собой фрагментированные мышечные волокна (В) и ядра миоцитов (ЯМ); бактериальных клеток практически не было.
Образец № 10, взятый сверху колонны у швеллера, был представлен рыхлой, сухой крошащейся БП с плохо сформированным полимерным матриксом, включал небольшие микроколонии бактериальных клеток грамотрицательного типа с микрокапсулами, а также покоящиеся клетки.
Образец № 11 был отобран с потолка цеха накопителя разделанного сырья, содержал редкие рыхлые органические частицы; клеток не обнаружено.
Образец № 12, отобранный со “сталактита”, образовавшегося в центральной части потолка в цехе накопителя разделанного сырья (рис. 3), неожиданно был представлен хорошо развитой многослойной пленкой (рис. 3а). Отмечено большое разнообразие морфотипов микробных клеток, развивающихся как смешанной популяцией, так и микроколониально. I тип ‒ грамотрицательные клетки овоидной формы, вегетативные (рис. 3а) и старые с компактизованным нуклеоидом (КН). II тип – грамположительные мелкие палочки (~0.2 × 0.8 мкм) (рис. 3а), часто растущие цепочкой. III тип (рис. 3б) ‒ крупные грамотрицательные бактерии с выраженным периплазматическим пространством. IV тип – крупные грамположительные бактерии (рис. 3в), растущие микроколониально и окруженные общим неполисаридным матриксом. Биопленочное население было гетерогенно не только морфологически, но и по физиологическому возрасту клеток: часто встречались клетки автолизированные (А) – чехлы, а также покоящиеся формы (ПФ) (нескольких типов – крупные и мелкие, различающиеся по плотности содержимого), имеющие электронно-плотную оболочку; в них часто хорошо виден компактизованный биокристаллический нуклеоид (КН), утолщенная оболочка. Обнаружена бактерия необычной формы (рис. 3г) (~0.4 × 1.2 мкм), старая клетка, переходящая в ПФ, с хорошо выраженными тороидальными структурами нуклеоида, характерными для его биокристаллизации в старых клетках, и окруженная мощной полисахаридной капсулой, превосходящей толщину бактерии.
Рис. 3.
Электронно-микроскопический снимок тонких срезов образца, взятого с потолка (“сталактит”) (накопитель разделанного сырья, завод № 1): а – многослойная БП, клетки разных морфотипов (I, II, III); б – микроколония старых грамположительных клеток (Г+ III), мембранные везикулы (МВ), автолизированные клетки (А); в – старые клетки Г+ IV морфотипа с компактизованным нуклеоидом (КН) и ПФ V морфотипа; г – старая клетка с биокристаллизованным нуклеоидом (БН) в полисахаридной капсуле (ПК).

Биопленки с завода № 2. Всего было отобрано 4 образца (табл. 1).
Образец № 1, взятый из канализационного трапа цеха обвалки и жиловки, представлен многослойной биопленкой (рис. 4). Первый слой, по-видимому, экспонированный наружу, представлен, в основном, участками неразложившегося органического материала (ОМ), в котором находятся активные бактериальные клетки (Кл). Внеклеточный полимерный матрикс отсутствует (рис. 4а). Второй слой представляет собой зрелую БП с хорошо сформированным ВПМ из полисахаридного материала, окрашиваемый рутениевым красным, и множественными нитями фибриллярного материала (рис. 4в). Бактериальные клетки, включенные в матрикс, грамотрицательного типа, тонкостенные, крупные овоиды (0.8–1.2 мкм) и палочки (0.5–1.5 мкм), окружены синтезируемой ими капсулой неполисахаридной природы (не окрашивается рутениевым красным); находятся в фазе стационарного роста – изобилуют включениями полигидроксиалканоатов ПГА (рис. 4б); образуют внеклеточные мембранные везикулы (МВ) – характерный признак БП (рис. 4в). Из характерных образцов следует отметить поперечно-полосатые мышечные волокна (МВ) и ядра миоцитов, высвобождаемые из мышечной ткани. На рис. 4в хорошо видно, что мышечные волокна разрушаются (что определяется по их просветлению) под влиянием протеолитических ферментов, выделяемых мембранными везикулами (МВ).
Рис. 4.
Электронно-микроскопический снимок тонких срезов образца № 1, взятого со стенки трапа цеха обвалки и жиловки завод № 2. Многослойная БП: а – органический материал (ОМ), клетки I морфотипа; б – сформированная БП, клетки I и II морфотипов, с включениями ПГА, остатки мышечных волокон (В), ядра миоцитов (ЯМ); в – клетка с мембранными везикулами (МВ); поперечно-полосатое мышечное волокно (МВ). Масштабная линейка – 1 мкм.

Образец № 2, отобранный из трубы под раковиной цеха обвалки и жиловки (рис. 5), представлен молодой поливидовой БП, с остатками неразложившегося органического материала (ОМ) (рис. 5а). Клетки нескольких типов: грамположительные и грамотрицательные кокки (~0.5‒1 мкм) с множеством пилей разной длины (рис. 5а, 5б), окруженные капсульным материалом неполисахаридной природы. Пили служат для прикрепления к субстрату. Матрикс неравномерно окрашивается рутениевым красным, включает участки волокнистого фибриллярного полисахаридного материала (рис. 5б), который синтезируется на специфических образованиях, условно названных “грибовидными выростами” клетки.
Рис. 5.
Электронно-микроскопический снимок тонких срезов образца № 2, взятого со стенки трубы раковины цеха обвалки и жиловки завод № 2: а – клетки Г‒ типа (Г‒ I) с пилями (П) и Г+ типа (Г+ II) с короткими пилями, органический материал (ОМ); б – сформированный внеклеточный полимерный матрикс (ВПМ) и клетки с пилями (П) и грибовидными выростами (ГВ).
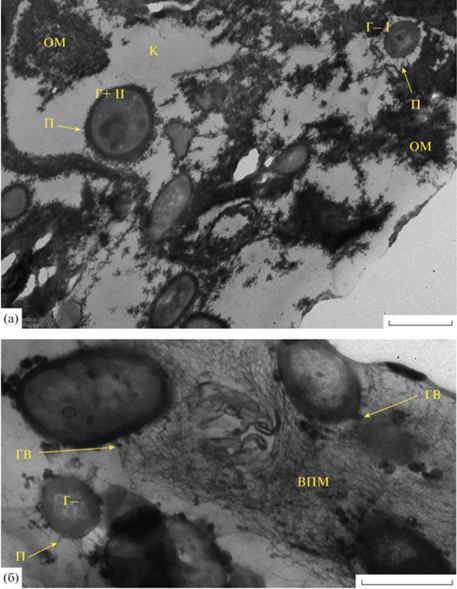
Образец № 3, взятый из трапа канализационного люка цеха разделки сырья (рис. 6), представлен хорошо сформированной БП с умеренно окрашиваемым рутениевым красным матриксом (рис. 6а, 6в). Биопленка гетерогенна по морфотипам бактерий: грамположительные мелкие овоиды, размножающиеся делением (0.4 × 0.6 мкм) и крупные кокки (1.5 мкм) (рис. 6а); грамотрицательные крупные овоиды, находящиеся в чехлах неполисахаридной природы и формирующие единую микроколонию (рис. 6б); крупные грамотрицательные (1.0 × 1.5 мкм) клетки, лежащие в многослойных капсулах внешнего из полисахаридного гранулированного материала и внутреннего неполисахаридного слоя (рис. 6в). Отмечены формирование множественных мембранных везикул (рис. 6г) и возрастная гетерогенность биопленочного населения – образование покоящихся форм (ПФ) нескольких морфотипов, идентифицируемых по высокой электронной плотности и толстым клеточным оболочкам.
Рис. 6.
Электронно-микроскопический снимок тонких срезов образца, взятого со стенки канализационного люка цеха разделки завод № 2: а – клетки Г+ I и II морфотипов; б – микроколония (МК) клеток Г+ II (обведено пунктиром); в – Г‒ клетки III морфотипа, матрикс (ВПМ); г – ПФ двух морфотипов. МВ – мембранные везикулы.
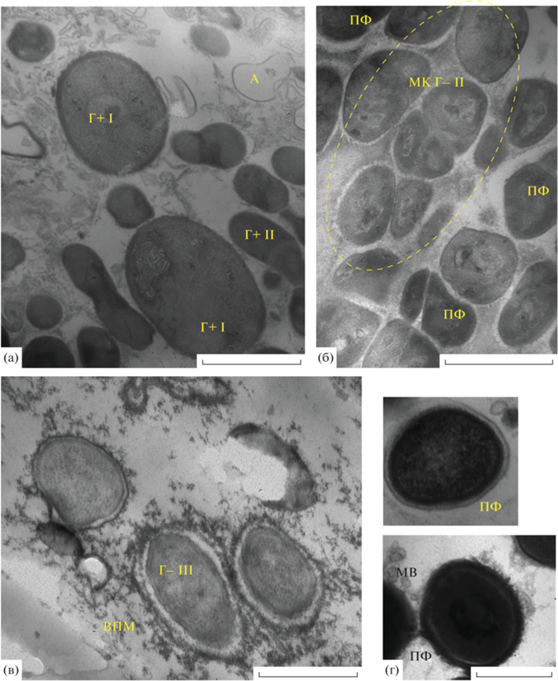
Образец № 4, отобранный из чана для мытья полов цеха разделки сырья (рис. 7), неожиданно был представлен многослойной хорошо развитой БП, формируемой участками со слабо разложившимся органическим материалом (рис. 7а), с волокнистым полисахаридным матриксом (рис. 7б‒7е), участками с микроколониями старых клеток с включениями ПГА (рис. 7г). В БП доминировали длинные грамположительные палочки (0.3 × 1.0‒ 1.5 мкм) (рис. 7а‒7в, 7д), образующие многочисленные короткие пили (рис. 7д) и капсулы неполисахаридной природы (рис. 7а‒7в, 7д). В молодых участках БП обнаруживаются многочисленные мембранные везикулы (МВ) (рис. 7в).
Рис. 7.
Электронно-микроскопический снимок тонких срезов образца, взятого со стенки чана для мытья полов цеха разделки завод № 2: а – двуслойная БП, органический материал (ОМ), клетки Г+ I и II морфотипов, мембранные везикулы (МВ); б – микроколония Г+ клеток II морфотипа; в – слоистая БП, клетки II морфотипа с пилями (П) в неполисахаридных микрокапсулах, матрикс (ВПМ); г – микроколония старых грамотрицательных клеток IV морфотипа с ПГА; д – микроколония клеток грамполжительного типа III морфотипа с микрокапсулами (МК) неполисахаридной природы, в полисахаридном волокнистом матриксе (ВПМ); е – старая клетка грамотрицательного типа V с ПГА с волокнистой капсулой (К) полисахаридной природы. Масштабная линейка – 1 мкм.

Обнаружен интересный морфотип старой, по-видимому, переходящей в покоящееся состояние клетки с включениями ПГА, окруженной мощным чехлом из волокнистого полисахаридного материала. Похожий морфотип был обнаружен в образце № 14 (завод № 1) (рис. 3г).
Формирование обильных моновидовых БП в чане для мытья полов, где постоянно присутствуют дезинфектанты, свидетельствует о селекции высокоустойчивого к ним клона бактерий, скорее всего непатогенных, и необходимости систематической смены дезинфицирующих средств.
Биопленки с завода № 3. На птицеперерабатывающем предприятии отобрано 10 образцов со всех этапов технологического процесса.
Образец № 1, взятый из трапа в цехе потрошения, не является БП и был представлен органическим материалом, гетерогенным по структуре – волокнистым и аморфным.
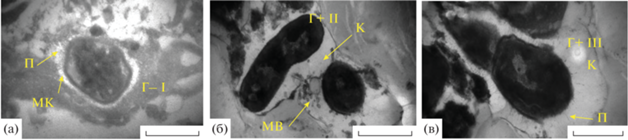
Образец № 2 – с потолка цеха потрошения (рис. 8) представлен классической зрелой поливидовой БП, условиями образования которой являются, по-видимому, обилие конденсата и редкая санитарная обработка. Визуализируются органические частицы, достаточно плотные, большое количество мембранных везикул (МВ) (рис. 8а) и ПФ грамположительных бактерий (электронноплотные толстостенные) (рис. 8а), автолизированные клетки (А), а также прорастающая ПФ с частично разрушенной оболочкой (рис. 8б). Другой морфотип (Г–II) представлен очень мелкими грамотрицательными бактериями, растущими микроколониально (рис. 8а, справа). Также обнаружены необычные грамотрицательные мелкие клетки (0.1−0.5 мкм) III морфотипа, окруженные сформированной полисахаридной капсулой (рис. 8в), растущие микроколониально, где наряду с вегетирующими клетками присутствуют ПФ с утолщенной клеточной оболочкой и тороидальными структурами биокристаллического нуклеоида (рис. 8в).
Рис. 8.
Электронно-микроскопический снимок тонких срезов образца, взятого с потолка цеха потрошения завод № 3: а – старая БП, микроколонии клеток I и II морфотипов, представленные покоящимися формами (ПФ); б – покоящиеся формы с кристаллизованным нуклеоидом (КН), слева – интактная, справа – прорастающая ПФ, хорошо видна периплазма (ПП); в – ПФ клеток грамотрицательного типа (Г‒ ПФ) с биокристаллизованным нуклеоидом (БН) с тороидальными структурами (ТС), окруженные структурированной полисахаридной капсулой (ПК), грамотрицательные мелкие клетки III морфотипа (Г‒III), окруженные сформированной полисахаридной капсулой (ПК). Масштабная линейка – 1 мкм (а) или 500 нм (б и в).

Образец № 3, взятый с лопасти винта ванны Морриса в цехе дезинфекции туш, представлен скоплениями органического материала, среди которых доминировали жировые капли, отдельные бактериальные клетки встречались крайне редко и выглядели нежизнеспособными. Биопленки как таковой нет.
Образец № 4 отобран из трапа на полу под ванной Морриса. Биопленка не развита, визуализируются органические остатки, капли жира, редко встречаются старые бактериальные клетки нескольких морфотипов, по-видимому, занесенные (рис. 9а, 9в). Обнаружены L-формы, окруженные только цитоплазматической мембраной (рис. 9в).
Рис. 9.
Электронно-микроскопический снимок тонких срезов образца, взятого со стенки трапа под ванной Морриса цеха дезинфекции тушек завод № 3: а – единичная клетка грамотрицательного типа (Г‒) в остатках органического материала (ОМ); б ‒ капли жира (Ж); в – старые L-формы (L-ф) с включениями ПГА, окруженные цитоплазматической мембраной (ЦПМ). Масштабная линейка – 500 нм.

Образец № 5 отобран с нижней стороны мостков у ванны Морриса – еще одной нетривиальной точки отбора. Образец представлен старой БП, содержащей старые вегетативные клетки с включениями ПГА (рис. 10а, 10б) нескольких морфотипов: овоидные крупные клетки грамположительного типа (рис. 10а), растущие часто в общих капсулах (рис. 10в), и длинные палочки (рис. 10а). Присутствует много автолизированных клеток и покоящихся форм нескольких морфотипов, различающихся структурной организацией оболочек (рис. 10б).
Рис. 10.
Электронно-микроскопический снимок тонких срезов образца, взятого с нижней стороны мостков, ведущих к ванне Морриса цеха дезинфекции тушек завод № 3: а – старые клетки грамположительного типа двух морфотипов (Г+ I и II); б ‒ ПФ разных типов, различающиеся структурой клеточных оболочек; в – старые клетки с ПГА в общей полисахаридной капсуле и покоящаяся клетка II типа. А – автолизированные клетки. Масштабная линейка – 1 мкм.

Образец № 6 отобран с потолка над ванной Морриса, и это третья точка нетрадиционного места отбора. В нем обнаружена старая, вероятно, функционально неактивная БП. Образец включает области с гетерогенным по окрашиванию рутениевым красным матриксом, редкими клетками и участки с кальцинированной структурой, без признаков БП. Обнаружены толстостенные ПФ, с компактизованным нуклеоидом, сгруппированные в цепочку в едином чехле.
Образец № 7 отобран со стены в туннеле охлаждения (рис. 11) при минусовой температуре и представлял собой замороженную массу. К удивлению, в нем обнаружена слоистая БП, включающая области типичной биопленки с матриксом, характеризующиеся обилием грамотрицательных клеток одного морфотипа, очень старых с компактизованным нуклеоидом, комковатой текстурой цитоплазмы (рис. 11а, 11б), и области из рыхлого органического материала, неравномерно окрашиваемого рутениевым красным. Очевидно, что БП сформирована психрофильным микроорганизмом.
Рис. 11.
Электронно-микроскопический снимок тонких срезов образца, взятого со стенки туннеля охлаждения завод № 3 (~0°С): а – моновидовая пленка грамотрицательных бактерий, старых с компактизованным нуклеоидом (КН) и мембранными везикулами (МВ); б – зона рыхлого органического материал (ОМ). Масштабная линейка – 1 мкм.

Образец № 8, отобранный с колес тележек в начале цеха готовой продукции (рис. 12), был представлен БП с развитым, неоднородно окрашиваемым рутением рыхлым органическим материалом. Бактериальная компонента была представлена клетками различных по строению клеточной стенки морфотипов и с пилями. Клетки, как правило, были окружены капсульным материалом неполисахаридной природы.
Рис. 12.
Электронно-микроскопический снимок тонких срезов образца, взятого с колес тележки № 1 (начало цеха упаковки готовой продукции завод № 3). Отдельные клетки трех морфотипов (Г– I, Г+ II, Г– III): а – клетки Г‒ I с короткими пилями (П) в неполисахаридной микрокапсуле (МК); б – клетки Г+ II в неполисахаридной капсуле (К) с мембранными везикулами; в ‒ клетки Г+ III с длинными пилями. Масштабная линейка – 1 мкм.
Образец № 9, отобранный также с колес тележек в цехе готовой продукции, но в зоне упаковки продукции, был представлен зрелой БП, с хорошо развитым гранулярным матриксом (рис. 13а), включающим клетки с короткими пилями. Покоящиеся формы разной степени созревания с утолщенной клеточной оболочкой и биокристаллизованным нуклеоидом (рис. 13б) окружены капсулой неполисахаридной природы, отграниченной от ВПМ слоем, образованным гранулярными полисахаридными частицами. Биопленка, по-видимому, старая и мало функциональная. В целом, биопленки на колесах тележек были похожими.
Рис. 13.
Электронно-микроскопический снимок тонких срезов образца, взятого с колес тележки № 2 (линия упаковки цеха упаковки завод № 3): а – старая БП, с плотным матриксом (ЭПМ) полисахариной природы, грамположительные клетки (Г+) с короткими пилями (П), некоторые окружены капсулой неполисахаридной природы (К); б – ПФ разных морфотипов, различающихся толщиной клеточной оболочки, с компактизованным нуклеоидом (КН), окруженные двухкомпонентной капсулой из неполисахаридного материала (К) и полисахаридных гранул (ПГ). Масштабная линейка – 1 мкм.

ОБСУЖДЕНИЕ
Биопленочная микробная контаминация созданной человеком экониши, а именно, помещений, оборудования и продукции пищевых производств, представляет серьезную опасность как причина порчи продуктов (Yuan et al., 2020a), а также как резервуар для сохранения и распространения патогенных бактерий (Alvarez-Ordonez et al., 2019). Основной причиной постоянной биопленочной контаминации является высокая устойчивость БП к дезинфицирующим средствам (Yuan et al., 2018, 2020b). БП в этой нише обладают многими отличительными свойствами, и одним из них является способность к формированию и росту в присутствии высоких концентраций бактерицидных дезинфектантов (что обусловлено выработкой принципиально новых механизмов резистентности, требующих специальных подходов для их детального изучения). Полное избавление от таких БП практически недостижимо, но можно снизить их количество путем оптимизации эффективности санобработки. Для этого нужна как можно более объективная информация о микробиологическом состоянии на пищевых производствах: уровне распространения БП, биоразнообразии биопленочных микроорганизмов, физиологической активности БП, ‒ с одной стороны, как причины биологической порчи продукции, а с другой – как резервуара для микробной контаминации помещений и пищевых продуктов. Эти результаты расширяют и углубляют представления об адаптационной способности МБ и возможностях их распространения в новых местах обитания, связанных, в частности, с производственной деятельностью человека. С этих позиций и была проведена сравнительная оценка биопленочной микробиологической контаминации помещений и оборудования на трех мясоперерабатывающих предприятиях, отличающихся перерабатываемым сырьем.
Отличительными чертами сравнительного исследования были: а) расширение спектра точек отбора образцов БП, включая нетривиальные и не подвергаемые ежедневной санитарной обработке места: потолки, туннель охлаждения с температурой ≈0°С, чан для мытья полов, где всегда растворяют дезинфектанты, нижняя сторона мостков, колеса тележек, ролики транспортеров; б) микроскопическая оценка (трансмиссионная электронная микроскопия) БП, позволяющая оценить степень их зрелости и функциональной активности по таким показателям, как развитость и природа матрикса, разнообразие морфотипов бактерий, их возрастная гетерогенность.
Во всех отобранных образцах БП с завода № 2 (перерабатывающего смешанное сырье ‒ свинина, говядина) были обнаружены молодые или зрелые БП с развивающимся или хорошо развитым матриксом, разнообразием морфотипов бактерий (рис. 4‒7), среди которых часто встречались клетки с пилями разной длины (рис. 5а, 5б), служащими, как правило, для прикрепления к поверхностям и другим клеткам. Образование структур с контактной функцией характерно для биопленочных бактерий и было описано ранее (Smirnova et al., 2010; Chapman, 2015). Неожиданным было обнаружение в чане для мытья полов, где постоянно присутствуют антисептики, зрелой БП (рис. 7), сформированной клетками одного морфотипа, который, по-видимому, селекционировался в условиях постоянного давления дезинфектанта. Это первое сообщение о селекции фенотипа пищевого контаминанта, способного к размножению и биопленкообразованию. Важно понять, какого характера эта устойчивость ‒ фенотипического или генотипического (van den Bergh et al., 2016; Levin-Reisman et al., 2017), так как в последнем случае возможен горизонтальный перенос детерминант устойчивости к другим видам пищевых контаминантов, и это будет влиять на эффективность применяемых дезинфектантов.
Микроскопический анализ бактериальной контаминации на заводе № 3 позволил заключить, что в таких тривиальных местах отбора, как сливные трапы или сливы под раковинами, биопленки не были обнаружены; отобранные образцы представлены органическим материалом с очень редким заносом клеток. Отсутствие БП в трапах канализационной системы свидетельствует о хорошем санитарном состоянии предприятия. В образцах, взятых из нетрадиционных мест отбора (нижняя часть мостков у ванны Морриса (рис. 10) или потолок в цехе потрошения (рис. 8), где имеют место обилие конденсата и затруднена дезинфекция), были обнаружены старые БП, бактериальное население которых представлено старыми клетками с включениями ПГА или толстостенными покоящимися клетками разных морфотипов. Это предполагает низкую физиологическую активность таких БП, но не снимает вопрос о них как резервуарах биопленочной контаминирующей микрофлоры. Также важным было обнаружение моновидовой (по морфотипу клеток) БП в образце, взятом со стены тоннеля охлаждения с температурой ~0°С (рис. 11). Это ставит вопрос о биопленочном развитии психрофильной пищевой микробиоты, среди которой встречаются патогены, и необходимости усиления санитарной обработки на этих участках и их включении в перечень мест систематического микробиологического анализа.
Еще одним нетрадиционным местом отбора образцов были потолки, достаточно редко подвергаемые дезинфекции (рис. 8). В них были визуализированы старые БП, включающие, в основном, покоящиеся формы разных морфотипов. Отметим, что ПФ были представлены только цистоподобными клетками, споры нигде не обнаруживались по причине или отсутствия в БП спорообразующих бактерий, или репрессии процессов спорообразования.
Таким образом, напрашивается вывод о необходимости пересмотра практики санитарного контроля (отбора проб для микробиологического анализа), практики дезинфекции – анализа эффективности и периодической смене дезинфектантов.
В половине образцов, отобранных на заводе № 1 (перерабатывающем свинину), сформировавшихся БП не было выявлено, что свидетельствует о хорошем санитарном состоянии предприятия. Зрелая поливидовая БП была обнаружена в образце с нижней поверхности спуска ящиков с мясом (рис. 1). Функциональная активность этой БП подтверждается обилием МВ. В этой БП обнаружены бактерии со множественными пилями. Еще одна БП выявлена в образце, взятом с колес тележки Рохли в сырьевом цехе (рис. 2). БП сформирована клетками двух морфотипов, основной из которых представлен палочками с включениями ПГА, то есть старыми клетками с низкой физиологической активностью, ПФ и автолизированными клетками. В нескольких образцах, взятых с потолка, БП не были обнаружены. Однако в центре потолка в цехе − накопителе разделанного сырья в месте возможной протечки (“сталактит”) была обнаружена хорошо сформированная поливидовая БП (рис. 3) с микробным населением различного возраста, вегетативными и автолизированными клетками и ПФ. Эта БП может быть источником контаминации, в связи с труднодоступностью для санобработки этого нетривиального места отбора, а также может вызывать биокоррозию материала в области развития БП.
Поливидовой состав биопленок на пищевых предприятиях (Burmølle et al., 2014; Yuan et al., 2019) и их фенотипическая гетерогенность описаны ранее (Sadiq et al., 2017). Полученные нами результаты и расширяют представление о гетерогенности биопленок также и по физиологическому состоянию, и по их структуре.
Общий сравнительный микроскопический анализ образцов биопленочных обрастаний поверхностей внутренних помещений, сливных труб и оборудования, взятых с общепринятых мест отбора и с нетривиальных точек отбора, позволил сделать следующие выводы:
а) отсутствие БП в местах традиционного отбора образцов (столы, трапы, сливные трубы) может свидетельствовать об эффективности санобработок, а наличие БП – напротив, о недостатках санитарных мероприятий по выбору мест обработки, по временнóму алгоритму санитарной обработки, возможно, по выбору дезинфектантов;
б) полноценные БП обнаружены в таких нетривиальных местах, как чан для мытья полов, стены тоннеля охлаждения, потолок, нижняя сторона мостков, колеса тележек, что указывает на необходимость расширения точек отбора образцов для контроля и санобработки и этих мест пищевых предприятий;
в) обнаружение сформированных БП в чане для мытья полов и на стене тоннеля охлаждения свидетельствует о 1) селекции бактериального фенотипа, устойчивого к данному дезинфектанту, и необходимости периодической замены последнего, и 2) о развитии психрофильных бактерий, биопленки которых могут служить резервуаром для контаминации пищевых продуктов, в том числе патогенами-психрофилами, что представляет определенную опасность;
г) микроскопический анализ пищевых БП позволил получить новую информацию о морфотипах выживания бактерий в БП. В различных образцах, таких как чан для мытья полов (завод № 2; рис. 7), потолок (завод № 3; рис. 8), потолок (завод № 1; рис. 3), взятых из нетривиальных точек отбора на всех трех МПЗ, были обнаружены старые клетки, созревающие в ПФ, окруженные мощными полисахаридными капсулами различного строения (рис. 3ж; 7е и 8д). Так как таких “капсулированных” старых клеток, созревающих в ПФ, ранее не наблюдали, можно предположить, что это своеобразный морфотип покоя у некоторых биопленочных бактерий, наряду с биопленочными ПФ с известной структурной организацией;
д) только анализ с применением трансмиссионной электронной микроскопии может предоставить информацию о физиологическом состоянии БП и дифференцировать молодые растущие БП от старых и “законсервированных” БП. Эти характеристики “физиологической активности” или “законсервированности” могут быть определены достаточно условно, но они дают информацию об адаптационных способностях МБ, а также об эффективности санитарных мер на пищевом предприятии или необходимости их усиления.
Таким образом, примененный электронно-микроскопический анализ дает важную информацию о наличии и состоянии биопленок в новой антропогенной нише (пищевых производствах), свидетельствует о разнообразии их состава и архитектуры и может быть рекомендован для санитарно-эпидемиологического мониторинга пищевых предприятий.
Список литературы
Журина М.В., Кострикина Н.А., Паршина Е.А., Стрелкова Е.А., Юсипович А.И., Максимов Г.В., Плакунов В.К. Визуализация внеклеточного полимерного матрикcа биопленок Chromobacterium violaceum с помощью микроскопических методов // Микробиология. 2013. Т. 82. С. 502–509.
Zhurina M.V., Kostrikina N.A., Parshina E.Yu., Strelkova E.A.,Yu-sipovich A.I., Maksimov G.V., Plakunov V.K. Visualization of the extracellular polymeric matrix of Chromobacterium violaceum biofilms by microscopic methods // Microbiology (Moscow). 2013. V. 82. P. 517–524.
Журина М.В., Николаев Ю.А., Плакунов В.К. Роль внеклеточного полимерного матрикса в защитном эффекте при действии антибиотика азитромицина на Chromobacterium violaceum // Микробиология. 2019. Т. 88. С. 497‒500.
Zhurina M.V., Nikolaev Yu.A., Plakunov V.K. Role of the extracellular polymer matrix in azithromycin protection of Chromobacterium violaceum biofilms // Microbiology. 2019. V. 88. P. 505–508.
Лойко Н.Г., Кряжевских Н.А., Сузина Н.Е., Демкина Е.В., Гальченко В.Ф., Эль-Регистан Г.И. Покоящиеся формы Sinorhizobium meliloti // Микробиология. 2011. Т. 80. С. 465–476.
Loiko N.G., Kryazhevskikh N.A., Demkina E.V., Kozlova A.N., Galchenko V.F., El’-Registan G.I., Suzina N.E., Muratova A.Y., Turkovskaya O.V. Resting forms of Sinorhizobium meliloti // Microbiology (Moscow). 2011. V. 80. P. 472–482.
Лойко Н.Г., Сузина Н.Е., Соина В.С., Смирнова Т.А., Орлова М.В., Азизбекян Р.Р., Синицын Д.О., Терешкина К.Б., Николаев Ю.А., Крупянский Ю.Ф., Эль-Регистан Г.И. Биокристаллические структуры в стационарных и покоящихся клетках прокариот // Микробиология. 2017. Т. 86. С. 703–719.
Loiko N.G., Nikolaev Y.A., El’-Registan G.I., Suzina N.E., Soina V.S., Smirnova T.A., Zubasheva M.V., Azizbekyan R.R., Sinitsyn D.O., Tereshkina K.B., Krupyanskii Y.F. Biocrystalline structures in the nucleoids of the stationary and dormant prokaryotic cells // Microbiology (Moscow). 2017. V. 86. P. 714‒727.
Мулюкин А.Л., Сузина Н.Е., Погорелова А.Ю., Антонюк Л.П., Дуда В.И., Эль-Регистан Г.И. Разнообразие морфотипов покоящихся клеток и условия их образования у Azospirillum brasilense // Микробиология. 2009. Т. 78. С. 42–52.
Mulyukin A.L., Pogorelova A.Yu., El-Registan G.I., Suzina N.E., Duda V.I., Antonyuk L.P. Diverse morphological types of dormant cells and conditions for their formation in Azospirillum brasilense // Microbiology (Moscow). 2009. V. 78. P. 33–41.
Мулюкин А.Л., Сузина Н.Е., Мельников В.Г., Гальченко В.Ф., Эль-Регистан Г.И. Состояние покоя и фенотипическая вариабельность у Staphylococcus aureus и Corynebacterium pseudodiphtheriticum // Микробиология. 2014. Т. 83. С.15–27.
Mulyukin A.L., Suzina N.E. Mel’nikov V.G., Gal’chenko V.F., El’-Registan G.I. Dormant state and phenotypic variability of Staphylococcus aureus and Corynebacterium pseudodiphtheriticum // Microbiology (Moscow). 2014. V. 83. P. 149‒159.
Плакунов В.К., Мартьянов С.В., Тетенева Н.А., Журина М.В. Управление формированием микробных биопленок: анти- и пробиопленочные агенты (обзор) // Микробиология. 2017. Т. 86. С. 402–420.
Plakunov V.K., Mart’yanov S.V., Teteneva N.A., Zhurina M.V. Controlling of microbial biofilms formation: anti- and probiofilm agents // Microbiology (Moscow). 2017. V. 86. P. 423–438.
Плакунов В.К., Николаев Ю.А., Ганнесен А.В., Чемаева Д.С., Журина М.В. Новый подход к выявлению защитной роли Esherichia coli в отношении грамположительных бактерий при действии антибиотиков на бинарные биопленки // Микробиология. 2019. Т. 88. С. 288‒296.
Plakunov V.K., Nikolaev Yu.A., Gannesen A.V., Chemaeva D.S., Zhurina M.V. A new approach to detection of the protective effect of Escherichia coli on gram-positive bacteria in binary biofilms in the presence of antibiotics // Microbiology. 2019. V. 88. P. 275–281.
Соляникова И.П., Сузина Н.Е., Егозарьян Н.С., Поливцева В.Н., Мулюкин А.Л., Егорова Д.О., Эль-Регистан Г.И., Головлева Л.А. Особенности структурно-функциональных перестроек клеток актинобактерий Microbacterium foliorum BN52 при переходе от вегетативного роста в состояние покоя и при прорастании покоящихся форм // Микробиология. 2017. Т. 86. С. 463‒475.
Solyanikova I.P., Suzina N.E., Egozarjan N.S., Polivtseva V.N., Mulyukin A.L., Egorova D.O., El-Registan G.I., Golovleva L.A. Structural and functional rearrangements in the cells of actinobacteria Microbacterium foliorum BN52 during transition from vegetative growth to a dormant state and during germination of dormant forms // Microbiology (Moscow). 2017. V. 86. P. 476–486.
Alvarez-Ordóñez A.L.M., Coughlan R.B., Cotter P.D. Biofilms in food processing environments: Challenges and opportunities // Annu. Rev. Food Sci. Technol. 2019. V. 10. P. 173–195.
Bergh van den B., Michiels J.E., Wenseleers T., Windels E.M., Boer P.V., Kestemont D., De Meester L., Verstrepen K.J., Verstraeten N., Fauvart M., Michiels J. Frequency of antibiotic application drives rapid evolutionary adaptation of Escherichia coli persistence // Nat. Microbiol. 2016. V. 1. P. 16020.
Burmølle M., Ren D., Bjarnsholt T., Sørensen S.J. Interactions in multispecies biofilms: Do they actually matter? // Trends Microbiol. 2014. V. 22. P. 84–91.
Chapman J. Microstructures of biofilm // Biofilm and materials science / Eds. Kanematsu H., Barry D.M. Springer Int. Publ., 2015. P. 35‒43.
Flemming H.C., Wingender J., Szewzyk U., Steinberg P., Rice S.A., Kjelleberg S. Biofilms: an emergent form of bacterial life // Nature Revs. Microbiol. 2016. V. 14. P. 563–575.
Galié S., García-Gutiérrez C., Miguélez E.M., Villar C.J., Lombó F. Biofilms in the food industry: health aspects and control methods // Front. Microbiol. 2018. V. 9. P. 898.
González-Rivas F., Ripolles-Avila C., Fontecha-Umaña F., Ríos-Castillo A.G., Rodríguez-Jerez J.J. Biofims in the spotlight: detection, quantification and removal methods // Compr. Rev. Food Sci. Food Saf. 2018. V. 217. P. 1261–1276.
Levin-Reisman I., Ronin I., Gefen O., Braniss I., Shoresh N., Balaban N.Q. Antibiotic tolerance facilitates the evolution of resistance // Science. 2017. V. 355. P. 826–830.
Muhammad M.H., Idris A.L., Fan X., Guo Y., Yu Y., Jin X., Qiu J., Guan X., Huang T. Beyond risk: bacterial biofilms and their regulating approaches // Front. Microbiol. 2020. V. 11. P. 928.
Nagakubo T., Nomura N., Toyofuku M. Cracking open bacterial membrane vesicles // Front. Microbiol. 2020. V. 10. P. 3026.
Sadiq F.A., Flint S., Li Y.J., Ou K., Yuan L., He G.Q. Phenotypic and genetic heterogeneity within biofilms with particular emphasis on persistence and antimicrobial tolerance // Future Microbiol. V. 12. P. 1087–1107.
Satpathy S., Sen S.K., Pattanaik S., Raut S. Review on bacterial biofilm: An universal cause of contamination // Biocat. Agric. Biotechnol. 2016. V. 7. P. 56–66.
Sharahi J.Y., Azimi T., Shariati A., Safari H., Tehrani M.K., Hashemi A. Advanced strategies for combating bacterial biofilms // J. Cell Physiol. 2019. https://doi.org/10.1002/jcp.28225
Schooling S.R., Beveridge T.J. Membrane vesicles: an overlooked component of the matrices of biofilms // J. Bacteriol. 2006. V. 88. P. 5945–5957.
Smirnova T.A., Didenko L.V., Tiganova I.G., Andreevskaya S.G., Alekseeva N.V., Stepanova T.V., Romanova Yu.M. Study of the structures of biofilms formed by Salmonella typhimurium bacteria on abiotic surfaces by the methods of light and transmission electron microscopy // Appl. Biochem. Microbiol. 2010. V. 46. P. 706–711.
Srey S., Jahid I.K., Ha S.D. Biofilm formation in food industries: a food safety concern // Food Control. 2013. V. 31. P. 572–585.
Stewart P., Franklin M. Physiological heterogeneity in biofilms // Nat. Rev. Microbiol. 2008. V. 6. P. 199–210.
Wimpenny J., Manz W., Szewzyk U. Heterogeneity in biofilms // FEMS Microbiol. Rev. 2000. V. 24. P. 661–671.
Yuan L., Sadiq F.A., Wang N., Yang Z., He G. Recent advances in understanding the control of disinfectant-resistant biofilms by hurdle technology in the food industry // Crit. Rev. Food Sci. Nutr. 2021. V. 61. P. 3876–3891.
Yuan L., Hansen M.F., Røder H.L., Wang N., Burmølle M., He G. Mixed-species biofilms in the food industry: current knowledge and novel control strategies // Crit. Rev. Food Sci. Nutr. 2020. V. 60. P. 2277–2293.
Yuan L., Burmølle M., Sadiq F.A., Wang N., He G. Interspecies variation in biofilm-forming capacity of psychrotrophic bacterial isolates from Chinese raw milk // Food Control. 2018. V. 91. P. 47‒57.
Yuan L., Wang N., Sadiq F.A., He G. Interspecies interactions in dual-species biofilms formed by psychrotrophic bacteria and the tolerance of sessile communities to disinfectants // J. Food Protect. 2020b. V. 83. P. 951–958.
Дополнительные материалы отсутствуют.


