Микробиология, 2022, T. 91, № 5, стр. 554-564
Биоремедиационный потенциал иммобилизованных на биочаре бактерий Azospirillum brasilense
А. Ю. Муратова a, *, Л. В. Панченко a, Е. В. Дубровская a, Е. В. Любунь a, С. Н. Голубев a, И. Ю. Сунгурцева a, А. М. Захаревич b, Л. Р. Бикташева c, П. Ю. Галицкая c, О. В. Турковская a
a Институт биохимии и физиологии растений и микроорганизмов, ФИЦ “Саратовский научный центр РАН”
410049 Саратов, Россия
b Образовательно-научный институт наноструктур и биосистем Саратовского национального исследовательского университета им. Н.Г. Чернышевского
410012 Саратов, Россия
c Институт экологии и природопользования, ФГАОУ ВО “Казанский (Приволжский) федеральный университет”
420097 Казань, Россия
* E-mail: muratova_a@ibppm.ru
Поступила в редакцию 07.05.2022
После доработки 19.05.2022
Принята к публикации 20.05.2022
- EDN: PYSDOX
- DOI: 10.31857/S0026365622100263
Аннотация
Получена характеристика биопрепарата, созданного путем иммобилизации на древесном биочаре клеток бактерии Azospirillum brasilense SR80. При культивировании в жидкой среде исследована сорбционная способность биочара в отношении нефти и его колонизация азоспириллами. Выявлено уменьшение сорбции нефти биочаром в присутствии микробных клеток. Изучение влияния температурного режима (22–45°С) показало, что при 22°С биодеградация нефти эффективнее осуществлялась иммобилизованными на биочаре клетками, а при 38°С – суспендированными. Полученные данные подтверждены результатами почвенных экспериментов. В условиях лабораторного вегетационного эксперимента использование иммобилизованной на биочаре микробной культуры совместно с двумя видами растений – злаком сорго веничным (Sorghum bicolor) и бобовым люцерной серповидной (Medicago falcata) показало максимальную эффективность очистки почвы от нефти по сравнению с другими вариантами. При этом штамм-интродуцент A. brasilense SR80 демонстрировал высокую выживаемость в обрабатываемой почве в течение 2 мес., что было зарегистрировано с использованием молекулярно-биологических методов. В полевом опыте в реальных погодных условиях жаркого засушливого лета показана бóльшая нефтеокисляющая активность суспендированных клеток азоспириллы по сравнению с иммобилизованными. Проведенные исследования показывают высокую степень зависимости биоремедиационных технологий от факторов окружающей среды и необходимость всестороннего изучения находящихся под их влиянием процессов.
Загрязнение природных и хозяйственных объектов нефтяными углеводородами продолжает оставаться актуальной проблемой. Среди многочисленных методов, разработанных для очистки нефтезагрязненных почвенных экосистем, биоремедиация и фиторемедиация являются технологиями выбора для многих предприятий нефтехимического комплекса (Lim et al., 2016; ГОСТ Р 57447-2017). В основе этих технологий – использование метаболической активности живых организмов (бактерий, грибов, растений), направленной на трансформацию, деградацию и утилизацию нефтяных углеводородов. В биоремедиации нефтезагрязненной почвы используется два основных подхода: биостимуляция (стимуляция деструктивной активности аборигенной микрофлоры по отношению к поллютантам путем изменения физико-химических условий среды для оптимизации ее развития) и биоаугментация (интродукция в загрязненные объекты селекционированных штаммов микроорганизмов, способных разрушать опасные ксенобиотики) (Lim et al., 2016; Liu et al., 2020). Для биостимуляции применяют различные агротехнические и агрохимические приемы обработки почвы, которые включают в себя рыхление, внесение азотно-фосфорных удобрений, эмульгаторов нефтяных углеводородов, а также разнообразных структураторов и дополнительных источников углерода для активизации процессов микробного кометаболизма (Lim et al., 2016). В последние годы для восстановления нефтезагрязненной почвы используется биочар – продукт пиролиза различных растительных остатков (Qin et al., 2013; Guirado et al., 2021; Wei et al., 2021; Guo et al., 2022). Биочар действует как эффективный сорбент загрязнителей, в том числе и нефти (Madhubashani et al., 2021), отмечается его положительный эффект на плодородие почвы и рост растений за счет снижения вымывания питательных веществ и улучшения их биодоступности (Tang et al., 2013). Кроме того, биочар может представлять собой матрицу для закрепления микробных клеток и их дальнейшего размножения с формированием биопленки и поэтому рассматривается как носитель для интродукции в загрязненную почву специализированных микроорганизмов-деструкторов с целью ее биоаугментации (Zhang et al., 2019; Gorovtsov et al., 2020; Li et al., 2020; Guo et al., 2022). Для биоаугментации нефтезагрязненных почв созданы и продолжают разрабатываться разнообразные биопрепараты на основе как монокультур, так и ассоциаций из нескольких специализированных микроорганизмов-деструкторов.
Азотфиксирующие бактерии рода Azospiril-lum – природные ассоцианты многих дикорастущих и культурных трав, произрастающих по всему миру, являются типичными представителями стимулирующих рост растений ризобактерий (PGPR). Ранее нами была показана нефтеокисляющая активность у бактерий этого рода (Муратова и соавт., 2005), подробно исследована деструктивная активность по отношению к различным нефтяным фракциям у штамма A. brasilense SR80 (Бондаренкова и соавт., 2009), а также оценена эффективность его использования в биоремедиации нефтезагрязненной почвы (Муратова и соавт., 2010). Позже биодеградация нефти азоспириллами была описана также и другими исследователями (Al-Mailem et al., 2014; Wu et al., 2021). Выявление нефтеокисляющего потенциала у азоспирилл позволяет рассматривать эти бактерии как потенциальные агенты биоремедиации загрязненной почвы и использовать их как самостоятельно, так и вместе с растениями.
Однако до настоящего времени исследований, посвященных нефтеокисляющим азоспириллам, иммобилизованным на каком-либо носителе, не обнаружено. Вместе с тем, есть данные об использовании штамма Azospirillum, иммобилизованного на лигните, для очистки сточных вод от фтора (Kulkarni et al., 2018). Рядом авторов показана принципиальная возможность иммобилизации азоспирилл на биочаре (Saranya et al., 2011a) и применения такого биопрепарата как структуратора, способствующего улучшению плодородия почвы, и как фитостимулятора для усиления роста растений (Saranya et al., 2011b).
Целью настоящего исследования явилось получение иммобилизованного на биочаре препарата нефтеокисляющего штамма бактерий Azospirillum brasilense и апробация его использования для биоремедиации и фиторемедиации нефтезагрязненной почвы.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Микроорганизмы и среды. В работе использовали штамм Azospirillum brasilense SR80 (IBPPM 24) из Коллекции ризосферных микроорганизмов ИБФРМ РАН (http://collection.ibppm.ru). Бактерии культивировали на LB-бульоне (Bertani, 1951) и среде Nfb (Dobereiner et al., 1979).
Древесный биочар. В экспериментах использовали коммерческий биочар (ООО “ДианАгро”, Россия) из древесины березы. Для получения характеристик биочара, важных для его использования в качестве сорбента нефти и носителя для микробных клеток, определяли сорбционные свойства, размер его частиц, удельную поверхность, а также водородный показатель его водной вытяжки (рН). Определение сорбционных параметров биочара (статической обменной емкости, степени извлечения загрязнителя из воды) в отношении нефтепродуктов проводили по стандартной методике (СТО РосГео 08-002-98). Нефтеемкость биочара определяли отношением массы нефтепродуктов к массе биочара, потраченного на сорбцию, согласно (Каменщиков, Богомольный, 2005). Средний размер частиц и удельную поверхность биочара оценивали с использованием дифракционного анализатора ANALYSETTE 22 (“Fritsch GmbH”, Idar-Oberstein, Германия). Измерение рН проводили на приборе Mettler Toledo 320 (“Mettler Toledo Instruments”, Shanghai, Китай). Остаточное содержание полициклических ароматических углеводородов (ПАУ) в биочаре определяли путем их экстракции хлороформом из гомогенизированного образца и ВЭЖХ анализа на хроматографе Dionex Ultimate 3000 (“Thermo Scientific”, США), оснащенном колонкой Acclaim 300 C18 и УФ-детектором (252 нм). Перед проведением экспериментов по иммобилизации биочар измельчали и просеивали через сито, получая фракцию 1 <3 мм, и стерилизовали суховоздушным жаром при 160°С в течение 2 ч.
Для иммобилизации клеток штамма A. brasilense SR80 получали суточную культуру бактерий, выращенных в 1 л жидкой среды LB (Bertani, 1951) при 28°С, 120 об./мин. Клетки осаждали центрифугированием при 3000 об./мин в течение 20 мин, ресуспендировали физиологическим раствором и повторно центрифугировали при 9000 об./мин в течение 10 мин. Из полученной микробной биомассы готовили густую суспензию, которую использовали для иммобилизации. В стерильные 100 мл колбы Эрленмейера, содержащие 50 мл среды LB, вносили 2.5 мл микробной суспензии, соответствующей 2.5 г влажной биомассы, и 2.5 г стерильного биочара. Колбы инкубировали 24 ч при 28°С в условиях аэрации на качалке при 120 об./мин, оценивая оптическую плотность культуральной жидкости каждые 2 ч, предварительно отделяя биочар фильтрованием. Степень иммобилизации клеток на биочаре (%) определяли по разнице оптической плотности контрольной культуры (без биочара) и планктонной в колбах с биочаром, вычисляя ее согласно (Li et al., 2017) по формуле: (P0 ‒ P1)/P0 × 100%, где P0 – оптическая плотность (OD440) контрольной бактериальной суспензии; P1 – оптическая плотность планктонной культуры в колбах с биочаром. Численность иммобилизованных на биочаре микроорганизмов определяли стандартным методом высева на LB-агар десятикратных серийных разведений суспензий, приготовленных из гомогенизированного образца биочара с бактериями.
Сканирующая электронная микроскопия (СЭМ). Образцы стерильного биочара и биочара с иммобилизованными микробными клетками, извлеченные из культуральной жидкости, высушивали в стерильных условиях, обезвоживали спиртом в возрастающих концентрациях и фиксировали 1% глютаровым альдегидом. Подготовленные образцы микроскопировали с использованием сканирующего (растрового) электронного микроскопа TESCAN MIRA II (Чехия). Исследования проводили на базе Образовательно-научного института наноструктур и биосистем Саратовского национального исследовательского государственного университета им. Н.Г. Чернышевского.
Биодеградацию нефти суспендированными и иммобилизованными на биочаре клетками штамма A. brasilense SR80 исследовали, культивируя бактерии в колбах Эрленмейера объемом 250 мл, содержащих 50 мл среды Nfb с нефтью или без нее. Для засева использовали 2-сут LB-агаровую культуру штамма A. brasilense SR80. Засев проводили до 0.5 ед. опт. пл., определяемой с использованием фотоэлектроколориметра при λ = 440 нм. После засева в половину колб добавляли стерильный биочар (1 г на 50 мл среды). Через 1 сут после засева в вариантах с биочаром наблюдалось просветление среды, что расценивали как иммобилизацию бактериальных клеток на носителе, в колбы добавляли 1% (об./об.) сырой нефти. Колбы с посевами культивировали в условиях аэрации на качалке при 120 об./мин в течение 14 сут при температуре 22, 30, 38 и 45°С. Деградацию нефти штаммом определяли весовым методом после культивирования и выражали в процентах.
Лабораторный вегетационный эксперимент. Эффективность очистки нефтезагрязненной почвы исследовали в лабораторных условиях с использованием биочара, суспендированных или иммобилизованных клеток A. brasilense SR80 и/или посева растений в различных сочетаниях. Эксперименты проводили с использованием каштановой почвы (N-NH4 – 14.4 мг/кг; N-NO3 – 10.7 мг/кг; Р2О5 – 253.3 мг/кг; полная влагоемкость – 39%, рН – 7.2), отобранной в Энгельсском районе Саратовской области. Почву просеивали через сито (размер ячеек 5 мм) и половину общего объема загрязняли нефтью (15 г/кг). Чистую и загрязненную почву фасовали в 1-л пластмассовые вегетационные сосуды, в которые через 5 сут вносили различные добавки: биочар (1% от веса почвы), суспендированные или иммобилизованные на биочаре клетки A. brasilense SR80 (не менее 107 кл./г почвы) и проводили посев растений сорго веничного (Sorghum bicolor L. Moench, 15 семян/сосуд) и люцерны серповидной (Medicago falcatа L., 20 семян/сосуд). Семена сорго были получены из ФГБНУ “Федеральный аграрный научный центр Юго-Востока” (г. Саратов), люцерны – из агрофирмы “СеДеК”. Подготовку микробной суспензии и иммобилизованных на биочаре клеток A. brasilense SR80 для внесения в почву проводили, как описано выше. Все варианты опыта, описание которых представлено в результатах, были поставлены в трех повторностях. Опыты проводили в фитокомнате с контролируемыми условиями: температура 23–25°С, освещенность 8000 лк, продолжительность светового периода 14 ч, темнового – 10 ч. Полив осуществляли ежедневно отстоянной водопроводной водой до 50% от полной влагоемкости. Продолжительность эксперимента составляла 70 сут. Через 1 и 2 мес. культивирования проводили отбор образцов почвы из вариантов, содержащих микроорганизм-интродуцент, для мониторинга выживаемости штамма. По окончании эксперимента определяли концентрацию нефти в почве.
Мониторинг численности микроорганизма-интродуцента. Выделение и очистку почвенной ДНК проводили с использованием набора Fast DNA®SPIN Kit for Soil (“MP Biomedicals”, США) и гомогенизатора Fast Prep®24 (“MP Biomedicals”, США), согласно инструкциям производителя. Образцы до анализа хранили при температуре ‒20°С. Оценку численности интродуцированного штамма A. brasilense SR80 в образцах почвы (по три повторности на образец) осуществляли методом количественной ПЦР (кПЦР) с использованием специфичных праймеров 80-3F (5'-TCCCAGCTCGCTTCTTCTGG-3') и 80-3R (5'-GCTGTCACGCAAACTGCCAT-3'), подобранных с помощью онлайн-ресурса Primer-BLAST (Ye et al., 2012) на основе размещенного в NCBI генома этого микроорганизма (GCF_003584185.1). Размер получаемого ПЦР-продукта – 107 п.н. Реакционная смесь для амплификации содержала 5 ед./мкл SynTaq ДНК-полимеразы, 10× буфер с красителем SYBRGreen, 2 ммоль/л dNTP, по 1 мкмоль/л прямого и обратного праймеров и 1 мкл ДНК. Подготовленные образцы помещали в ПЦР анализатор CFX96 Touch Real-Time PCR Detection System (“Bio-Rad”, Munich, Германия). Амплификацию проводили в следующем режиме: 95°C – 5 мин, 39 циклов, включающих 95°C – 30 с, 62.4°С – 30 с, 72°C – 30 с. Для построения калибровочной кривой осуществляли клонирование целевого ПЦР-продукта в клетках Escherichia coli, применяя TA cloning kit (“Invitrogen”, “Thermo Fisher”, США) с векторной плазмидой pCRTM2.1 (3900 п.н.) согласно инструкции производителя. Векторы со вставкой фрагмента генома A. brasilense SR80 экстрагировали с использованием Quick Plasmid Miniprep kit (“Invitrogen”, “Thermo Fisher”, США), а их концентрацию определяли с помощью флуориметра Qubit 3.0 (“Invitrogen”, “Thermo Fisher”, США) и Quant-iT™ dsDNA High-Sensitivity Assay Kit (“Invitrogen”, “Thermo Fisher”, США). Поскольку размеры вектора и вставки известны, число копий клонированного фрагмента рассчитывали, исходя из концентрации плазмидной ДНК.
Микрополевой опыт проводили на южном черноземе, на делянках размером 0.5 × 0.5 м2 в период с мая по июль 2021 г. Варианты опыта включали в себя по отдельности и в сочетаниях следующие обработки: чистую и загрязненную нефтью (1% об./об.) почву, внесение биочара (0.5%) и без него, интродукцию суспендированных или иммобилизованных на биочаре клеток штамма A. brasilense SR80 (не менее 107 кл./г почвы), посев растений (S. bicolor – 8 г/м2 и M. falcatа – 2 г/м2) и без них. Перед посевом растений в почву вносили аммиачную селитру (0.4 г/кг). Режим полива – в течение первых 21 сут поддерживали полевую влажность дополнительным поливом по мере необходимости, далее полив осуществлялся естественными осадками. За 70 сут проведения эксперимента среднесуточная температура воздуха составляла 18.9–24.5°С; температура на по-верхности почвы – 23.1–29.9°С; температура грунта на глубине 10–20 см – 25.8–35.5°С; количество выпавших осадков – 152 мм. Все варианты опыта, описание которых представлено в результатах, проводили в трех повторностях.
Остаточное содержание нефти в жидкой среде после культивирования бактерий и в почве определяли гравиметрическим методом с предварительной экстракцией углеводородов из образцов растворителем (ПНД Ф 16.1:2:2.2:2.3:3.64-10).
Статистическую обработку полученных экспериментальных данных проводили, вычисляя средние значения, для сравнения которых использовали показатели стандартного отклонения и доверительного интервала при P ≤ 0.05. Вычисления проводили в программе Microsoft Excel 2007 (“Microsoft”, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Использование бактериальных препаратов в виде клеток, сорбированных на том или ином носителе, целесообразно как с микробиологической, так и с технологической позиций. Иммобилизованные микроорганизмы находятся в состоянии биопленки, сохраняя свою жизнеспособность лучше, чем в суспензии. Это удобно и для хранения, и при внесении в загрязненную почву, где иммобилизация способствует поддержанию высокой численности интродуцента (Zhang et al., 2019).
Для получения иммобилизованых микробных клеток необходимым этапом является изучение характеристик носителя, предназначенного для создания биопрепарата. Имеющийся на отечественном рынке биочар различается по происхождению и свойствам, что требовало предварительной характеристики этого сорбента для иммобилизации бактерий-нефтедеструкторов.
Характеристика биочара. Анализ структурных характеристик и свойств поверхности материалов позволяет оценить эффективность их использования для иммобилизации микробных клеток и в процессах очистки от нефтепродуктов. Согласно результатам проведенных анализов, используемый в работе древесный биочар имел следующие характеристики: средний размер частиц составлял 15.7 мкм; концентрация исходной воды – 11.55 мг/г; рН водной вытяжки – 7.7; расчетная удельная поверхность – 75 м2/г, нефтеемкость – 1.2 г/г. Статическая емкость сорбента (максимальное количество вещества, поглощенного единицей объема или массы) составляла 0.57 мг/л. Степень извлечения (величина, показывающая, какая доля абсолютного количества вещества улавливается сорбентом, дающая достаточно полное представление о характере процесса) достигала максимального значения – 99.93%. Остаточное содержание ПАУ в биочаре составляло 10 мкг/г. Структура используемого в работе биочара представлена на микрофотографиях (рис. 1а и 1б), полученных с помощью сканирующей электронной микроскопии.
Рис. 1.
Изображения стерильного древесного биочара (а, б) и иммобилизованных на нем клеток A. brasilense SR80 (б), полученные с помощью сканирующей электронной микроскопии.

Полученные результаты показывают высокие характеристики биочара как сорбента нефтяных углеводородов, а также носителя микробных клеток, о чем свидетельствует нейтральное значение его кислотности, большая удельная поверхность. Вместе с тем, потенциальные негативные побочные эффекты, связанные с наличием остаточного количества образовавшихся в процессе пиролиза ПАУ, должны быть учтены при использовании биочара в процессах биорекультивации.
Иммобилизация клеток A. brasilense SR80 на биочаре. Известно, что при колонизации корней растений пластичность генома азоспирилл позволяет им осуществлять переход от подвижного состояния суспендированных клеток к формированию биопленок (Mata et al., 2018). Способность к образованию биопленок должна была обеспечить успешную иммобилизацию A. brasilense SR80 на биочаре в условиях их совместного культивирования.
Из рис. 2 видно, что сорбция клеток A. brasilense SR80 на биочаре в условиях аэрации на качалке достигала 38% уже через 2 ч культивирования. В последующем временном интервале 2–6 ч наблюдалось снижение этого показателя, вероятно, за счет десорбции незакрепившихся клеток, после чего вновь отмечено повышение иммобилизации, по-видимому, связанное с освоением бактериями более глубокого пространства биочара. Через 24 ч эффективность иммобилизации составила 53%. Учет жизнеспособных микроорганизмов путем высева на питательную агаризованную среду показал, что численность иммо-билизованных клеток A. brasilense SR80 при культивировании в среде LB в условиях аэрации на качалке достигала 9.3 × 109 КОЕ/г сухого биочара. С помощью сканирующей электронной микроскопии визуализировано присутствие бактериальных клеток на биочаре (рис. 1в).
Влияние иммобилизации и температуры на деградацию нефти штаммом A. brasilense SR80. Для сравнения эффективности деградации нефти суспендированными и иммобилизованными на биочаре клетками, а также определения влияния температуры, как фактора вероятного климатического воздействия на этот процесс, проводили культивирование бактерий A. brasilense SR80 в жидкой минеральной среде с нефтью с добавлением биочара и без него при температуре 22, 30, 38 и 45°С.
В ходе эксперимента наблюдались особенности физико-химических взаимодействий в системе “вода‒нефть‒биочар” и “вода‒нефть‒биочар‒микробные клетки”. В стерильных условиях биочар эффективно сорбировал нефть из среды, не оставляя ее свободных капель ни в среде, ни на стенках колбы. В присутствии бактерий взаимодействие нефти с биочаром нарушалось: микробные клетки предотвращали сорбцию нефти на биочаре, что предположительно может быть связано с изменением физико-химических свойств как самой нефти, так и сорбента под действием бактерий (Gorovtsov et al., 2020). На наш взгляд, основной причиной снижения адсорбции нефти на биочаре является продукция эмульгаторов и биотрансформация/биодеградация основных компонентов нефти исследуемым микроорганизмом. Ранее у штамма A. brasilense SR80 была обнаружена эмульгирующая активность по отношению к минеральному маслу (Е48 = 52%), и охарактеризована деградация сырой нефти (Бондаренкова и соавт., 2009), что подтверждает метаболическую активность исследуемого штамма в отношении нефтяного субстрата. Такая деятельность бактерии может влиять на гидрофобность нефти и поверхности биочара, способствовать изменению заряда на поверхности сорбента и поляризации компонентов нефти, снижая гидрофобное и электростатическое притяжение углеводородного загрязнителя. Образуемые в результате микробной деградации углеводородов полярные метаболиты так же могут изменять электрофильные и донорно-акцепторные электронные взаимодействия между биочаром и нефтью. Таким образом, использование биочара с иммобилизованными на нем клетками A. brasilense SR80 снижает его сорбционные свойства по отношению к нефти, по крайней мере, в жидкой среде, что вызывает сомнение в перспективности использования иммобилизованного на биочаре A. brasilense SR80 для очистки воды от углеводородного загрязнения. Вместе с тем, в почвенной среде имеют место иные взаимодействия и эффекты. Так, ранее было показано, что по сравнению с жидкими средами значения гидрофобности и заряда поверхности клеток азоспирилл на твердых поверхностях были выше (Castellanos et al., 1997). Учитывая, что эти параметры важны для адсорбции микробных клеток на той или иной матрице, можно предположить, что и колонизация биочара и взаимодействия азоспириллы с нефтью в условиях почвы могут быть иными.
Количественные характеристики процесса биодеградации сырой нефти суспендированными и иммобилизованными клетками штамма A. brasilense SR80, исследованные в водной среде при различной температуре, представлены на рис. 3. Из гистограммы видно, что и биочар, и температура оказывали выраженный эффект на деградацию нефти штаммом. Как суспендированные, так и иммобилизованные клетки бактерии демонстрировали сходную тенденцию изменения деструктивной активности в зависимости от температуры. Ожидаемо биодеградация нефти штаммом была минимальной (15–17%) при крайних значениях температуры (22 и 45°С), тогда как максимальная деградация нефти суспендированными клетками наблюдалась при 38°С, а для иммобилизованных при 30°С.
Рис. 3.
Биодеградация нефти (1%) в жидкой среде суспендированными (1) и иммобилизованными на биочаре (2) клетками A. brasilense SR80 при разной температуре и аэрации на качалке в течение 14 сут.
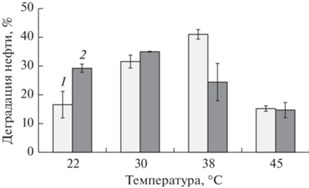
При температурах 22 и 30°С использование биочара сопровождалось увеличением биодеградации нефти до 29 и 35% соответственно относительно суспендированных клеток. Иммобилизация микроорганизмов на материале носителя увеличивает площадь контакта и количество клеток, обеспечивая более интенсивную деградацию нефти. Есть данные, свидетельствующие об увеличении адгезии клеток азоспирилл на поверхности полистирола с повышением температуры до 30°С (Dufrene et al., 1996). Усиление деградации нефти в жидкой среде показано при иммобилизации клеток нефтедеструкторов Corynebacterium variabile (Zhang et al., 2016), Vibrio sp. (Zhou et al., 2021). В нашем случае, при 30°С эффект биочара уже был менее выраженным по сравнению с отмеченным при 22°С, и эффективность деградации нефти иммобилизованными клетками A. brasilense SR80 была сопоставима с таковой суспендированных (35 и 32% соответственно). При температуре 38°С эффект биочара менялся на противоположный: деградация нефти суспендированными клетками A. brasilense SR80 увеличивалась до 41%, а иммобилизованными – снижалась до 24%. При 45°С эффект биочара полностью нивелировался, а деструктивная активность штамма снижалась до минимальных значений, что связано с торможением роста штамма при таком температурном режиме. Известно, что температурный оптимум для роста большинства азоспирилл составляет 30–37°С, тогда как при 45°С рост этих бактерий подавляется, как это было показано в работе Verma et al. (2011) на выборке из 30 штаммов бактерий этого рода.
Полученные результаты согласуются с данными ранее опубликованного исследования, посвященного использованию иммобилизованного на древесном поровом носителе лигните штамма бактерий Azospirillum для очистки сточных вод от фтора (Kulkarni et al., 2018). Авторы показали, что максимальное удаление фтора наблюдалось при 30°С, а с повышением температуры эффективность очистки воды снижалась, что могло быть связано с уменьшением количества активных центров адсорбента и ослаблением адсорбционных сил между поверхностью лигнита (содержащего азоспириллу или без микроорганизма) и ионами фтора. Несмотря на то, что указанное исследование проводилось с минеральным водорастворимым загрязнителем воды, можно считать, что повышение температуры для системы “вода‒биочар‒нефть‒микроорганизм” также может приводить к изменению и ослаблению гидрофобности, зарядов поверхностей компонентов системы, а, следовательно, и к снижению сорбции биочаром как нефти, так и микробных клеток.
Использование иммобилизованных на биочаре микробных клеток для ремедиации нефтезагрязненной почвы в условиях лабораторного эксперимента. Возможность и целесообразность использования нефтеокисляющего потенциала азоспирилл в сочетании с растениями-фиторемедиантами подтверждается результатами предыдущих исследований, свидетельствующих о стимуляции азоспириллами роста растений, выращиваемых в нефтезагрязненной среде (Муратова и соавт., 2005, 2010; Бондаренкова и соавт., 2009). Учитывая также положительные свойства биочара как структуратора почвы, способствующего росту растений (Tang et al., 2013), в условиях лабораторного эксперимента был исследован эффект применения иммобилизованного на биочаре штамма A. brasilense SR80 совместно с растениями и без них для очистки почвы от нефти.
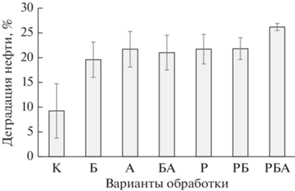
Анализ результатов такого исследования (рис. 4) показал, что выращивание растений сорго веничного и люцерны серповидной в нефтезагрязненной почве, предварительно обработанной биочаром с иммобилизованной на нем азоспириллой (в концентрации 1% от веса сухой почвы), увеличивало деградацию загрязнителя на 5% по сравнению с вариантом без растений (21.0%) или использованием только растений (по 21.7%), достигнув эффективности 26.2% за 70 сут культивирования.
Рис. 4.
Деградация нефти в условиях лабораторного эксперимента в контрольной необработанной почве (К) и при биоаугментации почвы бактериями A. brasilense SR80 (А) в присутствии биочара (Б) и/или растений (S. bicolor L. Moench и M. falcatа L.) (Р) и их комбинаций.
Мониторинг микроорганизма-интродуцента в почве показал (рис. 5), что, несмотря на ожидаемое снижение исходной численности клеток бактерии (107 КОЕ/г почвы) на протяжении двухмесячного лабораторного эксперимента, азоспирилла демонстрировала высокую выживаемость, как в чистой, так и в нефтезагрязненной почве – (104–105 – через 1 мес., 103–104 КОЕ/г – через 2 мес.). На численность A. brasilense SR80 в почве стимулирующее влияние оказывала нефть, а также присутствие растений.
Рис. 5.
Численность интродуцированного штамма A. brasilense SR80 в почве в присутствии биочара (Б) и/или растений (Р, S. bicolor L. Moench и M. falcatа L.) и нефти (Н, 10 г/л) через 1 мес. (1) и 2 мес. (2) культивирования в условиях лабораторного эксперимента.

Использование иммобилизованных на биочаре микробных клеток для ремедиации нефтезагрязненной почвы в условиях микрополевого опыта. Возможность использования штамма A. brasilense SR80 в суспендированном и иммобилизованном на биочаре состоянии для рекультивации почвы, загрязненной нефтью (10 г/кг), исследовали в микрополевом опыте с использованием растений-фиторемедиантов (S. bicolor и M. falcata). Полученные результаты отражены на рис. 6.
Рис. 6.
Деградация нефти в условиях микрополевого опыта в контрольной необработанной почве (К) и при биоаугментации почвы бактериями A. brasilense SR80 (А) в присутствии биочара (Б) и/или растений (Р, S. bicolor L. Moench и M. falcatа L.).
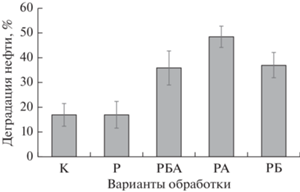
Как видно из гистограммы, культивирование только одних растений не приводило к эффективной очистке почвы – снижение концентрации нефтяных углеводородов было сопоставимо с таковым в необработанном контроле (17%), тогда как внесение в почву биочара и A. brasilense SR80 оказывало решающее значение для ее ремедиации. Так, использование с растениями биочара увеличивало деградацию нефти до 37%. Схожая эффективность очистки показана в варианте с внесением иммобилизованных на биочаре азоспирилл (36%). Максимальная биодеградация нефти (более 48%) достигалась при использовании растений и неиммобилизованных бактерий. Учитывая жаркое засушливое лето в регионе, где в период проведения эксперимента среднесуточная температура грунта на глубине 10–20 см достигала 35.5°С, полученные результаты подтверждают выявленную ранее бóльшую нефтеокисляющую активность суспендированных клеток по сравнению с иммобилизованными при повышенной температуре.
Полученные нами результаты сопоставимы с данными работы (Zhang et al., 2019), в которой использовали штамм-нефтедеструктор Microbacterium sp., иммобилизованный на биочаре, полученном из грибного мицелия, для очистки нефтезагрязненной почвы. Через 60 сут эксперимента этот вариант показал наибольшее снижение содержания загрязнителя (58.1% от исходной концентрации 47.7 г/кг) в почве по сравнению с неиммобилизованными бактериями (38.6%) и с одним биочаром (29.9%). Отметим, что в приведенном эксперименте доза вносимого в почву биочара составляла 5% (вес/вес), а доза микроорганизма – 10% (объем/вес), что практически не рентабельно для каких-либо полевых испытаний. В работе (Li et al., 2020) исследована эффективность очистки почвы от комплексного загрязнения нефтяными углеводородами и никелем с использованием устойчивого к никелю штамма Citrobacter sp., иммобилизованного на кукурузном биочаре. Через 50 сут эксперимента эффективность очистки почвы с использованием иммобилизованного на биочаре штамма, суспендированных микробных клеток, одного биочара и в контроле составила 45.5, 30.1, 25.9 и 18.5% соответственно при уровне загрязнения нефтью 16 г/кг. Доза внесения биочара составляла 3%, а бактерий – 107 КОЕ/г почвы (Li et al., 2020). Синергический эффект от использования биоаугментации в сочетании с биочаром, приводящий к высокоэффективной и экологически безопасной биоремедиации нефтезагрязненной почвы, отмечается многими исследователями (Wei et al., 2021; Guo et al., 2022). Иммобилизованный на биочаре бактериальный консорциум (Pseudomonas putida, Acinetobacter calcoaceticus и Sphingomonas sp.) обладал синергическим механизмом биоаугментации и биостимуляции при очистке почвы от нефти, снижая исходную концентрацию загрязнителя (44.3 г/кг) на 78.3% за 28 сут (Wei et al., 2021). Упоминается, что эффективность использования неиммобилизованного консорциума и биочара без бактерий достигала 60.3 и 45.8% соответственно. Для очистки нефтезагрязненной почвы были успешно применены также иммобилизованные на пшеничном биочаре бактерии Pseudomonas, Acinetobacter и Sphingobacterium (Guo et al., 2022).
Работы с использованием иммобилизованных на биочаре микроорганизмов-нефтедеструкторов в сочетании с растениями немногочисленны. В экспериментах (Ali et al., 2021) исследована эффективность очистки почвы от дизельного топлива (1% вес/об.) с помощью растения кукурузы (Zea mays L.), биочара и нефтеокисляющего штамма Bacillus sp. МН54 в течение 90 сут. Применение биочара и штамма-нефтедеструктора с растениями увеличивало биодеградацию нефти до 77% по сравнению с использованием только одной кукурузы (46%). Однако в этом исследовании бактерии не иммобилизовали на биочаре, а инокулировали ими семена растений, с которыми вносили биочар.
Сопоставление полученных в настоящей работе результатов с имеющимися в литературе данными показывает перспективность направления этих исследований, поскольку сочетает в себе необходимые элементы зеленой технологии.
Таким образом, в ходе проведенного исследования дана характеристика иммобилизации клеток стимулирующего рост растений штамма Azospirillum brasilense SR80, обладающего нефтеокисляющей активностью, на коммерческом древесном биочаре, используемом в качестве сорбента для нефтяного загрязнения и структуратора, позволяющего улучшить физико-химические характеристики грунта. Изучение биодеградации нефти в водной среде показало, что при температуре 22°С процесс осуществляется эффективнее иммобилизованными клетками A. brasilense SR80, а при 38°С – планктонными. В лабораторном эксперименте использование растений Sorghum bicolor и Medicago falcata в сочетании с иммобилизованным на биочаре штаммом A. brasilense SR80 способствовало выживаемости штамма-интродуцента в почве и позволяло достичь ее максимальной очистки в сравнении с другими приемами ремедиации. В полевом опыте в условиях жаркого засушливого лета показана бóльшая нефтеокисляющая активность суспендированных клеток по сравнению с иммобилизованными. В целом, проведенные исследования продемонстрировали возможность применения бактерий рода Azospirillum как в суспендированном, так и в иммобилизованном на биочаре состоянии для восстановления нефтезагрязненной почвы.
Список литературы
Бондаренкова А.Д., Муратова А.Ю., Турковская О.В. Влияние нефти на ассоциативную ризобактерию Azospirillum brasilense // Вестник Саратовского госагроуниверситета им. Н.И. Вавилова. 2009. № 9. С. 5–10.
ГОСТ Р 57447-2017. Наилучшие доступные технологии. Рекультивация земель и земельных участков, загрязненных нефтью и нефтепродуктами. М.: Стандартинформ, 2017. 25 с.
Каменщиков Ф.А., Богомольный Е.И. Нефтяные сорбенты. М.-Ижевск: НИЦ Регулярная и хаотическая динамика, 2005. 268 с.
Муратова А.Ю., Бондаренкова А.Д., Панченко Л.В., Турковская О.В. Использование комплексной фиторемедиации для очистки почвы, загрязненной нефтешламом // Биотехнология. 2010. № 1. С. 77–84.
Muratova A.Yu., Bondarenkova A.D., Panchenko L.V., Turkovslaya O.V. Use of integrated phytoremediation for cleaning-up of oil-sludge-contaminated soil // Appl. Biochem. Microbiol. 2010. V. 46. P. 789–794.
Муратова А.Ю., Турковская О.В., Антонюк Л.П., Макаров О.Е., Позднякова Л.И., Игнатов В.В. Нефтеокисляющий потенциал ассоциативных ризобактерий рода Azospirillum // Микробиология. 2005. Т. 74. С. 248–254.
Muratova A.Yu., Turkovskaya O.V., Antonyuk L.P., Makarov O.E., Pozdnyakova L.I., Ignatov V.V. Oil-oxidizing potential of associative rhizobacteria of the genus Azospirillum // Microbiology (Moscow). 2005. V. 74. P. 210–215.
ПНД Ф 16.1:2:2.2:2.3:3.64-10 Методика измерений массовой доли нефтепродуктов в пробах почв, грунтов, донных отложений, илов, осадков сточных вод, отходов производства и потребления гравиметрическим методом. М., 2010.
РосГео С. Т. О. 08-002-98 Технологические методы исследования минерального сырья. М.: Изд-во РосГео, 1998.
Ali M.H., Khan M.I., Bashir S., Azam M., Naveed M., Qadri R., Bashir S., Mehmood F., Shoukat M.A., Li Y., Alkahtani J., Elshikh M.S., Dwiningsih Y. Biochar and Bacillus sp. MN54 assisted phytoremediation of diesel and plant growth promotion of maize in hydrocarbons contaminated soil // Agronomy. 2021. V. 11. Art. 1795.
Al-Mailem D.M., Kansour M.K., Radwan S.S. Bioremediation of hydrocarbons contaminating sewage effluent using man-made biofilms: effects of some variables // Appl. Biochem. Biotechnol. 2014. V. 174. P. 1736–1751.
Bertani G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli // J. Bacteriol. 1951. V. 62. P. 293–300.
Castellanos T., Ascencio F., Bashan Y. Cell-surface hydrophobicity and cell-surface charge of Azospirillum spp. // FEMS Microbiol. Ecol. 1997. V. 24. P. 159–172.
Dobereiner J., Baldani V.L.D. Selective infection of maize roots by streptomycin-resistant Azospirillum lipoferum and other bacteria // Can. J. Microbiol. 1979. V. 25. P. 1264–1269.
Dufrene Y.F., Vermeiren H., Vanderleyden J., Rouxhet P.G. Direct evidence for the involvement of extracellular proteins in the adhesion of Azospirillum brasilense // Microbiology (SGM). 1996. V. 142. P. 855–865.
Gorovtsov A.V., Minkina T.M., Mandzhieva S.S., Perelomov L.V., Soja G., Zamulina I.V., Rajput V.D., Sushkova S.N., Mohan D., Yao J. The mechanisms of biochar interactions with microorganisms in soil // Environ. Geochem. Health. 2020. V. 42. P. 2495–2518.
Guo S., Liu X., Tang J. Enhanced degradation of petroleum hydrocarbons by immobilizing multiple bacteria on wheat bran biochar and its effect on greenhouse gas emission in saline-alkali soil // Chemosphere. 2022. V. 286. Art. 131663.
Kulkarni K., Bhogale G.M., Nalawade R. Adsorptive removal of fluoride from water samples using Azospirillum biofertilizer and lignite // Korean J. Chem. Eng. 2017. V. 35. P. 153–163.
Li X., Wang Y., Luo T., Ma Y., Wang B., Huang Q. Remediation potential of immobilized bacterial strain with biochar as carrier in petroleum hydrocarbon and Ni co-contaminated soil // Environ. Technol. 2020. V. 14. P. 1–31.
Li Z., Zhang X., Xiong X., Zhang B., Wang L. Determination of the best conditions for modified biochar immobilized petroleum hydrocarbon degradation microorganism by orthogonal test // IOP Conf. Series: Earth and Environmental Science. 2017. V. 94. Art. 012191.
Lim M.W., Lau E.V., Poh P.E. A comprehensive guide of remediation technologies for oil contaminated soil – Present works and future directions // Mar. Pollut. Bull. 2016. V. 109. P. 14–45.
Liu H., Tan X., Guo J., Liang X., Xie Q., Chen S. Bioremediation of oil-contaminated soil by combination of soil conditioner and microorganism // J. Soils Sediments. 2020. V. 20. P. 2121–2129.
Madhubashani A.M.P., Giannakoudakis D.A., Amarasinghe B.M.W.P.K., Rajapaksha A.U., Pradeep Kumara P.B.T., Triantafyllidis K.S., Vithanage M. Propensity and appraisal of biochar performance in removal of oil spills: a comprehensive review // Environ. Pollut. 2021. V. 288. Art. 117676.
Mata A.R., Pacheco C.M., Cruz Pérez J.F., Sáenz M.M., Baca B.E. In silico comparative analysis of GGDEF and EAL domain signaling proteins from the Azospirillum genomes // BMC Microbiology. 2018. V. 18. P. 20.
Qin G., Gong D., Fan M.-Y. Bioremediation of petroleum-contaminated soil by biostimulation amended with biochar // Int. Biodeterior. Biodegr. 2013. V. 85. P. 150–155.
Saranya K., Krishnan P.S., Kumutha K. French J. Biochar as an alternate carrier to lignite for the preparation of biofertilizers in India // Int. J. Curr. Res. 2011a. V. 33. № 5. P. 009–013.
Saranya K., Kumutha K., Krishnan P.S. Influence of biochar and Azospirillum application on the growth of maize // Madras Agric. J. 2011b. V. 98. P. 158–164.
Tang J., Zhu W., Kookana R., Katayama A. Characteristics of biochar and its application in remediation of contaminated soil // J. Biosci. Bioeng. 2013. V. 116. P. 653–659.
Verma R., Chourasia S.K., Jha M.N. Population dynamics and identification of efficient strains of Azospirillum in maize ecosystems of Bihar (India) // 3 Biotech. 2011. V. 1. P. 247–253.
Wei X., Peng P., Meng Y., Li T.T., Fan Z.P., Wang Q., Chen J.B. Degradation performance of petroleum-hydrocarbon-degrading bacteria and its application in remediation of oil contaminated soil // IOP Conf. Series: Earth and Environmental Science. 2021. V. 766. Art. 012096.
Wu D., Zhang X.J., Liu H.C., Zhou Y.G., Wu X.L., Nie Y., Kang Y.Q., Cai M. Azospirillum oleiclasticum sp. nov., a nitrogen-fixing and heavy oil degrading bacterium isolated from an oil production mixture of Yumen Oilfield // Syst. Appl. Microbiol. 2021. V. 44. Art. 126171.
Zhang H., Tang J., Wang L., Liu J., Gurav R.G., Sun K. A novel bioremediation strategy for petroleum hydrocarbon pollutants using salt tolerant Corynebacterium variabile HRJ4 and biochar // J. Environ. Sci. (China). 2016. V. 47. P. 7‒13.
Zhang B., Zhang L., Zhang X. Bioremediation of petroleum hydrocarbon-contaminated soil by petroleum-degrading bacteria immobilized on biochar // RSC Advances. 2019. V. 9. P. 35304–35311.
Zhou H., Jiang L., Li K., Chen C., Lin X., Zhang C., Xie Q. Enhanced bioremediation of diesel oil-contaminated seawater by a biochar-immobilized biosurfactant-producing bacteria Vibrio sp. LQ2 isolated from cold seep sediment // Sci. Tot. Environ. 2021. V. 793. Art. 148529.
Ye J., Coulouris G., Zaretskaya I., Cutcutache I., Rozen S., Madden T. Primer-BLAST: A tool to design target-specific primers for polymerase chain reaction // BMC Bioinform. 2012. V. 13. Art. 134.
Дополнительные материалы отсутствуют.



