Микробиология, 2022, T. 91, № 6, стр. 708-719
Выживание стареющих микробных популяций при летальных воздействиях
Г. И. Эль-Регистан a, *, Н. Г. Лойко a, Ю. А. Николаев a
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: anmsaa@yandex.ru
Поступила в редакцию 04.06.2022
После доработки 22.06.2022
Принята к публикации 23.06.2022
- EDN: BWCTXE
- DOI: 10.31857/S0026365622600493
Аннотация
В природных системах микроорганизмы периодически подвергаются ингибирующим рост и летальным воздействиям стрессоров. Известно, что в присутствии летальных доз антибиотиков популяция бактерий выживает и сохраняется как вид за счет жизнеспособных неделящихся дормантных клеток-персистеров. Как выживает популяция при летальных, и более того, сочетанных или последовательных воздействиях стрессоров химической и физической природы неизвестно, что и определило цель настоящего исследования. Проведен сравнительный анализ выживаемости популяций стационарных культур Escherihia coli К-12 MG1655 при летальных воздействиях антибиотика ципрофлоксацина (CIP) и лизирующего раствора, теплового и щелочного шоков. Выявлена более высокая устойчивость к стрессорным воздействиям: (1) стареющих стационарных клеток, содержащих сформированный биокристаллический нуклеоид, по сравнению с клетками, только перешедшими в стационарную фазу; (2) популяций, инкубируемых в буфере без питательных веществ, а не в ростовой среде. При действии CIP на популяции статически инкубируемых культур выявлена их более высокая устойчивость к сверхвысоким концентрациям CIP (100 мкг/мл) по сравнению с биоцидной дозой (10 мкг/мл) (эффект Игла). Обнаружена гетерогенность выживающих при летальных воздействиях теплового и рН-шока субпопуляций за счет реверсии к росту временно утративших способность образовывать колонии на плотной среде клеток (через 10–30 сут их инкубации). Выявленная устойчивость выживших после теплового или рН-шока клеток к последующей биоцидной атаке CIP позволяет идентифицировать эти клетки как персистеры. Обнаруженная гетерогенность субпопуляции персистеров по показателю их стрессоустойчивости может иметь значение при коррекции режимов стерилизации и антибиотикотерапии.
В настоящее время хорошо известно, что при воздействии летальных доз антибиотиков на культуры микроорганизмов в них выживают клетки малочисленной субпопуляции персистеров (0.001–5%), образующиеся в результате цитодифференцировки и приобретающие фенотип толерантности к любым антибиотикам (Balaban et al., 2004, 2013; Lewis, 2010). Частота образования таких клеток-персистеров возрастает по мере старения микробной культуры, составляя в фазе экспоненциального роста 0.001–0.1% (персистеры II типа) и 1–5% в стационарной фазе (персистеры I типа). При перенесении в свежую среду персистеры прорастают, возвращаясь к исходному фенотипу, и воспроизводят родительскую популяциючувствительных к антибиотикам клеток, в которой опять образуется малочисленная субпопуляция клеток-персистеров. Механизмы образования персистеров и их устойчивости к антибиотикам широко изучаются преимущественно на моделях патогенных бактерий, что обусловлено запросами медицины (Balaban et al., 2013; Michiels, Fauvart, 2016; van der Bergh et al., 2017). Практически неизвестно, как выживают бактериальные популяции при воздействии летальных доз стрессоров физической и химической природы, а также при их сочетанном действии. Имеется отрывочная информация об устойчивости персистеров к некоторым химическим токсикантам, например, ионам тяжелых металлов (Van den Bergh et al., 2017).
В наших исследованиях было показано, что сочетанное воздействие на экспоненциально развивающуюся микробную культуру сублетальных доз физических (тепловой шок, 45°С, 2 ч) и химических стрессоров (внесение микробного алармона – гексилрезорцина) влияет на развитие устойчивости микробной популяции к последующей летальной антибиотической атаке. Было обнаружено, что в зависимости от временного интервала между этими последовательными воздействиями, частота образования персистеров II типа возрастает или, напротив, уменьшается (Лойко с соавт., 2015). Показано потенцирующее действие стресса на образование персистеров I типа, сопряженное с переходом культуры в стационарную фазу (van den Bergh et al., 2022; Peyrusson et al., 2022). О том, как влияют стрессорные воздействия летального уровня на выживание стационарных культур и персистеров I типа, информации нет, хотя эти ситуации имеют место как в медицинской практике при стерилизации использованного оборудования и биологического материала, так и в природных системах. Вместе с тем хорошо известно, что клетки культур стационарной фазы (неделящиеся с эндогенным метаболизмом) более устойчивы к сублетальным стрессорным воздействиям, чем клетки экспоненциально растущей культуры (Pletnev et al., 2015; Agrawal et al., 2019; Gottesman, 2019).
Переход развивающейся бактериальной культуры в стационарную фазу роста вызван изменением транскрипционных программ, определяющих смену стратегий развития популяции с размножения клеток и экспансии пространства на запрет клеточного деления и повышение стрессоустойчивости клеток. Этот переход сопровождается важными событиями, обеспечивающими выживание популяции в неблагоприятных для роста условиях. На популяционном уровне выживание популяции в стрессовых условиях обеспечивается, как отмечено выше, фенотипическим переходом клеток малочисленной субпопуляции в фенотип персистеров. Устойчивость персистеров к повреждающим воздействиям, существенно более высокая, чем у ординарных клеток, обусловлена: (1) их крайне низкой метаболической активностью, то есть независимостью от условий окружающей среды, (2) очень низкой протон движущей силой (РМF), (3) снижением диффузии в клетку антибиотиков или других токсикантов, а также высокой эффективностью эффлюкс систем (Lewis, 2010; Grant, Hung, 2013; Maisonneuve, Gerdes, 2014; van den Bergh et al., 2017).
На клеточном уровне устойчивость к стрессам связана с изменением структурной организации клеточных оболочек, замещением в мембранах ненасыщенных жирных кислот насыщенными, что вызывает снижение микровязкости липидной стромы мембран и повышение их прочности (Ткаченко, 2012; Cañas-Duarte et al., 2020).
Основным событием, происходящим в стационарных клетках является структурная реорганизация нуклеоида. Транскрипционная программа клеток стационарной фазы включает изменения в синтезе белков, ассоциированных с нуклеоидом (NAPs), имеющих функции глобальных транскрипционных регуляторов (Azam, Ishihama, 1999). В стационарных клетках основным из NAPs становится белок Dps (${{\underset{\raise0.3em\hbox{$\smash{\scriptscriptstyle-}$}}{D} NA}}$ – binding ${{\underset{\raise0.3em\hbox{$\smash{\scriptscriptstyle-}$}}{p} rotein}}$ from $\underset{\raise0.3em\hbox{$\smash{\scriptscriptstyle-}$}}{s} {\text{tarved}}$ cells). Белок Dps, относящийся к семейству ферритиновых белков, образует самосборкой додекамеры, в полости которых Dps связывает ионы Fe2+ и окисляет их активными формами кислорода, образующимися в реакции Фентона, защищая, таким образом, клетки от окислительного стресса. Экспрессия белка Dps включена также в клеточные ответы на стрессорные воздействия голодания, температурного шока, рН-шока и др. (Karas et al., 2015). Другая, наиболее важная функциональная активность Dps обусловлена способностью его додекамеров к: (1) самосборке в упорядоченную кристаллическую структуру и (2) образованию комплексов с ДНК, что сопровождается ее компактизацией. Совокупно, это приводит к образованию биокристаллического нуклеоида (БН). Включение нитей ДНК в многослойную конструкцию Dps-Dps обусловливает обратимую супрессию транскрипционной активности ДНК (Karas et al., 2015; Janissen et al., 2018). Образование БН в стационарных клетках должно обеспечивать, таким образом, их более высокую стрессоустойчивость дополнительно к метаболически обусловленной стрессоустойчивости. Процесс биокристаллизации нуклеоида начинается при переходе культуры E. coli в стационарную фазу и завершается через 48 ч (Frenkel-Krispin et al., 2004). Отметим, что биокристаллизация нуклеоида имеет место как в обычных вегетативных стационарных клетках, так и в клетках-персистерах I типа, образовавшихся в стационарных популяциях. Дальнейшая судьба этих двух субпопуляций различна. В стареющей бактериальной культуре стационарная фаза сменяется фазой отмирания бактериальной культуры, когда обычные клетки автолизируются, а персистеры, устойчивые к автолизу, выживают. При этом обломки и внутреннее содержимое лизировавшихся клеток способствуют выживанию персистеров (Podlesek et al., 2016) и, согласно гипотезе (Лойко с соавт., 2015), созреванию персистеров в анабиотические покоящиеся формы, обладающие высокой устойчивостью к повреждающим стрессорным воздействиям. Эта устойчивость персистеров, приобретающих состояние спячки (dormancy) или оцепенения (quiescence), обусловлена изменением компонентного состава и, следовательно, структурной организации и функциональной активности клеточных оболочек: липидного состава мембран (Gonçalves, de Carvalho, 2016; Cañas-Duarte et al., 2020) и пептидоглигана клеточной стенки (Rittershaus et al., 2013; Pletnev et al., 2015; Jia et al., 2020), а также закислением цитоплазмы (Goode et al., 2021).
Таким образом, клетки стационарной популяции как ординарные вегетативные, так и персистеры обладают, по-видимому, ранжированной устойчивостью к повреждающим воздействиям. Наиболее устойчивы клетки-персистеры, созревающие в процессе длительного культивирования в высоко стрессоустойчивые покоящиеся формы. Достаточно устойчивы старые стационарные клетки с биокристаллизованным нуклеотидом, и наименее стрессоустойчивы клетки ранней стационарной фазы.
Целью настоящего исследования было определить уровень выживания (персистенции) бактериальных популяций Escherihia coli при индивидуальных и сочетанных летальных стрессорных воздействиях на стационарные культуры бактерий разного возраста. В настоящем исследовании было выяснено влияние на устойчивость клеток к действию стрессоров: (1) возраста стационарных клеток (1 и 3 сут); (2) природы стрессора – биологической (антибиотик ципрофлоксацин (CIP)), химической (лизирующий раствор, рН-шок), физической (тепловой шок); (3) последовательности сочетанного действия стрессоров.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Объекты исследования. В работе использовали грамотрицательные бактерии Escherihia coli шт. К12 MG1655 из коллекции культур НИИ новых антибиотиков им. Г.Ф. Гаузе РАН.
Бактерии культивировали в среде LB (Broth, Miller, VWR, USA) в колбах объемом 250 мл с 50 мл среды на орбитальной качалке (160 об./мин) при температуре 28°С. Инокулят – культуру стационарной фазы роста (ночная культура) вносили в количестве 0.5 мл на 50 мл среды (1%), что обеспечивало начальную оптическую плотность (ОП) ≈0.3 (λ = 450 нм, l = 10 мм) (Spectrophotometer 7315, Jenway, GB). Для определения численности стрессоустойчивых (выживших) клеток (персистеров) в стационарных (1 и 3 сут) культурах E. coli использовали графическую зависимость изменения титра клеток от времени воздействия.
Выявление персистеров I типа E. coli воздействием антибиотика CIP. В бактериальные культуры стационарной фазы роста (1 и 3 сут), полученные как описано выше, вносили CIP до конечных концентраций 10 и 100 мкг/мл, соответствующих 10 и 100 минимальным ингибирующим концентрациям (МИК), и инкубировали их при температуре 28°С без перемешивания в течение 14–16 сут. Периодически определяли титр жизнеспособных клеток по числу колониеобразующих единиц (КОЕ/мл) после высева 6-кратно отмытых от антибиотика 0.9% NaCl аликвот на агаризованную среду LB (с добавлением 1.5% Bacteriological Agar, Helicon, Russia).
Выявление персистеров I типа E. coli воздействием лизирующего раствора. В бактериальные культуры стационарной фазы роста (1 и 3 сут), полученные как описано выше, вносили содержащий додецилсульфат натрия лизирующий раствор (из набора Plasmid Miniprep Кат. # BC021L, Евроген, Россия) до конечных концентраций 2.5 и 5 об. % и инкубировали их при температуре 28°С без перемешивания в течение 4 часов. Каждые 40 мин определяли изменение титра жизнеспособных клеток после высева 2-кратно отмытых 0.9% NaCl аликвот на агаризованную среду LB (с добавлением 1.5% Bacteriological Agar, Helicon, Russia).
Выявление клеток стационарных культур E. coli, устойчивых к тепловому шоку. Аликвоты (1 мл) бактериальных культур E. coli стационарной фазы роста (1 и 3 сут) переносили в пластиковые пробирки объемом 2 мл и подвергали воздействию температуры 50, 55 или 60°С в течение 60 мин с использованием термошейкера (TS-100, Biosan) при перемешивании (740 об./мин). Каждые 5–10 мин определяли численность жизнеспособных клеток (методом КОЕ).
Выявление клеток стационарных культур E. coli, устойчивых к рН-шоку. Аликвоты (1 мл) бактериальных культур E. coli стационарной фазы роста (1 и 3 сут) переносили в пластиковые пробирки объемом 2 мл. Туда же вносили 1 н раствор КОН до увеличения показателя рН среды до 10.0. Культуры инкубировали при 28°С без перемешивания в течение 240 мин, определяя каждые 30 мин численность жизнеспособных клеток (методом КОЕ).
Подготовка клеточных популяций для дальнейших экспериментов. Клетки контрольных и опытных образцов делили на две партии. Первую партию контрольных и опытных образцов отделяли от культуральной жидкости центрифугированием (10 000 g, 15 мин), промывали PBS буфером (после теплового и щелочного шоков 2 раза, после действия CIP 6 раз), и ресуспендировали в культуральной жидкости, полученной после культивирования клеток E. coli в течение 1- или 3-х сут, соответственно (для экспериментов с CIP 6- и 8-сут, соответственно). Эти клеточные популяции обозначали “П среда”. Вторую партию контрольных и опытных образцов отделяли от культуральной жидкости центрифугированием (10 000 g, 15 мин), промывали PBS буфером (после теплового и щелочного шоков 2 раза, после действия CIP 6 раз), и ресуспендировали в PBS буфере, обозначая соответственно “К буфер” или “П буфер”.
Определение длительности выживания клеток после стрессорных воздействий. Клетки контрольных и опытных образцов, подготовленные, как описано выше, хранили в течение 4–8 мес. при 23°С без перемешивания, периодически определяя количество жизнеспособных клеток (методом КОЕ).
Стрессирование клеток, выживших после воздействия CIP. Клеточные популяции подвергали воздействию теплового шока (15 и 30 мин при температуре 55°С) и щелочного шока (увеличение рН до 10.0 добавлением 1 н КОН и инкубирование в течение 2 ч). Далее определяли численность оставшихся жизнеспособными клеток (методом КОЕ).
Стрессирование клеток, выживших после теплового шока. Клеточные популяции подвергали воздействию CIP (10 мкг/мл, инкубация в статическом режиме при 23°С в течение 5 сут) и щелочного шока (увеличение рН до 10.0 добавлением 1 н КОН и инкубирование в течение 2 ч). Далее определяли численность оставшихся жизнеспособными клеток (методом КОЕ).
Стрессирование клеток, выживших после воздействия щелочного шока. Клеточные популяции подвергали воздействию CIP (10 мкг/мл, инкубация в статическом режиме при 23°С в течение 5 сут) и теплового шока (15 и 30 мин при температуре 55°С). Далее определяли численность оставшихся жизнеспособными клеток (методом КОЕ).
Статистический анализ. Все эксперименты проводились в 5-ти кратной повторности. Статистический анализ был сделан с использованием стандартных методов в программе Microsoft Excel XP. Группу данных считали однородной, если среднеквадратичные отклонения σ не превышали 10%. Различия между группами считали достоверными при критерии вероятности Р > 0.95.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для выявления клеток-персистеров бактериальную популяцию подвергают воздействию летальных доз антибиотиков (Michiels, Fauvart, 2016). При этом об образовании субпопуляции персистеров судят по обнаружению плато на кривой отмирания клеток (Balaban et al., 2004, 2013). В настоящей работе, наряду с воздействием антибиотика CIP, впервые были предложены новые способы выявления персистеров с помощью лизирующего раствора, а также теплового и щелочного шоков путем анализа кривой отмирания клеток в результате действия стресса. Также рассматривались вопросы влияния на выживание клеточных популяций возраста культуры до стрессового воздействия и среды, в которой инкубируются клетки. Под термином “выживание” понимали сохранение бактериями колониеобразующей способности.
Выявляющее персистеры действие CIP
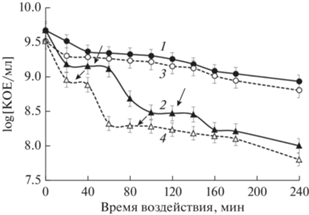
Персистеры I типа выявляли, добавляя CIP (10 и 100 мкг/мл) в 1 и 3 сут стационарные культуры E. coli (рис. 1). Парадоксально, но число выживших клеток в обеих культурах было больше при воздействии сверх высокой дозы CIP 100 мкг/мл – 10–15%, чем при биоцидной 10 мкг/мл – 1–3%. Такой феномен, при котором численность выживших бактерий больше при концентрациях антибиотика значительно более высоких, чем оптимальная бактерицидная концентрация, был описан как эффект Игла (Eagle, 1948; Eagle, Musselman, 1948). Его неоднократно фиксировали в экспериментах с культурами бактерий и грибов различных таксонов (Prasetyoputri et al., 2019). Отметим, что эффект Игла описывался ранее для экспоненциально растущих клеток, а в наших исследованиях впервые показан для клеток стационарных культур. Молекулярные и клеточные механизмы эффекта Игла плохо изучены, но полагают, что один из них связан с действием автолизинов, интерферирующем с действием антибиотиков. Также возможно, что сверхвысокие дозы антибиотика вызывают снижение уровня образующихся при стрессе АФК, что приводит к увеличению доли выживающих клеток (Prasetyoputri et al., 2019). Хотя эти гипотезы были сформулированы для экспоненциально растущих клеток, они не противоречат полученным нами результатам для стационарных культур. Существенных различий между выживанием клеток при антибиотической атаке в 1 и 3 сут культурах E. coli не было обнаружено, численность выявленных на “плато” клеток-персистеров в обоих вариантах составляла около 3% (действие 10 мкг/мл CIP) (табл. 1). Единственным различием было более быстрое отмирание клеток 3 сут культуры по сравнению с клетками 1 сут культуры.
Рис. 1.
Кривые отмирания популяций стационарных культур E. coli после внесения летальных доз CIP – 10 (1) и 100 (2) мкг/мл: а – 1 сут культура; б – 3 сут культура. Инкубация в статическом режиме. Стрелками указаны плато персистеров.
Таблица 1.
Доля (%) выживших клеток-персистеров популяций 1 и 3 сут стационарных культур E. coli после стрессорных летальных воздействий CIP, лизирующего раствора, теплового и щелочного шоков
| Летальное воздействие | Доля жизнеспособных клеток-персистеров, в % от первоначального количества |
|
|---|---|---|
| 1 сут культура | 3 сут культура | |
| CIP, 10 мкг/мл CIP, 100 мкг/мл |
3 13 |
3 10 |
| Лизирующий раствор, 5% | 5–7 | 3–5 |
| Тепловой шок 55°С, | ||
| 15 мин 20 мин |
0.001 0.0001 |
0.5 0.005 |
| Щелочной шок, | ||
| рН 10, 150 мин | 0.3 | 1.0 |
Выявляющее персистеры действие лизирующего раствора
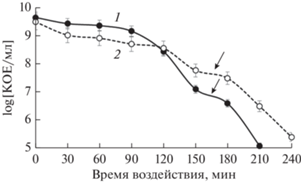
Персистеры I типа выявляли, добавляя лизирующий раствор (2.5 и 5 об. %) в 1 и 3 сут стационарные культуры E. coli (Canas-Duarte et al., 2014) (рис. 2). Селектирующий эффект зависел от концентрации лизирующего раствора и был хорошо выражен при использовании 0.5 об. % раствора для обоих вариантов – 1 и 3 сут культур E. coli. При этом в 3 сут культуре, в которой отмирание ординарных клеток шло быстрее, численность выживающих клеток составляла 3–5%, а в 1 сут культуре была выше – 5–7%. Это объясняется тем, что при старении стационарных клеток прочность клеточных оболочек снижается и воздействие компонентов лизирующего раствора приводит к более быстрому разрушению бактериальных клеток. Следует отметить, что количество персистеров, выявленное воздействием на популяцию CIP и лизирующего раствора, было примерно одинаково (табл. 1).
Селектирующее стационарные клетки E. coli действие летального рН-шока (защелачивание среды)
Действие КОН на статически инкубируемые 1 и 3 сут культуры, увеличивающее рН среды до значений 10.0, представлено на рис. 3 в виде графических зависимостей динамики снижения количества жизнеспособных клеток. После длительной лаг-фазы (до 90 и 120 мин соответственно) на кривой лизиса наблюдался период отмирания клеток, более быстрый в 1 сут культуре. Затем следовал 30 минутный период замедления гибели клеток (плато) и дальнейшее ускоренное отмиранием культуры. Численность клеток, по-видимому, персистеров, на выявленных плато, составляла около 0.3% в 1 сут культуре и 1% в 3 сут культуре (рис. 3), что несколько меньше, чем при выявлении персистеров воздействием антибиотика или лизирующего раствора (табл. 1). Вероятно, несмотря на то, что мембраны клеток-персистеров имеют повышенную прочность за счет высокого содержания насыщенных жирных кислот и пониженной микротекучести липидной стромы (Balaban et al., 2013), они тоже чувствительны к воздействию КОН.
Селектирующее стационарные клетки E. coli действие летального теплового шока
Развитие стрессового ответа клеток на сублетальный тепловой шок хорошо изучено. Показаны его воздействие на клеточную оболочку грамотрицательных бактерий, ее стрессовый ответ и основные пути проведения стрессового сигнала, в том числе функциональность σ-фактора, контролирующего продукцию липополисахаридов и целостность внешней мембраны (Wang et al., 2021). Имея повышенную прочность клеточных мембран, можно предположить, что клетки-персистеры должны быть более устойчивы к летальному тепловому шоку, что должно отразиться на кривой отмирания клеток образованием плато.
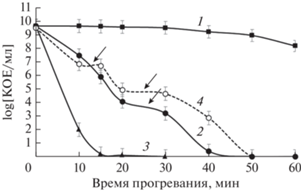
При подборе условий теплового шока наиболее показательным оказалось воздействие 55°С (рис. 4). В этом случае на кривых отмирания обнаруживались плато, соответствующие субпопуляциям с более выраженной термоустойчивостью клеток. Кривые отмирания популяций 1 и 3 сут культур имели сходный характер. Однако, клетки 3 сут культуры демонстрировали большую устойчивость, а кривая отмирания имела два хорошо выраженных плато: первое – в период 10–15 мин прогревания (0.5% клеток популяции) и второе – в период 20−30 мин прогревания, где численность выживших клеток составляла 0.01%. Более высокая термостабильность клеток 3 сут культур по сравнению с 1 сут культурами, по-видимому, объясняется спецификой структурной реорганизации клеток – завершением формирования в них БН с помощью белка Dps (Frenkiel-Krispin, Minsky, 2006; Крупянский с соавт., 2018). Одной из функций белка Dps является повышение термостабильности стационарных клеток по сравнению с клетками экспоненциально растущих культур (Almirón et al., 1992; Karas et al., 2015). Выявленные нами различия в термостабильности клеток 1 и 3 сут стационарных культур еще раз на новой модели подтвердили роль БН в термоустойчивости клеток.
Рис. 4.
Кривые отмирания популяций 1 (1, 2, 3) и 3 (4) сут стационарных культур E. coli при тепловом шоке 50°С (1), 55°С (2, 4), 60°С (3) в зависимости от времени воздействия. Стрелками указаны плато персистеров. Инкубация при перемешивании.
Таким образом, при летальных воздействиях высокой температуры или рН-шока жизнеспособными остаются около десятой – сотой доли процента от численности стационарных популяций. Можно полагать, что эти выжившие клетки являются персистерами.
Для проверки высказанного положения далее были изучены свойства полученных клеток-персистеров: способность к длительному сохранению жизнеспособности и устойчивость к перекрестному действию стрессорных факторов.
Свойства клеток-персистеров, выявленных после действия CIP
Длительность сохранения жизнеспособности. Отмытые от антибиотика субпопуляции клеток-персистеров 1 и 3 сут стационарных культур E. coli, оставшихся жизнеспособными после 5 сут воздействия летальных доз CIP, а также соответствующие им контрольные варианты стационарных культур, хранили в течение 7 мес. в среде роста и в буфере (табл. S1 ).
Сразу после воздействия CIP, отмывки и ресуспендирования выживших персистеров в среде роста или буфере титр жизнеспособных клеток составил 3.0 и 2.2% от исходного количества бактерий в 1 сут культуре и 2.3 и 2.1% в 3 суточной, соответственно. В контрольных популяциях, без воздействия антибиотика, но с 5-ти суточной инкубацией и последующим перенесением в среду или буфер количество жизнеспособных клеток оказалось ~35–50% от исходного (табл. S1 ).
Через месяц хранения 1 сут культур количество (относительно их титра на начало периода хранения) жизнеспособных персистеров, хранившихся в среде роста, снижалось до 3.5%, тогда как стационарных клеток в контрольном образце – до 7.1%. При хранении бактерий в буфере, количество выживших клеток было выше – 12.1 и 23.0% соответственно. В случае 3 сут культур и в среде роста, и в буфере относительное количество клеток-персистеров через месяц хранения было выше, чем в контрольных вариантах в 2.6 и 4.2 раза, соответственно. Т.е. прослеживалась общая тенденция лучшего сохранения жизнеспособных клеток как контрольных, так и опытных популяций в буфере, а также большая устойчивость к длительной инкубации 3 сут популяций. Интересно, что при хранении фракции персистеров 3 сут культур в течение 1 мес. в буфере их численность не менялась, а в среде роста – падала меньше, чем в 3 раза, что свидетельствует об устойчивости персистеров к автолизу (Balaban et al., 2013; Orman, Brynildsen, 2015; van den Bergh et al., 2017;Mohiuddin et al., 2021). Однако через 7 мес. инкубации доля КОЕ-образующих клеток-персистеров в этих образцах снижалось до 4.4% в буфере и 9.0% в среде, что можно объяснить гетерогенностью субпопуляции персистеров и приобретением частью из них состояния “некультивируемости” при принципиальном сохранении их жизнеспособности. Значительно снижалась численность жизнеспособных клеток через 7 мес. хранения и в контрольных популяциях, и по абсолютным значениям она совпадала со значениями в опытных вариантах. Т.е. доля выживших анабиотических покоящихся клеток (Эль-Регистан с соавт., 2006) в контрольных популяциях соответствовала численности персистеров в опытных популяциях, что подтверждает ранее высказанную гипотезу, рассматривающую персистеры как предшественники покоящихся форм (Лойко с соавт., 2015).
Устойчивость к стрессовым факторам. При сильном стрессовом воздействии основная часть популяции отмирает, а клетки малочисленной субпопуляции персистеров c нарушенным метаболизмом выживают (Hofer, 2022). Их состояние при этом характеризуется крайне слабым обменом веществ и пролонгированной реверсией к росту (Balaban et al., 2013). При этом реактивированные в свежей среде персистеры теряют свою стрессоустойчивость и погибают при повторном стрессорном воздействии (Wainwright et al., 2021), что используется как прием тиндализации в медицинской практике. Однако не известно, что будет со способностью персистеров ревертировать к росту, если их подвергать повторному летальному стрессовому воздействию без предварительной реактивации. Такая схема повторного перекрестного стресса клеток-персистеров была воспроизведена в наших экспериментах.
Воздействие теплового шока. Популяции персистеров 1 и 3 сут культур, выявленные CIP, а также популяции клеток контрольных вариантов, ресуспендированные в среде роста и буфере, подвергали тепловому шоку (55°С, 15 и 30 мин), после чего определяли численность выживших клеток (табл. S2 ).
В образцах 1 сут культур после 15 мин прогревания титр жизнеспособных клеток в контрольных и опытных вариантах снижался на 3–4 порядка, а в 3 сут – на 2–3 порядка. При этом относительное количество выживших клеток-персистеров во всех вариантах было выше, чем стационарных клеток в 1.5–4.5 раза. Устойчивости как контрольных, так и клеток-персистеров способствовала инкубация в PBS буфере. Т.е. в образцах клеток, суспендированных в среде роста, автолиз шел быстрее, чем при суспендировании клеток в буфере, что можно объяснить присутствием в среде роста токсичных продуктов метаболизма, а также ненасыщенных жирных кислот, индуцирующих автолиз клеток (Эль-Регистан с соавт., 2006). Синергидное действие ненасыщенных жирных кислот и нагревания вызывают сверхкритическое повышение текучести липидной стромы мембран и гибель клеток.
Описанные тенденции усиливались при более длительном (30 мин) воздействии температуры. Сам факт выживания части персистеров при возрастании времени прогревания свидетельствует о гетерогенности популяции персистеров по показателю терморезистентности. Если гетерогенность популяции покоящихся анабиотических форм по их терморезистентности была известна (Эль-Регистан с соавт., 2006), то для персистеров она показана впервые и может объясняться, различиями в составе и количестве структурных компонентов мембраны (насыщенных жирных кислот и др.).
Таким образом, после теплового шока в субпопуляциях персистеров выживает больший процент клеток (в 1.5–185 раз), чем в контрольных вариантах, при этом в образцах суспендирования в буфере больше, чем при суспендировании в среде роста. Эти результаты подтверждают высокую термоусточивость персистеров, а также роль среды, в которой клетки подвергались прогреванию, что показано впервые.
Воздействие защелачивания среды. В популяции персистеров 1 и 3 сут культур, выявленные CIP, а также популяции клеток контрольных вариантов, ресуспендированные в среде роста и буфере, вносили 1 н КОН до рН 10.0. Через 2 ч инкубации определяли количество жизнеспособных клеток (табл. S3 ).
Так же как и в экспериментах с воздействием повышенной температуры, клетки 1 сут культур оказались более чувствительны к щелочному шоку, чем клетки 3 сут культур, при этом персистеры оказались более устойчивы, примерно в 4 раза, чем контрольные стационарные клетки. Более высокая устойчивость персистеров может объясняться отмеченным ранее измененным (по сравнению с ординарными клетками) составом мембранных липидов и потому – структурной реорганизацией липидной стромы мембран.
Свойства клеток-персистеров, выявленных после летального щелочного шока
Длительность сохранения жизнеспособности. Отмытые от КОН субпопуляции клеток-персистеров 1 и 3 сут культур E. coli, а также соответствующие им контрольные варианты стационарных культур, хранили в течение 4 мес. в среде роста и в буфере (табл. S4 ).
Анализ результатов, полученных для контрольных и опытных образцов, хранившихся 1 мес. в статических условиях, выявил их принципиальные различия. Во всех образцах контрольных вариантов как 1 сут, так и 3 сут культур шло отмирание клеток, при этом более быстрое в среде роста, чем в буфере, и в 1 сут популяциях, чем в 3 сут, а количество жизнеспособных клеток (в % от исходного) снижалось до уровня 5–12%. Еще через 3 мес. хранения титр выживших клеток в контрольных вариантах составлял 0.5–0.8%, что соответствовало численности анабиотических покоящихся форм, в виде которых выживают и сохраняют вид бактериальные популяции (Эль-Регистан с соавт., 2006).
Принципиально другие результаты были получены для опытных вариантов. Отмирание клеток-персистеров шло быстрее в популяциях, инкубируемых в буфере, а чувствительность 3 сут клеток оказывалась выше. Следует отметить, что через мес. инкубации (а для 1 сут вариантов и через 4 мес.) количество жизнеспособных бактерий было выше, чем на момент начала их хранения, что связано с реактивацией части клеток популяций. Это объясняется тем, что щелочной рН-стресс на первом этапе сопровождается энергозависимым выходом из клеток K+, снижением активности воды, увеличением плотности цитоплазмы и ингибированием ряда метаболических процессов (Saito, Kobayashi, 2003; Padan et al., 2005). Поэтому сразу после стрессового шока численность способных образовывать колонии на плотной среде клеток в популяции резко снижается. На следующем этапе развития стрессового ответа начинается потребление ионов K+, которые в данном случае имеются как в среде роста, так и PBS буфере. Этот транспорт потенцируется осмотически активными веществами (Diskowski et al., 2015), присутствующими в среде роста (культуральной жидкости) и отсутствующими в буфере. Поэтому доля реактивированных клеток больше в образцах суспендирования клеток в среде роста, а не в буфере.
Также следует отметить совпадение численности клеток, выживших во всех вариантах через 4 мес. хранения, с численностью, принятой для персистеров – около 1% от исходного значения. Это позволяет предположить, что при летальном щелочном стрессе выживают клетки-персистеры. Однако, обнаруженная реактивация клеток опытных вариантов, приводящая к увеличению их численности, не позволяет рекомендовать прием летального воздействия КОН для селекции клеток-персистеров. Сам факт пролонгированной реактивации малочисленной субпопуляции клеток после летального стресса описывается впервые.
Воздействие CIP. В популяции клеток 1 и 3 сут стационарных культур, перенесших щелочной стресс, отмытых от КОН, и в популяции контрольных вариантов, ресуспендированных в среде роста или буфере, вносили CIP (10 мкг/мл) и инкубировали в статическом режиме 5 сут. Затем клетки отмывали от CIP и определяли численность выживших бактерий методом КОЕ (табл. S5 ).
Внесение CIP в популяции контрольных вариантов 1 и 3 сут культур ожидаемо привело к селекции субпопуляции персистеров, численность которых составила соответственно 2.6 и 2.4% в среде роста и 10.7 и 8.9% в буфере (табл. S5 ). Действие антибиотика на персистеры, выявленные воздействием КОН, имело менее катастрофичные последствия, особенно для 3 сут популяций, в которых остались жизнеспособными 32.8% клеток, инкубируемых в среде и 22.8% клеток, инкубируемых в буфере (табл. S5 ). Это подтверждает тот факт, что при летальном действии КОН выживают клетки-персистеры, а priori устойчивые к воздействию антибиотиков.
Дистресс, вызванный внесением CIP в суспензию персистеров, выявленных воздействием КОН, был более губителен для клеток 1 сут популяций. Титр выживших в них клеток был на 1–1.5 порядка меньше, чем в популяциях 3 сут культур, и составлял всего 0.02% (в среде) и 0.007% (в буфере) от исходного количества бактерий в популяции до всех воздействий (4.6 × 109 клеток/мл). Это еще раз подтверждает ранее сделанный вывод об устойчивости персистеров 3 сут культур за счет наличия в них сформированного БН.
Следует отметить, что при двойном последовательном действии стрессоров большую роль играет их очередность. Так, при внесении CIP в стрессированную КОН суспензию клеток 1 сут культур в среде роста выжило 7.7% клеток, а при обратной последовательности воздействий – сначала CIP, потом КОН, выжило 19.3%. Такой же эффект был обнаружен для образцов 3 сут культур (32.9 и 41.7%). Это свидетельствует о гетерогенности субпопуляции персистеров, что может иметь значение для коррекции режимов антибиотикотерапии.
Воздействие теплового шока. Популяции клеток 1 и 3 сут стационарных культур, перенесших щелочной стресс, отмытых от КОН, и популяции контрольных вариантов, ресуспендированных в среде роста или буфере, подвергали прогреванию при 55°С в течение 15 и 30 мин, после чего определяли численность КОЕ-образующих клеток (табл. S6 ). Таким образом, на клетки контрольных вариантов влиял только тепловой шок, а на клетки опытных вариантов – оба стрессора, КОН и высокая температура.
Как в контрольных, так и в опытных вариантах тепловой шок оказывал более губительное воздействие на клетки 1 сут культур и инкубированные в среде роста. Так, количество выживших клеток после 30 минутного воздействия термошока в опытных популяциях, хранящихся в среде роста и в буфере составило 0.02 и 0.1%, а в контрольных почти на два порядка меньше – 0.0001 и 0.003% соответственно. В 3 сут популяциях этот разрыв был меньше и составлял один порядок. Полученные результаты позволяет заключить, что рН-шок отселекционировал стрессоустойчивые клетки, выживающие при повторном воздействии не только CIP, но и теплового шока. Сравнение приведенных данных в табл. S6 с полученными при последовательном воздействии CIP и затем теплового шока (15 мин) (табл. S2 ) выявило их близость. Это подтверждает, что при дистрессе с большой долей вероятности выживают клетки-персистеры.
Свойства клеток-персистеров, выявленных после летального теплового шока
Длительность сохранения жизнеспособности. Подвергнутые 30 мин воздействию температуры 55°С субпопуляции клеток-персистеров 1 и 3 сут культур E. coli, а также соответствующие им контрольные варианты стационарных культур, хранили в течение 4 мес. в среде роста и в буфере (табл. S7 ).
Приведенные в табл. S7 результаты оказались схожи с полученными при воздействии щелочного шока (табл. S4 ). Сразу после прогрева численность КОЕ-образующих клеток резко снижалась во всех опытных образцах. При этом доля выживающих клеток была на 1.5–2 порядка меньше в ростовой среде, чем в буфере, и меньше в образцах 1 сут культур, чем 3 сут культур. Через 11 сут хранения в контрольных вариантах начинался автолиз, и численность клеток снижалась на 20–90%. В дальнейшем автолиз продолжался и через 4 мес. титр жизнеспособных клеток составлял 0.5–1% от первоначального. В опытных образцах все складывалось кардинально по-другому. В 1 и 3 сут опытных культурах, инкубируемых в среде роста, уже через 11 сут КОЕ-образующих клеток не обнаруживалось, тогда как в буферных образцах их численность, наоборот, возрастала на 1–2 порядка. Дальнейшее хранение практически не влияло на ситуацию. Через 4 мес. хранения численность персистеров (кроме варианта 1 сут в среде роста, где КОЕ-образующие клетки так и не выявлялись), а также контрольных клеток, было на уровне 1% от исходного в первоначальных популяциях, что соответствует принятой численности субпопуляции персистеров (Balaban et al., 2004, 2013).
Полученные результаты позволяют сделать ряд выводов. (1) Показанная для опытных образцов частичная реактивация клеток после теплового шока, аналогичная реактивации клеток после воздействия КОН (рН 10), свидетельствует об их стрессовом состоянии с временной потерей колониеобразующей способности. (2) Определение колониеобразующей способности клеток сразу после окончания стрессорного воздействия (тепловой шок, защелачивание среды, рН 10) не отражает количества жизнеспособных клеток. Численность колониеобразующих клеток следует определять через некоторое, эмпирически подобранное, время после повреждающего воздействия, достаточное для реактивации поврежденных, но не убитых клеток. (3) Удельная доля жизнеспособных клеток (от 100% в исходной популяции), восстановивших КОЕ-образующую способность после теплового шока ∼1%, позволяет отнести их к субпопуляции персистеров. (4) Увеличение численности выжившей субпопуляции за счет ревертировавших к росту клеток почти на 2 порядка (по сравнению с численностью сразу после воздействия стрессора) свидетельствует о гетерогенности персистеров по их стрессоустойчивости. (5) Отмирание стрессированных тепловым шоком клеток в ростовой среде (но не в буфере) объясняется синергидным действием ростингибирующих метаболитов, накапливающихся в стационарной фазе, и снижением барьерной функции мембран прогретых (55°С) клеток (Эль-Регистан с соавт., 2006). Полученные результаты демонстрируют биотехнологическую целесообразность долгосрочного хранения микроорганизмов в виде суспензии их стационарных клеток (со сформированным БН) в буферных растворах.
Воздействие защелачивания среды. В популяции персистеров 1 и 3 сут культур, выявленные 30 мин тепловым шоком (55°С), а также популяции клеток контрольных вариантов, ресуспендированные в среде роста и буфере, вносили 1 н КОН до рН 10.0. Через 2 ч инкубации определяли количество жизнеспособных клеток (табл. S8 ).
В контрольных вариантах, где бактерии подвергались действию только одного стрессора – КОН, жизнеспособность клеток снижалась до 6.3% в случае 1 сут культуры и 11.9% – 3 сут культуры, что подтверждает показанную выше более высокую стрессоустойчивость “стареющих” стационарных клеток со сформированным БН. В опытных образцах колониеобразующие клетки не выявлялись, что можно интерпретировать как следствие дистресса.
Воздействие CIP. В популяции клеток 1 и 3 сут стационарных культур, выявленные 30 мин тепловым шоком (55°С), и в популяции контрольных вариантов, ресуспендированных в среде роста или буфере, вносили CIP (10 мкг/мл) и инкубировали в статическом режиме 5 сут. Затем клетки отмывали от CIP и определяли численность выживших бактерий методом КОЕ (табл. S9 ).
В контрольных вариантах 1 и 3 сут культур, инкубируемых в ростовой среде, после воздействия CIP жизнеспособными оставались ~2.5% клеток, тогда как в популяциях, инкубируемых в буфере ~10.0%. Это подтверждает ранее сделанный вывод о потенцирующем автолиз клеток действии культуральной жидкости стареющих стационарных культур.
Персистеры, выявленные тепловым шоком, оказались очень устойчивы к действию антибиотика, особенно 3 сут, инкубируемые в среде, численность которых в результате воздействия снижалась только на 20%. Эта устойчивость к воздействию антибиотика предполагает, что при тепловом стрессе выживают именно клетки персистеры. Их низкая численность (103–105 клеток/мл) подтверждает ранее сделанный вывод о гетерогенности субпопуляции персистеров по признаку стрессоустойчивости. Отметим, что субпопуляции анабиотических покоящихся форм также гетерогенны по признаку стрессоустойчивости, в частности – терморезистентности, что ранее связывали с их различиями в структурной организации клеточных оболочек (моно- или многослойных) (Сузина с соавт., 2001). Однако такое объяснение не годится для персистеров, выявленных в стационарных культурах. Как было ранее показано для грамотрицательных бактерий за проведение сигнала при тепловом шоке ответственны несколько систем, в том числе, контролируемая σЕ-фактором (Wang et al., 2021), под контролем которого находится продукция липополисахаридов и целостность внешней мембраны, что влияет на выживание клеток при тепловом стрессе. Стохастичность выражения этой системы может определять различия в стрессовом ответе на тепловой шок в субпопуляции персистеров.
ЗАКЛЮЧЕНИЕ
В природных системах микроорганизмы периодически подвергаются ингибирующим рост и летальным воздействиям стрессоров. В настоящей статье приведены результаты системного исследования выживаемости популяций E. coli стационарной фазы роста при летальных воздействиях физических (тепловой шок), химических (лизирующий раствор, рН-шок) и биологических (антибиотик CIP) стрессоров. Анализ результатов выживания популяций при: (а) летальных воздействиях, (б) последующем длительном (до 7 мес.) хранении и (в) перекрестных стрессорных воздействиях, позволил сделать следующие выводы. (1) Сохранение бактериальной популяции как вида при летальных воздействиях любой природы осуществляется за счет выживания малочисленной субпопуляции клеток-персистеров, что расширяет диапазон стрессоров, к которым устойчивы эти дормантные (покоящиеся) формы. (2) Субпопуляция персистеров гетерогенна по признаку их стрессоустойчивости. (3) Стрессоустойчивость клеток стационарных популяций зависит от их структурной организации и выражена сильнее у старых стационарных клеток, содержащих сформированный БН. (4) Обнаружен эффект реверсии к росту у малочисленной субпопуляции клеток, временно (14 сут) потерявших способность к росту после летального воздействия теплового шока или рН-шока. (5) Обнаружено потенцирующее автолиз клеток действие ростовой среды стационарных культур (содержащей токсичные продукты клеточного метаболизма и аутоиндукторы автолиза), что обусловливает предпочтительность хранения микробных популяций в буфере.
Список литературы
Крупянский Ю.Ф., Лойко Н.Г., Синицын Д.О., Терешкина К.Б., Терешкин Э.В., Фролов И.А., Чуличков А.Л., Бокарева Д.А., Мысякина И.С., Николаев Ю.А., Эль-Регистан Г.И., Попов В.О., Соколова О.С., Шайтан К.В., Попов A.Н. Биокристаллизация в клетках и спорах бактерий и грибов // Кристаллография. 2018. Т. 63. С. 572‒577.
Krupyanskii Y.F., Loiko N.G., Sinitsyn D.O., Tereshkina K.B., Tereshkin E.V., Frolov I.A., Chulichkov A.L., Bokareva D.A., Mysyakina I.S., Nikolaev Y.A., El’-Registan G.I., Popov V.O., Sokolova O.S., Shaitan K.V., Popov A.N. Biocrystallization in bacterial and fungal cells and spores // Crystallogr. Rep. 2018. V. 63. P. 594‒599.
Кряжевских Н.А., Демкина Е.В., Манучарова Н.А., Соина В.С., Гальченко В.Ф., Эль-Регистан Г.И. Реактивация покоящихся и некультивируемых форм бактерий из древних почв и мерзлотных подпочвенных отложений // Микробиология. 2012. Т. 81. С. 474–485.
Kryazhevskikh N.A., Demkina E.V., Manucharova N.A., Soina V.S., Gal’chenko V.F., El’-Registan G.I. Reactivation of dormant and nonculturable bacterial forms from paleosoils and subsoil permafrost // Microbiology (Moscow). 2012. V. 81. P. 435–445.
Лойко Н.Г., Козлова А.Н., Николаев Ю.А., Гапонов А.М., Тутельян А.В., Эль-Регистан Г.И. Влияние стресса на образование антибиотикотолерантных клеток Escherichia coli // Микробиология. 2015. Т. 84. С. 512‒528.
Loiko N.G., Kozlova A.N., Nikolaev Y.A., Gaponov A.M., Tutel’yan A.V., El’-Registan G.I. Effect of stress on emergence of antibiotic-tolerant Escherichia coli cells // Microbiology (Moscow). 2015. V. 84. P. 595‒609.
Сузина Н.Е., Мулюкин А.Л., Лойко Н.Г., Козлова А.Н., Дмитриев В.В., Шорохова А.П., Горленко В.М., Дуда В.И., Эль-Регистан Г.И. Тонкая структура мумифицированных клеток микроорганизмов, образующихся под влиянием химического аналога аутоиндуктора анабиоза // Микробиология. 2001. Т. 70. С. 776–787.
Suzina N.E., Mulyukin A.L., Loiko N.G., Kozlova A.N., Dmitriev V.V., Shorohova A.P., Gorlenko V.M., Duda V.I., El’-Registan G.I. Fine structure of mummified cells of microorganisms formed under the influence of a chemical analogue of the anabiosis autoinducer // Microbiology (Moscow). 2001. V. 70. P. 667–677.
Ткаченко А.Г. Молекулярные механизмы стрессорных ответов у микроорганизмов: научное издание / Oтв. ред. Демаков В.А. Екатеринбург: РАН, УрО, Ин-т экологии и генетики микроорганизмов, 2012. 237 с.
Эль-Регистан Г.И., Мулюкин А.Л., Николаев Ю.А., Сузина Н.Е., Гальченко В.Ф., Дуда В.И. Адаптогенные функции внеклеточных ауторегуляторов микроорганизмов // Микробиология. 2006. Т. 75. С. 446‒456.
El-Registan G.I., Mulyukin A.L., Nikolaev Yu.A., Suzina N.E., Gal’chenko V.F., Duda V.I. Adaptogenic functions of extracellular autoregulators of microorganisms // Microbiology (Moscow). 2006. V. 75. P. 380‒389.
Agrawal A., Rangarajan N., Weisshaar J.C. Resistance of early stationary phase E. coli to membrane permeabilization by the antimicrobial peptide Cecropin A // Biochim. Biophys. Acta. ‒ Biomembr. 2019. V. 1861. P. 182990. https://doi.org/10.1016/j.bbamem.2019.05.012
Almirón M., Link A.J., Furlong D., Kolter R. A novel DNA-binding protein with regulatory and protective roles in starved Escherichia coli // Genes Dev. 1992. V. 6 (12B). P. 2646‒2654. https://doi.org/10.1101/gad.6.12b.2646
Bacterial Persistence. Methods and Protocols / Eds. Michiels J., Fauvart M. Humana New York, NY, 2016. 244 p. (Methods in Molecular Biology. V. 1333). https://doi.org/10.1007/978-1-4939-2854-5
Balaban N., Gerdes K., Lewis K., McKinney J.D. A problem of persistence: still more questions than answers? // Nat. Rev. Microbiol. 2013. V. 11. P. 587‒591.
Balaban N., Merrin I., Chait R.,Kowalik L., Leibler S. Bacterial persistence as a phenotypic switch // Science. 2004. V. 305. P. 1622‒1625.
Cañas-Duarte S.J., Perez-Lopez M.I., Herrfurth C., Sun L., Contreras L.M., Feussner I., Leidy C., Riaño-Pachón D.M., Restrepo S., Pedraza J.M. An integrative approach points to membrane composition as a key factor in E. coli persistence // BioRxiv. 2020. 08.28.271171. https://doi.org/10.1101/2020.08.28.271171
Diskowski M., Mikusevic V., Stock C., Hänelt I. Functional diversity of the superfamily of K+ transporters to meet various requirements // Biol. Chem. 2015. V. 396. P. 1003‒1014. https://doi.org/10.1515/hsz-2015-0123
Eagle H. A paradoxical zone phenomenon in the bactericidal action of penicillin in vitro // Science. 1948. V. 107. P. 44–45.
Eagle H., Musselman A.D. The rate of bactericidal action of penicillin in vitro as a function of its concentration, and its paradoxically reduced activity at high concentrations against certain organisms // J. Exper. Med. 1948. V. 88. P. 99–131.
Frenkiel-Krispin D., Ben-Avraham I., Englander J., Shimoni E., Wolf S.G., Minsky A. Nucleoid restructuring in stationary-state bacteria // Mol. Microbiol. 2004. V. 51. P. 395–405.
Frenkiel-Krispin D., Minsky A. Nucleoid organization and the maintenance of DNA integrity in E. coli, B. subtilis and D. radiodurans // J. Struct. Biol. 2006. V. 156. P. 311–319.
Gonçalves F.D., de Carvalho C.C. Phenotypic modifications in Staphylococcus aureus cells exposed to high concentrations of vancomycin and teicoplanin // Front. Microbiol. 2016. V. 7. Art. 13. https://doi.org/10.3389/fmicb.2016.00013
Goode O., Smith A., Zarkan A., Cama J., Invergo B.M., Belgami D., Caño-Muñiz S., Metz J., O’Neill P., Jeffries A., Norville I.H., David J., Summers D., Pagliara S. Persister Escherichia coli cells have a lower intracellular pH than susceptible cells but maintain their pH in response to antibiotic treatment // mBio. 2021. V. 12. e0090921. https://doi.org/10.1128/mBio.00909-21
Gottesman S. Trouble is coming: Signaling pathways that regulate general stress responses in bacteria // J. Biol. Chem. 2019. V. 294. P. 11685‒11700.
Grant S.S., Hung D.T. Persistent bacterial infections, antibiotic tolerance, and oxidative stress response // Virulence. 2013. V. 4. P. 273‒283.
Hofer U. Stress and disarray leading to persistence // Nat. Rev. Microbiol. 2022. V. 20. P. 63. https://doi.org/10.1038/s41579-021-00669-7
Janissen R., Arens M., Vtyurina N.N., Rivai Z., Sunday N.D., Eslami-Mossallam B., Gritsenko A.A., Laan L., de Ridder D., Artsimovitch I., Dekker N.H., Abbondanzieri E.A., Meyer A.S. Global DNA compaction in stationary-phase bacteria does not affect transcription // Cell. 2018. V. 174. P. 1188–1199. e14. https://doi.org/10.1016/j.cell.2018.06.049
Jia Y., Yu C., Fan J., Fu Y., Ye Z., Guo X., Xu Y., Shen C. Alterations in the cell wall of Rhodococcus biphenylivorans under norfloxacin stress // Front. Microbiol. 2020. V. 11. P. 554957. https://doi.org/10.3389/fmicb.2020.554957
Karas V.O., Westerlaken I., Meyer A.S. The DNA-Binding protein from starved cells (Dps) utilizes dual functions to defend cells against multiple stresses // J. Bacteriol. 2015. V. 197. P. 3206‒3215. https://doi.org/10.1128/JB.00475-15
Lewis K. Persister cells // Annu. Rev. Microbiol. 2010. V. 64. P. 357‒372.
Maisonneuve E., Gerdes K. Molecular mechanisms underlying bacterial persisters cell // Cell. 2014. V. 157. P. 539‒548. https://doi.org/10.1016/j.cell.2014.02.050
Mohiuddin S.G., Ghosh S., Ngo H.G., Sensenbach S., Karki P., Dewangan N.K., Angardi V., Orman M.A. Cellular self-digestion and persistence in bacteria // Microorganisms. 2021. V. 31. P. 2269. https://doi.org/10.3390/microorganisms9112269
Orman M.A., Brynildsen M.P. Inhibition of stationary phase respiration impairs persister formation in E. coli // Nat. Commun. 2015. V. 6. P. 1–13. https://doi.org/10.1038/ncomms8983
Padan E., Bibi E., Ito M., Krulwich T.A. Alkaline pH homeostasis in bacteria: new insights // Biochim. Biophys. Acta. 2005. V. 1717. P. 67‒88. https://doi.org/10.1016/j.bbamem.2005.09.010
Peyrusson F., Nguyen T.K., Najdovski T., Van Bambeke F. Host cell oxidative stress induces dormant Staphylococcus aureus persisters // Microbiol. Spectr. 2022. V. 10. Art. e0231321. https://doi.org/10.1128/spectrum.02313-21
Pletnev P., Osterman I., Sergiev P., Bogdanov A., Dontsova O. Survival guide: Escherichia coli in the stationary phase // Acta Naturae. 2015. V. 7. № 4. P. 22‒33.
Podlesek Z., Butala M., Šakanović A., Žgur-Bertok D. Antibiotic induced bacterial lysis provides a reservoir of persisters // Antonie van Leeuwenhoek. 2016. V. 109. P. 523‒528. https://doi.org/10.1007/s10482-016-0657-x
Prasetyoputri A., Jarrad A.M., Cooper M.A., Blaskovich M.A.T. The Eagle effect and antibiotic-induced persistence: two sides of the same coin? // Trends Microbiol. 2019. V. 27. P. 339‒354. https://doi.org/10.1016/j.tim.2018.10.007
Rittershaus E.S., Baek S.H., Sassetti C.M. The normalcy of dormancy: common themes in microbial quiescence // Cell Host Microbe. 2013. V. 13. P. 643–651. https://doi.org/10.1016/j.chom.2013.05.012
Saito H., Kobayashi H. Bacterial responses to alkaline stress // Sci. Prog. 2003. V. 86. P. 271‒282. https://doi.org/10.3184/003685003783238635
Van den Bergh B., Fauvart M., Michiels J. Formation, physiology, ecology, evolution and clinical importance of bacterial persisters // FEMS Microbiol. Rev. 2017. V. 41. P. 219‒251. https://doi.org/10.1093/femsre/fux001
Van den Bergh B., Schramke H., Michiels J.E., Kimkes T.E.P., Radzikowski J.L., Schimpf J., Vedelaar S.R., Burschel S., Dewachter L., Lončar N., Schmidt A., Meijer T., Fauvart M., Friedrich T., Michiels J., Heinemann M. Mutations in respiratory complex I promote antibiotic persistence through alterations in intracellular acidity and protein synthesis // Nat. Commun. 2022. V. 13. P. 546. https://doi.org/10.1038/s41467-022-28141-x
Wainwright J., Hobbs G. Nakouti I. Persister cells: formation, resuscitation and combative therapies // Arch. Microbiol. 2021. V. 203. P. 5899–5906.
Wang X.T., Xiao S.D., Ma B.G. Molecular responses to heat stress in Escherichia coli // Stress: Genetics, Epigenetics and Genomics. Handbook of Stress Series / Ed. Fink G. Elsevier, 2020. V. 4. P. 289‒296.
Дополнительные материалы
- скачать ESM.docx
- Приложение 1. Таблица S1. – Таблица S9.