Микробиология, 2022, T. 91, № 6, стр. 695-707
Анализ устойчивости к осмотическому стрессу биопленок почвенных бактерий Azospirillum brasilense
Д. И. Мокеев a, И. В. Волохина a, Е. М. Телешева a, С. С. Евстигнеева a, В. С. Гринев a, Т. Е. Пылаев a, b, Л. П. Петрова a, *, А. В. Шелудько a, **
a Институт биохимии и физиологии растений и микроорганизмов – обособленное структурное подразделение Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Саратовский научный центр Российской академии наук”
410049 Саратов, Россия
b Саратовский государственный медицинский университет им. В.И. Разумовского
Министерства здравоохранения Российской Федерации
410012 Саратов, Россия
* E-mail: petrova_lp@mail.ru
** E-mail: shel71@yandex.ru
Поступила в редакцию 28.03.2022
После доработки 18.05.2022
Принята к публикации 06.06.2022
- EDN: IBSJKP
- DOI: 10.31857/S0026365622800230
Аннотация
Для создания условий осмотического стресса при культивировании типового штамма Azospirillum brasilense Sp7 и его спонтанных вариантов Sp7.4 и Sp7.8 использовали полиэтиленгликоль (ПЭГ 6000), обеспечивающий стабильное снижение уровня водного потенциала, что позволяет моделировать влияние условий засухи на бактериальную популяцию. ПЭГ блокировал подвижность азоспирилл, но не оказывал подобного влияния на способность Sp7 и Sp7.8 формировать биопленки, а также на метаболическую активность биомассы пленок, сформированных без стресса. Осмотический стресс, вызванный ПЭГ 6000, стимулировал формирование биопленок у Sp7.8. Биопленки варианта Sp7.4 оказались наиболее восприимчивыми к негативному влиянию водного стресса, однако в планктонной культуре показатели роста этого варианта в данных условия превышали значения, характерные для Sp7 и Sp7.8. В биопленках штаммы Sp7, Sp7.4 и Sp7.8 продуцировали полисахариды и фитогормон ИУК, формировали клеточные формы, устойчивые к высушиванию. Варианты Sp7.4 и Sp7.8, как и Sp7, колонизировали корни, формировали на них биопленки и оказывали влияние на морфологию корневой системы проростков пшеницы. Результаты исследований показали, что спонтанные варианты штамма Sp7 интересны для дальнейших исследований, направленных на отбор перспективных штаммов азоспирилл, повышающих устойчивость растений к засухе.
Обитающие в ризосфере альфапротеобактерии Azospirillum brasilense оказывают существенное положительное влияние на рост растений и их устойчивость к абиотическим и биотическим стрессам: благодаря своей способности к фиксации азота и синтезу фитогормонов, контролю фитопатогенов, они улучшают минеральное питание растений, повышают их устойчивость к тяжелым металлам и нейтрализуют токсические вещества (Fibach-Paldi et al., 2012; Vurukonda et al., 2016; Fukami et al., 2018). Засуха/водный стресс, наряду с засолением почв и изменением климата, относится к числу основных абиотических стрессов, с которыми сталкиваются растения и ассоциированные с ними бактерии (Vurukonda et al., 2016; Ansari et al., 2021). В условиях стресса увеличивается потребление растениями ростовых факторов, возникает дефицит ресурсов, приводящий к замедлению роста и развития растений (Hsiao, 1973). Подобно растениям, ризосферные бактерии из-за засухи также подвергаются стрессу, который влияет на их жизнеспособность, физиологические и биохимические функции (Ansari et al., 2021).
Создание условий осмотического стресса при культивировании микроорганизмов и растений в присутствии различных осмотических агентов, обеспечивающих стабильное снижение водного потенциала среды и блокирование поглощения воды, позволяет моделировать влияние засухи на бактериальную популяцию и растения (Chutia, Borah, 2012; Ansari et al., 2021). Такой подход необходим для изучения механизмов и способов защиты микроорганизмов от данного вида стресса с целью отбора засухоустойчивых ризосферных бактерий, способствующих повышению устойчивости растений к условиям дефицита воды.
Определенное значение для успешного формирования и функционирования растительно-микробной ассоциации и противостояния микробов и растений различным абиотическим стрессам является способность бактерий формировать биопленки на корнях растения-хозяина (Шелудько и соавт., 2010, 2020; Fibach-Paldi et al., 2012; Bogino et al., 2013; Ansari et al., 2021). В биопленках бактерии заключены в матрикс, являющийся резервуаром воды, ферментов и питательных веществ и играющий структурную и защитную роли (Flemming, Wingender, 2010). Матрикс биопленок медленно высыхает, чем предохраняет микроорганизмы от изменений водного потенциала. Исследованы состав, структура и функции основных биополимеров матрикса биопленок азоспирилл, обеспечивающих фиксацию зрелых биопленок на твердой поверхности и выполняющих каркасную функцию, способствующих созданию в биопленках условий для фиксации азота (Wang et al., 2017; Шелудько и соавт., 2018, 2020). Охарактеризован морфологический и функциональный полиморфизм клеточных форм в биопленках азоспирилл (Wang et al., 2017; Шелудько и соавт., 2020). Наличие покоящихся форм в биопленочной популяции повышает устойчивость к таким негативным воздействиям, как высушивание и окислительный стресс (Шелудько и соавт., 2020).
Можно ожидать, что ризобактерии, формирующие устойчивые к засухе биопленки, найдут применение в борьбе со стрессом растений, обусловленным засухой (Ansari, Ahmad, 2019; Ansari et al., 2021). Однако информация о роли таких бактерий в ослаблении стресса от засухи у растений фрагментарна. Таким образом, основная цель настоящего исследования заключалась в оценке устойчивости к водному стрессу и высушиванию биопленок типового штамма A. brasilense Sp7 и его спонтанных вариантов с изменениями в структуре генома. В задачи исследования входили характеристика и анализ устойчивости биопленок к высушиванию, исследование влияния водного стресса на их формирование и физиологическую активность. В работе использованы описанные ранее спонтанные варианты штамма Sp7 с изменениями в структуре генома, затрагивающими плазмидные перестройки (Петрова и соавт., 2010; Кацы, Петрова, 2015). Поскольку фенотипические вариации влияют на широкий спектр свойств азоспирилл (Lerner et al., 2010; Петрова и соавт., 2010; Volfson et al., 2013; Кацы, Петрова, 2015), можно предположить, что устойчивость этих производных к водному стрессу/засухе может отличаться от устойчивости исходного штамма A. brasilense Sp7.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Штаммы бактерий и питательные среды. В работе использовали: штамм A. brasilense Sp7, выделенный в Бразилии из ризосферы росички лежачей (IBPPM 150; Tarrand et al., 1978), его производные Sp7.4 (IBPPM 573) и Sp7.8 (IBPPM 576) (Петрова и соавт., 2010; Кацы, Петрова, 2015). В скобках приведены регистрационные номера штаммов в Коллекции ризосферных микроорганизмов ИБФРМ РАН (Саратов, Россия; http://collection.ibppm.ru/). Бактерии культивировали при 30°C на малатно-солевой среде (МСС) (Döbereiner, Day, 1976) с 1 г/л NH4Cl. При необходимости из МСС исключали NH4Cl, добавляли агар (до концентрации 0.3, 0.4, 0.5 и 20%) или до 5 мМ L‑триптофана. Для создания условий осмотического/водного стресса в среды добавляли непроникающий осмотический агент полиэтиленгликоль (ПЭГ) со средней молекулярной массой 6000 (Chutia, Borah, 2012). ПЭГ 6000 вносили до концентрации 5, 10, 15, 20 и 25%, что соответствует ‒0.05 Мпа, –0.15 Мпа, –0.30 Мпа, –0.49 Мпа или –0.73 Мпа (Ansari et al., 2021).
Определение подвижности бактерий и скорости роста планктонных культур в условиях перемешивания. Ночные (18 ч) культуры бактерий разводили до значений А590 = 0.05–0.10 (l = 0.5 см) в стерильной среде МСС и инкубировали при 140 об./мин и температуре 30°С на шейкер-инкубаторе Excella E24 (“New Brunswick Scientific”, США). Каждые 2 ч измеряли оптическую плотность бактериальной культуры при А590 (l = 0.5 см).
Для изучения бактериальной подвижности из 24 ч планктонных культур готовили препарат “висячая” капля. Во время просмотра препаратов на микроскопе Leica DM6000 B (“Leica-Microsystems”, Германия) вели видеозапись. Оценивали подвижность всех клеток в поле зрения микроскопа. Анализ видеоизображения выполняли с помощью компьютерной программы, разработанной в ИБФРМ РАН. Для изучения перемещения бактерий в полужидких средах их инокулировали уколом бактериальной петли в пластины МСС с 0.4% агара. Через 48–72 ч измеряли диаметр макроколоний, сформированных подвижными клетками.
Анализ формирования биопленок и респираторной активности их биомассы. Суточные (24-часовые) культуры азоспирилл из жидкой МСС с NH4Cl, выросшие в условиях аэрации, отмывали 50 мМ фосфатным буфером (ФБ) (pH 7.0), разводили свежей средой МСС с NH4Cl или без него до значений А590 = = 0.05–0.10 (l = 0.5 см). Среды с инокулятом вносили в стеклянные пробирки (по 2 мл) или ячейки полистирольных планшетов с 96 плоскодонными лунками (по 0.2 мл) и инкубировали при 30°С в стационарных условиях. В качестве контроля в пробирки или ячейки планшетов вносили стерильные среды. Для оценки относительного количества биомассы в зрелых биопленках проводили их окрашивание кристаллическим фиолетовым (O’Toole, Kolter, 1998). К осторожно промытым дистиллированной водой биопленкам добавляли соответствующий объем (2 или 0.2 мл) 1% водного раствора кристаллического фиолетового, инкубировали при комнатной температуре 10 мин и, после удаления раствора, опять промывали водой. Связавшийся с биомассой биопленок краситель растворяли в 2 или 0.2 мл этанола и измеряли оптическую плотность полученного раствора при длине волны 590 нм на фотоколориметре КФК-2 (“Загорский оптико-механический завод”, Россия) или фотометре микропланшетного формата Multiskan Ascent (“ThermoLabsystems”, Финляндия). Уровень относительной респираторной активности клеток в биопленках определяли флуориметрическим резазурин-тестом, с модификациями. Из лунок планшета с биопленками отбирали планктонную культуру и вносили по 0.2 мл раствора AlamarBlue (“Sigma”, США) в ФБ (pH 7.0) (0.01 г/л). Планшеты инкубировали 24 ч при температуре 30°С. Интенсивность флуоресценции регистрировали на спектрофлуориметре Cary Eclipse (“Agilent”, США) при следующих параметрах: длина волны возбуждения 530 нм, длина волны эмиссии – 600 нм, ширина щели – 10 нм. Аналогичные манипуляции проводили с контрольными пробами.
Фазово-контрастную и просвечивающую электронную микроскопию биопленок, суспензий смытых биопленок и свободных клеток из планктонных культур выполняли на приборах, находящихся в ЦКП “Симбиоз” ИБФРМ РАН (г. Саратов, Россия): Leica DM6000 B (“Leica-Microsystems”, Германия) и Libra 120 (“Carl Zeiss”, Германия).
Оценка содержания углеводсодержащих компонентов в матриксе биопленок. Выделение компонентов матрикса проводили согласно рекомендациям, описанным в работе (Wang et al., 2017). Биомассу зрелых биопленок, сформированных на поверхности стекла, после удаления планктонных бактерий промывали 50 мМ ФБ (pH 7.0) и смывали пипетированием этим буфером, осаждали. Осадок дважды промывали ФБ (pH 7.0). Из отмытой биомассы экстрагировали компоненты матрикса 0.5 М ЭДТА кипячением в течение 10 мин при 100°C. Содержание в экстрактах углеводсодержащих компонентов определяли фенол-серным методом (Wang et al., 2017).
Определение содержания индолил-3-уксусной кислоты (ИУК). Биопленки выращивали под МСС с 5 мМ L-триптофана в течение 7 сут, перед окрашиванием пленок отбирали культуральную жидкость, центрифугировали, в надосадочной жидкости определяли содержание ИУК. Анализ проводили методом обращенно-фазовой ВЭЖХ на хроматографе Dionex Ultimate 3000 (“Thermo Scientific”, США) c использованием колонки Macherey-Nagel Nucleodur HTec С18, средний диаметр частиц 5 мкм с порами 100 Å, геометрия 150 × 3.0 мм ВЭЖХ.
Экстракт хроматографировали в условиях градиентного элюирования (растворитель А – ацетонитрил квалификации HPLC grade (“Panreac”, Испания), растворитель В – раствор фосфорной кислоты (рН 2.5) в воде MilliQ), растворитель С – вода MilliQ: состав подвижной фазы изменялся следующим образом: 0–1 мин – 40% А, 30% В, 30% С; 1–4 мин – 70% А, 15% В, 15% С; 4–7 мин – 70% А, 15% В, 15% С; 7–8 мин – 40% А, 30% В, 30% С; 8–12 мин – 40% А, 30% В, 30% С. Время анализа составило 12 мин. Скорость протока 0.25 мл/мин. Объем вводимого образца 5 мкл. Детектирование осуществлялось при длине волны 280 нм. Управление хроматографом и анализ данных выполнялся программой Chromeleon версии 7.1.2.1478 (“Thermo Scientific”, “Dionex”, США). Идентификацию ИУК проводили сравнением времени удерживания и спектров поглощения с таковыми для стандартного образца. Количественное содержание в растворе устанавливали по калибровочной кривой с коэффициентом корреляции R2 = 0.9997 линейной аппроксимации точек в диапазоне концентраций 0.78‒50.00 мкг/мл.
Определение численности колониеобразующих единиц (КОЕ) в биопленках. Зрелые биопленки осторожно промывали 50 мМ ФБ (pH 7.0). Определяли количество колониеобразующих единиц (КОЕ) в промытых нативных (не подвергавшимся каким-либо воздействиям) и сухих биопленках. В последнем случае промытые биопленки сушили при 30°С и хранили при 37°С (Шелудько и соавт., 2020). Для определения КОЕ в пробирки с биопленками вносили по 2 мл 50 мМ ФБ (pH 7.0), инкубировали 1 ч и смывали биомассу. Биомассу ресуспендировали в 50 мМ ФБ (pH 7.0) и 1 мин диспергировали на встряхивателе Vortex. Полученные суспензии контролировали при помощи световой микроскопии на присутствие в них клеточных агрегатов. Из полученной суспензии готовили серию десятикратных разведений и высевали из них по 100 мкл на плотную МСС. Результаты с учетом разведения пересчитывали на 2 мл, что соответствует смыву 1 биопленки. В качестве контроля использовали пробирки, в которых 7 сут инкубировали стерильную питательную среду. Результаты повторного проверочного окрашивания поверхности стекла опытных пробирок после смывания из них биопленок не отличались от контрольных значений и не превышали 0.04 ед. А590 (l = 0.5 см), что свидетельствовало о полноте смывания биомассы биопленок.
Анализ способности бактерий к колонизации корней проростков пшеницы. Семена мягкой яровой пшеницы сорта Саратовская 29, полученные из ФГБНУ ФАНЦ Юго-Востока (Саратов, Россия), стерилизовали, проращивали в течение 3 сут и инокулировали, выдерживая проростки с покачиванием (25 об./мин) в суспензии бактерий (ОП590 = 0.5 (l = 0.5 см)) в 50 мМ ФБ (pH 7.0), как описано ранее (Шелудько и соавт., 2010). Инокулированные проростки пшеницы однократно промывали стерильным 50 мМ ФБ (pH 7.0) и помещали над слоем жидкости в пробирки, содержащие 10 мл стерильной среды для растений следующего состава (г/л): KH2PO4 – 4; CaCl2 – 1.25; H3BO3 – 0.0016; CuSO4 · 5H2O – 0.00025; MgSO4 – 0.09; Na2MoO4 · 2H2O – 0.0025; KJ – 0.008; ZnSO4 – 0.015; FeSO4 · 7H2O – 0.028; этилендиаминтетрауксусной кислоты динатриевая соль – 0.037 (рН 6.0). В жидкой среде инокулированные растения выращивали еще 7 дней при 22°С и освещении с фотопериодом 16/8 ч. Распределение бактерий и образование биопленок на поверхности корней исследовали с использованием микроскопа Leica DM6000 B (“Leica Microsystems”, Германия) или конфокального микроскопа (для микроскопии корни помещали в 50% глицерин на 50 мМ ФБ; pH 7.0).
Из навесок стерильно отмытых корней проростков готовили гомогенат, в котором определяли количество КОЕ посредством высевов серийных десятикратных разведений на плотную МСС. Нулевое и первое разведение центрифугировали, удаляли надосадочную жидкость, сушили при 30°С и хранили при 37°С. В этих образцах выявляли устойчивые к высушиванию клетки, как описано выше. Количество бактерий, высеваемых с корней, пересчитывали на одно растение. Контролировали наличие посторонней микрофлоры в гомогенатах корней. Образцы, в высевах с которых встречались колонии с нехарактерной для азоспирилл морфологией, отбрасывали.
Определение морфометрических и морфофизиологических параметров пшеницы. Для каждого растения определяли длину корневой системы (в мм), процент разветвленных корней (корни с боковыми отростками) в корневой системе и деформацию корневых волосков (при микроскопии определяли процент искривленных от общего числа волосков на 50–90 участках корня). Для определения сырой и сухой массы (в мг) корневую систему отделяли от надземной части, взвешивали и высушивали при 70°С до постоянного веса.
Статистическая обработка результатов. Во всех случаях количественных измерений проводили не менее трех независимых экспериментов как минимум в двух повторностях. Оценку биомассы биопленок каждого штамма выполняли не менее шести раз. Каждый раз окрашивали биопленки, сформированные в пяти стеклянных пробирках. Результаты обрабатывали с использованием пакета Microsoft Office Excel 2010; доверительные интервалы определяли для 95% уровня значимости. Для выявления статистически значимых различий между средними значениями использовали однофакторный дисперсионный анализ (ANOVA) при уровне значимости 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование процесса формирования биопленок. Сравнение роста штаммов A. brasilense Sp7, Sp7.4 и Sp7.8 в жидких средах показало, что при интенсивном перемешивании их планктонные культуры после 24 ч инкубации находятся в стационарной фазе роста. Клетки из этих культур несут полярный жгутик, при помощи которого в среднем 85.5 ± 2.2% бактерий плавают со скоростью 28–30 мкм/с (табл. 1). В случае штамма Sp7.4 длина планктонных клеток больше, чем у Sp7 и Sp7.8 (рис. 1).
Таблица 1.
Влияние ПЭГ 6000 на клетки из планктонных культур A. brasilense и роение бактерий на полужидких средах
| Штамм | 24 ч культивирования в жидкой МСМ при перемешивании | (в) * диаметр макроколоний, сформированных бактериями за 72 ч инкубации в МСМ с агаром |
|||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (а) отношение A590 культуры с ПЭГ к A590 культуры без ПЭГ, в % |
(б) скорость движения клеток, мкм/с |
||||||||||||||
| 0.3% | 0.4% | 0.5% | |||||||||||||
| ПЭГ 6000, % | ПЭГ 6000, % | ||||||||||||||
| 0 | 5 | 10 | 15 | 20 | 25 | 0 | 5 | 10 | 0 | 5 | 0 | 5 | 0 | 5 | |
| Sp7 | 100.0 ±
± 0.5 г |
64.6 ±
± 13.0 в |
40.2 ±
± 6.6 б |
30.5 ±
± 2.2 б |
12.5 ±
± 1.6 а |
12.4 ±
± 1.8 а |
30.1 ±
± 1.5 б |
23.0 ±
± 0.9 а |
Н.п. | 31.9 ±
± 1.8 б |
3.8 ±
± 0.5 а |
22.9 ±
± 2.2 б |
12.7 ±
± 1.7 а |
13.9 ±
± 1.4 б |
11.0 ±
± 0.8 а |
| Sp7.4 | 100.0 ±
± 4.2 в |
92.0 ±
± 4.2 в |
88.0 ±
± 4.9 в, б |
78.2 ±
± 7.6 б |
43.7 ±
± 3.4 а |
43.5 ±
± 2.4 а |
28.3 ±
± 1.6 б |
23.1 ±
± 1.2 а |
Н.п. | 35.8 ±
± 1.9 б |
3.9 ±
± 0.3 а |
26.5 ±
± 2.4 б |
10.4 ±
± 0.9 а |
18.7 ±
± 2.8 б |
10.2 ±
± 1.4 а |
| Sp7.8 | 100.0 ±
± 5.4 в |
67.1 ±
± 7.5 б |
58.5 ±
± 2.7 б |
52.5 ±
± 3.1 б |
20.6 ±
± 3.6 а |
19.5 ±
± 0.5 а |
29.3 ±
± 1.3 б |
22.4 ±
± 1.1 а |
Н.п. | 37.1 ±
± 1.5 б |
3.8 ±
± 0.2 а |
27.0 ±
± 2.2 б |
11.4 ±
± 1.0 а |
18.4 ±
± 1.6 б |
10.5 ±
± 1.0 а |
Примечание. * Диаметр зоны инокуляции составлял 3.8 ± 0.2 мм. Н.п. – не перемещаются. Результаты однофакторного дисперсионного (ANOVA) анализа представлены строчными буквами; разными буквами обозначены статистически значимые различия между средними. В колонках (а‒в) сравнения проводили в строках; а или а – средние значения с наименьшей величиной.
Рис. 1.
Изменение длины (а) и ширины (б) клеток в биопленках, формируемых штаммами A. brasilense Sp7 (1), Sp7.4 (2) и Sp7.8 (3), на стекле под жидкой МСС с NH4Cl (1) или без связанного азота (2) в течение 7 сут. 0 сут культивирование – размер планктонных клеток, использованных для инокуляции.
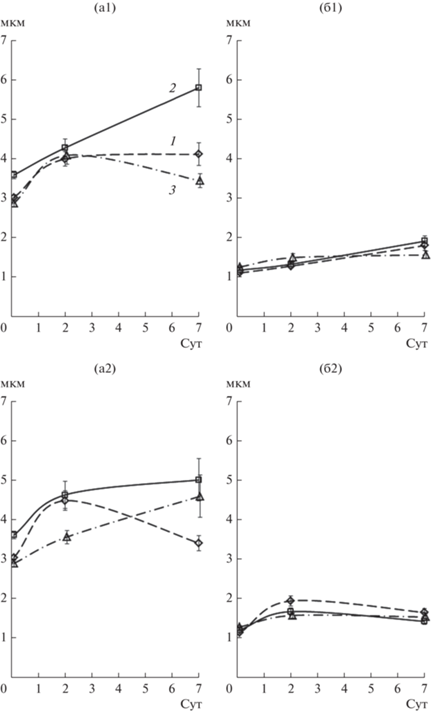
Охарактеризованные выше 24 ч планктонные культуры инокулировали в среду МСС с NH4Cl или без него и инкубировали статично в стеклянных пробирках. При переходе планктонных клеток всех исследованных штаммов (рис. 1; 0 сут культивирования) к биопленочному существованию происходило увеличение длины клеток уже на этапе адсорбции/адгезии бактерий. В 7-дневных пленках длина клеток у штаммов Sp7 и Sp7.8 изменялась в зависимости от присутствия азота в среде (у Sp7.8 уменьшалась под средой с NH4Cl и незначительно снижалась у Sp7 в условиях без азота). В случае Sp7.4 длина клеток увеличивалась на каждом этапе формирования биопленки под средой с NH4Cl (рис. 1). На 7 сут культивирования все три штамма завершали процесс формирования биопленок на разделе жидкость‒твердая поверхность (стабилизируется количество биомассы, образующей пленку). Сравнение биомассы в зрелых пленках показывало, что ее количество зависело от наличия NH4Cl в среде у штаммов Sp7 и Sp7.8, но не уступало показателям Sp7.4 (табл. 2, столбцы а). Биопленки Sp7, Sp7.4 и Sp7.8 содержали примерно одинаковое количество бактерий, способных формировать КОЕ на плотных агаризованных средах. В смывах из пробирок с биопленками число КОЕ незначительно варьировало в пределах порядка 1010 (КОЕ в биопленке, сформированной в 1 пробирке), независимо от количества биомассы биопленок и/или наличия источника связанного азота в среде (табл. 2, столбцы а, б).
Таблица 2.
Влияние NH4Cl в среде МСС на относительное количество биомассы биопленок A. brasilense (а, д) и ее характеристика (б‒г, е)
| Штамм | Сформированные за 7 сут культивирования под жидкой МСС на стекле биопленки | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (а) A590 кристаллического фиолетового, десорбированного после окрашивания биопленок |
(б) * количество КОЕ × 1010 в нативной биопленке |
(в) ** количество КОЕ в сухой биопленке |
(г) содержание гликополимеров в матриксе, мкг/биопленка |
МСС + L-триптофан, 5 мМ | ||||||||
| (д) A590 кристаллического фиолетового, десорбированного после окрашивания биопленок |
(е) продукция ИУК, мкг/мл |
|||||||||||
| +NH4Cl | –NH4Cl | + NH4Cl | –NH4Cl | +NH4Cl | –NH4Cl | +NH4Cl | –NH4Cl | +NH4Cl | –NH4Cl | +NH4Cl | –NH4Cl | |
| Sp7 | 0.79 ± 0.09 а |
1.00 ± 0.08 б |
1.3 ± 0.2 | 3.2 ± 0.5 | (2.5 ± 0.5) × × 101 | (4.4 ± 0.7) × × 104 | 72.4 ± 9.6 Б |
44.8 ± 4.7 Б |
0.57 ± 0.13 А |
0.58 ± 0.07 А |
23.8 ± 5.2 А |
16.0 ± 0.7 А |
| Sp7.4 | 0.75 ± 0.10 а |
0.81 ± 0.10 а |
1.0 ± 0.2 | 1.3 ± 0.4 | (2.3 ± 0.7) × × 101 | (2.3 ± 0.6) × × 101 | 27.6 ± 3.0 А |
36.3 ± 3.5 А |
0.67 ± 0.14 А, Б |
0.72 ± 0.16 Б |
20.0 ± 2.4 А |
24.4 ± 2.8 Б |
| Sp7.8 | 1.05 ± 0.09 б |
0.80 ± 0.12 а |
2.4 ± 0.4 | 1.3 ± 0.3 | (1.8 ± 0.3) × × 104 | (2.5 ± 0.9) × × 103 | 66.8 ± 11.4 Б |
43.3 ± 4.0 Б |
0.86 ± 0.08 Б |
0.55 ± 0.12 А |
20.1 ± 4.5 А |
16.4 ± 0.6 А |
Примечание. * Биомассу биопленки смывали 2 мл 50 мМ ФБ (pH 7.0), в полученной суспензии определяли КОЕ. ** 7-ми дневные биопленки высушили и хранили 10 сут при 37°C, биомассу смывали 2 мл 50 мМ ФБ (pH 7.0), в полученной суспензии определяли КОЕ. Результаты однофакторного дисперсионного (ANOVA) анализа представлены заглавными или строчными буквами; разными буквами обозначены статистически значимые различия между средними. В колонке (а) сравнения проводили в строке, в колонках (в‒е) сравнения проводили в столбце; а, А или А – средние значения с наименьшей величиной.
Также в биопленках оценили численность клеточных форм, устойчивых к высушиванию. Биопленки, выращенные на МСС с NH4Cl и без него (содержали 1010 КОЕ; табл. 2, столбец б), были высушены при 30°C и заложены на хранение при 37°C. Через 10 сут хранения КОЕ были обнаружены в биопленках всех трех штаммов. Максимальная численность 104 КОЕ/биопленка сохранялась в пленках Sp7, выращенных в среде без источника связанного азота. В аналогичных условиях биопленки Sp7.8 содержали 103 КОЕ, а на среде с NH4Cl этот показатель возрастал у этого штамма до 104 (табл. 2, столбец в). В среде с NH4Cl у Sp7 количество КОЕ снижается более чем на порядок (табл. 2, столбец в). В случае штамма Sp7.4 биопленки содержали минимальное число КОЕ (101), независимо от содержания азота в среде. Необходимо отметить, что бактериальные формы, устойчивые к высушиванию, являются частью системы механизмов, способствующих выживанию микробной популяции в условиях засухи/водного стресса (Berg et al., 1980; Sadasivan et al., 1987; Malinich, Bauer, 2018; Шелудько и соавт., 2020).
Анализ влияния осмотического стресса на формирование бактериями биопленок. Для создания модели осмотического/водного стресса использовали непроникающий осмотический агент полиэтиленгликоль (ПЭГ) со средним молекулярным весом 6000. Присутствие ПЭГ приводит к снижению водного потенциала среды и блокированию поглощения воды бактериями или корнями растений (Chutia, Borah, 2012; Ansari et al., 2021). Такой подход позволяет обеспечить стабильное снижение уровня водного потенциала в течение любых желаемых периодов времени и моделировать влияние условий засухи на бактериальную популяцию и растения (Chutia, Borah, 2012; Ansari et al., 2021).
На начальном этапе оценивали влияние различных концентраций ПЭГ 6000 на рост планктонных культур Sp7, Sp7.4 и Sp7.8 в жидкой МСС среде при перемешивании. За ростом наблюдали в течение 24 ч. Снижение показателей роста планктонных культур (A590 бактериальной культуры) на 50% и более происходит в присутствии 10% ПЭГ в случае штамма Sp7 и 20% ПЭГ у штаммов Sp7.4 и Sp7.8 по сравнению с показателями, характеризующими рост культур, сформированных без ПЭГ (A590 бактериальной культуры без ПЭГ) (табл. 1). Показатели роста планктонных культур Sp7.4 в присутствии всех использованных концентраций ПЭГ превышали значения, характерные для культур Sp7 и Sp7.8 (табл. 1). Возможно, устойчивость роста планктонных культур Sp7.4 к осмотическому стрессу обусловлены морфологией клеток этого штамма (рис. 1).
Присутствие ПЭГ влияло на подвижность азоспирилл. Так, в присутствии 5% ПЭГ существенно снижалась скорость движения плавающих клеток Sp7, Sp7.4 и Sp7.8 (табл. 1). Дальнейшее повышение концентрации ПЭГ (10–25%) блокировало подвижность планктонных клеток. ПЭГ также негативно влиял на формирование макроколоний бактериями всех исследованных штаммов на полужидких агаризованных средах (табл. 1). На полужидкой среде, содержащей 0.3% агара, ПЭГ в концентрации 5% блокировал подвижность плавающих клеток (клетки оставались в точке инокуляции в полужидкую среду) (табл. 1). При увеличении плотности агара до 0.4–0.5% азоспириллы перемещались в присутствии 5% ПЭГ, формируя колонии роящихся бактерий, хотя и меньшего диаметра, чем в контроле без стресса (табл. 1).
Анализ формирования азоспириллами био-пленок в условиях водного стресса (в присутствии ПЭГ) показал, что концентрация ПЭГ по-разному влияет на накапливание биомассы в биопленках разных штаммов исследуемых микроорганизмов (рис. 2а). Штаммы Sp7 и Sp7.4 формировали биопленки с минимальным количеством биомассы под МСС с NH4Cl, содержащей от 15 или от 10% ПЭГ соответственно. Под средой без азота оба штамма накапливали минимальное количество биомассы в присутствии ПЭГ от 10% (рис. 2а). В случае Sp7.8, независимо от присутствия NH4Cl, меньше всего биомассы накапливалось в пленках, сформированных под МСС с концентрацией ПЭГ от 20%. Под средой с 5% ПЭГ биопленки этого штамма содержали даже больше биомассы, чем в контроле без стресса. Вариант Sp7.8, формируя биопленки в присутствии ПЭГ (5–15%), накапливал больше биомассы, чем штаммы Sp7 и Sp7.4 (рис. 2а).
Рис. 2.
Влияние ПЭГ 6000 на формирование под жидкой средой штаммами A. brasilense Sp7 (1), Sp7.4 (2) и Sp7.8 (3) биопленок (а) и респираторную активность (б) сформированных без стресса пленок. Использовали среду МСС с NH4-Cl (1) или без связанного азота (2). Относительное количество биомассы биопленок, сформированных за 7 сут, оценивали, измеряя A590 кристаллического фиолетового, десорбированного после ее окрашивания. Респираторную активность биомассы 7-ми сут биопленок, сформированных без стресса, определяли после их культивирования в течение 10 сут с ПЭГ 6000. Результаты однофакторного дисперсионного (ANOVA) анализа представлены строчными буквами; разными буквами обозначены статистически значимые различия между средними. Анализировали влияние ПЭГ на средние значения измеряемых параметров штамма. а – средние значения с наименьшей величиной.
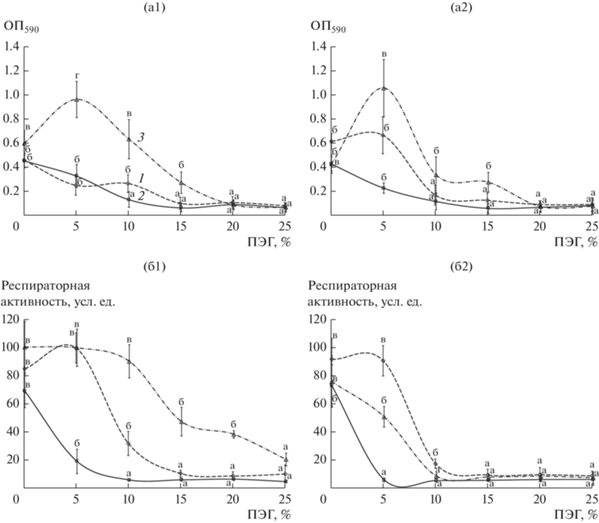
Анализ влияния осмотического стресса на респираторную активность биопленок азоспирилл. В другой серии экспериментов было исследовано влияние ПЭГ на уже сформированные (после 7 сут культивирования) биопленки. Зрелые биопленки инкубировали со средами, содержащими различные концентрации ПЭГ, в течение 10 дней. Затем измеряли респираторную активность биомассы биопленок (показатель метаболической активности клеток; Петрова и соавт., 2021). В биопленках Sp7, сформированных под средой с азотом, снижение респираторной активности более чем на 70% по сравнению с контролем (без стресса) происходило при концентрации ПЭГ в среде 15–25% (рис. 2б). У зрелых биопленок Sp7.8 из среды с азотом существенное уменьшение респираторной активности наступало после их инкубации с 25% ПЭГ (рис. 2б). В пленках Sp7 и Sp7.8, образованных под МСС без азота, уменьшение дыхательной активности на аналогичную величину случалось при инкубации с ПЭГ в концентрации от 10%. В случае Sp7.4 снижение уровня респираторной активности (более чем на 70%) происходило в присутствии 5% ПЭГ, независимо от наличия азота в среде (рис. 2б).
Необходимо отметить, что уровень метаболической активности в пленках Sp7.8, сформированных без стресса под средой с азотом, превосходил аналогичные показатели у родительского штамма или варианта Sp7.4 в присутствии всех исследованных концентраций ПЭГ (рис. 2б). Подобный ответ на присутствие ПЭГ был характерен для пленок Sp7, сформированных под средой без азота (рис. 2б).
Определенный вклад в устойчивость азоспирилл к водному стрессу могут вносить углеводсодержащие составляющие матрикса (Vurukonda et al., 2016; Шелудько и соавт., 2018; Gannesen et al., 2019), которые в биопленках являются частью многокомпонентной системы, опосредующей сродство пленок азоспирилл к различным субстратам и их структурную целостность (Wang et al., 2017; Шелудько и соавт., 2018). Оценка содержания углеводсодержащих компонентов в матриксе, полученном из смытой с поверхности стекла биомассы биопленок, показала, что из биопленок Sp7.4, по сравнению с Sp7 и Sp7.8, экстрагировалось меньше углеводных составляющих, независимо от наличия азота в среде выращивания пленок (табл. 2). Бактерии из нативных биопленок этого штамма оказались наиболее чувствительными к негативному влиянию ПЭГ (рис. 2б).
Анализ адаптации штамма A. brasilense Sp7 и его производных к существованию в корневой системе проростков пшеницы. Количество клеток A. brasilense, прикрепившихся к корням, стабилизировалось в течение 3 ч инкубации суспензии бактерий с трехсуточными проростками пшеницы. Число адсорбировавшихся клеток Sp7, Sp7.4 и Sp7.8 варьировало в пределах порядка 107 КОЕ/растение (табл. 3).
Таблица 3.
Влияние инокуляции A. brasilense на корневую систему проростков пшеницы
| Штамм | Число прикрепившихся бактерий | Проросток после 7-ми дней культивирования с бактериями | ||||||
|---|---|---|---|---|---|---|---|---|
| (а) КОЕ × 107, высеваемые из корневой системы 3-х дневных проростков |
высеваемые из корневой системы | (г) морфология корней |
||||||
| длина корней, мм | биомасса, мг | развет-вленные корни, % | деформи-рованные корневые волоски, % | |||||
| сырая | сухая | |||||||
| (б) КОЕ × 109 (нативные корни) |
(в) КОЕ × 105 (сухие корни*) |
|||||||
| к** | 0 | 0 | 0 | 56.3 ± 10.5 Б |
26.4 ± 4.4 А |
5.2 ± 0.3 А |
36.7 ± 4.1 А |
16.3 ± 1.6 А |
| Sp7 | 3.1 ± 0.5 | 3.1 ± 0.4 | 1.3 ± 0.3 | 35.7 ± 7.0 А |
32.5 ± 3.3 Б |
5.1 ± 0.3 А |
55.4 ± 4.1 Б |
37.3 ± 2.8 Б |
| Sp7.4 | 1.3 ± 0.3 | 1.3 ± 0.3 | 0.4 ± 0.04 | 38.6 ± 6.7 А |
37.9 ± 5.1 Б |
5.7 ± 0.3 Б |
52.4 ± 3.1 Б |
35.6 ± 2.7 Б |
| Sp7.8 | 1.4 ± 0.3 | 2.0 ± 0.3 | 1.3 ± 0.2 | 43.4 ± 7.7 А |
36.3 ± 4.5 Б |
5.5 ± 0.3 Б |
56.7 ± 3.0 Б |
41.3 ± 2.6 В |
Примечание. * Сухие корни, хранившиеся 7 сут при 37°C. ** Cтерильные растения. Результаты однофакторного дисперсионного (ANOVA) анализа в колонке (г) представлены строчными буквами; разными буквами обозначены статистически значимые различия между средними. Сравнения проводили в столбце. А или А – средние значения с наименьшей величиной.
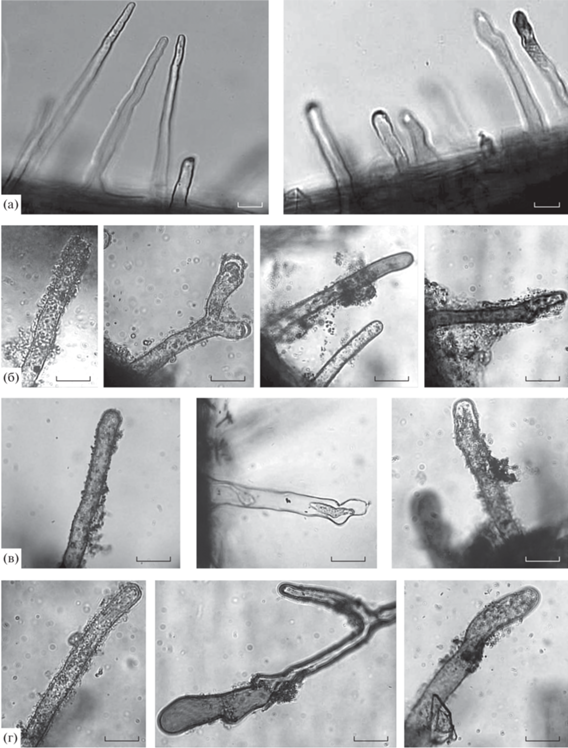
После инокуляции штаммами Sp7, Sp7.4 и Sp7.8 через 6–7 сут бактерии формировали моно- и многослойные биопленки на поверхности клеток эпидермиса корня. В зоне всасывания встречались корневые волоски, покрытые биопленками вдоль всей поверхности, бактериальные пленки располагались у мест соединения корневых волосков с поверхностью корня, на кончике корневого волоска (рис. 3 ).
Рис. 3.
Морфология корневых волосков в корневой системе стерильных (а) и инокулированных штаммами A. brasilense Sp7 (б), Sp7.4 (в) и Sp7.8 (г) проростков пшеницы после 7 дней культивирования в жидкой среде. Масштабная метка ‒ 25 мкм.
Охарактеризована численность устойчивых к высушиванию клеток Sp7, Sp7.4 и Sp7.8, заселивших корни проростков пшеницы и сформировавших там биопленки (гомогенаты инокулированных корней были высушены при 30°C и заложены на хранение при 37°C). Сухие корни после 10 сут хранения содержали 105 КОЕ Sp7 или Sp7.8 и 104 КОЕ в случае Sp7.4 (нативные корни до высушивания содержали 109 КОЕ) (табл. 3). Для биопленок, сформированных на абиотической поверхности под МСС, наблюдалась более выраженная тенденция снижения численности клеток в сухих образцах (табл. 2). Вероятно, у азоспирилл, адаптировавшихся к корневой системе растений, формируется больше клеточных форм, устойчивых к высушиванию (или в этих условиях потенциал устойчивости клеток к данному виду стресса возрастает), по сравнению с бактериями из биопленок, сформировавшимися в абиотических условиях – на стекле под МСС.
Присутствие всех исследованных штаммов азоспирилл в корневой системе проростков вызывало уменьшение ее длины, увеличение числа разветвленных корней и деформированных корневых волосков (табл. 3, рис. 3 ). В корневой системе перечисленные эффекты могли вызывать продуцируемые биопленками штаммов Sp7, Sp7.4 и Sp7.8 полисахариды, ИУК или другие фитогормоны, модулирующие влияние которых хорошо охарактеризовано для азоспирилл (Федоненко и соавт., 2004; Fibach-Paldi et al., 2012; Vurukonda et al., 2016; Fukami et al., 2018). Биопленки всех трех штаммов продуцировали сходное количество ИУК (табл. 2, столбцы г, е).
Бактерии вида A. brasilense имеют многокомпонентный геном, нередко претерпевающий спонтанные перестройки, в частности, приводящие к изменению плазмидных профилей штаммов. Перестройки в ДНК, в том числе изменение плазмидного профиля азоспирилл, могут затрагивать: морфологию колоний, агрегацию клеток и подвижность; синтез капсулы и пигментов; продукцию экзополисахаридов (ЭПС) и липополисахаридов (ЛПС), различных метаболитов; устойчивость к солевому стрессу, ампициллину и поверхностно-активным веществам; способность к утилизации углеводов (Lerner et al., 2010; Петрова и соавт., 2010; Volfson et al., 2013; Кацы, Петрова, 2015). Типовой штамм A. brasilense Sp7 имеет плазмиды с молекулярной массой 90 (pRhico), 115 (p115) и более 300 МДа. У использованных в настоящей работе спонтанных вариантов A. brasilense Sp7.4 и Sp7.8 отсутствовала 115-МДа плазмида и изменилась кажущаяся молекулярная масса pRhico, составляющая соответственно ~131 и 124 МДа (Петрова и соавт., 2010; Кацы, Петрова, 2015). В настоящем исследовании мы наблюдали, что спонтанные варианты A. brasilense Sp7.4 и Sp7.8, так же как и родительский штамм, колонизировали корни, формировали на них биопленки и оказывали влияние на морфологию корневой системы. Биопленки вариантов, как и Sp7, продуцировали полисахариды и фитогормон ИУК. Адаптируясь в корневой системе проростков пшеницы, все три штамма формировали клеточные формы, устойчивые к высушиванию. Клеточные формы, устойчивые к высушиванию, являются частью системы механизмов, способствующих выживанию микробной популяции в условиях водного стресса. Такие клетки у азоспирилл охарактеризованы как цистоподобные формы (ЦП-формы) (Sadasivan et al., 1987; Malinich, Bauer, 2018; Шелудько и соавт., 2020). ЦП-формы азоспирилл сравнивают с цистами азотобактера (Berg et al., 1980). Заметным отличием ЦП-форм Azospirillum от цист Azotobacter является отсутствие четкой дифференциации внешнего слоя на экзину и интину (Berg et al., 1980). В биопленках A. brasilense Sp7 для ЦП-форм характерен морфологический и функциональный полиморфизм (Wang et al., 2017; Шелудько и соавт., 2020). Очевидно, в сухих биопленках после гибели вегетативных клеток (Sadasivan et al., 1987; Malinich, Bauer, 2018; Шелудько, 2020) жизнеспособность сохраняется только у цистоподобных форм.
В условиях, моделирующих осмотический/водный стресс, подавлялась подвижность планктонных и роящихся клеток штаммов Sp7, Sp7.4 и Sp7.8. Непроникающий осмотический агент ПЭГ, использованный для создания условий осмотического стресса, в концентрации 10% блокировал движение клеток, плавающих при помощи полярного жгутика (Fla) в жидкой планктонной культуре. ПЭГ в концентрации 5% подавлял скорость плавающих бактерий в планктонной культуре, а на полужидкой среде, содержащей 0.3% агара, блокировал. При увеличении плотности агара до 0.4–0.5% азоспириллы синтезируют дополнительно многочисленные латеральные жгутики (Laf) (Petrova et al., 2020). Бактерии на этих средах продолжают перемещаться в присутствии 5% ПЭГ, формируя колонии роящихся клеток, но меньшего диаметра, чем в контроле без стресса.
При достаточной влажности ризосферные микроорганизмы слабо адсорбируются на поверхности частиц почвы и, следовательно, могут перемещаться к корням растений (Oliveira et al., 2004). Так, азоспириллы при 20% влажности почвы мигрируют от растения к растению (Bashan, 1986). Экспериментальная модель, в которой для стабильного и воспроизводимого снижения водного потенциала используется агаризованная среда с инфузией ПЭГ, близка к агрономическим засухе/водному стрессу в почве (Frolov et al., 2017).
ПЭГ в концентрациях, подавляющих/блокирующих подвижность плавающих/роящихся бактерий (5–10%), не оказывал значительного влияния на способность Sp7 и Sp7.8 формировать биопленки и не ингибировал метаболическую активность клеток этих штаммов в биопленках, сформированных без стресса. Показатели, характеризующие устойчивость биопленок спонтанного варианта Sp7.8 к условиям осмотического стресса/высушиванию, превосходили аналогичные параметры у родительского штамма или варианта Sp7.4. Биопленки Sp7.4 оказались наиболее восприимчивыми к негативному влиянию осмотического стресса, однако при тех же концентрациях ПЭГ планктонные культуры этого штамма росли лучше, чем культуры Sp7 и Sp7.8.
Типовой штамм A. brasilense Sp7 используют в качестве модели в исследованиях, направленных на подбор ризосферных бактерий, способных повышать устойчивость злаковых культур к негативному влиянию засухи/водного стресса (Notununu et al., 2022). Полученные нами данные свидетельствуют о том, что бактерии этого штамма формируют биопленки в условиях негативного воздействия осмотического/водного стресса. В биопленках клетки A. brasilense Sp7 приспосабливаются к условиям, моделирующим засуху/изменение водного режима. Таким образом, наши результаты анализа устойчивости биопленок A. brasilense Sp7 к осмотическому стрессу и имеющиеся литературные данные (Ansari, Ahmad, 2019; Ansari et al., 2021) позволяют использовать данный признак при отборе ризобактерий, перспективных для применения в борьбе со стрессом растений, обусловленном засухой. Варианты A. brasilense Sp7.4 и Sp7.8, являющиеся производными A. brasilense Sp7, интересны для дальнейших исследований, направленных на отбор перспективных штаммов, повышающих устойчивость растений к засухе.
Список литературы
Кацы Е.И., Петрова Л.П. Геномные перестройки у Azospirillum brasilense Sp7 с участием плазмиды pRhico и профага ΦAb-Cd // Генетика. 2015. Т. 51. С. 1351–1358.
Katsy E.I., Petrova L.P. Genome rearrangements in Azospirillum brasilense Sp7 with the involvement of the plasmid pRhico and the prophage ΦAb-Cd // Russ. J. Genet. 2015. V. 51. P. 1165–1171.
Петрова Л.П., Шелудько А.В., Кацы Е.И. Плазмидные перестройки и изменения в формировании биопленок Azospirillum brasilense // Микробиология. 2010. Т. 79. С. 129–132.
Petrova L.P., Shelud’ko A.V., Katsy E.I. Plasmid rearrangements and alterations in Azospirillum brasilense biofilm formation // Microbiology (Moscow). 2010. V. 79. P. 121–124.
Петрова Л.П., Филипьечева Ю.А., Телешева Е.М., Пылаев Т.Е., Шелудько А.В. Изменения в синтезе липополисахарида влияют на формирование биопленок Azospirillum baldaniorum in planta в условиях повышенного содержания меди // Микробиология. 2021. Т. 90. С. 459–470.
Petrova L.P., Filip’echeva Yu.A., Telesheva E.M., Pylaev T.E., Shelud’ko A.V. Variations in lipopolysaccharide synthesis affect formation of Azospirillum baldaniorum biofilms in planta at elevated copper content // Microbiology (Moscow). 2021. V. 90. P. 470–480.
Федоненко Ю.П., Здоровенко Э.Л., Коннова С.А., Игнатов В.В., Шляхтин Г.В. Сравнительная характеристика липополисахаридов и О-специфических полисахаридов Azospirillum brasilense Sp245 и его омегон-Km мутантов KM018 и KM252 // Микробиология. 2004. Т. 73. С. 180–187.
Fedonenko Yu.P., Zdorovenko E.L., Konnova S.A., Ignatov V.V., Shlyakhtin G.V. A comparison of the lipopolysaccharides and O-specific polysaccharides of Azospirillum brasilense Sp245 and its omegon-Km mutants KM018 and KM252 // Microbiology (Moscow). 2004. V. 73. P. 143–149.
Шелудько А.В., Широков А.А., Соколова М.К., Соколов О.И., Петрова Л.П., Матора Л.Ю., Кацы Е.И. Колонизация корней пшеницы бактериями Azospirillum brasilense с различной подвижностью // Микробиология. 2010. Т. 79. С. 696–704.
Shelud’ko A.V., Shirokov A.A., Sokolova M.K., Sokolov O.I., Petrova L.P., Matora L.Yu., Katsy E.I. Wheat root colonization by Azospirillum brasilense strains with different motility // Microbiology (Moscow). 2010. V. 79. P. 688–695.
Шелудько А.В., Филипьечева Ю.А., Телешева Е.М., Буров А.М., Евстигнеева С.С., Бурыгин Г.Л., Петрова Л.П. Характеристика углеводсодержащих компонентов биопленок Azospirillum brasilense Sp245 // Микробиология. 2018. Т. 87. С. 483–494.
Shelud’ko A.V., Filip’echeva Y.A., Telesheva E.M., Burov A.M., Evstigneeva S.S., Burygin G.L., Petrova L.P. Characterization of carbohydrate-containing components of Azospirillum brasilense Sp245 biofilms // Microbiology (Moscow). 2018. V. 87. P. 610–620.
Шелудько А.В., Мокеев Д.И., Евстигнеева С.С., Филипьечева Ю.А., Буров А.М., Петрова Л.П., Пономарева Е.Г., Кацы Е.И. Анализ ультраструктуры клеток в составе биопленок бактерий Azospirillum brasilense // Микробиология. 2020. Т. 89. С. 59–73.
Shelud’ko A.V., Mokeev D.I., Evstigneeva S.S., Filip’echeva Yu.A., Burov A.M., Petrova L.P., Ponomareva E.G., Katsy E.I. Cell ultrastructure in biofilms of Azospirillum brasilense // Microbiology (Moscow). 2020. V. 89. P. 50–63.
Ansari F.A., Ahmad I. Fluorescent Pseudomonas-FAP2 and Bacillus licheniformis interact positively in biofilm mode enhancing plant growth and photosynthetic attributes // Sci. Rep. 2019. V. 9. P. 4547.
Ansari F.A., Jabeen M., Ahmad I. Pseudomonas azotoformans FAP5, a novel biofilm-forming PGPR strain, alleviates drought stress in wheat plant // Int. J. Environ. Sci. Technol. 2021. V. 18. P. 3855–3870.
Bashan Y. Migration of the rhizosphere bacteria Azospirillum brasilense and Pseudomonas fluorescens towards wheat roots in the soil // J. Gen. Microbiol. 1986. V. 132. P. 3407‒3414.
Berg R.H., Tyler M.E., Novick N.J., Vasil V., Vasil I.K. Biology of Azospirillum-sugarcane association: enhancement of nitrogenase activity // Appl. Environ. Microbiol. 1980. V. 39. P. 642–649.
Bogino P.C., Oliva M.M., Sorroche F.G., Giordano W. The role of bacterial biofilms and surface components in plant-bacterial associations // Int. J. Mol. Sci. 2013. V. 14. P. 15838–15859.
Chutia J., Borah S.P. Water stress effects on leaf growth and chlorophyll content but not the grain yield in traditional rice (Oryza sativa Linn.) genotypes of Assam, India: II. Protein and proline status in seedlings under PEG induced water stress // Am. J. Plant Sci. 2012. V. 3. P. 971–980.
Döbereiner J., Day J.M. Associative symbiosis in tropical grass: Characterization of microorganisms and dinitrogen fixing sites // Symposium on Nitrogen Fixation / Eds. Newton W.E., Nijmans C.J. Pullman: Washington State University Press, 1976. P. 518–538.
Fibach-Paldi S., Burdman S., Okon Y. Key physiological properties contributing to rhizosphere adaptation and plant growth promoting abilities of Azospirillum brasilense // FEMS Microbiol. Lett. 2012. V. 326. P. 99–108.
Flemming H.-C., Wingender J. The biofilm matrix // Nat. Rev. Microbiol. 2010. V. 8. P. 623–633.
Frolov A., Bilova T., Paudel G., Berger R., Balcke G.U., Birkemeyer C., Wessjohann L.A. Early responses of mature Arabidopsis thaliana plants to reduced water potential in the agar-based polyethylene glycol infusion drought model // J. Plant Physiol. 2017. V. 208. P. 70–83.
Fukami J., Cerezini P., Hungria M. Azospirillum: benefits that go far beyond biological nitrogen fixation // AMB E-xpr. 2018. V. 8. P. 73–85.
Gannesen A.V., Zdorovenko E.L., Botchkova E.A., Hardouin J., Massier S., Kopitsyn D.S., Gorbachevskii M.V., Kadykova A.A., Shashkov A.S., Zhurina M.V., Netrusov A.I., Knirel Y.A., Plakunov V.K., Feuilloley M.G.J. Composition of the biofilm matrix of Cutibacterium acnes acneic strain RT5// Front. Microbiol. 2019. V. 10. Art. 1284. https://doi.org/10.3389/fmicb.2019.01284
Hsiao T.C. Plant responses to water stress // Ann. Rev. Plant Physiol. 1973. V. 24. P. 519–570.
Lerner A., Valverde A., Castro-Sowinski S., Lerner H., Okon Y., Burdman S. Phenotypic variation in Azospirillum brasilense exposed to starvation // Environ. Microbiol. Rep. 2010. V. 2. P. 577‒586.
Malinich E.A., Bauer C.E. The plant growth promoting bacterium Azospirillum brasilense is vertically transmitted in Phaseolus vulgaris (common bean) // Symbiosis. 2018. V. 76. P. 97–108.
Notununu I., Moleleki L., Roopnarain A., Adeleke R. Effects of plant growth-promoting rhizobacteria on the molecular responses of maize under drought and heat stresses: a review // Pedosphere. 2022. V. 32. P. 90–106.
Oliveira A.L.M., Canuto E., Silva E.E., Veronica M.R., Baldani J.I. Survival of endophytic diazotrophic bacteria in soil under different moisture intensities // Braz. J. Microbiol. 2004. V. 35. P. 295–299.
O’Toole G.A., Kolter R. Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signalling pathways: a genetic analysis // Mol. Microbiol. 1998. V. 28. P. 449–461.
Petrova L.P., Yevstigneeva S.S., Borisov I.V., Shelud’ko A.V., Burygin G.L, Katsy E.I. Plasmid gene AZOBR_p60126 impacts biosynthesis of lipopolysaccharide II and swarming motility in Azospirillum brasilense Sp245 // J. Basic Microbiol. 2020. V. 60. P. 613–623.
Sadasivan L., Neyra C.A. Cyst production and brown pigment formation in aging cultures of Azospirillum brasilense ATCC 29145 // J. Bacteriol. 1987. V. 169. P. 1670–1677.
Tarrand J.J., Krieg N.R., Döbereiner J. A taxonomic study of the Spirillum lipoferum group with description of a new genus, Azospirillum gen. nov. and two species, Azospirillum lipoferum (Beijerinck) comb. nov. and Azospirillum braslense sp. nov. // Can. J. Microbiol. 1978. V. 24. P. 967–980..
Volfson V., Fibach-Paldi Sh., Paulucci N.S., Dardanelli M., Matan O., Burdman S., Okon Y. Phenotypic variation in Azospirillum brasilense Sp7 does not influence plant growth promotion effects // Soil Biol. Biochem. 2013. V. 67. P. 255–262.
Vurukonda S.S.K.P., Sandhya V., Shrivastava M., Ali S.K.Z. Enhancement of drought stress tolerance in crops by plant growth promoting rhizobacteria // Microbiol. Res. 2016. V. 184. P. 13–24.
Wang D., Xu A., Elmerich C., Ma L.Z. Biofilm formation enables free-living nitrogen-fixing rhizobacteria to fix nitrogen under aerobic conditions // ISME J. 2017. V. 11. P. 1602–1613.
Дополнительные материалы отсутствуют.


