Микробиология, 2023, T. 92, № 1, стр. 31-41
Состояние цианобактерии Arthrospira platensis и ассоциированной с ней микрофлоры при длительном хранении в состоянии АНГИДРОБИОЗА
И. А. Харчук a, О. А. Рылькова a, *, Н. М. Береговая a
a Федеральный исследовательский центр “Институт биологии южных морей
им. А.О. Ковалевского РАН”
299011 Севастополь, Россия
* E-mail: ol.rylkova@yandex.ru
Поступила в редакцию 05.04.2022
После доработки 23.06.2022
Принята к публикации 24.06.2022
- EDN: NMNLXB
- DOI: 10.31857/S002636562210024X
Аннотация
Стандартными методами определен биохимический состав Arthrospira (Spirulina) platensis (Nordstedt) Gomont после длительного хранения (4 года, 17 лет) в состоянии ангидробиоза. Показано, что количество белков (55.3–61.2%) и суммарных углеводов (13.0–15.6%) в клетках цианобактерий соответствовало данным, известным из литературы и полученным нами ранее при закладке этих же образцов на хранение. Содержание свободных нуклеотидов (1.8–2.6%), липидов (1.3–11.0%) и, особенно, пигментов было низким (0.5–1.3, 0.03–0.12, 1.4–2.0, 0.03–0.05% соответственно, для хлорофилла а, каротиноидов, С-фикоцианина и аллофикоцианина). Количество нуклеиновых кислот в пробах достигало: 3.1–24.0 и 0.11–0.16% соответственно, для РНК и ДНК. При микроскопическом исследовании A. рlatensis (17 лет хранения) показано наличие 34.2% необратимо поврежденных и 65.8% мертвых клеток. Для определения количественных и морфологических показателей ассоциированной микрофлоры предложено использовать комплексную физико-химическую обработку (метанол, ультразвук, центрифугирование) суспензии реактивированных цианобактерий. В морфологической структуре микробиома выделены 3 основные группы (палочковидные, округлые и извитые формы). В сообществе доминировали палочковидные формы: крупные палочки составляли 60.5%, мелкие палочки – 14.4%. Мицелиальные формы (тонкие нити), кокки и извитые формы встречались реже. В среднем объем бактериальной клетки составлял 0.27 ± 0.04 мкм3. Вклад бактерий составлял от 3.3 до 11.3% (в среднем 8.3 ± 4.4%) от веса сухой биомассы А. рlatensis. Высказано предположение, что на биохимические показатели и жизнеспособность цианобактерий оказывала влияние сопутствующая микрофлора.
Цианобактерия Arthrospira (Spirulina) рlatensis содержит огромное количество белка, витаминов, минералов, кислот, около 2 тыс. ферментов, ценных пигментов; она используется в медицине как биологически активная добавка, применяется в косметологии, диетологии, является одним из популярных объектов культивирования (Vonshak 1997; Falquet, Hurni, 2006; Liu et al., 2016).
Цианобактерии сохраняют в альгологических и биотехнологических коллекциях с использованием широкого спектра методических подходов. Одним из способов является переведение культивируемых организмов в состояние анабиоза, чаще осуществляемое путем обезвоживания клеточной биомассы. Хранение культур в подобном состоянии обеспечивает долгосрочное сохранение клеток с поддержанием их высокой жизнеспособности, предупреждает мутационные изменения, т.е. поддерживает организмы в максимально близком к естественному состоянию (Харчук, 2007, 2008). Известны данные, что при переводе в состояние ангидробиоза в клетках должна оставаться вода, что позволяет структурам клетки перейти в гелеобразное состояние, сохраняя жизнеспособность, а биохимические процессы приостанавливаются. При низкой остаточной влажности происходит деструкция клеточных элементов, что приводит к гибели клеток, а при высокой влажности могут начать развиваться гнилостные процессы (Бекер и соавт., 1981). Экспериментальным путем показано, что для сохранения жизнеспособности А. рlatensis остаточная влажность должна составлять 7‒11% (Харчук, 2015).
Ранее установлено, что в нативной пробе А. рlatensis содержание основных биохимических показателей ‒ белков, липидов и суммарных углеводов; пигментов (хлорофилла а и каротиноидов), свободных нуклеотидов, ДНК, РНК в целом соответствовало диапазону величин, описанных другими авторами (Vonshak, 1997; Falquet, Hurni, 2006; Харчук, 2008; Liu et al., 2016). В первый год хранения после обезвоживания, по сравнению с нативной пробой, в биохимическом составе А. рlatensis не было обнаружено достоверных изменений (Харчук, 2008). Установлено, что после 6-летнего хранения при реактивации А. рlatensis переходила в активную фазу роста, клетки приступали к делению, в культуре были обнаружены молодые трихомы (Харчук, 2007, 2008). Однако остается невыясненным вопрос о максимальной длительности хранения цианобактерий в обезвоженном состоянии, в течение которой способность к восстановлению и делению клеток будет сохраняться.
Широко известно, что при выращивании альгокультур в них всегда присутствует сопутствующая микрофлора (Тархова, 2005; Mogale, 2016; Vardaka et al., 2016), а также возможна контаминация, возникающая во время хранения сухой биомассы. В лабораторных условиях рост цианобактерий А. рlatensis сопровождается развитием протеолитических, амилолитических, липолитических и др. гетеротрофных микроорганизмов, среди которых чаще выделяют четыре доминирующих рода: Flavobacterium, Mycobacterium, Achromobacter, Pseudomonas (Тархова, 2005). Микроорганизмы могут влиять на жизнеспособность и биохимические показатели альгокультур.
Целью данной работы было исследование жизнеспособности и биохимического состава клеток А. рlatensis при длительном хранении в состоянии анабиоза, оценка морфологической структуры сопутствующей микрофлоры и ее вклада в биомассу А. рlatensis.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Условия выращивания и перевод А. рlatensis в состояние ангидробиоза. Объектом исследования служила культура Arthrospira (Spirulina) platensis (Nordstedt) Gomont (штамм IBBS–31) из коллекции отдела биотехнологии и фиторесурсов ФИЦ ИнБЮМ РАН. Цианопрокариоты выращивались в режиме накопительного культивирования при постоянном круглосуточном освещении и автоматическом перемешивании с использованием насоса для удаления избытка кислорода из среды и равномерного прогрева всего слоя питательного раствора культуры. Барботировали атмосферным воздухом с общей скоростью подачи 1.42 л мин–1, что составляло 0.35 л мин–1 л–1 культуры. Интенсивность света на поверхности раствора культуры составляла 10.7 кЛк, для измерения использовали прибор квантометр Li-250А (“Li-Cor”, США). Температура среды изменялась в диапазоне 20–25°С. В качестве питательной среды для А. platensis использовали среду Заррука (Faucher et al., 1979). Культиваторами служили стеклянные стаканы объемом 2 дм3; объем среды составлял 1 дм3 при высоте слоя 14–15 см.
На стационарной стадии роста трихомы А. platensis концентрировали путем их фильтрации через мельничный газ 100–105 ПЭ. Сконцентрированную культуру А. platensis промывали дистиллированной водой в соотношении 1 : 3 для полного отмывания от солей и сохранения клеточных мембран и оболочек; сохранность клеток контролировали микроскопированием. Затем полученную пасту водорослей разделяли на несколько частей и высушивали до воздушно-сухого состояния в термостате в температурном диапазоне 30–70°С в течение 24 ч при остаточной влажности 8.5–9.5%. Обезвоженные клетки цианобактерий хранили в герметично закрытых полиэтиленовых упаковках в темноте при температуре 15–20°С.
Биохимические исследования А. platensis. В работе использовали высушенную биомассу А. platensis, которая ранее была исследована в нативном состоянии, после обезвоживания и через один год хранения (Харчук, 2008). Работы с этим же образцом А. platensis были продолжены через 4- и 17-летние сроки хранения. Пробы обрабатывали по схеме комплексного химического анализа гидробионтов (Копытов и соавт., 1985). Содержание пигментов определяли спектрофотометрическими методами на приборе СФ-2000 (“ЛОМО”, Россия). Хлорофилл а (Хл а) из сухих клеток А. platensis экстрагировали 90% ацетоном; оптическую плотность полученных супернатантов регистрировали при 664 и 647 нм. Каротиноиды (КР) оценивали в суммарной вытяжке пигментов А. рlatensis по поглощению в области 480 нм (Rowan, 1989). Массовую долю белка в цианобактериях определяли по методике Лоури (Lowry et al., 1951). Количество свободных нуклеотидов (СН), РНК и ДНК определяли спектрофотометрическим методом (Спирин, 1958). Общее содержание липидов находили спектрофотометрическим методом с фосфованилиновым реактивом. Определение углеводов проводили с помощью L-триптофанового реактива (Агатова, 2004). С-фикоцианин экстрагировали дистиллированной водой, его содержание рассчитали по формуле, приведенной в работе (Геворгиз, Нехорошев, 2017). Показатели биохимического состава выражали в процентах в пересчете на сухую массу (СМ). Остаточную влажность определяли стандартным методом доведения до постоянного веса.
Подготовка суспензии А. рlatensis для микроскопических исследований и оценки вклада бактериальной составляющей. Чтобы минимизировать внешнее загрязнение, все используемые растворы (фиксаторы, стерильную питательную среду Заррука, химические реагенты) непосредственно перед работой фильтровали через мембранные фильтры с диаметром пор 0.2 мкм (“Sartorius”, Германия). Для размачивания А. platensis использовали стерильные пластиковые пробирки, в которые помещали навеску цианобактерий (0.01–0.05 г) и добавляли 3 мл стерильной среды Заррука, разбавленной дистиллированной водой, в соотношении (1 : 2), по методике, описанной ранее (Харчук, 2015). Через 60 мин экспозиции при комнатной температуре аликвоту суспензии клеток А. platensis фиксировали в течение 60 мин глутаровым диальдегидом до конечной концентрации 2.5% и использовали для микроскопических исследований ассоциированной микрофлоры с помощью сканирующего электронного микроскопа (СЭМ) и расчета вклада бактерий в биомассу А. platensis методом взвешиваний. Остальную суспензию продолжали реактивировать в течение 30 сут с ежедневным определением жизнеспособности клеток (см. следующий раздел).
Определение жизнеспособности А. platensis. Выявление живых и мертвых клеток цианобактерий осуществляли с помощью светового микроскопа Carl Zeiss (“Axiostar plus”, Германия), снабженного камерой (“Сanon А 620”, Япония) при увеличении от ×200 до ×630 методом дифференциального окрашивания клеток метиленовым синим (Сиренко, 1975). Одновременно учитывали общее количество реактивируемых клеток и определяли долю клеток, сохранивших жизнеспособность (под жизнеспособностью подразумевали способность А. platensis эндогенно поглощать краситель). Результаты интерпретировали по методике Мейселя (Мейсель и соавт., 1961), адаптированной авторами для цианобактерий.
Определение доли бактерий в культуре А. рlatensis методом взвешиваний. Суспензию клеток сразу после размачивания и фиксирования (контроль), осаждали на предварительно доведенные до постоянного веса нитроцеллюлозные фильтры с диаметром пор 0.2 мкм (фильтры и воронки “Sartorius”, Германия). Параллельно аликвоту суспензии, для более полного извлечения микрофлоры из суспензии цианобактерий, подвергали физико-химической обработке (Lunau et al., 2005; Kallmeyer et al., 2008; Rylkova et al., 2019). Для этого суспензию обрабатывали метанолом (конечная концентрация в пробе 10%), выдерживали в ультразвуковой установке (Unitra unima 01SZTYN UM-4, VA140, V220, Hz50) в течение 15 мин при 35°С, встряхивали c помощью вортекса (Microspin FV-2400, “Biosan”, Латвия) в течение 1 мин и центрифугировали (ОПн-3У4.2, “ДАСТАН”, Кыргызская Республика) в течение 10 мин при 900 g. Супернатант использовали для исследования с помощью СЭМ (см. ниже), а осадок трижды промывали стерильной средой Заррука и центрифугировали (Lunau et al., 2005; Kallmeyer et al., 2008; Rylkova et al., 2019). При такой обработке бактериальная составляющая оставалась в супернатанте, а полученный осадок с клетками А. рlatensis, свободный от сопутствующей микрофлоры, отфильтровывали на предварительно доведенные до постоянного веса нитроцеллюлозные фильтры с диаметром пор 0.2 мкм. После фильтрации всех образцов их просушивали в сушильном шкафу (2B-151, Украина) при температуре 105°С в течение 24 ч и вновь взвешивали (Sartorius L220S, “Sartorius”, Германия). По разнице между контролем и осадками, подвергшимся физико-химической обработке, определяли вклад бактерий в биомассу А. рlatensis.
Морфологические исследования клеток бактерий. При подготовке образцов для сканирующего электронного микроскопа (СЭМ) аликвоту (0.5–2 мл) надосадочной жидкости после физико-химической обработки (см. выше) пробы из реактивированной культуры А. рlatensis концентрировали на поликарбонатный фильтр с диаметром пор 0.2 мкм (“ОИЯИ”, Россия). Далее проводили дегидратацию, используя серию разведений этанола: 20, 30, 50, 75, 96, 100% (Bratbak et al., 1993). Для сушки образцов в критической точке (1.5–2.5 ч) использовали устройство Leica EM CPD300 (Германия). Для напыления (Au/Pd; 0.5–1.0 мин) применяли прибор Leica EM ACE200 (Германия). Просматривали образцы с помощью сканирующего электронного микроскопа Hitachi SU3500 (Япония) при увеличении от ×5000 до ×35 000. На 40 случайно выбранных полях зрения определяли линейные размеры (длина, ширина, диаметр) 300 бактериальных клеток и процент встречаемости каждой из морфологических групп. Размеры бактерий по микрофотографиям определяли с помощью программы ImageJ 1.50i (National Institutes of Health, США, Java 1.6.0_20 (32-bit)). Объем кокков рассчитывали по формуле объема шара, объем палочек и извитых форм определяли по формуле объема цилиндра.
Статистический анализ проводили в пакете STATISTICA (data analysis software system), версия 10 (“StatSoft, Inc.”, www.statsoft.com), построение графиков – в программах SigmaPlot 10.0 (“SYSTAT Software, Inc.”) и Grapher 8 (“Golden Software, Inc.”). Полученные данные обработаны с использованием параметрических критериев и представлены в виде средней арифметической (М) из пяти повторностей (n), стандартной ошибке среднего (mM); доверительного интервала (CI); статистическую значимость различий оценивали по t-критерию Стьюдента (p < 0.05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Микроскопические исследования культуры Arthrospira platensis. Показано, что в первые часы реактивации через 17 лет хранения A. platensis в обезвоженном состоянии преобладали внешне неповрежденные клетки цианобактерий (рис. 1а). При увеличении времени реактивации обнаружено увеличение доли клеток с разрушающимся пигментом (рис. 1б). Через 30 сут после начала эксперимента мы наблюдали доминирование клеток с разрушенным содержимым, но сохранивших трихомы (рис. 1в). Применение к этим же образцам A. platensis адаптированной классификации Мейселя (1961) показали наличие необратимо поврежденных и мертвых клеток: 65.8 и 34.2% соответственно (рис. 2).
Рис. 1.
Исследование культуры A. platensis после 17-ти лет хранения с помощью световой микроскопии: а – сразу после реактивации; б – 3 сут эксперимента; в – 30 сут эксперимента. Масштабная линейка ‒ 10 мкм.
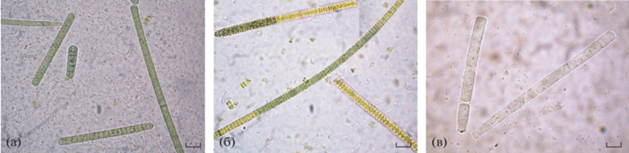
Рис. 2.
Содержание клеток различных групп в культуре А. рlatensis на различных сроках хранения в состоянии ангидробиоза (приведены данные при температуре обезвоживания 60°С): I – неповрежденные или слегка поврежденные клетки; II – сильно поврежденные; III – необратимо поврежденные; IV – мертвые клетки. Данные по пробам после 1 и 4 года хранения приведены по (Харчук, 2007), 17 лет хранения – данные настоящего исследования.
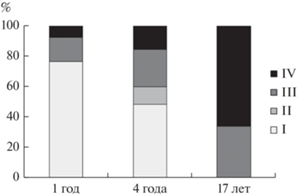
Ранее было обнаружено, что в этих же пробах после 1 года хранения доминировали неповрежденные или слегка поврежденные клетки, способные к делению (I группа); их доля составляла 76.6%. На необратимо поврежденные клетки, продолжающие осуществлять нарушенный обмен веществ, быстро восстанавливающие свои нативные размеры и переходившие к репарации поврежденных клеточных структур (III группа), приходилось 16%. Такое восстановление было длительным (до 30 сут), однако к делению клетки не переходили и постепенно разрушались. На долю мертвых клеток (IV группа) приходилось 7.4% (Харчук, 2007) (рис. 2). Через 4 года хранения произошло значительное перераспределение вкладов клеток различных групп: содержание I группы снизилось в 1.6 раза и составило 48.6%; появились клетки II группы (11.4%), сильно поврежденные, медленно восстанавливающие функции, но способные к делению; увеличился вклад клеток III группы в 1.5 раза (24.6%) и IV группы в 2 раза (15.4%) (Харчук, 2007) (рис. 2).
Содержание биохимических соединений в клетках А. рlatensis. Ранее установлено, что в нативной пробе А. рlatensis, перед ее обезвоживанием и закладкой на хранение, содержание основных биохимических показателей составляло: 58, 14.8 и 17.3% соответственно, для белков, липидов и суммарных углеводов. Количество пигментов составляло 1.8 и 0.6% (для хлорофилла а и каротиноидов), свободных нуклеотидов – 4.7%, ДНК – 0.13% и РНК – 2.5%. Сразу после обезвоживания А. рlatensis количество белка, суммарных углеводов, пигментный состав и содержание ДНК практически не менялись, для липидов и свободных нуклеотидов обнаружено небольшое снижение, а для белка и РНК – увеличение содержания. Через 1 год хранения отмечено стабильное содержание белка и углеводов, незначительное снижение остальных показателей, за исключением содержания ДНК и РНК. Однако все величины для этих периодов по сравнению с нативной пробой были статистически незначимы (парный t-тест, р > 0.05) (Харчук, 2008) (рис. 3).
Рис. 3.
Биохимический состав А. рlatensis (% от сухой биомассы) при температуре обезвоживания 60°С. НК – суммарные нуклеиновые кислоты; СН – свободные нуклеотиды; СУВ – суммарные углеводы. Данные по нативной, обезвоженной пробам и после 1 года хранения приведены по (Харчук, 2008), через 4 года, 17 лет хранения – данные настоящего исследования.

Установлено, что обезвоживание цианобактерий с целью сохранения их в жизнеспособном состоянии необходимо проводить в температурном диапазоне 30–60°С (Харчук, 2015, 2018). В данном исследовании для всех биохимических показателей А. рlatensis отсутствовала достоверная разница при температуре обезвоживания 30 и 60°С (парный t-тест, р > 0.05). При сравнении биохимических показателей, полученных для разных сроков хранения, мы ориентировались на оптимальную температуру сушки 60°С и установленную остаточную влажность для исследуемых образцов 8.5–9.5%.
По сравнению с обезвоженной пробой (рис. 3) для образцов А. рlatensis после 4-х и 17-ти лет хранения обнаружено недостоверное снижение содержания белка (с 61.2 ± 0.8 до 55.3 ± 1.2%), суммарных углеводов (с 15.6 ± 0.3 до 13.0 ± 0.4%) и свободных нуклеотидов (с 2.6 ± 0.02 до 1.8 ± ± 0.15%); во всех случаях парный t-тест, р > 0.05.
Количество липидов за этот период снизилось в 8.3 раза с 11.0 ± 0.03 до 1.3 ± 0.11%, хлорофилла а ‒ почти втрое (с 1.3 ± 0.01 до 0.46 ± 0.02%), каротиноидов – в четыре раза (с 0.12 ± 0.01 до 0.03 ± 0.002%). Во всех случаях различия были достоверными (парный t-тест, р < 0.05) (табл. 1, рис. 3).
Таблица 1.
Биохимический состав и показатели жизнеспособности клеток цианобактерий Arthrospira platensis, после 4 и 17 лет хранения в состоянии ангидробиоза (приведены средние значения с доверительным интервалом при температуре обезвоживания 60°С)
| Биохимические показатели, % СВ | 4 года | 17 лет |
|---|---|---|
| Белок | 61.2 ± 0.8 | 55.3 ± 1.2 |
| Липиды | 11.0 ± 0.03 | 1.3 ± 0.11 |
| Суммарные углеводы | 15.6 ± 0.3 | 13.0 ± 0.4 |
| Хлорофилл а | 1.3 ± 0.01 | 0.46 ± 0.02 |
| Каротиноиды | 0.12 ± 0.01 | 0.03 ± 0.002 |
| С-фикоцианин | 2.0 ± 0.15 | 1.4 ± 0.07 |
| Аллофикоцианин | 0.05 ± 0.01 | 0.03 ± 0.01 |
| Свободные нуклеотиды | 2.6 ± 0.02 | 1.8 ± 0.15 |
| РНК | 3.1 ± 0.05 | 24.0 ± 1.4 |
| ДНК | 0.11 ± 0.01 | 0.16 ± 0.03 |
Фикобилипротеины (ФБП) А. platensis, входящие в пул белковых веществ, были представлены С-фикоцианином (С-ФК) и аллофикоцианином (АФЦ) (Стадничук, 1990). При длительном хранении нами отмечена деструкция С-ФК (снижение содержания с 2.0 ± 0.15 до 1.4 ± 0.07%) и почти полное разрушение АФЦ (с 0.05 ± 0.01% до 0.03 ± 0.01%) (табл. 1).
Количество ДНК возрастало с 0.11 ± 0.005 до 0.16 ± 0.03%, а РНК достоверно увеличивалось в 7.9 раз, с 3.1 ± 0.05 до 24.0 ± 1.41% (парный t-тест, р < 0.05). Необходимо отметить, что данные по содержанию нуклеиновых кислот для клеток А. рlatensis немногочисленны, однако известно, что количество РНК в 3–4 раза больше, чем ДНК (Ciferri, 1983). Величины всех биохимических показателей A. platensis, сохраняемой 4 года и 17 лет в состоянии ангидробиоза, представлены в табл. 1.
Таким образом, через 4 года хранения образцов были выявлены значимые изменения биохимического состава цианобактерий. По сравнению с только что обезвоженной пробой, на фоне стабильного содержание белка и углеводов, обнаружено снижение величин остальных показателей в 1.2–4.5 раза; для липидов, свободных нуклеотидов и пигментов различия были достоверными (парный t-тест, р < 0.05) (рис. 3, табл. 1). Вероятно, этот период являлся переломным при хранении клеток в обезвоженном состоянии.
После 17-ти лет хранения в ангидробиозном состоянии (по сравнению с обезвоженной пробой; Харчук, 2008) нами зафиксированы стабильное содержание белка и суммарных углеводов; однако количество липидов снизилось на порядок, свободных нуклеотидов – в 1.4 раза; для хлорофилла и каротиноидов снижение составляло 3.8 и 18 раз соответственно (рис. 3, табл. 1). Кроме того, отмечено снижение в 4–12 раз содержания С-ФЦ, белка фотосинтетического аппарата, собирающего свет и связывающего пигменты (Liu et al., 2016); аллофикоцианин разрушился практически полностью (табл. 1) (парный t-тест, р < 0.05). Известно, что С-ФЦ чувствителен к действию протеаз, света, кислорода, влаги и температуры, то есть легко разлагается в естественном состоянии (Kannaujiya, Sinha, 2015). Соотношение С-ФЦ/АФЦ определяет перенос энергии от фикобилисом к хлорофиллу а во время фотосинтеза (Vonshak, 1997). Вероятно, полученные нами низкие величины содержания липидов и пигментов (хлорофилла а, каротиноидов, С-ФЦ, АФЦ) в клетках цианопрокариот (табл. 1, рис. 3) косвенно указывают на деструкцию пигментно-липидного комплекса.
Известно, что А. рlatensis обладает мощным потенциалом аминокислотного синтеза, поэтому уровень белка может достигать чрезвычайно высоких величин до 70–74% сухого вещества (Vonshak, 1997). Белки составляют более половины сухого вещества цитоплазматической мембраны цианопрокариот, входят в состав клеточной оболочки. Фикобилипротеины фотосинтетического аппарата (которые тоже входят в белковый пул) могут достигать 20% массы всех водорастворимых белков, выполняя при этом роль резервных веществ (Rowan, 1989; Стадничук, 1990). Однако, как указывалось выше, при длительном хранении нами обнаружены крайне низкие величины С-ФЦ, АФЦ. Вероятно, относительно высокие показатели содержания белка (55.3–61.2%) в клетках цианобактерий при длительном хранении объясняются другими факторами.
Следует отметить, что после 4-х лет хранения А. рlatensis количество РНК практически не изменилось по сравнению с только что обезвоженной пробой (Харчук, 2008), а через 17 лет наблюдалось достоверное увеличение содержания в 6.9 раз (парный t-тест, р < 0.05) (рис. 3, табл. 1). Возможно, высокие показатели содержания белка в обезвоженной биомассе цианобактерий, а также увеличение содержания РНК (обнаруженное через 17 лет) можно объяснять вкладом ассоциированной микрофлоры.
Микроскопические исследования микрофлоры, ассоциированной с культурой A. platensis. Учитывая, что исследования были выполнены на альгологически чистой, но не аксеничной культуре цианобактерий, мы предположили, что на изменение биохимических показателей и на жизнеспособность клеток A. platensis действительно могла влиять сопутствующая микрофлора.
Прямым методом взвешиваний показано, что доля микрофлоры при физико-химической обработке метанолом, ультразвуком и центрифугированием составляла 8.3 ± 4.4% (при диапазоне 3.3–11.3%).
По данным электронной микроскопии бактериальные клетки были обнаружены вне клеток А. рlatensis (рис 4а), а также в слизевом чехле (рис. 4б) и на поверхности цианобактерий (рис. 4в). В морфологической структуре микрофлоры в культуре A. platensis, реактивированной после состояния анабиоза, нами выделены 3 основные группы (табл. 2): палочковидные, округлые и извитые формы (Шлегель, 1987; Слизень и соавт., 2020). В сообществе преобладали палочковидные формы, среди которых доминировали крупные палочки (60.5%) объемом 0.33 ± 0.05 мкм3; длина клеток изменялась от 0.44 до 12.54 мкм, ширина – от 0.19 до 1.19 мкм (табл. 2, рис. 5а, 5б, 5г). Мелкие палочки объемом 0.13 ± 0.02 мкм3, длиной 0.45–2.01 мкм и шириной 0.26–0.58 мкм (рис. 5ж) встречались с частотой 14.4%. Мицелиальные формы (тонкие нити) длиной 1.08–8.49 мкм, шириной 0.13–0.25 мкм и объемом 0.11 ± 0.03 мкм3 составляли 12.4% от общего числа микроорганизмов (рис. 5а, 5в). Еще реже попадались округлые формы (кокки) (рис. 5д) диаметром 0.14–0.82 мкм, объемом 0.10 ± 0.04 мкм3 (6.5%) и извитые формы (4.4%) объемом 0.22 ± ± 0.10 мкм3 (рис. 5е). Единичными были цепочки палочек длиной 0.63–1.32 мкм, шириной 0.29–0.40 мкм и объемом 0.11–0.01 мкм3; длина таких цепочек достигала 7.38–27.06 мкм (рис. 5а).
Рис. 4.
Электронные микрофотографии сопутствующей микрофлоры в культуре А. рlatensis: а – общий вид микробиома; б – бактериальные клетки в слое слизи; в – бактерии на поверхности слизевого чехла А. рlatensis. Масштабная линейка: а – 3 мкм; б, в – 1 мкм.
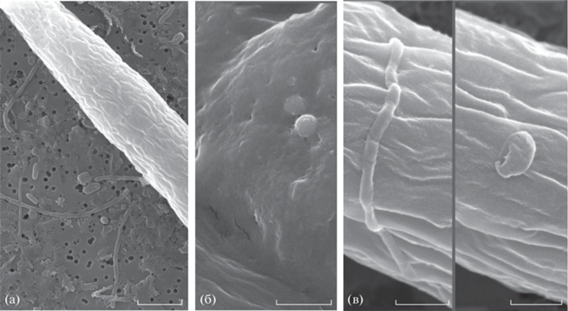
Таблица 2.
Морфологические показатели сопутствующей микрофлоры в культуре при реактивации А. рlatensis
| Морфотипы | % встречаемости | Размеры, мкм | Объем, мкм3 | |
|---|---|---|---|---|
| длина/диаметр | ширина | |||
| Крупные палочки | 60.5 | $\frac{{1.53 \pm 0.23}}{{0.44{\kern 1pt} - {\kern 1pt} 12.54}}$ | $\frac{{0.48 \pm 0.06}}{{0.19{\kern 1pt} - {\kern 1pt} 1.19}}$ | $\frac{{0.33 \pm 0.05}}{{0.04{\kern 1pt} - {\kern 1pt} 1.92}}$ |
| Мелкие палочки | 14.4 | $\frac{{0.95 \pm 0.09}}{{0.45{\kern 1pt} - {\kern 1pt} 2.01}}$ | $\frac{{0.41 \pm 0.03}}{{0.26{\kern 1pt} - {\kern 1pt} 0.58}}$ | $\frac{{0.13 \pm 0.02}}{{0.04{\kern 1pt} - {\kern 1pt} 0.20}}$ |
| Палочки в цепочках | 1.8 | $\frac{{0.87 \pm 0.08}}{{0.63{\kern 1pt} - {\kern 1pt} 1.32}}$ | $\frac{{0.36 \pm 0.01}}{{0.29{\kern 1pt} - {\kern 1pt} 0.40}}$ | $\frac{{0.11 \pm 0.01}}{{0.03{\kern 1pt} - {\kern 1pt} 0.16}}$ |
| Округлые формы (кокки) | 6.5 | $\frac{{0.51 \pm 0.10}}{{0.14{\kern 1pt} - {\kern 1pt} 0.82}}$ | ‒ | $\frac{{0.10 \pm 0.04}}{{0.001{\kern 1pt} - {\kern 1pt} 0.29}}$ |
| Извитые формы | 4.4 | $\frac{{3.14 \pm 1.17}}{{0.27{\kern 1pt} - {\kern 1pt} 6.13}}$ | $\frac{{0.30 \pm 0.09}}{{0.11{\kern 1pt} - {\kern 1pt} 0.59}}$ | $\frac{{0.22 \pm 0.10}}{{0.01{\kern 1pt} - {\kern 1pt} 0.61}}$ |
| Мицелиальные формы (тонкие нити) | 12.4 | $\frac{{3.54 \pm 0.72}}{{1.08{\kern 1pt} - {\kern 1pt} 8.49}}$ | $\frac{{0.20 \pm 0.01}}{{0.13{\kern 1pt} - {\kern 1pt} 0.25}}$ | $\frac{{0.11 \pm 0.03}}{{0.02{\kern 1pt} - {\kern 1pt} 0.33}}$ |
| Средний объем бактерий | $\frac{{0.27 \pm 0.04}}{{0.01{\kern 1pt} - {\kern 1pt} 2.86}}$ | |||
Рис. 5.
Электронные микрофотографии сопутствующей микрофлоры в культуре реактивированной А. рlatensis: а – белой стрелкой обозначена крупная палочка; черной стрелкой – палочки, объединенные в цепочку; белой стрелкой с пунктирными линиями – мицелиальная форма микроорганизмов (тонкая нить); б – крупная палочка; в – мицелиальная форма; г – крупные палочки; д – кокк; е – извитая форма; ж – мелкие палочки. Масштабная линейка ‒ 1 мкм.
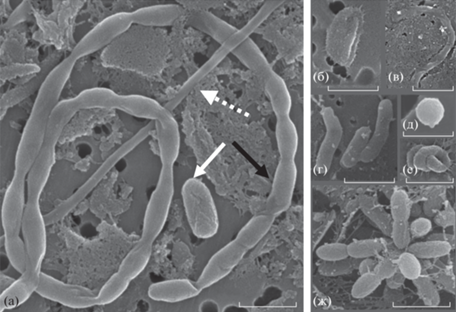
В среднем объем бактериальной клетки, рассчитанный по измерениям 300 клеток, составлял 0.27 ± 0.04 мкм3 (изменяясь 0.001–2.86 мкм3). Интересно отметить, что среди крупных палочек и извитых форм часто встречались клетки с выростами, предположительно, пилями (белкового происхождения) или полисахаридными тяжами (рис. 5б, 5е).
Известно, что микрофлора, связанная с культурами А. рlatensis, как правило, немногочисленна и непатогенна. Высокая щелочность культуральной среды (рН 8.5–11.0) является барьером для проникновения бактерий, дрожжей, грибов или водорослей. Некоторые вещества, выделяемые А. рlatensis или содержащиеся в ней, обладают бактерицидным или бактериостатическим действием (Falquet, Hurni, 2006). Согласно литературным данным, в культуре спирулины обычно содержится от 3 × 104 до 6 × 105 кл. мл–1; в сухой биомассе спирулины ‒ от 103 до 106 жизнеспособных организмов на 1 г (Velji, Albright, 1986; Falquet, Hurni, 2006). Необходимо отметить, что подобные исследования были выполнены классическими микробиологическими методами посевов бактерий на питательные среды. По данным проточной цитометрии для культур различных микроводорослей численность бактерий составляла около 105–107 кл. мл–1 (Рауэн и соавт., 2011). Нами также подтверждено наличие большого количества бактериальных клеток в суспензии реактивированной А. рlatensis (рис. 4а).
Таким образом, изменения биохимического состава (разрушение липидно-пигментного комплекса), а также показатели жизнеспособности клеток цианобактерий (большая доля мертвых и необратимо поврежденных клеток) при длительном хранении А. рlatensis в обезвоженном состоянии указывают на глобальные негативные перестройки в культуре цианобактерий. За счет разрушенных клеток А. рlatensis повышается пул органических субстратов, что может стать толчком для развития гетеротрофных микроорганизмов (Тархова, 2008; Mogale, 2016; Vardaka et al., 2016). Возможно, полученное нами достаточно стабильное содержание белка и увеличение количества нуклеиновых кислот в трихомах А. рlatensis при длительном хранении и объясняется развитием ассоциированной микрофлоры. Известно, что в процентном отношении от сухого вещества (в целом для бактериальных клеток) доля белка достигает 72–78%, количество липидов и нуклеиновых кислот составляет 1.5–3 и 8–16% соответственно (Nalage et al., 2016).
Таким образом, обилие микрофлоры, обнаруженной в культуре реактивированных цианобактерий (рис. 4а), и рассчитанный вклад бактериальной составляющей (3.3–11.3%) в биомассу спирулины указывает на то, что влияние ассоциированной микрофлоры на биохимический состав высушенной биомассы А. рlatensis при длительном ее хранении в обезвоженном состоянии нельзя игнорировать. Кроме того, контроль количества гетеротрофных бактерий в сухой биомассе А. рlatensis является отправной точкой для дальнейших исследований по выращиванию и переработке биомассы цианобактерий в коммерческих целях (Vardaka et al., 2016).
Таким образом, результаты биохимического анализа А. рlatensis, сохраняемой в состоянии ангидробиоза длительное время (4 года и 17 лет), показали, что количество белка (55.3–61.2%) и суммарных углеводов (13.0–15.6%) в целом соответствовало данным, полученным ранее при закладке этих же образцов на хранение. Содержание липидов (1.3–11.0%), свободных нуклеотидов (1.8–2.6%) и пигментов было низким (0.46–1.3 и 0.03–0.12% соответственно для хлорофилла а и каротиноидов). Отмечена деструкция С-фикоцианина до 1.4–2.0% и почти полное разрушение аллофикоцианина 0.03–0.05%, что является косвенным признаком разрушения фотосинтетической системы. Микроскопические исследования показали, что в реактивированной культуре А. рlatensis (17 лет хранения) доминировали мертвые (65.8%) и необратимо поврежденные клетки (34.3%). Количество ДНК (через 4 г. и 17 лет хранения) увеличивалось с 0.11 до 0.16%, а РНК достигало 3.1–24.0%. Вероятно, стабильное содержание белка и возрастание количества нуклеиновых кислот (особенно РНК) происходило за счет активного развития сопутствующей микрофлоры, ассоциированной с А. рlatensis. В морфологической структуре микробиома (после 17 лет хранения сухой биомассы А. рlatensis) выделены 3 основные группы (палочковидные, округлые и извитые формы), среди которых доминировали палочковидные формы. Крупные палочки составляли 60.5%, мелкие палочки, нитевидные, извитые и округлые формы (кокки) встречались реже. В среднем объем бактериальной клетки составлял 0.27 ± 0.04 мкм3; вклад бактерий в биомассу А. рlatensis изменялся от 3.3 до 11.3% (в среднем 8.3 ± 4.4%) от сухого вещества цианобактерий. Высказано предположение, что на биохимические показатели и жизнеспособность цианобактерий оказывала влияние сопутствующая микрофлора.
На основании полученных результатов показано, что хранение А. рlatensis в обезвоженном состоянии в течение 17 лет является нецелесообразным. Для длительного хранения рекомендовано использовать монокультуру цианобактерий, очищенную от сопутствующей микрофлоры и в стерильных вакуумных упаковках.
Список литературы
Агатова А.И. Руководство по современным биохимическим методам исследования водных экосистем, перспективных для промысла и марикультуры. М.: Изд-во ВНИРО, 2004. 123 с.
Бекер М.Е., Дамберг Б.Э., Рапопорт А.И. Анабиоз микроорганизмов. Рига: Зинатне, 1981. 252 с.
Гевориз Р.Г., Нехорошев М.В. Количественное определение массовой доли С-фикоцианина и аллофикоцианина в сухой биомассе Spirulina (Arthrospira) platensis North. Geitl. Холодная экстракция, Севастополь 2017 // Электронный ресурс https://repository.marine-research.org/handle/299011/46 (дата обращения 19.10.2021).
Копытов Ю.П., Дивавин И.А., Цымбал И.М. Схема комплексного биохимического анализа гидробионтов // “Рациональное использование ресурсов моря – важный вклад в реализацию продовольственной программы”: материалы конф. ИнБЮМ АН УССР. Севастополь, 1985. Т. 4.2. С. 227–231. Деп. в ВИНИТИ 16.04.85, № 2556-85.
Мейсель М.Н., Медведева Г.А., Алексеева В.М. О выявлении живых, поврежденных и мертвых микроорганизмов // Микробиология. 1961. Т. 30. С. 855–862.
Рауэн Т.В., Ханайченко А.Н., Муханов В.С. Влияние микроводорослей и их фильтратов на численность бактерий в среде выращивания камбалы калкана // Морской экологический журн. 2011. Т. 10. № 3. С. 48‒56.
Рылькова О.А., Гулин С.Б., Пименов Н.В. Определение общей численности микроорганизмов в донных осадках Черного моря методом проточной цитометрии // Микробиология. 2019. Т. 88. С. 685‒694.
Rylkova O.A., Gulin S.B., Pimenov N.V. Determination of the total microbial abundance in Black Sea bottom sediments using flow cytometry // Microbiology (Moscow). 2019. V. 88. P. 700‒708.
Сиренко Л.А., Сакевич А.И., Осипович Л.Ф. Методы физиолого-биохимического исследования водорослей в гидробиологической практике. Киев: Наукова думка, 1975. 247 с.
Слизень В.В., Кирильчик Е.Ю., Шабан Ж.Г., Черношей Д.А., Канашкова Т.А. Лабораторный практикум по общей микробиологии. 5-е изд. Минск: БГМУ, 2020. 80 с.
Спирин А.С. Спектрофотометрическое определение суммарного количества нуклеиновых кислот // Биохимия. 1958. Т. 23. С. 656–662.
Стадничук И.Н. Фикобилипротеины. Итоги науки и техники. Сер. Биол. химия. М. ВИНИТИ, 1990. Т. 40. 196 с.
Тархова Э.П. Микроорганизмы, сопутствующие Spirulina platensis в накопительной питательной культуре // Экология моря. 2005. Вып. 70. С. 49‒52.
Харчук И.А. Влияние длительности хранения на жизнеспособность клеток Spirulina platensis (Nordst.) в состоянии ангидробиоза // Экология моря. 2007. Вып. 74. С. 80–83.
Харчук И.А. Динамика компонентов биохимического состава Spirulina platensis Nords. при ангидробиозе // Экология моря. 2008. Вып. 76. С. 67‒71.
Харчук И.А. Способ длительного хранения микроводорослей. RU 2541452 C1 от 10.02.2015.
Харчук И.А. Динамика жизнеспособности и компонентов биохимического состава Arthrospira (Spirulina) platensis (Nords) Gomont в зависимости от температуры дегидратации при переводе в состояние ангидробиоза // Вопросы современной альгологии. 2018. № 1(16). http://algology.ru/1258
Шлегель Г. Общая микробиология. М.: Мир, 1987. 566 с.
Bratbak G., Kemp P.F., Sherr B.F., Sherr E.B., Cole J.J. Microscope methods for measuring bacterial biovolume: Epifluorescence microscopy, scanning electron microscopy, and transmission electron microscopy // Handbook of Methods in Aquatic Microbial Ecology / Eds. Cole J.J. Boca Raton: CRC Press, 1993. Ch. 36. P. 309–317. https://doi.org/10.1201/9780203752746
Ciferri O. Spirulina, the edible microorganism // Microbiol. Rev. 1983. V. 47. P. 551‒578.
Falquet J., Hurni J.P. Spiruline Aspects Nutritionnels. Antenna Technologies, 2006. 41 p.
Faucher O., Coupal B., Leduy A. Utilization of scawater – urea as a culture medium for Spirulina maxima // Can. J. Microbiol. 1979. V. 25. P. 752.
Kallmeyer J., Smith D.C., Spivac A.J., D’Hondt S. New cell extraction procedure applied to deep subsurface sediments // Limnol. Oceanogr. Methods. 2008. V. 6. P. 236–245.
Kannaujiya V.K., Sinha R.P. Thermokinetic stability of phycocyanin and phycoerythrin in food-grade preservatives // J. Appl. Phycol. 2016. V. 28. P. 1063–1070. https://doi.org/10.1007/s10811-015-0638-x
Liu Q., Huang Y., Zhang R., Cai T., Cai Y. Medical application of Spirulina platensis derived C-phycocyanin // Evid. Based Complement. Alternat. Med. 2016. V. 2016. 14 p. Art. 7803846. https://doi.org/10.1155/2016/7803846
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J.P. Protein measurement with folin phenol reagent // J. Biol. Chem. 1951. V. 193. P. 265–275.
Lunau M., Lemke A., Walther K., Martens-Habbena W., Simon M. An improved method for counting bacteria from sediments and turbid environments by epifluorescence microscopy // Environ. Microbiol. 2005. V. 7. P. 961–968.
Mogale M. Identification and quantification of bacteria associated with cultivated Spirulina and impact of physiological factors. University of Cape Town, 2016. http://hdl.handle.net/11427/22921
Nalage D., Khedkar G., Kalyankar A., Sarkate A., Ghodke S., Bedre V.B., Khedkar C.D. Single cell proteins // The Encyclopedia of Food and Health / Eds. Caballero B., Finglas P., Toldra F. London, UK: Oxford, Academic Press, 2016. V. 4. P. 790‒794.
Rowan K.S. Photosynthetic Pigments of Algae. Cambridge: Cambridge Univ. Press, 1989. 334 p.
Vardaka E., Kormas K.A., Katsiapi M., Genitsaris S., Moustaka-Gouni M. Molecular diversity of bacteria in commercially available “Spirulina” food supplements // PeerJ. 2016. V. 4. P. 1610.
Velji M.I., Albright L.J. Microscopic enumeration of attached marine bacteria of seawater, marine sediment, fecal matter and kelp blade samples following pyrophosphate and ultrasound treatments // Can. J. Microbiol. 1986. V. 32. P. 121–126.
Vonshak A. (ed.) Spirulina platensis (Arthrospira). Physiology, Cell-Biology and Biotechnology. CRC Press, 1997. 233 p.
Дополнительные материалы отсутствуют.


