Микробиология, 2023, T. 92, № 1, стр. 24-30
Leucosporidium Egoroviorum f.a., sp. nov., новый вид дрожжевых грибов, выделенный из кабачков
А. В. Качалкин a, b, *, А. М. Глушакова a, c, М. А. Томашевская b
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
b Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН
142290 Пущино, Россия
c НИИ вакцин и сывороток им. И.И. Мечникова
105064 Москва, Россия
* E-mail: kachalkin_a@mail.ru
Поступила в редакцию 17.08.2022
После доработки 26.08.2022
Принята к публикации 26.08.2022
- EDN: NMDAEF
- DOI: 10.31857/S0026365622600638
Аннотация
Новый анаморфный вид базидиомицетовых дрожжей Leucosporidium egoroviorum f.a., sp. nov. выделен в качестве эндофита из плодов Cucurbita pepo subsp. pepo (кабачок). По своим генетическим, физиологическим и морфологическим характеристикам новый вид принципиально отличается от близкородственных видов L. fellii, L. intermedium и L. krtinense. Голотип нового вида – КБП Y-6804T, сохранен в метаболически неактивном состоянии, культуры изотипа: ВКМ Y-3065, DSM 113574 и CBS 17590; регистрация таксона в базе MycoBank MB 842805.
В ходе изучения дрожжевого населения внутренних частей плодов сельскохозяйственных культур отечественного и импортного производства было обнаружено значительное количество эвритопных видов дрожжей с эндофитным образом жизни, развитие которых во внутренних тканях идет бессимптомно (Качалкин и соавт., 2021; Kachalkin et al., 2021). При выполнении исследования также были выделены и описаны новые виды, которые к настоящему времени известны только как обитатели сельскохозяйственных плодов: Cyberlindnera dauci, Metschnikowia taurica, Vishniacozyma phoenicis и Yamadazyma cocois (Crous et al., 2020a, 2020b, 2021; Maksimova et al., 2020). Помимо этого, обнаружен широко распространенный в плодах вид Kwoniella endophytica, находки которого в других местообитаниях также неизвестны (Crous et al., 2018).
Среди известных ранее видов дрожжей, из плодов Cucurbita pepo subsp. pepo (кабачок) были выделены непигментированные штаммы одноклеточных базидиомицетовых дрожжевых грибов, не продуцирующие крахмалоподобные соединения и не ассимилирующие инозит, с максимальной температурой роста 26°C. Видовая идентификация культур на основании нуклеотидных последовательностей ITS-региона рДНК показала, что они относятся к неизвестному ранее виду рода Leucosporidium.
Род Leucosporidium был описан при исследовании штаммов антарктических гетеробазидиомицетов (Fell et al., 1969). К настоящему времени к роду Leucosporidium относят не только телеоморфные формы дрожжей, но и родственные им анаморфы. Всего в роде 12 видов, которые, в большинстве своем, являются психротолерантными или психрофильными организмами и обнаруживаются в почве, на растительном материале и в морской среде, в высоких и умеренных широтах (Yurkov et al., 2012; Laich et al., 2014; de García et al., 2015; Mašínová et al., 2017; Crous et al., 2019). Дрожжи рода Leucosporidium являются биотехнологически значимыми микроорганизмами, как источник внеклеточных низкотемпературных ферментов, а также они обладают способностью к биодеградации фенольных соединений (de García et al., 2015).
В данной работе публикуется описание нового вида рода Leucosporidium.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
В сентябре 2021 г. были исследованы шесть кабачков из Владимирской области в период их зрелости и не имеющие нарушения покровных тканей. Поверхность плодов с целостностью покровных тканей, перед посевом обрабатывали 70% этанолом и 2% раствором гипохлорита натрия с последующим удалением остатков растворов стерильной дистиллированной водой (Gai et al., 2009). После снятия покровных тканей стерильным скальпелем, вырезали участки внутренних тканей, измельчали и заливали стерильной водой в соотношении 1 : 10. Полученные суспензии обрабатывали на вортексе MultiReax (“Heidolph”, Германия) в течение 15 мин на скорости 2000 об./мин и высевали в трехкратной повторности на агаризованную глюкозо-пептонно-дрожжевую среду (GPYA) с хлорамфениколом. Чашки инкубировали при 22‒24°C в течение недели. Выросшие дрожжевые колонии учитывали дифференцированно на основании макро- и микроморфологических характеристик, представители морфогрупп были выделены в чистую культуру для видовой идентификации. Видовую идентификацию дрожжевых грибов проводили на основе анализа нуклеотидной последовательности ITS-региона рДНК. Выделение ДНК и постановку ПЦР проводили по ранее описанной методике (Glushakova, Kachalkin, 2017). Секвенирование ДНК осуществляли с помощью набора реактивов Big Dye Terminator V3.1 Cycle Sequencing Kit (“Applied Biosystems”, США) с последующим анализом продуктов реакции на секвенаторе Applied Biosystems 3130xl Genetic Analyzer в ЗАО “Евроген” (Москва). Для секвенирования был использован праймер ITS5 (5'-GGA AGT AAA AGT CGT AAC AAG G). Идентификацию дрожжей на основании полученных результатов секвенирования проводили, используя данные генбанка NCBI (www.ncbi.nlm.nih.gov) и базы данных MycoID (www.mycobank.org).
Для расширенной генетической характеристики нового вида дрожжевых грибов были исследованы последовательности других генов, а именно 18S (SSU) и D1/D3 домены 26S (LSU) рРНК, TEF1, RPB1 и RPB2. Апмлификация и секвенирование генов выполнялись с использованием следующих праймеров: LR5, NS1 и NS8, RPB1-Af и RPB1-Cr, RPB2-7cR и RPB2-5F, EF-983f и EF-2218r (подробнее данные указаны в работе Kachalkin et al., 2021). Сборку нуклеотидных последовательностей осуществляли с помощью программного обеспечения DNA Baser Sequence Assembler 4 (“Heracle BioSoft S.R.L.”). Для построения филогенетического дерева выравнивание нуклеотидных последовательностей для типовых культур осуществляли с использованием онлайн-версии алгоритма MAFFT (Katoh et al., 2019). Филогенетическое дерево для выравненных последовательностей ITS и D1/D2 регионов рДНК было построено в программе MEGA6 (Tamura et al., 2013) с использованием метода максимального правдоподобия на основе модели GTR с гамма-распределением инвариантных сайтов для 1000 альтернативных построений.
Штаммы нового вида были морфологически и физиологически охарактеризованы стандартными методами на твердых и жидких средах (Kurtzman et al., 2011).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе проведенного исследования дрожжевые грибы были обнаружены во всех исследованных образцах мякоти кабачков, их средняя численность составила 1.3 × 103 КОЕ/г. Проведенная видовая идентификация выделенных из кабачков штаммов дрожжей показала достаточно высокое разнообразие обнаруживаемых внутри дрожжей. Всего было выделено и идентифицировано 13 видов: Aureobasidium pullulans (относительное обилие – 17.26%), Barnettozyma californica (0.13%), Candida parapsilosis (6.12%), C. sake (2.41%), Cystofilobasidium infirmominiatum (9.24%), Debaryomyces hansenii (1.17%), Hanseniaspora uvarum (5.04%), Metschnikowia pulcherrima (7.67%), Papiliotrema flavescens (0.24%), Rhodotorula babjevae (1.21%), Rh. mucilaginosa (24.83%), Vishniacozyma victoriae (1.21%), а также дрожжи рода Leucosporidium (23.47%). Отдельно стоит отметить, что обнаруженные внутри мякоти дрожжи являются, в большинстве своем, типичными обитателями почвенно-растительных субстратов, а также эвритопными видами, ранее часто обнаруживаемыми и в других сельскохозяйственных плодах (Чернов и соавт., 2013; Kachalkin et al., 2021). Вероятнее всего, как было показано ранее, для многих дрожжевых грибов не составляет труда проникать во внутренние ткани плодов из внешней среды (Infante et al., 2012). Именно этим можно объяснить и находку в качестве эндофитов типичного почвенного вида B. californica, а также синантропного контаминанта почв – Candida parapsilosis.
Среди доминирующих видов в мякоти кабачков были обнаружены дрожжи рода Leucosporidium. Как было отмечено ранее, дрожжи данного рода являются психротолерантными или психрофильными организмами, которые обнаруживаются часто в почве и в разлагающемся растительном материале. Ранее нами были сделаны находки другого вида данного рода – L. scottii – в качестве минорного компонента в мякоти яблок, груш и в кизиле из Подмосковья и в г. Москве (неопубликованные данные). Достаточно высокая доля в сообществе кабачков дрожжей рода Leucosporidium позволяет предположить, что именно из почвы эти дрожжи и попали в мякоть исследованных плодов.
Из разных образцов кабачков были выделены и исследованы три штамма рода Leucosporidium: КБП Y-6804, КБП Y-6805 и КБП Y-6806 (табл. 1). Для всех культур было проведено секвенирование регионов ITS1-5.8S-ITS2 (ITS регион) и D1/D3 доменов LSU, которое показало конспецифичность исследованных штаммов. Для штамма КБП Y-6804, помимо основных генетических маркеров, были получены нуклеотидные последовательности SSU региона рДНК и генов TEF1, RPB1, RPB2, которые были ранее исследованы для ряда других видов рода (Wang et al., 2015).
Таблица 1.
Информация об исследованных штаммах
| Штамм | Номера в других коллекциях | Нуклеотидные последовательности | ||||
|---|---|---|---|---|---|---|
| ITS-LSU | SSU | TEF1 | RPB1 | RPB2 | ||
| КБП Y-6804Т | ВКМ Y-3065 DSM 113574 CBS 17590 | OM038460 | OM033544 | OV309161 | OV309162 | OV309163 |
| КБП Y-6805 | ВКМ Y-3066 | OM038461 | – | – | – | – |
| КБП Y-6806 | ВКМ Y-3067 | OM038462 | – | – | – | – |
Результаты поиска полученных нуклеотидных последовательностей по генбанку NCBI показали, что по ITS-региону наибольшее сходство (93.99%) с видом L. fellii (CBS 7287T, GenBank NR_073276; 30 замен, включая семь делеций), по данным LSU – наибольшее сходство (98.60%) с L. intermedium (CBS 11759, GenBank KY108447; 12 замен и одна делеция), по SSU – сходство 99.10% с L. fellii (JCM 9887T, GenBank NG_063541; 15 замен, включая семь делеций), по TEF1 – сходство 89.65% с L. fellii (JCM 9887T, GenBank KJ707784; 113 замен, включая 18 делеций), по RPB1 – сходство 80.54% с L. fellii (JCM 9887T, GenBank KJ708030; 65 замен, включая 3 делеции), и по данным RPB2 – сходство 78.61% с L. golubevii (CBS 9651T, GenBank KJ708185; 151 замена, включая 21 делецию). Таким образом, полученные результаты по сравнению основных и дополнительных генетических маркеров указывают, что исследованные культуры принадлежат к новому виду рода Leucosporidium (Vu et al., 2016).
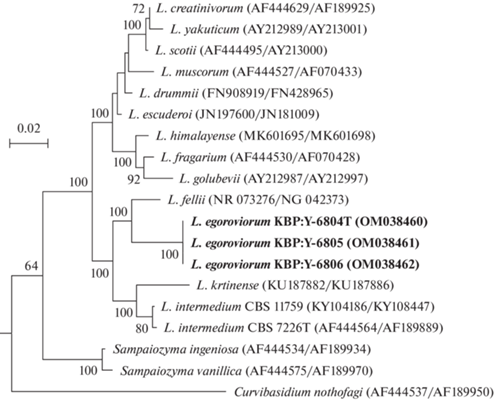
Филогенетическое положение вида L. egoroviorum sp. nov. продемонстрировано с использованием филогении на основе нуклеотидных последовательностей ITS и LSU регионов рДНК (Yurkov et al., 2012; Laich et al., 2014; Mašínová et al., 2017; Crous et al., 2019). Полученные результаты показали, что штаммы нового вида формируют хорошо поддержанный клад вместе телеоморфными видами L. fellii и L. intermedium, а также с анаморфным видом L. krtinense (рис. 1).
Рис. 1.
Филогенетическое положение L. egoroviorum f.a., sp. nov. и других видов рода Leucosporidium на основе последовательностей ITS и LSU регионов рДНК. В скобках указаны номера нуклеотидных последовательностей GenBank. Rhodotorula toruloides (AF444489/AF070426) – скрытая внешняя группа.
Штаммы нового вида были морфологически и физиологически охарактеризованы с помощью стандартных методов на твердой и жидкой средах. Проведенные тесты на скрещивание на разных средах (глюкозо-пептонный агар – GPYA, солодовый агар – MEA, картофельно-декстрозный агар – PDA, кукурузный агар – CMA и морфологический агар) в течение трех месяцев при 10 и 22°C не дали никаких результатов. Описание нового вида выполняется на анаморфных культурах с обозначением forma asexualis (f.a.), согласно опубликованным рекомендациям (Lachance, 2012). В будущем, при обнаружении новых изолятов, возможно, удастся изучить полный жизненный цикл нового вида и описать его совершенную форму.
Новый вид заметно отличается по физиологическим тестам от близкородственных видов рода (табл. 2). На основании физиологических тестов новый вид наиболее близок (7 отличий) к L. fellii, а с другими филогенетически близкими видами число отличий значительно больше (по данным Kurtzman et al., 2011; Mašínová et al., 2017).
Таблица 2.
Отличительные физиологические характеристики L. egoroviorum f.a., sp. nov.
| L. egoroviorum f.a., sp. nov. | L. fellii | L. intermedium | L. krtinense | |
|---|---|---|---|---|
| Ассимиляция: | ||||
| Инулин | – | – | – | + |
| Сахароза | – | – | + | + |
| D-галактоза | – | – | + | + |
| Трегалоза | + | + | V | + |
| Мальтоза | + | – | V | + |
| Мелецитоза | + | – | – | + |
| Целлобиоза | + | + | + | – |
| Салицин | + | + | – | – |
| L-сорбоза | + | + | V | D |
| L-рамноза | + | + | – | – |
| D-ксилоза | – | + | – | + |
| L-арабиноза | – | – | – | + |
| D-арабиноза | S | + | – | – |
| D-рибоза | W | – | V | D |
| Этанол | + | – | + | + |
| Рибит | W | + | – | + |
| Молочная кислота | W | – | + | D |
| D-глюкозамин | W | + | – | – |
| Нитраты | + | + | – | + |
| Кадаверин | – | ? | + | + |
| Рост при/c: | ||||
| 50% глюкозы | + | ? | – | ? |
| 10% NaCl и 5% глюкозы | + | ? | – | W |
| 0.01% циклогексимида | – | + | – | + |
| 0.1% циклогексимида | – | + | – | + |
| Без витаминов | + | + | + | – |
| 25°C | + | + | – | + |
| 30°C | – | – | – | + |
Несмотря на филогенетическую и физиологическую близость L. egoroviorum f.a., sp. nov. к виду L. fellii, культуры заметно различаются по форме и размеру клеток. Клетки L. fellii вытянутые, сигаровидные, длиной 7‒17 мкм (Kurtzman et al., 2011), а у нового вида более короткие, овальные, размером до 9 мкм (рис. 2). Кроме того, отличительной характеристикой нового вида является наличие на некоторых клетках коротких монополярных стебельков-конидиофоров с почкой, схожей с баллистоспорой. Однако тесты на образование баллистоспор, которые формируются у близкородственной культуры L. intermedium, показали, что у нового вида почкование идет без отстрела.
Рис. 2.
Leucosporidium egoroviorum f.a., sp. nov., штамм КБП Y-6804Т: дрожжевые клетки на среде MEA (через 7 сут при 21°C). Масштабная линейка – 5 мкм.

Таким образом, на основании генетических, физиологических и морфологических характеристик выделенные штаммы заметно отличаются от других видов рода Leucosporidium, что дает основание описать их как новый вид.
Описание нового вида Leucosporidium egoroviorum Kachalkin, A.M. Glushakova & M.A. Tomashevskaya, f.a., sp. nov.
Назван в честь двух российских ученых – микробиолога и биохимика Московского государственного университета им. М.В. Ломоносова – Н.С. Егорова (1921‒2021) и С.Н. Егорова (1948‒2021).
На глюкозо-пептоновом агаре (GPYA) и 5% солодовым агаре (MEA) через 7 сут культивирования при 21°C, штрих цвета слоновой кости, гладкий, полуглянцевый, с ровным краем. Клетки от овальных до эллипсовидных (2.0‒5.0 × 4.0‒9.0 мкм), встречаются поодиночке, парами или в небольших скоплениях и коротких цепочках, размножаются полярным почкованием, часто демонстрируя почкование на коротком или удлиненном (до 3.5 мкм длиной) монополярном стебельке. В старых культурах на GPYA и картофельно-декстрозном агаре (PDA) могут присутствовать шаровидные клетки. В клетках присутствуют липидоподобные тела. Плохо развитый псевдомицелий образуются редко. Половые структуры, истинный мицелий и баллистоконидии обнаружены не были после культивирования в течение трех месяцев при 10 и 21°C (чистые культуры и в тесте на скрещивание) на средах GPYA, MEA, PDA, кукурузном агаре (CMA) и морфологическом агаре. Глюкозу не сбраживает. Ассимилирует следующие источники углерода: глюкоза, мальтоза, целлобиоза, трегалоза, мелезитоза, D-арабиноза (медленно), D-рибоза (слабо), L-рамноза, D-глюкозамин (слабо), этанол, глицерин, рибитол (слабо), D‑маннитол, D-глюцитол, салицин, DL-молочная кислота (слабо), янтарная кислота, лимонная кислота, 2-кето-D-глюконат, 5-кето-D-глюконат, D-глюкуронат (слабо) и арбутин. Не растет на галактозе, L-сорбозе, лактозе, сахарозе, мелибиозе, раффинозе, инулине, растворимом крахмале, D-ксилозе, L-арабинозе, метаноле, эритрите, галактитоле, инозите, метил-α-D-глюкозиде. Ассимиляция азотных соединений: положительная для сульфата аммония, нитрата калия и L-лизина, отрицательная для кадаверина. Рост на безвитаминной среде, на среде с 50% глюкозы и 0.5% дрожжевого экстракта, а также на среде MEA с 10% NaCl положительный. Рост с 0.01 и 0.1% циклогексимида отрицательный. Крахмалоподобные соединения не образует. Окраска диазониевым синим В и уреазная реакция положительны. Максимальная температура роста 26°C.
Типовой штамм выделен как эндофит из мякоти кабачка (Cucurbita pepo subsp. pepo) из Владимирской области (Россия) в сентябре 2021 г. А.М. Глушаковой (голотип КБП Y-6804Т, сохранен в метаболически неактивном состоянии в коллекции дрожжей кафедры биологии почв МГУ (WDCM 1173), изотипы: ВКМ Y-3065, DSM 113574 и CBS 17590; нуклеотидные последовательности ITS-D1/D3 доменов LSU рДНК, SSU, генов TEF1, RPB1 и RPB2 размещены в генбанке NCBI: OM038460, OM033544, OV309161, OV309162 и OV309163; регистрация таксона в базе MycoBank MB 842805).
Description of Leucosporidium egoroviorum Kachalkin, A.M. Glushakova & M.A. Tomashevskaya, f.a., sp. nov.
Named in honour of two Russian scientists, microbiologist and biochemist at the Lomonosov Moscow State University, Nikolay S. Egorov (1921–2021) and Sergey N. Egorov (1948–2021).
On glucose peptone yeast extract agar (GPYA) and 5% malt extract agar (MEA), after 7 d at 21°C, streak is ivory coloured, smooth and semi-glossy, with an entire margin. Cells are subglobose to ellipsoidal (2.0–5.0 × 4.0–9.0 μm), occurring singly, in pairs or in small clusters and short chains, dividing by polar budding, often showing budding on short or elongated monopolar stalk (up to 3.5 μm long). Globose cells may be present in older cultures on GPYA and potato dextrose agar (PDA). Lipid-like bodies presents in cells. Poorly developed pseudohyphae are rarely formed. Sexual structures, true hyphae and ballistoconidia have not been observed during 3 months at 10 and 21°C in culture (pure cultures and in mating test) grown on GPYA, MEA, PDA, cornmeal agar (CMA) and yeast morphology agar. Glucose is not fermented. Glucose, maltose, cellobiose, trehalose, melezitose, D-arabinose (slow), D-ribose (weak), L-rhamnose, D-glucosamine (weak), ethanol, glycerol, ribitol (weak), D-mannitol, D-glucitol, salicin, DL-lactic acid (weak), succinic acid, citric acid, 2-keto-D-gluconate, 5‑keto-D-gluconate, D-glucuronate (weak) and arbutin are assimilated; no growth occurs on galactose, L-sorbose, lactose, sucrose, melibiose, raffinose, inulin, soluble starch, D-xylose, L-arabinose, methanol, erythritol, galactitol, myo-inositol, methyl α-D-glucoside. Assimilation of nitrogen compounds: positive for ammonium sulphate, potassium nitrate and L-lysine, and negative for cadaverine. Growth on vitamin-free medium, on 50% w/w glucose/yeast extract (0.5%) agar, on MEA with 10% NaCl is positive. Growth with 0.01 and 0.1% cycloheximide is negative. Starch-like compounds are not produced. Diazonium blue B colour and urease reactions are positive. Maximum growth temperature is 26°C.
Typus. Russia, Vladimir oblast, isolated as endophyte from the pulp of marrow squash (Cucurbita pepo subsp. pepo ), Sep. 2021, A.M. Glushakova (holotype KBP Y-6804T, preserved in a metabolically inactive state in the Yeast collection of Department of Soil Biology of Lomonosov Moscow State University (WD-CM 1173), isotypes: VKM Y-3065, DSM 113574, and CBS 17590; ITS-D1/D3 domains of LSU nrDNA, SSU, TEF1, RPB1 and RPB2 sequences GenBank OM038460, OM033544, OV309161, OV309162 and OV309163; MycoBank MB 842805).
Список литературы
Качалкин А.В., Глушакова А.М., Стрелецкий Р.А., Савченко В.Е., Венжик А.С. Эндофитные дрожжи в плодах сельскохозяйственных культур // 3-й Российский микробиологический конгресс (г. Псков, 26 сентября–1 октября 2021 г.): Материалы конгресса. Псков: ООО Конкорд, 2021. С. 29–30.
Чернов И.Ю., Глушакова А.М., Качалкин А.В. Аннотированный список видов дрожжей Московского региона // Микология и фитопатология. 2013. Т. 47. С. 103‒115.
Crous P.W., Carnegie A.J., Wingfield M.J., Sharma R., Mughini G. et al. Fungal Planet description sheets: 868–950 // Persoonia. 2019. V. 42. P. 291‒473.
Crous P.W., Cowan D.A., Maggs-Kölling G., Yilmaz N., Larsson E. et al. Fungal Planet description sheets: 1112–1181 // Persoonia. 2020a. V. 45. P. 251–409.
Crous P.W., Cowan D.A., Maggs-Kölling G., Yilmaz N., Thangavel R. et al. Fungal Planet description sheets: 1182–1283 // Persoonia. 2021. V. 46. P. 313–528.
Crous P.W., Luangsa-ard J.J., Wingfield M.J., Carnegie A.J., Hernández-Restrepo M. et al. Fungal planet description sheets: 785–867 // Persoonia. 2018. V. 41. P. 238‒417.
Crous P.W., Wingfield M.J., Chooi Y.-H., Gilchrist C.L.M., Lacey E. et al. Fungal Planet description sheets: 1042–1111 // Persoonia. 2020b. V. 44. P. 301–459.
de García V., Coelho M.A., Maia T.M., Rosa L.H., Vaz A.M. et al. Sex in the cold: taxonomic reorganization of psychrotolerant yeasts in the order Leucosporidiales // FEMS Yeast Res. 2015. V. 15. Art. fov019. P. 1–12.
Fell J.W., Statzell A., Hunter I.L., Phaff H.J. Leucosporidium gen. nov. The heterobasidiomycetous stage of several yeasts of the genus Candida // Antonie van Leeuwenhoek. 1969. V. 35. P. 433–462.
Gai C.S., Lacava P.T., Maccheroni W., Jr., Glienke C., Araujo W.L., Miller T.A., Azevedo J.L. Diversity of endophytic yeasts from sweet orange and their localization by scanning electronmicroscopy // J. Basic Microbiol. 2009. V. 49. P. 441–451.
Glushakova A.M., Kachalkin A.V. Endophytic yeasts in Malus domestica and Pyrus communis fruits under anthropogenic impact // Microbiology (Moscow). 2017. V. 86. P. 128–135.
Infante E., Marquinez X., Moreno G. Tomato peel (Solanum lycopersicum L.) colonization by the endophyte yeast Candida guilliermondii (Castellani) Langeron et Guerra // Agronomía Colombiana. 2012. V. 30. P. 388–394.
Kachalkin A.V., Abdullabekova D.A., Magomedova E.S., Yurkov A.M. Zygotorulaspora dagestanica sp. nov., a novel ascomycetous yeast species associated with the Georgian honeysuckle (Lonicera iberica M. Bieb.) // Int. J. Syst. Evol. Microbiol. 2021. V. 71. Art. 004785. P. 1‒6.
Kachalkin A.V., Glushakova A.M., Venzhik A.S. Presence of clinically significant endophytic yeasts in agricultural crops: monitoring and ecological safety assessment // IOP Conf. Series: Earth and Environmental Science. 2021. V. 723. Art. 042005. P. 1–6.
Katoh K., Rozewicki J., Yamada K.D. MAFFT online service: multiple sequence alignment, interactive sequence choice and visualization // Brief Bioinform. 2019. V. 20. P. 1160–1166.
Kurtzman C.P., Fell J.W., Boekhout T., Roberts V. Methods for isolation, phenotypic characterization and maintenance of yeasts // The Yeasts: A Taxonomic Study / Eds. Kurtzman C.P., Fell J.W. and Boekout T. Amsterdam: Elsevier Science, 2011. P. 87–110.
Kurtzman C.P., Fell J.W., Boekhout T. (eds.). The Yeasts: A Taxonomic Study, Elsevier, 2011, 5th ed.
Lachance M.A. In defense of yeast sexual life cycles: the forma asexualis: an informal proposal // Yeast Newsl. 2012. V. 61. P. 24–25.
Laich F., Chávez R., Vaca I. Leucosporidium escuderoi f.a., sp. nov., a basidiomycetous yeast associated with an Antarctic marine sponge // Antonie van Leeuwenhoek. 2014. V. 105. P. 593‒601.
Maksimova I.A., Glushakova A.M., Thanh V.N., Kachalkin A.V. Yamadazyma cocois f.a., sp. nov., an ascomycetous yeast isolated from coconuts // Int. J. Syst. Evol. Microbiol. 2020. V. 70. P. 3491‒3496.
Mašínová T., Pontes A., Carvalho C., Sampaio J.P., Baldrian P. Libkindia masarykiana gen. et sp. nov., Yurkovia mendeliana gen. et sp. nov. and Leucosporidium krtinense f.a. sp. nov., isolated from temperate forest soils // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 902‒908.
Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA6: molecular evolutionary genetics analysis version 6.0 // Mol. Biol. Evol. 2013. V. 30. P. 2725–2729.
Vu D., Groenewald M., Szöke S., Cardinali G., Eberhardt U. et al. DNA barcoding analysis of more than 9000 yeast isolates contributes to quantitative thresholds for yeast species and genera delimitation // Stud. Mycol. 2016. V. 85. P. 91–105.
Wang Q.M., Groenewald M., Takashima M., Theelen B., Han P.J. et al. Phylogeny of yeasts and related filamentous fungi within Pucciniomycotina determined from multigene sequence analyses // Stud. Mycol. 2015. V. 81. P. 27‒53.
Yurkov A.M., Schäfer A.M., Begerow D. Leucosporidium drummii sp. nov., a member of the Microbotryomycetes isolated from soil // Int. J. Syst. Evol. Microbiol. 2012. V. 62. P. 728‒734.
Дополнительные материалы отсутствуют.


