Микробиология, 2023, T. 92, № 1, стр. 77-85
Влияние атранов на рост Rhodococcus qingshengii VKM Ac-2784D в присутствии различных источников углерода и на его способность к разложению нафталина
Л. А. Беловежец a, *, Ю. А. Маркова b, А. А. Левчук a, Е. Н. Оборина a, С. Н. Адамович a
a Иркутский институт химии им. А.Е. Фаворского СО РАН
664033 Иркутск, Россия
b Сибирский институт физиологии и биохимии растений СО РАН
664033 Иркутск, Россия
* E-mail: lyu-sya@yandex.ru
Поступила в редакцию 12.05.2022
После доработки 27.05.2022
Принята к публикации 06.06.2022
- EDN: NNLXFM
- DOI: 10.31857/S0026365622600390
Аннотация
Rhodococcus qingshengii VKM Ac-2784D, выделенный из ризосферы пырея, является перспективным нефтедеструктором. Для увеличения его биотехнологического потенциала было изучено влияние атранов (потенциальных стимуляторов роста) на рост и деструкцию нафталина данным микроорганизмом. Показано, что сила и характер влияния исследуемых атранов на все изучаемые параметры функционирования R. qingshengii VKM Ac-2784D зависят от природы источника углерода: внесение атранов в богатую питательную среду БТН практически не влияло на скорость роста бактерий; в минеральной среде 8Е и в среде 8Е с глюкозой происходила кратковременная активация роста, характеризующаяся сокращением лаг-фазы; в присутствии нафталина данные соединения действовали на прирост популяции R. qingshengii VKM Ac-2784D преимущественно негативно. Исследованные атраны оказывали неблагоприятное воздействие на скорость разложения нафталина R. qingshengii VKM Ac-2784D, а также снижали гидрофобность клеточной стенки и синтез внеклеточных биосурфактантов. Предполагается, что исследованные соединения будут негативно влиять на скорость разложения нефти данным микроорганизмом.
Род Rhodococcus объединяет преимущественно непатогенные микроорганизмы (Ившина и соавт., 2021), широко распространенные во внешней среде. В большинстве своем это почвенные микроорганизмы, но отдельные представители высеваются из шламовых вод и очистных сооружений промышленных предприятий (Krivoruchko et al., 2019; Ившина и соавт., 2021). Это связано со способностью родококков метаболизировать большой спектр соединений, включая поллютанты. Известно разложение родококком таких соединений, как диклофенак, бетулин, дротаверин (Шаханов и соавт., 2019; Ившина и соавт., 2021). Все это обусловливает использование родококков в биотехнологических процессах, одним из которых является нефтедеструкция. Родококки входят в состав некоторых микробиологических препаратов для очистки почв от нефти и ее компонентов (Рогозина и соавт., 2010, Ерофеевская, Чернявский, 2016). Недостатком таких препаратов является относительно медленный рост и набор биомассы родококками. Поэтому для введения этих микроорганизмов в производство перспективно применять вещества, стимулирующие их рост.
Ранее в ИрИХ СО РАН были синтезированы вещества атрановой природы, у которых обнаружен стимулирующий эффект для ряда микроорганизмов (Adamovich, 2019). Атраны, как класс соединений, был открыт в Институте химии им. А.Е. Фаворского СО РАН. Несмотря на очевидный биологический потенциал данного класса соединений, наиболее широко изучены кремний-содержащие атраны (силатраны) (Воронков, Барышок, 2005, Леменовский и соавт., 2008).
Поэтому представляло интерес исследовать влияние атранов на рост культуры R. qingshengii VKM Ac-2784D и способность этих бактерий к деструкции компонентов нефти на примере нафталина.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Rhodococcus qingshengii VKM Ac-2784D (Petrushin et al., 2021) (ранее R. erythropolis VKM Ac-2784D) выделен из ризосферы пырея ползучего (Elytrigia repens (L.) Nevski), произрастающего на нефтезагрязненной территории Заларинского района Иркутской области (Третьякова и соавт., 2015). Штамм входит в состав запатентованных препаратов для биоремедиации почв от нефти и защиты растений, произрастающих в неблагоприятных условиях (Беловежец и соавт., 2019).
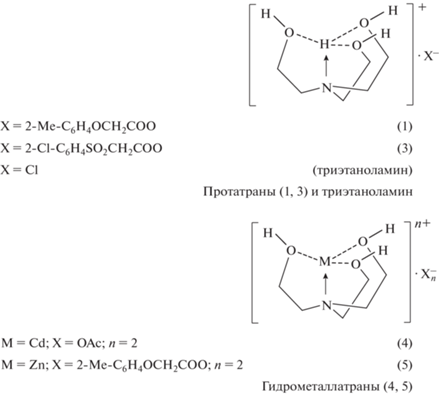
Для исследования были выбраны протатраны (соединения 1 и 3) и гидрометаллатраны (соединения 4 и 5) (рис. 1). В качестве контроля был выбран триэтаноламин (ТЭА), являющийся исходным соединением для их синтеза. Исследуемые вещества представляют собой бесцветные нетоксичные (LD50 = 1300‒6000 мг/кг) низкоплавкие порошки, устойчивые при хранении, хорошо растворимые в воде, спирте и в других органических растворителях. Их состав и строение полностью подтверждены методами элементного анализа, ИК-, 1Н, 13С, 15N ЯМР-спектроскопии, масс-спектрометрии и рентгеновской дифрактометрии (Adamovich, 2019). Чистота исследуемых соединений составляла до 99.87%.
Определение минимальной ингибирующей концентрации (МИК) атранов для штамма R. qingshengii VKM Ac-2784D проводили стандартным диск-диффузионным методом (Решедько, Cтецюк, 2001) на ГРМ-агаре (Оболенск, Россия).
Для изучения влияния атранов на рост штамма R. qingshengii VKM Ac-2784D и биодеградацию нафталина проводили культивирование в колбах и планшетах на качалке в течение 7 сут. Для инокуляции использовали смывы средой 8Е двухсуточной агаровой культуры. Для культивирования использовали максимально сбалансированную по углероду и азоту богатую питательную среду БТН-бульон (ООО “Биотехновация”, Россия) и минеральную питательную среду 8Е следующего состава (г/л): NH4NO3 ‒ 1.0; MgCl2 ‒ 0.1; KH2PO4 ‒ 3.0; K2HPO4 ‒ 7.0; CaCO3 ‒ 1.0; pH 7.0. В качестве источника углерода в среду 8Е вносили 0.5% глюкозы или нафталина (“СКМ”, Россия).
Показатель гидрофобности бактериальных клеток определяли по методу, описанному в работе (Серебрякова и соавт., 2002). Суспензию клеток микроорганизма, выращенную в питательной среде 8Е с добавлением глюкозы или гексадекана (в концентрации 0.5%) в виде единственного источника углерода, встряхивали с гексаном (в соотношении 1 : 1), затем определяли ОП (λ = 530 нм) водной фазы. Контролем служила стерильная питательная среда. Количество внеклеточных биосурфактантов определяли гравиметрически.
Процент разложения нафталина определяли, рассчитывая площадь пика с помощью ВЭЖХ (система Agilent 1260 Infinity II с диодно-матричным детектором) при двух длинах волн ‒ 280 и 272 нм. Чистота нафталина (“СКМ”, Россия) подтверждена хроматографически.
Градиент элюента отражен в табл. 1. Скорость потока 1 мл/мин, колонка Kromasil 100-5-C18 4.6 × × 150 мм, температура термостата колонки 30°С, объем ввода 10 мкл. В результате проведенных параллельных анализов были построены кривые и определены уравнения прямой линии тренда. Угловой коэффициент этого уравнения является характеристикой эффективности атрана.
Таблица 1.
Градиент элюента
| Время, мин | 2% уксусная кислота, % | Ацетонитрил, % |
|---|---|---|
| 0‒2 | 45 | 55 |
| 2‒3 | 45 | 55 |
| 3‒5.5 | 40 | 60 |
| 5.5‒7 | 40 | 60 |
| 7‒8 | 45 | 55 |
Эффективность биодеградации нафталина выражали в процентах, рассчитывая по формуле:
где Sk ‒ площадь пика нафталина контрольного образца, Ss ‒ площадь пика нафталина образца с добавкой атрана.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Несмотря на то, что некоторые атраны являются запатентованными стимуляторами роста микроорганизмов (Mirskova et al., 2016), мы сочли необходимым определить их минимальную ингибирующую концентрацию (МИК) для R. qingshengii VKM Ac-2784D. Показано, что МИК варьировала от 6 × 10–4 до 2.5 × 10–3 г/л в зависимости от конкретного соединения. Поэтому для дальнейших исследований были взяты концентрации выше и ниже МИК (10–3‒10–6 г/л).
На БТН-среде без внесения атранов фаза экспоненциального роста начиналась на 2 сут культивирования, а переход в стационарную фазу – после 4 сут (рис. 2). Рост на питательной среде с глюкозой характеризуется длительной (до 3 сут) лаг-фазой и небольшим приростом биомассы. Безуглеродная среда закономерно не дает возможности роста микроорганизма, давая отрицательную динамику численности до 4 сут культивирования, а прирост биомассы в данной среде минимальный. Интересно, что в присутствии нафталина в качестве единственного источника углерода практически отсутствует лаг-фаза, а фаза экспоненциального роста наступает уже на первые сутки культивирования. В то же время фаза стационарного роста быстро сменяется фазой снижения биомассы. Вероятно, это связано с быстрым исчерпанием источника углерода и переходом культуры в зону автолизиса.
Рис. 2.
Динамика роста R. qingshengii VKM Ac-2784D в зависимости от среды культивирования: (1) БТН; (2) 8Е; (3) 8Е с глюкозой; (4) 8Е с нафталином.

Внесение атранов в полную питательную среду (БТН-бульон) практически не оказало воздействия на прирост R. qingshengii VKM Ac-2784D. В 1-е сут культивирования наблюдалась активация роста под действием атрана 3 в концентрации 10–5 и 10–6 г/л, атрана 4 в концентрации 10–5 г/л и атрана 5 в концентрации 10–6 г/л. На рис. 3 представлены данные по влиянию атрана 3 как наиболее активного среди исследуемых соединений (рис. 3а). Таким образом, низкие концентрации атранов 3, 4 и 5 способны привести к сокращению лаг-фазы, однако в последующие сутки культивирования значимых отличий от контроля нами не зафиксировано. Следовательно, при избытке питательных веществ, атраны практически не влияют на скорость роста R. qingshengii VKM Ac-2784D.
Рис. 3.
Влияние атранов (на примере протатрана 3) на рост R. qingshengii VKM Ac-2784D в зависимости от среды культивирования: а – БТН; б – 8Е; в – 8Е с глюкозой; г – 8Е с нафталином. Обозначения: (1) контроль; (2) концентрация 10–6 г/л; (3) концентрация 10–5 г/л; (4) концентрация 10–4 г/л; (5) концентрация 10–3 г/л.

В среде 8Е все атраны показали сходное действие (рис. 3б). В 1-е сут атраны, вероятно, оказывали протективное действие, снижая степень отмирания клеток, о чем говорит менее резкое изменение оптической плотности. В течение эксперимента этот эффект нивелировался, и к концу культивирования рост клеток был значительно ниже контрольных значений. Исключением был атран 1 в концентрации 10–5 г/л, оказавший резко негативное влияние на популяцию бактерий. Действие атрана 3 в отсутствии углерода заключается в сокращении лаг-фазы, однако к 4 сут влияние исчезает, а в дальнейшем идет угнетение роста культуры. Причем нет четко выраженной фазы экспоненциального роста. Действие атрана 5 в безуглеродной среде заключается в сокращении лаг-фазы (максимально эффективна концентрация 10–5 г/л) и торможении дальнейшего роста культуры. Триэтаноламин, как и атраны, в 1-е сут не активировал рост бактерий. Таким образом, в данной среде происходило сокращение лаг-фазы, однако из-за отсутствия питательных веществ в среде данный эффект не сохранялся, и отмирание клеток в конце эксперимента превосходило данный показатель в контроле.
Влияние атранов в среде 8Е с глюкозой похоже на их влияние в голодной среде. В начале культивирования наблюдается скачок роста, связанный, вероятно, с сокращением лаг-фазы, а в конце культивирования для большинства атранов отличия от контроля были несущественны (рис. 3в). Некоторые исключения не влияют на общую тенденцию.
Совершенно другая картина наблюдалась при культивировании бактерий в среде 8Е, где в качестве единственного источника углерода использовался нафталин (рис. 3г). В данных условиях атраны не активировали рост бактерий в лаг-фазу; напротив, мы либо не наблюдали значимых отличий от контроля, либо прирост популяции R. qingshengii VKM Ac-2784D существенно снижался. На 4 и 7 сут культивирования было отмечено незначительное превышение прироста в варианте, обработанном атраном 3 в концентрации 10–4 г/л. Таким образом, в присутствии нафталина характер действия атранов значительно отличается от наблюдаемого в средах 8Е и 8Е с глюкозой; данные соединения действуют на прирост популяции R. qingshengii VKM Ac-2784D преимущественно негативно.
Для того чтобы микроорганизм мог успешно осуществлять разложение неполярных компонентов нефти, необходима выработка биологических поверхностно-активных веществ (биосурфактантов). Родококки способны синтезировать клеточно-связанные и внеклеточные сурфактанты, что позволяет им реализовать две стратегии разложения предельных углеводородов (Куюкина, 2006). Увеличение гидрофобности клеточной стенки, обусловленное присутствием клеточно-связанных сурфактантов, способствует адгезии клеток на поверхности нефтяных капель, а синтез внеклеточных биосурфактантов ‒ их эмульгированию.
Установлено, что атраны в концентрации 10–4 г/л существенно снижают гидрофобность клеточной стенки у бактерий, культивируемых в вышеуказанных средах (табл. 2). Это касается и синтеза внеклеточных биосурфактантов. Их количество в присутствии атранов в среднем вдвое меньше, чем в контроле. Исключение составляет атран 3 в среде с гексадеканом, в присутствии которого гидрофобность клеточной стенки была немного выше, чем в контроле.
Таблица 2.
Количество сурфактантов, продуцируемых R. qingshengii VKM Ac-2784D, и гидрофобность его клеточной стенки
| Параметр | Варианты опыта | ||||||
|---|---|---|---|---|---|---|---|
| контроль | протатраны | гидрометаллатраны | триэтаноламин | ||||
| 1 | 3 | 4 | 5 | ||||
| Внеклеточные сурфактанты, г/л | 0.418 | 0.286 | 0.185 | 0.29 | 0.267 | 0.281 | |
| Гидрофобность клеточной стенки, % | Гексадекан | 55.1 | 33.1 | 57.6 | 9.3 | 9.0 | 28.1 |
| Глюкоза | 45.6 | 4.5 | 0.95 | 20.5 | 20.2 | 13.2 | |
Так как исследуемый штамм родококка является эффективным нефтедеструктором, было необходимо оценить влияние атранов на скорость разложения углеводородов. Наиболее простой, удобный и информативный способ оценки – это использование модельных соединений ароматической составляющей нефти, в частности, нафталина (Василенко и соавт., 2008; Тимергазина, Переходова, 2012).
Установлено, что все исследуемые атраны, включая триэтаноламин, оказывали неблагоприятное воздействие на скорость разложения нафталина. Исключение составляют атраны 3, 4 и 5 в концентрации 10–6 г/л, эффективность биодеградации (ЭБ) нафталина в присутствии которых равнялась 6, 10 и 9% соответственно. В остальных случаях разложение нафталина полностью ингибировалось (табл. 3).
Таблица 3.
Эффективность биодеградации нафталина штаммом R. qingshengii VKM Ac-2784D через 7 сут культивирования в присутствии атранов (%)
| Концентрация атранов | Протатран | Гидрометаллатраны | Триэтаноламин | ||
|---|---|---|---|---|---|
| 1 | 3 | 4 | 5 | ||
| 10–3 | ‒166 | ‒182 | ‒132 | ‒113 | ‒98 |
| 10–4 | ‒172 | ‒171 | ‒141 | ‒68 | ‒188 |
| 10–5 | ‒177 | ‒98 | ‒112 | ‒30 | ‒183 |
| 10–6 | ‒185 | 6 | 10 | 9 | ‒110 |
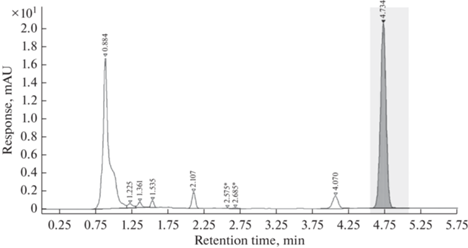
В результате ВЭЖХ исследования обнаружено 7 пиков, предположительно относящихся к интермедиатам деструкции нафталина (рис. 4). Эти пики не соответствовали известным продуктам распада нафталина, таким как пирокатехин, салициловая, гентизиновая и протокатеховая кислоты. Для оценки действия атранов мы провели сравнение в динамике площади хроматографических пиков.
Рис. 4.
Хроматограмма культурального фильтрата R. qingshengii VKM Ac-2784D в контрольном образце в присутствии бактерий на 3 сут.
Пик с временем выхода 1.598 мин отсутствует в контрольной пробе и проявляется только в образцах с атранами 1 и 5. Дополнительные исследования показали, что данный пик относится к продукту диссоциации исходных атранов, а именно к аниону о-крезола.
Следующий пик с временем выхода 1.543 мин обнаружен практически на всех хроматограммах (рис. 5а). В контроле данный интермедиат накапливается на 3‒5 и 7 сут культивирования, тогда как в присутствии атранов, особенно в низких их концентрациях, он образуется в существенно меньших количествах. Исключение составляет атран 4, в присутствии которого на 7-е сут культивирования наблюдается увеличение концентрации данного интермедиата, превышающее контроль.
Рис. 5.
Площади пиков веществ со временем выхода: а – 1.543 мин; б ‒ 2.102 мин; в – 4.068 мин. По данным ВЭЖХ (концентрация атранов 10–4 г/л). Обозначения: (1) протатран 1; (2) триэтаноламин; (3) протатран 3; (4) гидрометаллатран 4; (5) гидрометаллатран 5; (6) контроль.
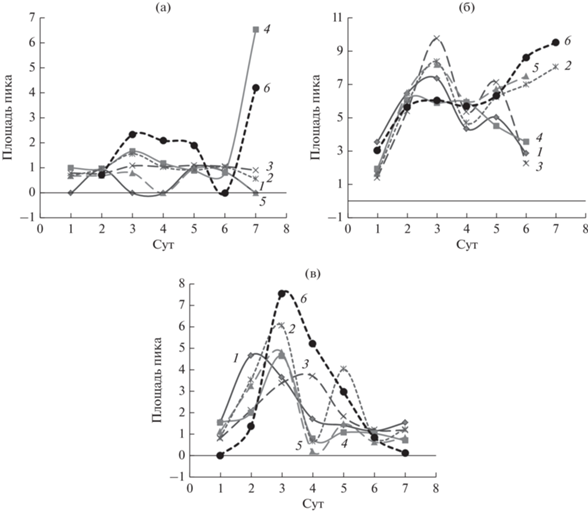
Еще один пик, который присутствует на всех хроматограммах, ‒ соединение со временем выхода 2.102 мин. Динамика накопления данного вещества совпадает для стерильного образца и в присутствии бактерий (рис. 5б). Добавка атранов оказывает незначительное влияние на процесс. Следует отметить, что на 7-е сут, по данным УФ спектрального анализа, происходит изменение вещества на другое во всех концентрациях и практически у всех атранов (табл. 4, рис. 6).
Таблица 4.
Образцы атранов, в которых происходит смена вещества на 7 сут
| Соединение | Концентрация, г/л | |||
|---|---|---|---|---|
| 10–3 | 10–4 | 10–5 | 10–6 | |
| Протатран 1 | + | ‒ | + | ‒ |
| Протатран 3 | ‒ | + | + | + |
| Гидрометаллатран 4 | ‒ | + | + | + |
| Гидрометаллатран 5 | + | + | + | + |
| Триэтаноламин | + | ‒ | ‒ | + |
Пик со временем выхода 4.068 мин также наблюдается на всех хроматограммах (рис. 5в). Во всех концентрациях содержание вещества в пробах с атранами ниже по сравнению с контролем. Только у атрана 4 в концентрации 10–6 г/л профиль кривой совпадает с контролем. В присутствии атранов динамика площади пиков ближе к наблюдаемой для абиотического разложения нафталина, что свидетельствует о блокировании процесса деструкции данного модельного соединения. Площадь остальных пиков незначительна, поэтому сложно отличима от шума.
Таким образом, показано, что характер влияния исследуемых атранов на все изучаемые параметры функционирования R. qingshengii VKM Ac-2784D зависят от природы источника углерода. Внесение атранов в богатую питательную среду БТН практически не влияло на скорость роста бактерий. В минеральной среде 8Е с добавлением глюкозы и без нее происходила кратковременная активация роста микроорганизма, характеризующаяся сокращением лаг-фазы. В присутствии нафталина данные соединения действовали на прирост популяции R. qingshengii VKM Ac-2784D преимущественно негативно. Интересно, что большинство показателей роста и развития микроорганизма было схожим, как для исследованных атранов, так и для триэтаноламина. Это позволяет сделать предположение, что основной эффект атранов связан именно с наличием триэтаноламина в молекуле данных соединений.
Показано, что все исследуемые атраны оказывали неблагоприятное воздействие на скорость разложения нафталина R. qingshengii VKM Ac-2784D, а также снижали гидрофобность клеточной стенки и синтез внеклеточных биосурфактантов. Следовательно, исследуемые соединения будут негативно влиять на скорость разложения нефти данным микроорганизмом.
Список литературы
Беловежец Л.А., Третьякова М.С., Маркова Ю.А. Микробный препарат для биоремедиации почвы, загрязненной нефтью и нефтепродуктами. Патент РФ № 2705290. 2019.
Беловежец Л.А., Третьякова М.С., Маркова Ю.А. Микробный препарат для защиты растений, произрастающих на нефтезагрязненных почвах. Патент РФ № 2744094. 2021.
Василенко С.Л., Кохановская Е.Ю., Перова В.А., Титок М.А. Характеристика природных деструкторов нафталина // Материалы III Межд. науч. конф. “Ксенобиотики и живые системы”. Минск, 22‒24 октября 2008 г. С. 21‒23.
Воронков М.Г., Барышок В.П. Силатраны в медицине и сельском хозяйстве. Новосибирск: СО РАН, 2005. 255 с.
Ерофеевская Л.А., Чернявский В.Ф. Потенциал использования Rhodococcus для активации процессов очищения почв от нефтезагрязнений // Современная наука: актуальные проблемы теории и практики. Серия: Естественные и технические науки. 2016. № 9‒10. С. 3‒6.
Ившина И.Б., Куюкина М.С., Каменских Т.Н., Криворучко А.В., Тюмина Е.А., Елькин А.А. Углеводородокисляющие родококки: особенности биологической организации под воздействием экополлютантов: атлас-монография / Под ред. Ившиной И.Б. Екатеринбург: УрО РАН, 2021. 140 с.
Куюкина М.С. Биосурфактанты актинобактерий рода Rhodococcus: индуцированный биосинтез, свойства, применение. Автореферат дис. … докт. биол. наук. Пермь, 2006. 45 с.
Леменовский Д.А., Зайцева Г.С., Карлов С.С. Атраны ‒ молекулярные бутоны // Природа. 2008. № 3. С. 28‒34.
Решедько Г.К., Cтецюк О.У. Особенности определения чувствительности микроорганизмов диско-диффузионным методом // Клиническая микробиология и антимикробная химиотерапия. 2001. Т. 3. С. 348‒354.
Рогозина Е.А., Андреева О.А., Жаркова С.И., Мартынова Д.А., Орлова Н.А. Сравнительная характеристика отечественных биопрепаратов, предлагаемых для очистки почв и грунтов от загрязнения нефтью и нефтепродуктами // Нефтегазовая геология. Теория и практика. 2010. Т. 5. № 3. С. 1‒18.
Серебрякова Е.В., Дармов И.В., Медведев Н.П., Алексеев С.А., Рыбак С.И. Оценка гидрофобных свойств бактериальных клеток по адсорбции на поверхности капель хлороформа // Микробиология. 2002. Т. 70. С. 237‒239.
Тимергазина И.Ф., Переходова Л.С. К проблеме биологического окисления нефти и нефтепродуктов углеводородо-кисляющими микроорганизмами // Нефтегазовая геология. Теория и практика. 2012. Т. 7. № 1. С. 1‒28.
Третьякова М.С., Беловежец Л.А., Маркова Ю.А. Скрининг бактерий, ассоциированных с растениями, по способности деструктировать компоненты нефти // Системы. Методы. Технологии. 2015. № 4(28). С. 138‒142.
Шаханов А.В., Досаев А.А., Скичко А.С. Математическое моделирование процесса биоразложения дротаверина гидрохлорида клетками родоккоков // Успехи в химии и химической технологии. 2019. Т. 33. № 11(221). С. 101‒104.
Adamovich S.N. New atranes and similar ionic complexes. Synthesis, structure, properties // Appl. Organomet. Chem. 2019. V. 33. Art. e4940.
Krivoruchko A., Kuyukina M., Ivshina I. Advanced rhodococcus biocatalysts for environmental biotechnologies // Catalysts. 2019. V. 9. Art. 236.
Mirskova A.N., Adamovich S.N., Mirskov R.G. Protatranes as effective biostimulators for agriculture, biotechnology, and microbiology // Chem. Sustain. Develop. 2016. V. 24. P. 713‒729.
Petrushin I.S., Markova Y.A., Karepova M.S., Zaytsev Y.V., Belovezhets L.A. Complete genome sequence of Rhodococcus qingshengii strain VKM Ac-2784D, isolated from Elytrigia repens rhizosphere // Microbiol. Resour. Announc. 2021. V. 10. Art. e00107-21.
Дополнительные материалы отсутствуют.