Микробиология, 2023, T. 92, № 1, стр. 86-97
Микробная деструкция изделий из полипропилена и поливинилхлорида в анаэробных условиях
Д. В. Малахова a, М. А. Егорова a, М. Р. Леонтьева a, А. Г. Ельченинов b, Т. В. Панова c, Ю. Д. Александров d, Е. А. Цавкелова a, *
a Кафедра микробиологии биологического факультета МГУ им. М.В. Ломоносова
119234 Москва, Россия
b Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
c Кафедра высокомолекулярных соединений химического факультета МГУ
им. М.В. Ломоносова
119991 Москва, Россия
d Кафедра коллоидной химии химического факультета МГУ им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: tsavkelova@mail.ru
Поступила в редакцию 24.07.2022
После доработки 03.09.2022
Принята к публикации 15.09.2022
- EDN: NNTETA
- DOI: 10.31857/S0026365622600602
Аннотация
Важнейшее преимущество материалов из синтетических полимеров – устойчивость к биоразложению – является одновременно и причиной их накопления, и загрязнения окружающей среды. Тем не менее, некоторые пластики в аэробных условиях подвергаются медленной микробной деструкции, однако об анаэробном разложении пластиков практически ничего не известно. В рамках настоящей работы был исследован рост анаэробных умеренно термофильных (55°С) консорциумов в присутствии образцов изделий из полипропилена (ПП) и поливинилхлорида (ПВХ). Установлено, что в присутствии пластиков увеличивалось количество микробной биомассы по сравнению с контролем, образовывались продукты анаэробного разложения (СО2, Н2 и Н2S), а масса образцов уменьшалась по сравнению с контролем на 4.4% (ПП) и 6.5% (ПВХ). Бактериальные клетки адгезировались и формировали колонии и биопленки на поверхности пластика. Анализ состава микробных сообществ показал, что в них значительно увеличилась численность анаэробных гидролитиков рода Tepidimicrobium, потенциальных синтрофных бактерий рода Tepidanaerobacter и, в особенности, сульфатвосстанавливающих бактерий (Desulfohalotomaculum). Исследования, проведенные с помощью дифференциальной сканирующей калориметрии и инфракрасной Фурье-спектроскопии, показали, что уменьшение массы пластика происходит, в основном, за счет гидролиза присутствующих в изделиях добавок (пластификаторов), однако в случае ПВХ наблюдали также изменение структуры пластика. Обсуждается роль таких микробных сообществ в водной среде и глубинных слоях полигонов твердых бытовых отходов, где в анаэробных условиях и при повышенной температуре возможна трансформация отходов ПП и ПВХ.
Полимерные синтетические материалы (пластики) широко используются в самых различных областях деятельности человека; их производство растет, достигнув 368 млн т к 2019 г., а предполагаемая продукция в 2050 г. может составить более 800 млн т (Baran, 2022). Привлекательность пластиков объясняется дешевизной, легким весом, пластичностью материала и, не в последнюю очередь, устойчивостью к биологическому разложению. Это же качество, однако, является и причиной крупнейшей экологической проблемы: пластиковые отходы в огромных количествах загрязняют водоемы и почву, принося вред населяющим Землю живым существам, включая человека. Полная утилизация пластиковых отходов возможна при их сжигании, но даже этот способ применяется лишь к 12% от всего объема произведенного пластика (Geyer et al., 2017). Кроме того, сжигание, например, материалов из поливинилхлорида приводит к образованию хлора, фенолов, диоксинов и других крайне токсичных и канцерогенных для человека соединений. Вторичной переработке подвергается около 3–10% пластика, тогда как основная часть скапливается на полигонах твердых бытовых отходов (ТБО) или поступает в биосферу (Geyer et al., 2017; Ru et al., 2020).
В последнее время появляется все больше информации о биодеградации пластиков с использованием культур микроорганизмов и их ферментов, описанных, в том числе, в ряде недавних обзоров (Mohanan et al., 2020; Ru et al., 2020; Плакунов и соавт., 2020; Котова и соавт., 2021). В многочисленных экспериментальных работах приводятся сильно различающиеся данные о возможностях и скоростях разложения пластиков грибами и бактериями (в основном аэробными органотрофами), а также о влиянии на этот процесс различных физико-химических факторов (Котова и соавт., 2021). Несмотря на явное отсутствие бактерий, эффективно разлагающих пластики, накопление информации о микроорганизмах, способных осуществлять деструкцию таких изделий, может в дальнейшем привести к созданию технологий биологической утилизации пластиковых отходов.
Подавляющее большинство работ по микробной деградации пластиков посвящено изучению разложения полиэтилена и полиэтилентерефталата, в то время как сведения о биодеградации полипропилена (ПП) и поливинилхлорида (ПВХ) весьма ограниченны (Skariyachan et al., 2018; Rana et al., 2022). Вместе с тем, эти пластики входят в число наиболее массово производимых: на долю ПП и ПВХ приходится 21 и 12% соответственно, от общего числа продукции пластиковых материалов (Geyer et al., 2017). Пластиковые изделия и отходы, в том числе содержащие ПП и ПВХ, зачастую захораниваются в виде ТБО на полигонах, и доступ кислорода в такие системы ограничен частично или полностью.
Целью нашей работы было изучение потенциальной возможности анаэробного биоразложения изделий из ПП и ПВХ, обнаружение и идентификация бактерий, способствующих утилизации этих полимеров, а также исследование процессов, происходящих в анаэробных условиях с этими материалами.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования и условия культивирования. Источником микроорганизмов, потенциально способных к разложению ПП и ПВХ в анаэробных условиях, служили наиболее активные целлюлозолитические микробные консорциумы, выделенные ранее из различных природных и антропогенных источников (Цавкелова и соавт., 2012; Tsavkelova et al., 2018). Исходно было использовано 6 различных целлюлозолитических сообществ, а также образцы почвы (4 образца), компостных куч (2 образца) и навоз крупного рогатого скота (КРС, 2 образца).
Инокулят (10%, объем/объем для жидких или масса/объем для твердых образцов) вносили в 100-мл флаконы с 40 мл питательной среды следующего состава (г/л): K2HPO4 – 1.0; KH2PO4 – 1.0; NH4Cl – 2.5; MgSO4 · 7H2O – 0.5; CaCl2 · 6H2O – 0.1; NaCl – 0.1; CaCO3 – 1.0; NaHCO3 – 5.0; раствор микроэлементов – 1 мл. Раствор микроэлементов содержал (мг/л): ZnCl2 – 70.0; MnCl2 · 4H2O – 100.0; CoCl2 · 6H2O – 190.0; H3BO3 – 6.0; Na2MoO4 · · 2H2O – 36.0; CuCl2 · 2H2O – 2.0; NiCl2 · 6H2O – 24.0; Na2WO4 · 2H2O – 15.0; FeSO4 · 7H2O – 1000.0; рН среды 7.0‒7.5.
В качестве пластиковых субстратов использовали фрагменты упаковочных пакетов для круп из полипропилена и обложки для тетради из поливинилхлорида, в виде пленок площадью 1 см2; конечное количество субстрата во флаконе составляло 0.1 г. Поскольку исходные инокуляты содержали целлюлозолитические сообщества и компостируемую растительную биомассу, в качестве дополнительного субстрата при первом засеве в среду вносили целлюлозу в виде фильтровальной бумаги (8 г/л), а также дрожжевой экстракт (2 г/л) и пептон (1 г/л). В последующих пересевах в качестве органических ко-субстратов использовали только дрожжевой экстракт и пептон, а их концентрация была уменьшена до 0.2 и 0.5 г/л соответственно. Флаконы герметично закупоривали и создавали анаэробные условия культивирования, заменяя газовую фазу аргоном.
Инокулированные флаконы инкубировали при 55°С в термостате (“Binder”, Германия). В качестве контролей использовали неинокулированные питательные среды того же состава, а также засеянные среды без пластика. Пересевы производили после тщательного перемешивания, перенося шприцем аликвоту культуральной жидкости (10% по объему) в новый флакон с соответствующим образцом пластика и фоновой средой. В первом пассаже культуры инкубировали в течение 1.5‒2 мес., а в последующих – 2‒3 мес. Все эксперименты проводили в 3‒5 повторностях.
Анализ роста культур и образования ими продуктов анаэробного метаболизма. Динамику роста микробных сообществ оценивали по изменению содержания общего белка. Для этого проводили щелочной гидролиз клеток с помощью 2 н NaOH, который добавляли в соотношении 1 : 1 к суспензии клеток и оставляли при 37°С на 2 ч, после чего образцы разводили в 5 раз. В полученном гидролизате колориметрически (КФК-3-01-“ЗОМЗ”, Россия) определяли общий белок по стандартному методу Лоури.
Образование газообразных продуктов (метан, водород, углекислый газ) измеряли с помощью газовой хроматографии на хроматографе Кристалл 2000 М (“Хроматэк”, Россия) с микрокапиллярной колонкой FFIP (15 000 × 0.5 мм), аргоном в качестве газа-носителя и температурным детектором (градиент от 70 до 160°C). Результаты анализировали с помощью программного обеспечения Chromatec Analytic 2.5 (“Хроматэк”, Россия) согласно описанной ранее методике (Цавкелова и соавт., 2012).
Концентрацию сульфид-иона определяли колориметрически при 660 нм на фотоэлектроколориметре КФК-3-01-“ЗОМЗ” (Россия) в кювете с длиной оптического пути 1 см, используя N,N-диметил-парафенилендиамин (Trüper, Schlegel, 1964).
Анализ структуры микробных сообществ. Состав анаэробных микробных сообществ, утилизирующих ПП и ПВХ, проводили в динамике, исследуя их после второго и четвертого пересевов. Для выделения ДНК из сообществ 5 мл культуры центрифугировали при 12 000 g в течение 5 мин, супернатант сливали, а осадок клеток замораживали при ‒20°С. Из образцов выделяли ДНК с использованием набора DNeasy PowerLyzer Mcrobal Kit (“Qiagen”) и гомогенизатора FastPrep-24 5G (“MP Bio”, США) в соответствии с инструкцией производителя. Концентрацию ДНК измеряли на флуориметре Qubit 2.0 (“Invitrogen/Life Technologies”, США). Подготовку ДНК библиотек фрагмента V4 гена 16S рРНК, последующее секвенирование на платформе Illumina MiSeq (“Illumina”, CША) и первичную обработку прочтений проводили, как описано ранее (Vortsepneva et al., 2021). Прочтения были обработаны и отфильтрованы с использованием пакета dada2 v.1.14.1 (Callahan et al., 2016) со следующими параметрами: truncLen = 220, maxN = 0, maxEE = 2, truncQ = 2. В полученных образцах с помощью dada2 были определены уникальные последовательности (ASV – amplicon sequence variant) для каждого образца, было проверено наличие химерных последовательностей. Для финального набора ASV была определена таксономическая принадлежность в пакете dada2 с использованием нативного байесовского классификатора (Wang et al., 2007) на основе базы данных Silva Ref NR v. 138.1 (Quast et al., 2013). Показатели биоразнообразия, такие как индекс Шэннона, обратный индекс Симпсона и индекс Chao1 были определены с использованием пакета phyloseq v.1.3 (McMurdie, Holmes, 2017). Визуализацию данных проводили в пакете ggplot2 и ggpattern (https://coolbutuseless.github.io/package/ggpattern/).
Анализ изменения массы и структуры пластиков. Проводили измерение массы исходного пластика, а также ПП и ПВХ в опытных и контрольных вариантах перед началом культивирования и после его окончания. Кусочки пластика в опытных образцах отмывали от адгезированных клеток путем инкубации на шейкере при 150 об./мин в 2%-ном растворе SDS и в течение 4 ч, последующей трехкратной отмывкой в дистиллированной воде и высушивании при 55°С в течение 18 ч. Массу образцов определяли на аналитических весах (ER 60A, “A&D Company Ltd.”, Япония). С контрольными образцами производили те же самые процедуры.
Микробные обрастания образцов и происходящие с пластиком механические изменения исследовали с помощью сканирующей электронной микроскопии (СЭМ) в центре коллективного пользования “Электронная микроскопия в науках о жизни” МГУ им. М.В. Ломоносова. Для этого образцы фиксировали 30 мин в 2.5% глутаровом альдегиде на фосфатном буфере, затем обезвоживали в этиловом спирте возрастающих концентраций (30, 50, 70, 80 и 99.5%) и далее в смесях абсолютного спирта и ацетона в пропорциях 3 : 1, 1 : 1, 1 : 3. Образцы помещали в абсолютный ацетон на ночь и затем высушивали в критической точке на оборудовании HCP-2 Critical Point Dryer (“Hitachi”, Япония) и напыляли смесью Au–Pd в ионно-распылительной установке Eiko IB-3 Ion Coater (“Hitachi”, Япония). Изучение образцов проводили в сканирующем электронном микроскопе JSM-6380LA (“Jeol”, Япония) в режиме высокого вакуума при давлении в камере 3 × 10–5 торр с ускоряющим напряжением 20 кВ.
Для анализа структуры и свойств исследуемых пластиков образцы заливали раствором 2 н NaOH и инкубировали при 37°С в течение 2 ч, после чего трижды отмывали дистиллированной водой и высушивали при 55°С в течение 18 ч для удаления бактериальных клеток. Структуру образцов пластика исследовали методом инфракрасной (ИК) спектроскопии; ИК спектры регистрировали на ИК-Фурье спектрометре Nicolet IR200 (“Thermo Electron”, CША) с приставкой нарушенного полного внутреннего отражения (ZnSe кристалл) в диапазоне от 600 до 4000 см–1.
Теплофизические свойства образцов пластика изучали методом дифференциальной сканирующей калориметрии (ДСК) на термоанализаторе DSC 402 F1 Phoenix (“Netzsch”, Германия). Для этого образцы пластика массой 2‒5 мг помещали в алюминиевые тигли, запечатывали и нагревали со скоростью 10°C/мин в токе аргона 50 мл/мин. Образцом сравнения служил пустой алюминиевый тигель. Для анализа использовали только первый цикл нагревания, который дает информацию об исходном состоянии кристаллической фазы в образце. Степень кристалличности вычисляли по формуле: χ = ΔH/ΔH0, где ΔН ‒ экспериментально полученная теплота плавления полимера, а ΔН0 ‒ теплота плавления идеального кристалла полимера (170 Дж/г для полипропилена).
Измерение краевых углов смачивания проводили на приборе OCA 15EC (“DataPhysics”, Германия). Для этого образцы размером 10 × 5 мм наклеивали на предметное стекло при помощи двустороннего скотча, наносили 1–2 мкл дистиллированной воды и выдерживали 10 с для достижения равновесия. Метод основан на измерении краевых углов (Θ) капель жидкости, нанесенных на поверхность. Краевой угол представляет собой угол между касательной к поверхности капли, проведенной из точки касания, и исследуемой поверхностью.
Все эксперименты проводили в нескольких (3‒5) повторностях. Статистическую обработку проводили в программе Microsoft Excel XP.
РЕЗУЛЬТАТЫ
Рост анаэробного термофильного микробного сообщества и наблюдаемые изменения среды в присутствии образцов изделий из ПП и ПВХ. Культивирование микробных сообществ, засеянных из различных источников, включая целлюлозолитические сообщества, почву, навоз КРС и компостные кучи, через 6‒8 нед. инкубирования при 55°С выявило активность микроорганизмов только в пробах с наиболее активными целлюлозолитическими консорциумами. По сравнению с контрольными вариантами в них было отмечено не только помутнение среды и газообразование, но и изменение цвета пластика. Среди целлюлозолитических сообществ были отобраны по два для каждого вида пластика, которые были объединены для следующего пересева. В образцах с инокулятами из других источников таких изменений отмечено не было. В пробах, инокулированных навозом КРС, помутнение среды и повышение давления за счет образования газообразных продуктов, наблюдаемое в первом пассаже, исчезло после пересева. Полученные итоговые микробные сообщества в дальнейшем пересевали еще три раза уже на обедненную среду, лишенную целлюлозы в качестве косубстрата, и со сниженным содержанием дрожжевого экстракта и пептона, и они продолжали показывать отмеченные изменения по образованию продуктов метаболизма, микробному росту, изменению состояния пластиков и убыли массы образцов, в отличие от контрольных вариантов (табл. 1).
Таблица 1.
Параметры развития анаэробных микробных сообществ в присутствии пластиковых изделий из полипропилена (ПП) и поливинилхлорида (ПВХ) при 55°С
| Пластик | Пересев | Органические добавки, г/л | Время инкубации, сут | Прирост белка, мкг/млb | Убыль массы пластика, % | Давление, бар | Продукты метаболизмаb |
|---|---|---|---|---|---|---|---|
| ПП | 1 | Целлюлоза ‒ 10.0; ДЭа ‒ 2.0; пептон ‒ 1.0 | 45‒60 | ‒c | 4.4 ± 0.38 | 0.8 | ‒ |
| 2 | ДЭ ‒ 0.2; пептон ‒ 0.5 | 60‒90 | ‒ | 2.8 ± 0.09 | 0.4 | СО2 0.7%; Н2 0.05%; Н2S 0.4 ± 0.09 мМ |
|
| 3 | 60‒90 | ‒ | 1.7 ± 0.16 | 0.3 | СО2 0.6%; Н2 0.03% Н2S 0.8 ± 0.10 мМ |
||
| 4 | 35‒90 | 57 ± 5.0 | 0.9 ± 0.03 | 0.3 | СО2 0.5%; Н2 0.01% Н2S 0.7 ± 0.04 мМ |
||
| ПВХ | 1 | Целлюлоза ‒ 10.0; ДЭ ‒ 2.0; пептон ‒ 1.0 | 45‒60 | ‒ | 6.5 ± 0.32 | 1.0 | ‒ |
| 2 | ДЭ ‒ 0.2; пептон ‒ 0.5 | 60‒90 | ‒ | 4.7 ± 0.13 | 0.6 | СО2 1.2%; Н2 0.07% Н2S 0.7 ± 0.16 мМ |
|
| 3 | 60‒90 | ‒ | 3.1 ± 0.15 | 0.4 | СО2 1.0%; Н2 0.04% Н2S 1.2 ± 0.09 мМ |
||
| 4 | 35‒90 | 70 ± 3.2 | 2.4 ± 0.08 | 0.4 | СО2 1.1%; Н2 0.03% Н2S 1.1 ± 0.11 мМ |
В процессе роста в опытных культурах во всех пересевах наблюдали избыточное давление, которое было достаточно высоким (1.0 бар для ПВХ и 0.8 бар для ПП) в первичном посеве, когда в среде присутствовала целлюлоза, однако затем не превышало 0.3‒0.4 и 0.4‒0.6 бар для ПП и ПВХ соответственно. Газохроматографический анализ показал, что образующиеся газообразные продукты состоят из углекислого газа (0.7% от общего объема газовой фазы для сообществ, культивируемых на ПП, и 1.2% для сообществ, выращиваемых на ПВХ) и незначительного количества водорода (0.07 и 0.03% на ПВХ и ПП соответственно). В контрольных культурах показатели практически не отличались от нуля.
Помимо газообразных продуктов, в культурах, содержащих пластики и анаэробные термофильные консорциумы, было отмечено появление растворенного сульфида (табл. 1). Его максимальное образование наблюдали в третьем пассаже, при этом наибольшей концентрации в динамике развития сообществ значения достигали к 60–70 сут культивирования в каждом из пересевов (табл. 1). Небольшое количество сульфида в контрольных флаконах, лишенных пластика, могло образовываться за счет использования сообществом присутствовавших в среде дрожжевого экстракта и пептона; однако оно составило лишь 7‒20% от сульфида, образующегося в опытных флаконах с пластиком.
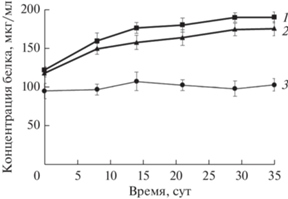
Динамика развития микробных сообществ, которые к этапу заключительного четвертого пересева культивировали в целом более 10 мес., показала, что в течение 35 сут культивирования во всех опытных образцах происходило увеличение содержания микробного белка по сравнению с контролями без пластика (табл. 1, рис. 1). Более высокие показатели были характерны для культур, использующих ПВХ.
Рис. 1.
Динамика развития микробных термофильных анаэробных сообществ, культивируемых на поливинилхлориде (ПВХ) и полипропилене (ПП). Значения представлены средним арифметическим из трех повторностей; (1) ‒ ПВХ, (2) ‒ ПП; (3) ‒ контроль.
Изменения в составе микробных сообществ в процессе их инкубации с образцами ПП и ПВХ. Результаты высокопроизводительного секвенирования V4-вариабельных фрагментов генов 16S рРНК бактерий анаэробных термофильных сообществ в опыте (с пластиком) и контроле (без пластика) представлены в табл. 2. Изначальное количество прочтений V4-региона гена 16S рРНК для образцов составляло от 4671 до 23 868; после проведения этапов фильтрации и удаления химерных последовательностей количество прочтений сократилось до 3986‒17 723. Среди всех прочтений были определены 506 уникальных последовательностей. Пропорция нехимерных уникальных последовательностей составляла 89% от общего количества прочтений.
Таблица 2.
Структура микробных сообществ, культивируемых при 55°С, без (контроль) и с добавлением полипропилена (PP) и поливинилхлорида (PVC)
| Полипропилен | II | IV | ||||||
| Контроль (PP.2.c) | % | Опыт (PP.2.p) | % | Контроль (PP.4.c) | % | Опыт (PP.4.p) | % | |
| Tepidimicrobium | 47.24 | Tepidimicrobium | 32.38 | Tepidimicrobium | 45.27 | Tepidimicrobium | 39.83 | |
| M55-D21 (Firmicutes, Limnochordia) | 20.97 | M55-D21 | 24.99 | Uncultured Peptococcaceae | 35.39 | Tepidanaerobacter | 40.70 | |
| Tepidanaerobacter | 17.30 | Tepidanaerobacter | 18.50 | M55-D21 (Limnochordia) | 8.08 | Desulfohalotomaculum | 18.29 | |
| SBR2 (Firmicutes, Thermoanaerobacterales) | 5.32 | Desulfohalotomaculum | 5.09 | Desulfohalotomaculum | 3.68 | |||
| Desulfohalotomaculum | 4.36 | Uncultured Peptococcaceae | 3.05 | Tepidanaerobacter | 3.50 | |||
| Поливинилхлориид | 2-й пересев | 4-й пересев | ||||||
| Контроль (PVC.2.c) | % | Опыт (PVC.2.p) | % | Контроль (PVC.4.c) | % | Опыт (PVC.4.p) | % | |
| Herbinix | 33.94 | Tepidimicrobium | 62.23 | Tepidimicrobium | 33.50 | Tepidimicrobium | 32.69 | |
| Tepidimicrobium | 13.41 | Desulfohalotomaculum | 17.96 | Uncultured Planococcaceae (Bacillales) |
24.61 | Desulfohalotomaculum | 12.15 | |
| Bacteroides | 9.26 | Tepidanaerobacter | 15.11 | Tepidanaerobacter | 11.70 | Tepidanaerobacter | 27.45 | |
| Uncultured Lachnospiraceae | 5.52 | M55-D21 (Limnochordia) | 6.82 | Brockia | 27.63 | |||
| Faecalibacterium | 4.57 | Herbinix | 6.37 | |||||
| Desulfohalotomaculum | 1.27 | Desulfohalotomaculum | 1.98 | |||||
Примечание. В таблице показанo относительное присутствие бактерий, представляющих доминирующие популяции (>3% от всех), за исключением Desulfohalotomaculum, чья популяция в контроле для поливинлхлорида составила лишь 1.27‒1.98%. В скобках указаны более высокие таксономические ранги для бактерий с неопределенным родом. Анализ состава микробных сообществ проводили для второго (II) и четвертого (IV) пересевов.
Для всех изученных образцов были получены индексы альфа-разнообразия (рис. ES1); наибольшим биоразнообразием согласно индекcу Шэннона обладал контрольный образец второго пассажа для ПВХ (PVC.2.cont) (3.49), другие образцы контролей имели показатели 2.27‒2.91. В опытных образцах, которые культивировали с добавлением пластиков, более низкие показатели 1.8‒2.59 подтверждали узкое разнообразие микроорганизмов в составе микробных сообществ, селектированных за время культивирования на пластиках. Другие индексы (обратный индекс Симпсон и индекс Chao1) демонстрировали аналогичные тенденции. В дальнейшую работу были взяты 200 наиболее массовых ASV, которые представляли 97‒100% исследуемых микробиомов.
Во всех образцах бактерии филума Firmicutes (Bacillota) составляли от 80.9 до 99.9% всех прокариот. В контрольном для ПВХ образце PVC.2.cont присутствует значительная доля представителей Bacteroidota (13.29%). Кроме того, в различных образцах можно было обнаружить последовательности, отнесенные к филумам Proteobacteria, Actinobacteriota, Halanaerobiaeota в качестве минорных компонентов сообщества (0.05‒2.28%). Разнообразие в контрольных образцах значительно сократилось от второго к четвертому пересеву.
В опытных образцах за время культивирования произошла сукцессия микробных популяций (табл. 2), в результате которой стали доминировать представители родов Tepidimicrobium, Tepidanaerobacter и, особенно, сульфатвосстанавливающие бактерии (СВБ) из рода Desulfohalotomaculum. Несмотря на то, что эти микроорганизмы также встречались и в контрольных образцах, лишь Tepidimicrobium имел сходные пропорции в опытных и контрольных сообществах к 4-му пассажу (около 33% на ПВХ и 40‒45% на ПП). Причем этот гидролитик в вариантах с ПВХ, очевидно, вытеснил известную термофильную целлюлозолитическую бактерию Herbinix sp. (табл. 2). Два других микроорганизма представлены в контрольных образцах в значительно меньших количествах: доля Tepidanaerobacter составила 3.5% на ПП и 11.7% на ПВХ (против 40 и 27.4% в опытных вариантах), а Desulfohalotomaculum – лишь 3.7% на ПП и менее 2% на ПВХ, что меньше в 5 и 6 раз, соответственно, чем в опыте. Кроме того, сообщества контрольных образцов содержали и другие бактерии, принадлежащие к порядкам Clostridiales и Bacillales, которые не были обнаружены или элиминировались из опытных микробных сообществ. Интересным отличием опытных образцов с ПВХ является накопление в нем бактерий рода Brockia (27.6%).
Изменение массы, состояния поверхности и структуры пластиков. В результате инкубирования микробных сообществ с пластиком масса ПВХ в опытных образцах первого пассажа уменьшилась на 6.5%, а ПП – на 4.4% за два месяца культивирования. В последующих пересевах уменьшение массы пластиков продолжилось, однако, с меньшей эффективностью (табл. 1). В контрольных вариантах изменений массы ПВХ и ПП не происходило.
После второго пересева и инкубации в течение двух месяцев была проведена сканирующая электронная микроскопия (СЭМ) образцов пластика, инкубировавшихся в присутствии активных микробных сообществ. Было выявлено, что бактерии адгезируются на поверхности пластика и присутствуют в виде одиночных клеток или агрегатов и популяций, объединенных межклеточным матриксом (рис. 2). В отличие от контрольных (неинокулированных) образцов (рис. 2а), структура пластика, инкубированного в анаэробных условиях в присутствии термофильных микробных сообществ (рис. 2б), стала гетерогенной, сам пластик стал более рыхлым, было отмечено отслоение мелких частиц и появление полостей и разрывов на его поверхности (рис. 2в).
Рис. 2.
Поверхность пластика после обрастания микробным анаэробным термофильным сообществом. Обозначения: ПВХ ‒ поливинилхлорид; ПП ‒ полипропилен; (а) ‒ контрольные (неинокулированные) образцы; (б) ‒ опытные образцы с отдельными клетками бактерий и популяциями микробных клеток, формирующих агрегаты и обрастания на пластике; (в) ‒ опытные образцы, отмытые от бактериальных клеток с помощью раствора SDS.

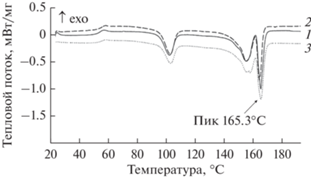
Изменения структуры пластиков были исследованы с помощью метода дифференциальной сканирующей калориметрии (ДСК), позволяющего получить информацию о температуре и теплотах плавления кристаллической фазы, а также о других фазовых переходах в полимерах. В образцах ПП, как контрольных, инкубированных в среде, так и в опытных, значимых изменений (дефектов, нарушения целостности материала) по сравнению с исходным полимером обнаружено не было (рис. 3). Наряду с характерным для ПП пиком плавления при 165°С, присутствует пик плавления при 103°С, характерный для полиэтилена, что указывает на присутствие этого полимера в исследуемой пластиковой упаковке. При этом температуры плавления полимерных компонентов, которым соответствуют пики на кривых ДСК, для контрольного и опытного образцов оставались практически неизменными. Вычисленные исходя из площадей пиков плавления величины степени кристалличности ПП для всех трех образцов (исходный полимер, абиогенный контроль и опытные образцы) оказались примерно одинаковыми и составляли 8‒9%. По данным ИК-Фурье спектроскопии не было обнаружено пиков (данные не представлены), характерных для продуктов разложения ПП, в частности, отсутствовал пик, соответствующий карбонильной группе, образующейся при окислении полимеров в аэробных условиях, и характеризующий степень разложения полиолефинов. Поверхностные изменения ПП, исследованные с помощью измерения угла смачивания, также показали, что для исследованных образцов ПП угол смачивания практически не изменялся по сравнению с исходным материалом и составлял порядка 90°. Таким образом, по данным анализа структуры и поверхности материала (упаковка для круп) на основе полипропилена в результате воздействия бактерий заметных изменений в самом полимере не наблюдалось, а потеря массы в ходе культивирования могла происходить за счет разложения присутствовавших в изделии дополнительных соединений.
Рис. 3.
Кривые дифференциальной сканирующей калориметрии (ДСК) для образцов на основе полипропилена: исходный пластик ‒ упаковка для пищевых продуктов (1), абиогенный контроль в среде (2) и опытный образец, инкубированный в присутствии бактерий (3).
В случае образцов ПВХ (обложка для книг), как в контроле, так и в опыте, наблюдали существенное изменение цвета пластика: исходно прозрачный материал приобретал цвет от светло-желтого (в среде) до желто-коричневого и даже пурпурного (в присутствии бактерий), что может свидетельствовать о протекании химических реакций, усиливающихся при контакте с микробным консорциумом. Измерения краевого угла смачивания образцов свидетельствуют о существенной гидрофилизации поверхности: для исходного и контрольного материалов величина Θ составляют ~90°, в то время, как для инкубированного в присутствии бактерий образца Θ уменьшается до 65°‒70°, что также свидетельствует о биогенном воздействии на образец. Данные ИК-Фурье спектроскопии позволяют сделать вывод о некоторых модификациях в исследованных образцах, однако, основные изменения наблюдаются в пиках, характерных для химических групп, содержащихся в возможных пластификаторах. Так, в исходном образце ПВХ интенсивная полоса поглощения при 1720 см–1, характерная для карбонильной группы, свидетельствует о присутствии фталатов, а слабая полоса при 1190 см–1 – о наличии фосфатов (данные не представлены). В спектре инкубированного в присутствии бактерий образца интенсивность полосы 1720 см–1 снижается, что говорит об уменьшении содержания пластификатора в ПВХ. Кроме того, в образце, подвергавшемуся воздействию бактерий, также наблюдается появление нескольких слабых полос в области 1600‒1670 см–1, отвечающих наличию двойных углерод‒углеродных связей в полимерных цепях. Появление двойных связей также может являться причиной появления окраски у материала.
ОБСУЖДЕНИЕ
Поливинилхлорид (ПВХ) и полипропилен (ПП), наряду с полиэтилентерефталатом, полистиролом и полиэтиленом, относят к базовым, наиболее широко распространенным пластикам. Упаковочный пластик составляет 39.6% от всего глобально произведенного пластика (Baran, 2022). Полипропилен – это линейный углеводород, представляющий собой продукт полимеризации пропилена, с формулой (C3H6)n. В зависимости от расположения метильной группы выделяют три стереоизомера этого высокомолекулярного соединения. Наличие добавок, в том числе натуральных волокон, крахмала и полилактида в составе готовой продукции ПП, а также методы предобработки, связанные с УФ- и γ-облучением или термической обработкой, значительно влияют на разложение изделий из ПП (Rana et al., 2022). Для дрожжей Yarrowia lipolytica была установлена способность потреблять не сам ПП, а продукты его термического пиролиза, в результате которого образовывались алифатические углеводороды, жирные спирты и алканы (Mihreteab et al., 2019). Уменьшение массы ПП отмечали при культивировании аэробных бактерий родов Bacillus, Pseudomonas, Enterobacter и Rhodococcus (Auta et al., 2018; Rana et al., 2022), но уровень снижения массы ПП варьировал от 0.43% за 12 мес. до 6.4% за 40 сут (Auta et al., 2018; Котова и соавт., 2021), что в значительной степени связано с различными методологическими подходами к расчету степени биоразложения пластиков. Так, сенсационным сообщением является термофильный (50°С) аэробный консорциум, состоящий из бактерий родов Brevibacillus и Aneurinibacillus, который за 140 сут снижал массу полипропленовых гранул на 44%, а пленок из этого материала ‒ на 56% (Skariyachan et al., 2018).
Поливинилхлорид состоит из линейных или малоразветвленных макромолекул, а изделия на его основе обычно содержат термостабилизаторы, пигменты, красители, минеральные наполнители и пластификаторы, которые также могут быть субстратом для микроорганизмов. Среди деструкторов ПВХ, способных к частичному разложению полимера, описаны представители грибов из родов Phanerocheate, Lentinus, Aspergillus (Ali et al., 2014), а среди бактерий – бациллы и псевдомонады, в том числе в составе консорциумов, например, состоящих из Pseudomonas otitidis, Bacillus cereus и Acanthopleurobacter pedis (Anwar et al., 2016; Giacomucci et al., 2019). За период инкубации от 3 до 9 мес. такие микробные сообщества показали уменьшение молекулярной массы ПВХ в 2.4 и 4.3 раза соответственно по сравнению с контролем (Anwar et al., 2016).
Таким образом, имеющиеся в настоящее время экспериментальные данные показывают, что микробная деструкция ПП и ПВХ происходит с той или иной степенью эффективности, хотя ее регистрация затруднена медленной скоростью процесса и, главное, присутствием примесей в прозводственных изделиях из пластика. Все упомянутые исследования проводили исключительно в аэробных условиях, а среди изученных деструкторов ПП и ПВХ представлены аэробные микроорганизмы.
В настоящей работе мы исследовали анаэробный процесс разложения пластиковых изделий, которые преимущественно составляют отходы, накапливающихся в окружающей среде. Нами впервые было продемонстрировано уменьшение массы ПП- и ПВХ-субстратов и их деструкция, происходящая за период инкубации 2‒3 мес. (60‒90 сут) в анаэробных умеренно термофильных условиях, что сходно по скоростям, зарегистрированным и описанным другими авторами для аэробного разложения этих же субстратов (Auta et al., 2018; Котова и соавт., 2021). Убыль массы пластиков сопровождалась развитием микробного сообщества и увеличением биомассы бактерий, среди которых доминирующими популяциями стали гидролитики (Tepidimicrobium), а также синтрофные (Tepidanaerobacter) и сульфатредуцирующие (Desulfohalotomaculum) бактерии. Присутствие Tepidimicrobium во всех исследованных сообществах (в опыте и контроле) может объясняться преимущественным потреблением ими пептона и/или дрожжевого экстракта, входящих в состав среды. Для представителей Tepidimicrobium характерен органотрофный рост на ряде белоксодержащих субстратов, включая пептон, триптон, дрожжевой экстракт и казаминовые кислоты, тогда как углеводы потребляются лишь некоторыми видами (например, T. xylanilyticum; Niu et al., 2009) или совсем не используются (T. ferriphilum; Slobodkin et al., 2006). Пептон используется представителями Bacillales, а также пептококками и лимнохлоридиями, принадлежащими сейчас или ранее к порядку Clostridiales, которые были выявлены в контрольных, но не в опытных образцах. Однако небольшие количества пептона и дрожжевого экстракта (0.05 и 0.02% соответственно) недостаточны для полноценного активного развития микроорганизмов пептолитиков в течение длительного (2‒3 мес.) периода культивирования. За это время более доступные субстраты полностью истощились, а разнообразие пептолитиков в опытных образцах значительно сократилось к четвертому пересеву до единственного представителя Tepidimicrobium. Тем не менее, аккумуляция микробных популяций Tepidanaerobacter и сульфатредуцирующих бактерий Desulfohalotomaculum показывает формирование микробного сообщества, участвующего в медленном и комплексном процессе анаэробного разложения пластиков. Tepidanaerobacter использует органические спирты и кислоты: так, бутират и лактат потребляются Tp. syntrophicus JLT (Sekiguchi et al., 2006; Matsuura et al., 2016), а ацетат – Tp. acetatoxydans Re1 (Manzoor et al., 2013), в том числе в синтрофных ассоциациях с гидрогенотрофными метаногенами (Sekiguchi et al., 2006; Matsuura et al., 2016).
Наличие пластика может способствовать структурированию микробных консорциумов за счет адгезии и конкурентных преимуществ одних микробных популяций над другими и установления новых трофических связей в таком микробном сообществе. Это подтверждается накоплением в опытных вариантах продуктов анаэробной деструкции: СО2, Н2 и Н2S. Низкое содержание водорода можно объяснить потреблением его сульфатредукторами, в результате чего происходило образование сероводорода. Такую же роль могут играть обнаруженные нами в ПВХ-разлагающем сообществе бактерии рода Brockia. Следует отметить, однако, что для единственного известного вида этих термофильных строго анаэробных бактерий, Brockia lithotrophica, выделенного из горячего источника кальдеры вулкана Узон, акцептором водорода является элементная сера (Perevalova et al., 2013). Примечательно, что дрожжевой экстракт не только не стимулирует рост этой бактерии, но и не требуется для роста; штамм также не использует простые сахара, пируват, ацетат, пропионат и пептон. Таким образом, в результате инкубации в присутствии обоих видов пластиков разнообразие микроорганизмов в микробных сообществах падает по сравнению с контролем, что косвенно подтверждает участие селектированных за время опыта микроорганизмов в разложении исследованных изделий из ПВХ и ПП. Мы также не выявили ни активных целлюлозолитиков, ни метаногенных архей, которые присутствовали в некоторых исходных инокулятах (Tsavkelva et al., 2018). Однако значительная доля сульфатвосстанавливающих бактерий вызывает интерес, поскольку присутствие в среде MgSO4 · 7H2O в количестве 0.5 г/л хоть и благоприятствует росту, но не является определяющим фактором для накопления СВБ в микробном сообществе. При этом СВБ широко представлены в анаэробных зонах различных природных и антропогенных экосистем (Muyzer, Stams, 2008). СВБ из рода Desulfohalotomaculum (ранее род Desulfotomaculum; Watanabe, 2018) имеют оптимумы роста от 35 до 60°С и отличаются устойчивостью к NaCl в диапазоне от 0.1 до 14%. Известно, что Мировой океан является главным стоком для сульфатов (Muyzer, Stams, 2008), поэтому можно предположить, что именно СВБ будут превалировать в анаэробной зоне в случае попадания туда пластиковых отходов; этому также будет способствовать устойчивость к высокой солености представителей Desulfohalotomaculum. СВБ способны также разлагать различные органические полютанты: толуол, ксилол и другие циклические ароматические соединения и углеводороды (Meckenstock et al., 2016), используя их как источник углерода и энергии, что увеличивает их потенциальные возможности к ко-разложению пластиков, особенно в составе отходов. В тоже время, нельзя исключать и ингибирующего действия пластиков на микроорганизмы, что еще раз подтверждает, что конкурентное преимущество будут получать более устойчивые микробные популяции.
Сравнение результатов, полученных различными методами анализа, указывает на то, что в случае ПП основным субстратом являлись присутствующие в нем добавки, так как, несмотря на уменьшение массы пластика и видимое на электронных микрофотографиях разрушение его поверхности, результаты ДСК, измерения краевых углов смачивания и ИК не показали изменений в структуре ПП. При использовании ПВХ потеря полимерным материалом добавок, безусловно, также имеет место, однако увеличение гидрофильности поверхности и появление двойных С‒С связей в самом полимере говорит о том, что структура основной цепи ПВХ под действием бактерий, вероятнее всего, также претерпевает изменения. При использовании аэробных бактерий Bacillus flexus и Pseudomonas citronellolis гравиметрически было показано, что они уменьшают вес пластика примерно на 19%, однако в основном используют именно добавки к ПВХ, а не сам полимер (Giacomucci et al., 2019).
В глубинных слоях полигонов ТБО, наряду с образованием анаэробных условий, происходит повышение температуры, поэтому очень важно понимание, существуют ли потенциальные термофильные и умеренно термофильные анаэробные сообщества, способные осуществлять процесс разложения пластиковых отходов в этих условиях. Полученные нами результаты подтверждают процесс анаэробной деструкции изделий из полипропилена и поливинилхлорида, а исследованные нами консорциумы могут рассматриваться как лабораторная модель глубинных горизонтов полигонов ТБО или анаэробных зон гидросферы, где создаются сходные условия. Можно предположить, что для более глубокого анаэробного разложения отходов из ПП и ПВХ требуются более длительный период, а также дальнейшие исследования для увеличения эффективности процессов не только биодеструкции, но и биоразложения этих материалов.
Список литературы
Котова И.Б., Тактарова Ю.В., Цавкелова Е.А., Егорова М.А., Бубнов И.А., Малахова Д.В., Ширинкина Л.И., Соколова Т.Г., Бонч-Осмоловская, Е.А. Микробная деградация пластика и пути ее интенсификации // Микробиология. 2021. Т. 90. С. 627‒659.
Kotova I.B., Taktarova Yu.V., Tsavkelova E.A., Egorova M.A., Bubnov I.A., Malakhova D.V., Shirinkina L.I., Sokolova T.G., Bonch-Osmolovskaya E.A. Microbial degradation of plastics and approaches to make it more efficient // Microbiology (Moscow). 2021. V. 90. P. 671‒701.
Плакунов В.К., Ганнесен А.В., Мартьянов С.В., Журина М.В. Биокоррозия синтетических пластмасс: механизмы деградации и способы защиты // Микробиология. 2020. Т. 89. С. 631‒645.
Plakunov V.K., Gannesen A.V., Mart’yanov S.V., Zhurina M.V. Biocorrosion of synthetic plastics: degradation mechanisms and methods of protection // Microbiology (Moscow). 2020. V. 89. P. 647‒659.
Цавкелова Е.А., Егорова М.А., Петрова Е.В., Нетрусов А.И. Образование биогаза микробными сообществами при разложении целлюлозы и пищевых отходов // Прикл. биохимия и микробиология. 2012. Т. 48. № 4. С. 417‒424.
Tsavkelova E.A., Egorova M.A., Petrova E.V., Netrusov A.I. Biogas production by microbial communities via decomposition of cellulose and food waste // Appl. Biochem. Microbiol. 2012. V. 48. P. 377‒384.
Ali M.I., Ahmed S., Robson G., Javed I., Ali N., Atiq N., Hameed A. Isolation and molecular characterization of polyvinyl chloride (PVC) plastic degrading fungal isolates // J. Basic Microbiol. 2014. V. 54. P. 18–27.
Anwar M.S., Kapri A., Chaudhry V., Mishra A., Ansari M.W., Souche Y., Nautiyal C.S., Zaidi M.G.H., Goel R. Response of indigenously developed bacterial consortia in progressive degradation of polyvinyl chloride // Protoplasma. 2016. V. 253. P. 1023–1032.
Auta H.S., Emenike C.U., Jayanthi B., Fauziah S.H. Growth kinetics and biodeterioration of polypropylene microplastics by Bacillus sp. and Rhodococcus sp. isolated from mangrove sediment // Mar. Poll. Bull. 2018. V. 127. P. 15–21.
Baran B. Resource (in)efficiency in the EU: a case of plastic waste // Ekonomia i Prawo. Economics and Law. 2022. V. 21. № 1. P. 45‒62.
Callahan B.J., McMurdie P.J., Rosen M.J., Han A.W., Johnson A.J., Holmes S.P. DADA2: High-resolution sample inference from Illumina amplicon data // Nat. Methods. 2016. V. 13. P. 581‒583.
Geyer R., Jambeck J.R., Law K.L. Production, use, and fate of all plastics ever made // Sci. Adv. 2017. V. 3. P. e1700782.
Giacomucci L., Raddadi N., Soccio M., Lotti N., Fava F. Polyvinyl chloride biodegradation by Pseudomonas citronellolis and Bacillus flexus // New Biotechnol. 2019. V. 52. P. 35–41.
Manzoor S., Bongcam-Rudloff E., Schnürer A., Müller B. First genome sequence of a syntrophic acetate-oxidizing bacterium, Tepidanaerobacter acetatoxydans strain Re1 // Genome Announc. 2013. V. 1. P. e00213-12.
Matsuura N., Ohashi A., Tourlousse D.M., Sekiguchi Y. Draft genome sequence of the syntrophic lactate-degrading bacterium Tepidanaerobacter syntrophicus JLT // Genome Announc. 2016. V. 4. P. e01712-15.
McMurdie P.J., Holmes S. Phyloseq: an R package for reproducible interactive analysis and graphics of microbiome census data // PLoS One. 2013. V. 8. P. e61217.
Meckenstock R.U., Boll M., Mouttaki H., Koelschbach J.S., Tarouco P.C., Weyrauch P., Dong X., Himmelberg A.M. Anaerobic degradation of benzene and polycyclic aromatic hydrocarbons // Microb. Physiol. 2016. V. 26. P. 92‒118.
Mihreteab M., Stubblefield B.A., Gilbert E.S. Microbial bioconversion of thermally depolymerized polypropylene by Yarrowia lipolytica for fatty acid production // Appl. Microbiol. Biotechnol. 2019. V. 103. P. 7729‒7740.
Muyzer G., Stams A. The ecology and biotechnology of sulphate-reducing bacteria // Nat. Rev. Microbiol. 2008. V. 6. P. 441‒454.
Mohanan N., Montazer Z., Sharma P.V., Levin D.B. Microbial and enzymatic degradation of synthetic plastics // Front. Microbiol. 2020. V. 11. P. 580709.
Niu L., Song L., Liu X., Dong X. Tepidimicrobium xylanilyticum sp. nov., an anaerobic xylanolytic bacterium, and emended description of the genus Tepidimicrobium // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 2698‒2701.
Perevalova A.A., Kublanov I.V., Baslerov R., Zhang G., Bonch-Osmolovskaya E.A. Brockia lithotrophica gen. nov., sp. nov., an anaerobic thermophilic bacterium from a terrestrial hot spring // Int. J. Syst. Evol. Microbiol. 2013. V. 63. P. 479‒483.
Quast C., Pruesse E., Yilmaz P., Gerken J., Schweer T., Yarza P., Peplies J., Glöckner F.O. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools // Nucl. Acids Res. 2013. V. 41. P. 590‒596.
Rana A.K., Thakur M.K., Saini A.K., Mokhta S.K., Moradi O., Rydzkowski T., Alsanie W.F., Wang Q, Grammatikos S., Thakur V.K. Recent developments in microbial degradation of polypropylene: integrated approaches towards a sustainable environment // Sci. Total Environ. 2022. V. 826. P. 154056.
Ru J., Huo Y., Yang Y. Microbial degradation and valorization of plastic wastes // Front. Microbiol. 2020. V. 11. P. 442.
Sekiguchi Y., Imachi H., Susilorukmi A., Muramatsu M., Ohashi A., Harada H., Hanada S., Kamagata Y. Tepidanaerobacter syntrophicus gen. nov. sp. nov., an anaerobic, moderately thermophilic, syntrophic alcohol- and lactate-degrading bacterium isolated from thermophilic digested sludges // Int. J. Syst. Evol. Microbiol. 2006. V. 56. P. 1621–1629.
Skariyachan S., Patil A.A., Shankar A., Manjunath M., Bachappanavar N., Kiran S. Enhanced polymer degradation of polyethylene and polypropylene by novel thermophilic consortia of Brevibacillus sps. and Aneurinibacillus sp. screened from waste management landfills and sewage treatment plants // Polym. Degrad. Stab. 2018. V. 149. P. 52–68.
Slobodkin A.I., Tourova T.P., Kostrikina N.A., Lysenko A.M., German K.E., Bonch-Osmolovskaya E.A., Birkeland N.K. Tepidimicrobium ferriphilum gen. nov., sp. nov., a novel moderately thermophilic, Fe(III)-reducing bacterium of the order Clostridiales // Int. J. Syst. Evol. Microbiol. 2006. V. 56. P. 369‒372.
Trüper H.G., Schlegel H.G. Sulphur metabolism in Thiorhodaceae I. Quantitative measurements on growing cells of Chromatium okenii // Antonie van Leeuwenhoek. 1964. V. 30. P. 225‒238.
Tsavkelova E., Prokudina L., Egorova M., Leontieva M., Malakhova D., Netrusov A. The structure of the anaerobic thermophilic microbial community for the bioconversion of the cellulose-containing substrates into biogas // Process Biochem. 2018. V. 66. P. 183‒196.
Vortsepneva E., Chevaldonné P., Klyukina A., Naduvaeva E., Todt C., Zhadan A., Tzetlin A., Kublanov I. Microbial associations of shallow-water Mediterranean marine cave Solenogastres (Mollusca) // Peer J. 2021. V. 9. e12655.
Wang Q., Garrity G.M., Tiedje J.M., Cole J.R. Naïve Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy // Appl. Environ. Microbiol. 2007. V. 73. P. 5261‒5267.
Watanabe M., Kojima H., Fukui M. Review of Desulfotomaculum species and proposal of the genera Desulfallas gen. nov., Desulfofundulus gen. nov., Desulfofarcimen gen. nov. and Desulfohalotomaculum gen. nov. // Int. J. Syst. Evol. Microbiol. 2018. V. 68. P. 2891‒2899.
Дополнительные материалы
- скачать ESM.tiff
- Приложение 1.
Рис. ES1. Показатели альфа-биоразнообразия анаэробных микробных сообществ при расчете индексов Чао (Chao1), Шеннона (Shannon) и обратного индекса Симпсона (InvSimpson) для опытных образцов (plast) с изделиями из полипропилена (PP) и поливинилхлорида (PVC) и контрольных образцов (cont) для второго (2) и четвертого (4) пересевов микробных консорциумов, культивируемых при 55°С.


