Микробиология, 2023, T. 92, № 1, стр. 68-76
Биоцидная активность наночастиц аспарагината хитозана
А. Б. Шиповская a, Т. Н. Луговицкая b, *, И. В. Зудина a
a Саратовский национальный исследовательский государственный университет
им. Н.Г. Чернышевского
410012 Саратов, Россия
b Уральский федеральный государственный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, Россия
* E-mail: tlugovitskaja@mail.ru
Поступила в редакцию 09.07.2022
После доработки 14.08.2022
Принята к публикации 14.08.2022
- EDN: NNDRBA
- DOI: 10.31857/S0026365622600547
Аннотация
Исследована биологическая активность наночастиц аспарагината хитозана, образующихся в системе хитозан‒L-аспарагиновая кислота‒вода на начальном этапе фазового разделения, в отношении клеток эу- и прокариот. Культивирование Staphylococcus aureus 209 P и Escherichia coli 113-13 в питательной среде с добавлением наночастиц приводило к массированной гибели бактериальных культур. Наиболее высокое биоцидное действие проявлялось в отношении грамположительных бактерий. Биотестирование выявило высокую биосовместимость наночастиц хитозана и их способность ускорять пролиферативную активность эпидермальных и эпителиальных клеточных культур. Полученные результаты демонстрируют перспективность использования наночастиц аспарагината хитозана в медико-биологических и фармакологических приложениях.
В последние годы особое внимание уделяется получению наночастиц хитозана и исследованию их биологической функциональности. Хитозан – линейный сополимер (1 → 4)-2-амино-2-дезокси-β-D-глюкана и (1 → 4)-2-ацетамидо-2-дезокси-β-D-глюкана со степенью дезацетилирования выше ~75 мол. %. Метаболизируется некоторыми ферментами человека, особенно лизоцимом, что позволяет рассматривать его как биорезорбируемый полимер (Muzzarelli, 2011; Babicheva et al., 2017). Он антитоксичен (Салтыкова и соавт., 2018; Gegel et al., 2018), обладает высокой мукоадгезией (Stie et al., 2020), проявляет антиоксидантные (Салтыкова и соавт., 2018) и биоцидные свойства (Rhoades, Roller, 2000; No et al., 2002; Raafat et al., 2008; Kong et al., 2010; Куликов и соавт., 2012; Гегель и соавт., 2018), ингибирует процесс формирования биопленок (Полюдова и соавт., 2019). Сочетает в себе высокую биосовместимость (Rinaudo, 2006; Muzzarelli, 2011) и ранозаживляющие свойства (Lau, Kiick, 2015; Шиповская и соавт., 2021). Установлено, что хитозан оказывает активирующее действие на макрофаги, ингибирует металлопротеиназы, а также действует как хемоаттрактант для нейтрофилов, стимулирует эпителизацию и образование грануляционной ткани (Muzzarelli, 2011). При этом хитоолигомеры участвуют в синтезе гликозаминогликанов, способствующих подвижности, адгезии и пролиферации клеток и, соответственно, восстановлению тканей.
Как и хитозан, наночастицы на его основе нетоксичны (Mohammed et al., 2017), обладают широким спектром антибактериальной активности (Rozman et al., 2019; Chandrasekaran et al., 2020), мукоадгезивностью (Marciello et al., 2017; Mohammed et al., 2017), противовоспалительным и антиоксидантным потенциалом (Supraja et al., 2018; Mubarak et al., 2018), противораковым (Kravanja et al., 2019) и ранозаживляющим действием (Rossi et al., 2017; Rozman et al., 2019). Кроме того, благодаря малым размерам хитозановые наночастицы приобретают дополнительные ценные свойства, такие как увеличенная площадь поверхности и квантовые размерные эффекты (Chandrasekaran et al., 2020). Показано, что биоактивность наночастиц хитозана оказывается существенно более высокой по сравнению с исходным хитозаном (Rossi et al., 2017; Chandrasekaran et al., 2020). В случае иммобилизации в структуре наночастиц противомикробных препаратов наблюдается не только стабилизация, но и повышение эффективности действия антимикробного агента (Rozman et al., 2019).
Наночастицы хитозана могут быть получены с использованием эмульсионной или межфазной полимеризации, коацервации/осаждения, самосборки, ионнотропного гелеобразования с использованием ионных сшивающих агентов и др. (Ильина и соавт., 2008; Luangtana-Anan et al., 2017; Rossi et al., 2017; Divya, Jisha, 2018). Хитозановые наночастицы перспективны в системах контролируемой непарентеральной доставки лекарств и их пролонгированного высвобождения в зоне запланированной локализации (Mohammed et al., 2017; Divya, Jisha, 2018), а также инкапсуляции биологически активных веществ (Marciello et al., 2017; Luangtana-Anan et al., 2017; Rozman et al., 2019), тераностике (Jhaveri et al., 2021), в качестве высокоэффективных ранозаживляющих материалов (Rozman et al., 2019), противомикробных агентов (Divya, Jisha, 2018; Chandrasekaran et al., 2020), средств стимуляции роста и защиты растений (Yu et al., 2021). Отмечается также расширение биологической функциональности наночастиц при использовании для их получения солей хитозана с фармакологически активными карбоновыми кислотами и аминокислотами – аскорбиновой, гликолевой, молочной, глутаминовой (Rossi et al., 2017; Luangtana-Anan et al., 2017).
В настоящей работе для получения наночастиц использовали соль хитозана с L-аспарагиновой кислотой (AspA). Ранее нами исследованы условия растворения хитозана в водном растворе AspA (Луговицкая и соавт., 2017, 2020). Обнаружено, что система хитозан‒AspA‒вода кинетически нестабильна вследствие эффектов ионной ассоциации, и через ~24–36 ч после ее приготовления образуются зародыши новой фазы в виде сферических и эллипсоидных наночастиц (Lugovitskaya et al., 2022; рис. 1). Во времени наблюдается агрегация наночастиц, и через ~72–96 ч концентрированная по полимеру фаза высаждается из системы в виде мелкодисперсного осадка. ИК-спектроскопия и рентгеновская дифрактометрия показали, что осадок представлен солевой формой аспарагината хитозана с развитой системой Н-связей и высокой степенью кристалличности. Наночастицы легко выделяются из хранившейся системы распылением на стеклянную обезжиренную поверхность с использованием механического инжектора.
Рис. 1.
СЭМ-фотографии наночастиц аспарагината хитозана, выделенных из системы хитозан‒AspA‒вода через 24 (а) и 36 ч (б) после ее приготовления.

Выбор L-аспарагиновой кислоты был обусловлен ее высокой биологической значимостью: она относится к классу протеиногенных аминокислот, выполняет важную роль в процессах переаминирования, биосинтеза мочевины и пиримидиновых оснований, в цикле лимонной кислоты (Кребса), широко используется в медико-биологических и фармакологических приложениях (Ayon, 2020). Ранее нами уже были показаны антибактериальная активность свежеприготовленных водных растворов аспарагината хитозана и их высокая биосовместимость с тканями человека (Луговицкая и соавт., 2017, 2020).
Целью настоящей работы явилось исследование биоцидной активности наночастиц аспарагината хитозана, образующихся в системе хитозан‒AspA‒ вода на начальном этапе фазового разделения, в отношении клеток эу- и прокариот.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Использовали порошкообразный хитозан со средневязкостной молекулярной массой 200 кДа, степенью деацетилирования 82 мол. %, влажностью W = 8 ± 1 мас. % (ООО “Биопрогресс”, Россия); порошок AspА фармакопейной степени чистоты, полученной биокаталитическим синтезом с использованием штамма E. coli ВКПМ 7188 (АО “Биоамид”, Россия); бидистиллированную воду; этиловый спирт (95.6%), ацетон. CTS и AspА использовали без дополнительной очистки, остальные реагенты были квалификации ч. д. а.
Исходную систему хитозан‒AspA‒вода получали растворением расчетных навесок хитозана (с учетом W образца) и AspА в бидистиллированной воде при 25°С и перемешивании на магнитной мешалке с частотой оборотов вращения 400‒500 об./мин до визуального растворения порошков в течение 1–2 ч. Навески хитозана предварительно стерилизовали в ламинарном боксе (“NUAIRE Biological Safeti Cabinets”, Франция) в течение 15 мин. Полученный гомогенный водный раствор аспарагината хитозана фильтровали через фильтр Millipore с диаметром пор ≤0.45 мкм и оставляли в комнатной атмосфере (760 мм рт. ст., 22 ± 2°C) на 24 ч для формирования наночастиц.
Для подтверждения образования наночастиц 0.5 мкл суточной системы хитозан‒AspA‒вода распыляли на стеклянную обезжиренную (этиловым спиртом и ацетоном) поверхность с использованием механического инжектора в форме шприца и высушивали в течение 1–2 ч при 22 ± 2°С и атмосферном давлении до воздушно-сухого состояния. На полученные образцы напыляли слой золота толщиной 5 нм на установке K450X Carbon Coater (“Quorum Technologies, Ltd.”, Германия) и анализировали на растровом электронном микроскопе SEM MIRA//LMU (“Tescan”, Чехия) при напряжении 30 кВ и проводящем токе 400 пкА.
Антибактериальную активность исследовали на модели суточных культур референтных штаммов Staphylococcus aureus 209 P и Escherichia coli 113-13, культивируемых в мясо-пептонном бульоне (МПБ) без добавки (контроль) и с добавкой AspA или наночастиц аспарагината хитозана. Использовали водный раствор AspA концентрации 0.4 × 10–3 моль/дл и систему хитозан‒AspА‒вода с концентрацией хитозана С = 0.5 × 10–3 осново-моль/дл и той же концентрации AspA, т.е. с мольным соотношением кислота/хитозан ([As-pA]/[~‒NH2]) 0.8 моль/осново-моль, взятые в разведении 1 : 10. Здесь и далее данное соотношение [AspA]/[~‒NH2] выбрано с учетом степени протонирования полимера при формировании солевой формы аспарагината хитозана (Луговицкая и соавт., 2020) с целью минимизирования присутствия в системе несвязанной AspA.
Суточные агаровые тест-культуры S. aureus 209 P и E. coli 113-13 вносили в литровые колбы с МПБ для получения суспензии с оптической плотностью D = 0.2, инкубировали при 37°С в условиях интенсивной аэрации до достижения D = 0.5. Оптическую плотность измеряли при λ = 600 нм на спектрофотометре UV-Vis Specord-M40 (“Carl Zeiss”, Германия). Далее в пробирку вносили 4.5 мл бактериальной суспензии, добавляли 0.5 мл физиологического раствора (контроль), либо такой же объем водного раствора AspА или взвеси наночастиц аспарагината хитозана и культивировали в течение 18 ч при 37°С. Затем клетки осаждали центрифугированием, двукратно промывали фосфатно-солевым буфером и окрашивали смесью флуоресцентных красителей SYTO 9 и иодида пропидия (набор реактивов Live/Dead BacLight Bacterial Viability Kit, США). Зеленый краситель SYTO 9 визуализировал живые бактерии, красный краситель иодид пропидия – бактерии с поврежденной мембраной. Приготовленные препараты микроскопировали на флуоресцентном микроскопе Nikon Eclipse LV100D (“Nikon”, Япония). Антибактериальную активность АG/R (отн. ед.) выражали по соотношению:
где FG и FR – количество (%) жизнеспособных и погибших бактерий соответственно. Для получения статистически значимого результата эксперимент повторяли трижды.
Цитотоксическое действие исследовали in vitro на модели клеточных линий человеческих дермальных фибробластов и нормальных кератиноцитов, полученных из биоптатов кожи здоровых взрослых доноров после косметической операции, а также эпителиоцитов эмбриональной почки макаки резус MA-104 (ИНЦ РАН, г. Санкт-Петербург, Россия). Методика получения человеческих фибробластов и нормальных кератиноцитов взята из работы (Howling et al., 2001). Использовали систему хитозан‒AspА‒вода с С = 0.3 × 10–3 осново-моль/дл, [AspA]/[~‒NH2] = 0.8 моль/осново-моль, разведение 1 : 6.
Для культивирования фибробластов и MA-104 применяли ростовую среду DMEM (“Sigma”), кератиноцитов – смесь ростовых сред DMEM : F12 = = 3 : 1 (“Sigma”), дополненные 10% FBS (“Hyclone”) и 1% антибиотиков (“Sigma”). В стерильные чашки Петри с питательной средой вносили суспензию суточной культуры фибробластов из расчета 200 тыс. кл./мл, либо кератинцитов – 250 тыс. кл./мл или MA-104 – 110 тыс. кл./мл и взвесь наночастиц аспарагината хитозана. Контролем служила питательная среда с клеточной культурой без наночастиц. Клетки культивировали в течение 3‒4 сут в СО2-инкубаторе “MCO–18AIC San-yo” (Япония) при постоянных температуре (37°С), влажности (90%) и содержании СО2 (5%). Питательную среду в чашках не меняли до окончания срока наблюдения. Для объективизации исследования проводили по три опытных посева для каждой клеточной культуры.
О цитотоксическом действии наночастиц аспарагината хитозана судили по времени адгезии и распластывания клеток, а также скорости их пролиферации. Наблюдение за адгезией, распластыванием и пролиферацией клеток осуществляли на инвертированном микроскопе “Биолам П-3” (“ЛОМО”, Россия) с цифровой камерой. После инкубации неприкрепившиеся клетки удаляли, а адгезированную культуру фиксировали 70% раствором этилового спирта в течение 10 мин (20°С), окрашивали 0.04% раствором трипанового синего и подсчитывали количество клеток на автоматическом счетчике клеток “Countess Thermo Fisher Scientific” (США). Для количественной оценки пролиферативных свойств использовали индекс пролиферации (PI):
где NT и NК – количество клеток в питательной среде с добавкой наночастиц аспарагината хитозана и в контроле.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Наше предыдущее исследование показало, что в системе хитозан‒AspA‒вода на начальном этапе ее фазового разделения образуются наночастицы аспарагината хитозана (Lugovitskaya et al., 2022). Формирование наночастиц происходит в результате ионной ассоциации хитозанового поликатиона и аниона кислоты с формированием ионных пар и мультиплетных структур. В настоящем исследовании использовали систему хитозан‒AspA‒вода, выдержанную в условиях комнатной атмосферы в течение 24 ч, то есть в которой формируются наночастицы сферической формы (рис. 1а). Перед проведением экспериментов систему тестировали на наличие наночастиц методом электронной микроскопии; размер частиц составил 40–90 нм.
Биоцидное действие наночастиц аспарагината хитозана оценивали в условиях in vitro как в отношении клеток прокариот (референтные штаммы бактерий S. aureus 209 P и E. coli 113-13), так и в отношении культур эукариотических клеток животного происхождения (эпителиоциты МА-104, человеческие кератиноциты и фибробласты).
Результаты исследования антибактериальной активности наночастиц аспарагината хитозана представлены на рис. 2 и в табл. 1. После обработки культур бактерий флуоресцентными красителями жизнеспособные клетки окрашивались в зеленый цвет, а клетки с поврежденными мембранами – в красный. Экспериментально установлено, что добавление в МПБ наночастиц аспарагината хитозана приводит к существенному угнетению роста обеих бактериальных тестовых культур. Причем культура грамположительной S. aureus 209 P была в ~6 раз более чувствительна к воздействию наночастиц аспарагината хитозана, чем культура грамотрицательной E. coli 113-13. Водный раствор AspA оказывал меньшее биоцидное действие на обе культуры, по сравнению с наночастицами.
Рис. 2.
Флуоресцентная микроскопия культур S. aureus 209 P (а–в) и E. coli 113-13 (г–е), выросших в МПБ без добавления (а, г) и с добавлением АspA (б, д) наночастиц аспарагината хитозана (в, е). Зеленая флуоресценция – жизнеспособные клетки; красная флуоресценция – погибшие клетки. Увеличение ×400.
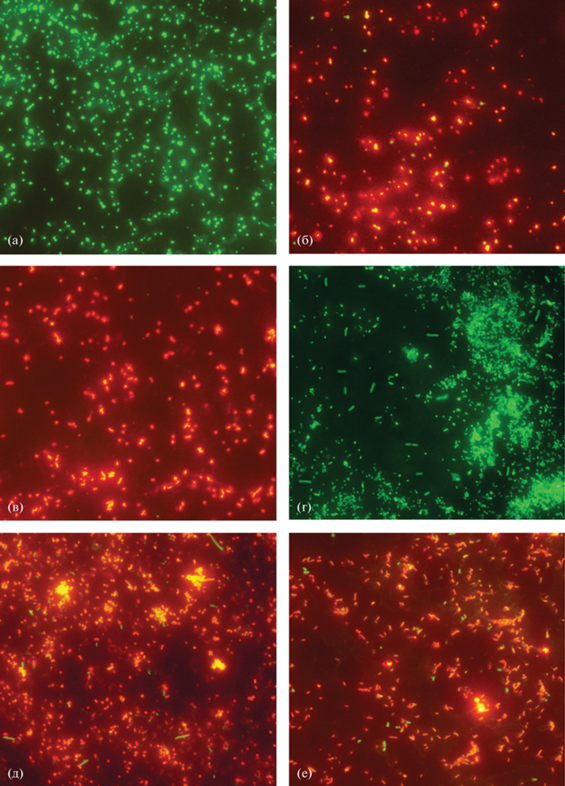
Таблица 1.
Соотношение жизнеспособных и нежизнеспособных клеток S. aureus 209 P и E. coli 113-13 через 18 ч культивирования в МПБ без добавления (контроль) и с добавлением АspA или наночастиц аспарагината хитозана
| Образец | Staphylococcus aureus 209 P | Escherichia coli 113-13 | ||||
|---|---|---|---|---|---|---|
| количество клеток, % | АG/R × 102, отн. ед. |
количество клеток, % | АG/R × 102, отн. ед., |
|||
| живые | погибшие | живые | погибшие | |||
| Контроль | 100 | 0 | – | 100 | 0 | – |
| АspA | 6.0 | 94.0 | 6.4 | 12.6 | 87.4 | 14.4 |
| Наночастицы | 1.4 | 98.6 | 1.4 | 7.6 | 92.4 | 8.3 |
Как оказалось, внесение наночастиц аспарагината хитозана в питательную среду для культивирования эукариотических клеток в условиях in vitro не только не оказывает цитотоксическое действие на эпителиоциты МА-104 и человеческие кератиноциты и фибробласты, но и положительно влияет на скорость адгезии и распластывания клеток, а также ускоряет их пролиферацию (рис. 3, табл. 2). Так, через 1 ч культивирования в среде с добавкой наблюдается значимо большее количество адгезированных и распластанных клеток, чем в стандартной питательной среде (табл. 2). В течение последующих двух суток формирование монослоя клеток в присутствии наночастиц аспарагиновокислого хитозана шло также более быстрыми темпами, а индекс пролиферации значимо выше, чем в контроле. Форма и размеры клеток зрелого монослоя соответствуют норме (рис. 3), что свидетельствует об отсутствии цитотоксического действия тестируемых наночастиц и их высокой биосовместимости.
Рис. 3.
Формирование монослоя дермальных фибробластов (а, б), кератиноцитов (в, г) и эпителиоцитов линии МА-104 (д, е) через 48 ч культивирования в питательной среде без добавления (а, в, д) и с добавлением наночастиц аспарагината хитозана.
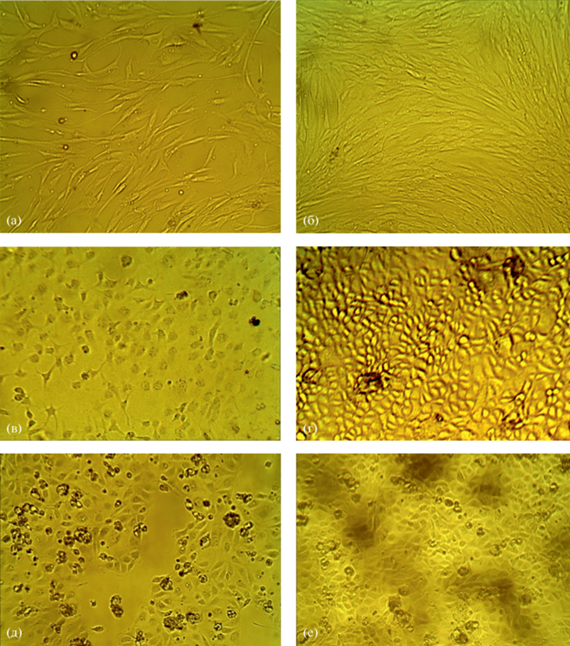
Таблица 2.
Пролиферативные характеристики эпидермальных и эпителиальных клеток при культивировании в питательной среде без добавления (контроль) и с добавлением наночастиц аспарагината хитозана
| Образец | Культура клеток | Доля адгезированных клеток, % | Доля распластанных клеток, % | Время формирования монослоя, ч | PI |
|---|---|---|---|---|---|
| время культивирования 1 ч | 48 ч | ||||
| Контроль | Фибробласты | 55.5 | 77.2 | >60 | 1.0 |
| Наночастицы | 92.4 | 96.5 | <48 | 2.7 | |
| Контроль | Кератиноциты | 20.8 | 61.6 | >72 | 1.0 |
| Наночастицы | 51.4 | 91.5 | <56 | 3.1 | |
| Контроль | МА-104 | 84.0 | 56.4 | >48 | 1.0 |
| Наночастицы | 99.3 | 97.7 | <48 | 4.5 | |
Принято считать, что биоцидная активность хитозана в отношении клеток прокариот определяется наличием в составе макроцепи протонированных аминогрупп, обуслoвливающих связывание биополимера с анионными компонентами поверхностных структур клеток микроорганизмов за счет электростатического взаимодействия (Raafat et al., 2008; Kong et al., 2010). При этом, как полагают, образуются трансмембранные каналы в виде цилиндрических бочек или тороидальных пор. Характер и масштабы повреждения бактериальной стенки зависят от количества адсорбированного на ее поверхности хитозана, что, в свою очередь, определяется плотностью отрицательного заряда клеточной мембраны (Másson et al., 2008). В случае грамотрицательных бактерий главной мишенью для положительно заряженных молекул солевой формы хитозана является отрицательно заряженный липополисахарид, входящий в состав наружной части клеточной мембраны и обеспечивающий структурную целостность бактериальной клетки. У грамположительных бактерий основной мишенью являются тейхоевые кислоты (Набережных и соавт., 2008). И липополисахариды, и тейхоевые кислоты способны связывать ионы металлов, играя важнейшую роль в сохранении нормального баланса бивалентных катионов в районе цитоплазматической мембраны.
Ряд авторов утверждают, что хитозан оказывает более сильное биоцидное действие на грамположительные бактерии (No et al., 2002). В нашем исследовании наблюдалась аналогичная тенденция: грамположительный штамм S. aureus 209 P проявил более высокую чувствительность к действию наночастиц аспарагината хитозана, чем грамотрицательный штамм E. coli 113-13. При этом процент нежизнеспособных клеток в суспензиях обоих штаммов в присутствии наночастиц был существенно выше, чем у этих же культур в присутствии AspA. По всей видимости, немаловажную роль в этом явлении играет увеличение числа доступных протонированных аминогрупп хитозана за счет возрастания удельной площади поверхности наночастиц.
Проявляя биоцидное действие в отношении клеток прокариотов, наночастицы аспарагината хитозана не оказывали какое-либо деструктивное влияние на клетки эукариотов. Отдельные авторы ранее указывали на тот факт, что двуслойные цитоплазматические мембраны клеток млекопитающих обогащены цвиттерионными фосфолипидами (фосфатидилэтаноламином, фосфатидилхолином, сфингомиелином) и стеринами (холестерином), которые обеспечивают клетке нейтральный суммарный поверхностный заряд, что и препятствует электростатическому взаимодействию с хитозаном (Rhoades, Roller, 2000). В наших экспериментах было показано, что в присутствии наночастиц аспарагината хитозана культуры эпидермальных и эпителиальных клеток демонстрировали высокую пролиферативную активность и способность в более короткие сроки, чем в контроле, формировать зрелый монослой. Видимо, благодаря близости хитозана как по структуре, так и по составу к мукополисахаридам внеклеточного вещества и клеточных оболочек млекопитающих (гиалуроновой кислоте, хондроитину и др.), а также соизмеримым с хитоолигомерами размером наночастиц, последние могут участвовать в синтезе гликозаминогликанов и улучшать ростовые характеристики культур клеток.
Проведенное биотестирование клеточных культур эу- и прокариот позволяет рассматривать наноструктурированную систему хитозан‒AspA‒вода как прототип высокоэффективного антибактериального препарата нового поколения, а также в качестве перспективной модифицирующей добавки для улучшения ростовых качеств питательной среды и ускорения роста популяции клеток в культуре. На наш взгляд, использование наночастиц аспарагината хитозана открывает широкие возможности при создании принципиально новых видов лекарственных форм, вакцин и может быть востребовано в самых разнообразных медико-биологических и фармакологических приложениях, в том числе, в области тераностики.
Список литературы
Гегель Н.О., Зудина И.В., Малинкина О.Н., Шиповская А.Б. Влияние изомерной формы аскорбиновой кислоты на антибактериальную активность ее солей с хитозаном // Микробиология. 2018. Т. 87. С. 618–623.
Gegel N.O., Zudina I.V., Malinkina O.N., Shipovskaya A.B. Effect of ascorbic acid isomeric forms on antibacterial activity of its chitosan salts // Microbiology (Moscow). 2018. V. 87. P. 732–737.
Ильина А.В., Варламов В.П., Ермаков Ю.А. Хитозан – полимер для формирования наночастиц // ДАH. 2008. Т. 421. № 2. С. 199–201.
Il’ina A.V., Varlamov V.P., Skryabin K.G., Ermakov Yu.A., Orlov V.N. Chitosan is a natural polymer for constructing nanoparticles // Doklady Chem. 2008. V. 421. P. 165–167.
Куликов С.Н., Шакирова Д.Р., Тихонов В.Е., Безродных Е.А., Ильина А.В., Левов А.Н., Варламов В.П. Антимикотическая активность хитозана и его производных в отношении Candida albicans // Проблемы медицинской микологии. 2012. Т. 14. № 4. С. 50–54.
Луговицкая Т.Н., Шиповская А.Б. Физико-химические свойства водных растворов L-аспарагиновой кислоты с добавкой хитозана // Журн. общей химии. 2017. Т. 87. С. 650–656.
Lugovitskaya T.N., Shipovskaya A.B. Physicochemical properties of aqueous solutions of L-aspartic acid containing chitosan // Russ. J. Gen. Chem. 2017. V. 87. P. 782–787.
Луговицкая Т.Н., Зудина И.В., Шиповская А.Б. Получение и свойства аспарагиновокислых растворов хитозана // Журн. прикл. химии. 2020. Т. 93. С. 90–99.
Lugovitskaya T.N., Zudina I.V., Shipovskaya A.B. Obtaining and properties of L-aspartic acid solutions of chitosan // Russ. J. Appl. Chem. 2020. V. 93. P. 80–88.
Набережных Г.А., Горбач В.И., Лихацкая Г.Н., Давыдова В.Н., Соловьева Т.Ф. Взаимодействие хитозанов и N-ацилированных производных хитозанов с липополисахаридами грамотрицательных бактерий // Биохимия. 2008. Т. 73. С. 530–541.
Naberezhnykh G.A., Gorbach V.I., Likhatskaya G.N., Davidova V.N., Solov’eva T.F. Interaction of chitosans and their N-acylated derivatives with lipopolysaccharide of gram-negative bacteria // Biochemistry (Moscow). 2008. V. 73. P. 432–441.
Полюдова Т.В., Шагдарова Б.Ц., Коробовa В.П., Варламов В.П. Бактериальная адгезия и образование биопленок в присутствии хитозана и его производных // Микробиология. 2019. Т. 88. С. 129–136.
Polyudova T.V., Korobov V.P., Shagdarova B.T., Varlamov V.P. Bacterial adhesion and biofilm formation in the presence of chitosan and its derivatives // Microbiology (Moscow). 2019. V. 88. P. 125–131.
Салтыкова Е.С., Гайфуллина Л.Р., Каскинова М.Д., Гатауллин А.Р., Матниязов Р.Т., Поскряков А.В., Николенко А.Г. Действие хитозана на развитие микроспоридий Nosema apis в медоносных пчелах // Микробиология. 2018. Т. 87. С. 624–630.
Saltykova E.S., Gaifullina L.R., Kaskinova M.D., Gataullin A.R., Matniyazov R.T., Poskryakov A.V., Nikolenko A.G. Effect of chitosan on development of Nosema apis microsporidia in honey bees // Microbiology (Moscow). 2018. V. 87. P. 738–743.
Шиповская А.Б., Малинкина О.Н., Гегель Н.О., Зудина И.В., Луговицкая Т.Н. Структура и свойства солевых комплексов хитозана с диастереомерами аскорбиновой кислоты // Изв. АН. Сер. химич. 2021. № 9. С. 1765–1774.
Shipovskaya A.B., Malinkina O.N., Gegel N.O., Zudina I.V., Lugovitskaya T.N. Structure and properties of chitosan salt complexes with ascorbic acid diastereomers // Russ. Chem. Bull. 2021. V. 70. P. 1765–1774.
Ayon N.J. Features, roles and chiral analyses of proteinogenic amino acids // AIMS Mol. Sci. 2020. V. 7. P. 229–268.
Babicheva T.S., Gegel N.O., Shipovskaya A.B. Visualization of morphological features of chitosan microtubes during biodegradation // J. Phys.: Conf. Ser. – IOP Publishing, 2017. Iss. 4. P. 042026.
Chandrasekaran M., Kim K.D., Chun S.C. Antibacterial activity of chitosan nanoparticles: a review // Processes. 2020. V. 8. P. 1173.
Divya K., Jisha M.S. Chitosan nanoparticles preparation and applications // Environ. Chem. Lett. 2018. V. 16. P. 101–112.
Gegel N.O., Zhuravleva Yu.Yu., Shipovskaya A.B., Malinkina O.N., Zudina I.V. Influence of chitosan ascorbate chirality on the gelation kinetics and properties of silicon-chitosan-containing glycerohydrogels // Polymers. 2018. V. 10. P. 259.
Howling G.I., Dettmar P.W., Goddard P.A., Hampson F.C., Dornish M., Wood E.J. The effect of chitin and chitosan on the proliferation of human skin fibroblasts and keratinocytes in vitro // Biomaterials. 2001. V. 22. P. 2959–2966.
Jhaveri J., Raichura Z., Khan T., Momin M., Omri A. Chitosan nanoparticles-insight into properties, functionalization and applications in drug delivery and theranostics // Molecules. 2021. V. 26. P. 272.
Kong M., Chen X.G., Xing K., Park H.J. Antimicrobial properties of chitosan and mode of action: a state of the art review // Int. J. Food Microbiol. 2010. V. 144. P. 51–63.
Kravanja G., Primožič M., Knez Ž., Leitgeb M. Chitosan-based (nano) materials for novel biomedical applications // Molecules. 2019. V. 24. P. 1960.
Lau H.K., Kiick K.L. Opportunities for multicomponent hybrid hydrogels in biomedical applications // Biomacromolecules. 2015. V. 16. P. 28–42.
Luangtana-Anan M., Nunthanid J., Limmatvapirat S. Potential of different salt forming agents on the formation of chitosan nanoparticles as carriers for protein drug delivery systems // J. Pharm. Investigation. 2017. V. 49. P. 37–44.
Lugovitskaya T.N., Shipovskaya A.B., Shmakov S.L., Shipenok X.M. Formation, structure, properties of chitosan aspartate and metastable state of its solutions for obtaining nanoparticles // Carbohydr. Polym. 2022. V. 277. P. 118773.
Marciello M., Rossi S., Caramella C., Remunan-Lopez C. Freeze-dried cylinders carrying chitosan nanoparticles for vaginal peptide delivery // Carbohydr. Polym. 2017. V. 170. P. 43–51.
Másson M., Holappa J., Hjálmarsdóttir M., Rúnarsson Ö.V., Nevalainen T., Järvinen T. Antimicrobial activity of piperazine derivatives of chitosan // Carbohydr. Polym. 2008. V. 74. P. 566–571.
Mohammed M.A., Syeda J., Wasan K.M., Wasan E.K. An overview of chitosan nanoparticles and its application in non-parenteral drug delivery // Pharmaceutics. 2017. V. 9. Is. 4. P. 53.
Mubarak Ali D., Lewis Oscar F., Gopinath V., Alharbi N.S., Alharbi S.A., Thajuddin N. An inhibitory action of chitosan nanoparticles against pathogenic bacteria and fungi and their potential applications as biocompatible antioxidants // Microb. Pathog. 2018. V. 114. P. 323–327.
Muzzarelli R.A.A. Chitosan composites with inorganics, morphogenetic proteins and stem cells, for bone regeneration. Review article // Carbohydr. Polym. 2011. V. 83. P. 1433–1445.
No H.K., Park N.Y., Lee S.H., Meyers S.P. Antibacterial activity of chitosans and chitosan oligomers with different molecular weights // Int. J. Food Microbiol. 2002. V. 74. P. 65–72.
Raafat D., Von Bargen K., Haas A., Sahl H.G. Insight into the mode of action of chitosan as an antibacterial compound // Appl. Environ. Microbiol. 2008. V. 74. P. 3764–3773.
Rhoades J., Roller S. Antimicrobial actions of degraded and native chitosan against spoilage organisms in laboratory media and foods // Appl. Environ. Microbiol. 2000. V. 66. P. 80–86.
Rinaudo M. Chitin and chitosan: properties and applications // Prog. Polym. Sci. 2006. V. 31. P. 603–632.
Rossi S., Vigani B., Puccio A., Bonferoni M.C., Sandri G., Ferrari F. Chitosan ascorbate nanoparticles for the vaginal delivery of antibiotic drugs in atrophic vaginitis // Marine Drugs. 2017. V. 15. P. 319.
Rozman N.A.S., Tong W.Y., Leong C.R., Tan W.N., Hasanolbasori M.A., Abdullah S.Z. Potential antimicrobial applications of chitosan nanoparticles (ChNP) // J. Microbiol. Biotechnol. 2019. V. 29. P. 1009–1013.
Stie M.B., Gätke J.R., Wan F., Chronakis I.S., Jacobsen J., Nielsen H.M. Swelling of mucoadhesive electrospun chitosan/polyethylene oxide nanofibers facilitates adhesion to the sublingual mucosa // Carbohydr. Polym. 2020. V. 242. P. 116428.
Supraja N., Thiruchenduran S., Prasad T. Synthesis and characterization of chitosan nanoparticles and evaluation of antimicrobial activity antioxidant activity // Advancement Bioequiv. Bioavailab. 2018. V. 2. P. 88–93.
Yu J., Wang D., Geetha N., Khawar K.M., Jogaiah S., Mujtaba M. Current trends and challenges in the synthesis and applications of chitosan-based nanocomposites for plants: a review // Carbohydr. Polym. 2021. V. 261. P. 117904.
Дополнительные материалы отсутствуют.


