Микробиология, 2023, T. 92, № 1, стр. 57-67
Сравнительная оценка стрессовых ответов микроводорослей Prorocentrum cordatum (Ostenfeld) Dodge и Dunaliella salina (Teod.) на присутствие в среде наночастиц меди
Е. С. Соломонова a, *, Н. Ю. Шоман a, А. И. Акимов a, О. А. Рылькова a
a Федеральный исследовательский центр “Институт биологии южных морей им. А.О. Ковалевского
Российской академии наук”
299011 Севастополь, Россия
* E-mail: solomonov83@mail.ru
Поступила в редакцию 25.05.2022
После доработки 23.08.2022
Принята к публикации 24.08.2022
- EDN: NMVTMJ
- DOI: 10.31857/S0026365622600468
Аннотация
Проведена сравнительная оценка стрессовых реакций двух видов микроводорослей Prorocentrum cordatum и Dunaliella salina, существенно различающихся как в клеточном строении, так и ареале обитания, на присутствие в среде наночастиц оксида меди. Установлено, что воздействие наночастиц на исследуемые микроводоросли носило схожий характер. Токсический эффект влияния поллютанта проявлялся в прогрессирующей продукции активных форм кислорода в клетках водорослей на фоне снижения их удельной скорости роста, что, вероятно, объясняется высвобождением ионов меди Cu2+ из оксида или проникновением отдельных наночастиц внутрь клеток. При механическом воздействии наночастиц (НЧ) наблюдалась их агрегация на поверхности клеток и деформация клеточных оболочек. Присутствие токсиканта в культуральной среде приводило к достоверному увеличению клеточных объемов, перфорации плазмалеммы, преобладанию деформированных клеток неправильной формы в культурах микроводорослей. В то же время показана разная устойчивость исследуемых видов к воздействию CuO НЧ. Сублетальные и летальные концентрации CuO НЧ для P. cordatum составили 400 и 520 мкг/л, тогда как для D. salina 3000 и 3750 мкг/л соответственно. Предложены гипотезы, объясняющие устойчивость D. salina к воздействию CuO НЧ. Во-первых, D. salina способна продуцировать высокие концентрации лигандов (фитохелатины и металлотионеины), выделяемых клетками в среду для связывания ионов меди. Во-вторых, ареал существования D. salina приурочен к экстремальным условиям среды, что может способствовать ее толерантности к стрессу, что, по-видимому, является генетически закрепленным свойством и частью общей устойчивости водорослей и к другим видам загрязнителей. Кроме того, высокая устойчивость D. salina к воздействию CuO НЧ может объясняться ее способностью секретировать в условиях стресса внеклеточные полимерные соединения для формирования защитного слоя, предотвращающего взаимодействие микроводорослей с наночастицами. Предлагается применение P. cordatum в биомониторинге морских экосистем, загрязненных наночастицами, тогда как зеленая микроводоросль D. salina является перспективным видом для биоремедитации вод.
Инженерные наночастицы являются новыми материалами, широко применяемыми во многих областях деятельности человека. Рост объемов их производства и успешное внедрение вызывают естественные опасения по поводу проявления специфических наноразмерных эффектов для живых организмов. При этом в опасной зоне риска находятся водные организмы (Klaine et al., 2008). Считается, что негативное влияние наночастиц металлов на живые организмы обусловлено комплексным эффектом ряда различных механизмов. В их числе: 1) механическое повреждение мембран клеток, адсорбция отдельных НЧ и их агрегатов на поверхности клеточной стенки, что нарушает ее проницаемость и дыхательную функцию; 2) высвобождение ионов металлов и 3) окислительный стресс (Wang et al., 2020). Отдельные эксперименты по оценке токсичности НЧ на микроводоросли трудно сопоставимы как по видовой специфике объекта исследования, так и по свойствам самих наночастиц, вследствие чего полученные результаты неоднозначны, а иногда противоречивы. Степень токсичности НЧ зависит от их типа, размера, формы, физико-химических свойств и концентрации в среде (Miller et al., 2010). В целом, разрозненность экспериментальных данных в настоящий момент не позволяет исследователям прийти к единому мнению о степени воздействия наноматериалов на живые организмы. В то время как установление допустимых диапазонов концентрации, проведение полной оценки рисков применения НЧ, а также выяснение биологической безопасности наночастиц с учетом всех их физико-химических свойств и иных характеристик являются актуальной задачей.
В данной работе предпринята попытка на модели двух видов микроводорослей ‒ Prorocentrum cordatum и Dunaliella salina, оценить влияние наночастиц оксида меди, которые входят в состав широко использующихся противообрастающих красок и, соответственно, выщелачиваются из них в воду в большом количестве (Adeleye et al., 2016). Выбор объектов исследования обусловлен их значительными различиями как в клеточном строении, так и в условиях их существования. Тестируемый вид P. cordatum – это планктонная водоросль, вызывающая массовые цветения в Черном море в летний период (Сеничева, 2008). Кроме того, P. cordatum относится к потенциально токсичным видам водорослей за счет своей способности выделять водорастворимые токсины (Heil et al., 2005), которые могут представлять серьезную опасность для рыболовства, общественного здравоохранения и морских экосистем. Ранее сообщалось, что увеличение в морской среде концентрации загрязняющих веществ, в частности, наноматериалов, может усугубить данную проблему (Li et al., 2019). Зеленая микроводоросль D. salina представляет собой один из наиболее перспективных объектов для промышленного получения β-каротина и вегетирует в условиях экстремальных экосистем. Ареалом ее обитания являются гиперсоленые озера, характеризующиеся сильным загрязнением, гипоксией и аноксией (Anufriieva et al., 2018). Также выбранные объекты исследования имеют различное строение клеточной оболочки, что особенно важно для оценки механического воздействия НЧ на клетки микроводорослей. P. cordatum характеризуется наличием целлюлозной клеточной стенки в виде текальных пластинок, на которых имеется около 20 пор (Matantseva et al., 2020), в то время как у D. salina клеточная стенка отсутствует, что делает данный вид микроводоросли, вероятно, более чувствительным к действию НЧ.
Таким образом, цель данного исследования заключалась в сравнительной оценке физиологических и морфологических реакций микроводорослей P. cordatum и D. salina в ответ на присутствие в среде наночастиц оксида меди.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования. В качестве объекта исследования были использованы альгологически чистые культуры динофитовой микроводоросли Prorocentrum cordatum (Ostenfeld) Dodge, 1975 (штамм IBSS-64) и зеленой микроводоросли Dunaliella salina (Teod.) (штамм IBSS-1) из коллекции культур микроводорослей и цианобактерий (IBSS) научно-образовательного центра коллективного пользования “Гидробионты мирового океана” (WDCM № 1201) Федерального исследовательского центра “Институт биологии южных морей им. А.О. Ковалевского РАН”.
Условия проведения экспериментов. В ходе эксперимента водоросли выращивали на модифицированной питательной среде f/20 (разбавленная в 10 раз среда f/2; Guillard, Ryther, 1962) без добавления меди и ЭДТА, способного связывать растворенные в воде ионы металлов в хелатные комплексы, тем самым уменьшая их активность и токсическое действие на клетки. Питательную среду готовили на основе фильтрованной и пастеризованной морской воды соленостью 18‰. Культивирование водорослей проводили в конических колбах с объемом культуральной суспензии 150 мл при интенсивности света 85 мкЭ/(м2 с) (5 кЛк), свето-темновом периоде 14/10 ч и температуре 20°С. Освещение колб осуществляли снизу светодиодами холодного света. Уровень освещенности определяли зондирующим 4π датчиком квантометра QSL 2101 (“Biospherical Instruments Inc.”, США). Барботаж культур осуществляли аквариумными компрессорами, скорость подачи воздуха составляла 0.5 л/л культуры в минуту, величина рН культуральной среды находилась в пределах 8.2–8.5. Предварительно до начала эксперимента водоросли адаптировали к заданным абиотическим условиям роста в течение 2 сут. При этом плотность культур поддерживали примерно на одном уровне в экспоненциальной фазе роста (порядка (1‒1.2) × 104 кл./мл у P. cordatum и (2‒2.2) × 104 кл./мл у D. salina) путем ежесуточного разбавления свежей питательной средой. На 3 сут эксперимента в колбы вносили растворы поллютантов.
Для приготовления растворов токсикантов использовали нанопорошок оксида меди (размер частиц 50, “Sigma-Aldrich”, № 544868). Раствор, содержащий наночастицы оксида меди, предварительно обрабатывали ультразвуком с помощью ультразвуковой ванны “Сапфир” в течение 1 ч для диспергирования частиц.
Эксперимент проводили в два этапа. На первом исследовали действие наночастиц меди на скорость роста и продукцию активных форм кислорода (АФК) в клетках P. cordatum и D. salina. Для этого в культуральные сосуды вносили CuO НЧ в концентрациях 0, 100, 200, 300, 520 мкг/л (в пересчете на ионы Cu2+) для P. cordatum и 0, 250, 665, 1330, 2000, 2500, 3750 мкг/л для D. salina. Выбор исследуемых концентраций токсикантов обусловлен предварительно полученными данными о степени устойчивости исследуемых видов водорослей к воздействию CuO НЧ. После добавления поллютантов культуры выращивали в накопительном режиме в заданных абиотических условиях в течение 5 сут.
На втором этапе эксперимента исследовали возможность восстановления продукционных показателей водорослей при добавлении в среду сублетальных концентраций CuO НЧ: 400 мкг/л для P. cordatum и 3000 мкг/л для D. salina (выбор концентраций обусловлен результатами первого этапа эксперимента). В ходе эксперимента культуры P. cordatum и D. salina выращивали в накопительном режиме в течение 5 и 8 сут соответственно. Измерение численности клеток проводили через 3, 6, 12, 24, 48, 72, 96, 120, 168 и 192 ч после добавления поллютанта.
Методы измерений. Цитометрический анализ проб проводили в центре коллективного пользования “Спектрометрия и хроматография” Федерального исследовательского центра “Институт биологии южных морей им. А.О. Ковалевского РАН” на проточном цитометре MACS Quant Analazer (“Miltenyi Biotec”, Германия), оборудованном тремя лазерами (405, 488 и 635 нм). Для обработки данных использовали программу FSC Express 7 Research Edition. Общую численность микроводорослей в культурах определяли в кластере на 2-х параметрических цитограммах по прямому светорассеянию (FS) и флуоресценции отдельных клеток в красной спектральной области (FL4, 675 нм) на безразмерных логарифмических шкалах. Концентрацию клеток рассчитывали по скорости протока пробы (25 мкл/мин) и количеству событий зарегистрированных в определенный промежуток времени. Контроль качества измерений численности производили с помощью калибровочных флуоросфер (Flow-CheckTM, “Beckman Coulter”) с известной концентрацией в пробе. Также в работе использовали показатель SS (боковое светорассеяние) проточного цитометра, характеризующий гранулярность клеток и их зернистость.
Продукцию активных форм кислорода у исследуемых культур водорослей оценивали по флуоресценции красителя 2-7-дихлорфлуоресцеиндиацетат (D2CFH-DA; “Merck”, Германия). D2CFH-DA – клеточно-проницаемый индикатор АФК, наиболее часто используемый для количественной оценки количества генерируемых АФК (Wang, Joseph, 1999). Рабочий раствор красителя и окраску суспензии клеток проводили в соответствии с протоколом, опубликованным в работе (Wang, Joseph, 1999). Интенсивность флуоресценции D2CFH-DA оценивали по свечению клеток в зеленой области спектра (525 нм), предварительно вычитали значения автофлуоресценции клеток P. cordatum и D. salina в данной области спектра.
Удельную скорость роста микроводорослей рассчитывали по формуле (Финенко, Ланская, 1971):
где: µ – удельная скорость роста водорослей, сут–1; N0 и Nt – исходная концентрация клеток и их количество через время t, клеток · л–1; t – время между измерениями, сут.
Токсическое воздействиe наночастиц на исследуемые тест-объекты оценивали по показателю ЕC50 – концентрации поллютанта, при которой численность клеток в культурах и удельная скорость роста водорослей снижались на 50% по отношению к контролю.
Микроскопия. При подготовке образцов для сканирующего электронного микроскопа (СЭМ) 1–2 мл фиксированной пробы концентрировали на трековую мембрану с диаметром пор 3.0 мкм (производства ОИЯИ, г. Дубна, Россия). Далее проводили дегидратацию, используя серию разведения этанола: 20, 30, 50, 75, 96 и 100% (Murtey, Ramasamy, 2016). Для сушки образцов в критической точке (1.5–2.5 ч) использовали устройство Leica EM CPD 300 (Германия). Для напыления (Au/Pd; 0.5–1.0 мин) применяли прибор Leica EM ACE 200 (Германия). Просматривали образцы с помощью сканирующего электронного микроскопа Hitachi SU3500 (Япония), при увеличении от ×500 до ×5000.
В клетках P. cordatum и D. salina измеряли длину (h) и ширину (d); объем для каждого вида рассчитывали по формулам, приведенным в работе (Брянцева и соавт., 2005).
Микроскопию клеток проводили через 72 ч инкубирования водорослей в среде с НЧ CuO в концентрациях 300 и 2500 мкг/л для P. cordatum и D. salina соответственно.
Статистическая обработка данных выполнялась по стандартным программным пакетам Microsoft Exel 7.0, Grapher-16 для персонального компьютера. Значения, указанные на графиках и в таблице, представляют собой среднее из трех повторностей. Бары на графиках показывают среднеквадратичное отклонение измеряемых величин. Достоверность различий между выборками оценивали по t-критерию Стьюдента, при уровни значимости р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
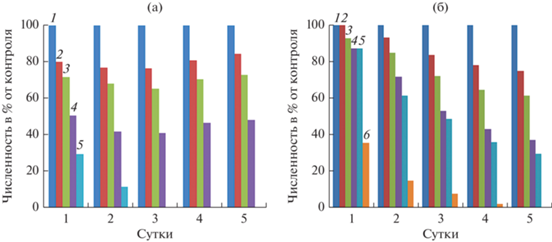
Влияние наночастиц меди на скорость роста и продукцию активных форм кислорода у P. cordatum и D. salina. На рис. 1 представлена динамика изменения численности культур P. cordatum и D. salina при добавлении в среду наночастиц оксида меди различной концентрации. У обоих исследуемых видов наблюдалось закономерное снижение скорости роста с увеличением концентрации поллютанта. Однако P. cordatum был более чувствителен к воздействию CuO НЧ, чем D. salina. Так, через 72 ч после внесения поллютанта 50%-е снижение численности P. cordatum относительно контроля отмечено при концентрации CuO НЧ 280 мкг/л, в то время как для D. salina данная величина была на порядок выше и составляла 2500 мкг/л. Двукратное снижение удельной скорости роста на участке экспоненциального роста водорослей наблюдалось при 290 мкг/л CuO НЧ у P. cordatum и при 1900 мкг/л у D. salina. Летальное воздействие наночастиц меди на микроводоросли отмечено при их концентрации в среде 520 и 3750 мкг/л для P. cordatum и D. salina соответственно. В ряде работ с пресноводными представителями фитопланктона показано стимулирующее действие низких концентраций наночастиц меди на рост водорослей. Так называемый эффект гормезиса был отмечен у Chlorolobion braunii (Echeveste et al., 2017), Chlorella sp. (Wan et al., 2018).
Рис. 1.
Изменение численности клеток P. cordatum (а) и D. salina (б) в накопительной культуре в зависимости от концентрации CuO НЧ (мкг/л): (а) 1 – 0, 2 – 100, 3 – 200, 4 – 300, 5 – 520; (б) 1 – 0, 2 – 250, 3 – 665, 4 – 1330, 5 – 2000, 6 – 2500.
Установлено, что исследуемые виды водорослей по-разному реагировали на добавление в среду сублетальных концентраций наночастиц оксида меди (400 мкг/л для P. cordatum и 3000 мкг/л для D. salina). Результаты представлены на рис. 2. У обоих видов ингибирующее воздействие поллютанта на микроводоросли отмечено уже в первые часы после его внесения в среду. Через 3 ч культивирования, как у D. salina, так и у Р. сordatum, наблюдалось 30%-е снижение численности клеток. Однако для D. salina оно имело обратимый характер. Так, через 6 ч после внесения поллютанта отмечено восстановление роста культуры, но с более низкой скоростью, чем в контроле. Удельная скорость роста на участке экспоненциального роста составила 0.1 сут–1. Через 6 сут культивирования водорослей в данных условиях отмечен выход кривой роста на стационарную фазу при численности клеток в культуре 2.8 × 104 кл./мл. В то же время в контрольном варианте эксперимента (без добавления НЧ) удельная скорость роста водорослей была в 3 раза выше, а конечная плотность культуры достигала 12.4 × 104 кл./мл.
Рис. 2.
Динамика численности клеток P. cordatum (а, 1 – контроль, 2 – 400 мкг/л CuO НЧ, 3 – 520 мкг/л CuO НЧ) и D. salina (б, 1 – контроль, 2 – 3000 мкг/л CuO НЧ, 3 – 3750 мкг/л CuO НЧ) после добавления в среду сублетальных и летальных концентраций наночастиц оксида меди.
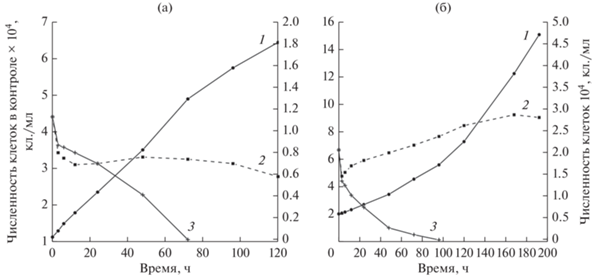
У P. cordatum отмечен иной физиологический отклик на воздействие сублетальных концентраций исследуемого поллютанта. Как было отмечено выше, внесение в культуральную среду CuO НЧ в концентрации 400 мкг/л на начальном этапе эксперимента (первые 3 ч) приводило к 30%-ому снижению числа клеток в культуре до 0.7‒0.8 × 104 кл./мл. Дальнейшее культивирование водорослей в этих условиях в течение 4 сут не оказывало существенного влияния на их численность. При этом клетки сохраняли свою жизнеспособность, однако отмечено значительное уменьшение их подвижности. Такие поведенческие реакции водорослей на длительное культивирование в условиях пороговых концентрации CuO НЧ связаны с физиологическими особенностями исследуемых видов водорослей. Отсутствие роста у P. cordatum, вероятно, обусловлено формированием неподвижных стадий или покоящихся цист, которое свойственно данному виду в случае наступления неблагоприятных условий для вегетации (Matantseva et al., 2020). Однако агломерация наночастиц на клеточной стенке P. cordatum, отчетливо наблюдаемая в ходе микроскопирования, и, возможно, интернализация их через поры или в ходе экдизиса (сбрасывание клеточных покровов для формирования цист) приводила к дальнейшему разрушению клеток и гибели культуры. Описываемый характер роста D. salina в условиях сублетальных концентраций наночастиц в среде может быть объяснен адаптационными механизмами, направленными на предотвращение токсического влияния поллютантов, путем производства внеклеточных полимерных веществ и элиминации соединений во внешнюю среду (Sendra et al., 2018а).
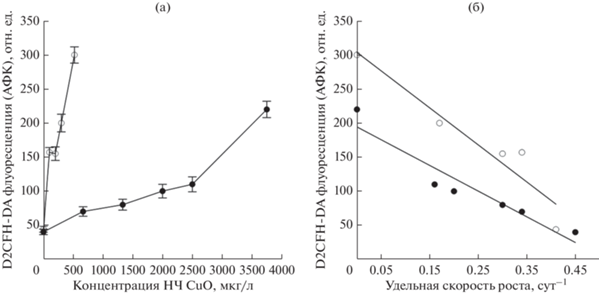
У обоих исследуемых видов после добавления в среду НЧ CuO отмечено резкое увеличение продукции АФК, приводящее к развитию окислительного стресса в клетках. Максимальные значения флуоресценции D2CFH-DA, отражающей продукцию АФК в клетках, наблюдались через 72 ч после добавления поллютанта. Изменение флуоресценции D2CFH-DA в зависимости от концентрации наночастиц в среде на 3 сут эксперимента представлено на рис. 3а. Полученные данные демонстрируют видоспецифичноcть физиологического отклика микроводорослей к действию поллютанта: CuO НЧ более токсичны для P. cordatum, чем для D. salina. Так, у P. cordatum трехкратное увеличение значений флуоресценции D2CFH-DA относительно контроля отмечено уже при 100 мкг/л CuO НЧ, а при концентрации нанопорошка 520 мкг/л величина D2CFH-DA повышалась до максимальных 300 отн. ед. У D. salina в диапазоне концентраций НЧ 0‒2500 мкг/л флуоресценция D2CFH-DA повышалась от 40 до 110 отн. ед., резкое увеличение исследуемого параметра до 220 отн. ед. отмечено только при концентрации меди 3750 мкг/л. Следует отметить, что прогрессирующяя продукция АФК в клетках двух исследуемых видов водорослей происходит на фоне снижения их удельной скорости роста (рис. 3б), что указывает на токсическое воздействие меди на клетку. Такой эффект CuO НЧ может объясняться высвобождением ионов меди Cu2+ из оксида или проникновением отдельных наночастиц внутрь клеток (Wang et al., 2020).
Рис. 3.
(а) Изменение флуоресценции D2CFH-DA (продукция активных форм кислорода) в зависимости от концентрации CuO НЧ в среде у P. cordatum (⚪) и D. salina (⚫) через 72 ч после добавления поллютанта; (б) связь флуоресценции D2CFH-DA и удельной скорости роста у P. cordatum (⚪) и D. salina (⚫) при воздействии CuO НЧ.
Известно, что эукариотические водоросли способны продуцировать хелатирующие медь лиганды (фитохелатины) (Ahner et al., 1995; Ahner, Morel, 1995), которые связывают растворенные в воде ионы металлов в хелатные комплексы, тем самым уменьшая их активность и токсическое действие на клетки. Исследования данной направленности проводились с разными представителями фитопланктона (Sunda, Huntsman, 1998) и показали, что скорость и способность продуцирования органических лигандов видоспецифична (Ahner et al., 1995; Ahner, Morel, 1995; Shafik, 2008). По мнению многих авторов именно это является основной причиной наблюдаемых различий в чувствительности видов микроводорослей к действию токсикантов (Ahner et al., 1995; Ahner, Morel, 1995; Echeveste et al., 2018). Так в исследовании (Ahner et al., 1995) отмечено, что у динофитовой микроводоросли Heterocapsa pygmaea, в отличие от других исследованных в работе видов (диатомеи Thalassiosira weissjlogii и T. oceanica, зеленые микроводоросли Dunaliella tertiolecta и Tetraselmis maculata, кокколитофориды Pleurochrysis carterae, Emiliania huxleyi и Pavlova lutheri), не наблюдалось увеличения продукции фитохелатина с ростом концентрации кадмия в культуральной среде. Это, по мнению авторов, может свидетельствовать о высокой чувствительности таксономической группы динофитовых водорослей к загрязнениям тяжелыми металлами. Данные, подтверждающие данную гипотезу, представлены и в ряде других работ, основным объектом исследования которых являлся P. cordatum, а в качестве поллютантов использовались гербицид (Ebenezer, Ki, 2013) и биоцид сульфата меди (Guo et al., 2016). Ссылаясь на полученные результаты, авторы вышеуказанных работ предлагают рассматривать P. cordatum как наиболее подходящий модельный организм для оценки экотоксичности в морской среде. В то время как D. salina, наоборот, способна уменьшать токсическое действие меди на клетки путем производства внеклеточных полимерных веществ, связывающих ионы меди, и элиминации токсиканта во внешнюю среду (Shafic, 2008). Поэтому D. salina, как и ряд других зеленых микроводорослей (Shafic, 2008), не только является перспективным видом для промышленного получения каротиноидов, но и может активно использоваться в биоремедитации вод, загрязненных металлами.
Очевидно, что способность продуцировать хелатирующие лиганды является не единственным объяснением степени толерантности разных систематических групп водорослей к действию поллютантов. В ходе эволюции микроводоросли выработали и ряд других ответных реакций (включение антиоксидантной системы, изменение проницаемости клеточных мембран и другие), позволяющих им адаптироваться в среде, подверженной загрязнению металлами (Ahner et al., 1995; Ahner, Morel, 1995; Wang et al., 2020). Кроме того, в работе (Blanck, 2002) показано, что различная устойчивость видов к действию поллютантов может быть объяснена различием их условий существования, т.е. виды, вегетирующие в экстремальных экосистемах (D. salina является типичным представителем флоры гиперсоленных озер), будут более толерантны и к другим антропогенным загрязнителям.
Влияние наночастиц оксида меди на морфологию клеток P. cordatum и D. salina, объем клеток и их гранулярность. Морфометрические исследования клеток D. salina в нативной пробе (контроль) показали, что D. salina была представлена большей частью грушевидными (56%), а также шаровидными (44%) формами, снабженными двумя жгутиками одинаковой длины (рис. 4в). Клетки P. cordatum имели уплощенную форму, варьирующую от овально-округлой до сердцевидной, при этом в культуре доминировали водоросли обычной формы с плотным клеточным содержимым (84%), единично встречались клетки округлой формы (рис. 4а). Добавление наночастиц меди вызывало значительное увеличение клеточных объемов клеток и гетерогенности размерной структуры исследуемых видов водорослей. Средний объем клеток D. salina в контроле составлял 390 ± 80 мкм3, тогда как при добавлении в среду CuO НЧ в концентрации 2500 мкг/л он достоверно увеличивался в 1.3 раза до 530 ± 87 мкм3 по сравнению с контролем (непарный t-тест, p < 0.05).
Рис. 4.
Микрофотографии Р. cordatum и D. salina при различных условиях культивирования: (а) – нативная проба Р. cordatum (контроль), (б) – культивирование Р. cordatum с добавлением CuО НЧ 300 мкг/л; (в) – нативная проба D. salina (контроль), (г) – культивирование D. salina с добавлением CuО НЧ 2500 мкг/л (по данным СМ через 72 ч культивирования). Масштабная линейка соответствует 5 мкм для D. salina и 10 мкм для Р. cordatum.
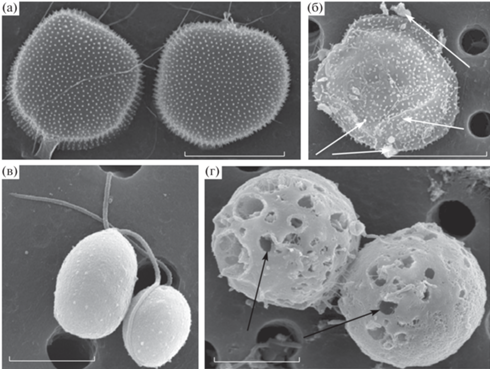
У P. cordatum через 72 ч после внесения в среду CuO НЧ в концентрации 300 мкг/л средний объем клеток также достоверно повышался до 1530 ± ± 230 мкм3 по сравнению с контролем 960 ± 70 мкм3 (непарный t-тест, р < 0.05). Добавление поллютата в культуральную среду у обоих видов водорослей вызывало изменение их клеточной формы (рис. 4б, 4г). Так, доля грушевидных клеток в культуре D. salina снижалась до 29%, что было в 2 раза ниже, чем в контроле, а количество шаровидных форм увеличивалось до 71%. У P. cordatum количество клеток нормальной формы снижалось в 9.3 раза (до 9%), а также наблюдалось увеличение в 1.4 раза числа клеток с ретракцией цитоплазмы (до 23%). У обоих видов микроводорослей обнаруживались клетки неправильной формы, полупрозрачные с разрушенным содержимым.
Округление клеток и увеличение их линейных размеров, как известно, является реакцией на стрессовые условия роста (Антоненко и соавт., 2010). В работе (Alho et al., 2020) с пресноводным видом Raphidocelis subcapitata авторами также отмечены значительные морфологические изменения клеток, вызванные CuO НЧ: увеличение объемов клеток и их зернистости при концентрации наночастиц в среде свыше 0.97 мг/л. Кроме того, инкубирование P. cordatum в среде с добавлением сублетальных концентраций наночастиц оксида меди приводило к перестройке клеточных покровов водорослей после стрессового воздействия. В литературе этот процесс описан как экдизис – сбрасывание клеточных покровов (Morrill, Loeblich, 1983). Подобные перестройки чаще всего происходят при формировании неподвижных стадий, временных или покоящихся цист, в ответ на неблагоприятные условия роста (Matantseva et al., 2020).
Анализ морфологической структуры D. salina и Р. сordatum с помощью сканирующего электронного микроскопа показал, что большинство клеток характеризуются значительной деформацией клеточной стенки и изменением формы клеток; черными стрелками на микрофотографиях обозначены места очевидных повреждений. При воздействии НЧ на клетки P. cordatum отмечено “сморщивание” и усадка клеточной стенки (рис. 4б, белые стрелки), а также адсорбция агрегатов НЧ на поверхности клетки (рис. 4б, белые стрелки), происходящая за счет электростатических взаимодействий и химических связей, как указано в работе (Adeleye, Keller, 2016). Отметим, что подобного рода реакции на присутствие в среде наночастиц являются типичными и наблюдаются у многих других видов микроводорослей (Wang et al., 2020), в том числе и у пресноводных микроводорослей (Aruoja et al., 2009).
У обоих исследованных видов увеличение концентрации CuO НЧ в среде приводило к линейному повышению гранулярности клеток (боковое светорассеяние SS). Так, через 72 ч культивирования D. salina при концентрации поллютанта от 0 до 2500 мкг/л SS клеток составляла от 75 до 160, у P. cordatum гранулярность клеток изменялась от 211 до 345 в диапазоне концентраций CuO НЧ 0 до 300 мкг/л. Закономерное повышение SS, очевидно, обусловлено механическим воздействием наночастиц на микроводоросли, приводящим к ультраструктурным повреждениям клеток. Аналогичные результаты, где механическое воздействие металлических НЧ на клетки микроводорослей подтверждалось одновременно данными СЭМ и увеличением сигнала бокового светорассеяния, были отмечены в ряде работ (Saison et al., 2009; Oukarroum et al., 2019). Так, в исследовании (Xia et al., 2015) показано, что при добавлении в культуральную среду 5 мг/л TiO2 НЧ у Nitzschia closterium обнаружено значительное повышение интенсивности бокового светорассеяния по сравнению с контролем. Авторы полагают, что увеличение интенсивности SS указывает на поглощение/интернализацию TiO2 НЧ водорослями.
Считается, что виды с тонкой клеточной стенкой более чувствительны к воздействию НЧ, чем виды с плотными целлюлозными, кремниевыми или карбонатными клеточными оболочками (O-ukarroum et al., 2015). Основываясь на этом положении, стоило бы полагать, что D. salina, из-за отсутствия клеточной стенки в качестве “защитного барьера”, менее устойчива к механическому воздействию наночастиц по сравнению с P. cordatum, клетки которого покрыты армированным целлюлозным панцирем. Однако в нашем исследовании данная теория не нашла своего подтверждения. Кроме того, данная гипотеза опровергается и в ряде других исследований (Rohder et al., 2015; Sendra et al., 2018). Так, в работе (Rohder et al., 2015) показано, что чувствительность к воздействию наночастиц CeO2 и Ce(NO3)3 у штамма пресноводной водоросли Chlamydomonas reinhardtii с плотной клеточной стенкой и мутантного штамма без клеточной стенки была одинаковой, указывая на то, что оболочка клетки не препятствовала негативному воздействию поллютантов. Мы полагаем, что D. salina, как и ряд других микроводорослей, лишенных клеточной стенки, в стрессовых условиях способна к формированию плотной многослойной структуры, которая представляет собой внеклеточные полимерные вещества (полисахариды, белки, ДНК и липиды), окружающие клетки микроводорослей (Tang et al., 2018). Эта способность определенных видов водорослей к синтезу данной структуры, выступающей в качестве внешнего барьера от воздействия НЧ и их проникновения внутрь клетки, делает их более устойчивыми к подобному виду загрязнителя.
Таким образом, по результатам экспериментального исследования установлены основные закономерности изменения ростовых, морфологических и функциональных показателей P. cordatum и D. salina при добавлении в культуральную среду CuO НЧ в разной концентрации. Анализ собственных и литературных данных показал, что механизм негативного влияния CuO НЧ на микроводоросли схож для разных видов и определяется совокупным эффектом двух разнонаправленных процессов: токсического воздействия на клетки и механического повреждения клеточных покровов. Токсический эффект влияния поллютанта проявляется в прогрессирующем увеличении продукции активных форм кислорода в клетках водорослей, индуцирующих окислительный стресс, на фоне снижения их удельной скорости роста, что, вероятно, объясняется высвобождением ионов меди Cu2+ из оксида или проникновением отдельных наночастиц внутрь клеток. Механическое воздействие НЧ вызывает деформацию и повреждение клеточных оболочек, а также наблюдается их агрегация на поверхности водорослей. Существующая гипотеза о защитной “барьерной” роли клеточной стенки от механического воздействия металлических наночастиц (Saison et al., 2010; Tang et al., 2018) не нашла подтверждения в нашем исследовании. Так, наличие плотного армированного целлюлозного панциря у P. cordatum не обеспечивало клеткам большую устойчивость от механического воздействия CuO НЧ по сравнению с D. salina с ультратонкой клеточной оболочкой.
Однако, несмотря на схожий механизм действия исследуемого поллютанта, разные виды водорослей сильно различаются по степени устойчивости к воздействию CuO НЧ, что обусловлено видоспецифическими особенностями их морфологии и физиологии. Одной из основных причин толерантности микроводорослей к воздействию металлических НЧ служит их способность продуцировать высокие концентрации лигандов (фитохелатины и металлотионеины), выделяемых клетками в среду для связывания ионов меди. Кроме того защитным механизмом микроводорослей с тонкими клеточными стенками, предотвращающим их взаимодействию с наночастицами, является способность секретировать в условиях стресса внеклеточные полимерные соединения (полисахариды, белки, липиды), для формирования вокруг клетки плотной многослойной защитной структуры. Устойчивость видов к воздействию CuO НЧ зависит также от ареала и условий их существования: виды, приуроченные к экстремальным экосистемам, более толерантны к воздействию поллютанта, чем представители морского и пресноводного фитопланктона, также как и виды из загрязненных мест обитания будут более устойчивы к поллютантам, чем микроводоросли чистых мест.
Учитывая разную степень толерантности и особенности физиологического отклика на воздействие CuO НЧ, динофлагеллят P. cordatum может эффективно применяться в качестве модельного организма для оценки качества морской воды в результате ее загрязнения наночастицами оксида меди. Тогда как зеленая микроводоросль D. salina является перспективным видом, который можно использоваться в биоремедитации вод, загрязненных тяжелыми металлами.
Список литературы
Антоненко С.П., Догадина Т.В., Комаристая В.П. Изменчивость морфометрических признаков Dunaliella salina в условиях культуры // Экология моря. 2010. Т. 81. С. 5‒12.
Брянцева Ю.В., Лях А.М., Сергеева А.В. Расчет объемов и площадей поверхности одноклеточных водорослей Черного моря. Севастополь: НАН Украины Институт биологии южных морей, 2005. 25 с.
Сеничева М.И. Новые и редкие для Черного моря виды диатомовых и динофитовых водорослей // Экология моря. 2002. Т. 62. С. 25–29.
Финенко З., Ланская Л. Рост и скорость деления водорослей в лимитированных объемах воды // Экологическая физиология морских планктонных водорослей. Киев, 1971. С. 22–26.
Adeleye A.S., Conway J.R., Garner K., Huang Y., Su Y., Keller A.A. Engineered nanomaterials for water treatment and remediation: Costs, benefits, and applicability // Chem. Eng. J. 2016. V. 286. P. 640–662. https://doi.org/10.1016/j.cej.2015.10.105
Adeleye A.S., Keller A.A. Interactions between algal extracellular polymeric substances and commercial TiO2 nanoparticles in aqueous media // Environ. Sci. Technol. 2016. V. 50. P. 12258–12265. https://doi.org/10.1021/acs.est.6b03684
Ahner B.A., Kong S., Morel F.M.M. Phytochelatin production in marine algae. 1. An interspecies comparison // Limnol. Oceanogr. 1995. V. 40. P. 649–657. https://doi.org/10.4319/lo.1995.40.4.0649
Ahner B.A., Morel F.M.M. Phytochelatin production in marine algae. 2. Induction by various metals // Limnol. Oceanogr. 1995. V. 40. P. 658–665. https://doi.org/10.4319/lo.1995.40.4.0658
Alho L.D.O.G., Souza J.P., Rocha G.S., da Silva Mansano A., Lombardi A.T., Sarmento H., Melão M.G.G. Photosynthetic, morphological and biochemical biomarkers as tools to investigate copper oxide nanoparticle toxicity to a freshwater chlorophyceae // Environ. Pollut. 2020. V. 265. P. 114856. https://doi.org/10.1016/j.envpol.2020.114856
Anufriieva E.V., Balycheva D.S., Vdodovich I.V., Shadrin N.V. Microalgae in the diet of Eucypris mareotica (Crustacea, Ostracoda) in the hypersaline lake Chersonesskoye (Crimea) // Ecologica Montenegrina. 2018. V. 17. P. 100–104.
Aruoja V., Dubourguier H.C., Kasemets K., Kahru A. Toxicity of nanoparticles of CuO, ZnO and TiO2 to microalgae Pseudokirchneriella subcapitata // Sci. Total Environ. 2009. V. 407. P. 1461‒1468. https://doi.org/10.1016/j.scitotenv.2008.10.053
Blanck H. A critical review of procedures and approaches used for assessing pollution-induced community tolerance (PICT) in biotic communities // Hum. Ecol. Risk Assess. 2002. V. 8. P. 1003–1034. https://doi.org/10.1080/1080-700291905792
Ebenezer V., Ki J.S. Quantification of toxic effects of the herbicide metolachlor on marine microalgae Ditylum brightwellii (Bacillariophyceae), Prorocentrum minimum (Dinophyceae), and Tetraselmis suecica (Chlorophyceae) // J. Microbiol. 2013. V. 51. P. 136–139. https://doi.org/10.1007/s12275-013-2114-0
Echeveste P., Croot P., von Dassow P. Differences in the sensitivity to Cu and ligand production of coastal vs offshore strains of Emiliania huxleyi // Sci. Total Environ. 2018. V. 625. P. 1673–1680. https://doi.org/10.1016/j.scitotenv.2017.10.050
Echeveste P., Silva J.C., Lombardi A.T. Cu and Cd affect distinctly the physiology of a cosmopolitan tropical freshwater phytoplankton // Ecotoxicol. Environ. Saf. 2017. V. 143. P. 228‒235. https://doi.org/10.1016/j.ecoenv.2017.05.030
Guillard R., Ryther J. Studies of marine planktonic diatoms: I. Cyclotella nana (Hustedt), and Detonula confervacea (Cleve) Gran // J. Can. Microbiol. 1962. V. 8. P. 229–239. https://doi.org/10.1139/m62-029
Guo R., Lim W.A., Ki J.S. Genome-wide analysis of transcription and photosynthesis inhibition in the harmful dinoflagellate Prorocentrum minimum in response to the biocide copper sulfate // Harmful Algae. 2016. V. 57. P. 27–38. https://doi.org/10.1016/j.hal.2016.05.004
Heil C.A., Glibert P.M., Fan C. Prorocentrum minimum (Pavillard) Schiller: a review of a harmful algal bloom species of growing worldwide importance // Harmful Algae. 2005. V. 4. P. 449–470. https://doi.org/10.1016/j.hal.2004.08.003
Klaine S.J., Alvarez P.J., Batley G.E., Fernandes T.F., Handy R.D., Lyon D.Y., Mahendra S., McLaughlin M.J., Lead J.R. Nanomaterials in the environment: behavior, fate, bioavailability, and effects // Environ. Toxicol. Chem. 2008. V. 27. P. 1825–1851. https://doi.org/10.1897/08-090.1
Li M., Jiang Y., Chuang C.Y., Zhou J., Zhu X., Chen D. Recovery of Alexandrium tamarense under chronic exposure of TiO2 nanoparticles and possible mechanisms // Aquat. Toxicol. 2019. V. 208. P. 98–108. https://doi.org/10.1016/j.aquatox.2019.01.007
Matantseva O., Berdieva M., Kalinina V., Pozdnyakov I., Pechkovskaya S., Skarlato S. Stressor-induced ecdysis and the cate cyst formation in the armoured dinoflagellates Prorocentrum cordatum // Sci. Rep. 2020. V. 10. P. 1–17. https://doi.org/10.1038/s41598-020-75194-3
Miller R.J., Lenihan H.S., Muller E.B., Tseng N., Hanna S.K., Keller A.A. Impacts of metal oxide nanoparticles on marine phytoplankton // Environ. Sci. Technol. 2010. V. 44. P. 7329–7334. https://doi.org/10.1021/es100247x
Morrill L.C., Loeblich A.R. Formation and release of body scales in the dinoflagellate genus Heterocapsa // J. Mar. Biolog. Assoc. UK. 1983. V. 63. P. 905–913. https://doi.org/10.1017/S0025315400071319
Murtey M.D., Ramasamy P. Sample preparations for scanning electron microscopy – life sciences // Modern Electron Microscopy in Physical and Life Sciences / Eds. Janecek M., Kral R. IntechOpen, 2016. P. 161–185.
Oukarroum A., Bras S., Perreault F., Popovic R. Inhibitory effects of silver nanoparticles in two green algae, Chlorella vulgaris and Dunaliella tertiolecta // Ecotoxicol. Environ. Saf. 2012. V. 78. P. 80–85. https://doi.org/10.1016/j.ecoenv.2011.11.012
Oukarroum A., Halimi I., Siaj M. Cellular responses of Chlorococcum sp. algae exposed to zinc oxide nanoparticles by using flow cytometry // Water Air Soil Pollut. 2019. V. 230. P. 1–7. https://doi.org/10.1007/s11270-018-4051-3
Rohder L.A., Brandt T., Sigg L., Behra R. Influence of agglomeration of cerium oxide nanoparticles and speciation of cerium(III) on short term effects to the green algae Chlamydomonas reinhardtii // Aquat. Toxicol. 2014. V. 152. P. 121–130. https://doi.org/10.1016/j.aquatox.2014.03.027
Saison C., Perreault F., Daigle J.C., Fortin C., Claverie J., Morin M., Popovic R. Effect of core-shell copper oxide nanoparticles on cell culture morphology and photosynthesis (photosystem II energy distribution) in the green alga, Chlamydomonas reinhardtii // Aquat. Toxicol. 2010. V. 96. P. 109–114. https://doi.org/10.1016/j.aquatox.2009.10.002
Sendra M., Blasco J., Araujo C.V.M. Is the cell wall of marine phytoplankton a protective barrier or a nanoparticle interaction site? Toxicological responses of Chlorella autotrophica and Dunaliella salina to Ag and CeO2 nanoparticles // Ecol. Indic. 2018. V. 95. P. 1053–1067. https://doi.org/10.1016/j.ecolind.2017.08.050
Sendra M., Moreno-Garrido I., Blasco J., Araujo C.V. Effect of erythromycin and modulating effect of CeO2 NPs on the toxicity exerted by the antibiotic on the microalgae Chlamydomonas reinhardtii and Phaeodactylum tricornutum // Environ. Pollut. 2018. V. 242. P. 357–366. https://doi.org/10.1016/j.envpol.2018.07.009
Shafik M.A. Phytoremediation of some heavy metals by Dunaliella salina // Global J. Environ. Res. 2008. V. 2. P. 01–11.
Sunda W.G., Huntsman S.A. Processes regulating cellular metal accumulation and physiological effects: phytoplankton as model systems // Sci. Total Environ. 1998. V. 219. P. 165–181. https://doi.org/10.1016/S0048-9697(98)00226-5
Tang Y., Xin H., Yang F., Long X. A historical review and bibliometric analysis of nanoparticles toxicity on algae // J. Nanopart. Res. 2018. V. 20:92. P. 1–17. https://doi.org/10.1007/s11051-018-4196-4
Wan J.K., Chu W.L., Kok Y.Y. Cheong K.W. Assessing the toxicity of copper oxide nanoparticles and copper sulfate in a tropical Chlorella // J. Appl. Phycol. 2018. V. 30. P. 3153‒3165. https://doi.org/10.1007/s10811-018-1408-3
Wang H., Joseph J.A. Quantifying cellular oxidative stress by dichlorofluorescein assay using microplate reader // Free Rad. Biol. Med. 1999. V. 27. P. 612–616. https://doi.org/10.1016/S0891-5849(99)00107-0
Wang L., Huang X., Sun W., Too H.Z., Laserna A.K.C., Li S.F.Y. A global metabolomic insight into the oxidative stress and membrane damage of copper oxide nanoparticles and microparticles on microalga Chlorella vulgaris // Environ. Pollut. 2020. V. 258. P. 113647. https://doi.org/10.1016/j.envpol.2019.113647
Xia B., Chen B., Sun X., Qu K., Ma F., Du M. Interaction of TiO2 nanoparticles with the marine microalga Nitzschia closterium: growth inhibition, oxidative stress and internalization // Sci. Total Environ. 2015. V. 508. P. 525–533. https://doi.org/10.1016/j.scitotenv.2014.11.066
Дополнительные материалы отсутствуют.


